Method Article
Un grand latéral Craniotomie Procédure pour Mesoscale grand champ d'imagerie optique de l'activité cérébrale
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole présente un procédé pour créer un grand craniotomie unilatéral sur les régions temporales et pariétales du cortex cérébral de souris. Ceci est particulièrement utile pour l'imagerie en temps réel sur une vaste zone d'un hémisphère cortical.
Résumé
Le craniotomie est une procédure généralement effectuée pour exposer le cerveau pour des expériences in vivo. Dans la recherche de la souris, la plupart des laboratoires utilisent une petite craniotomie, typiquement de 3 mm x 3 mm. Ce protocole présente un procédé pour créer un 7 mm x 6 mm fenêtre crânienne exposer plus d'un hémisphère cérébral au cours des souris cortex pariétal et temporal (par exemple, bregma 2.5 à 4.5 mm, latéral à 0 - 6 mm) sensiblement plus grande. Pour effectuer cette opération, la tête doit être inclinée d'environ 30 ° et une grande partie du muscle temporal doit être rétracté. En raison de la grande quantité d'élimination des os, cette procédure est destinée uniquement aux expériences aiguës avec l'animal anesthésié tout au long de la chirurgie et l'expérience.
Le principal avantage de cette innovante grande fenêtre crânienne latérale est de fournir un accès simultané aux deux zones médiale et latérale du cortex. Cette grande fenêtre crânienne unilatérale peut être utilisée pour étudier la dynamique entre les cellules nerveuses,ainsi qu'entre les différentes zones corticales par la combinaison des enregistrements électrophysiologiques multi-électrodes, l' imagerie de l' activité neuronale (par exemple, l' imagerie intrinsèque ou extrinsèque), et la stimulation optogenetic. De plus, ce grand craniotomie expose également une grande surface des vaisseaux sanguins corticales, ce qui permet une manipulation directe de la vasculature corticale latérale.
Introduction
Le craniotomie est une procédure standard utilisée par les neuroscientifiques pour révéler une partie du cerveau. Depuis l'aube de l'électrophysiologie, la craniotomie a permis des avancées sans précédent dans le domaine des neurosciences. cartographie Dense du cortex cérébral avec des électrodes a conduit à des expériences de tester des hypothèses et des théories basées sur ces cartes. Nous avons récemment entré dans une nouvelle ère où la craniotomie est utilisée pour l'imagerie in vivo de débit sanguin cortical 1, 2, 3 et de l' architecture neurovasculaire 4, ce qui permet la visualisation en temps réel de l' activité corticale dans les zones exposées 5, 6, 7. Bien que de nombreuses études utilisent des craniotomies combinées avec des techniques in vivo d'imagerie optique pour étudier la structure et la fonction des neurones corticaux, des cellules gliales, et corvasculature tical 8, 9, d' autres enquêtes sont limitées par de petites zones du cortex exposé (mais voir 10).
Le but de ce protocole est de fournir un procédé pour créer un grand craniotomie latéral, ce qui expose le cortex cérébral de la ligne médiane de la Squamosal, et allant au-delà bregma et lambda. Cette grande craniotomie permet la visualisation simultanée des cortex associatifs (rétrosplénial, cingulaire et pariétal), le moteur primaire et secondaire, somatosensoriel, visuel et le cortex auditif. Cette méthode a été précédemment couplé avec l' imagerie tension de colorant sensible (VSDI) pour étudier comment de multiples aires corticales interagissent entre eux au cours de l' activité corticale spontanée et induite par stimulus-5, 11, 12. Les aspects les plus difficiles de cette procédure comprennent le positionnement de la têtede l'animal, la fixation de la plaque de tête, et d'éviter une hémorragie tout en séparant le muscle temporal de l'os pariétal. Il faut aussi prendre au cours des processus de forage et d'enlèvement du crâne comme les courbes de crâne sous un angle oblique.
Protocole
Le protocole suivant suit les directives Université de Lethbridge Comité de protection des animaux (ACC) et est conduite conformément aux normes du Conseil canadien de protection des animaux (CCPA).
1. Préparation
- Pour les périodes d'études prolongées, autoclave toutes les fournitures chirurgicales ouvertes et veiller à ce que la stérilité est maintenue tout au long de la chirurgie. Si plusieurs interventions chirurgicales sont nécessaires, autoclave entre les chirurgies.
- Assurez-vous qu'il ya beaucoup de tampon du cerveau à portée de main (au moins 50 ml). La solution est composée de 134 mM de chlorure de sodium, de potassium 5,4 mM, 1 mM d'hexahydrate de chlorure de magnésium, 1,8 mM de dihydrate de chlorure de calcium, le sodium et 5 mM de HEPES, pH équilibré à 7,4 avec 5 M de chlorure d'hydrogène.
- Placer la souris dans une chambre d'induction et anesthésier avec 3-4% d'isoflurane. Suivez avec 1,0 à 2,0% isoflurane pour l'entretien pendant la chirurgie. Réduire encore aussi bas que de 0,4 à 0,8% au cours de l'imageries = "xref"> 5, 13, 14, 15, à condition que l' anesthésie appropriée est maintenue. Ces faibles niveaux d'anesthésie nécessitent une surveillance vigilante et fréquente de la souris (environ toutes les 5 minutes) pour qu'il reste aréflexique aux stimuli douloureux.
REMARQUE: Déshydratation peut devenir problématique en raison de la surface élevée au rapport de volume de la souris et exacerbée par une utilisation prolongée de l'isoflurane.- Utiliser des injections sous-cutanées de sérum physiologique, 0,1 ml par 10 g de poids corporel, toutes les 1 - 2 h. Lorsque suffisamment hydratée, la souris urinera une fois tous les 1 - 2 h.
- surveiller de près la souris pour assurer une anesthésie tout au long de la chirurgie et cohérente imagerie. Ne laissez pas sans surveillance souris et prendre soin qu'il regagne jamais conscience.
- Transférer la souris anesthésiée à la mise en place tête porte et le placer sur un coussin chauffant thermo-régulation réglé à 37 ° C. Fixer les teet supérieursH dans un porte-dents.
- Tournez la tête de la souris vers la gauche à environ 30 ° pour exposer le côté latéral droit de la tête et fixez la tête de la souris avec l'extrémité émoussée des barres de l'oreille ( Figure 1A ).
- Appliquer une pommade ophtalmique pour éviter le séchage de la cornée.
- Pour réduire l'œdème cérébral, injecter dexaméthasone (4 mg / kg) par voie intramusculaire.
- Essuyez la peau sur la zone chirurgicale avec des écouvillons de coton trempés dans 4% de chlorhexidine (3 fois) et 70% d'éthanol (3 fois). N'utilisez chaque coton-tige qu'une seule fois.
- Don gants chirurgicaux et recouvrir l'animal avec une pellicule plastique adhésive. Fournir de l'anesthésie local en injectant de la lidocaïne (8 à 10 mg / kg, 2% d'épinéphrine) par voie sous-cutanée sur le site de la craniotomie. Attendez 3 à 5 minutes pour que le médicament soit absorbé dans le tissu.
2. Suppression de la peau et retrait du muscle du crâne
- Effectuez presque toutes ces procédures tout en regardant le crâne sous unmicroscope disséquant (par exemple, 0,7 - puissance 4.5X, en fonction de la situation).
- Soulevez la peau 1 mm à gauche de la ligne médiane (juste derrière l'oreille) avec une pince et faire une petite incision horizontale avec des ciseaux chirurgicaux.
- Ajouter un 5 - 6 mm découpe latérale vers l'oreille droite, puis coupé vers l'extrémité rostrale de la tête.
- Au point d'incision initial, insérer les ciseaux et couper 10 mm rostral.
- Couper la peau autour de l'oreille droite et près de l'œil droit d'exposer le côté droit du crâne et du muscle temporal. Assurez-vous que la partie la plus large de la zone exposée est d'au moins 7 mm. Coupez la peau plus si la zone chirurgicale doit être étendue.
- Fixer la peau autour de l'incision en mettant quelques gouttes de colle cyanoacrylate butyle entre le crâne et la peau. Assurez-vous que le tissu a été préalablement séché avec des applicateurs à bout de coton ou des tissus laminés pour augmenter l'efficacité de l'adhésif.
- L'utilisation d'un coton-tige, frotter la surfacedu crâne dans un mouvement circulaire pour enlever le périoste du crâne. Veiller à ce que personne ne reste en séchant complètement le crâne.
- En utilisant des ciseaux et des pinces à ressort, séparer le muscle temporal du crâne; couper et retirer le muscle latéralement jusqu'à la Squamosal (Figure 1C). Prenez soin de ne pas endommager la veine temporale superficielle qui longe le niveau de l'os squamosal près de l'œil, sinon une hémorragie pourrait se produire.
- saignement de contrôle de mousse de gel pré-imprégné dans le tampon de cerveau. Pour utiliser une grave hémorragie cauterizer de chaleur. Déposer la colle cyanoacrylate de butyle sur les sites de saignement après traitement avec le cauterizer de chaleur. Vérifiez que la zone est préalablement séché à l'aide d'applicateurs à bout de coton ou des tissus laminés pour augmenter l'efficacité de l'adhésif.
3. Craniotomie
NOTE: Le chirurgien doit faire preuve de diligence lors de l'enlèvement du crâne etDure pour éviter des complications inutiles. Les étapes de dépannage sont incluses si des complications surviennent.
- Marquez l'emplacement de bregma soit avec un marqueur à pointe fine, soit coupez un petit morceau de morceau triangulaire et pointez un coin à bregma ( Figure 2A ) pour orienter les régions cérébrales sous-jacentes.
- Avant d'apposer la plaque de tête, assurez-vous que le crâne est complètement sec. Le crâne séchera rapidement à l'air après l'application de la mousse de gel trempée dans un tampon de cerveau, si un plus grand séchage est nécessaire, utilisez des écouvillons de coton. Cette étape est cruciale pour la fixation de la plaque de tête ( figure 1B ).
REMARQUE: S'il y a du périoste laissé sur le crâne, ou si le crâne n'est pas sec avant de coller sur la plaque de tête, il se détachera probablement. Si cela se produit, retirez doucement la plaque avant et recommencez. Des saignements peuvent survenir au cours de ce processus; Laisser quelques minutes pour le coaguler, puis retirer doucement. Ce processus n'est pas recommandé de répéter plus de deux fois. - Appliquer une colle cyanoacrylate d'éthyle autour du bord inférieur de la plaque de tête 16 et coller la plaque de tête sur la zone de craniotomie ( Figure 1D et Figure 2A ).
- Remplissez l'espace d'ouverture entre le crâne et la plaque de tête avec du ciment dentaire en laissant seulement la zone de craniotomie exposée. Attendez que le ciment dentaire séche et durcisse, typiquement de 5 à 10 min ( figure 2B ).
- Une fois le ciment réglé, remplir brièvement le puits avec un tampon de cerveau et laisser tremper pendant 3 à 5 minutes. Utilisez un tissu enroulé pour éliminer le tampon du cerveau avant le forage ( Figure 2C ).
- Décrivez la zone chirurgicale en marquant légèrement la surface du crâne avec une perceuse dentaire. Utilisez une perceuse pneumatique (réglée à maximum 20 PSI), avec une bague FG ¼ et commandée avec une pédale à pédale variable.
- Tracez délicatement le foret le long de la marque originale pour l'approfondir, essurer le forage ne pénètre pas à travers le crâne dans le cerveau (figure 2D). Se relaient toutes les quelques minutes entre le forage et tamponner la surface du crâne avec des tissus laminés humidifiés. Cela permettra de réduire le chauffage et le séchage du crâne de friction mécanique et une exposition prolongée.
NOTE: Le crâne sera diffusé rapidement sec après application de la mousse de gel humide. Si le séchage plus est nécessaire, utiliser des tampons de pointe de coton.
Attention: Le crâne est inégale d'épaisseur. Par exemple, la crête pariétale-temporelle est la plus épaisse, tandis que les régions du crâne près de la ligne médiane et les repères squamosal sont relativement minces. - Au cours du forage, de vérifier périodiquement pour le flambement du crâne en appuyant doucement sur elle avec une pince ou l'outil de forage non-mobile. Lorsque l'os commence à boucle, arrêter le forage et plonger toute la fenêtre dans le tampon du cerveau.
NOTE: Si le sang se précipite hors d'une zone, il peut suggérer que la dure-mère a été endommagé. Si tel est le cas, placez un ETMi-humide mousse de gel sur la zone et essayer pour absorber le sang tout en appliquant une légère pression à la mousse de gel avec un tampon de coton-tige. - Attendre au moins 5 minutes avant l'enlèvement du crâne pour adoucir l'os et à réduire le risque de la dure-mère coller à l'os, ce qui rend le procédé d'élimination du crâne plus facile.
- Effectuer le processus de suppression du crâne tandis que le crâne est immergé dans un tampon du cerveau.
NOTE: Si une partie du crâne reste obstinément attaché, une lame de scalpel # 11 peut être utilisé pour marquer doucement le crâne. Prenez soin de ne pas percer la lame à travers le crâne et dans le cerveau. - A partir du bord antérieur, soulever doucement le crâne en vrac à partir de la dure-mère à l'aide de pinces.
NOTE: Si une petite quantité de saignement se produit au cours du processus de retrait du crâne, retirez le tampon avec une pipette de transfert ou d'une seringue, puis remplacer par un nouveau tampon. - Une fois que l'os est lâche et « flottant » sur la dure-mère, saisir fermement l'os avec une pince et soulever l'os dela dure-mère. Assurez-vous de l'os ne pénètre jamais dans le cerveau.
- Pour contrôler le saignement, rouler le coin d'un tissu en un point et éliminer la majeure partie de la mémoire tampon à partir du puits crânienne. appliquer rapidement une mousse de gel, pré-imprégné dans le tampon, dans la zone de saignement tout en ajoutant une très légère pression avec un tampon de coton-tige.
NOTE: Le saignement provient généralement du bord de l'os ou la surface de la dure-mère; les deux cas sont normaux et des saignements cesseront rapidement si aucun des principaux vaisseaux sanguins sont endommagés. Si le saignement continue, le sang peut remplir la totalité de la fenêtre, la formation d'une feuille de caillot sur la zone de formation d'image.- Pour retirer la feuille de caillot, soigneusement ramasser des morceaux de sang coagulé de la zone d'imagerie tout en laissant le caillot sanguin intact autour de la source du vaisseau sanguin rompu. Prenez soin de ne pas enlever le caillot de sang de la source de saignement car cela pourrait causer encore plus la perte de sang. Irriguer la surface du cerveau avec un tampon de cerveau pour laver du sang.
- Faites attention à ne pas toucher latissu délicat du cerveau ou en ajoutant des corps étrangers au cerveau; répéter jusqu'à ce que le saignement a cessé, pendant environ 2-5 min (Figure 2E).
NOTE: A ce stade, le craniotomie est prêt pour la préparation de la fenêtre crânienne (voir étape 5). Si nécessaire, retirez la dure-mère avant l'implantation de la fenêtre crânienne (voir étape 4).
4. Dura Retrait
REMARQUE: Dura suppression nécessite beaucoup de soins et peut prendre plus de 15 minutes.
- Éloigner le tampon en excès de la craniotomie. Tout en maintenant une surface humide, prendre un petit morceau de la dure-mère avec une pince et doucement déchirer la dure-mère.
- Utiliser des pinces et des ciseaux à ressort à déchirer doucement et couper la dure-mère.
- Laissez tomber le tampon plus de cerveau sur la surface du cerveau pour faire flotter la dure-mère et l'aider à séparer du cerveau. Continuer jusqu'à ce que tous Doura est retiré du site de fenêtre crânienne. Quand elle est réalisée correctement le cerveau semble être très propre avec bl distinctevaisseaux ood et sans défauts (comparer avec la figure 2E 2F).
Attention: Certaines zones de la dure - mère sont attachés à petites artérioles sur la surface du cerveau (par exemple, près de l' extrémité proximale de la ligne médiane de la zone d'association pariétale), et le retrait d' une telle rupture peut l'artériole. Dans de tels cas, il peut être préférable de laisser un petit morceau de Doura intact au-dessus de l'artériole. Le VSD ne peut pas pénétrer dans cette petite zone, mais cela est préférable d'avoir des saignements majeurs. - Fixer la surface du cerveau dans de l'agarose, dès que possible pour minimiser les mouvements de pulsation et d'empêcher en outre le gonflement (voir l'étape 5).
5. Préparer la fenêtre crânienne
- Vaporiser le couvercle en verre avec 70% d'éthanol et en utilisant une cartouche d'air à sécher délicatement. Assurez-vous que le verre est complètement propre, sans taches ou de la poussière présente.
- Préparer 1,3% d'agarose par chauffage de 200 mg de poudre d'agarose dissous dans 15 ml de tampon de cerveau. Réglez le microWAvancer à haute et chauffer pendant 10 à 15 s à la fois, remuer doucement, jusqu'à ce que toute gélose soit dissoute.
Remarque: Assurez-vous qu'aucune bulle ou particule n'est présente, car cela interférera avec l'imagerie. - Placez un thermomètre dans l'agarose chaud et refroidissez l'agarose jusqu'à une température de solidification (~ 40 ° C).
REMARQUE: L'utilisation d'eau froide sur l'extérieur du récipient d'agarose peut accélérer le processus de refroidissement. Mélanger légèrement en continu afin de s'assurer qu'aucune bulle ou particule ne soit présente. - Immédiatement avant d'appliquer la gélose, retirer le tampon du cerveau du puits cranial. Dessinez l'agarose avec une pipette de transfert et déposez l'agarose directement sur le cerveau. Placez rapidement le couvercle sur la surface et fixez le capot avec des gouttes d'agarose sur les coins.
6. Euthanasie
REMARQUE: Dans notre expérience, cette procédure nécessite des chirurgiens expérimentés d'au moins 3 à 4 cabinets d'entraide pour atteindre plus de 90%taux de réussite. Les chirurgiens moins expérimentés peuvent exiger encore plus pratique. Au cours de la craniotomie ou durotomie, le cerveau peut subir des dommages, comme si les coups de poing de forage à travers l'os dans le cerveau. Certains dégâts mineurs au bord de craniotomie peut être admissible. Cependant, si le cerveau ne semble pas « propre » avec les vaisseaux sanguins en bon état rouge vif et blanc cortex, l'expérience peut être résiliées. Des exemples de préparations pauvres comprennent ceux qui ont des vaisseaux sanguins morts, ou lorsque le cortex est marqué par les vaisseaux sanguins déchirés ou endommagés. Si l'un de ces signes sont présents, l'expérience sera donné peu probable des données de qualité. Que ce soit la chirurgie / expérience a réussi ou non, sans cruauté euthanasier la souris à la fin de l'expérience.
- Profondément anesthésier avec au moins 3,5% d'isoflurane. Ensuite, faire une injection intraperitoneale de pentobarbital de sodium à 300 mg / kg. Idéalement, si l'aiguille est insérée dans le foie, la mort sera très rapide (<1 min).
- Si la perfusion est nécessaire, vérifiez que l'animal est profondément anesthésié avant de poursuivre (voir étape 1.3).
- Par ailleurs, si la perfusion n'est pas nécessaire, attendre un minimum de 5 min, puis vérifiez que la souris est morte. Confirmer l'absence de respiration, rythme cardiaque, ainsi qu'un manque de retrait de la douleur et des réflexes de la cornée. En outre, d'observer pour la coloration bleu / blanc pâle des extrémités et assombrissement des vaisseaux sanguins sur le cortex.
Résultats
Pour étudier les interactions entre les zones corticales dans un seul hémisphère, nous avons utilisé un grand craniotomie étendant à travers le sinus sagittal et 5 - 6 mm latéral. Cette fenêtre crânienne inclus primaire (moteur, somatosensoriel, visuel, auditif), secondaire (moteur, visuel), et d' association (rétrosplénial, cingulaire, association pariétal) de cortex hémisphère droit du cerveau (Figure 3A). Pour ce travail , nous avons utilisé l' imagerie tension colorant sensible (VSD), ce qui reflète les changements dans la membrane potentielle 3. Ce protocole serait également utile pour d' autres extrinsèques (par exemple, le calcium 17 et glutamate 18 imagerie) ou des expériences d'imagerie intrinsèques. Lorsque la stimulation de la patte arrière, forelimb, moustaches, système visuel ou auditif des souris légèrement anesthésiés à l'aide isoflurane 0,5%, nous avons observé des modèles de consensus de dépolarisation corticale (> Figure 3B). Conformément aux études précédentes 5, 19, 20, 21, 22, nous avons constaté que brève stimulation tactile du cortex canon C2 a conduit à l' activation des zones somatosensoriel primaire, ainsi que des « îlots » de réponses dans les zones fonctionnellement liées. Par exemple, le cortex moteur primaire (M1) ou une représentation secondaire du cortex somato - sensoriel (S2; Figure 3BI). Une stimulation unique 1 ms pip de tonalité (25 kHz) conduit à l'activation du cortex auditif primaire (A1) environ 20 ms après la stimulation auditive (Figure 3Bii). Au cours des prochaines millisecondes, la dépolarisation propagation à travers le cortex auditif et transmis au cortex somatosensoriel secondaire voisine. Environ 25 ms après l'apparition de la tonalité, une dépolarisation cortical secondaire sortirait, situé 1,07; 0,2 mm médial et 1,9 ± 0,1 mm en arrière par rapport au bregma (n = 9 souris). Ceci est à peu près l'emplacement de la zone d'association pariétal (ZEP). Le signal VSD propage ensuite vers la zone médiane, où d'autres zones d'association cortical sont situés, y compris rétrosplénial (RS) et le cortex cingulaire (CG). Par conséquent, la stimulation auditive a conduit à l'activation de deux domaines d'intervention distincts, dont les ondes progressives de propagation VSD dépolarisation dans une zone plus large dans le cortex de la ligne médiane. Stimulation focale de l'oeil contralateral avec une impulsion de 1 ms vert LED, a conduit à l' activation du cortex visuel primaire dans les 40 ms (Figure 3Bv). Cette activation primaire du cortex visuel a été suivie par: (1) l'expansion spatiale de VSD dépolarisation dans des zones voisines situées médialement, latéralement et en avant de la zone activée initiale; (2) La dépolarisation d'une seconde région corticale médiale environ 50 ms après la stimulation (n = 8 expériences) situé le long de sa suture gittal. Ceci est similaire aux stimulations sensorielles du membre antérieur (Figure 3Biii), des membres postérieurs (figure 3Biv), C2, ou whiskers audition. réponses évoquées de VSDI de stimulation sensorielle de la patte antérieure, des membres postérieurs ou audition activés initialement les cortex sensoriels primaires respectifs, suivie d'une propagation anisotrope de l'activité, ainsi que l'activation de la ligne médiane du cortex environ 20 - 40 ms après la stimulation. Ce résultat était similaire à des réponses de stimulation visuelle quartiles. La propagation de l' activité évoquée sensorielle le long de ces lignes médianes et activation fréquente des mêmes régions par l' activité spontanée 6 peut suggérer que ces régions sont le moyeu central du noyau de connexion du cortex de souris, dans lequel l' information sensorielle peut intégrer à l' activité corticale spontanée.
2fig1.jpg »/>
Figure 1. Configuration chirurgicale et préparation. (A) la tête de la souris est rasé, lavé, mis en rotation d' environ 30 ° pour l' exposition latérale, et fixé à l'extrémité émoussée de barres d'oreilles. L'isoflurane anesthésique est délivré par l'intermédiaire d'une pièce de nez et le porte-dents. La souris est recouverte d'une pellicule de matière plastique auto-adhésive pour la stérilité et la chaleur accrue. (B) la peau gros plan montrant périoste et retiré de la plaque de crâne pariétal, le muscle temporal est intacte. (C) Le muscle temporal est enlevée pour exposer la plaque temporelle et Squamosal, noter la veine superficielle est en bon état. (D) avant la fixation, la plaque de tête est positionnée dans l'emplacement correct avec de la cire. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
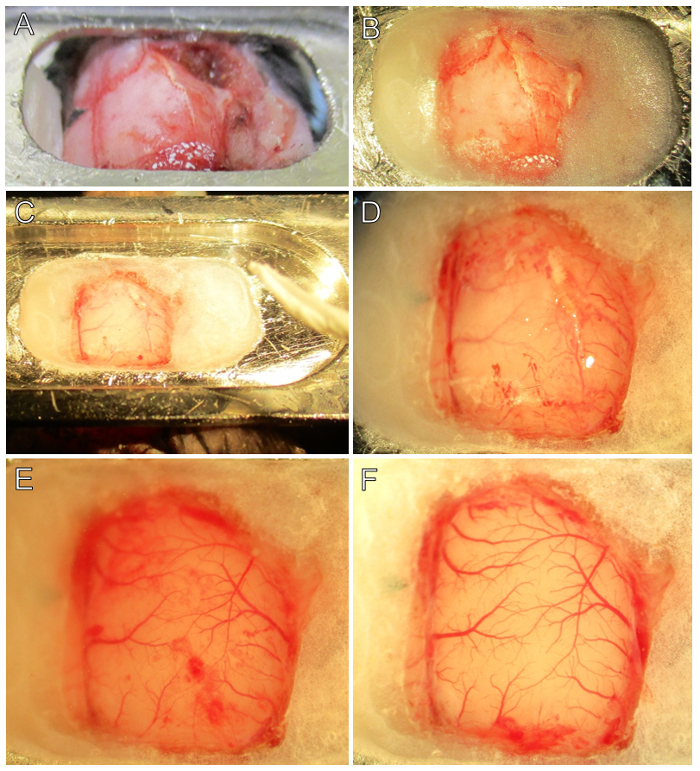
Figure 2. Etape par étape chirurgicale procédure. (A) La plaque de tête est fixé sur le crâne avec de la colle cyanoacrylate d'éthyle au niveau des emplacements antérieurs et postérieurs. Notez l'emplacement du bregma (morceau de ruban noir triangulaire). (B) La fenêtre crânienne est préparé par application d' épaississement ciment dentaire entre la tête de plaque et le crâne. Notez que bregma et les points de repère squamosal restent visibles. (C) Après le séchage du ciment, du tampon de cerveau est ajoutée pour ramollir le crâne et pour empêcher l' adhérence de la dure - mère. Un tissu laminé aidera à retirer le tampon du cerveau avant le forage. (D) ont été marqués Les bords de la craniotomie. Notez que la vasculature se voit plus facilement à travers l'os amincie près des bords dentaires de ciment. (E) les plaques pariétales et crâne temporel ont été removed et la dure-mère est visible. Notez les taches de sang sur la dure-mère de saignement mineur, ce qui est normal. Un examen attentif de moins de 2 - grossissement 4X révélera deux couches de vaisseaux sanguins, l'un dans la dure-mère et l'autre dans le pia. (F) La dure - mère est éliminée révélant un cortex vierge. Pial vasculature est rouge vif sans défauts présents. Notez les morceaux errants de Doura de couleur blanche sur les bords de la fenêtre crânienne. Dans cet exemple, il y avait un saignement dural mineur à la partie postérieure de la fenêtre crânienne, qui coagulé rapidement. S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
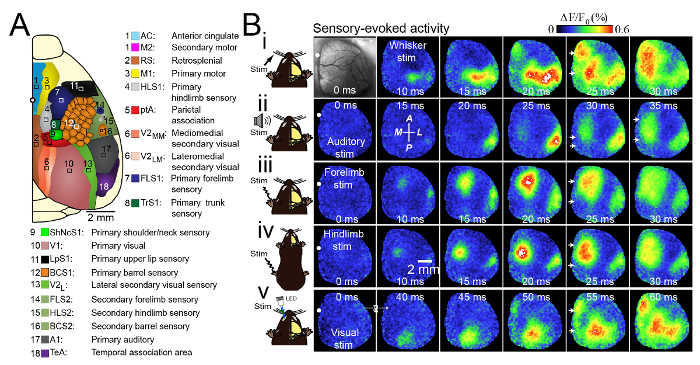
Figure 3. Modèles uniques et consensus d' activation lors de multiples formes de stimulation sensorielle. < / strong> (A) Représentation schématique de la craniotomie unilatérale montrant les régions corticales imagées. (B) Photomicrographie de la craniotomie large unilatérale avec bregma indiquée par un cercle blanc dans chaque image. Les modèles de l'activation corticale sont présentés dans une souris anesthésiées avec de l'isoflurane (0,5%) après (i) la stimulation (Stim) de la trichite controlatéral C2, (ii) la stimulation auditive, (iii) la stimulation controlatérale des membres antérieurs, (iv) la stimulation controlatérale des membres postérieurs et (v) la stimulation visuelle de l'oeil contralateral avec une diode électroluminescente (LED). Il y avait l'activation de toutes les formes après la ligne médiane de la stimulation sensorielle (flèches blanches) à 10 - 25 ms après l'activation du cortex sensoriel primaire. Les réponses sont la moyenne de 20 essais. La seconde directions d'image à partir de la gauche dans la deuxième rangée (ii) indique la partie antérieure (A), postérieure (P), médiane (M) et latérale (L). Modifié avec la permission de Mohajerani, et al., 2013.p_upload / 52642 / 52642fig3large.jpg » target = "_ blank"> S'il vous plaît cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Ce protocole innovant pour une grande fenêtre crânienne permet une imagerie simultanée sur les zones temporelles et pariétales du cortex cérébral. Combiné avec l'imagerie optique, il peut aider à révéler la dynamique neuronale dans les zones corticales au cours de l'activité spontanée et induite par stimulus. Cette craniotomie expansive expose également une grande extension du réseau vasculaire cortical, dont l'extrémité proximale de l'artère cérébrale moyenne (MCA), ce qui permet l'imagerie in vivo de la circulation sanguine et la manipulation directe des vaisseaux latéraux pour les modèles ischémiques. Cette technique sera d' une grande utilité pour les lignes récemment mis au point des souris exprimant des protéines de tension et indicateur de calcium 23. Ces souris offrent l'avantage pratique de contourner la nécessité d'une incubation tension colorants sensibles sur le cortex. Ces colorants extrinsèques prennent le temps de pénétrer de manière adéquate le tissu cérébral (~ 60 - 90 min) et sont limitées par leur toxicité légère. De grandes crâniotomies ont égalementété précédemment utilisé pour étudier le cerveau de rat avec le développement VSDI 11. rats nouveau-nés ont une tête beaucoup plus grande et est comparable en taille avec des souris adultes. Cela permet aux chercheurs une occasion unique d'étudier les problèmes de développement en neurosciences, mais pas avec des souris transgéniques.
Les principales limites de cette méthode sont l'incapacité des expériences chroniques. La courbure du crâne rend le processus de forage plus difficile et plus long que craniotomies plus petites. Pour ce grand craniotomie, il est essentiel de positionner la tête avec les repères centraux de suture et squamosal être parallèle au plan de focalisation de la lentille. Bien que une certaine distorsion du cerveau est attendu de la courbure du cerveau, celles-ci sont surmontées en se concentrant dans les couches superficielles du cortex. Ce problème est atténué en obtenant de nombreuses répétitions de stimulation et de la moyenne. En résumé, notre grande technique craniotomie est largement applicationlicable pour l'étude des problèmes actuels en neurobiologie.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été soutenu par un Conseil de recherches en sciences naturelles et en génie du Canada (CRSNG) subvention à la découverte # 40352, Campus Alberta président du Programme d'innovation, Alberta Alzheimer Programme de recherche à MHM et FONCER en bourse de doctorat BIF et bourses d'études supérieures AIHS à MK. Nous remercions Pu Min Wang pour le développement de ce protocole et pour la formation chirurgicale et Behroo Mirza Agha et Di Shao pour l'élevage.
matériels
| Name | Company | Catalog Number | Comments |
| Heating Pad | FHC | 40-90-2 | |
| Fine Scissors | Fine Science Tools | 14058-09 | |
| Forceps | Fine Science Tools | 11251-35 | 2 or more pairs are recommended |
| Spring scissors | Fine Science Tools | 15000-00, 15000-10 | 1 pair should be designated for dura removal |
| Jet tooth shade powder | LANG Dental | Jet Tooth Shade Powder | to be mixed with the Jet Liquid |
| Jet tooth shade liquid | LANG Dental | Jet Tooth Shade Liquid | to be mixed wihth the Jet Powder |
| Drill Heads - Carbide Burs FG 1/4 389 | Midwest Dental | 385201 | |
| Agarose Powder | Sigma-Aldrich | A9793 | |
| Gelfoam | Sinclair Dental Canada | Pfizer Gelfoam | |
| Isoflurane | Western Drug Distribution Centre Ltd | 124125 | |
| Lidocaine 2% Epinephrine | Western Drug Distribution Centre Ltd | 125299 | |
| Dexamethazone 5 mg/mL | Western Drug Distribution Centre Ltd | 125231 | |
| Butyl cyanoacrylate glue (VetBond) | Western Drug Distribution Centre Ltd | 12612 |
Références
- Sigler, A., Mohajerani, M. H., Murphy, T. H. Imaging rapid redistribution of sensory-evoked depolarization through existing cortical pathways after targeted stroke in mice. Proc Natl Acad Sci U S A. 106 (28), 11759-11764 (2009).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5 (11), 874-885 (2004).
- Blinder, P., Shih, A. Y., Rafie, C., Kleinfeld, D. Topological basis for the robust distribution of blood to rodent neocortex. Proc Natl Acad Sci U S A. 107 (28), 12670-12675 (2010).
- Mohajerani, M. H., et al. Spontaneous cortical activity alternates between motifs defined by regional axonal projections. Nat Neurosci. 16 (10), 1426-1435 (2013).
- Mohajerani, M. H., McVea, D. A., Fingas, M., Murphy, T. H. Mirrored bilateral slow-wave cortical activity within local circuits revealed by fast bihemispheric voltage-sensitive dye imaging in anesthetized and awake mice. J Neurosci. 30 (10), 3745-3751 (2010).
- Lippert, M. T., Takagaki, K., Xu, W., Huang, X., Wu, J. Y. Methods for voltage-sensitive dye imaging of rat cortical activity with high signal-to-noise ratio. J Neurophysiol. 98 (1), 502-512 (2007).
- Misgeld, T., Kerschensteiner, M. In vivo imaging of the diseased nervous system. Nat Rev Neurosci. 7 (6), 449-463 (2006).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nat Rev Neurosci. 9 (3), 195-205 (2008).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Eur J Neurosci. 31 (12), 2221-2233 (2010).
- McVea, D. A., Mohajerani, M. H., Murphy, T. H. Voltage-sensitive dye imaging reveals dynamic spatiotemporal properties of cortical activity after spontaneous muscle twitches in the newborn rat. J Neurosci. 32 (32), 10982-10994 (2012).
- Sweetnam, D., et al. Diabetes impairs cortical plasticity and functional recovery following ischemic stroke. J Neurosci. 32 (15), 5132-5143 (2012).
- Yin, Y. Q., et al. In vivo field recordings effectively monitor the mouse cortex and hippocampus under isoflurane anesthesia. Neural Regeneration Research. 11 (12), 1951-1955 (2016).
- Sharp, P. S., et al. Comparison of stimulus-evoked cerebral hemodynamics in the awake mouse and under a novel anesthetic regime. Scientific Reports. 5, 12621 (2015).
- Kyweriga, M., Mohajerani, M. H., Kianianmomeni, A. Optogenetics: Methods and Protocols. Methods in Molecular Biology. 1408, 251-265 (2016).
- Grutzendler, J., Gan, W. B. . Imaging in neuroscience and development : a laboratory manual. , (2005).
- Vanni, M. P., Murphy, T. H. Mesoscale transcranial spontaneous activity mapping in GCaMP3 transgenic mice reveals extensive reciprocal connections between areas of somatomotor cortex. J Neurosci. 34 (48), 15931-15946 (2014).
- Xie, Y., et al. Resolution of High-Frequency Mesoscale Intracortical Maps Using the Genetically Encoded Glutamate Sensor iGluSnFR. J Neurosci. 36 (4), 1261-1272 (2016).
- Chan, A. W., Mohajerani, M. H., LeDue, J. M., Wang, Y. T., Murphy, T. H. Mesoscale infraslow spontaneous membrane potential fluctuations recapitulate high-frequency activity cortical motifs. Nat Commun. 6, 7738 (2015).
- Lim, D. H., et al. In vivo Large-Scale Cortical Mapping Using Channelrhodopsin-2 Stimulation in Transgenic Mice Reveals Asymmetric and Reciprocal Relationships between Cortical Areas. Front Neural Circuits. 6, (2012).
- Ferezou, I., et al. Spatiotemporal dynamics of cortical sensorimotor integration in behaving mice. Neuron. 56 (5), 907-923 (2007).
- Mohajerani, M. H., Aminoltejari, K., Murphy, T. H. Targeted mini-strokes produce changes in interhemispheric sensory signal processing that are indicative of disinhibition within minutes. Proc Natl Acad Sci U S A. 108 (22), E183-E191 (2011).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon