Method Article
Una procedura Grande laterale Craniotomia per Mesoscale Wide-field Optical Imaging di Brain Activity
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo protocollo presenta un metodo per creare una grande craniotomia unilaterale sulle regioni temporali e parietali della corteccia cerebrale del mouse. Ciò è particolarmente utile per l'imaging in tempo reale su un'area espansiva di un emisfero corticale.
Abstract
La craniotomia è una procedura comunemente eseguita per esporre il cervello per gli esperimenti in vivo. Nella ricerca del mouse, la maggior parte dei laboratori utilizzano una piccola craniotomia, in genere da 3 mm x 3 mm. Questo protocollo introduce un metodo per creare una finestra del cranio sostanzialmente quella da 7 x 6 mm esponendo più di un emisfero cerebrale sopra il mouse corteccia temporale e parietale (ad esempio, bregma di 2,5 - 4,5 mm laterale sul 0 - 6 mm). Per eseguire questo intervento, la testa deve essere inclinata di circa 30 ° e gran parte del muscolo temporale deve essere ritirato. A causa della grande quantità di rimozione ossea, questa procedura è previsto solo per gli esperimenti acuti con l'animale anestetizzato durante l'intervento chirurgico e sperimentare.
Il vantaggio principale di questo innovativo grande finestra cranica laterale è di fornire accesso simultaneo a entrambe le zone mediale e laterale della corteccia. Questo grande finestra del cranio unilaterale può essere utilizzato per studiare le dinamiche neurali tra le cellule,nonché tra le diverse aree corticali combinando multi-elettrodo registrazioni elettrofisiologiche, imaging dell'attività neuronale (ad esempio, l'imaging intrinseca o estrinseca), e la stimolazione optogenetic. Inoltre, questa grande craniotomia espone anche una grande area di vasi sanguigni corticali, consentendo la manipolazione diretta della vascolarizzazione corticale laterale.
Introduzione
Craniotomia è una procedura standard utilizzato da neuroscienziati per rivelare una porzione del cervello. Sin dagli albori della elettrofisiologia, la craniotomia ha consentito innovazioni senza precedenti nel campo delle neuroscienze. mappatura densa della corteccia cerebrale con elettrodi ha portato ad ipotesi esperimenti di prova e teorie basate su queste mappe. Abbiamo recentemente entrati in una nuova era in cui la craniotomia è utilizzata per l'imaging in vivo del flusso sanguigno corticale 1, 2, 3 e architettura neurovascolari 4, permettendo la visualizzazione in tempo reale dell'attività corticale nelle aree esposte 5, 6, 7. Sebbene molti studi utilizzano craniotomie combinate con tecniche di imaging ottico in vivo per studiare la struttura e la funzione dei neuroni corticali, glia e corvascolarizzazione tici 8, 9, ulteriori indagini sono limitate da piccole aree della corteccia esposta (ma vedi 10).
Lo scopo di questo protocollo è quello di fornire un metodo per creare una grande craniotomia laterali, esponendo la corteccia cerebrale dalla linea mediana all'osso squammoso, e si estende oltre bregma e lambda. Questa grande craniotomia consente la visualizzazione simultanea delle cortecce di associazione (retrosplenial, cingolo, e parietale), motoria primaria e secondaria, somatosensoriale, visivo, e la corteccia uditiva. Questo metodo è stato precedentemente accoppiato con immagini a colori sensibile tensione (VSDI) per indagare come più aree corticali interagiscono tra loro durante l'attività spontanea e stimolo indotto corticale 5, 11, 12. Gli aspetti più difficili di questa procedura include il posizionamento della testadell'animale, che fissa la piastra di testa, ed evitando emorragia mentre separa il muscolo temporale dall'osso parietale. Si deve inoltre tener conto durante i processi di foratura e di rimozione del cranio come le curve cranio ad un angolo obliquo.
Protocollo
Il seguente protocollo segue l'Università del Comitato Animal Care Lethbridge (ACC) le linee guida, ed è condotta in conformità con gli standard del Consiglio canadese Animal Care (CCAC).
1. Preparazione
- Per periodi di tempo prolungati, autoclave tutte le forniture chirurgiche aperte e garantire che la sterilità viene mantenuta per tutta la chirurgia. Se sono necessari più interventi chirurgici, autoclave tra interventi chirurgici.
- Assicurarsi che ci sia un sacco di tampone cervello a portata di mano (almeno 50 mL). La soluzione è composta da 134 mM cloruro di sodio, 5,4 mM di potassio, 1 mM di cloruro di magnesio esaidrato, 1,8 mM di cloruro di calcio diidrato, e 5 mM HEPES sodio, pH bilanciato a 7,4 con acido 5 M di idrogeno.
- Posizionare il mouse in una camera di induzione e anestetizzare con 3 - 4% isoflurano. Seguire con 1,0-2,0% isoflurano per la manutenzione durante l'intervento chirurgico. Ridurre ulteriormente a partire allo 0,4 - 0,8% durante l'imagingS = "xref"> 5 , 13 , 14 , 15 , a condizione che venga mantenuta un'anestesia adeguata. Questi bassi livelli di anestesia necessitano di monitoraggio vigile e frequente del mouse (circa ogni 5 min) per assicurarsi che rimangano muscolosi agli stimoli dolorosi.
NOTA: La disidratazione può diventare problematica a causa dell'elevato rapporto tra superficie e volume del topo ed esacerbato dall'uso prolungato di isoflurano.- Utilizzare iniezioni sottocutanee di soluzione salina, 0,1 ml per 10 g di peso corporeo, ogni 1 - 2 h. Quando opportunamente idratato, il mouse urinerà una volta ogni 1 - 2 h.
- Monitorare attentamente il mouse per garantire un'anestesia coerente durante l'intervento chirurgico e l'imaging. Non lasciare il mouse incustodito e prendersi cura di non riprendere mai la coscienza.
- Trasferire il mouse anestetizzato sul set di testa e posizionarlo su un pannello di riscaldamento termoregolatore impostato a 37 ° C. Fissare il tetto superioreh in un supporto denti.
- Ruotare la testa del mouse verso sinistra di circa 30 ° per esporre la parte laterale destra della testa e fissare la testa del topo con l'estremità smussata di barre orecchio (Figura 1A).
- Applicare una pomata oftalmica per evitare l'essiccazione della cornea.
- Per ridurre l'edema cerebrale, iniettare desametasone (4 mg / kg) per via intramuscolare.
- Pulire la pelle sopra l'area chirurgica con tamponi di cotone imbevuto 4% clorexidina (3 volte) e 70% di etanolo (3 volte). Utilizzare ogni tampone di cotone solo una volta.
- Munirsi di guanti chirurgici e coprire l'animale con la pellicola adesiva. Fornire anestetico locale iniettando di lidocaina (8 - 10 mg / kg; 2% epinefrina) per via sottocutanea sul sito craniotomia. Attendere 3-5 minuti per il farmaco di essere assorbito nel tessuto.
2. Rimozione della pelle e retrazione del muscolo dal cranio
- Eseguire quasi tutte queste procedure durante la visualizzazione del cranio, sotto undissezione microscopio (ad esempio, 0,7 - 4,5 x alimentazione, a seconda della situazione).
- Sollevare la pelle 1 mm a sinistra della linea mediana (appena dietro l'orecchio) con una pinza e fare una piccola incisione orizzontale con le forbici chirurgiche.
- Fare un 5 - taglio laterale 6 mm verso l'orecchio destro, e poi tagliare verso la fine rostrale della testa.
- Al punto di incisione iniziale, inserire le forbici e tagliare 10 mm rostralmente.
- Tagliare la pelle intorno l'orecchio destro, vicino l'occhio destro per esporre il lato destro del cranio e muscolo temporale. Assicurarsi che la parte più larga della zona esposta è di almeno 7 mm. Tagliare la pelle ulteriormente se l'area chirurgica deve essere estesa.
- Fissare la pelle intorno l'incisione mettendo alcune gocce di cianoacrilato colla butilica tra il cranio e la pelle. Garantire che il tessuto è stato preventivamente essiccato con applicatori di cotone punta o tessuti laminati per aumentare l'efficacia dell'adesivo.
- Usando un tampone di cotone, strofinare la superficiedel cranio in un movimento circolare per rimuovere il periostio dal cranio. Assicurarsi che nessuno rimanga asciugando completamente il cranio.
- Utilizzando forbici e pinze a molla, separare il muscolo temporale dal cranio; tagliare e ritrarre il muscolo lateralmente fino all'osso squammoso (Figura 1C). Prestare la massima attenzione a non danneggiare la vena temporale superficiale che costeggia il livello dell'osso squamosal vicino all'occhio, in caso contrario potrebbero verificarsi emorragia.
- Controllo emorragia con schiuma gel pre-impregnato in tampone cervello. Per grave emorragia utilizzare un cauterizer di calore. Goccia cianoacrilato colla butilica sui siti di sanguinamento dopo il trattamento con il calore cauterizer. Assicurarsi che l'area viene essiccato preventivamente mediante applicatori punta di cotone o tessuti laminati per aumentare l'efficacia dell'adesivo.
3. Craniotomia
NOTA: Il chirurgo deve rimanere diligente durante la rimozione del cranio eDura per evitare complicazioni inutili. Le procedure di risoluzione dei problemi sono incluse in caso di complicazioni.
- Segnare la posizione del bregma con un indicatore fine o tagliare un nastro piccolo pezzo triangolare e puntare un angolo a bregma ( Figura 2A ) per orientare le regioni del cervello sottostanti.
- Prima di apporre la testa, assicurarsi che il cranio sia completamente asciutto. Il cranio si asciuga rapidamente dopo l'applicazione della schiuma gel immersa nel tampone del cervello, se è necessario un maggiore essiccamento, utilizzare tamponi di punta di cotone. Questo passaggio è fondamentale per la fissazione della lastra di testa ( figura 1B ).
NOTA: Se sul teschio rimane del periosteo o se il cranio non è asciutto prima di incollare sulla piastra di testa, probabilmente si stacca. Se ciò accade, rimuovere delicatamente la piastra di testa e ricominciare. Durante questo processo si può verificare il sanguinamento; Lasciare qualche minuto per coagulare e quindi togliere delicatamente. Questo processo non è raccomandato per essere ripetuto più di due volte. - Applicare la colla etilcianoacrilato attorno al bordo inferiore della piastra di testa 16, ed incollare la piastra di testa sopra la zona craniotomia (Figura 1D e Figura 2A).
- Riempire lo spazio tra la piastra di apertura cranio e la testa con cemento dentale lasciando solo la zona craniotomia esposta. Attendere per il cemento dentale per asciugare e indurire, tipicamente 5 - 10 min (Figura 2B).
- Una volta che il cemento è impostato, brevemente riempire il pozzetto con tampone cervello e lasciare agire da 3 - 5 min. Utilizzare un tessuto laminato per rimuovere il tampone cervello prima perforazione (Figura 2C).
- Delineare l'area chirurgica con una leggera segnando la superficie del cranio con un trapano dentistico. Utilizzare un martello pneumatico (impostato al massimo di 20 PSI), con un FG ¼ bava, e controllato con un pedale velocità variabile.
- Delicatamente tracciare il trapano lungo il punteggio originale per approfondirla, eARANTIRE il trapano non penetra attraverso il cranio nel cervello (Figura 2D). A turno ogni pochi minuti tra foratura e tamponando la superficie del cranio con i tessuti laminati inumidite. Questo ridurrà il riscaldamento ed essiccamento del cranio da attrito meccanico ed esposizione prolungata.
NOTA: Il cranio andrà in onda rapidamente asciutta dopo l'applicazione della schiuma gel bagnato. Se è necessario più di essiccazione, utilizzare tamponi di cotone punta.
Attenzione: Il cranio è uniforme di spessore. Ad esempio, la cresta parietale-temporale è la zona più spessa, mentre le regioni cranio vicino alla linea mediana e monumenti squammoso sono relativamente sottili. - Durante la perforazione, controllare periodicamente per deformazione del cranio premendo delicatamente su di esso con una pinza o la punta del trapano non in movimento. Quando l'osso inizia a fibbia, smettere di foratura e immergere l'intera finestra in un tampone cervello.
NOTA: Se il sangue si precipita fuori di una zona, si può suggerire che la dura madre è stata danneggiata. Se questo è il caso, inserire un semi-bagnato schiuma gel sull'area e cercare di assorbire il sangue mentre delicatamente applicando pressione alla schiuma gel con un tampone di punta di cotone. - Attendere almeno 5 minuti prima della rimozione del cranio per ammorbidire l'osso e per ridurre la possibilità di attaccare la dura fino all'osso, rendendo il processo di rimozione del cranio più facile.
- Eseguire il processo di rimozione del cranio, mentre il cranio è immerso in un tampone cervello.
NOTA: Se una parte del cranio rimane ostinatamente attaccato, una lama di bisturi # 11 può essere utilizzato per segnare delicatamente il cranio. Prestare la massima attenzione a non forare la lama attraverso il cranio e nel cervello. - A partire dal bordo anteriore, sollevare delicatamente il cranio allentato dalla dura madre con pinze.
NOTA: se una piccola quantità di sanguinamento si verifica durante il processo di rimozione del cranio, rimuovere il buffer con una pipetta di trasferimento o una siringa, e poi sostituirlo con nuovo buffer. - Una volta che l'osso è allentata e "galleggiare" sulla dura, afferrare saldamente l'osso con una pinza e sollevare l'osso dallala dura madre. Assicurarsi che l'osso non penetra nel cervello.
- Per controllare il sanguinamento, rotolare l'angolo di un tessuto in un punto e rimuovere la maggior parte del buffer dal pozzo cranica. applicare rapidamente schiuma gel, pre-impregnato in un tampone, per la zona sanguinante aggiungendo pressione molto leggera con un tampone di punta di cotone.
NOTA: Il sanguinamento di solito proviene da bordo del osso o la superficie della dura; entrambi i casi sono normali e sanguinamento si fermeranno rapidamente se senza grandi vasi sanguigni sono danneggiati. Se l'emorragia continua, il sangue può riempire l'intera finestra, formare un foglio coagulo sopra l'area di esposizione.- Per rimuovere il foglio di coagulo, accuratamente raccogliere pezzi di sangue coagulato dalla area di esposizione, lasciando intatto il coagulo di sangue attorno alla fonte del vaso sanguigno rottura. Fare attenzione a non rimuovere il coagulo di sangue dalla sorgente di spurgo in quanto ciò potrebbe causare ancora più perdita di sangue. Irrigare la superficie del cervello con tampone cervello per lavare via il sangue.
- Fare attenzione a non toccare iltessuto cerebrale delicato o aggiungere materiale estraneo al cervello; ripetere fino emorragia si è fermata, per circa 2 - 5 minuti (figura 2E).
NOTA: A questo punto, la craniotomia è pronto per la preparazione della finestra del cranio (vedi punto 5). Se necessario, rimuovere la dura prima di impiantare la finestra del cranio (vedi punto 4).
4. Rimozione Dura
NOTA: la rimozione Dura richiede estrema attenzione e può richiedere oltre 15 min.
- Disegnare via il tampone in eccesso dalla craniotomia. Pur mantenendo una superficie umida, afferrare un piccolo pezzo di dura con una pinza e strappare delicatamente la dura.
- Utilizzare pinze e forbici molla strappare delicatamente e tagliare via la dura.
- Goccia più tampone cervello sulla superficie del cervello galleggiare la dura e aiutare separato dal cervello. Continuare fino a quando tutto dura viene rimosso dal sito finestra del cranio. Quando eseguito correttamente apparirà il cervello a essere molto pulito con bl distintanavi OOD e senza macchie (confrontare figura 2E con 2F).
Attenzione: Alcune aree della dura madre sono attaccati alle piccole arteriole sulla superficie del cervello (per esempio, vicino alla linea mediana prossimale alla zona associazione parietale), e la rimozione di tale possono rompersi arteriole. In questi casi, può essere meglio lasciare un piccolo pezzo di dura intatta sopra la parte superiore della arteriole. Il VSD non può penetrare quella piccola zona, ma questo è preferito avere sanguinamento maggiore. - Fissare la superficie del cervello in agarosio appena possibile per ridurre al minimo il movimento da pulsazione e prevenire ulteriore rigonfiamento (vedere la fase 5).
5. Preparazione cranica finestra
- Spruzzare il vetro di copertura con il 70% di etanolo e utilizzare una bombola d'aria per asciugare delicatamente. Assicurarsi che il vetro sia completamente pulita senza macchie o polvere presente.
- Preparare 1,3% agarosio mediante riscaldamento a 200 mg di polvere di agarosio disciolti in 15 mL di tampone cervello. Impostare il forno a micrave ad alta e calore per 10 - 15 s per volta, mescolando delicatamente in mezzo, fino a quando tutti agar è disciolto.
Nota: Assicurare bolle o particelle sono presenti in quanto potrebbero interferire con l'imaging. - Posizionare un termometro nel agarosio caldo e raffreddare l'agarosio fino a poco sopra solidificazione di temperatura (~ 40 ° C).
NOTA: Acqua corrente fredda sopra la parte esterna del contenitore agarosio può accelerare il processo di raffreddamento. Delicatamente mescolare continuamente per garantire l'assenza di bolle o in presenza di particolato. - Immediatamente prima di applicare l'agar, rimuovere il buffer cervello dal pozzo cranica. Redigere l'agarosio con una pipetta di trasferimento e rilasciare l'agarosio direttamente sul cervello. posizionare rapidamente il vetrino sulla superficie e fissare il vetrino con agarosio gocce sugli angoli.
6. eutanasia
NOTA: i chirurghi Nella nostra esperienza, questa procedura richiede sperimentato almeno 3 - 4 ambulatori di pratica per raggiungere più del 90%tasso di successo. Meno chirurghi esperti potrebbero richiedere ancora più pratica. Durante la craniotomia o durotomia, il cervello può subire danni, come ad esempio se i punzoni di perforazione attraverso l'osso nel cervello. Certo danno minore al bordo della craniotomia può essere consentita. Tuttavia, se il cervello non ha un aspetto "pulito" con brillanti vasi sanguigni intatti rossi e la corteccia bianca, l'esperimento può avere bisogno di essere terminato. Esempi di preparazioni povere includono quelli con i vasi sanguigni morti, o quando la corteccia è contrassegnata con vasi sanguigni strappati o danneggiati. Se uno qualsiasi di questi segni sono presenti, l'esperimento sarà improbabile produrre dati di alta qualità. Se l'intervento chirurgico / esperimento ha avuto successo o meno, umanamente eutanasia il mouse al termine dell'esperimento.
- Profondamente anestetizzare con almeno il 3,5% isoflurano. Quindi, dare un'iniezione intraperitoneale di pentobarbital sodico a 300 mg / kg. Idealmente, se l'ago viene inserito nel fegato, morte sarà molto rapida (<1 min).
- Se è richiesta la perfusione, verificare che l'animale è anestetizzato profondamente prima di procedere (vedi passo 1.3).
- In alternativa, se la perfusione non è richiesto, attendere un minimo di 5 min e quindi verificare che il mouse è morto. Confermare l'assenza di respirazione, battito cardiaco, così come la mancanza di recesso dolore e riflessi corneali. Inoltre, per osservare azzurro / colorazione bianco di estremità e oscuramento dei vasi sanguigni sulla corteccia.
Risultati
Per studiare le interazioni tra le aree corticali all'interno di un singolo emisfero, abbiamo usato un ampio craniotomia estende attraverso il seno sagittale e 5 - 6 mm lateralmente. Questa finestra cranica inclusa primaria (motore, somatosensoriale, visivo, uditivo), secondari (motore, visivo), e di associazione (retrosplenial, cingolo, parietale associazione) cortecce di emisferi destro (Figura 3A). Per questo lavoro abbiamo utilizzato l'imaging tensione sensibile colorante (VSD), che riflette le variazioni del potenziale di membrana 3. Questo protocollo sarebbe anche utile per altri estrinseca (ad esempio, calcio 17 e glutammato 18 immagini) o esperimenti di imaging intrinseche. Quando stimolando l'arti posteriori, zampa anteriore, baffi, visivo o uditivo di topi anestetizzati con leggerezza utilizzando 0,5% isoflurano, abbiamo osservato i modelli di consenso di depolarizzazione corticale (> Figura 3B). Coerente con gli studi precedenti 5, 19, 20, 21, 22, abbiamo trovato che breve stimolazione tattile di C2 barile corticale portato alla attivazione delle aree somatosensoriale primaria, così come "isole" di risposte all'interno di aree funzionalmente collegati. Ad esempio, la corteccia motoria primaria (M1) o rappresentazione secondaria di corteccia somatosensoriale (S2; Figura 3Bi). Una singola 1 ms tono pip (25 kHz) stimolazione ha determinato l'attivazione della corteccia uditiva primaria (A1) a circa 20 ms dopo stimolazione uditiva (Figura 3Bii). Nel corso dei prossimi pochi millisecondi, la depolarizzazione diffuse in tutto il corteccia uditiva e passato a vicina corteccia somatosensoriale secondaria. Circa 25 ms dopo l'inizio tono, una depolarizzazione corticale secondaria emergerebbe, situato 1.07; 0,2 millimetri mediale e 1,9 ± 0,1 mm posteriormente rispetto al bregma (n = 9 topi). Si tratta di circa l'ubicazione della zona di associazione parietale (PTA). Il segnale VSD poi propagato alla zona mediana dove si trovano altre aree corticali associative compreso retrosplenial (RS) e corteccia cingolata (CG). Pertanto, stimolazione uditiva portato alla attivazione di due aree focali distinte, da cui onde viaggianti di VSD depolarizzazione diffusione ad una zona più estesa all'interno della linea mediana della corteccia. Stimolazione focale dell'occhio controlaterale con un verde 1 ms impulso LED, all'attivazione della corteccia visiva primaria entro 40 ms (Figura 3Bv). Questa attivazione primaria della corteccia visiva è seguito: (1) l'espansione spaziale di VSD depolarizzazione nelle zone limitrofe situate medialmente, lateralmente, e anteriore alla zona iniziale attivato; (2) depolarizzazione di una seconda regione corticale mediale circa 50 ms dopo la stimolazione (n = 8 esperimenti) disposta lungo sa sutura gittal. Questo era simile a stimolazioni sensoriali di arti anteriori (Figura 3Biii), arti posteriori (Figura 3Biv), C2 basette o provino. risposte VSDI evocati dalla stimolazione sensoriale dell'arto anteriore, arti posteriori o provino inizialmente attivati rispettivi cortecce sensoriali primarie, seguite da una diffusione anisotropa di attività, così come l'attivazione linea mediana della corteccia circa 20 - 40 ms dopo la stimolazione. Questo risultato è stato simile a risposte da stimolazione visiva e soffio. La propagazione dell'attività sensoriale evocata lungo queste rotte linea mediana e attivarsi frequentemente stesse regioni attività spontanea 6 può suggerire che queste regioni sono il mozzo centrale del nucleo collegamento della corteccia topo, in cui le informazioni sensoriali possono integrarsi con attività corticale spontanea.
2fig1.jpg"/>
Figura 1. Setup chirurgico e preparazione. Testa (A) mouse viene rasata, purificati, ruotato di circa 30 ° per l'esposizione laterali, e fissato con l'estremità smussata di barre orecchio. anestetico isoflurano avviene tramite un elemento di naso e supporto denti. Il mouse è coperto con pellicola trasparente autoadesiva per aumentare la sterilità e calore. (B) Primo piano mostrando la pelle e periostio rimosso dalla piastra cranio parietali, il muscolo temporale è intatta. (C) Il muscolo temporale è rimosso esponendo la piastra temporale e ossa squammoso, notare la vena superficiale, non è danneggiato. (D) prima del fissaggio, la piastra di testa è posizionata nella posizione corretta con cera. Si prega di cliccare qui per vedere una versione più grande di questa figura.
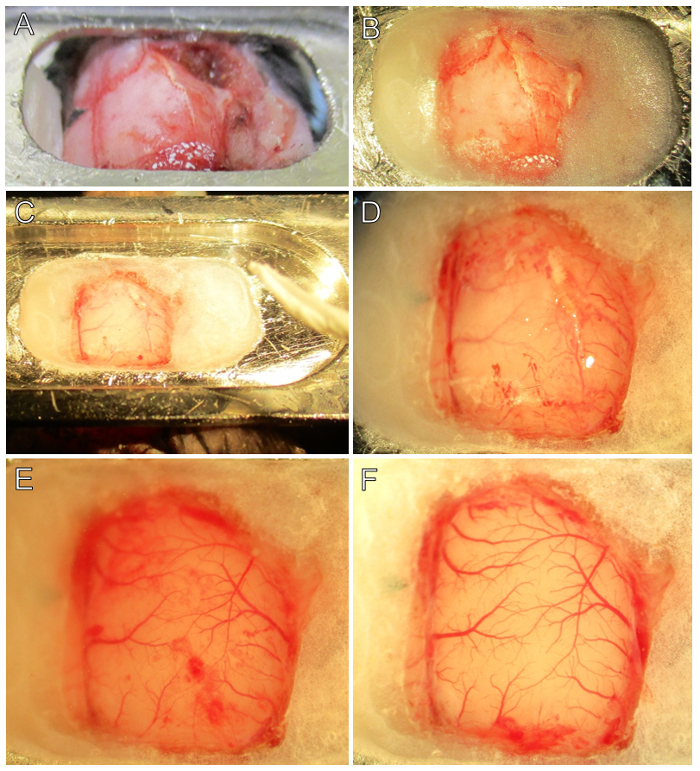
Figura 2. Step-by-step procedura chirurgica. (A) La testa piastra è attaccata al cranio con colla etilcianoacrilato nelle posizioni anteriore e posteriore. Si noti la posizione del bregma (pezzo nero di nastro triangolari). (B) La finestra del cranio è preparato applicando cemento dentale addensato tra la testa-piastra e cranio. Si noti che bregma ed i punti di riferimento squamosal rimangono visibili. (C) Dopo essiccazione del cemento, viene aggiunto tampone cervello per ammorbidire il cranio e per impedire l'adesione della dura. Un tessuto laminato aiuterà la rimozione del buffer cervello prima della perforazione. (D) I bordi della craniotomia sono stati segnati. Si noti il sistema vascolare è più facilmente visibile attraverso l'osso assottigliata in prossimità dei bordi cemento dentale. (E) Le piastre parietale e temporale del cranio sono stati RemovEd e la dura madre è visibile. Nota macchie di sangue sulla dura da sanguinamento minore, il che è normale. attento esame sotto 2 - 4X rivelerà due strati di vasi sanguigni, uno nella dura e l'altro nel pia. (F) La dura viene rimosso rivelando una corteccia incontaminato. Pial vascolare è rosso brillante, senza macchie presenti. Nota i pezzi vaganti di bianco dura di colore ai bordi della finestra del cranio. In questo esempio, c'è stato uno spurgo durale minore in corrispondenza della porzione posteriore della finestra del cranio, che rapidamente coagulato. Si prega di cliccare qui per vedere una versione più grande di questa figura.
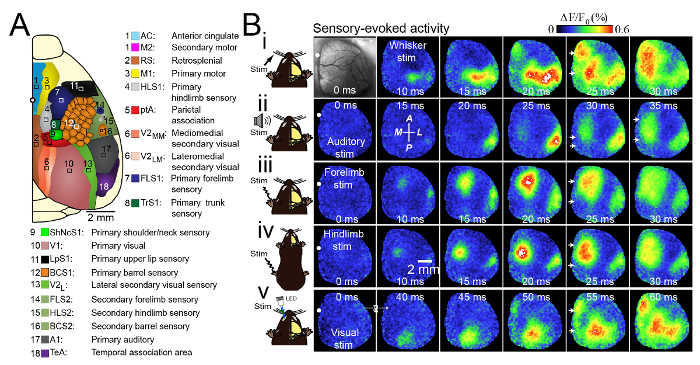
Figura 3. Modelli unici e Consenso attivazione durante molteplici forme di stimolazione sensoriale. < / Strong> (A) Schema della craniotomia unilaterale che mostra le regioni corticali imaged. (B) Fotomicrografia dell'ampia craniotomia unilaterale con bregma indicata da un cerchio bianco in ogni immagine. Modelli di attivazione corticale sono mostrati in un topo anestetizzato con isoflurano (0,5%) dopo (i) stimolazione (stim) del whisker contralaterale C2, (ii) stimolazione uditiva, (iii) stimolazione contralaterale forelimb, iv) stimolazione posteriore laterale contralaterale V) stimolazione visiva dell'occhio contralaterale con un diodo emettitore (LED). C'era l'attivazione della linea mediana dopo tutte le forme di stimolazione sensoriale (frecce bianche) a 10 - 25 ms dopo l'attivazione primaria della corteccia sensoriale. Le risposte sono la media di 20 prove. L'immagine seconda da sinistra nella seconda riga (ii) indica le direzioni anteriori (A), posteriori (P), mediali (M) e laterali (L). Modificato con permesso di Mohajerani, et al., 2013.p_upload / 52642 / 52642fig3large.jpg" target = '_ blank'> Clicca qui per vedere una versione più grande di questa figura.
Discussione
Questo protocollo innovativo per una grande finestra cranica permette l'imaging simultaneo sulle zone temporali e parietali della corteccia cerebrale. Combinato con imaging ottico, può aiutare a rivelare dinamiche neurali all'interno di aree corticali durante l'attività spontanea e stimolo-indotta. Questo craniotomia espansiva espone anche una grande estensione della rete vascolare corticale, tra cui l'estremità prossimale dell'arteria cerebrale media (MCA), consentendo imaging in vivo del flusso sanguigno e la manipolazione diretta di navi laterali per modelli ischemiche. Questa tecnica sarà di grande utilità per le linee recentemente sviluppate di topi esprimenti proteine di tensione e indicatore di calcio 23. Questi topi offrono il vantaggio pratico di bypassando la necessità di incubazione coloranti sensibili tensione sulla corteccia. Questi coloranti estrinseci prendono tempo di penetrare adeguatamente il tessuto cerebrale (~ 60 - 90 min) e sono limitati dalla loro tossicità mite. Grandi craniotomie hanno ancheprecedentemente utilizzato per studiare il cervello di ratto in via di sviluppo con VSDI 11. ratti appena nati hanno una testa molto più grande ed è paragonabile per dimensioni con topi adulti. Questo offre ai ricercatori l'opportunità unica di studiare problemi di sviluppo nel campo delle neuroscienze, anche se non con i topi transgenici.
Le principali limitazioni di questo metodo sono l'impossibilità per gli esperimenti cronici. La curvatura del cranio rende il processo di perforazione più impegnativo e richiede tempo che craniotomie più piccoli. Per questo grande craniotomia, è fondamentale per posizionare la testa con i punti di riferimento centrali sutura e squammoso essere parallelo al piano di messa a fuoco della lente. Mentre alcuni distorsione del cervello è previsto dalla curvatura del cervello, questi vengono superati concentrandosi negli strati superficiali della corteccia. Questo problema è ulteriormente alleviato ottenendo numerose ripetizioni di stimolazione e media. In sintesi, la nostra tecnica craniotomia grande è ampiamente appLicable per lo studio dei problemi attuali nella neurobiologia.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è stato sostenuto da un consiglio scientifico di ricerca scientifica del Canada (NSERC) Discovery Grant # 40352, Campus Alberta per l'Innovation Program Chair, Alberta Alzheimer Research Program a MHM e NSERC CREATE in borsa di dottorato BIF e borsa di studio post-laurea AIHS a MK. Ringraziamo Pu Min Wang per lo sviluppo di questo protocollo e per la formazione chirurgica, e Behroo Mirza Agha e Di Shao per la carriera.
Materiali
| Name | Company | Catalog Number | Comments |
| Heating Pad | FHC | 40-90-2 | |
| Fine Scissors | Fine Science Tools | 14058-09 | |
| Forceps | Fine Science Tools | 11251-35 | 2 or more pairs are recommended |
| Spring scissors | Fine Science Tools | 15000-00, 15000-10 | 1 pair should be designated for dura removal |
| Jet tooth shade powder | LANG Dental | Jet Tooth Shade Powder | to be mixed with the Jet Liquid |
| Jet tooth shade liquid | LANG Dental | Jet Tooth Shade Liquid | to be mixed wihth the Jet Powder |
| Drill Heads - Carbide Burs FG 1/4 389 | Midwest Dental | 385201 | |
| Agarose Powder | Sigma-Aldrich | A9793 | |
| Gelfoam | Sinclair Dental Canada | Pfizer Gelfoam | |
| Isoflurane | Western Drug Distribution Centre Ltd | 124125 | |
| Lidocaine 2% Epinephrine | Western Drug Distribution Centre Ltd | 125299 | |
| Dexamethazone 5 mg/mL | Western Drug Distribution Centre Ltd | 125231 | |
| Butyl cyanoacrylate glue (VetBond) | Western Drug Distribution Centre Ltd | 12612 |
Riferimenti
- Sigler, A., Mohajerani, M. H., Murphy, T. H. Imaging rapid redistribution of sensory-evoked depolarization through existing cortical pathways after targeted stroke in mice. Proc Natl Acad Sci U S A. 106 (28), 11759-11764 (2009).
- Shih, A. Y., et al. Two-photon microscopy as a tool to study blood flow and neurovascular coupling in the rodent brain. J Cereb Blood Flow Metab. 32 (7), 1277-1309 (2012).
- Grinvald, A., Hildesheim, R. VSDI: a new era in functional imaging of cortical dynamics. Nat Rev Neurosci. 5 (11), 874-885 (2004).
- Blinder, P., Shih, A. Y., Rafie, C., Kleinfeld, D. Topological basis for the robust distribution of blood to rodent neocortex. Proc Natl Acad Sci U S A. 107 (28), 12670-12675 (2010).
- Mohajerani, M. H., et al. Spontaneous cortical activity alternates between motifs defined by regional axonal projections. Nat Neurosci. 16 (10), 1426-1435 (2013).
- Mohajerani, M. H., McVea, D. A., Fingas, M., Murphy, T. H. Mirrored bilateral slow-wave cortical activity within local circuits revealed by fast bihemispheric voltage-sensitive dye imaging in anesthetized and awake mice. J Neurosci. 30 (10), 3745-3751 (2010).
- Lippert, M. T., Takagaki, K., Xu, W., Huang, X., Wu, J. Y. Methods for voltage-sensitive dye imaging of rat cortical activity with high signal-to-noise ratio. J Neurophysiol. 98 (1), 502-512 (2007).
- Misgeld, T., Kerschensteiner, M. In vivo imaging of the diseased nervous system. Nat Rev Neurosci. 7 (6), 449-463 (2006).
- Kerr, J. N., Denk, W. Imaging in vivo: watching the brain in action. Nat Rev Neurosci. 9 (3), 195-205 (2008).
- Aronoff, R., et al. Long-range connectivity of mouse primary somatosensory barrel cortex. Eur J Neurosci. 31 (12), 2221-2233 (2010).
- McVea, D. A., Mohajerani, M. H., Murphy, T. H. Voltage-sensitive dye imaging reveals dynamic spatiotemporal properties of cortical activity after spontaneous muscle twitches in the newborn rat. J Neurosci. 32 (32), 10982-10994 (2012).
- Sweetnam, D., et al. Diabetes impairs cortical plasticity and functional recovery following ischemic stroke. J Neurosci. 32 (15), 5132-5143 (2012).
- Yin, Y. Q., et al. In vivo field recordings effectively monitor the mouse cortex and hippocampus under isoflurane anesthesia. Neural Regeneration Research. 11 (12), 1951-1955 (2016).
- Sharp, P. S., et al. Comparison of stimulus-evoked cerebral hemodynamics in the awake mouse and under a novel anesthetic regime. Scientific Reports. 5, 12621 (2015).
- Kyweriga, M., Mohajerani, M. H., Kianianmomeni, A. Optogenetics: Methods and Protocols. Methods in Molecular Biology. 1408, 251-265 (2016).
- Grutzendler, J., Gan, W. B. . Imaging in neuroscience and development : a laboratory manual. , (2005).
- Vanni, M. P., Murphy, T. H. Mesoscale transcranial spontaneous activity mapping in GCaMP3 transgenic mice reveals extensive reciprocal connections between areas of somatomotor cortex. J Neurosci. 34 (48), 15931-15946 (2014).
- Xie, Y., et al. Resolution of High-Frequency Mesoscale Intracortical Maps Using the Genetically Encoded Glutamate Sensor iGluSnFR. J Neurosci. 36 (4), 1261-1272 (2016).
- Chan, A. W., Mohajerani, M. H., LeDue, J. M., Wang, Y. T., Murphy, T. H. Mesoscale infraslow spontaneous membrane potential fluctuations recapitulate high-frequency activity cortical motifs. Nat Commun. 6, 7738 (2015).
- Lim, D. H., et al. In vivo Large-Scale Cortical Mapping Using Channelrhodopsin-2 Stimulation in Transgenic Mice Reveals Asymmetric and Reciprocal Relationships between Cortical Areas. Front Neural Circuits. 6, (2012).
- Ferezou, I., et al. Spatiotemporal dynamics of cortical sensorimotor integration in behaving mice. Neuron. 56 (5), 907-923 (2007).
- Mohajerani, M. H., Aminoltejari, K., Murphy, T. H. Targeted mini-strokes produce changes in interhemispheric sensory signal processing that are indicative of disinhibition within minutes. Proc Natl Acad Sci U S A. 108 (22), E183-E191 (2011).
- Madisen, L., et al. Transgenic mice for intersectional targeting of neural sensors and effectors with high specificity and performance. Neuron. 85 (5), 942-958 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon