Method Article
체외 합성에 인간의 세포에서 단백질 발현 유도의 mRNA를 수정의
요약
이 비디오 문서에서는, 우리는 세포에서 단백질 발현의 유도에 대한 수정의 mRNA의 체외 합성을 설명합니다.
초록
원하는 세포에서 단백질 합성의 유도 합성 메신저 RNA (mRNA의)를 코딩의 외생 배달 재생 의학, 기본적인 세포 생물학, 질병의 치료, 세포의 재 프로그래밍 분야에서 엄청난 잠재력을 가지고있다. 여기서 우리는 유동 세포 계측법에 의해 유도 된 단백질 발현의 감소 면역 활성화의 가능성과 안정성이 향상, 생산의 mRNA의 품질 관리, 세포의 형질의 mRNA와 검증과 수정의 mRNA의 생성 단계 프로토콜에 의해 단계를 설명합니다. eGFP는 mRNA의 단일 형질 전환 후 3 일까지, 형질 전환 된 HEK293 세포 eGFP는을 생산하고 있습니다. 이 비디오 문서에서, eGFP는 mRNA의 합성을 예로 들어 설명한다. 그러나, 절차는 다른 원하는 mRNA를 생산에 적용될 수있다. mRNA의 변성 합성을 사용하여, 세포를 일시적들이 정상적으로 발현하지 것이다 원하는 단백질을 발현하도록 유도 될 수있다.
서문
세포에서, 전령 RNA의 전사 (mRNA의) 원하는 단백질 내로의 mRNA의 번역은 다음 셀의 적절한 기능을 보장한다. 유전 또는 획득 한 유전 질환 단백질의 부족과 장애 합성으로 이어질 심각한 질병을 일으킬 수 있습니다. 따라서, 결함이 없거나 단백질의 생산을 유도하는 새로운 치료 방법은 세포 내로의 mRNA 합성의 개질 외인성 전달, 목적 단백질을 코딩이다. 이에 따라, 세포가 정상적으로 생성되지 않거나 자연적으로 필요하지 않을 기능 단백질을 합성하는 트리거됩니다. 이 방법을 사용하여, 유전 질환의 mRNA의 도입에 의해 보정 될 수없는 결함이 있거나 한 단백질을 코딩. mRNA의 치료는 또한 종양 세포 또는 병원체에 의해 발현 된 단백질 항원을 접종 synthetize하기 위해 사용될 수있다. 이에, 숙주 면역 시스템은 효과적으로 종양 세포를 제거하거나 infe을 방지하기 위해 활성화 될 수있다ctions 2,3. 또한, 최근에는 mRNA를 성공적으로 유도 된 다 능성 줄기 세포 (iPSCs)를 생성하기 위해 사용되었다. 이러한 목적을 위해, 섬유 아세포 리 프로그래밍의 발현이 4-6 인자 유도 및 재생 의학에 막대한 잠재력 iPSCs으로 변환하는 mRNA를 함께 형질 감염시켰다.
이전에, 종래의 mRNA의 사용은 낮은 안정성과 강한 면역 원성 연관되었다. 따라서, 기존의 mRNA의 임상 적용은 제한되었다. 그러나 Kariko과 동료의 mRNA 분자 내에 5 메틸 시티와 pseudouridine로 시티 딘과 딘의 교체는 생물학적 유체 안정의 mRNA 분자를 렌더링 극적으로 지금 수정의 mRNA의 임상 적용을 허용 면역 활성화 7-10 감소.
합성으로 생산 된 수정의 mRNA를 사용하여, 원하는 유전자 성적표는 일시적으로 생체 (11)에 전달 될 수또는 시험관 내에서 단백질 발현을 유도한다. 도입의 mRNA는 세포 번역 기계에 의해 생리 학적 조건에서 변환됩니다. 인해 바이러스 유전자 치료 벡터에 비해 숙주 세포 게놈 내로 통합의 부족으로, 종양의 위험도 12,13 방지된다. 따라서, 수정 합성의 mRNA를 사용하여 치료 이후에보다 좋은 임상 승인을 얻을 것이다.
여기에, 우리는 수정 된 mRNA를 생산 (그림 1)의 mRNA와 세포와 형질 전환 된 세포에서 단백질 발현의 평가, 형질 전환에 대한 자세한 프로토콜을 설명합니다.
프로토콜
필수 DNA 시퀀스를 코딩 포함하는 플라스미드 1. 확대 술 (CDS)
- 사전 따뜻한 실온으로 변환 키트에 포함되어 SOC 배지, 37 ° C, 100 ㎍ / ml의 암피실린을 함유하는 LB 아가 플레이트. 42 ° C의 물을 욕조를 평형.
- 화학적 구성 요소 E. 중 하나 유리 병을 해동 얼음에 대장균.
- 화학적 성분의 E. 바이알 내로 CDS 함유 플라스미드 1-5 μL (100 ng의 10 페이지)를 첨가 대장균과 부드럽게 섞는다. 피펫 팅하여 세포를 혼합하지 마십시오. 플라스미드를 추가 한 후, 부드럽게 튜브를 눌러 섞는다.
- 30 분 동안 얼음 혼합물을 품어.
- 열 충격 E. 흔들림없이 물을 욕조에 42 ° C에서 30 초 동안 대장균.
- 2 분 동안 얼음에 병을 놓습니다.
- E.에 예열 SOC 매체의 250 μl를 추가 대장균은 세균 배양기에서 37 ° C에서 1 시간 동안 300 rpm에서 수평으로 박테리아를 흔들어.
- 100 μL와 미리 예열하는 LB 아가 플레이트에 변환 믹스 150 μl를 확산 판을 반전 하룻밤에 37 ° C를 품어.
- 콜로니가 표시되고 나면, 100 ㎍ / ㎖의 앰피 실린 5 ㎖의 LB 배지를 함유하는 15 ㎖의 배양 관에 각각 플레이트로부터 단일 콜로니를 접종. 문화가 늦게 로그 또는 고정 단계가 될 때까지 300 rpm에서 진탕 37 ° C에서 하룻밤을 품어.
- 형질 전환 된 E.의 장기 저장 용 콜라이, 피펫 cryovial으로 100 % 글리세롤 75 μl를. 세균 배양 (냉동 주식이 25 % 글리세롤을 포함한다)의 225 μl를 추가, 잘 섞는다 및 -80 ° C에서 cryovial를 저장합니다.
- 제조업체의 지시에 따라 플라스미드 정제 키트를 사용하여 필요한 CDS를 함유하는 플라스미드를 분리.
- 분광 광도계를 사용하여 플라스미드 농도를 결정한다.
- 20 μL의 분량을 준비하고 오랜 시간 동안 -20 ° C에 저장합니다.
- 참고 : PCR을 이용하여 증폭 시험 관내 전사 (IVT), 여기에 관심있는 CDS, eGFP는 대한 DNA 템플릿을 구하십시오. 동시에, 120 티미 딘 (T)의 폴리 T-꼬리는 T (120) 확장자 역 프라이머를 사용하여 삽입에 추가됩니다. 이에 의해, 생성되는 mRNA IVT 후 정의 된 길이의 폴리 A-꼬리를 얻었다.
- 표 1에서 설명하는대로 PCR 혼합물을 준비합니다.
- 완전히 반응 혼합물을 섞는다. NOTE : PCR 생성물은 4-5 IVT 반응에 사용될 수있다. IVT 용 DNA 템플릿 량을 증가시키기 위해, PCR 혼합물의 총 체적이 증가 될 수있다. 몇몇 PCR 튜브 각각 함유하는 100 ㎕의 PCR 혼합물을 PCR 생성물의 충분한 수율을 확보 할 수있다.
- PCR 열 순환기에 튜브를 놓고 PCR 사이클링 프로토콜 (표 2)를 사용하여 PCR을 실행.
- P는 정리20 ㎕의 뉴 클레아 제 -없는 물을 사용하는 DNA는 제조업체의 지침에 따른 용출 및 PCR 정제 키트를 이용하여 CR 반응.
- 분광 광도계를 이용하여 DNA 농도를 측정한다. 참고 : 감지 DNA 농도가 약 300 ㎍ / ㎖의입니다. 따라서, 예상 총량은 ~ 6 μg의이어야한다. 다른 단백질에 대한 DNA의 양은 CDS의 길이에 따라 달라질 수 있으며, 플라스미드의 양은 PCR, 프라이머 어닐링 온도 및 싸이클 횟수에 사용.
- 오랜 시간 동안 -20 ° C에서 DNA 동결 또는 IVT 직접 사용.
3. 조정 단계 : PCR 제품의 품질
- DNA 겔 전기 영동에 의해 PCR 산물의 품질을 확인.
- 플라스크에 1 배 TBE와 아가로 오스의 원하는 금액을 섞는다. 1 % 아가 로즈 겔의 경우, 1 배의 TBE 50ml로 오스 0.5 g을 추가한다.
- 아가까지 마이크로 웨이브가 용해된다. 이 비등하게하지 마십시오. 아가로 오스 용액에 완전히 있는지 확인합니다.
- 50 ml의 아가 로스 젤에 5 μL 핵산 젤 얼룩을 추가합니다.
- , 아가 로스 젤 상자에 젤을 부어 콤을 설정하고 젤 응고 될 때까지 약 1 시간을 기다립니다.
- 빗을 제거하고 젤 트레이에 젤 상자를 배치합니다.
- 12 μL의 총 부피의 2 μL 6 배 로딩 버퍼 80-10,000 염기쌍의 DNA 사다리의 2 μL (200 NG) 및 PCR 제품의 200 NG를 각각 섞는다.
- 조심스럽게 아가로 오스 겔의 우물에 DNA 샘플을로드합니다.
- 버퍼를 실행으로 1X TBE를 사용하여, 1 시간 동안 100 V에서 아가 로스 젤을 실행합니다.
- 이미징 시스템 (도 2)의 DNA 밴드를 시각화.
4. 시험 관내 전사 (IVT)
- NOTE는 : PCR 후, 플라스미드 인서트 증폭 및 폴리 T 꼬리 첨가된다. IVT 동안, 유전 정보는 DNA에서 RNA로 전사된다. 생성 된 mRNA의 성적 증명서는 세포에서 단백질을 생산하는 데 사용됩니다.
- 의 RNase D와 작업 영역과 피펫을 청소오염 제거 솔루션입니다. 반응이 RNases와 혼합의 자주 사용하는 PCR 깨끗하고 무균 이중 필터 피펫 팁과 오염을 최소화하기 위해 장갑을 변경합니다.
- 표 3에 기재된 바와 같이 NTP / 캡 아날로그 혼합물을 준비한다.
- 와동에 의해 철저하게 NTP / 캡 아날로그 혼합물을 혼합하고 짧게 스핀 다운.
- 표 4에 기재된 바와 같이 IVT 반응 혼합물을 조립한다.
- 부드럽게 피펫 팅 아래에 의해 철저하게 IVT 반응 혼합물을 섞는다. 이어서 튜브의 하단에 혼합물을 수집 짧게 PCR 튜브를 원심 분리기.
- 써모에서 3 시간 동안 37 ° C에서 품어.
참고 : 최적의 배양 시간이 삽입 주어진 템플릿의 전사 효율의 길이에 따라 달라집니다. 짧은 삽입 (NT <500)의 경우, 더 긴 배양 시간이 유리할 수있다. 경시 실험을 최대 수율을위한 최적의 배양 시간을 결정하기 위해 행해질 수있다. 따라서, exampl를 들어, IVT 반응을 설정즉, 1, 2, 3, 4, 6 시간, 밤새 인큐베이션하고 mRNA의 양을 결정한다. eGFP는 mRNA의 생성에 대한 시험 관내 전사의 동력학은도 3에 도시된다. - , 주형 DNA를 제거 IVT 반응 혼합물에 DNase의 1 μL (2 U / μL)를 추가하려면, 잘 혼합하고 37 ℃에서 15 분을 품어.
- 제조자의 지시에 따라 RNA 정제 키트를 사용하여 반응 혼합물을 정제 하였다. 40 ㎕의 뉴 클레아 제 무 물로 2 회 스핀 컬럼 막으로부터 수정의 mRNA를 용출. NOTE : 검출 된 RNA의 농도는 약 1500 ㎍ / ml 일. 따라서, 예상 총량은 ~ 120 μg의이어야한다. 다른 단백질 합성의 mRNA 양 CDS의 길이와 IVT 사용되는 PCR 산물의 양에 따라 다를 수있다.
남극 인산 가수 분해 효소 정제 된 mRNA를 5. 치료
- 참고 : 생성 된 mRNA의 5를 제거하기 위해 포스 파타 아제로 처리 '트라이면역 활성화에 RIG-I에 의해 인식 이어질 수 있습니다 인산염. 또한, 인산 처리는자가 결찰 반응에 다시 회람을 방지 할 수 있습니다.
- 정제 된 mRNA의 솔루션의 79 μL에 10 배 남극 포스 파타 아제 반응 버퍼 9 μl를 추가합니다. 그 후, 남극 포스 파타 아제 (5 U / μL)의 2 μL를 추가하고 부드럽게 샘플을 섞는다. 30 분 동안 37 ° C에서 반응 혼합물을 인큐베이션.
- 제조자의 지시에 따라 RNA 정제 키트를 사용하여 반응 혼합물을 정제 하였다. 50 ㎕의 뉴 클레아 제 무 물로 2 회 스핀 컬럼 막으로부터 수정의 mRNA를 용출.
- 분광 광도계를 사용하여 변형 된 mRNA의 농도를 측정한다. 260 nm의 체크인 / 280 nm에서의 흡광도의 비율 (A (260) / A (280)) ≥ 1.8 내지 260의 비율 / A (230)의 순도를 나타내는, 인을 2.0이라고.
참고 : 예상 총 생산량은이 sufficie이며, 약 90 μg의해야NT 약 36 mRNA의 형질합니다. - 클레아없는 물을 첨가하여 100 ng의 / μL로의 mRNA의 농도를 조정.
- -80 ° C에서 형질 및 저장에 필요한 일회용 씩에 수정 된 mRNA의 나누어지는. 여러 동결 및 해동 사이클을 피하십시오. 제대로 준비하고 mRNA를 몇 년 동안 안정 저장됩니다. 작업하는 동안 항상 얼음에 수정 된 mRNA를 유지합니다.
6. 조정 단계 : 종합 된 수정 된 mRNA의 품질
- RNA 겔 전기 영동에 의해 수정의 mRNA의 품질을 확인합니다.
- 플라스크에 1 배 TBE와 아가로 오스의 원하는 금액을 섞는다. 1 % 아가 로즈 겔의 경우, 1 배의 TBE 50ml로 오스 0.5 g을 추가한다.
- 아가까지 마이크로 웨이브가 용해된다. 이 비등하게하지 마십시오. 아가로 오스 용액에 완전히 있는지 확인합니다.
- 50 ml의 아가 로스 젤에 5 μL 핵산 젤 얼룩을 추가합니다.
- , 아가 로스 겔 상자에 겔을 붓고 빗 설정하고 겔 솔리 때까지 약 1 시간을 기다려dified.
- 빗을 제거하고 젤 트레이에 젤 상자를 배치합니다.
- 0.5 ~ 10 KB의 RNA 사다리의 3 μL (3 μg의)와 mRNA의 10 μL의 총 부피의 7 μL 로딩 버퍼 각각 수정하여 합성 200 NG를 섞는다. 로딩 완충액의 조성은 표 5에 기재되어있다.
- 10 분 동안 70 ° C에서 사다리와 mRNA의 샘플을 변성시킨다.
- 조심스럽게 사다리와 1 % 아가 로스 젤에서 mRNA의 샘플을로드합니다.
- 버퍼를 실행으로 1X TBE를 사용하여 1 시간 동안 100 V에서 전기 영동을 수행합니다.
- 젤 문서 시스템 (그림 4)를 사용하여 자외선 transilluminator가와 사진에 사다리와 mRNA의 밴드를 시각화.
7. 형질에 대한 세포의 준비
- 12 웰 플레이트 잘 당 판 (2) X10 5 세포 (HEK293 세포).
- 세포 배양기에서 37 ° C에서 밤새 세포를 부화. 참고 : 형질의 날에, 세포가 REAC해야한다80-90 %를을 hed.
8. 세포의 mRNA 트랜 수행
- 수정 된 mRNA를 해동.
- 형질 전환에 대한 리포 플렉스를 생성합니다.
- 수정 mRNA의 25 μL (2.5 μg의) 내가 12 웰 플레이트 잘 하나의 형질 전환을위한 형질 전환 혼합물을 생성하는 혈청 배지를 감소 473 μL 옵티-MEM (최소 필수 중간)에 양이온 성 지질 형질 전환 시약의 2 μL를 추가합니다. 형질 전환되는 우물의 수에 따라 볼륨을 확장 할 수 있습니다. 음성 대조군으로, mRNA를하지 않고 형질 전환 혼합물을 제조.
- 부드럽게 피펫 팅하여 컴포넌트를 섞는다. 형질 감염을위한 리포 플렉스를 생성하기 위해 20 분 동안 실온에서 형질 전환 혼합물을 인큐베이션.
참고 : 형질 전환 혼합물이 항생제가 포함되어 있지 않습니다. 따라서, 세포를 처리하는 동안 불임을 보장하기 위해주의를 기울입니다. - 500 μL의 DPBS와 세포를 씻으 / 웰.
- 12도 괞 찮아 잘 하나에 형질 전환 혼합물 μL 500 추가테.
- 37 ° C에서 4 시간, 5 % CO 2 세포를 부화.
- 형질 전환 혼합물을 대기음 세포에 1 ml의에게 완전한 세포 배양 배지를 추가한다.
- 세포 배양기에서 24 시간 동안 세포를 품어.
- 형광 현미경을 수행하면 형광 현미경 (도 5)를 사용하여 분석한다. NOTE는 : eGFP는 이외의 mRNA는 mRNA의 코딩에 의해 생성되는 형질 전환 세포에서 다른 단백질의 발현을 조사하기 위해서, 세포는 커버 슬립에서 배양 될 수있다. 이어서 형질 감염이 수행 될 수 있고, 세포를 적절한 항체로 염색하고 형광 현미경으로 분석 될 수있다.
세포의 eGFP는 표현의 9 유세포 분석
- 웰로부터 세포 배양 배지를 제거하고 (칼슘 및 마그네슘없이) 1 ㎖의 DPBS로 각 웰을 세척 하였다. 세포 배양 플레이트의 표면으로부터 세포를 분리하는 웰 당 500 ㎕를 트립신 / EDTA를 추가한다. 계속해서, (500)을 추가μL TNS 당 잘 트립신을 비활성화합니다.
- 실온에서 300 XG에서 5 분 동안 분리 된 세포를 원심 분리기. 만 펠렛을 떠나 뜨는을 제거합니다. 150 ㎕의 세포 고정액에서 세포 펠렛을 재현 탁하고 유세포 튜브에 세포 현탁액을 전송.
- eGFP는 발현 세포의 비율 및 평균 지오 (형광 강도의 기하 평균) (도 6)를 사용하여 형광 강도를 분석.
시간 이상 단백질 발현 10. 측정
- 또한 단계 8에 기재된 바와 같이, 12- 웰 플레이트의 웰 (3)의 셀의 mRNA 트랜 수행 mRNA를 첨가하지 않은 형질 전환 혼합물로 HEK293 세포를 웰 3을 배양한다.
- eGFP는 1, 2의 발현을 측정, 3 일 후 형질 전환 단백질 발현 (도 7)의 지속 기간을 평가.
결과
eGFP는의 CDS를 포함하여 pcDNA 3.3 플라스미드를 사용하여, 수정 된 eGFP는 mRNA를 합성 (도 1)를 구축했다. PCR에 의한 삽입 증폭 및 폴리 T-미행 한 후, 약 1,100 bp의 길이의 명확한 밴드 (그림 2)을 검출한다. mRNA의 (그림 3)의 수율은 IVT 시간을 증강 증가. IVT 후, 약 1100 bp의 길이의 명확한 mRNA의 밴드가 생성 될 eGFP는 mRNA의 길이 (도 4)에 대응하는 검출되었다.
eGFP는 mRNA의 생성의 기능은 HEK293 세포의 형질 감염에 의해 시험 하였다. 이러한 목적을 위해, 형질 감염 복합체 (리포 플렉스)는 양이온 성 지질 형질 감염 시약을 이용하여 생성 하였다. 형질 12- 웰 플레이트의 웰 당 2 × 105 세포로 수행 하였다. eGFP는 세포의 제조는 Figu (형광 현미경을 사용하여 형질 감염 후 24 시간을 검출 하였다다시 5) 세포 계측법 (그림 6) 흐름.
HEK293 세포는 eGFP는 mRNA를 함께 형질 감염시켰다. eGFP는 식 1, 2, 3 일 형질 세포에서 단백질 발현의 지속 기간을 평가하기 위해 (도 7) 후에 결정되었다. 24 시간 후, 단백질 발현이 세포에서 가장 높았다. 양은 모든 다음날 1.6 배 감소 하였다. 도 3 일 후, 세포 eGFP는를 함유 하였다.
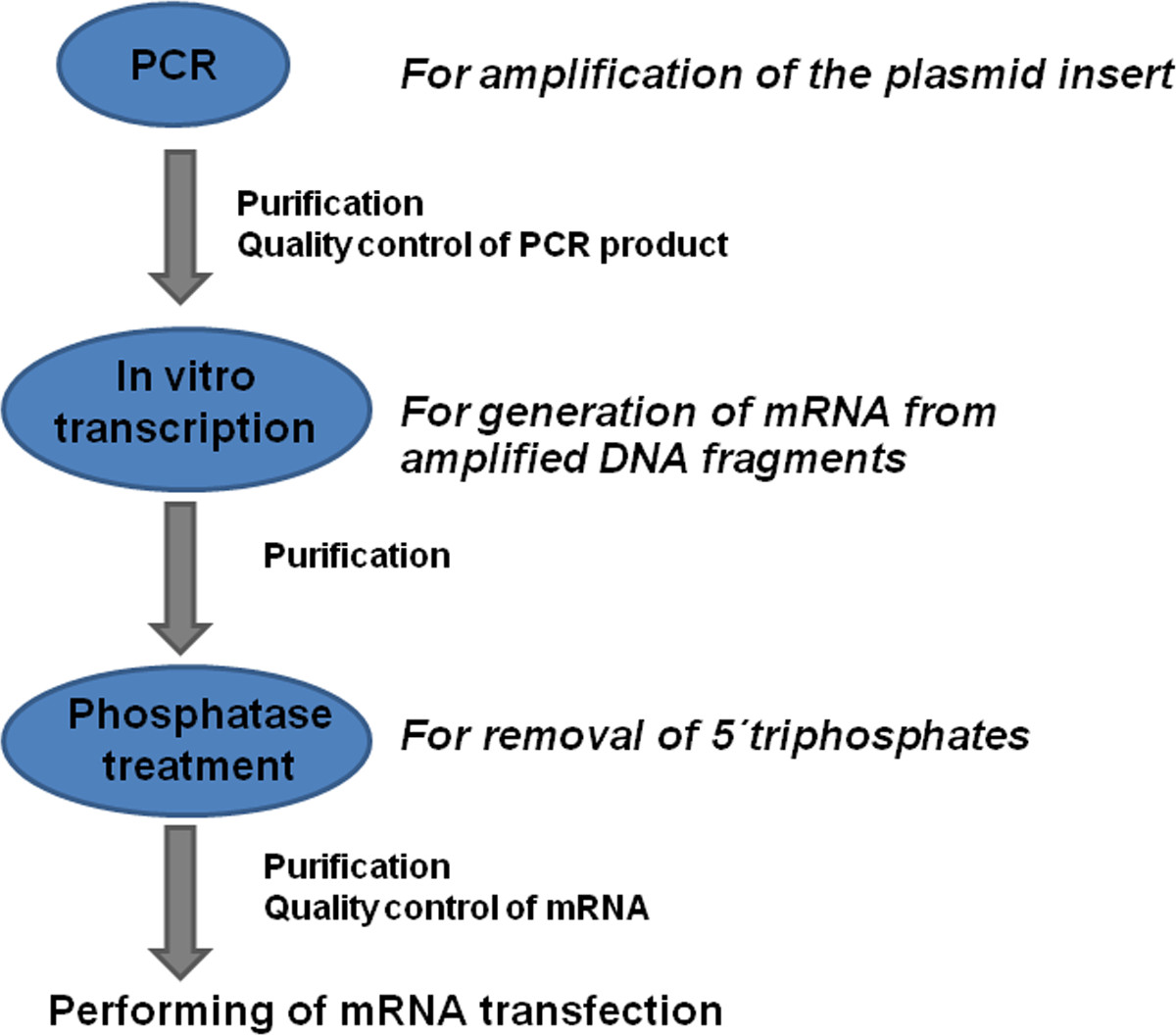
그림 1. 공지 플 랭킹 서열을 가진 mRNA의 변성 제조 공정의 개요 코딩 DNA 서열 (CDS)는 특이 적 프라이머를 사용하여 PCR에 의해 증폭된다. PCR 생성물을 정제하고, 생성 된 DNA의 품질이 결정된다. 이 mRNA를 시험 관내 전사 공정을 사용하여 DNA 생성물로부터 생성된다. 이 제품은 purifie입니다 D와 인산으로 처리가 5'- 트리 포스페이트를 제거합니다. 추가의 정제 및 생성 된 mRNA의 품질 관리 후에 mRNA의 형질 감염을 수행 할 수있다.

그림 2. 후의 PCR DNA 사다리 및 PCR 생성물 DNA 산물의 분석은 1 % 아가 로즈 겔상에서 수행 하였다. 약 1,100 bp의 길이의 명확한 DNA 밴드가 검출되어야한다.

그림 3 :.이 후 eGFP는 mRNA의 1) RNA 사다리와 IVT 제품의 세대에 대한 시험 관내 전사의 속도론) 0 분, 3) 10 분, 4) 30 분, 5) 180 분, 6) 360 분, 7) DNA 템플릿은 혼자 1 % 아가 로스 젤에서 실행되었다.
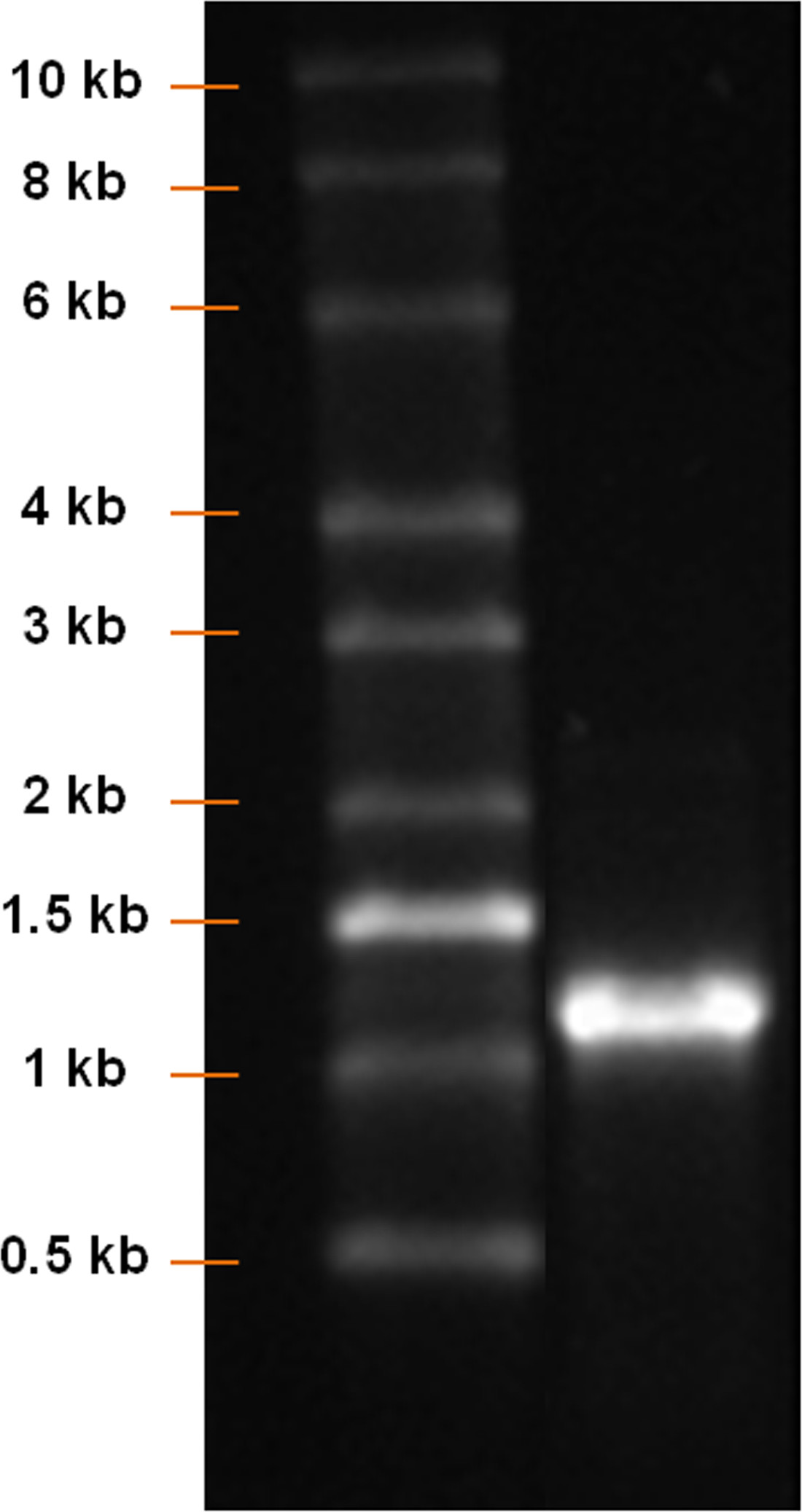
도 4 :. IVT RNA 사다리와 IVT 생성물 후 mRNA의 생성물의 분석은 1 % 아가 로즈 겔상에서 수행 하였다. 약 1,100 bp의 길이의 명확한 mRNA의 밴드가 검출되어야한다.
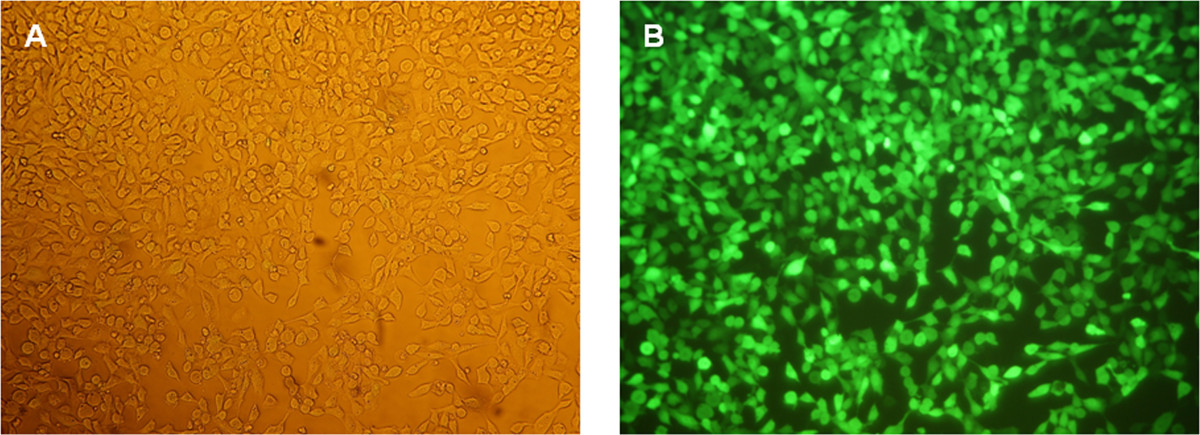
그림 5 : HEK293 세포 eGFP는 mRNA의 형질 전환 후 24 시간의 형광 현미경 분석. 100X의 배율에서의 셀 (A) 상 대비 이미지. (B) 100 배의 배율로 세포의 형광 이미지.
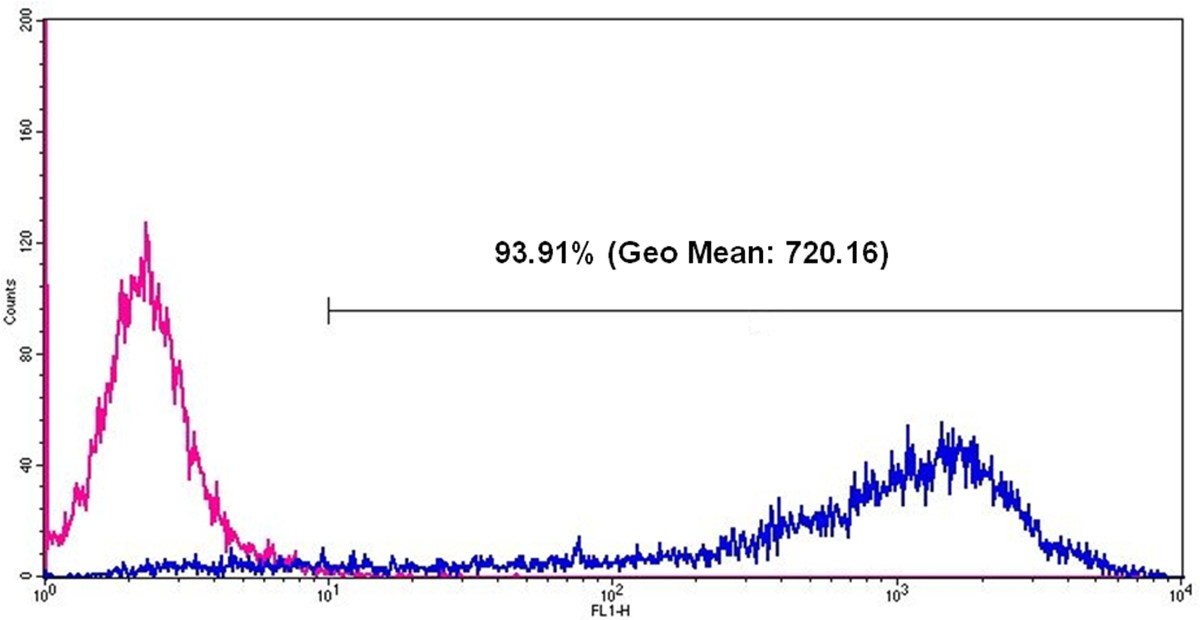
그림6 : 유세포은 eGFP는 mRNA의 형질 전환 후 HEK293 세포에서 eGFP는 식의 24 시간을 분석 핑크 라인은 mRNA의 형질 전환없이 세포를 나타내며, 파란색 선은 eGFP는 mRNA의 형질 전환 후 eGFP는 양성 세포를 나타냅니다.. eGFP는 mRNA의 형질 전환 한 후, 측정 된 모든 세포의 93.91 %가 긍정적이며, 지오 평균 (형광 강도의 기하 평균)은 720.16이다.

도 7 : 유세포 1, 2, 3 일 eGFP는 mRNA의 형질 감염 후 HEK293 세포에서 발현 eGFP는 분석 단백질의 mRNA 발현은 형질 감염 후 최고 24 시간이다.. 그 후, 양이 1.6 배 감소된다 매일 (N = 3).
표 1 : PCR 혼합물의 조성입니다.
| 구성 요소 | 최종 농도 | 양 (μL) |
| 정방향 프라이머 | 0.7 μM | (7) |
| 역방향 프라이머 | 0.7 μM | (7) |
| 5 배 Q-솔루션 | 1X | (20) |
| 5 배 HotStar HiFidelity PCR 버퍼 | 1X | (20) |
| 플라스미드 DNA | 50 NG / 100 ㎕ | 변수 |
| HotStar HiFidelity DNA 중합 효소 (2.5 U / μL) | 2.5 U | 1 |
| 뉴 클레아없는 물 | 변수 | |
| 총 볼륨 | (100) |
표 1 : PCR 혼합물의 조성입니다.
| 사이클 수 | 시간 | 온도 (° C) | |
| 초기 변성 단계 | 1 | 5 분 | 95 |
| 3 단계 사이클링 | 2-25 | ||
| · 변성 | 45 초 | 95 | |
| · 소둔 | 1 분 | (55) | |
| · 확장 | 1 분 | (72) | |
| 최종 확장 단계 | (26) | 10 분 | (72) |
| PCR 사이클의 종료 | 명확하지 않은 | 4 |
표 2 : PCR 사이클링 홍보otocol.
| 구성 요소 | 주식 농도 (MM) | 최종 농도 (mM)을 | 볼륨 (μL) |
| ATP (MEGAscript T7 키트) | (75) | 7.5 | 4 |
| GTP (MEGAscript T7 키트) | (75) | 1.875 | 1 |
| (Trilink에서) 나-CTP | (100) | 7.5 | 3 |
| (Trilink에서) 의사 UTP | (100) | 7.5 | 3 |
| 3'-O-나-M (7) G (5') PPP (5') G의 RNA 캡 구조 아날로그 | (10) | 2.5 | (10) |
| 총 볼륨 | (23) |
표 3 : NTP / 캡 아날로그 혼합물의 조성입니다.
| 구성 요소 | 최종 농도 | 양 (μL) |
| 뉴 클레아없는 물 | 변수 | |
| 의 RNase 억제제 | 40 U | 1 |
| NTP / 캡 아날로그 혼합물 (단계 4.3) | (23) | |
| PCR 산물 | 1 μg의 | 변수 |
| 10 배의 반응 완충액 | 1X | 4 |
| 배 T7 RNA 폴리머 라제 효소 믹스 | 1X | 4 |
| 총 볼륨 | (40) |
표 4 : 시험 관내 전사의 구성 (IVT) 반응 혼합물.
| 구성 요소 | 양 (μL) |
| 포름 아미드 | 3.3 |
| 37 % 포름 알데히드 | 1 |
| MEN 버퍼 (10 배) | 1 |
| (peqGOLD 범위 믹스 DNA 사다리와 함께 제공) 6 배 로딩 버퍼 | 1.7 |
| 총 볼륨 | (7) |
표 5 : RNA 겔 전기 영동 로딩 완충액의 제조.
| 문화 매체와 버퍼 셀 | |
| HEK-293 세포 배양 배지 | FCS의 25 ml의 페니실린 / 스트렙토 마이신의 2.5 ml의 L-GLU의 2.5 ML을 추가220 ml의 DMEM 높은 포도당 tamine. 4 ° C에서 매체를 보관 2 주 이내에 사용하십시오. |
| TBE 버퍼 (10 배) | 0.9 M 트리스 염기, 0.9 M 붕산 및 1 L의 물에 20 mM의 EDTA (Ampuwa)을 녹인다. 버퍼의 pH는 8입니다. |
| MEN 버퍼 (10 배) | 200 MM의 MOPS, 50 mM의의 NaOAc, 1 L의 물에 10 mM의 EDTA (Ampuwa)을 녹인다. 7 NaOH로 pH 값을 조정합니다. |
표 6 : 세포 배양 배지 및 버퍼.
토론
mRNA의 치료는 재생 의학, 질병 및 예방 접종의 치료 분야에서 엄청난 잠재력을 가지고있다. 이 비디오는, 세포에서 단백질 발현의 유도를위한 안정화 된 변형의 mRNA의 생성을 보여준다. 이 프로토콜을 이용하여, 다른 원하는 mRNA를 생성 할 수있다. 변형 된 mRNA를 시험 관내 합성은 표적 단백질의 발현을 유도하는 것이 바람직 mRNA를 함께 세포의 형질 감염을 허용한다. 외생 전달 mRNA를 완전히 분해 될 때까지 이에 의해, 목적 단백질은 생리 학적 조건에서 일시적으로 발현된다.
이 비디오에서는, eGFP는의 발현은 eGFP는 mRNA의와 HEK293 세포의 단일 형질 전환 후 3 일 동안 증명되었다. 다른 단백질을 코딩하는 mRNA의 분자는 짧은 단백질 발현 기간을 초래할 수있다. 단백질의 발현으로 인해 외생 전달의 mRNA의 분해를 감소시킨다. 솜에 대한이 기술의 따라서, 제한전자 응용 프로그램은 단백질 발현의 과도 유도 될 수 있습니다. 따라서, 더 긴 기간 동안 세포 내에서 단백질 발현을 유지하기 위해, mRNA의 반복 전송이 요구된다. mRNA의 형질 삽입 성 돌연변이 유발 및 바이러스 벡터에 비해 암과 백혈병의 발달을 방지 숙주 게놈 내로 비 통합의 장점을 가지고 있지만, 생체 내 형질 감염 효율은 바이러스 벡터를 사용하는 것보다 작을 수있다.
형질 감염 시약 필요한 mRNA의 농도와 양을 누락 된 단백질을 생산하는 mRNA를 외인성 전달을위한 표적 세포는 각각 다른 세포 형 (14)에 대해 최적화되어야한다.
반복 된 동결 및 해동의 mRNA는 mRNA의 생성의 안정성을 유지하기 피해야한다. 따라서, 작업 분취 제조 할 수있다. PCR 및 IVT 후, 단지 단일 특정 대역을 검출한다. 그렇지 않은 경우, PCR 사이클 수, 프라이머 annea링 온도 및 / 또는 플라스미드 DNA의 양은 IVT 위해 특정 DNA 생성물을 얻기 위해 최적화되어야한다. 또한, IVT 시간 및 IVT위한 DNA 템플릿의 양은 충분한 양의 특정 길이의 mRNA를 얻기 위해 최적화 될 수있다.
공개
저자는 그들이 더 경쟁 재정적 이익이 없다는 것을 선언합니다.
감사의 말
이 프로젝트는 바덴 - 뷔 르템 베르크, 독일에 유럽 사회 기금에 의해 투자되었다.
자료
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| DMEM, high glucose | PAA | E15-009 | |
| FBS | Life Technologies | 10500 | |
| Penicillin/Streptomycin | PAA | P11-010 | 100x |
| L-glutamine | PAA | M11-004 | 200 mM |
| DPBS without calcium and magnesium | PAA | E15-002 | |
| 0.04% Trypsin / 0.03% EDTA | Promocell | C-41020 | |
| TNS | Promocell | C-41120 | Trypsin Neutralizing Solution, 0.05% trypsin inhibitor in 0.1% BSA |
| HEK-293 cells | ATCC | CRL-1573 | |
| Consumables | |||
| Tissue culture plates, 12-well | Corning | 3512 | |
| Cell culture flask (75 cm2) | Corning | 430641 | |
| DNase-and RNase-free 1.5 ml sterile microcentrifuge tubes | Eppendorf | 0030 121.589 | Safe-Lock, Biopur |
| 15 ml conical tubes | greiner bio-one | 188271 | |
| PCR clean and sterile epT.I.P.S. dualfilter pipette tips | Eppendorf | 10 µl: 022491202; 100 µl: 022491237; 1,000 µl: 022491253 | |
| Cryovial | greiner bio-one | 122279-128 | Cryo.s |
| 14 ml polypropylene round bottom tube for bacterial culture | BD Falcon | 352059 | |
| Plasmid amplification and purification | |||
| pcDNA 3.3_eGFP Plasmid | Addgene | 26822 | |
| One Shot Top10 chemically component Escherichia coli | Invitrogen | C4040-10 | |
| Sterile water (Ampuwa) | Fresenius Kabi | 1636071 | |
| LB medium (Luria/Miller) | Carl Roth | X968.1 | Dissolve 25 g L-1 in sterile water. |
| LB agar (Luria/Miller) | Carl Roth | X969.1 | Dissolve 40 g L-1 in sterile water. |
| Ampicillin Ready Made Solution | Sigma Aldrich | A5354 | 100 mg/ml |
| Glycerol | Sigma Aldrich | G2025 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| mRNA production | |||
| HotStar HiFidelity Polymerase Kit | Qiagen | 202602 | |
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| MEGAscript T7 Kit | Life Technologies | AM1334 | |
| 5-Methylcytidine-5´-triphosphate | Trilink | N1014 | 5-Methyl-CTP |
| Pseudouridine-5´-triphosphate | Trilink | N1019 | Pseudo-UTP |
| 3´-O-Me-m7G(5´)ppp(5´)G RNA cap structure analog | New England Biolabs | S1411L | |
| RiboLock RNase Inhibitor | Thermo Scientific | EO0381 | 40 U/µl |
| TURBO DNase | Life Technologies | AM1334 | 2 U/µl (from MEGAscript T7 Kit) |
| Antarctic phosphatase | New England Biolabs | MO289S | |
| RNeasy mini kit | Qiagen | 74104 | |
| RNaseZap solution | Life Technologies | AM9780 | |
| Transfection | |||
| Lipofectamine 2000 Transfection Reagent | Invitrogen | 11668-019 | Cationic lipid transfection reagent |
| Opti-MEM I Reduced Serum Media | Invitrogen | 11058-021 | Improved Minimal Essential Medium (MEM) that allows a reduction of Fetal Bovine Serum (FBS) supplementation |
| Gel electrophoresis | |||
| Agarose | Sigma-Aldrich | A9539 | |
| Gelred Nucleic Acid Gel Stain | Biotium | 41003 | 10,000x in water |
| peqGOLD Range Mix DNA-Ladder | Peqlab | 25-2210 | |
| Flow cytometry analyses | |||
| CellFIX (1x) | BD Biosciences | 340181 | 10x concentrate |
| Primer for insert amplification and poly (T) tail PCR | |||
| Forward Primer (HPLC-grade) 10 µM | Ella Biotech | 5´-TTGGACCCTCGTAC AGAAGCTAATACG-3´ | |
| Reverse Primer (HPLC-grade) 10 µM | Ella Biotech | 5´- T120-CTTCCTACT CAGGCTTTATTCAA AGACCA-3´ | |
| Equipment | |||
| Cell incubator | Binder | CO2 (5%) and O2 (20%) | |
| CASY cell counter | Schärfe System | ||
| Sterile workbench | BDK Luft-und Reinraumtecknik GmbH | ||
| Bacterial incubator | Incutec | ||
| Water bath | |||
| ScanDrop spectrophotometer | Analytic Jena | ||
| PCR thermocycler | Eppendorf | ||
| Microcentrifuge | Eppendorf | ||
| Vortex | peqlab | ||
| Thermomixer | Eppendorf | ||
| Gel apparatus for electrophoresis | Bio-Rad | ||
| Gel documentation system | Bio-Rad | ||
| FACScan System | BD Biosciences | ||
| Fluorescence microscope | Nikon | ||
| Phase-contrast microscope | Zeiss | ||
참고문헌
- Bangel-Ruland, N., et al. CFTR-mRNA delivery: a novel alternative for cystic fibrosis "gene therapy". The journal of gene medicine. , (2013).
- Benteyn, D., et al. Design of an Optimized Wilms" Tumor 1 (WT1) mRNA Construct for Enhanced WT1 Expression and Improved Immunogenicity In Vitro and In Vivo. Molecular therapy Nucleic acids. 2, 134(2013).
- Petsch, B., et al. Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection. Nature. 30, 1210-1216 (2012).
- Mandal, P. K., Rossi, D. J. Reprogramming human fibroblasts to pluripotency using modified mRNA. Nature protocols. 8, 568-582 (2013).
- Warren, L., et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell stem cell. 7, 618-630 (2010).
- Yakubov, E., Rechavi, G., Rozenblatt, S., Givol, D. Reprogramming of human fibroblasts to pluripotent stem cells using mRNA of four transcription factors. Biochemical and biophysical research communications. 394, 189-193 (2010).
- Anderson, B. R., et al. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic acids research. 38, 5884-5892 (2010).
- Kariko, K., Buckstein, M., Ni, H., Weissman, D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 23, 165-175 (2005).
- Kariko, K., et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Molecular therapy : the journal of the American Society of Gene Therapy. 16, 1833-1840 (2008).
- Kariko, K., Weissman, D. Naturally occurring nucleoside modifications suppress the immunostimulatory activity of RNA: implication for therapeutic RNA development. Current opinion in drug discovery & development. 10, 523-532 (2007).
- Kormann, M. S., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature biotechnology. 29, 154-157 (2011).
- Hacein-Bey-Abina, S., et al. Insertional oncogenesis in 4 patients after retrovirus-mediated gene therapy of SCID-X1. The Journal of clinical investigation. 118, 3132-3142 (2008).
- Hacein-Bey-Abina, S., et al. Efficacy of gene therapy for X-linked severe combined immunodeficiency. The New England journal of medicine. 363, 355-364 (2010).
- Avci-Adali, M., et al. Optimized conditions for successful transfection of human endothelial cells with in vitro synthesized and modified mRNA for induction of protein expression. Journal of biological engineering. 8, 8(2014).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유