Method Article
In vitro Synthese von modifizierten mRNA zur Induktion der Proteinexpression in menschlichen Zellen
In diesem Artikel
Zusammenfassung
In diesem Video-Artikel beschreiben wir die in vitro Synthese von modifizierten mRNA zur Induktion der Proteinexpression in den Zellen.
Zusammenfassung
Die exogene Lieferung von Codierungs synthetischen Boten-RNA (mRNA) für die Induktion der Proteinsynthese in gewünschten Zellen hat ein enormes Potenzial in den Bereichen der regenerativen Medizin, Grund Zellbiologie, Behandlung von Krankheiten und Reprogrammierung von Zellen. Hier beschreiben wir eine Schritt für Schritt das für die Erzeugung der modifizierten mRNA mit verringerter Immunaktivierungspotential und eine erhöhte Stabilität, die Qualitätskontrolle des hergestellten mRNA, die Transfektion von Zellen mit mRNA und Verifizierung der Protein-Expression induziert durch Durchflusszytometrie. Bis zu 3 Tage nach einer einzigen Transfektion mit eGFP mRNA, die transfizierten HEK293 Zellen produzieren eGFP. In diesem Video-Artikel wird die Synthese von eGFP mRNA als ein Beispiel beschrieben. Jedoch kann das Verfahren für die Herstellung von anderen gewünschten mRNA angewendet werden. Verwendung des synthetischen modifizierten mRNA können Zellen induziert werden, um vorübergehend die gewünschten Proteine, die sie normalerweise nicht ausdrücken würde auszudrücken.
Einleitung
In Zellen, die Transkription von Messenger-RNA (mRNA) und die folgende Übersetzung der mRNA in die gewünschten Proteine zu gewährleisten das reibungslose Funktionieren von Zellen. Angeborene oder erworbene genetische Störungen können zu einer unzureichenden und dysfunktionale Synthese von Proteinen führen und zu schweren Krankheiten. Somit ist ein neuer Therapieansatz, um die Produktion von fehlenden oder defekten Proteine induzieren die exogene Lieferung von synthetischen modifizierten mRNA in Zellen, die für das gewünschte Protein. Dabei werden Zellen ausgelöst, um funktionelle Proteine, die sie normalerweise nicht produzieren oder wäre natürlich nicht nötig zu synthetisieren. Mit diesem Ansatz können genetische Erkrankungen, die durch Einführung von mRNA korrigiert werden, dass die für das defekte oder fehlende protein 1. Die mRNA-Therapie kann auch für die Impfung verwendet werden, um Protein-Antigene, die von Tumorzellen oder Pathogene exprimiert werden, zu synthetisieren sind. Dadurch kann Immunsystem des Wirts aktiviert werden, effektiv zu eliminieren oder zu verhindern, Tumorzellen InFEctions 2,3. Ferner ist in den letzten Jahren mRNA wurde erfolgreich verwendet, um induzierte pluripotente Stammzellen (iPS) zu erzeugen. Zu diesem Zweck wurden Fibroblasten mit mRNAs transfiziert, um induzieren die Expression von Reprogrammierungsfaktoren 4-6 und sie in iPS-Zellen mit einem enormen Potenzial in der regenerativen Medizin zu konvertieren.
Bisher wurde die Verwendung von herkömmlichen mRNA mit niedriger Stabilität und starke Immunogenität assoziiert. So wurden klinische Anwendungen der herkömmlichen mRNAs beschränkt. Aber der Austausch von Cytidin und Uridin durch 5-Methylcytidin und Pseudouridin in der mRNA-Moleküls durch Kariko und Kollegen gerendert mRNA-Molekülen in biologischen Flüssigkeiten stabil und drastisch reduziert Immunaktivierung 7-10, die nun ermöglicht die klinische Anwendbarkeit der modifizierten mRNA.
Verwendung synthetisch hergestellte modifizierte mRNAs können gewünschte Gentranskripten vorübergehend in vivo 11 geliefert werdenoder in vitro, um die Proteinexpression zu induzieren. Die eingeführte mRNA unter physiologischen Bedingungen durch die zelluläre Translationsmaschinerie übersetzt. Aufgrund mangelnder Integration in das Wirtszellgenom Vergleich zu viralen Gentherapie-Vektoren, wird das Risiko einer Onkogenese verhindert 12,13. Somit wird die Therapie mit modifizierten Kunst mRNA besser klinische Akzeptanz in der Zukunft.
Hier beschreiben wir ein detailliertes Protokoll zur Herstellung der modifizierten mRNA (Figur 1), die Transfektion von Zellen mit mRNA und die Bewertung der Protein-Expression in transfizierten Zellen.
Protokoll
1. Augmentation von Plasmiden, die gewünschten Codier- DNA-Sequenzen (CDS)
- Vorwärmen SOC-Medium, das in der Transformationssatz enthalten ist, auf Raumtemperatur, und die LB-Agarplatten, die 100 ug / ml Ampicillin und 37 ° C. Äquilibrieren das Wasserbad auf 42 ° C.
- Tauwetter ein Fläschchen von chemisch Komponente E. coli auf Eis.
- In 1-5 ul der Plasmid (10 pg bis 100 ng), die die CDS in das Fläschchen aus chemisch Komponente E. coli und vorsichtig mischen. Die Zellen nicht mischen durch Pipettieren. Nach der Zugabe von Plasmiden, mischen durch Antippen des Rohres sanft.
- Inkubieren der Mischung auf Eis für 30 min.
- Hitzeschock der E. coli für 30 sec bei 42 ° C in einem Wasserbad ohne Schütteln.
- Stellen Sie die Durchstechflasche auf Eis für 2 min.
- In 250 ul vorgewärmtes SOC-Medium in den E. coli und schüttelt die Bakterien horizontal bei 300 rpm über 1 Stunde bei 37 ° C in einem bakteriellen Inkubator.
- Verbreiten Sie 100 ul und 150 ul von Transformationsansatz auf vorgewärmten LB-Agar-Platten, invertieren die Platten und Inkubation über Nacht bei 37 ° C.
- Nachdem Kolonien sichtbar werden, zu inokulieren eine einzelne Kolonie von jeder Platte in eine 15 ml-Kulturröhrchen mit 5 ml LB-Medium mit 100 ug / ml Ampicillin. Über Nacht inkubieren bei 37 ° C mit Schütteln bei 300 rpm, bis die Kultur in der späten log-Phase oder stationären.
- Für die langfristige Lagerung von transformierten E. coli, Pipette 75 ul 100% Glycerin in die Kryoröhrchen. In 225 ul der Bakterienkultur (gefroren Lager werden 25% Glycerin), gut mischen und speichern die Kryoröhrchen bei -80 ° C.
- Isolierung der Plasmide, die die erforderlichen CDS mit einem Plasmid Purification Kit nach den Anweisungen des Herstellers.
- Bestimmen Sie die Plasmidkonzentration mit einem Spektralphotometer.
- Bereiten Aliquots von 20 ul und im Kühlschrank bei -20 ° C für längere Zeit.
- HINWEIS: Um die DNA-Matrize für die in vitro Transkription (IVT), der CDS von Interesse, hier eGFP wird mittels PCR amplifiziert zu erhalten. Gleichzeitig wird ein Poly-T-Schwanz 120 Thymidin (T) an dem Einsatz unter Verwendung eines Reverse-Primer mit einem T 120 Erweiterung hinzugefügt. Dadurch werden die erzeugten mRNAs erhalten einen Poly-A-Schwanz mit definierter Länge nach dem IVT.
- PCR-Gemisch herzustellen, wie in Tabelle 1 aufgeführt.
- Mischen Sie das Reaktionsgemisch gründlich. HINWEIS: PCR-Produkt kann in 4-5 IVT-Reaktionen verwendet werden. Um die DNA-Matrize für die IVT Menge zu erhöhen, kann Gesamtvolumen des PCR-Gemischs erhöht werden. Mehrere PCR-Röhrchen, die jeweils 100 & mgr; l PCR-Gemisch verwendet werden, um eine ausreichende Ausbeute an PCR-Produkt zu erhalten.
- Legen Sie die PCR-Röhrchen in einem Thermocycler und führen Sie die PCR unter Verwendung des PCR-Zyklusprotokoll (Tabelle 2).
- Bereinigen Sie die PCR-Reaktion unter Verwendung eines PCR-Reinigungs-Kit nach Herstellerangaben isoliert und eluiert die DNA unter Verwendung von 20 & mgr; l Nuklease-freies Wasser.
- Messen der Konzentration der DNA unter Verwendung eines Spektrophotometers. HINWEIS: Die DNA-Konzentration nachgewiesen ist ungefähr 300 & mgr; g / ml. Daher sollte die erwartete Gesamtmenge ~ 6 & mgr; g. Die Menge an DNA für andere Proteine können in Abhängigkeit von der Länge der CDS unterscheiden, die Menge an Plasmid für die PCR, Annealingtemperatur von Primern und Zykluszahl verwendet.
- Frieren Sie die DNA bei -20 ° C für eine lange Zeit oder verwenden Sie es direkt für IVT.
3. Kontroll Schritt: Qualität der PCR Produkt
- Überprüfen Sie die Qualität des PCR-Produkts durch DNA-Gelelektrophorese.
- Mischen Sie die gewünschte Menge an Agarose mit 1x TBE in einem Kolben. Für eine 1% Agarosegel mit 0,5 g Agarose in 50 ml 1x TBE.
- Mikrowellen, bis die Agarose aufgelöst. Lassen Sie es nicht zu kochen. Sicherzustellen, dass die Agarose vollständig in Lösung.
- In 5 ul Nukleinsäure Gel Fleck auf 50 ml Agarose-Gel.
- Gießen Sie das Gel in einem Agarose-Gel-Box, stellen Sie den Kamm, und warten Sie etwa 1 Stunde, bis das Gel verfestigt.
- Nehmen Sie den Kamm und platzieren Sie das Gel Box in einem Gelträger.
- Mix 2 ul (200 ng) 80-10,000 bp DNA-Leiter und 200 ng PCR-Produkt mit jeweils 2 & mgr; l Ladepuffer 6x in einem Gesamtvolumen von 12 ul.
- DNA-Proben vorsichtig in die Vertiefungen des Agarosegels geladen.
- Mit 1x TBE als Laufpuffer, führen Sie das Agarose-Gel bei 100 V für 1 Stunde.
- Visualisierung der DNA-Banden auf einem Abbildungssystem (2).
4. In vitro-Transkription (IVT)
- HINWEIS: Nach der PCR wurde die Plasmid-Inserts verstärkt und ein Poly-T-Schwanz angefügt. Während der IVT wird genetische Information von der DNA zur RNA transkribiert. Die erzeugte mRNA-Transkript wird verwendet, um Proteine in Zellen zu erzeugen.
- Reinigen Sie die Arbeitsfläche und Pipetten mit einem RNase decontamination Lösung. Verwenden PCR clean und steril Dual-Filterpipettenspitzen und häufig Handschuhe wechseln, um eine Kontamination zu minimieren Reaktionsmischungen mit RNasen.
- Bereiten Sie die NTP / cap analoge Mischung, wie in Tabelle 3 beschrieben.
- Mischen Sie die NTP / cap analoge Mischung gründlich durch Vortexen und kurz abzentrifugieren.
- Montieren Sie das IVT Reaktionsgemisch wie in Tabelle 4 beschrieben.
- Mischen Sie das IVT Reaktionsgemisch gründlich durch sanftes Auf- und Abpipettieren. Anschließend zentrifugieren Sie das PCR-Röhrchen kurz, um das Gemisch am Boden des Röhrchens zu sammeln.
- Inkubieren bei 37 ° C für 3 Stunden in einem Thermomixer.
HINWEIS: Die optimale Inkubationszeit hängt von der Länge der Einsätze und transkriptionale Effizienz der gegebenen Vorlage. Für kurze Einsätze (<500 nt), kann eine längere Inkubationszeit von Vorteil sein. Ein Zeitverlaufsexperiment durchgeführt, um die optimale Inkubationszeit für maximale Ausbeute zu bestimmen. Daher up IVT Reaktionen gesetzt, für example für 1, 2, 3, 4, 6 h und Inkubation über Nacht und bestimmen die mRNA Menge. Die Kinetik der in vitro-Transkription zur Erzeugung von eGFP mRNA ist in Abbildung 3 dargestellt. - Um die Vorlage DNA zu entfernen, fügen 1 ul DNase (2 U / ul) an die IVT Reaktionsgemisch, gut mischen und Inkubation 15 min bei 37 ° C.
- Reinige das Reaktionsgemisch mit Hilfe eines RNA Purification Kit gemäß Herstellerangaben. Eluieren die modifizierte mRNA aus dem Spin-Säule Membran zweimal mit 40 ul Nuklease-freies Wasser. HINWEIS: Die RNA-Konzentration nachgewiesen ist etwa 1500 & mgr; g / ml. Daher sollte die erwartete Gesamtmenge ~ 120 & mgr; g. Die Menge des synthetisierten mRNA für andere Proteine können in Abhängigkeit von der Länge der CDS und der Menge des PCR-Produkts für die IVT unterscheiden.
5. Behandlung von gereinigten mRNA mit Antarctic Phosphatase
- HINWEIS: Der generierte mRNA wird mit Phosphatase behandelt, um 5 entfernen 'triPhosphate, die von RIG-I, um die Immunaktivierung erkannt und führen kann. Ferner verhindert die Phosphatase-Behandlung Wieder Zirkularisierung selbstLigaTionsReaktion.
- In 9 ul 10x Antarctic Phosphatase Reaktionspuffer auf 79 ul gereinigte mRNA-Lösung. Anschließend fügen Sie 2 ul Antarctic Phosphatase (5 U / ul) und vorsichtig mischen die Probe. Inkubieren der Reaktionsmischung bei 37 ° C für 30 min.
- Reinige das Reaktionsgemisch mit Hilfe eines RNA Purification Kit gemäß Herstellerangaben. Eluieren die modifizierte mRNA aus der Spinsäule Membran zweimal mit 50 & mgr; l Nuklease-freies Wasser.
- Messung der Konzentration der modifizierten mRNA unter Verwendung eines Spektrophotometers. Überprüfen Sie, ob das Verhältnis der Absorption bei 260 nm / 280 nm (A 260 / A 280) ist ≥ 1,8 und das Verhältnis von A 260 / A 230 ist 2,0, was Reinheit zeigt.
HINWEIS: Die erwartete Gesamtrendite sollte etwa 90 ug werden, was sufficie istnt für ca. 36 mRNA Transfektionen. - Stellen Sie die Konzentration der mRNA bis 100 ng / ul durch Zugabe von Nuklease-freies Wasser.
- Aliquot der modifizierten mRNA in Einweg Aliquots für Transfektionen und bei -80 ° C erforderlich. Vermeiden Sie mehrfaches Einfrieren und Auftauen. Richtig zubereitet und gelagert mRNA ist seit vielen Jahren stabil. Während der Arbeitszeit, immer das modifizierte mRNA auf Eis.
6. Steuer Schritt: Qualität synthetisierter Modifizierte mRNA
- Überprüfen Sie die Qualität der modifizierten mRNA durch RNA-Gelelektrophorese.
- Mischen Sie die gewünschte Menge an Agarose mit 1x TBE in einem Kolben. Für eine 1% Agarosegel mit 0,5 g Agarose in 50 ml 1x TBE.
- Mikrowellen, bis die Agarose aufgelöst. Lassen Sie es nicht zu kochen. Sicherzustellen, dass die Agarose vollständig in Lösung.
- In 5 ul Nukleinsäure Gel Fleck auf 50 ml Agarose-Gel.
- Gießen Sie das Gel in ein Agarose-Gel-Box, stellen Sie den Kamm, und warten Sie etwa 1 Stunde, bis das Gel solidified.
- Nehmen Sie den Kamm und platzieren Sie das Gel Box in einem Gelträger.
- Mix 3 & mgr; l (3 & mgr; g) von 0,5-10 kb RNA-Leiter und 200 ng der synthetisierten modifizierten mRNA mit jeweils 7 & mgr; l Ladepuffer in einem Gesamtvolumen von 10 ul. Die Zusammensetzung des Ladepuffers ist in Tabelle 5 beschrieben.
- Denaturieren der Leiter und die mRNA-Proben bei 70 ° C für 10 min.
- Die Leiter und die mRNA-Proben auf dem 1% Agarosegel sorgfältig zu laden.
- Führen Elektrophorese bei 100 V für 1 h mit 1x TBE als Laufpuffer.
- Visualisieren Sie die Leiter und mRNA-Banden auf einem UV-Transilluminator und fotografieren mit einem Geldokumentationssystem (Abbildung 4).
7. Vorbereitung der Zellen für die Transfektion
- Platte 2 x10 5 Zellen (HEK293-Zellen) pro Vertiefung der Platte mit 12 Vertiefungen.
- Die Zellen bei 37 ° C über Nacht inkubieren in einem Zellinkubator. HINWEIS: Am Tag der Transfektion wurden die Zellen sollten reac habenhed 80-90% Konfluenz.
8. Durchführen von mRNA Transfektion von Zellen
- Auftauen modifizierten mRNA.
- Generieren Sie die Lipoplexe für die Transfektion.
- Hinzufügen von 25 ul (2,5 ug) der modifizierten mRNA und 2 & mgr; l kationisches Lipid Transfektionsreagenz bis 473 & mgr; l Opti-MEM (Minimal Essential Medium) I Serummedium, das Transfektionsgemisch zur Transfektion eine Vertiefung einer 12-Well-Platte zu erzeugen, reduziert. Scale up die Volumina entsprechend der Anzahl von Brunnen zu transfizierenden. Als negative Kontrolle, bereiten eine Transfektion Gemisch ohne mRNA.
- Mischen Sie die Komponenten vorsichtig durch Pipettieren. Inkubieren der Transfektion Mischung bei Raumtemperatur für 20 min bis Lipoplexe zur Transfektion zu erzeugen.
HINWEIS: Die Transfektion Mischung enthält keine Antibiotika. So kümmern sich um die Sterilität zu gewährleisten, während der Handhabung Zellen. - Wash-Zellen mit 500 ul DPBS / well.
- Gib 500 ul Transfektionsgemisch in eine Vertiefung einer 12-Well-plate.
- Inkubieren der Zellen für 4 Stunden bei 37 ° C und 5% CO 2.
- Saugen Sie das Transfektionsmischung und 1 ml komplettes Zellkulturmedium zu den Zellen.
- Inkubieren der Zellen für 24 h in der Zelle Inkubator.
- Zuführen fluoreszenzmikroskopische Analyse mit einem Fluoreszenzmikroskop (Abbildung 5). ANMERKUNG: Um die Expression von anderen Proteinen in Zellen, die durch Transfektion mit anderen mRNA als eGFP kodierende mRNA hergestellt werden untersuchen, können die Zellen auf Deckgläsern gezüchtet werden. Dann wird die Transfektion durchgeführt werden kann und die Zellen können mit geeigneten Antikörpern gefärbt und durch Fluoreszenzmikroskopie analysiert.
9. Durchflusszytometrische Analysen der eGFP-Expression in Zellen
- Entfernen Zellkulturmedium aus den Vertiefungen und Waschen jeder Vertiefung mit 1 ml DPBS (ohne Calcium und Magnesium). Gib 500 & mgr; l Trypsin / EDTA pro Vertiefung, um die Zellen von der Oberfläche der Zellkulturplatten zu lösen. Anschließend fügen Sie 500ul TNS pro Well Trypsin inaktivieren.
- Zentrifugieren der abgelösten Zellen 5 min bei 300 × g bei Raumtemperatur. Entfernen Sie den Überstand so dass nur die Pellets. Zellpellet in 150 ul Zellfixierungslösung und übertragen Sie die Zellsuspension in eine Durchflusszytometrie Röhre.
- Analyse des Prozentsatzes der eGFP-exprimierenden Zellen und die Fluoreszenzintensität unter Verwendung von Geo Mittelwert (geometrischer Mittelwert der Fluoreszenzintensität) (Figur 6).
10. Die Messung der Proteinexpression im Laufe der Zeit
- Zuführen mRNA-Transfektion von Zellen in 3 Vertiefungen einer Platte mit 12 Vertiefungen, wie in Schritt 8 beschrieben Zusätzlich inkubieren 3 Vertiefungen von HEK293-Zellen mit dem Transfektionsgemisch ohne Zugabe von mRNA.
- Messen der Expression des eGFP 1, 2 und 3 Tage nach der Transfektion, die Dauer der Protein-Expression (Figur 7) zu bewerten.
Ergebnisse
Mit einem pcDNA 3.3 Plasmid, das die CDS der eGFP wurde die Synthese von modifizierten eGFP mRNA hergestellt (Abbildung 1). Nach Einsatz von PCR-Amplifikation und Poly-T-Tailing ist eine klare Bande mit einer Länge von etwa 1.100 bp nachgewiesen (Abbildung 2). Erhöhen der IVT Zeit verstärkte die Ausbeute an mRNA (Figur 3). Nach der IVT wurde ein klares mRNA-Bande mit einer Länge von etwa 1.100 bp nachgewiesen, die auf die Länge des eGFP mRNA produziert werden (Figur 4) entspricht.
Die Funktionalität der erzeugten eGFP mRNA wurde durch Transfektion von HEK293-Zellen getestet. Zu diesem Zweck wurden die Transfektion Komplexe (Lipoplexe) unter Verwendung eines kationischen Lipids Transfektionsreagenz erzeugt. Die Transfektion wurde mit 2 x 10 5 Zellen pro Vertiefung von 12-Well-Platte durchgeführt. Die Herstellung von eGFP in den Zellen nachgewiesen, 24 Stunden nach der Transfektion mittels Fluoreszenzmikroskopie (FiguWieder 5) und Durchflusszytometrie (Abbildung 6).
HEK293-Zellen wurden mit eGFP mRNA transfiziert. eGFP-Expression wurde 1, 2 und 3 Tage nach der Transfektion, die Dauer der Protein-Expression in den Zellen zu bewerten (Figur 7) bestimmt. Nach 24 h wurde die Protein-Expression am höchsten in den Zellen. Der Betrag wurde reduziert 1,6-fach jeden nächsten Tag. Selbst nach 3 Tagen enthielten die Zellen eGFP.
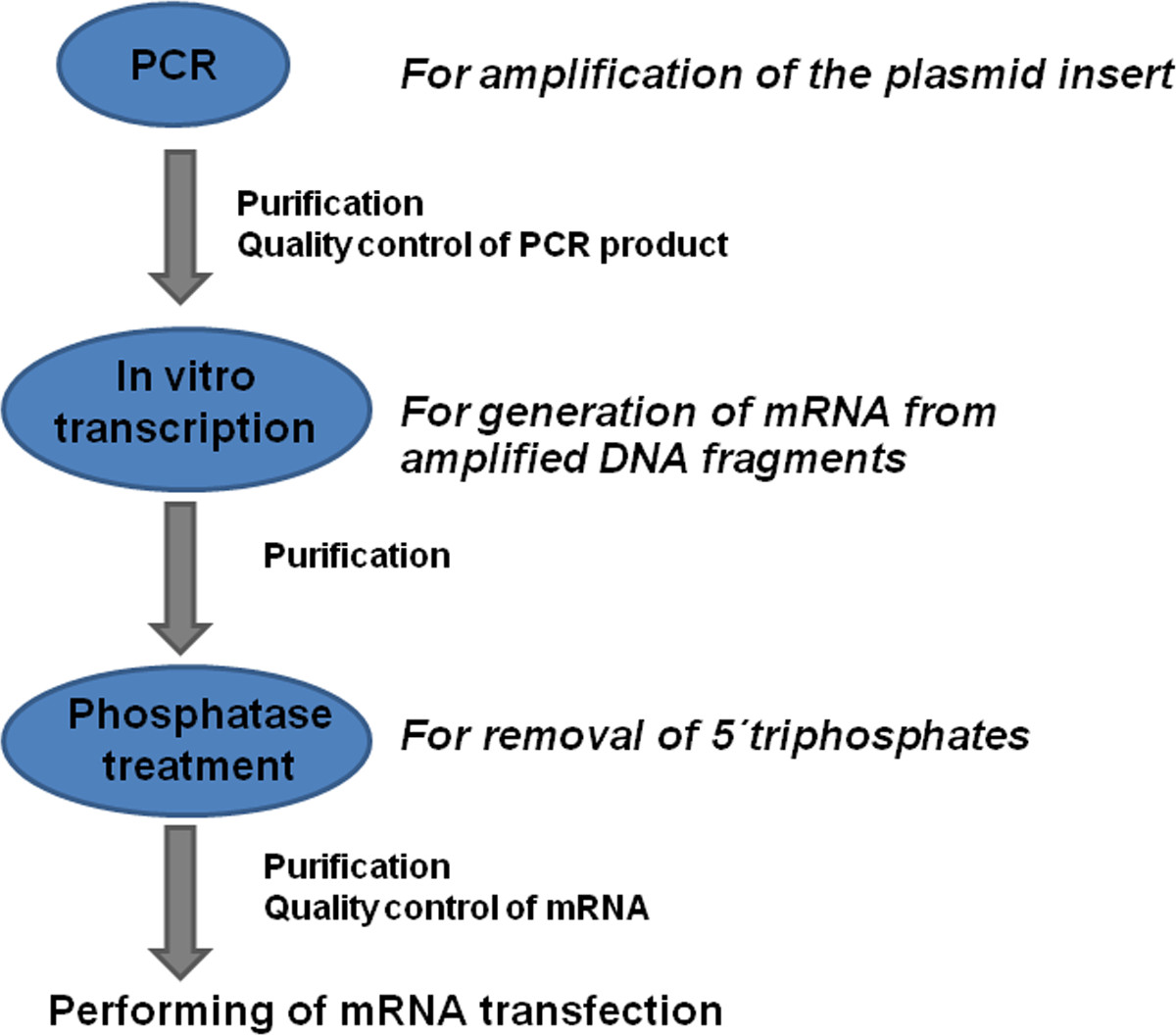
Fig. 1: Übersicht der modifizierten mRNA Produktionsprozess Coding DNA-Sequenzen (CDS) mit bekannten flankierenden Sequenzen werden durch PCR unter Verwendung spezifischer Primer. Das PCR-Produkt wird gereinigt, und die Qualität der erzeugten DNA bestimmt. Die mRNA aus DNA-Produkt unter Verwendung des in vitro Transkriptionsverfahren erzeugt. Das Produkt ist purifie d und mit Phosphatase behandelt, um 5'-Triphosphate zu entfernen. Nach der zusätzlichen Reinigung und Qualitätskontrolle der erzeugten mRNA kann die mRNA Transfektionen durchgeführt werden.

Fig. 2: Analyse der DNA-Produkt nach der PCR-DNA-Leiter und PCR-Produktes wurden auf einem 1% Agarose-Gel laufen gelassen. Eine klare DNA-Bande mit einer Länge von etwa 1.100 bp festgestellt werden sollte.

Fig. 3: Kinetik der in vitro-Transkription zur Erzeugung von eGFP mRNA 1) RNA-Leiter und IVT Produkte nach 2) 0 min, 3) 10 min, 4), 30 min, 5) 180 min, 6) 360 min und 7) DNA-Matrize allein wurden auf einem 1% Agarose-Gel laufen gelassen.
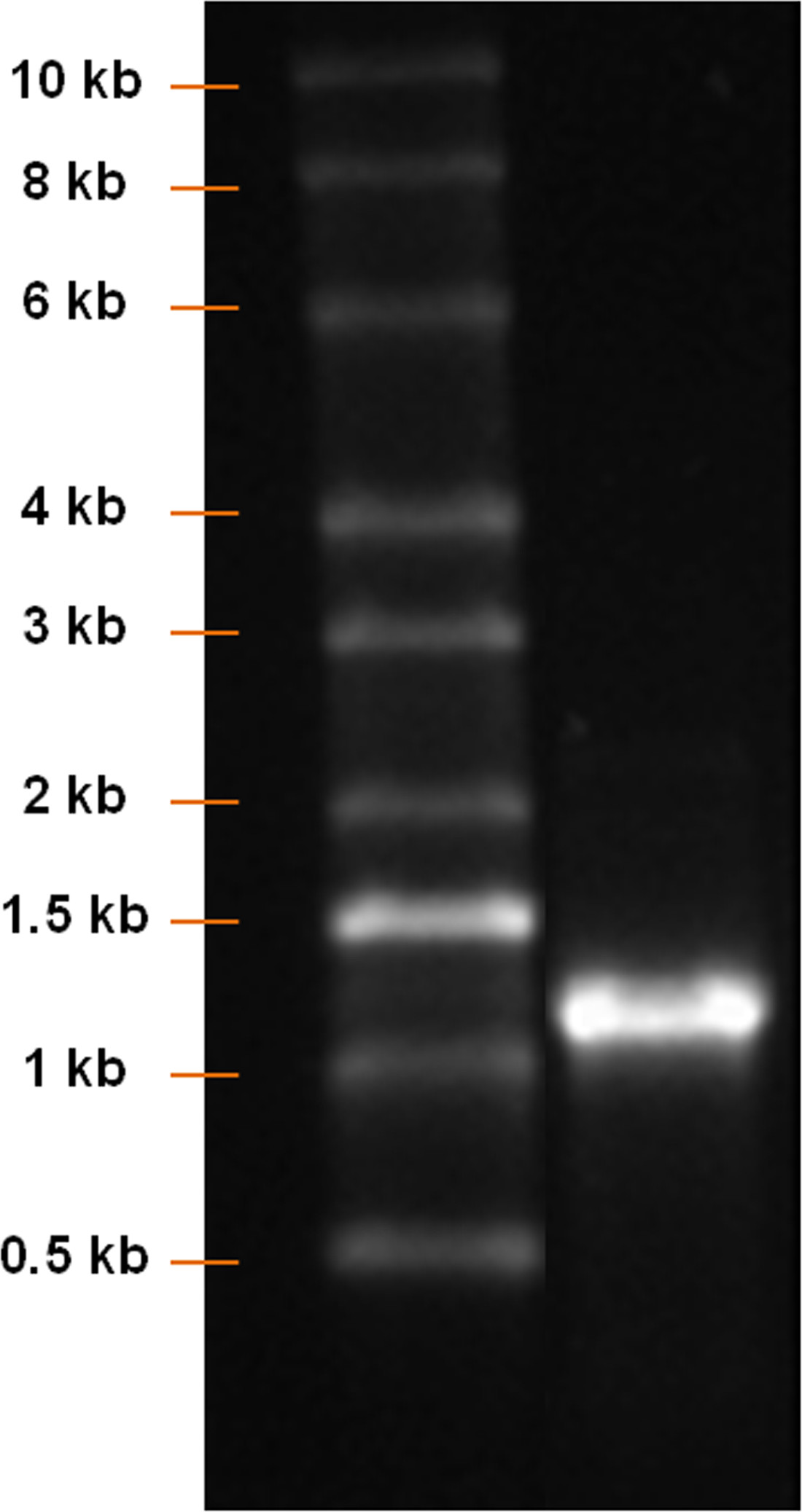
Fig. 4: Analyse der mRNA-Produkt nach IVT-RNA-Leiter und IVT Produktes wurden auf einem 1% Agarose-Gel laufen gelassen. Eine klare mRNA-Bande mit einer Länge von etwa 1.100 bp festgestellt werden sollte.
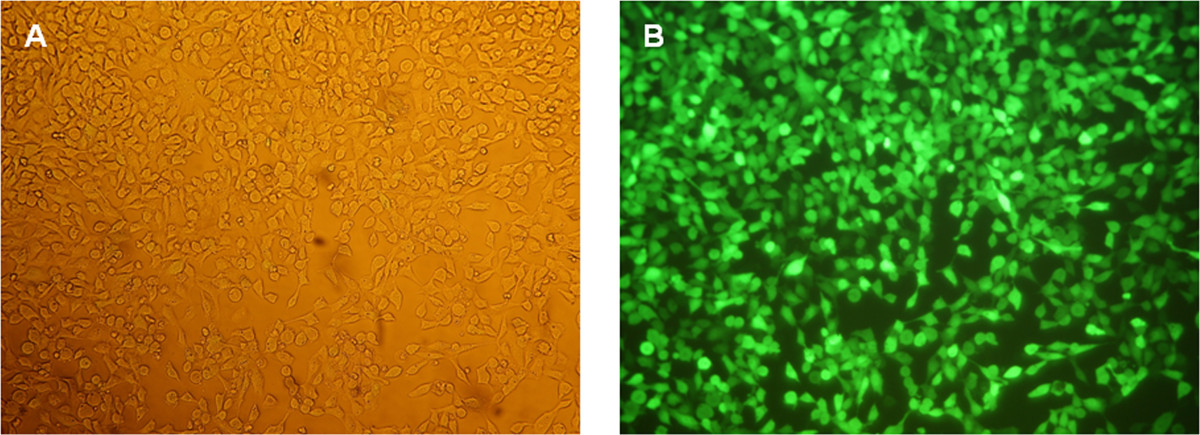
Abbildung 5: Fluoreszenzmikroskopische Analyse von HEK293-Zellen 24 Stunden nach der eGFP mRNA Transfektion. (A) Phasenkontrastbild der Zellen bei einer Vergrßerung von 100X. (B) Fluoreszenzbilder der Zellen bei einer Vergrßerung von 100X.
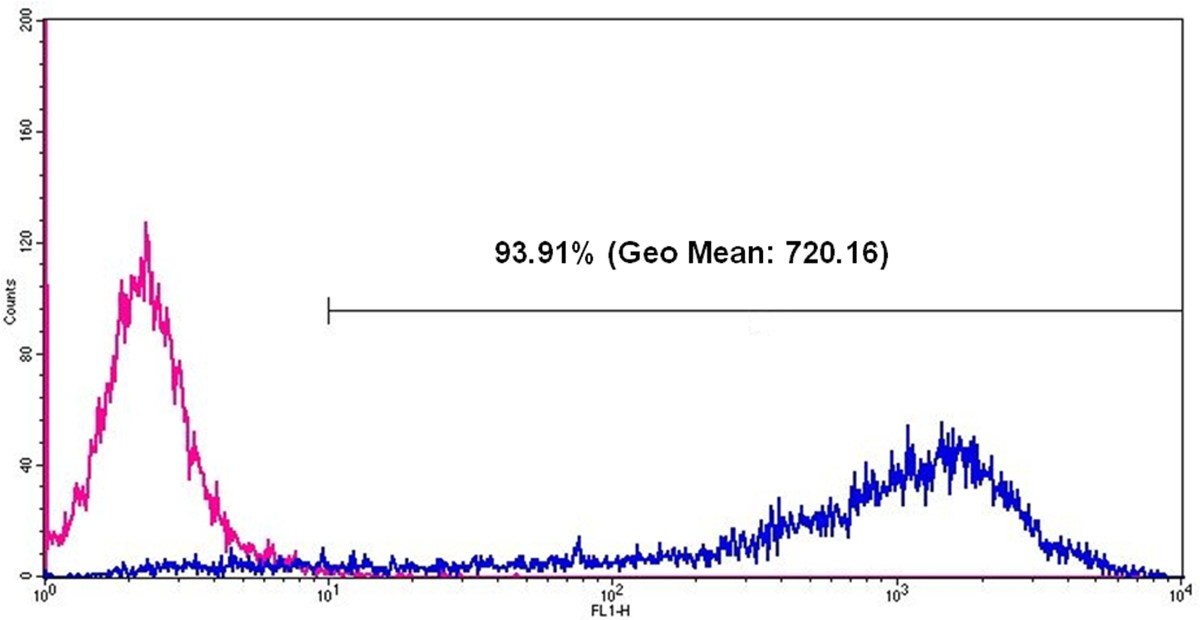
Abbildung6: Durchflusszytometrische Analysen der eGFP-Expression in HEK293-Zellen 24 Stunden nach der eGFP mRNA Transfektion Die rosa Linie stellt Zellen ohne mRNA Transfektion und die blaue Linie nach eGFP mRNA Transfektion stellt eGFP positiven Zellen.. Nach eGFP mRNA-Transfektion, 93,91% aller gemessenen Zellen sind positiv und die Geo Mittelwert (geometrischer Mittelwert der Fluoreszenzintensität) ist 720,16.

Abbildung 7: Die durchflusszytometrische Analysen der eGFP-Expression in HEK293-Zellen 1, 2 und 3 Tage nach der Transfektion wurden die eGFP mRNA-Protein-Expression am höchsten ist 24 h nach der Transfektion mRNA.. Danach wird der Betrag vermindert 1,6fache täglich (n = 3).
Tabelle 1: Zusammensetzung des PCR-Ansatzes.
| Komponente | Endkonzentration | Betrag (ul) |
| Forward Primer | 0,7 & mgr; M | 7 |
| Reverse Primer | 0,7 & mgr; M | 7 |
| 5x Q-Lösung | 1x | 20 |
| 5x HotStar Hifidelity PCR Buffer | 1x | 20 |
| Plasmid DNA | 50 ng / 100 ul | Variable |
| HotStar Hifidelity DNA Polymerase (2,5 U / ul) | 2,5 U | 1 |
| Nuklease-freies Wasser | Variable | |
| Gesamtvolumen | 100 |
Tabelle 1: Zusammensetzung des PCR-Ansatzes.
| Zykluszahl | Zeit | Temperatur (° C) | |
| Anfänglichen Denaturierungsschritt | 1 | 5 min | 95 |
| 3-Stufen-Radsport | 2-25 | ||
| · Denaturierung | 45 sec | 95 | |
| · Glühen | 1 min | 55 | |
| · Erweiterung | 1 min | 72 | |
| Schlussverlängerungsschritt | 26 | 10 min | 72 |
| Ende PCR-Zyklen | Unbestimmt | 4 |
Tabelle 2: PCR-Zyklus protocol.
| Komponente | Auf Konzentration (mM) | Endkonzentration (mM) | Volumen (ul) |
| ATP (von Megascript T7 Kit) | 75 | 7,5 | 4 |
| GTP (von Megascript T7 Kit) | 75 | 1,875 | 1 |
| Me-CTP (von Trilink) | 100 | 7,5 | 3 |
| Pseudo-UTP (von Trilink) | 100 | 7,5 | 3 |
| 3'-O-Me-m 7 G (5') ppp (5') G RNA-Cap-Struktur analog | 10 | 2,5 | 10 |
| Gesamtvolumen | 23 |
Tabelle 3: Zusammensetzung des NTP / cap analoge Mischung.
| Komponente | Endkonzentration | Betrag (ul) |
| Nuklease-freies Wasser | Variable | |
| RNase Inhibitor | 40 U | 1 |
| NTP / cap analoge Mischung (aus Schritt 4.3) | 23 | |
| PCR-Produkt | 1 & mgr; | Variable |
| 10x Reaktionspuffer | 1x | 4 |
| 10x T7 RNA-Polymerase-Enzym-Mix | 1x | 4 |
| Gesamtvolumen | 40 |
Tabelle 4: Zusammensetzung der in vitro-Transkription (IVT) Reaktionsgemisch.
| Komponente | Betrag (ul) |
| Formamid | 3.3 |
| 37% Formaldehyd | 1 |
| MEN Puffer (10x) | 1 |
| 6x Ladepuffer (mit dem peqGOLD Bereich Mix DNA-Ladder im Lieferumfang enthalten) | 1,7 |
| Gesamtvolumen | 7 |
Tabelle 5: Herstellung von Beladungspuffer für die RNA-Gel-Elektrophorese.
| Zellkulturmedium und Puffer | |
| HEK-293-Zellkulturmedium, | 25 ml FCS, 2,5 ml Penicillin / Streptomycin, 2,5 ml L-GluTamine in 220 ml DMEM High Glucose. Bewahren Sie das Medium bei 4 ° C und verwenden Sie es innerhalb von 2 Wochen. |
| TBE-Puffer (10x) | Man löst 0,9 M Tris-Base, 0,9 M Borsäure und 20 mM EDTA in 1 L Wasser (Ampuwa). Der pH-Wert des Puffers 8 ist. |
| MEN Puffer (10x) | Auflösen 200 mM MOPS, 50 mM NaOAc, 10 mM EDTA in 1 l Wasser (Ampuwa). Stellen Sie den pH-Wert mit NaOH auf 7. |
Tabelle 6: Zellkulturmedium und Puffer.
Diskussion
Die mRNA-Therapie hat ein enormes Potenzial im Bereich der regenerativen Medizin, Behandlung von Krankheiten und Impfungen. In diesem Video zeigen wir die Herstellung einer stabilisierten, modifizierten mRNA zur Induktion der Proteinexpression in den Zellen. Unter Verwendung dieses Protokolls kann andere gewünschte mRNA erzeugt werden. Die in vitro Synthese von modifizierten mRNA erlaubt die Transfektion von Zellen mit der gewünschten mRNA die Expression von Zielproteinen zu induzieren. Dadurch wird das gewünschte Protein transient unter physiologischen Bedingungen exprimiert, bis die exogen zuge mRNA vollständig abgebaut.
In diesem Video wurde die Expression von eGFP für 3 Tage nach einer einzigen Transfektion von HEK293-Zellen mit eGFP mRNA nachgewiesen. mRNA-Moleküle kodierenden andere Proteine könnte zu einer kürzeren Proteinexpressionszeit führen. Die Expression des Proteins verringert aufgrund einer Verschlechterung des exogen zuge mRNA. Daher kann die Einschränkung dieser Technik zum some Anwendungen könnte der vorübergehende Induktion der Proteinexpression ist. So, um die Proteinexpression in den Zellen über einen längeren Zeitraum aufrecht zu erhalten, wiederholt Lieferung von mRNA notwendig. Obwohl mRNA-Transfektion hat den Vorteil, nicht-Integration in das Wirtsgenom, die Insertions-Mutagenese und die Entwicklung von Krebs und Leukämie im Vergleich zu viralen Vektoren verhindert, konnte die in vivo Transfektionseffizienz weniger als mit viralen Vektoren sein.
Die erforderliche mRNA Konzentration und Menge des Transfektionsreagenz sollte für jeden anderen Zelltyp 14, der die Zielzellen für die Abgabe von exogenen mRNA, um die fehlenden Proteins produzieren optimiert werden.
Wiederholtes Einfrieren und Auftauen der mRNA sollte vermieden werden, um die Stabilität der erzeugten mRNA erhalten. Daher kann Arbeits Aliquots hergestellt werden. Nach PCR und IVT, sollte nur eine einzige spezifische Bande nachgewiesen werden. Andernfalls wird die Anzahl von PCR-Zyklen Primer Annealing Temperatur und / oder der Menge von Plasmid-DNA sollte optimiert werden, um die spezifische DNA-Produkt für IVT erhalten. Weiterhin kann das IVT Zeit und die Menge an DNA-Templat für die IVT optimiert werden, um mRNA aus einer bestimmten Länge in ausreichenden Mengen zu erhalten.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen.
Danksagungen
Dieses Projekt wurde von dem Europäischen Sozialfonds in Baden-Württemberg, Deutschland finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Cell culture | |||
| DMEM, high glucose | PAA | E15-009 | |
| FBS | Life Technologies | 10500 | |
| Penicillin/Streptomycin | PAA | P11-010 | 100x |
| L-glutamine | PAA | M11-004 | 200 mM |
| DPBS without calcium and magnesium | PAA | E15-002 | |
| 0.04% Trypsin / 0.03% EDTA | Promocell | C-41020 | |
| TNS | Promocell | C-41120 | Trypsin Neutralizing Solution, 0.05% trypsin inhibitor in 0.1% BSA |
| HEK-293 cells | ATCC | CRL-1573 | |
| Consumables | |||
| Tissue culture plates, 12-well | Corning | 3512 | |
| Cell culture flask (75 cm2) | Corning | 430641 | |
| DNase-and RNase-free 1.5 ml sterile microcentrifuge tubes | Eppendorf | 0030 121.589 | Safe-Lock, Biopur |
| 15 ml conical tubes | greiner bio-one | 188271 | |
| PCR clean and sterile epT.I.P.S. dualfilter pipette tips | Eppendorf | 10 µl: 022491202; 100 µl: 022491237; 1,000 µl: 022491253 | |
| Cryovial | greiner bio-one | 122279-128 | Cryo.s |
| 14 ml polypropylene round bottom tube for bacterial culture | BD Falcon | 352059 | |
| Plasmid amplification and purification | |||
| pcDNA 3.3_eGFP Plasmid | Addgene | 26822 | |
| One Shot Top10 chemically component Escherichia coli | Invitrogen | C4040-10 | |
| Sterile water (Ampuwa) | Fresenius Kabi | 1636071 | |
| LB medium (Luria/Miller) | Carl Roth | X968.1 | Dissolve 25 g L-1 in sterile water. |
| LB agar (Luria/Miller) | Carl Roth | X969.1 | Dissolve 40 g L-1 in sterile water. |
| Ampicillin Ready Made Solution | Sigma Aldrich | A5354 | 100 mg/ml |
| Glycerol | Sigma Aldrich | G2025 | |
| QIAprep Spin Miniprep Kit | Qiagen | 27104 | |
| mRNA production | |||
| HotStar HiFidelity Polymerase Kit | Qiagen | 202602 | |
| QIAquick PCR Purification Kit | Qiagen | 28106 | |
| MEGAscript T7 Kit | Life Technologies | AM1334 | |
| 5-Methylcytidine-5´-triphosphate | Trilink | N1014 | 5-Methyl-CTP |
| Pseudouridine-5´-triphosphate | Trilink | N1019 | Pseudo-UTP |
| 3´-O-Me-m7G(5´)ppp(5´)G RNA cap structure analog | New England Biolabs | S1411L | |
| RiboLock RNase Inhibitor | Thermo Scientific | EO0381 | 40 U/µl |
| TURBO DNase | Life Technologies | AM1334 | 2 U/µl (from MEGAscript T7 Kit) |
| Antarctic phosphatase | New England Biolabs | MO289S | |
| RNeasy mini kit | Qiagen | 74104 | |
| RNaseZap solution | Life Technologies | AM9780 | |
| Transfection | |||
| Lipofectamine 2000 Transfection Reagent | Invitrogen | 11668-019 | Cationic lipid transfection reagent |
| Opti-MEM I Reduced Serum Media | Invitrogen | 11058-021 | Improved Minimal Essential Medium (MEM) that allows a reduction of Fetal Bovine Serum (FBS) supplementation |
| Gel electrophoresis | |||
| Agarose | Sigma-Aldrich | A9539 | |
| Gelred Nucleic Acid Gel Stain | Biotium | 41003 | 10,000x in water |
| peqGOLD Range Mix DNA-Ladder | Peqlab | 25-2210 | |
| Flow cytometry analyses | |||
| CellFIX (1x) | BD Biosciences | 340181 | 10x concentrate |
| Primer for insert amplification and poly (T) tail PCR | |||
| Forward Primer (HPLC-grade) 10 µM | Ella Biotech | 5´-TTGGACCCTCGTAC AGAAGCTAATACG-3´ | |
| Reverse Primer (HPLC-grade) 10 µM | Ella Biotech | 5´- T120-CTTCCTACT CAGGCTTTATTCAA AGACCA-3´ | |
| Equipment | |||
| Cell incubator | Binder | CO2 (5%) and O2 (20%) | |
| CASY cell counter | Schärfe System | ||
| Sterile workbench | BDK Luft-und Reinraumtecknik GmbH | ||
| Bacterial incubator | Incutec | ||
| Water bath | |||
| ScanDrop spectrophotometer | Analytic Jena | ||
| PCR thermocycler | Eppendorf | ||
| Microcentrifuge | Eppendorf | ||
| Vortex | peqlab | ||
| Thermomixer | Eppendorf | ||
| Gel apparatus for electrophoresis | Bio-Rad | ||
| Gel documentation system | Bio-Rad | ||
| FACScan System | BD Biosciences | ||
| Fluorescence microscope | Nikon | ||
| Phase-contrast microscope | Zeiss | ||
Referenzen
- Bangel-Ruland, N., et al. CFTR-mRNA delivery: a novel alternative for cystic fibrosis "gene therapy". The journal of gene medicine. , (2013).
- Benteyn, D., et al. Design of an Optimized Wilms" Tumor 1 (WT1) mRNA Construct for Enhanced WT1 Expression and Improved Immunogenicity In Vitro and In Vivo. Molecular therapy Nucleic acids. 2, 134 (2013).
- Petsch, B., et al. Protective efficacy of in vitro synthesized, specific mRNA vaccines against influenza A virus infection. Nature. 30, 1210-1216 (2012).
- Mandal, P. K., Rossi, D. J. Reprogramming human fibroblasts to pluripotency using modified mRNA. Nature protocols. 8, 568-582 (2013).
- Warren, L., et al. Highly efficient reprogramming to pluripotency and directed differentiation of human cells with synthetic modified mRNA. Cell stem cell. 7, 618-630 (2010).
- Yakubov, E., Rechavi, G., Rozenblatt, S., Givol, D. Reprogramming of human fibroblasts to pluripotent stem cells using mRNA of four transcription factors. Biochemical and biophysical research communications. 394, 189-193 (2010).
- Anderson, B. R., et al. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic acids research. 38, 5884-5892 (2010).
- Kariko, K., Buckstein, M., Ni, H., Weissman, D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity. 23, 165-175 (2005).
- Kariko, K., et al. Incorporation of pseudouridine into mRNA yields superior nonimmunogenic vector with increased translational capacity and biological stability. Molecular therapy : the journal of the American Society of Gene Therapy. 16, 1833-1840 (2008).
- Kariko, K., Weissman, D. Naturally occurring nucleoside modifications suppress the immunostimulatory activity of RNA: implication for therapeutic RNA development. Current opinion in drug discovery & development. 10, 523-532 (2007).
- Kormann, M. S., et al. Expression of therapeutic proteins after delivery of chemically modified mRNA in mice. Nature biotechnology. 29, 154-157 (2011).
- Hacein-Bey-Abina, S., et al. Insertional oncogenesis in 4 patients after retrovirus-mediated gene therapy of SCID-X1. The Journal of clinical investigation. 118, 3132-3142 (2008).
- Hacein-Bey-Abina, S., et al. Efficacy of gene therapy for X-linked severe combined immunodeficiency. The New England journal of medicine. 363, 355-364 (2010).
- Avci-Adali, M., et al. Optimized conditions for successful transfection of human endothelial cells with in vitro synthesized and modified mRNA for induction of protein expression. Journal of biological engineering. 8, 8 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten