Method Article
절단 조각의 탐지와 전류 측정을 결합하여 상피 나트륨 채널 (ENAC)의 단백질 분해 활성의 데모
요약
heterologously Xenopus의 표현 상피 나트륨 채널 (ENAC)의 단백질 분해 활성은 난자가 세포 표면에서의 이온 채널 벽개 제품의 외관을 조사하는 바이오 티 닐화 방식으로 전류 측정을 결합하여 설명 될 수 laevis의. 기능적으로 중요한 절단 부위는 부위 특이 적 변이를 이용하여 식별 될 수있다.
초록
The described methods can be used to investigate the effect of proteases on ion channels, receptors, and other plasma membrane proteins heterologously expressed in Xenopus laevis oocytes. In combination with site-directed mutagenesis, this approach provides a powerful tool to identify functionally relevant cleavage sites. Proteolytic activation is a characteristic feature of the amiloride-sensitive epithelial sodium channel (ENaC). The final activating step involves cleavage of the channel’s γ-subunit in a critical region potentially targeted by several proteases including chymotrypsin and plasmin. To determine the stimulatory effect of these serine proteases on ENaC, the amiloride-sensitive whole-cell current (ΔIami) was measured twice in the same oocyte before and after exposure to the protease using the two-electrode voltage-clamp technique. In parallel to the electrophysiological experiments, a biotinylation approach was used to monitor the appearance of γENaC cleavage fragments at the cell surface. Using the methods described, it was demonstrated that the time course of proteolytic activation of ENaC-mediated whole-cell currents correlates with the appearance of a γENaC cleavage product at the cell surface. These results suggest a causal link between channel cleavage and channel activation. Moreover, they confirm the concept that a cleavage event in γENaC is required as a final step in proteolytic channel activation. The methods described here may well be applicable to address similar questions for other types of ion channels or membrane proteins.
서문
프로테아제는 복잡한 규제 신호 전달 경로에 관여 매우 정교한 프로테아제 캐스케이드로, 소화의 문맥에서 단백질의 잘 알려진 단백질 가수 분해에 이르기까지 여러 가지 생리적 반응에 관여하는 효소이다. 단백질 분해 효소가 자신의 촉매 활성 부위에 따라 일곱 개 그룹으로 분류됩니다 아스파라긴산, 아스파라긴, 시스테인, 글루탐산, 메탈로, 세린, 트레오닌 단백질 분해 효소. 다른 프로테아제는 항상 단백질의 일차 구조로부터 예측하기 쉽지 않은 별개의 절단 부위를 표적으로한다. MEROPS 데이터베이스 ( http://merops.sanger.ac.uk/는 ) 단백질 분해 효소와 그 우선 절단 부위의 넓은 범위에 대한 자세한 정보를 제공합니다. 기능적으로 관련이 절단 부위는 부위 특이 적 변이를 이용하여 식별 될 수있다.
그것은 잘 ENAC의 단백질 분해 처리 일의 활성화의 중요한 메커니즘이라고 설립특정 이온 채널 1,2입니다. 흥미롭게도, 관련 산 감지 이온 채널 1A (ASIC1a)의 기능은 또한 프로테아제 3-5에 의해 수정 될 수 있다는 증거가있다. 현재는 단백질 분해 채널 분열 다른 이온 채널 또는 수송의 활동을 조절에 관련된 생리 학적 역할을하는지 여부 의문 남아있다. 그러나, 잘 단백 분해 절단은 G 단백질 결합 수용체, 프로테아제 활성화 된 수용체 (PARS)의 그룹을 활성화하는 것이 확립 6. 여러 세린 프로테아제 (예 : 채널 활성화 단백질 분해 효소 (CAP1-3), 키모 트립신은, 트립신, furin, 플라스, 호중구 엘라 스타 제, 및 칼리 크레인)은 단백질 가수 분해 ENAC이 활성화하는 것으로 나타났다. 세린 프로테아제 외에, 프로테아제의 다른 그룹은 단백질 분해 ENAC 활성화에 관여 될 수있다. 사실, 최근의 데이터를 보여줍니다 메탈의 meprin-β 7 시스테인 프로테아제 카 텝신-S (8)는 또한 할 수있다 ACTIVA테 ENAC. 그러나, ENAC 활성화를위한 (병리) 생리 학적으로 관련 단백질 분해 효소가 결정되는 유지하고 조직에 조직과 다를 수 있습니다.
프로테아제가 우선적으로 아미노산 서열의 특정 부위에서 절단하는 것으로 알려져있다. 예를 들어, 세린 프로테아제는 키모 트립신, 방향족 아미노산은 페닐알라닌 및 티로신 잔기 클 리빙 후에 특정 절단 패턴을 도시한다. 염기성 잔기의 라이신 또는 아르기닌 후에 이에 대하여, 세린 프로테아제는 트립신 우선적 클리브. 부위 특이 적 돌연변이 유발에 의해 생성 된 돌연변이 인간 γENaC 구문을 사용 heterologously 난자 발현 시스템에서 발현 ENAC 기능적으로 관련이 절단 부위는 8-13를 식별 할 수있다.
격리 된 난 모세포에 세 ENAC 소단위 (αβγ)를위한 cRNA를 주입함으로써, ENAC 기능적으로 이들 세포에서 발현 될 수 있고, 세포막에 존재하는 채널의 활성을 측정 할 수있다두 전극 전압 - 클램프 기술을 이용하여. 이뇨제 아밀로 라이드, 특정 ENAC 억제제, 아밀로 라이드를 구분 ENAC 중재 전체 - 셀 전류 성분 (ΔI AMI)를 사용하여 비특이적 누설 전류 나 다른 이온 채널 실시한 전류로부터 분리 될 수있다. 따라서, ΔI AMI 값은 전체적인 ENAC 활동을 반영 아밀로 라이드의 부재시 기록 된 해당 전체 - 셀 전류에서의 아밀로 라이드의 존재하에 측정 된 전체 - 셀 전류를 감산함으로써 결정될 수있다. 단백질 분해 효소가 ENAC에 자극 효과가 있는지 여부를 테스트하기 위해, ΔI AMI는 즉, 이전과 단백질 분해 효소 함유 용액에서 난자의 배양 후, 동일한 난자에 두 번 측정한다. 두 번째 측정에 대한 첫 번째에서 ΔI AMI의 증가는 단백질 분해 ENAC 활성화를 나타냅니다. 키모 트립신은 극대 또는 난자 발현 시스템에서 2,14 ENAC을 자극하는 것으로 알려져 확인 합니하는데 사용될 수있다RM이 단백질 분해 ENAC 활성화는 난자의 주어진 배치에서 감지합니다.
전체 - 셀 전류의 측정과 병행, 바이오 티 닐화 방법 9 ENAC의 외관과 상관이 세포 표면에 조각을 절단 ΔI AMI의 증가는 단백질 분해 효소에 난자의 노광시 탐지 여부를 조사하기 위해 사용 하였다. 세포 표면의 단백질은 비오틴으로 표시되며 뉴트라 비딘 표지 아가로 오스 비즈 바이오틴 결합 단백질에 의해 세포 내 단백질에서 분리 될 수있다. 바이오틴 단백질은 서양 얼룩에 의해 분석 될 수있다. 세포 표면에서 γENaC 절단 단편 γENaC의 C-말단에서 에피토프에 대항 특이 적 항체를 사용하여 검출 될 수있다. 기능적으로 중요한 절단 부위 (들)을 식별하기 위해, 절단 부위는 부위 특이 적 변이를 이용하여 변이 수 예측. 야생형 및 돌연변이 채널들로부터 난자를 사용한 병렬 실험에서 비교AME 배치.
이러한 방법론적인 접근법과는 ENAC 중재 전체 - 셀 전류의 단백질 분해 활성은 세포 표면에 조각을 절단 ENAC의 시간 종속 외관과 상관 것을 처음으로 입증 하였다. 이러한 결과는 채널 분열 및 채널 활성화 사이의 인과 관계를 제안합니다. 또한,이 전극의 전압 - 클램프 기법, 플라스 민을위한 기능적 관련 절단 부위, 13 키모 트립신 및 카 텝신 S-13과 조합 추정 절단 부위의 부위 특이 적 변이를 사용하는 것이 확인되었다.
프로토콜
Xenopus의 난자 된 cRNA의 미세 주입 1. 격리
- 성인 여성의는 Xenopus laevis의에서 난자를 얻습니다. 0.2 % MS222에있는 동물을 마취시키다, 작은 복부 절개를 통해 난소 엽 (叶)을 잘라 내다.
- 칼슘 무료 OR2 용액 (표 1의 제조법)에 용해 클로스 트리 디움 histolyticum에서 2 형 콜라의 600 ~ 700 U / ㎖로 3 ~ 4 시간 동안 19 ° C에서 소화 효소에 의해 난소 로브에서 난자를 분리합니다.
- 선택을위한 솔루션이 포함 된 높은 나트륨에 두눈 현미경 페트리 접시에 defolliculated 난자를 배치 (ND96를 : 레시피를 표 1).
- 스테이지 V-VI 난자를 선택하고 파스퇴르 피펫을 가진 다른 배양 접시에 놓습니다. 참고 : 무뚝뚝한 파스퇴르 피펫을 난자의 손상을 방지하기 위해 불타는에 의해.
- cRNA를 (예를 들어, 0.2 NG 당 αβγENaC 서브 유닛)와 난 모세포를 주입한다. RNase가없는 물에 cRNAs을 녹입니다. 참고 : 총각각의 난자에 주입 부피는 46 NL입니다.
- (표 1에서 제조법 ND9) 판매자는 난자의 나트륨 로딩을 방지하기 위해 낮은 나트륨 용액에 19 ° C에서 난 모세포를 주입했다. 박테리아의 성장을 방지하기 위해 100 U / ㎖ 페니실린 나트륨 및 100 ㎍ / ml의 스트렙토 마이신 설페이트 용액 보조 식품. 조심스럽게 손상되거나 죽은 난자의 양을 제한하고 cRNA를 주입 한 후 이틀 동안 목욕 솔루션으로 채워진 12 잘 플레이트의 우물에서 개별 소규모 그룹을 유지하기 위해 난자를 처리합니다.
2. 두 전극 전압 클램프 실험을 수행
- 사후 2 일후 난자를 측정한다.
- ND96 솔루션 중력 공급 살포 시스템과 아밀로 라이드 (2 μM)를 포함 ND96 솔루션을 다른 주사기 하나의 주사기를 채우십시오. 마운트 50cm 난자 목욕 챔버 위에 주사기. 참고 : ENAC 억제제 아밀로 라이드의 농도는 자사의 IC (50)보다 20 배 높은 것으로 선택되었다 (100 NM).
- 150 W의 할로겐 형광 근원을 켜고 쌍안 현미경으로 좋은 시각화를 허용하는 난자 목욕 챔버 위 10cm로 조정합니다. 그런 흡입 켜고 난자 욕 챔버의 단부에 흡입관을 조정한다. 튜브를 superfusion하는 흡입 튜브 반대를 찾습니다 '어댑터 난자 목욕 입력. 주 : 흡인력 난자를 superfusing 용액의 연속적인 흐름을 지원하기에 충분해야한다.
- IV 중력 유동 제어 장치를 사용하여 3-5 ㎖ / 분 각 용액 superfusion 속도를 조정한다. 난자 목욕 챔버 어댑터 superfusion 튜브를 연결합니다.
- <1 μm의 팁 직경을 얻기 위해 마이크로 피펫 풀러와 유리 모세관을 당깁니다. 그런 다음 3 M의 KCl과 함께 ~ 1 / 4에 모세 혈관을 채우십시오. 참고 : 전극 홀더의 실버 와이어의 염소 부분의 KCl 용액에 침지되어 있는지 확인합니다. 모세관의 끝 부분에 공기 방울을 확인합니다. 기포의 압력 측정을 손상저항 부유 용량을 증가시켜 별 개로.
- 현재의 전극 홀더와 전압 전극에 모세 혈관을 삽입하고 마이크로 매니퓰레이터를 사용 ND96 포함 아밀로 라이드 (2 μM) 솔루션에 배치합니다.
아밀로 라이드에 민감한 전체 셀 전류의 3. 측정
- 제로 V의 m 및 V 지점을 조정함으로써 전압 전극 (V의 m) 및 전류 전극 (V 전자)의 전극 전위는 버튼 오프셋 NOTE :. 저항 V의 m 및 0.5을 측정하는 전극 용 1-2 MΩ되어야 현재 주입 전극 -1 MΩ.
- 전압 감지 전극에 근접 목욕 챔버로 난자를 놓습니다. 참고 : 이러한 전송 단계를 수행하는 동안 난자를 손상시키지 마십시오. 난자를 전송하는 파스퇴르 피펫을 사용합니다. 난자에게 피펫의 가장자리의 손상을 방지하기 위해 불타는에 의해 무디게해야한다.
- OO을 찌른다모두 미세 전극을 부드럽게 cytes.
- -60 mV 범위 앰프에서 유지 가능성을 설정하고 차트 레코더의 전원을 켭니다. 솔루션을 포함하는 아밀로 라이드 (2 μM)를 켭니다. 참고 : 현재는 약 0 ± 0.5 μA해야한다. 큰 누설 전류가 새는 말뚝으로 찌르는 형벌을 나타냅니다. 따라서 이러한 난자는 거부되어야한다. 또한, 아밀로 라이드 (2 μM)의 존재에 측정 된 누설 전류는 αβγ-WT는 난자를 표현 αβγ 돌연변이 ENAC 측정에게 난자를 표현하는 유사해야합니다. 이것은 돌연변이 채널의 아밀로 라이드 - 민감성에 영향을주지 않는 것을 나타낸다.
- 녹음을 시작합니다. 필요한 경우 게인을 조정합니다.
- 측정 된 전류가 안정적으로 고원에 도달 한 후, 아밀로 라이드 무료 솔루션으로 변경. 참고 : 현재의 흔적 하향 현재 편향 안쪽 전류, 세포에 세포 측면에서 양의 전하의 이동, 즉 (나 +)에 해당합니다.
- AF현재 고원이 (후 ~ 60 초)에 도달 할 터, 다시 아밀로 라이드 함유 용액에 superfusion을 전환합니다. 난자의 전류가 초기 기준 전류에 도달하면, 전압 클램프를 해제하고 부드럽게 전극을 철회.
- , 말뚝으로 찌르는 형벌의 사이트에서 세포막의 재 밀봉을 허용 프로테아제 무료 ND96 솔루션의 100 ~ 150 μl를 포함하는 96 - 웰 플레이트 잘 하나에 난자를 배치합니다.
- 5 분 후, 30 분의 인큐베이션 시간 동안 용액을 함유하는 프로테아제 또는 프로테아제가없는 대조 용액에 난자를 옮긴다. 주 : 배양 시간은 단백질 분해 효소와 공부 채널에 따라 달라집니다.
- 배양 단계는 현재의 측정을 반복 한 후 (3.2 및 아래 참조). 참고 : 단백질 분해 효소 용액에서 배양 한 후 난자의> 90 %를 측정 할 수있다.
4. 바이오 티 닐화 분석
- 선택하고 두눈 현미경으로 결함이있는 난자를 폐기합니다. 참고 : 주사를 사용ED는 전류 측정 및 바이오 티 닐화 실험에 대해 동일한 배치에서 난자.
- 실험에있는 그것의 사용하기 전에 적어도 20 분 동안 실온에서 비오틴을 유지합니다.
- 솔루션을 준비 : ND96와 ND96는 적절한 단백질 분해 효소를 포함. 그 라벨로 간략하게 난자의 부상을 방지하기 위해 팁을 불타는에서 파스퇴르 피펫을 준비합니다. 참고 : 여기에, ND96에서 단백질 분해 효소 키모 트립신 2 ㎍ / ml를 사용합니다. 해법의 교차 오염을 방지하기 위해 별도의 피펫으로 각 그룹을 치료.
- RT에서 단백질 분해 효소를 함유하는 2.5 ml의 제어 ND96 또는 ND96로 6 - 웰 플레이트의 각 웰을 입력합니다. 그런 다음 잘 당 30 난자를 입금하고 실온에서 30 분 동안 그들을 품어. 참고 : 다음 절차는 항상 얼음에 샘플을 유지하는 것이 중요합니다. 모든 원심 분리 단계에서 4 ℃에서 수행된다
- 2.5 ML의 ND96 (각 그룹은 세척 단계 3 우물을 필요로한다)과 새로운 6 - 웰 플레이트의 각 웰을 입력하고 비오틴 무게. 참고 : 2.5 밀리그램의 비타민 B 복합체 P어 잘 (1 ㎎ / ㎖)가 필요합니다. 25 ML의 바이오 티 닐화 버퍼 표 1 (레시피)에서 바이오 티 닐화 버퍼 (10) 그룹 (즉, 25 밀리그램의 비타민 B 복합체 ()에 비오틴을 디졸브.
- 잘 2.5 ML의 ND96 가득에 난자의 각 그룹을 전송합니다. 전송 남아있는 단백질 분해 효소를 씻어 ND96와 두 개의 추가 우물에 순차적으로 난자. ND96에서 5 분 동안 난자를 품어.
- 잘 들어있는 2.5 ml의 비오틴 솔루션으로 난자를 전송하고 15 분 동안 교반과 ( '통')와 함께 그들을 품어. 참고 : 비타민 B 복합체 용액의 희석을 방지하기 위해 피펫 전송 ND96을 최소화합니다.
- 바이오 티 닐화 반응을 중지도 포함 2.5 ML 담금질 버퍼 (표 1의 제조법)으로 난자의 각 그룹을 전송합니다. 그리고, 또한 2.5 ml의 버퍼 해소하고 부드러운 교반과 함께 5 분 동안 품어 포함 된 두 번째 우물에 난자의 각 그룹을 전송할 수 있습니다.
- 손상되거나 죽은 난자를 제거합니다. 주 :다음 절차에 대한 그룹 별 난자의 같은 번호를 선택합니다.
- 1.5 ㎖의 플라스틱 microcentrifuge 관에 난자의 각 그룹을 전송합니다. 참고 : 전송 급냉 버퍼의 양을 최소화합니다.
- 그 후, 단백질 분해 효소 억제제와 보완 (레시피는 표 1 참조) 1 ㎖ 용해 버퍼에 27 G 바늘을 통해 전달하여 난자를 용해.
- 1500 X g에서 10 분 동안 용 해물을 원심 분리기.
- 기음 상등액 0.5 % 트리톤-X-100, 0.5 % NP40을 함유 1.5 ml의 마이크로 원심 분리 튜브로 옮긴다. 나머지 펠렛을 폐기하십시오. 참고 : 상층 액은 바이오틴 플라즈마 막 단백질 및 비 - 바이오틴 세포 내 단백질을 포함하고 있습니다.
- 얼음에 20 분 동안 마이크로 원심 튜브를 품어. 반복적 와류이 기간 동안 튜브 완전히 NP40 및 트리톤-X-100에있는 단백질을 분해한다.
- 1,500 X g에서 3 분 동안 난자 그룹 당 아가로 오스 비즈의 원심 분리기 100 μL. 후원심 분리 비즈 솔루션에서 뜨는을 제거하고 버퍼 구슬 평형을 용해 완충액으로 3 회 세척한다.
- 비즈 바이오틴 단백질의 결합을 허용하는 4.13에서 제조 된 단백질 세제 솔루션을 포함하는 각 microcentrifuge 관에 세척 구슬의 피펫 100 μL.
- 4 ℃에서 오버 헤드가 회전 O / N과 마이크로 원심 튜브를 품어
- 1,500 X g에서 3 분의 microcentrifuge 튜브를 원심 분리기. 그런 다음 새로운 튜브에 뜨는을 전송합니다. 참고 : 세포 내 단백질은 비오틴으로 표시되지 않습니다. 상층 액을 -20 ℃에서 저장 될 수있다 구슬을 대기음하지 마십시오.
웨스턴 블롯 분석에 의한 세포 표면에서 ENAC 분열 파편의 5. 검출
- 용해 버퍼로 구슬을 세 번 세척하고 2X SDS-PAGE 샘플 버퍼의 100 μl를 추가합니다. 참고 : 샘플은 -20 ° C에 저장하거나 바로 웨스턴 블롯 분석을 제조 할 수있다.
- 종기의5 ~ 95 ° C에서 최소 및 얼음에 다음 장소 튜브 amples.
- 3 20,000 XG에 분 새로운 microcentrifuge 관에 뜨는을 피펫을위한 원심 분리기 샘플. 참고 :이 상층 액은 난자의 세포 표면에서 비오틴 세포막의 단백질을 포함하고 있습니다.
- 세포 표면에 절단 조각을 조사하기 위해 서양 얼룩에 의해이 상층의 30 μl를 분석합니다.
- 적절한 겔 (8 %, 10 %, 12 %가 추궁 절단 단편의 분자량에 따라서)을 사용하여 SDS-PAGE (소듐 도데 실 설페이트 폴리 아크릴 아미드 겔 전기 영동)에 의해 바이오틴 단백질을 분리.
- 세미 드라이 블로 팅에 의해 폴리 불화 비닐 리덴 (PVDF) 막에 단백질을 전송합니다.
- (그림 3과 13 참조) C-말단에있는 항원에 대항 인간 γENaC에 대한 특이 항체를 가진 막을 조사.
- 보조 반으로 고추 냉이 퍼 옥시 데이즈 표지 염소 항 - 토끼 항체를 사용하여몸.
- 화학 발광 신호를 감지합니다.
결과
세린 프로테아제 플라스는 ENAC 매개 전류를 활성화 할 수 있는지 여부를 조사하기 위해, 개별 ENAC 발현 난자의 ΔI AMI는 단백질 분해 효소가없는 (제어)에서 난자의 30 분의 배양 (그림 2A) 또는 플라스 함유 용액 (그림 전후에 결정되었다 도 2b)이 전극 전압 - 클램프 기술 (도 1 참조)을 사용. 플라스에 노출을 측정 모든 난자에 ΔI AMI 증가했다. 반면, 제어 실험에서, 단백질 분해 효소가없는 솔루션 ENAC 발현 난자의 30 분의 배양 효과는 경미한 (그림 2 C, D)을했다. 따라서,이 방법을 사용하여 플라스 의하여 ENAC 중재 전류의 자극이 검출 될 수있다.
ENAC 매개 전류의 활성화뿐만 아니라,시 추정 절단 부위를 돌연변이의 효과를 연구하기 위해 채널의 분열에, WT-ENAC에 키모 트립신의 효과는 그에 비교 하였다변이 된 프로 스타와 플라스 절단 부위와 돌연변이 ENAC (γ의 RKRK178AAAA, K189A). 채널 키모 트립신에 의해 활성화뿐만 아니라 ENAC 모양 세포 표면에 제품을 절단의 타임 코스는 다른 프로테아제 배양 시간 (도 4a)를 사용하여 조사 하였다. 이것은 돌연변이 채널 지연 및 키모 트립신에 의한 ENAC 중재 현재의 활성을 감소 시킨다는 것을 증명 하였다. 이것은 완전히 쪼개진 서브 유닛에 대응하는 67 kDa의 낮은 분자량 γENaC 절단 단편의 지연 외형으로 평행을 이룬다. 절단 조각은 C-말단에있는 항원 (그림 3)에 대한 감독 γENaC 항체를 사용하여 검출 하였다. 이 방법 론적 접근 ENAC 중재 전류의 단백질 분해 활성의 타임 코스가 세포 표면에서 67 kDa의 γENaC의 분열 생성물의 모양 (도 4 B, C)와 상관 관계가 있음을 보여준다. 이 개념을 지원단백질 분해 채널 절단 및 채널 활성화 13 사이의 인과 관계 링크를 클릭하십시오. 더욱이, 세포 표면에서 전류 측정 및 γENaC 단편의 검출을 결합하여이를 변이 된 절단 부위가 단백질 분해 채널 활성화에 기능적으로 관련이 있다는 것을 입증 하였다.

그림 1. heterologously Xenopus의 표현 ENAC에 단백질 분해 효소의 자극 효과를 결정하는 절차 난자를 laevis의. ENAC 활동이 아밀로 라이드에 민감한 전체 셀 전류 성분 ΔI AMI를 측정하여 추정된다.
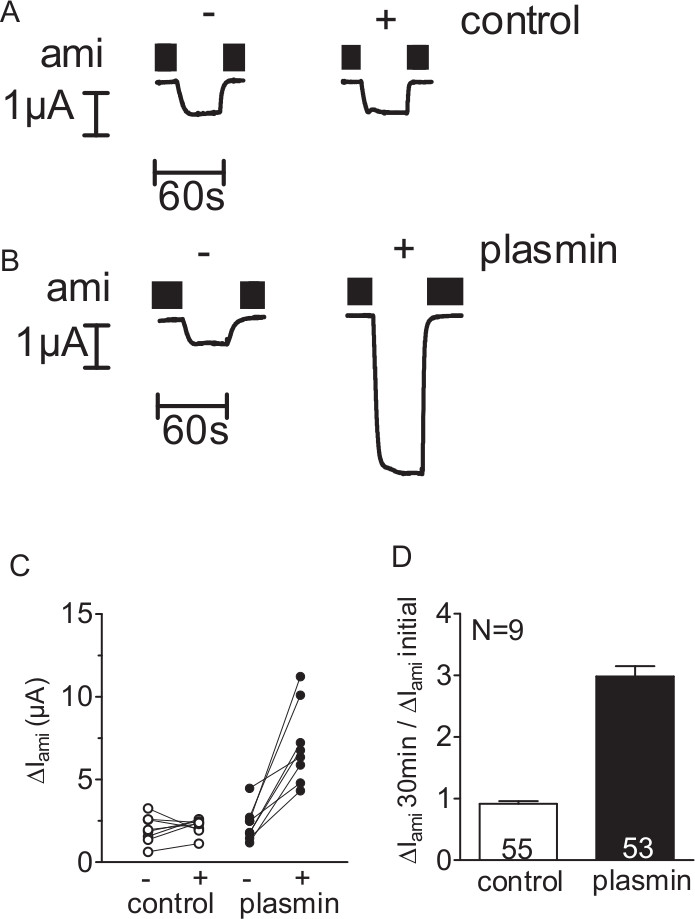
그림 2. 플라스는 ENAC 매개 CURREN을 자극ENAC을 표현 난자의 TS. 인간의 ENAC을 표현 (AD) 난 모세포는 단백질 분해 효소가없는 솔루션 (제어) 또는 플라스 (10 ㎍ / ㎖) 함유 용액에 30 분 동안 배양 하였다. (-) 전에 ΔI AMI를 결정하고, 이후에 (+) 배양, 난자가 -60 뮤직 비디오의 개최 가능성은 고정 된 (A, B) 난자 하나의 배치에서 4 대표 전체 셀 전류 흔적.. 아밀로 라이드 (AMI)는 검은 색 막대로 나타낸 바와 같이 구체적으로 ENAC을 억제하기 위해 목욕 솔루션에 존재했다. (C)는 각각의 난자에서 얻은 데이터 포인트가 선으로 연결되어있다. (D)와 유사한 실험의 개요 C. 열 같이 표현 ΔI AMI에 상대적으로 자극 효과가 부화하기 전에 측정 된 초기 ΔI AMI (ΔI 아미 초기)에 30 분 배양 (ΔI AMI 30 분) 후 측정 ΔI AMI의 비율로 계산. 열이 내부 숫자 표시측정 된 각각의 난자의 수. N은 난자의 다른 배치의 수를 나타냅니다. (이 그림에서 수정 된 [Haerteis 등 2012 세대 J Physiol 140, 375-389, 간접 :. 10.1085/jgp.201110763])
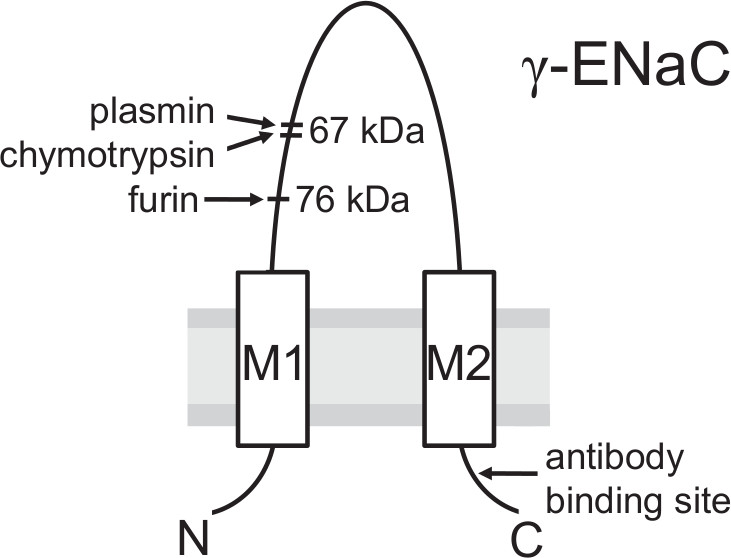
채널은 세포막에 도달하기 전에 골지 - 연관의 convertase의 furin 의한 단백질 분해 활성 및 사용 된 항체의 결합 부위에 대한 γENaC 소단위 보여주는 절단 부위의도 3. 모델. 단백 분해 절단은 생합성 경로에서 ENAC 성숙을 위해 중요하다. 76 kDa의 단편을 furin 의한 단리는 γ-서브 유닛의 C-말단에서 에피토프에 대하여 접근 및 바이오 티 닐화 된 항체를 사용하여 세포 표면에서 검출 될 수 후. 단백질 분해 EN의 중요한 마지막 단계교류 활성화는 아마 γENaC이 67 kDa의 절단 조각의 결과로 furin 사이트에 지역의 말단에서 세포 외 단백질 분해 효소 (예 : 플라스 또는 키모 트립신)에 의해 절단되어 세포막에서 열립니다. (이 그림에서 수정 된 [Haerteis 등 2012 세대 J Physiol 140, 375-389, 간접 :. 10.1085/jgp.201110763])

그림 4 :. 플라스 (K189)과 프로 스타 절단 부위 (RKRK178) 모두에 변경을 가하면 ENAC 매개 전류의 활성화 및 채널의 γ-서브 유닛의 67 kDa의 절단 제품의 모양을 지연 난 모세포는 WT을 표현하는 (오픈 기호) 및 γ RKRK178AAAA은, K189A ENAC 돌연변이 채널 (폐쇄 기호) 단백질 분해 효소가없는 솔루션 (제어)에서 30 분 동안, 5, 3 배양 하였다키모 트립신 (2 ㎍ / ㎖)이 포함 된 용액에 0 또는 60 분. (A) 배양 전후 ΔI AMI를 결정하기는 난자 -60 뮤직 비디오의 개최 가능성에 고정되었다. 원이 부화하기 전에 측정 된 초기 ΔI AMI (ΔI 아미 초기)에 5 후에 측정 ΔI AMI의 비율, 30, 60 분의 배양 (ΔI 아미 분)을 나타냅니다. 각 데이터 포인트는 네 개의 다른 배치의 난자 22-24 개별 측정 평균치 ΔI AMI를 나타낸다. (BD) ΔI AMI, 세포 표면에서 비오틴 γENaC 발현 SDS-PAGE로 분석의 검출과 병행. γENaC 인간 γENaC의 C-말단에있는 항원에 대한 항체로 검출되었다. 각 레인은 B 또는 D에 표시된 것과 유사한 세 서부 오,의의 난자 하나의 일괄 처리에서 대표 서쪽 롯이 표시됩니다. (CE) 농도계 분석76 kD의 (개방 열) 및 67 kD의 (회색 열)의 영역에서 검출 ignals가 결정 검출 된 총 신호의 합으로 정규화 하였다. N은 난자의 다른 배치의 수를 나타냅니다. 더 큰 이미지를 보려면 여기를 클릭하십시오.
토론
이 원고에서 성공적으로 단백질 분해 효소에 의해 ENAC의 활성화를 기본 메커니즘을 연구하기 위해 적용된 방법 론적 접근 방식은 8,13를 설명한다. 잘 확립는 Xenopus laevis의 난자 발현 시스템은 기능적으로 표현 ENAC에 사용되었다. ENAC 기능은 종래의 2 전극 전압 클램프 기법으로 평가 하였다. 부위 특이 적 변이는 기능적으로 관련된 프로테아제 절단 부위를 식별하기 위해 사용 하였다. 전기 생리 측량으로 병렬로 수행 바이오 티 닐화 실험은 가능한 ENAC의 외관은 단백질 분해 활성 전류와 세포 표면에 제품을 절단 상관시키는 제. 현재 활성의 시간 경과와 세포 표면에 단백질 분해 절단 조각의 모양 간의 상관은 단백질 분해 활성 채널의 개념을 지원한다.
두 전극 전압 클램프 녹음 O의 말뚝으로 찌르는 형벌을 필요로두 개의 미소 전극과 ocyte. 이 절차는 일반적으로 각각의 난자에 한 번만 수행됩니다. 그러나, 난자 명백 손상없이 초기 전체 - 셀 전류 기록 후 미세 전극을 제거하게 실현되었다. 실제로, impalements의 사이트에서 세포막은 몇 분 이내에 다시 봉인이 나타납니다. 따라서, 처음 두 전극 전압 클램프 측정을 완료 한 후, 미세 원심 분리 튜브 또는 충전 96 - 웰 플레이트의 웰에 두 전극 전압 클램프 설정의 실험 유량 챔버로부터 난자를 전송하는 것이 가능하다 테스트 또는 제어 솔루션의 작은 양. 이후, 동일한 난자 유동 챔버로 다시 전송 될 수 있고 제 두 전극 전압 클램프 측정을 수행하기 위해 다시 찔 수있다. 현저하게, 중재 ENAC 전류 난자는 대조액에 유지 제 1 및 제 2 측정 간의 많이 변화하지 않았다. 단백질 분해 효소 함유 졸의 난자의 대비, 배양에서첫 번째 측정 이후의 ution가 두 번째 측정에서 증가 ENAC 매개 전류 (그림 2)의 결과. 이 발견은 단백질 분해 채널 활성화를 나타냅니다.
하나의 난자에 두 개의 별도의 전류 측정을 수행하는 것은 난자가 시험 용액의 소량의 시간 가변 길이 두 측정 사이 프로테아제 또는 다른 약리학 적 제제에 노출 될 수있는 이점을 제공한다. 대량 비용 및 / 또는 사용할 수없는 제, 예를 들어, 정제 된 단백질 분해 효소 제제를 사용하는 경우 중요합니다. 에이전트의 제한 여부는 지속적으로 분당 몇 밀리리터의 유속으로 난자를 superfusing에 필요한 테스트 솔루션의 큰 볼륨으로 불가능 (또는 감당할 수없는) 연속 두 전극 전압 클램프 녹음에서 사용할 수 있도록 할 수 있습니다. 또한, 연속적인 두 전극 전압 클램프 측정은 잘 알려진 신동 의해 제한된다자연 채널 런의 enon 또한 ENAC (15)에 대해 설명했다. 반면, 한 시간 이상까지 두 개의 별도의 측정 사이의 솔루션을 테스트하기 위해 난자를 노출하는 것은 일반적으로 (그림 4A 참조) 문제가있는 것은 아닙니다. 마지막으로, 같은 난자에서 수행 두 개의 연속 측정은 약물 효과의 쌍을 관찰 할 수 있습니다. 그것은 일반적으로 이온 채널의 표현에서 관찰 된 난자, 사이의 높은 변동성의 문제를 줄일 수 있기 때문에, 난 모세포 (단백질 분해 효소 처리 및 차량 처리)의 두 개의 분리 된 그룹의 짝이 측정을 통해 장점이 있습니다. 페어링 관측과 제 측량 데이터를 정상화 할 가능성이 적은 난자 약리 제의 상당한 효과를 입증하는 실험 그룹별로 필요하다. 데이터의 정규화는 쉽게 다른 이온 통로 발현 수준 따라서 상이한 기준 전류 (도 2D와 난자의 다른 배치로부터의 데이터를 요약 할 수있다). 이 접근법은 또한 이온 채널 활성은 (도 2 참조) 제 측량으로부터 먼저 차량 처리 제어 난자에 안정적으로 유지하는 것이 입증하기 위해 분명히, 제어의 실험이 필요하다.
단백질 분해 현재 활성화가 세포 표면에 제품을 절단 ENAC의 외관과 상관을 입증하기 위해, 바이오 티 닐화 접근법은 원래 해리스 등에 의해 기재된. 구가 사용될 수있다. 이 절차는 (프로토콜 절에 상세하고도 4에 도시 된 바와 같이) 및 프로테아제 ENAC 중재 전류의 후속 활성화가 절단 단편의 시간 종속 외형으로 평행을 이룬다 채널의 노출을 발휘하도록 하였다. 바이오 티 닐화 방법은 세포 표면에서의 전체적인 증가 또는 막 단백질의 감소에 대한 분석을 허용한다. 따라서,이 방법은 단백질 분해 효소 및 다른 PHAR의 영향을 조사하는 것이 적합하다원형질막에 또는 채널 검색시 채널 삽입시 macological 에이전트. 또한, 바이오틴 세포막 단백질의 웨스턴 블롯 분석은 허용 단백질 단편 (예를 들어 단백질 분해 ENAC 단편) 또는 기능적으로 관련 될 수있는 글리코 실화 패턴의 변화의 검출.
결론적으로, 방법의 조합은 ENAC 중재 전체 - 셀 전류에 프로테아제 자극 효과를 조사하고 광범위한 애플리케이션에 유용 할 수 ENAC의 발생과 상관 관계가 세포 표면에 제품을 절단 입증하는데 사용. 특히,이 방법은 다른 이온 채널, 수송 또는 횡단 수용체 (예 : 단백질 분해 효소 활성화 수용체 갈 거예요)의 규정에 대한 비슷한 질문을 해결하기 위해 적합 할 수있다.
공개
The authors have nothing to disclose.
감사의 말
The expert technical assistance of Céline Grüninger, Christina Lang, Sonja Mayer, and Ralf Rinke is gratefully acknowledged. We thank Dr. Morag K. Mansley for carefully reading the manuscript. This project was supported by a grant of the Deutsche Forschungsgemeinschaft (Grant SFB 423: Kidney Injury: Pathogenesis and Regenerative Mechanisms, to C. Korbmacher), grants of the Interdisziplinäres Zentrum für Klinische Forschung (to S. Haerteis and M. Krappitz), the ELAN program (to S. Haerteis) of the Friedrich-Alexander-Universität Erlangen-Nürnberg, and the University Library of Erlangen-Nürnberg.
자료
| Name | Company | Catalog Number | Comments |
| Bath Clamp Headstage for OC-725C-V | Warner Instrument Corporation | - | |
| Cold light source - Schott KL 1500 LCD | Schott | #SCOC150200EU | brightness 4; mechanical aperture: D; color temperature: 3000 K |
| E Series Electrode Holder (Str, Vent, Ag Wire, 1.2 mm) | ADinstruments | #ESW-F10v | |
| left micromanipulator; MM-33L | Warner Instrument Corporation | #64-0055 | |
| LIH 1600 - computer interface | HEKA | - | |
| magnetic valve system (ALA BPS-8) in combination with a TIB14 interface (HEKA) | ALA Scientific Instruments, HEKA | - | |
| OC-725C amplifier for two-electrode voltage-clamp recordings | Warner Instrument Corporation | - | |
| P-97 FLAMING/BROWN Micropipette Puller | Sutter Instruments | - | heat=550; velocity=22; time=200 |
| right micromanipulator; MM-33R | Warner Instrument Corporation | #64-0056 | |
| Series Electrode Holder (45°, Vent, Handle, Ag Wire, 1.2 mm) | ADinstruments | #E45w-f10vh | |
| STAT 2 IV Gravity Flow Controller | Conmed | #P-S2V-60 | |
| vacuum generator ejector SEG - for suction to remove bath solution | Schmalz | - | |
| Material | |||
| INFUJECT 60ml pump syringes for solutions | Braun | #22050 | |
| Injekt-F for lysing the oocytes | Braun | #9166033V | |
| standard wall borosilicate tubing with filament | Sutter Instruments | #BF150-86-10 | outside diameter: 1.50 mm; inside diameter: 0.86 mm; length: 10 cm |
| Reagent | |||
| complete, Mini, EDTA-free protease inhibitor cocktail tablets | Roche Applied Science | #11836170001 | |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | #21217 | |
| Horseradish peroxidase-labeled secondary goat anti-rabbit antibody | Santa Cruz Biotechnology | #sc-2004 | |
| NeutrAvidin Agarose | Thermo Scientific | #29200 | Neutravidin-labeled agarose beads |
| NP40 (Nonidet P-40) | Sigma-Aldrich | #I8896 | |
| Roti-Load 1 (2× SDS-PAGE sample buffer) | Carl Roth | #K929.2 | |
| SuperSignal West Femto Chemiluminescent Substrate for detection of chemiluminescent signals | Thermo Scientific | #34095 | |
| Triton-X-100 | Sigma-Aldrich | #T8787 | |
참고문헌
- Kleyman, T. R., Carattino, M. D., Hughey, R. P. ENaC at the cutting edge: regulation of epithelial sodium channels by proteases. The Journal of Biological Chemistry. 284, 20447-20451 (2009).
- Rossier, B. C., Stutts, M. J. Activation of the epithelial sodium channel (ENaC) by serine proteases. Annu Rev Physiol. 71, 361-379 (2009).
- Poirot, O., Vukicevic, M., Boesch, A., Kellenberger, S. Selective regulation of acid-sensing ion channel 1 by serine proteases. The Journal of Biological Chemistry. 279, 38448-38457 (2004).
- Vukicevic, M., Weder, G., Boillat, A., Boesch, A., Kellenberger, S. Trypsin cleaves acid-sensing ion channel 1a in a domain that is critical for channel gating. The Journal of Biological Chemistry. 281, 714-722 (2006).
- Clark, E. B., Jovov, B., Rooj, A. K., Fuller, C. M., Benos, D. J. Proteolytic cleavage of human acid-sensing ion channel 1 by the serine protease matriptase. The Journal of Biological Chemistry. 285, 27130-27143 (2010).
- Ossovskaya, V. S., Bunnett, N. W. Protease-activated receptors: contribution to physiology and disease. Physiological reviews. 84, 579-621 (2004).
- Garcia-Caballero, A., et al. Activation of the epithelial sodium channel by the metalloprotease meprin β-subunit. Channels (Austin. 5, 14-22 (2011).
- Haerteis, S., et al. Proteolytic activation of the epithelial sodium channel (ENaC) by the cysteine protease cathepsin-S. Pflügers Archiv: European Journal of Physiology. 464, 353-365 (2012).
- Harris, M., Firsov, D., Vuagniaux, G., Stutts, M. J., Rossier, B. C. A novel neutrophil elastase inhibitor prevents elastase activation and surface cleavage of the epithelial sodium channel expressed in Xenopus laevis oocytes. The Journal of Biological Chemistry. 282, 58-64 (2007).
- Passero, C. J., Mueller, G. M., Rondon-Berrios, H., Tofovic, S. P., Hughey, R. P., Kleyman, T. R. Plasmin activates epithelial Na+ channels by cleaving the γ-subunit. The Journal of Biological Chemistry. 283, 36586-36591 (2008).
- Svenningsen, P., et al. Plasmin in nephrotic urine activates the epithelial sodium channel. Journal of the American Society of Nephrology : JASN. 20, 299-310 (2009).
- Patel, A. B., Chao, J., Palmer, L. G. Tissue kallikrein activation of the epithelial Na channel. American Journal of Physiology. Renal Physiology. 303, (2012).
- Haerteis, S., Krappitz, M., Diakov, A., Krappitz, A., Rauh, R., Korbmacher, C. Plasmin and chymotrypsin have distinct preferences for channel activating cleavage sites in the γ-subunit of the human epithelial sodium channel. The Journal of General Physiology. 140, 375-389 (2012).
- Chraibi, A., Vallet, V., Firsov, D., Hess, S. K., Horisberger, J. D. Protease modulation of the activity of the epithelial sodium channel expressed in Xenopus oocytes. The Journal of General Physiology. 111, 127-138 (1998).
- Volk, T., Konstas, A. A., Bassalay, P., Ehmke, H., Korbmacher, C. Extracellular Na+ removal attenuates rundown of the epithelial Na+-channel (ENaC) by reducing the rate of channel retrieval. Pflügers Archiv: European Journal of Physiology. 447, 884-894 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유