Method Article
上皮钠通道(ENaC)的蛋白水解激活通过结合电流测量与检测裂解片段示范
摘要
上皮钠通道(ENaC)的异源表达在非洲爪蟾的蛋白水解活化蟾卵母细胞可通过将当前测量与生物素化的方法,调查的离子通道的酶切产物在细胞表面的外观来证明。功能重要的切割位点可通过使用位点定向诱变来识别。
摘要
The described methods can be used to investigate the effect of proteases on ion channels, receptors, and other plasma membrane proteins heterologously expressed in Xenopus laevis oocytes. In combination with site-directed mutagenesis, this approach provides a powerful tool to identify functionally relevant cleavage sites. Proteolytic activation is a characteristic feature of the amiloride-sensitive epithelial sodium channel (ENaC). The final activating step involves cleavage of the channel’s γ-subunit in a critical region potentially targeted by several proteases including chymotrypsin and plasmin. To determine the stimulatory effect of these serine proteases on ENaC, the amiloride-sensitive whole-cell current (ΔIami) was measured twice in the same oocyte before and after exposure to the protease using the two-electrode voltage-clamp technique. In parallel to the electrophysiological experiments, a biotinylation approach was used to monitor the appearance of γENaC cleavage fragments at the cell surface. Using the methods described, it was demonstrated that the time course of proteolytic activation of ENaC-mediated whole-cell currents correlates with the appearance of a γENaC cleavage product at the cell surface. These results suggest a causal link between channel cleavage and channel activation. Moreover, they confirm the concept that a cleavage event in γENaC is required as a final step in proteolytic channel activation. The methods described here may well be applicable to address similar questions for other types of ion channels or membrane proteins.
引言
蛋白酶是参与多种生理反应,从蛋白质的众所周知的蛋白水解降解,在消化的情况下,对涉及复杂的调节信号转导途径高度复杂的蛋白酶级联反应的酶。蛋白酶根据其催化活性位点分为7组:天冬氨酸,天冬酰胺,半胱氨酸,谷氨酸,金属,丝氨酸和苏氨酸蛋白酶。不同的蛋白酶靶向不同的切割位点,这并不总是很容易从蛋白质的一级结构来预测。该MEROPS数据库( http://merops.sanger.ac.uk/ )提供了一个广泛的蛋白酶及其优惠的切割位点的详细信息。功能相关的切割位点可以使用定点诱变来识别。
它是公认的ENaC的蛋白水解处理激活的第一个重要的机制特别是离子通道1,2。有趣的是,有证据表明,相关的酸敏感离子通道(ASIC1a)的功能也可通过蛋白酶3-5修改。目前,它仍然是一个悬而未决的问题是否蛋白酶裂解通道在调节其它离子通道或转运蛋白的活性相关的生理作用。然而,它是公认的蛋白水解切割活化的基团G蛋白偶联型受体,蛋白酶活化受体(PAR灯)的6。几种丝氨酸蛋白酶( 例如,通道活化蛋白酶(CAP1-3),胰凝乳蛋白酶,胰蛋白酶,弗林蛋白酶,纤维蛋白溶酶,中性粒细胞弹性蛋白酶,和激肽释放酶),已显示出蛋白水解激活的ENaC 2。除了丝氨酸蛋白酶,可能涉及的蛋白水解激活ENaC的其它基团的蛋白酶。事实上,最近的数据表明,金属蛋白酶meprin-β7和半胱氨酸蛋白酶的组织蛋白酶-S 8还可以活化TE的ENaC。然而,(病理)生理有关的蛋白酶激活ENaC的仍有待确定,可能与从组织到组织。
蛋白酶是已知的优先切割在氨基酸序列的特定位点。例如,丝氨酸蛋白酶糜蛋白酶显示了特异性切割图案切割的芳香族氨基酸残基的苯丙氨酸和酪氨酸之后。与此相反,丝氨酸蛋白酶胰蛋白酶的碱性残基赖氨酸或精氨酸后优先裂解。利用定点诱变产生的突变型人γENaC构建体,在ENaC的功能相关的切割位点的异源表达在卵母细胞表达系统中可被识别的8-13。
通过注射的cRNA为3的ENaC亚单位(αβγ)转换成隔离的卵母细胞,ENaC的可功能性地表达在这些细胞和存在于质膜通道的活性可以通过以下方式测使用双电极电压钳技术。通过使用利尿剂阿米洛利,一个特定的ENaC抑制剂阿米洛利敏感的ENaC-介导的全细胞电流分量(ΔIAMI)可以从非特异的泄漏电流或从其他离子通道的传导电流分开。于是,ΔIAMI值反映整体的ENaC活性,并且可以通过减去在阿米洛利从记录在没有阿米洛利的相应的全细胞电流的存在下测得的全细胞电流来确定。要测试的蛋白酶是否有对ENaC的刺激效果,ΔIAMI在相同的卵母细胞测量两次, 即前和在含蛋白酶溶液中的卵母细胞的培养后。到第二测量增加ΔIAMI从第一表示ENaC的蛋白水解激活。胰凝乳蛋白酶或胰蛋白酶是已知的,以最大程度地刺激的ENaC在卵母细胞表达系统2,14和可用于置信RM的蛋白水解激活ENaC的检测是在一个给定的一批卵母细胞。
在平行于全细胞电流测量,生物素化的方法9被用来研究的增加ΔIAMI是否检测到时的卵母细胞暴露于蛋白酶的关联与ENaC的外观裂解片段在细胞表面。蛋白在细胞表面被用生物素标记,并且可以从细胞内蛋白的生物素化的蛋白质结合到中性亲和素标记的琼脂糖珠进行分离。生物素化的蛋白质可以通过蛋白质印迹分析。可以使用针对在γENaC的C-末端表位的特异性抗体来检测在细胞表面γENaC裂解片段。以识别功能上相关的裂解位点(S),预测的切割位点可以使用位点定向诱变突变。野生型和突变通道中使用卵母细胞从S平行实验进行比较AME批次。
用此方法途径可以证实对于第一次的ENaC-介导的全细胞电流的蛋白水解活化关联与ENaC的时间依赖性的外观裂解片段在细胞表面。这些结果表明通道裂解和激活通道之间的因果关系。此外,当使用在具有双电极电压钳技术,在功能上相关的切割位点为纤溶酶,胰凝乳蛋白酶13和组织蛋白酶-S 8相结合推定的切割位点的位点定向诱变进行鉴定。
研究方案
1,分离爪蟾卵母细胞的cRNA和微量注射的
- 从成年雌性非洲爪蟾卵母细胞获得。麻醉动物在0.2%的MS222,并通过一个小的腹部切口切除卵巢瓣。
- 通过酶消化从卵巢裂片卵母细胞分离在19℃下3-4小时与溶组织梭菌 600-700 U / ml的2型胶原酶溶解在无钙OR 2溶液(配方见表1)。
- 对于选择,将defolliculated卵母细胞在培养皿中在双目显微镜下的解决方案,包含一个高钠(ND96:配方见表1)。
- 选择阶段,第五和第六的卵母细胞,并将其放置在另一个培养皿用巴斯德吸管。注:钝巴斯德吸管通过燃烧,以防止卵母细胞的伤害。
- 注入卵母细胞的cRNA( 如 0.2纳克每αβγENaC亚基)。溶解在无RNA酶的水的cRNA。注:总量注入每个卵母细胞是46 NL。
- 店注入卵母细胞在19℃的低钠溶液,以防止卵母细胞的钠负荷(ND9:配方见表1)。补充解决方案,100 U / ml的青霉素钠和100微克/毫升硫酸链霉素,以防止细菌滋生。小心处理的卵母细胞,以限制受损或死亡的卵母细胞的数量,并保持它们在12孔板孔中的cRNA注射后两天充满了槽液个别小团体。
2,进行两电极电压钳实验
- 注射后两天测量的卵母细胞。
- 填补重力给料的灌注系统以ND96溶液和另一种注射器用含有氨氯吡咪(2μM)ND96溶液中的一个注射器。注射器山上方50cm的卵母细胞浴室。注意:ENaC的抑制剂阿米洛利的浓度被选择为比其IC 50高20倍(100纳米)。
- 打开一个150瓦的卤素冷光源并调整到10厘米的卵母细胞浴室允许与双目显微镜良好的视觉效果上面。然后打开抽吸和调节吸入管在卵母细胞浴室的端部。找到吸管相反灌流管"适配器进入卵母细胞浴。注:吸力必须足以支持解决方案的表面灌流卵母细胞的连续流。
- 通过使用四重力流动控制装置调节各溶液的表面灌流速度至3-5毫升/分钟。连接灌流管带适配器的卵母细胞浴室。
- 拉玻璃毛细管用微量拉马取得<1μm的端部直径。然后填写毛细血管〜1/4与3米氯化钾。注意:请确保电极架的银线的氯化一部分浸在氯化钾溶液中。检查是否有气泡在毛细管的末端。气泡损害measu由河源地区的电阻增加寄生电容。
- 插入毛细血管进入的电流的电极夹和电压电极和使用该微操纵器将它们放置到含有ND96阿米洛利(2μM)溶液。
的阿米洛利敏感的全细胞电流3。测量
- 零电压电极(V m)和电流电极(V E)通过调整V M和V E的电极电位偏移按钮注意:该电阻应为1-2MΩ的测量V m和0.5电极-1MΩ的电流注入电极。
- 将卵母细胞放入浴室在靠近电压感测电极。注意:在任何这些步骤转移不要破坏卵母细胞。用巴斯德吸管转移的卵母细胞。为了避免损坏卵母细胞吸管的边缘应该由火焰已经变得十分迟钝。
- 刺穿OO与两个微电极轻轻核细胞。
- 设置的保持电位在放大器至-60 mV和打开图表记录器。打开含有溶液中的氨氯吡咪(2μM)。注:当前应约0±0.5μA。较大的泄漏电流指示泄漏刺穿。因此,这些卵母细胞应予以拒绝。此外,在阿米洛利(2μM)的存在下测得的漏电流应在αβγ-WT表达卵母细胞的那些αβγ突变ENaC的测定表达卵母细胞相似。这表明该突变不影响该信道的阿米洛利敏感性。
- 开始录制。如果有必要调整增益。
- 后测得的电流达到一个稳定的平台,改为阿米洛利免费的解决方案。注:在当前的痕迹向下偏转电流对应于内向电流,正电荷即运动( 钠离子)从细胞外侧面进入细胞。
- AF之三的电流达到平稳状态(后〜60秒),切换灌流回含阿米洛利解决方案。后的卵母细胞的电流达到初始基线电流,关闭电压钳,轻轻撤出的电极。
- 以允许质膜再密封在穿刺的部位,将卵母细胞在96孔板中含有100〜150微升蛋白酶自由ND96溶液的一个孔中。
- 5分钟后,转移到卵母细胞含有溶液的蛋白酶或无蛋白酶的对照溶液在30分钟温育时间。注:该温育时间取决于蛋白酶和所研究的通道。
- 经过孵育步骤重复电流测量(见3.2和以下)。注:这是可能的孵化蛋白酶溶液后测定> 90%的卵母细胞。
4,生物素含量
- 选择并在双目显微镜下丢弃有缺陷的卵母细胞。注:使用注射编卵母细胞来自同一批次的电流测量和对生物素化的实验。
- 保持生物素在室温下它在实验中使用前至少20分钟。
- 准备解决方案:ND96和ND96包含适当的蛋白酶。通过标记它们并简要地燃烧自己的提示,以避免卵母细胞的损伤准备巴斯德吸液管。注:在这里,蛋白酶糜蛋白酶2微克/毫升ND96使用。对待每一个组一个单独的吸管,避免解决方案的交叉污染。
- 填充一个6孔板的每个孔用2.5ml控制ND96 ND96或含有蛋白酶在RT。然后存每孔30的卵母细胞,并培育他们为在室温30分钟。注:对于后续的程序它来保持样品在冰上在任何时候都非常重要。乃于4℃下进行所有离心步骤
- 填充新的6孔板的每个孔用2.5ml ND96(各组需要3个孔的洗涤步骤),并权衡的生物素。注:2.5毫克生物素p呃井(1毫克/毫升)是必需的。溶解的生物素在25毫升生物素化缓冲液(配方见表1)生物素化缓冲液( 即 25毫克生物素(10组)。
- 各组卵母细胞转移到一个充满良好用2.5ml ND96。卵母细胞转移到连续两个额外井ND96洗刷掉任何剩余的蛋白酶。孵化的卵母细胞5分钟,在ND96。
- 转移的卵母细胞成孔含有2.5毫升生物素溶液并孵育它们温和搅拌('摇动')为15分钟。注:最小化传输ND96用移液管,以避免稀释的生物素溶液中。
- 将每个组的卵母细胞的成井含2.5毫升淬灭缓冲液(配方见表1)停止生物素化反应。然后,传送每个组卵母细胞成还含有2.5毫升淬灭缓冲液孵育5分钟,温和搅拌的第二井。
- 移除受损或死亡的卵母细胞。注意:请选择以下程序相同数量每组卵母细胞。
- 各组卵母细胞转移到1.5 ml塑料离心管中。注:最小化的转移淬灭缓冲液的量。
- 随后,通过在1ml裂解缓冲液将它们通过一个27号针头裂解的卵母细胞(配方见表1),补充有蛋白酶抑制剂。
- 离心裂解液10分钟,在1500×g下。
- 吸出上清液,并将其转移至含有0.5%的Triton-X-100和0.5%NP40 1.5 ml离心管中。倒掉剩余的沉淀。注意:将上清液含有生物素化的质膜蛋白和非生物素化的细胞内蛋白质。
- 孵育微量离心管20分钟,在冰上。反复涡流在此期间在管完全溶解在NP40和Triton-X-100的蛋白质。
- 离心机100微升每卵母细胞群琼脂糖珠为3分钟,在1500×g下。之后,离心从珠粒溶液中除去上清液,洗涤三次,用裂解缓冲液中平衡的珠子用缓冲液。
- 移液管加入100μl的洗涤珠子到含有制备在4.13以允许生物素化的蛋白质的珠的结合蛋白质 - 去污剂溶液各离心管中。
- 孵育离心管带头顶旋转O / N在4°C。
- 离心机的离心管为3分钟1,500×g的。然后将上清液转移到新管中。注意:细胞内蛋白不用生物素标记。上清液可被储存在-20℃。不要吸出珠。
5,检测ENaC的裂解片段在通过蛋白质印迹分析细胞表面
- 用裂解缓冲液洗涤珠粒3次,并加入100μl的2×SDS-PAGE样品缓冲液中。注:样品可以储存在-20°C或立即进行免疫印迹分析准备。
- 熬samples 5分钟,在95℃,然后发生管置于冰上。
- 离心样品为3分钟,20,000×g离心并吸取上清到一个新的离心管。注:此上清液中含有生物素化的质膜蛋白的卵母细胞的细胞表面上。
- 分析30微升上清通过Western blot检测细胞表面,调查裂解片段。
- 使用适当的凝胶(8%,10%,12%,这取决于研究的裂解片段的分子量)通过SDS-PAGE(十二烷基硫酸钠聚丙烯酰胺凝胶电泳)分离生物素化的蛋白。
- 通过半干印迹的蛋白质转移到聚偏二氟乙烯(PVDF)膜上。
- 探测膜与针对人γENaC的特异性抗体针对在C-末端的表位(参见图3和13)。
- 使用辣根过氧化物酶标记的山羊抗兔抗体作为二抗体。
- 检测化学发光信号。
结果
调查丝氨酸蛋白酶纤溶酶是否可激活的ENaC-介导的电流,从个人ENaC的表达卵母细胞中的ΔIAMI之前和之后30分钟温育在无蛋白酶(对照)的卵母细胞( 图2A)或含有纤维蛋白溶酶溶液( 图测定2B)使用双电极电压钳技术( 见图1)。暴露于纤维蛋白溶酶增加ΔI 阿米里测量每一卵母细胞。与此相反,在对照实验中,孵育30分钟在无蛋白酶溶液ENaC的表达卵母细胞具有可忽略的影响( 图2C,D)。因此,通过使用这种方法的ENaC-介导的电流的刺激纤溶酶可以被检测到。
为了研究突变后的ENaC-介导的电流的激活,以及推定的切割位点的影响,在信道解理,胰凝乳蛋白酶对WT-ENaC的效果是与该上相比突变的ENaC与突变prostasin和纤维蛋白溶酶切割位点(γRKRK178AAAA; K189A)。糜蛋白酶通道活化以及ENaC的外观的酶切产物在细胞表面的时间过程是通过使用不同的蛋白酶的孵育时间( 图4A)的影响。它表明,该突变体通道的延迟,并降低ENaC的介导的电流通过胰凝乳蛋白酶的激活。这是由较低分子量的γENaC裂解的67 kDa的对应于完全裂解的亚单位片段的延迟外观并联。使用γENaC抗体针对在C-末端的表位( 图3)检测裂解的片段。这种方法途径证明的ENaC介导电流的蛋白水解激活的时间进程关联与67 kDa的γENaC裂解产物在细胞表面的外观( 图4 B,C)。这支持的概念蛋白水解裂解通道和通道激活13之间的因果关系。此外,通过结合电流测量和γENaC片段的检测在细胞表面也表明了该突变的切割位点在功能上是相关的蛋白水解途径的活化。

图1。确定对ENaC的蛋白酶的异源表达在非洲爪蟾的刺激作用的过程蟾卵母细胞。的ENaC活性的估计通过测量阿米洛利敏感的全细胞电流分量ΔIAMI。
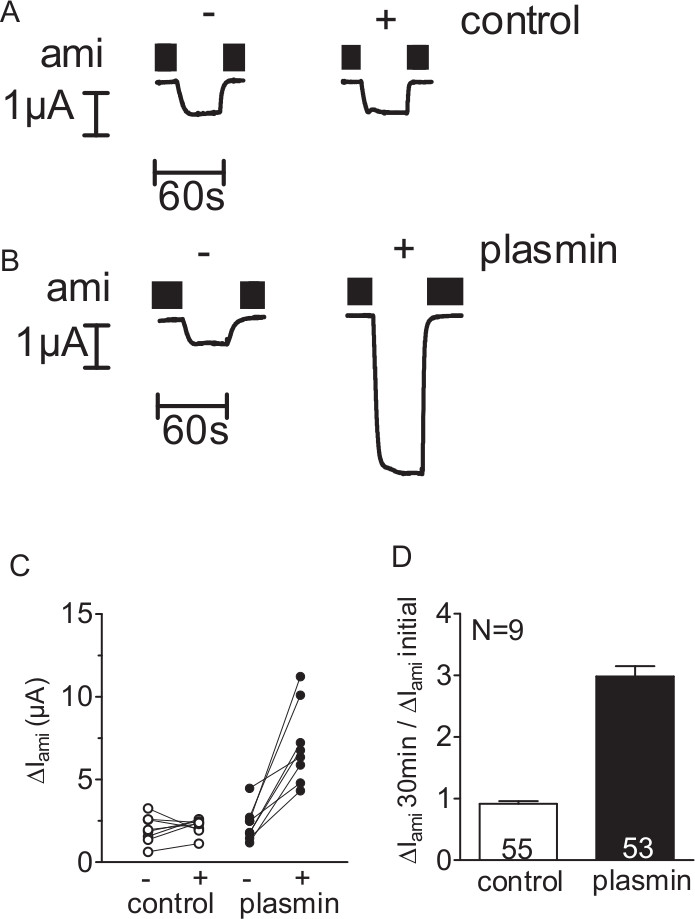
图2。溶栓刺激的ENaC介柯伦变性人卵母细胞中表达ENaC的。 (AD)的卵母细胞表达人ENaC的在无蛋白酶溶液(对照)或含有纤维蛋白溶酶(10微克/毫升)的溶液中温育30分钟。要确定ΔIAMI前( - )和之后(+)孵化,卵母细胞钳制在-60 mV的电位(A,B)四代全细胞从一批卵母细胞电流的痕迹。阿米洛利(AMI)是存在于浴中的溶液,以专门抑制ENaC的由黑条所指示的(C)来自个体的卵母细胞中获得的数据点用线连接起来。类似的实验的(D)的概要如图C.列代表上ΔIAMI相对刺激效应计算为ΔIAMI的孵育30分钟(ΔIAMI 30分钟),以初始ΔIAMI(ΔIAMI初始)孵育前测后测得的比值。列内的数字表示测量的单个卵母细胞的数目。N表示的卵母细胞的不同批次的数量。 (这个数字已经被修改[Haerteis 等人2012Ĵ根生理学 140,375-389,DOI:10.1085/jgp.201110763])
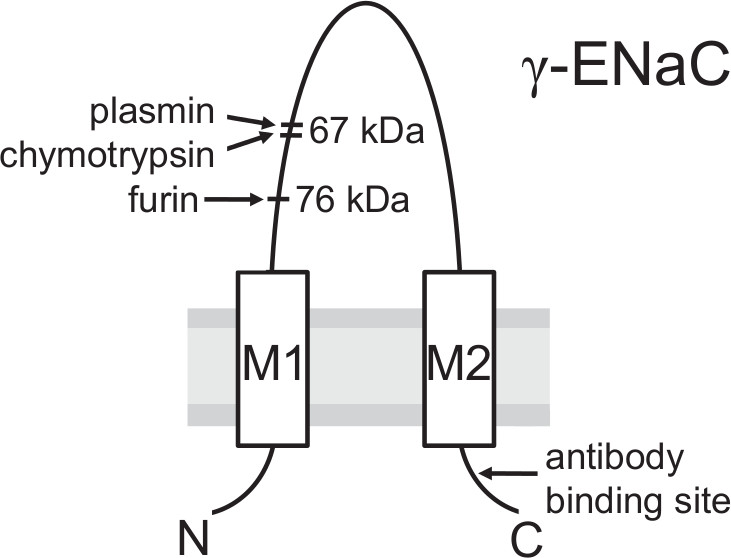
图3模型的γENaC亚基显示切割位点的蛋白水解活性和所用的抗体的结合位点的蛋白水解切割位由高尔基体相关的弗林蛋白酶转化为成熟的ENaC重要的生物合成途径之前的通道到达质膜。后可在细胞表面用生物素化的方法和抗体,该抗体针对在γ-亚单位的C-末端的表位来检测裂解由弗林蛋白酶一个76 kDa的片段。在蛋白水解EN举足轻重的最后一步的aC激活可能发生在质膜,其中γENaC是由胞外蛋白酶( 如纤溶酶或胰凝乳蛋白酶)的区域中远端的弗林蛋白酶位点产生一个67 kDa的裂解片段切下。 (这个数字已经被修改[Haerteis 等人2012Ĵ根生理学140,375-389,DOI:10.1085/jgp.201110763])

图4:诱变两个纤溶酶(K189)和prostasin切割位点(RKRK178)延迟的ENaC-介导的电流的激活和通道的γ-亚单位的67 kDa的裂解产物的外观,卵母细胞表达的WT(空心符号)和γRKRK178AAAA; K189A突变ENaC的通道(封闭符号)孵育在无蛋白酶溶液(对照),30分钟或5,30,或60分钟中含有糜蛋白酶(2微克/毫升)的溶液(A)要确定ΔIAMI之前和之后孵化,卵母细胞钳制在-60 mV的电位。圆圈代表ΔIAMI后5测量,温育60分钟(ΔIAMI分钟),以初始ΔIAMI(ΔIAMI初始)孵育前测定比30,或。每个数据点表示在四个不同批次22-24个人卵母细胞测得的平均ΔIAMI(BD)在平行于ΔIAMI,生物素化的γENaC的在细胞表面表达,经SDS-PAGE分析的检测。 γENaC与针对人γENaC的C-末端表位的抗体进行检测。三印迹类似于如图B或D。对于每个车道时,S显示从一批卵母细胞代表性的印迹。(CE)密度分析在76 kD的(空心柱)和67 kD的(灰色柱)的区域检测ignals进行测定和标准化为检测到的总信号的总和。N表示卵母细胞的不同批次的数量。 点击这里查看大图。
讨论
在这个手稿方法论的办法,成功地应用于研究的ENaC蛋白酶的激活内在机制描述8,13。已确立的非洲爪蟾卵母细胞表达系统用于功能性表达的ENaC。 ENaC的功能评估与传统的双电极电压钳技术。位点定向诱变被用于识别功能上相关的蛋白酶切割位点。在平行的电生理测量进行生物素化实验使人们有可能相关的ENaC的外观的酶切产物在细胞表面与蛋白水解当前激活。当前激活的时间过程和蛋白裂解片段在细胞表面的出现之间的相关性支持的蛋白水解途径的激活的概念。
双电极电压钳记录需要邻的穿刺ocyte有两个微电极。通常是在一个单独的卵母细胞仅执行一次该过程。然而,它以去除微电极可行的初始全细胞电流记录,不会对卵母细胞明显受损后。的确,在质膜处impalements的部位出现在几分钟之内重新密封。从而,完成了第一双电极电压钳测量后,就可以在卵母细胞从双电极电压钳设置的实验流室转移到微量离心管或96孔板中充满的阱小体积的试验或对照溶液。此后,相同的卵母细胞可以转移回流动室中,可以再次刺穿以进行第二两电极电压钳测量。值得注意的是,ENaC的-介导的电流变化不大时,卵母细胞保持在控制溶液中的第一和第二测量之间。与此相反,孵育在含有蛋白酶溶胶的卵母细胞第一次测量之后ution导致增加的ENaC-介导的电流在所述第二测量( 图2)。这一发现表明蛋白水解通道激活。
进行两个独立的电流测量在单个卵母细胞的优点是在卵母细胞可暴露于两次测量的时间在小体积的试验溶液的可变长度之间的蛋白酶或其它药理学试剂。使用代理这是昂贵的和/或不可用数量大, 如纯化的蛋白酶制剂时,这是非常重要的。代理的有限可用性可能使由于大容量的需要,用于连续表面灌流的卵母细胞以每分钟几毫升的流速试验溶液不可能(或负担不起)使用它们在连续的两电极电压钳记录。此外,连续的两电极电压钳测量是通过众所周知的Phenom不限自发通道破败冷的哀嫩也描述了ENaC的15。与此相反,露出的卵母细胞来测试两个不同的测量值之间的解决方案长达一个小时或更一般不会造成问题(参见图4A)。最后,在相同的卵母细胞进行两次连续的测量允许的药物作用配对观测。这具有超过从卵母细胞(蛋白酶处理和载体处理的)的两个单独的组配对的测量的优点,因为它降低了的卵母细胞中,通常在离子通道表达观察到的高可变性的问题。与配对的观察和对数据归一化到所述第一测量的可能性,需要每个实验组较少的卵母细胞中表现出药理活性剂的显著作用。数据的归一化也可以很容易地总结从卵母细胞用不同的离子通道的表达水平,因此不同的基准电流( 图2D的不同批次的数据)。显然,对照实验是必要的这一方法,以证明所关心的离子通道活性保持稳定在媒介物处理的对照卵母细胞从第一到第二测量( 见图2)。
以证明蛋白水解当前激活与ENaC的外观相关的酶切产物在细胞表面,生物素化的方法最初是由Harris 等人所述。9都可以使用。这个过程(详见协议部分和图4中示出)被改编以证明通道,暴露于蛋白酶和ENaC的介导电流的后续激活是通过裂解片段的依赖于时间的外观并联。生物素化的方法还允许在细胞表面的整体增加或减少膜蛋白的分析。因此,这种方法是合适的,调查蛋白酶和其他药业的效果当信道插入macological代理到质膜或在通道检索。此外,生物素化的质膜蛋白的Western印迹分析可检测的蛋白片段( 例如,蛋白水解ENaC的片段)或改变其可以是功能上相关的糖基化模式的。
总之,相结合的方法来研究的蛋白酶上的ENaC-介导的全细胞电流的刺激作用和表现出与ENaC的发生相关的酶切产物在细胞表面可以是用于范围广泛的应用中是有用的。特别是,这些方法可能适用于解决有关其他离子通道,转运或跨膜受体( 如蛋白酶激活受体PAR灯)的调节类似的问题。
披露声明
The authors have nothing to disclose.
致谢
The expert technical assistance of Céline Grüninger, Christina Lang, Sonja Mayer, and Ralf Rinke is gratefully acknowledged. We thank Dr. Morag K. Mansley for carefully reading the manuscript. This project was supported by a grant of the Deutsche Forschungsgemeinschaft (Grant SFB 423: Kidney Injury: Pathogenesis and Regenerative Mechanisms, to C. Korbmacher), grants of the Interdisziplinäres Zentrum für Klinische Forschung (to S. Haerteis and M. Krappitz), the ELAN program (to S. Haerteis) of the Friedrich-Alexander-Universität Erlangen-Nürnberg, and the University Library of Erlangen-Nürnberg.
材料
| Name | Company | Catalog Number | Comments |
| Bath Clamp Headstage for OC-725C-V | Warner Instrument Corporation | - | |
| Cold light source - Schott KL 1500 LCD | Schott | #SCOC150200EU | brightness 4; mechanical aperture: D; color temperature: 3000 K |
| E Series Electrode Holder (Str, Vent, Ag Wire, 1.2 mm) | ADinstruments | #ESW-F10v | |
| left micromanipulator; MM-33L | Warner Instrument Corporation | #64-0055 | |
| LIH 1600 - computer interface | HEKA | - | |
| magnetic valve system (ALA BPS-8) in combination with a TIB14 interface (HEKA) | ALA Scientific Instruments, HEKA | - | |
| OC-725C amplifier for two-electrode voltage-clamp recordings | Warner Instrument Corporation | - | |
| P-97 FLAMING/BROWN Micropipette Puller | Sutter Instruments | - | heat=550; velocity=22; time=200 |
| right micromanipulator; MM-33R | Warner Instrument Corporation | #64-0056 | |
| Series Electrode Holder (45°, Vent, Handle, Ag Wire, 1.2 mm) | ADinstruments | #E45w-f10vh | |
| STAT 2 IV Gravity Flow Controller | Conmed | #P-S2V-60 | |
| vacuum generator ejector SEG - for suction to remove bath solution | Schmalz | - | |
| Material | |||
| INFUJECT 60ml pump syringes for solutions | Braun | #22050 | |
| Injekt-F for lysing the oocytes | Braun | #9166033V | |
| standard wall borosilicate tubing with filament | Sutter Instruments | #BF150-86-10 | outside diameter: 1.50 mm; inside diameter: 0.86 mm; length: 10 cm |
| Reagent | |||
| complete, Mini, EDTA-free protease inhibitor cocktail tablets | Roche Applied Science | #11836170001 | |
| EZ-Link Sulfo-NHS-Biotin | Thermo Scientific | #21217 | |
| Horseradish peroxidase-labeled secondary goat anti-rabbit antibody | Santa Cruz Biotechnology | #sc-2004 | |
| NeutrAvidin Agarose | Thermo Scientific | #29200 | Neutravidin-labeled agarose beads |
| NP40 (Nonidet P-40) | Sigma-Aldrich | #I8896 | |
| Roti-Load 1 (2× SDS-PAGE sample buffer) | Carl Roth | #K929.2 | |
| SuperSignal West Femto Chemiluminescent Substrate for detection of chemiluminescent signals | Thermo Scientific | #34095 | |
| Triton-X-100 | Sigma-Aldrich | #T8787 | |
参考文献
- Kleyman, T. R., Carattino, M. D., Hughey, R. P. ENaC at the cutting edge: regulation of epithelial sodium channels by proteases. The Journal of Biological Chemistry. 284, 20447-20451 (2009).
- Rossier, B. C., Stutts, M. J. Activation of the epithelial sodium channel (ENaC) by serine proteases. Annu Rev Physiol. 71, 361-379 (2009).
- Poirot, O., Vukicevic, M., Boesch, A., Kellenberger, S. Selective regulation of acid-sensing ion channel 1 by serine proteases. The Journal of Biological Chemistry. 279, 38448-38457 (2004).
- Vukicevic, M., Weder, G., Boillat, A., Boesch, A., Kellenberger, S. Trypsin cleaves acid-sensing ion channel 1a in a domain that is critical for channel gating. The Journal of Biological Chemistry. 281, 714-722 (2006).
- Clark, E. B., Jovov, B., Rooj, A. K., Fuller, C. M., Benos, D. J. Proteolytic cleavage of human acid-sensing ion channel 1 by the serine protease matriptase. The Journal of Biological Chemistry. 285, 27130-27143 (2010).
- Ossovskaya, V. S., Bunnett, N. W. Protease-activated receptors: contribution to physiology and disease. Physiological reviews. 84, 579-621 (2004).
- Garcia-Caballero, A., et al. Activation of the epithelial sodium channel by the metalloprotease meprin β-subunit. Channels (Austin. 5, 14-22 (2011).
- Haerteis, S., et al. Proteolytic activation of the epithelial sodium channel (ENaC) by the cysteine protease cathepsin-S. Pflügers Archiv: European Journal of Physiology. 464, 353-365 (2012).
- Harris, M., Firsov, D., Vuagniaux, G., Stutts, M. J., Rossier, B. C. A novel neutrophil elastase inhibitor prevents elastase activation and surface cleavage of the epithelial sodium channel expressed in Xenopus laevis oocytes. The Journal of Biological Chemistry. 282, 58-64 (2007).
- Passero, C. J., Mueller, G. M., Rondon-Berrios, H., Tofovic, S. P., Hughey, R. P., Kleyman, T. R. Plasmin activates epithelial Na+ channels by cleaving the γ-subunit. The Journal of Biological Chemistry. 283, 36586-36591 (2008).
- Svenningsen, P., et al. Plasmin in nephrotic urine activates the epithelial sodium channel. Journal of the American Society of Nephrology : JASN. 20, 299-310 (2009).
- Patel, A. B., Chao, J., Palmer, L. G. Tissue kallikrein activation of the epithelial Na channel. American Journal of Physiology. Renal Physiology. 303, (2012).
- Haerteis, S., Krappitz, M., Diakov, A., Krappitz, A., Rauh, R., Korbmacher, C. Plasmin and chymotrypsin have distinct preferences for channel activating cleavage sites in the γ-subunit of the human epithelial sodium channel. The Journal of General Physiology. 140, 375-389 (2012).
- Chraibi, A., Vallet, V., Firsov, D., Hess, S. K., Horisberger, J. D. Protease modulation of the activity of the epithelial sodium channel expressed in Xenopus oocytes. The Journal of General Physiology. 111, 127-138 (1998).
- Volk, T., Konstas, A. A., Bassalay, P., Ehmke, H., Korbmacher, C. Extracellular Na+ removal attenuates rundown of the epithelial Na+-channel (ENaC) by reducing the rate of channel retrieval. Pflügers Archiv: European Journal of Physiology. 447, 884-894 (2004).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。