Method Article
C.의 생체 Neuronal 칼슘 이미징에서 elegans
요약
작은 투명 몸, 잘 문서화 neuroanatomy 및 의무 유전자 기술과 시약의 호스트로, C. elegans를위한 이상적인 모델 유기체를 만들어 생체 내 neuronal 영상. 여기 유전자 인코딩 형광 칼슘 지표를 사용하여 그대로 어른이 동물에서 단일 신경 세포 이미징을 설명합니다.
초록
선충류 웜 C. elegans는 생체에서 상대적으로 단순하고 저렴한 비용으로 neuronal 이미징을위한 이상적인 모델 생물이다. 작은 투명 몸과 간단한 잘 특징 신경계의 손상 동물에서 확인하고 신경 세포의 형광 이미징 할 수 있습니다. 동물의 생리 기능에 미치는 영향을 최소화와 간단한 고정 기법은 오랜 시간 경과 영상 할 수 있습니다. 이러한 cameleon 1 GCaMP이 같은 유전자 인코딩 칼슘 민감한 fluorophores의 개발은 세포 생리학과 neuronal 활동을 모두 관련된 neuronal 칼슘의 생체 이미징에 수 있습니다. 특정 뉴런에서 이러한 fluorophores을 표현 수많은 유전자 변형 종자는 쉽게 사용할 수 있습니다 또는 잘 구축 된 기술을 사용하여 구축 할 수 있습니다. 여기, 우리는 GCaMP와 cameleon를 사용하여 생체 내에서 단일 신경 세포 내 칼슘 역학을 측정하기위한 세부 절차를 설명합니다. 우리는 장점과 disadvant을 논의모두 세뿐만 아니라 샘플 준비 (동물 고정) 및 이미지 분석의 다양한 방법. 외상성 레이저 손상 신경의 생리적 칼슘 응답을 측정 cameleon를 사용하여 외부 전기 분야 2 특정 뉴런의 감각 반응)를 측정하는 GCaMP를 사용하여 : 1) 마지막으로, 우리는 두 실험의 결과를 제시한다. 다음과 같은 칼슘 이미징 기술은 C.에 광범위하게 사용됩니다 elegans와는 유전 적 배경에서 자유롭게 이동하는 동물, 동시에 여러 뉴런과 비교 측정으로 확장되었습니다. C.는 elegans 기술 단순성과 비용의 다른 모델 시스템을 통해 장점과 생체 neuronal 이미지에 대한 강력하고 유연한 시스템을 제공합니다.
서문
여기 C.의 생체 칼슘 이미징에 대한 실질적인 방법을 제시 elegans의 뉴런. 높은 신호 대 잡음 비율 유전자 인코딩 칼슘에 민감한 fluorophores의 개발은 C.하게 neurophysiology과 활동의 측정을위한 비교적 간단하고 비용 효율적인 시스템을 elegans. 우리 이미징는 일반적으로 사용 가능한 fluorophores의 폭 넓은 분야 형광 이미징을 사용하여 표준 복합 현미경으로 이루어집니다. 우리는 각각의 강점과 약점을 토론, 다양한 fluorophores 서로 다른 샘플 준비를 채용 몇 가지 기술을 제시한다. 데이터는 후 두 예를 들어 실험에서 제공됩니다. 여기에서 설명한 기술에 훌륭한 추가 리소스가 WormBook, "영상 뉴런과 근육의 활동"R. 커로 (에서 찾을 수 있습니다 http://www.wormbook.org ) 3.
geneti의 두 가지 주요 클래스켈리 인코딩 형광 칼슘 기자는 일반적으로 C.에 사용됩니다 elegans : 단일 채널 GCaMP과 걱정 기반 cameleon. 우리는 방법을 설명하고 각에서 생성 된 데이터에 대한 예를 표시합니다.
GCaMP는 주변 칼슘 농도에 민감 수정 그린 형광 단백질 (GFP)을 기반으로합니다. 이것은 calmodulin에 의해 칼슘의 바인딩이 효율적으로 형광등 확인이로 GFP 분자을 제공되도록 GFP의 융합과 높은 칼슘 친 화성 단백질 calmodulin에 의해 달성된다. 이 fluorophores의 최근 발전은 칼슘 수준의 생리적 범위와 ~ 95 밀리 초 상승 시간 및 ~ 650 밀리 초 감소 시간 4 합리적으로 빠른 반응 속도론 이상의 형광 강도의 최대 500 % 증가로 뛰어난 신호 크기를 생성합니다. 비교적 짧은 기간 (분) 동안이 대형 신호는 낮은 해상도 영상을 허용 (낮은 배율)와, 잘 행동 INIT 부여 할 수 있습니다ial 기준 측정, 연속 기준선 또는 비교 측정의 필요성을 깨뜨릴.
Cameleon은 두 개의 독립적 인 채널이나 파장 1 비교 ratiometric 측정을 생성하는 걱정 기반의 형광가되는 장점이 있습니다. 이 calmodulin 단백질로 연결 두 개의 별도 fluorophores (시안과 노란색 발광 형광 단백질, CFP 및 YFP)으로 구성되어 있습니다. 단지는 CFP을 자극 푸른 빛 (440 nm 정도)으로 조명하고 있습니다. 칼슘의 바인딩은 YFP (수용체)에 CFP (기증자)에서 형광 공명 에너지 전송 (걱정) 증가와 CFP 방사 (480 nm 정도)가 감소하고 YFP 방사 (535 nm 정도) 증가하는 원인이 서로 가깝게 fluorophores을 제공합니다 . 상대 칼슘 수준은 YFP / CFP 강도의 비율로 측정됩니다. Cameleon의 동력학은 ~ 1 초의 상승 시간과 ~ 3 초 5 붕괴 시간을 가지고 생체로 측정 GCaMP,보다 느린 있습니다. 그러나,oppositely 이동 신호의 비율은 신호의 크기를 증가시키고 인해 형광 농도, 모션 또는 초점 드리프트 및 표백의 변화에 가능한 유물의 번호를 보상.
유전자 인코딩 형광 기자 exogenously 관리 프로브와 C.와 함께 필요한 샘플 준비의 대부분을 백지화 elegans 작은 투명한 몸은 간단한 넓은 필드 형광을 사용하여 손상 동물에서 이미지 할 수 있습니다. 샘플 준비의 주요 기술 과제는 안전하게 동물을 고정하는 것이 있습니다. 다른 일반적으로 사용되는 기술 장점과 단점 각각의 숫자가 있습니다. 동물을 마비하는 약리 에이전트를 사용하면 쉽게 구현할 수 있으며, 수 (Levamisole, 점유 근육 조직을 일으키는 일반적으로 6 데 사용되는 cholinergic 작용제) 한 준비에서 여러 동물의 장착. C. elegans는 물리적으로 장착하여 고정 할 수 있습니다뻣뻣한 10% 아가로 오스 7, 8 있습니다. 동물의 생리 기능에이 최소화 미치는 영향은 장기 이미징 (시간) 여러 동물의 복구를 할 수 있지만 더 기술적으로 어렵습니다. 이러한 기술 모두 동물 (이는 커버 슬립 이하)에 물리적으로 액세스를 제한하기 때문에 특정 실험 자극 (예 : 빛, 온도, 전기장 또는 레이저 손상 등)와 함께 사용할 수 있습니다. 이러한 화학 물질의 접촉이나 관리와 같은 물리적 인 액세스가 필요합니다 자극에 대한 많은 연구가 성공적으로 C.이 붙은 것 장소에 elegans (수의학 등급 접착제를 사용하여) 9. 이 기술적으로 더 도전이며, 하나의 동물 준비하고 동물 복구를 허용하지 않습니다. 마지막으로, 다수의 마이크로 유체 장치는 물리적 C.을 억제하는 고용 한 elegans은, 동물 생리를 보존 자극 (장치 설계에 따라 다름) 대부분의 유형에 대한 노출을 허용하고하면 동물의 신속한 교류 및 복구를 사용할 수 있습니다 10, 11. 그러나 microfluidics는 디자인, 제조 및 구현에 추가 기술 기술과 기능을 필요로합니다. 고정 동물 활동 및 자극에 반응은 일반적으로 감각과 interneurons로 측정 할 수 있습니다. 모터 뉴런의 활동 움직이는 동물의 이미지에 대한 더 많은 정교한 기술을 필요로합니다. 여기 약리 paralyzation와 치열한 아가로 오스와 고정의 두 가장 간단한 기술을 채용 자세한 방법을 제시합니다.
여기에 제시된 방법은 C.의 neuronal 활동 및 세포 생리학을 측정하는 데 사용할 수 있습니다 elegans. 우리는 각각의 예를 들어 주 : 외부 전기장에 ASJ 신경의 감각 응답을 측정 할 수 GCaMP 사용하고, 신경 세포의 레이저 손상 생리 칼슘 응답을 측정 cameleon을 사용합니다. 이러한 예는 fluorophores의 두 유형의 장점과 단점을 보여 시스템이 가능합니다 무엇을 보여줍니다.
프로토콜
1. 광 설치
- epifluorescence 이미징 기능으로 표준 복합 현미경을 사용합니다. 우리는 Intensilight HG의 조명기와 니콘 이클립스 티-U 역 현미경을 사용합니다.
- 최고의 이미지 및 신호 품질에 대해 높은 배율, 높은 수치 조리개 목표를 사용합니다. 우리는 일반적으로 니콘 X60 1.4 NA 오일 침적 목표를 사용합니다. 어떤 경우에는 그것은 형광 및 신호 강도의 표현 수준에 따라 (X40, X20) 낮은 배율을 사용할 수 있습니다.
- 이러한 이미지 감도를 극대화하고 배경 소음을 최소화 할 수있는 ANDOR 클라라 카메라로 CCD 카메라를 냉각 높은 감도를 사용합니다.
- 단일 색상 fluorophores은 형광의 특정 파장을위한 설정 표준 현미경 형광 필터를 사용하십시오. GCaMP 사용에 대한 표준 GFP 필터는 525 나노 미터에서 488 나노 미터와 배출에 여기에 최적화 된 설정합니다. 더 이상 광학 수정이 필요하지 않습니다.
- 등 cameleon 등 ratiometric fluorophores, 들어, 동일한 이미지가 동시에 두 개의 서로 다른 파장에서 캡처 할 수 있도록 이중 이미징 시스템을 사용합니다. 이것은 카메라에 듀얼 이미지 나란히을 투영하여 수행됩니다. 광 등급 브레드 보드에 기본 광학 구성 요소를 사용하여이 작업을 수행하는 간단한 설정은 그림 1에 도시된다. 그것은으로 구성되어 있습니다 :
- 440 ± 20 나노 미터 여기 필터와 455 nm의로 설정 현미경 필터는 긴 이색 성 거울을 전달합니다.
- 즉시 현미경 이미징 포트 (카메라 CCD 센서는 일반적으로 앉아있는 곳) 이외의 초기 이미지 평면에 배치 이미지 마스크. 이 기능은 카메라 센서의 절반 만이 채울 수 있도록 시야를 제한합니다. 두 이미지를 나란히 예상되고 날카로운 이미지 테두리의 첫 번째 이미지 평면 결과와 겹치는에이 마스크를 배치.
- 첫 번째 릴레이 렌즈는 멀리 t에서 하나 초점 거리를 설정그는이 빛을 collimates 있도록 초기 이미지 평면.
- (<515 nm 정도, 시안) 다른 전송하면서 한 가지 색상을 (> 515 nm 정도, 노란색) 반사 두 개의 이미지 파장 또는 채널로 빛을 분할 이색 성 거울.
- 추가로 특정 이미지 파장 (485의 시안 ± 535 40 나노 미터 및 노란색 ± 30 nm 정도)로 전송 빛을 제한 방출 필터 (밴드 패스 필터),
- 이 CCD 카메라에서 두 번째 이미지 평면에 빛을 refocuses 있도록 빔 경로에 배치 번째 릴레이 렌즈 (각 채널에 대해 하나).
- 거울과 두 번째 이색 성 거울의 한 쌍은 두 이미지가 재결합하는 등의 빔 경로를 지휘하고 카메라 CCD 센서에 나란히을 예상하고 있습니다. 그림 4A는 결과 이미지의 예를 보여줍니다.
- 초기 광학 정렬 : 고 대비 imag과 광학의 설정 및 정렬을 시작낮은 배율 렌즈와 전송 폭 넓은 분야 조명 조명을 (현미경 슬라이드에 그려진 검은 sharpie이 잘 작동)를 사용하여 전자. 현미경 oculars을 통해 집중 이미지를 가져와 후 사용할 현미경 포트로 전환. 높은 빛 조명은 초기 초점 평면 (현미경 포트 이외의 몇 cm)에 색인 카드에 이미지를 볼 수 있습니다. 빔 경로의 첫 번째 릴레이 렌즈 (C)를 놓고는 초기 초점 비행기에서 한 초점 거리이며, 빔 경로 (예 : 직접 빔 경로에 중심) 편향되지 않고 빛을 collimates 있도록. 보기의 절반 필드를 제한하고 이미지에서 날카로운 보더를 생성 조정 첫 번째 초점 평면에서 마스크를 놓습니다. 그림 1b와 같이 빔 경로가 테이블 표면에 평행하게 유지하고 두 개의 평행 한 경로를 나란히에서 실행되도록 거울과 필터 (D, E, G)를 배치합니다. 센터 두 번째 릴레이 각각의 빔 경로의 렌즈 (F)와카메라 CCD 센서가 될 것입니다이었다 배치 색인 카드에 초점에 이미지를 가져 길을 따라 앞뒤로으로 이동합니다. 올바르게 수행되면 두 이미지는 현미경 oculars 및 기타 카메라 포트 parfocal해야합니다. 마지막 위치에 카메라를 배치하고 정렬을 조정.
- 미세 조정 광학 정렬 : 미세 조정 광학 정렬에 CCD 카메라가 본 이중 이미지를 사용합니다. 고 대비 이미지를 사용하여 최종 정렬 높은 배율로 전환, 낮은 배율로 시작합니다. 반사 이미지 (그림 1B에 노란색 채널)의 필드의 나머지 절반을 충당하기 위해 X와 Y. 위치에서 카메라를 이동하여 뷰의 카메라의 필드의 반을 충당하기 위해 전송 이미지 (그림 1B에서 시안 채널) 위치 의 빔 경로에있는 마지막 두 거울 (G)를 조정하여 볼 수 있습니다. 빔 경로를 따라 앞뒤로 각 채널에 대해 두 번째 릴레이 렌즈를 이동하여 초점을 최적화합니다. 왼쪽 경우그대로 광 설치가 안정적 만 희귀 한 미세 조정 조정을 필요로한다.
2. 샘플 준비 및 데이터 수집.
- Caenorhabditis 유전학 센터 (CGC) 또는 기타 소스에서 관심의 신경 세포에서 칼슘 민감한 형광을 표현 동물을 취득. 또는 유전자 변형 동물은 표준 C.를 사용하여 구성 할 수 있습니다 elegans 기술. 단세포 표현은 (때로는 바람직하지 여러 뉴런이 조사 할 경우, 12 참조) 이미지와 여러 셀에서 측정 쉽게 분리 될 수있는만큼 필요하지 않습니다. 형광의 transgene이 게놈에 통합되지 않은 경우, 표현의 중요한 변화가 동물에서 동물로 발생할 수 있습니다. 이 경우, 형광 해부 현미경을 사용하여 높은 표현 수준 동물을 preselecting하면 신호 대 잡음 비율을 증가하고 측정을 향상시킵니다. 형광 표현 수준 옛 성은쉽게 실험에 필요한 인수 매개 변수 아래 카메라로 이미징 할 충분한 될 D.
- 실험실 테이프 두 조각으로 간격을두고 두개의 유리 슬라이드 사이의 용융 아가로 오스의 작은 방울을 눌러 원하는 고정 기술 (아래 2.3 참조)에 필요한 아가로 오스 패드를 확인합니다. 필요한 경우, 아가로 오스 패드는 동물을 장착하기 전에 유리 커버 슬립으로 이전 할 수 있습니다. 그림 2를 참조하십시오.
- C.를 고정 다음 방법 중 하나를 사용하여 이미지에 대한 elegans :
- 약리 Paralyzation : 2퍼센트 아가로 오스 패드 (2.2에 패드를하기 전에 용융 아가로 오스로 혼합)에 0.05 % Levamisole을 추가합니다. 패드에 5-10 동물을 선택하고 커버 슬립을 다룹니다. 그 위치에 개최 커버 슬립의 모서리에 왁스 혼합물의 소량 (50 % 파라핀 왁스 50 % 석유 젤리)를 적용합니다. B에 효과 동물을 위해 Levamisole 5-10 분 허용아직 완전히 ecome.
- 스티프 아가로 오스의 고정 : C. elegans는 물리적으로 굳어 10% 아가로 오스 패드와 0.05 μm의 직경 폴리스티렌 나노 입자를 사용하여 고정 할 수 있습니다. 2.2을 10 %로 아가로 오스 패드 (중량 NGM 버퍼에서 10 % 아가로 오스)합니다. 패드의 상단에 구슬 솔루션 ~ 3 μl (볼륨의 NGM에 1시 10분 폴리스티렌 마이크로)를 추가합니다. 신속 5-10 C.을 선택 패드에 구슬 솔루션의 수영장에 부드럽게 elegans는 커버 슬립을 다룹니다. 그 위치에 개최 커버 슬립의 모서리에 적용 용융 왁스를 사용합니다. (이 기법에 대한 자세한 내용은뿐만 아니라 이전 주피터 제 8 조 등 7 참조)
- 접착 : C. elegans는 동물의 한면에 적용 수의학 학년 접착제의 소량을 사용하는 곳에서 접착 할 수 있습니다.
- 마이크로 유체 장치는 : 많은 마이크로 유체 장치는 물리적 C.를 개최하도록 설계되었습니다 이미징을위한 장소에 elegans.
- 현미경에 준비된 슬라이드를 삽입하고 원하는 신경 세포에 초점을 맞 춥니 다. 그것은 C.을 찾기 위해 종종 가장 쉬운 것입니다 시야 조명과 낮은 배율을 사용 elegans. 그런 다음 높은 배율과 찾아 특정 신경 세포에 초점을 형광 이미지로 전환.
- 자극 : 특정 자극에 대한 neuronal 응답 (조명, 전기 분야, gustatory 및 후각 신호, 온도 등) 필요하다면, 자극 장치는이에 동물에 투여 될 수있다하는 현미경 설치로 설계되어야 이미징 동안 샘플 준비.
- 현미경 CCD 카메라를 사용하여 이미지를 획득. 노출 시간과 여기 광 수준은 concordantly 적은 시간 해상도로 더 이상 노출 시간을 필요로하는 약한 신호, 기준 신호와 형광의 표현 수준에 따라 달라집니다. 우리는 일반적으로 ~ 300 밀리 초 노출 시간을 사용합니다.
- 개별적으로 또는 TI 등의 이미지를 취득영화 나 저속 촬영. 때문에 C. elegans의 뉴런은 일반적으로 속도가 느린 활성화 역학 (즉, 그들은 나트륨 기반의 액션 잠재력을 결여)을 표시 ~ 1 초에 느린 프레임 속도는 종종 신경 세포 역학을 측정하기에 충분합니다. 취득 가격까지 ~이이 약한 형광에 필요한 통합 시간에 의해 제한 될 수 있지만 초당 90 프레임이 사용되었습니다. 고정 준비가 안정적이고 프레임 속도 느린 경우 하나의 뉴런의 개인 영화는 쉽게 몇 분 (~ 5-10 분) 이상 확장 할 수 있습니다.
3. 데이터 분석
- ImageJ와 NIS 요소를 포함한 역동적이고 ratiometric 분석 기능을 볼 수있는 다양한 형광 이미징 소프트웨어 패키지의 다수가 있습니다. 우리는 관심 선택한 지역에 걸쳐 평균 형광 신호를 측정 할 수있는 간단한 사용자 정의 MATLAB 프로그램을 사용합니다.
- 개별 이미지 (또는 유지 시간 경과 영화에 대한완벽 계속) 이미징 뉴런과 배경 측정을위한 별도의 인근 지역 내 관심 (ROI)의 지역을 선택합니다. 듀얼 이미지의 각 유사한 투자 수익 (ROI)과 배경 영역을 선택 ratiometric 이미지를하십시오.
- 시간 경과 영화 내 이미징 뉴런의 완만 한 움직임이 자동으로 다양한 객체 추적 방식을 사용하여 수행 할 수 있습니다 각 프레임에서 투자 수익 (ROI)을 선택하기 위해 추가 분석이 필요합니다. 우리 프로그램은 거친 경계가 (모든 프레임에 관심 객체를 포함한)을 수동으로 선택하고 독립적 인 배경 영역이 선택되어있는 영화의 모든 이미지의 압축 이미지를 표시합니다. 첫 번째 프레임의 경우 투자 수익 (ROI)를 수동 경계 지역 내에서 선택됩니다. 이후의 각 프레임에 대한, 프로그램은 올바른 크기 (즉, 수동 첫 번째 프레임의 투자 수익 (ROI)과 같은 픽셀의 같은 수의)의 투자 수익 (ROI)을 생성하기 위해 경계 지역 내에서 가장 밝은 픽셀을 선택합니다. 이미지 위치 objec관심 t이 프로토콜은 각 프레임에 대한 합리적인 투자 수익 (ROI)을 선택 경계 지역 내에서 주변 배경을 한 후 충분히 밝아 있습니다.
- 각 프레임에 대한 형광 신호, F는, 투자 수익 (ROI)의 평균 픽셀 강도 마이너스 배경 지역의 평균 강도로 계산됩니다. Ratiometric 값은 -0.65 / 두 신호의 비율 (YFP - YFP 배경) (CFP-CFP 배경)로 계산됩니다. 0.65의 요인은 fluorophores에 의존뿐만 아니라 (이 값은 일반적으로 cameleon 설정을위한 ~ 0.6입니다) 사용 된 특정 필터 설정됩니다 YFP 채널에 CFP 채널의를 통해 출혈에 대한 보상.
- , ΔF / F = (F (t)-F O) / F O : 각 프레임에 대한 상대적인 칼슘 수준은 첫 번째 프레임 (또는 프레임 시리즈)에서 측정 초기 기본 값으로 정규화 된 강도의 변경 률로 계산됩니다 F (t)는 시간 t와 F O에서 형광입니다초기 기본 값입니다.
- 전지 본체를 선택 투자 수익 (ROI)이 가장 강한 가장 강력한 신호를 생성하지만 신경 프로세스를 따라 투자 수익 (ROI)에서 신호를 선택하고 측정 할 수도 있습니다.
4. 문제 해결
- 표백 : 여기 빛에 노출 형광의 표백 및 노출 수준에 따라 달라집니다 신호의 꾸준한 감소로 표시되어 발생할 수 있습니다. Ratiometric 측정이 보상하는 데 도움이됩니다. 한 파장의 표백 그러나 선택적는 여전히 (빨리 다음 일반적으로 CFP 표백제 YFP) 발생할 수 있습니다. 표백 노출 시간 및 / 또는 여기 강도를 (조명 경로의 중간 밀도 필터) 감소하여 빛 노출 수준을 감소 발생합니다. 필요한 경우, 하나는 모의 실험을 실행 (같은 여기에 노출되어 있지만 neuronal 자극)과 신호 붕괴의 일정한 시간을 정량화하여 표백 보상 할 수 있습니다.
- 고정 : 간단한 이미지 분석을 위해는 동물이 녹음 기간 동안 상대적으로 남아 중요합니다 여기에 설명 된 C.이 있습니다. elegans는 녹화시 이동이를 가능성이 가장 높은 만들기, 빛 노출과 실험 자극에 반응. 축삭 과정에서 측정 특히 완만 한 움직임 측정에 상당한 소음을 소개 할 수 있습니다. Ratiometric 분석은 전지 본체에서 어느 정도 및 측정보다 강력한 아르 이러한 효과를 완화하는 데 도움이됩니다. 조심스럽게 실행과 고정 절차의 상세는 아직 완전히 동물이 높아집니다.
- 배경 선택 : 배경 지역의주의 선택이 성공적으로 이미지 분석을위한 필요합니다. 배경 지역이 합리적으로 균일하고 이미징 뉴런 후 어두워해야합니다. 그것은 충분히 이미징 뉴런에서 분산 된 광 (그리고 따라서 픽업 신호)을 방지하기 위해 제거해야합니다. 우리는 균일 한 지역 20-5를 찾을 수투자 수익 (ROI)에서 0 μm 대부분의 경우에 잘 작동합니다.
- Ratiometric 광학 : 영상 광학의 올바른 정렬은 분명 이중 이미지를 생성 중요합니다. ratiometric 이미징을위한 상업 현미경 첨부 파일을 사용할 수 있습니다. 대안 기술은 각각에 대해 별도의 이미지를 기록하면서 빠르게 방출 파장 사이를 전환 할 빠른 필터 휠을 사용하여 빠른 연속 이미지를 고용하는 것입니다.
- Ratiometric 분석 : 분석 여기에 설명이 투자 수익 (ROI)을 통해 평균을 가진 강력한 신호를 생성하는 비교적 간단한 방법입니다. 그것은 투자 수익 (ROI)을 선택 없지 밝은 물체가 필요합니다. 보다 정교한 ratiometric 분석은 정확하게 형광 비율은 픽셀에서 픽셀을 계산 될 수 있다는 등의 듀얼 이미지를 정렬하고 매핑하여이 가능합니다.
결과
여기 두 개의 서로 다른 실험의 결과를 제시한다. 첫 번째는 형광 칼슘 기자 광학 그대로 C.에 neuronal 활동을 모니터링하는 데 사용할 수있는 방법에 대한 좋은 예를 제공 정의 된 외부 자극에 특정 감각 신경 세포의 반응을 측정 할 GCaMP 고용 elegans. 두 번째는 cameleon이 과도 세포 내 칼슘이 때문에 칼슘 생리학은 생체 내에서 단일 세포 내에서 측정 할 수있는 방법을 설명하는 특정 레이저 손상에 대한 응답으로 신경 세포 내에서 발생 측정하는 고용합니다. 각 측정의 기술적 인 측면 개별 평가 결과를 상세하게 소개하고 설명합니다에 초점을합니다. 종종 시간 (자극에 대해 각 시점에서의 평균 응답으로 계산) 또는 특정 측정 항목 (예 : 응답의 평균 진폭 등) 동안의 평균 응답은 많은 시련에서 계산됩니다. 일반적으로 10-20 시련이 받아 들일 수있는 평균 측정을 생성 할 필요가 있지만, t 아르그 숫자는 응답의 고유 다양성에 따라 달라집니다. 여기에 논의 된 실험에 대한 이러한 데이터 분석은 12 및 13에서 찾을 수 있습니다.
감각 응답 GCaMP 측정 : 강한 외부 전기장 (≥ 3 V / cm), C.를 받게 elegans 적극적으로 정확한 이동 운동과 필드의 마이너스 극으로 크롤링합니다. 우리는 이전에이 electrotactic 행동은 주로 동물의 머리 12에있는 왼쪽 및 오른쪽 ASJ의 뉴런, amphid 감각 뉴런에 의해 중재되어 나타났다. 이 응답을 시각화하기 위해 우리는 GPA-9 발기인 아래의 왼쪽과 오른쪽 ASJ의 뉴런에 특별히 GCaMP3을 표현 형질 변형을 사용. 두 가지 커버 용지 (같은 절차에 설명 된) 사이에 끼어 0.05 % Levamisole를 포함하는 아가로 오스 패드를 사용하여 이미지에 동물을 고정. 전기 자극은에 맞는 사용자 지정 구축 이미징 챔버를 사용하여 관리 된역 니콘 티 현미경의 무대 (12 참조). 간단히 말하자면, 커버 슬립 준비가 커버 슬립을 통해 이미지 아래 및 표준의 목표에 대한 액세스를 허용하는 작은 플라스틱 챔버에 구멍 위에 (아래 웜면 포함)에 위치해 있습니다. 챔버는 0.25 MM NaCl로 가득 50 밀리미터 글리세롤 버퍼와 전기장 자극은 챔버의 끝을 기다리는 두 백금 전극을 사용하여 적용되었습니다. 위의 설명한 바와 같이, 하나의 ASJ 뉴런은 CGaMP가 X100 1.4 NA 오일 침적 목표 및 표준 GFP 필터 설정을 사용하여 이미지로 한 표현. 세 가지 시련 각 지속 10 초 (그림 3)에 대한 외부 3 V / cm 전기장에 동물을 subjecting 동안 시간 경과 영화는 80 초 (1 프레임 / 초, 300 밀리 초 노출 시간)에 인수되었다. 우리는 위에서 설명한 이미지 분석을 사용하여 전지 본체에서 형광 강도를 측정했습니다. 동영상은 실험이 진행되는 동안 움직임과 초점 드리프트 모두 약간의 오류가 표시됩니다. 세인트GCaMP 신호의 rength 그러나 1 및 제 3 자극 모두에 대응 형광의 큰 ~ 250 % 증가를 보여주는 강력한 남아있다. 두 번째 자극의 결과는 실질적으로 neuronal 응답에 변화를 시연 감소합니다. 표백은 일관된 기준 수준으로 돌아 의해 분명 같은 최소한의 것입니다.
세포 칼슘 생리학의 Cameleon 측정 : 외상성 세포의 부상은 생리적 응답 명령하는 세포의 운명 (즉, 세포의 죽음을 대 수리 공정의 개시)에 필수적인 역할을 뉴런 내에서 과도 큰 칼슘을 트리거합니다. 우리는 개인 C.을 잘라야 femtosecond 레이저를 사용하여 생체이 손상 유발 응답을 측정 할 수 있습니다 elegans 뉴런 14 동시에 cameleon YC3.60 13, 15을 사용하여 세포의 칼슘 신호를 측정하는 동안. 여섯 mechanosensory 뉴런 (아래에 cameleon YC3.60을 표현 동물멕-4 발기인) 등의 절차에 설명 된 10% 아가로 오스와 폴리스티렌 나노 입자를 사용하여 고정되었습니다. 우리는 절차에 설명 된 CFP와 YFP 형광 채널에서 모두 신호를 기록하기 위해 듀얼 이미징 광학을 고용. 우리는 하나의 ALM 신경을 이미지로하고 레이저 축삭 ~ 전지 본체 (그림 4A)에서 20 μm의 타겟. 축삭은 이미징 목적 (레이저 수술에 대한 자세한 내용은 13 참조)하여 축삭을 따라 대상 지점에 초점을 맞춘 적외선 레이저를 펄스 femtosecond에서 불 수있는 간단한 (<1 초) 노출에 의해 절단되었다. 레이저 수술과 ratiometric 분석을 사용하여 계산 칼슘 수준을 수행하는 동안 400 밀리 초 노출 시간과 프레임 매 3 초에서 시간 경과 이미지는 320 초에 대해 기록했다.
신호는 전지 본체 (그림 4B)에서와 컷 포인트 (그림 4C)의 5 μm에서 축삭 세그먼트에 대해 개별적으로 측정 하였다. 그림은 C 모두 표시FP와 YFP 농도뿐만 아니라 그 결과는 비율을 초조해. 전지 본체의 측정은 잘 CFP가 빠르게 감소하고 YFP이 t = 0 초 (빨간색 화살표)에서 레이저 손상에 대한 응답으로 증가와 함께 행동하고 있습니다. 근처에 기본 수준으로 다시 떨어지기 전에 ~ 90 초에 지속되는 ratiometric 신호 (ΔF / F)의 즉각적인 ~ 200 % 증가이 발생합니다. 표백은 일관된 기준에서 분명 같은 최소한의 것입니다.
절단 점에 가까운 축삭 세그먼트에서 형광의 로컬 금액은 신호를 복잡하게, 실험이 진행되는 동안 다릅니다. 레이저 수술은 축삭을 severs하고 간단히 형광 탈출을 일시적으로 그 지역의 세포질 농도를 감소 할 수 있습니다 막이 파열. 이 그림 4C에서 YFP 추적의 초기 감소와 시간 t = 0 초 및 t = 6 초, 그림 4A에서 YFP 이미지의 손상 지점 근처의 축삭 세그먼트의 비교에서 분명하다. 라에적이 시간 포인트는 절단 끝은 더 지역화 된 형광 및 강도의 증가의 결과로, 지속적인 회복의 일환으로 부어. 이 그림 4C와 시간 t = 0 초 및 t = 270 초, 그림 4A에서 CFP 이미지의 축삭 세그먼트의 비교에서 천천히 증가 CFP 추적에서 가장 분명하다. 그러나 이러한 변화는 둘 다 채널에 영향을 미치는 안달 비율이 효과적으로 보상. 그 결과 측정 신호에 즉시 ~ 150 % 증가 (ΔF / F) ~ 90 초에 가까운 기준에 극적으로 회복 한 후 150 초에서 추가 작은 보조 응답 전지 본체와 비슷한 응답을 보여줍니다. 이 신경 세포에서 신경 세포와 수술로 수술마다 다를 수 있습니다 다른 효과에서 칼슘 신호를 분리하는 것은 매우 어려울 것 같은 ratiometric 분석이 측정에 중요합니다. 축삭 신호는 형광을 주차 할 수 주로 인해 전지 본체 신호와 비교하여 더 많은 노이즈가좁은 축삭에있는 작은 투자 수익 (ROI).

1 그림. 기본 설정 및 ratiometric 광학. A) 사진이 역 복합 현미경과 ratiometric 이미징 광학 구성된 실험 설정을 보여줍니다. B) ratiometric 걱정 기반의 측정에 필요한 이미징 광학을 도시 개략도. 이미지가 CCD 배열에 나란히 예상되고 두 파장 또는 채널로 나뉩니다.

그림 2. 샘플 준비. C. elegans는 이미징을위한 얇은 아가로 오스 패드에 장착되어 있습니다. A) 아가로 오스 패드가의 작은 방울을 sandwiching에 의해 만들어진이 현미경 사이의 용융 아가로 오스는 실험실 테이프 두 조각. B) 동물은 아가로 오스 패드에 전송과 네 모서리의 각에서 왁스의 작은 금액으로 장소에서 개최 coverslip과 덮여 간격으로 나와야 슬라이드.

그림 3. GCaMP 예를 들어 데이터입니다. GCaMP 신호 / 전기 분야 (녹색 성분) 오프에 교대에 응답 할 ASJ 신경 세포의 세포 시체에서 생체에 기록 ΔF / F. 두꺼운 회색 선은 외부 전기장 (3 V / cm)가 동물에 적용 기간을 나타냅니다. 스케일 바는 형광 강도 100 % 증가를 나타냅니다.
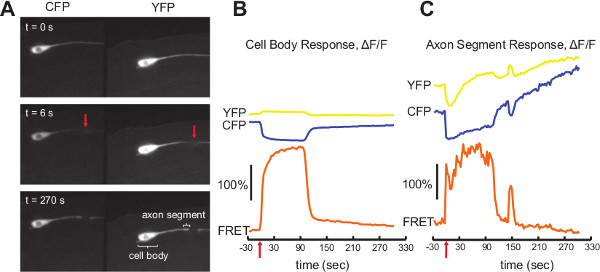
4 그림. Cameleon 예제 데이터입니다. A) 세 별도의 프레임은 이중 이미지를 보여주는전지 본체에서 축삭 20 μm의 레이저 수술 전후 ALM 신경을 볼 수 있습니다. 중앙 패널에 빨간색 화살표는 절단 지점을 나타냅니다. 하단 패널은 전지 본체와 B와 C의 신호를 생산 축삭 세그먼트를 보여줍니다. B) 레이저 수술 (빨간색 화살표). C) cameleon YC3 전후 ALM 신경의 전지 본체에서 측정 cameleon YC3.60 신호 0.60 신호는 레이저 수술 전후의 컷 포인트 5 μm 이내에 축삭 세그먼트에서 측정. 옐로우 흔적 파란색 흔적이 결과로이 비율을 안달 아르 CFP 신호와 오렌지 흔적을 나타냅니다 YFP 신호를 나타냅니다. 모든 시간은 레이저 수술 시간을 기준으로합니다. 스케일 바 형광 강도의 100 % 증가를 나타냅니다. 큰 그림을 보려면 여기를 클릭하십시오 .
토론
유전자 인코딩 칼슘 표시기가 널리 C.에 활용 된 elegans 신경 생물학. 많은 그룹은 전기 필드에 ASJ 응답과 함께 시연와 같은 외부 자극에 차 감각 뉴런의 반응을 공부하고 이러한 기술을 고용하고 있습니다. 눈에 잘 띄는 예는 기계 터치의 감각, 특정 화학 물질, 온도 및 전기 분야 12, 16-19 등이 있습니다. interneuron 및 근육 세포의 활동은 자극에 대한 응답으로, 동물 행동의 통제에 모두 모니터링하고 있습니다. 이러한 연구의 대부분은이 기술에게 부분적으로 억제하거나 자유롭게 움직일 동물뿐만 아니라 동시에 여러 뉴런에서 기록 뉴런에서 녹화를 사용하려면 이미지 인식 및 추적 기술을 사용하여 더 단계를 추진해 왔습니다. 추가 연구는뿐만 아니라 여기에 제시된로 neuronal 손상 13, 20 응답으로 칼슘 생리학의 다른 측면을 조사했습니다더 이상 시간의 척도가 21 neuronal 퇴행.
특정 실험을 설계에서 일반적으로 사용되는 칼슘 기자와 동물 고정에 대한 대체 기술의 각은 신중하게 고려되어야합니다. 고정 기술은 이러한 동물에 대한 물리적 인 액세스가 필요, 영상 또는 높은 처리량을 필요에 따라 동물을 복구 할 수있는 기능 등의 기술적 인 측면에 의해 결정됩니다. 다른 형광 칼슘 기자뿐 아니라 특정 장점과 단점이 있습니다. GCaMP은 간단 단일 채널 이미지 분석을 고용하고 큰 신호 대 잡음 비율이 많은 상황은 적용합니다. 반면에 Cameleon 더 복잡한 이미징 및 분석을 필요로하지만, 그 결과 ratiometric 측정 가능성이 큰 유물과 상황에서 중요한 수 있습니다. 예를 들어, 형광의 양 (레이저 손상의 예에서와 같이)에 변동은 오랜 기간 동안 발생할 수 있습니다(시간) 표현 수준의 변화로 인해. 추가 듀얼 이미징 전략은 (또는 물리적으로 연결) RFP의 형광과 공동 표현 GCaMP으로도 가능합니다. 걱정을 기반으로하는 것은 아니지만 실시간 기본 측정과 같은 빨간색 채널을 사용하는 동안이 현대적인 GCaMP 변종의 넓은 동적 범위를 활용합니다.
그것은 그 많은 2 채널 영상 현미경 시스템 및 분석 소프트웨어는 종종 더 비싼 반면, 여기에 설명 된 집 건축 시스템을 구축하기를 꺼려 연구자에게 매력적 될 수있는 상업적으로 사용할 수 있습니다 유의하는 것이 중요합니다. 상업 듀얼 이미징 시스템 (DualView2-DV2, Photometrics)는 일반적으로 우리의 집 건축 시스템과 유사한 광학을 사용할 수 있지만 표준화 된 정렬 절차 단일 현미경 첨부 파일 내에 포함되어 있습니다. 또한, 빠른 필터 교환 시스템 (람다 DG-4/DG-5 또한, 셔터 악기) 2 색 채널의 급속한 실시간으로 연속 영상 무선 인터넷 접속을 허용추가 이미징 광학을 thout뿐만 아니라 고가이며 필터 교환 및 카메라 수집 사이의 정확한 동기화를 필요로합니다.
요약하면, C. elegans는 생체 이미징 시스템으로 장점 번호를 제공합니다. 유전자 인코딩 fluorophores은 종종 세포 구체적이며 주입 또는 외인성 fluorophores의 관리에 대한 필요성을 제거 할 수 있습니다. C. elegans 광학 접근성이 쉽고 유지 관리 비용 대비 효과가 그대로 동물에서 이미지는 복잡한 절개 나 neuronal 배양을 필요로 세포 생리학을 보존하지 않습니다 수 있습니다. 또한, C. elegans이 가능 유전자 시약 및 잘 알려진 기술의 큰 번호와 유전자 분석을 위해 훌륭한 기능을 갖추고 있습니다. 물론 단점 시스템에있어, 주요 관심사는 아마도이 invertebrate이되기도하는. 또한, fluorophores 칼슘 농도 아침 일찍의 상대적 변화를보고절대 값 및 측정의 시간 해상도보다 연구는 형광의 역학뿐만 아니라 약한 형광 신호의 필요한 통합 시간 모두에 의해 제한 될 수 있습니다. 마지막으로, 동안 칼슘 neuronal 활동의 중요한 부분이며, fluorophores을 신호하는 것은 바로 같은 electrophysiological 기술을 측정 막 전압 잠재력을보고하지 않습니다. 그럼에도 불구하고, 여기 C.를 발표 절차에 의해 도시 elegans는 neuronal 이미징 연구의 광범위한 매력 비교적 간단하고 비용 효율적인 시스템입니다.
공개
제작자들은 더 경쟁 금융 이익이 없다는 점 선언합니다.
감사의 말
몇몇 사람들은이 문서에 설명 된 작업에 기여 하였다. CVG는 실험 설정을 구축하고, LS, SHC, 그리고 CVG는 실험을 수행했습니다. CVG와 SHC는 원고를 썼다. 모든 저자는 이후 개정 과정에 참여했고 원고의 최종 사본을 승인했습니다. 우리는 GCaMP 변형에 대한 폴 Sternberg 감사드립니다. 이 작품에 사용 된 일부 선충류의 긴장은 연구 자원에 대한 NIH 국립 센터 (NCRR)의 지원을 받고 있습니다 Caenorhabditis 유전학 센터 (CGC)에 의해 제공되었다. MATLAB 이미지 분석 프로그램은 18에서 사용되는에서 적응되었습니다. 저자는 보스턴 대학과 매사추세츠 생명 과학 센터에서 지원했다.
자료
| Name | Company | Catalog Number | Comments |
| Eclipse Ti-U inverted microscope | Nikon | ||
| Intensilight HG Illuminator | Nikon | C-HGFI | Fluorescent light source |
| CFI Plan Apo VC 60X Oil | Nikon | ||
| Optical table or 3'X3' optical grade breadboard | Thor Labs | If an optical table is not used an optical grade breadboard on a solid laboratory bench should suffice. | |
| Clara Interline Camera | Andor Technology | High-sensitivity CCD camera | |
| wtGFP Longpass Emission | Chroma Technology Corp. | 41015 | GFP filter set for imaging GCaMP |
| Filter 440 +/- 10 nm | Chroma | D440/20x EX | excitation filter for cameleon |
| Dichroic mirror > 455 nm longpass | Chroma | 455DCLP BS | microscope dichroic for cameleon imaging |
| Dichroic mirror > 515 nm longpass | Chroma | 515DCLP BS | dichroic mirror for cameleon imaging |
| Filter 535 +/- 15 nm | Chroma | D535/30m EM | YFP emission filter |
| Filter 480 +/- 20 nm | Chroma | D485/40m EM | CFP emission filter |
| Lens, 200 mm, Achromat | Thor Labs | AC508-200-A1 | Relay lens for FRET optics (3) |
| Silver broadband mirror | Thor Labs | ME2S-P01 | FRET optics (2) |
| NGM buffer | |||
| Levamisole | Sigma | ||
| Polybead Microspheres | Polysciences, Inc. | 08691-10, 2.5% by volume, 50 nm diameter | polystyrene nanoparticles for C. elegans immobilization |
| Transgenic strain, Strain gpa-9::GCaMP3(in pha-1; him-5 bkg) | Sternberg Lab | Strain PS6388 | |
| Transgenic strain, mec- 4::YC3.60 | Gabel Lab | Strain CG1B |
참고문헌
- Miyawaki, A., Llopis, J., Heim, R., McCaffery, J. M., Adams, J. A., Ikura, M., Tsien, R. Y. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388, 882-887 (1997).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat. Biotechnol. 19, 137-141 (2001).
- Kerr, R. Imaging the activity of neurons and muscles. WormBook. , (2006).
- Tian, L., Hires, S. A., Mao, T., Huber, D., Chiappe, M. E., Chalasani, S. H., Petreanu, L., Akerboom, J., McKinney, S. A., Schreiter, E. R., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875 (2009).
- Reiff, D. F., Ihring, A., Guerrero, G., Isacoff, E. Y., Joesch, M., Nakai, J., Borst, A. In vivo performance of genetically encoded indicators of neural activity in flies. J. Neurosci. 25, 4766-4778 (2005).
- Rand, J. B. Acetylcholine. WormBook. , (2005).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization. PLoS ONE. 8 (1), e53419 (2013).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), e2707 (2011).
- Kerr, R., Lev-Ram, V., Baird, G., Vincent, P., Tsien, R. Y., Schafer, W. R. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4, 727-731 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab. Chip. 7, 1515-1523 (2007).
- Gabel, C. V., Gabel, H., Pavlichin, D., Kao, A., Clark, D. A., Samuel, A. D. Neural circuits mediate electrosensory behavior in Caenorhabditis elegans. J. Neurosci. 27, 7586-7596 (2007).
- Pinan-Lucarre, B., Gabel, C. V., Reina, C. P., Hulme, S. E., Shevkoplyas, S. S., Slone, R. D., Xue, J., Qiao, Y., Weisberg, S., Roodhouse, K., et al. The Core Apoptotic Executioner Proteins CED-3 and CED-4 Promote Initiation of Neuronal Regeneration in Caenorhabditis elegans. PLoS Biol. 10, e1001331 (2012).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neurosci. 7, 30 (2006).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proc. Natl. Acad. Sci. U.S.A. 101, 10554-10559 (2004).
- Kindt, K. S., Quast, K. B., Giles, A. C., De, S., Hendrey, D., Nicastro, I., Rankin, C. H., Schafer, W. R. Dopamine mediates context-dependent modulation of sensory plasticity in C. elegans. Neuron. 55, 662-676 (2007).
- Chalasani, S. H., Chronis, N., Tsunozaki, M., Gray, J. M., Ramot, D., Goodman, M. B., Bargmann, C. I. Dissecting a circuit for olfactory behaviour in Caenorhabditis elegans. Nature. 450, 63-70 (2007).
- Clark, D. A., Gabel, C. V., Gabel, H., Samuel, A. D. Temporal activity patterns in thermosensory neurons of freely moving Caenorhabditis elegans encode spatial thermal gradients. J. Neurosci. 27, 6083-6090 (2007).
- Biron, D., Shibuya, M., Gabel, C., Wasserman, S. M., Clark, D. A., Brown, A., Sengupta, P., Samuel, A. D. A diacylglycerol kinase modulates long-term thermotactic behavioral plasticity in C. elegans. Nat. Neurosci. 9, 1499-1505 (2006).
- Ghosh-Roy, A., Wu, Z. L., Goncharov, A., Jin, Y. S., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Bianchi, L., Gerstbrein, B., Frokjaer-Jensen, C., Royal, D. C., Mukherjee, G., Royal, M. A., Xue, J., Schafer, W. R., Driscoll, M. The neurotoxic MEC-4(d) DEG/ENaC sodium channel conducts calcium: implications for necrosis initiation. Nat. Neurosci. 7, 1337-1344 (2004).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유