Method Article
En imagerie calcique in vivo des neurones en C. elegans
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Avec son petit corps, transparent et documenté neuroanatomie et une foule de techniques génétiques qui se prêtent et réactifs, C. elegans Fait un organisme modèle idéal pour In vivo Imagerie neuronale utilisant relativement simples et peu coûteuses techniques. Nous décrivons ici l'imagerie seul neurone dans les animaux adultes intacts génétiquement codés à l'aide des indicateurs de calcium fluorescentes.
Résumé
Le ver nématode C. elegans est un organisme modèle idéal pour relativement simple, l'imagerie à faible coût neuronale in vivo. Son petit corps transparentes et simples, bien caractérisé le système nerveux permet l'identification et l'imagerie de fluorescence d'un neurone à l'intérieur de l'animal intact. Techniques d'immobilisation simples avec un impact minimal sur la physiologie de l'animal permettent prolongée imagerie time-lapse. Le développement de fluorophores calcium génétiquement encodés sensibles tels que cameleon 1 et 2 GCaMP permettre l'imagerie in vivo de calcium neuronal concernant la physiologie cellulaire et l'activité neuronale. De nombreuses souches transgéniques exprimant ces fluorophores dans des neurones spécifiques sont facilement disponibles ou peuvent être construits en utilisant des techniques bien établies. Ici, nous décrivons des procédures détaillées pour la mesure dynamique du calcium dans un seul neurone in vivo en utilisant à la fois GCaMP et caméléon. Nous discutons des avantages et des disadvantles âges de deux, ainsi que diverses méthodes de préparation des échantillons (immobilisation des animaux) et l'analyse d'image. Enfin, nous présentons les résultats de deux expériences: 1) Utilisation GCaMP pour mesurer la réponse d'un neurone sensoriel spécifique à un champ électrique externe et 2) Utilisation cameleon pour mesurer la réponse physiologique de calcium d'un neurone à l'endommagement laser traumatique. Techniques d'imagerie calcique comme ceux-ci sont largement utilisés dans C. elegans et ont été étendues aux mesures chez les animaux se déplaçant librement, les neurones multiples simultanément et de comparaison entre fonds génétiques. C. elegans présente un système robuste et flexible pour l'imagerie neuronale in vivo avec des avantages par rapport aux systèmes d'autres modèles de simplicité et de coût.
Introduction
Nous présentons ici des méthodes pratiques pour l'imagerie in vivo de calcium dans C. neurones elegans. Le développement de la codés génétiquement sensible au calcium avec une grande fluorophores signal sur bruit rend C. elegans un système relativement simple et rentable pour la mesure de la neurophysiologie et de l'activité. Notre formation d'image est effectuée avec un microscope standard à l'aide d'imagerie à grand champ de fluorescence des fluorophores couramment disponibles. Nous présentons plusieurs techniques employant différents fluorophores et la préparation des échantillons différents, de discuter les forces et les faiblesses de chacun. Les données sont ensuite présentées à partir de deux expériences exemple. Une excellente ressource supplémentaire sur les techniques décrites ici peuvent être trouvés dans WormBook, "Imagerie l'activité des neurones et les muscles" de R. Kerr, ( http://www.wormbook.org ) 3.
Deux grandes classes d'génétiquementment codées reporters fluorescents de calcium sont couramment utilisés dans C. elegans: GCaMP seul canal et FRET à base de cameleon. Nous allons décrire les méthodes et montrer des exemples de données générés par chacun.
GCaMP est basé sur une modification de la protéine fluorescente verte (GFP) qui est sensible à la concentration de calcium environnante. Ceci est réalisé par fusion de la GFP et de la calmoduline de calcium de haute affinité protéine, de telle sorte que la fixation du calcium par la calmoduline de la molécule apporte une confirmation dans la GFP efficace fluorescent 2. Les récents progrès dans ces fluorophores générer taille exceptionnelle du signal avec une augmentation jusqu'à 500% de l'intensité de fluorescence dans une gamme physiologique de la calcémie et de la cinétique relativement rapide de ~ 95 ms de temps de montée et temps de descente ~ 650 msec 4. Sur des périodes de temps relativement courtes (minutes), ces signaux peuvent permettre grandes pour l'imagerie basse résolution (faible grossissement) et, étant donné un sage init amesure de référence ial, nier la nécessité pour base continue ou mesures comparatives.
Cameleon a l'avantage d'être un fluorophore FRET basée sur une mesure qui génère ratiométrique comparaison de deux canaux indépendants ou longueurs d'onde 1. Il se compose de deux fluorophores séparés (cyan et jaune émettant des protéines fluorescentes, CFP et YFP) reliés par une protéine calmoduline. Le complexe est éclairé par la lumière bleue (440 nm) qui excite la PCP. Fixation du calcium apporte les fluorophores se rapprocher, ce qui augmente le transfert d'énergie de fluorescence par résonance (FRET) à partir de la PCP (donneur) de la YFP (accepteur) et provoquer l'émission de la PCP (480 nm) et pour diminuer l'émission YFP (535 nm) pour augmenter . Le taux de calcium relatifs sont mesurés par le rapport de l'intensité de la YFP / PCP. Cameleon cinétique est plus lente que celle de GCaMP, mesurée in vivo pour avoir un temps de montée d'environ 1 s et un temps de décroissance de 3 ~ 5 sec. Cependant,le rapport des signaux en opposition mobiles augmente la taille du signal et pour compenser un certain nombre d'objets possibles à cause de changements de concentration en fluorophore, de mouvement ou de la dérive et de mise au point de blanchiment.
Génétiquement codés rapporteurs fluorescents annuler une grande partie de la préparation des échantillons avec des sondes exogènes administrées et C. elegans petit corps transparent permet l'imagerie chez l'animal intact en utilisant de simples fluorescence large champ. Le principal défi technique dans la préparation des échantillons est donc d'immobiliser les animaux en toute sécurité. Il ya un certain nombre de différentes techniques couramment utilisées chacune avec des avantages et des inconvénients. L'utilisation d'un agent pharmacologique de paralyser les animaux est facile à mettre en œuvre et permet le montage de plusieurs animaux sur une préparation (lévamisole, un agoniste cholinergique qui provoque le tissu musculaire à saisir est généralement utilisé 6). C. elegans peut aussi être physiquement immobilisé par leur montagele raide 10% d'agarose 7, 8. Cet impact réduit sur la physiologie des animaux, permet à long terme d'imagerie (heures) et la récupération de plusieurs animaux, mais est techniquement plus difficile. Ces deux techniques limiter l'accès physique aux animaux (qui sont sous une lamelle) et ne peut donc être utilisé avec certains stimuli expérimentaux (tels que la lumière, la température, champ électrique ou de dommage au laser). Pour les stimuli où l'accès physique est nécessaire, comme le toucher ou l'administration de produits chimiques, de nombreuses études ont réussi à coller C. elegans en place (en utilisant de la colle d'vétérinaire) 9. Ce qui est techniquement plus difficile, est une préparation unique animal et ne permet pas la récupération des animaux. Enfin, de nombreux dispositifs microfluidiques ont été employées que physiquement contre C. elegans, la préservation de la physiologie animale, ce qui permet une exposition à la plupart des types de stimuli (en fonction de la conception du dispositif) et peut permettre l'échange rapide et de récupération des animaux 10, 11. Cependant microfluidique besoin d'autres compétences techniques et des capacités dans la conception, la fabrication et la mise en œuvre. L'activité animaux immobilisés et de relance de réponse peut généralement être mesurée en sensoriels et des interneurones. L'activité des neurones moteurs nécessite des techniques plus sophistiquées d'imagerie chez l'animal en mouvement. Ici, nous allons présenter les méthodes détaillées utilisant les deux techniques les plus simples de la paralysie pharmacologique et immobilisation rigide agarose.
Les méthodes présentées ici peuvent être utilisés pour mesurer l'activité neuronale et la physiologie des cellules de C. elegans. Nous donnons un exemple de chaque: en utilisant GCaMP pour mesurer la réponse du neurone sensoriel ASJ à un champ électrique externe, et en utilisant cameleon pour mesurer la réponse physiologique au calcium endommagement laser d'un neurone. Ces exemples montrent les avantages et les inconvénients des deux types de fluorophores et d'illustrer ce qui est possible avec le système.
Protocole
1. Configuration optique
- Utiliser un microscope composé standard avec des capacités d'imagerie à épifluorescence. Nous utilisons un Nikon Eclipse Ti-U microscope inversé avec un illuminateur Intensilight HG.
- Pour une meilleure qualité d'image et du signal utiliser un fort grossissement, objectif haute ouverture numérique. Nous utilisons généralement un Nikon X60 1.4 Objectif NA immersion dans l'huile. Dans certains cas, il est possible d'utiliser plus faible grossissement (X40, X20) en fonction du niveau d'expression du fluorophore et la force du signal.
- Utilisez une haute sensibilité refroidie caméra CCD, comme une caméra Andor Clara afin de maximiser la sensibilité des images et minimiser le bruit de fond.
- Pour fluorophores d'une seule couleur, utilisez le filtre de fluorescence microscope standard conçu pour régler la longueur d'onde particulière du fluorophore. Pour GCaMP utiliser une norme GFP filtre optimisé pour la excitation à 488 nm et une émission à 525 nm. Aucune autre modification optiques sont nécessaires.
- Pour les fluorophores ratiométriques, comme cameleon, utilisez un système d'imagerie à double tel que des images identiques peuvent être simultanément capturé à deux longueurs d'onde distinctes. Ceci est obtenu en projetant les images doubles côte à côte sur la caméra. Une configuration simple à faire, en utilisant des composants optiques de base sur une planche à pain de qualité optique, est illustrée à la figure 1. Il se compose de:
- Un filtre microscope réglé avec 440 ± 20 nm et filtre d'excitation 455 nm de long passent miroir dichroïque.
- Un masque d'image placé dans le plan image initiale immédiatement à l'extérieur du microscope d'imagerie port (où le capteur de la caméra CCD qui siègent habituellement). Cela restreint le champ de vue de telle sorte qu'il ne remplir que la moitié de capteur de la caméra. Plaçant ce masque les résultats premier plan d'image dans l'image des frontières nettes et sans chevauchement, lorsque les deux images sont projetées côte à côte.
- L'objectif premier relais définir une longueur focale loin de til plan de l'image initiale telle qu'elle collimate la lumière.
- Un miroir dichroïque qui divise la lumière en deux longueurs d'onde d'imagerie ou canaux séparés reflétant une couleur (> 515 nm, jaune) tout en transmettant l'autre (<515 nm, cyan).
- Filtres d'émission (filtres passe-bande) restreignant encore la lumière transmise aux longueurs d'onde d'imagerie spécifiques (cyan à 485 ± 40 nm et jaune à 535 ± 30 nm),
- Les lentilles relais seconde (une par canal) placés dans les trajets des faisceaux de telle sorte qu'il se recentre la lumière à un second plan image à la caméra CCD.
- Une paire de miroirs et un second miroir dichroïque dirige les chemins de faisceaux de telle sorte que les deux images sont projetées recombinés et côte-à-côte sur le capteur de la caméra CCD. Figure 4A montre un exemple de l'image résultante.
- Alignement optique initiale: Lancer l'installation et l'alignement de l'optique avec une imagerie à haut contrastee l'aide d'une lentille de faible grossissement et éclairage en lumière transmise à grand champ (un Sharpie noir tiré sur une lame de microscope fonctionne bien). Amener l'image à focaliser à travers les oculaires du microscope et ensuite commuté sur le port de microscope à être utilisé. Avec un éclairage de lumière élevée afficher l'image sur une fiche au niveau du plan focal initial (quelques centimètres en dehors du port microscope). Placer la lentille premier relais (C) dans le trajet du faisceau de telle sorte qu'il est une distance focale à partir du plan focal initial et collimate la lumière sans dévier la trajectoire du faisceau (par exemple est directement centré dans le trajet du faisceau). Placer le masque sur le premier plan focal, adapté pour restreindre moitié du champ de vision et produire une frontière dans l'image nette. Positionner les miroirs et filtres (D, E, G) de telle sorte que le trajet du faisceau reste parallèle à la surface de la table et se déroule en deux voies parallèles côte-à-côte, comme représenté sur la figure 1B. Centre des lentilles relais secondes (F) dans leurs chemins de faisceaux respectifs etles déplacer d'avant en arrière le long des chemins de mettre les images à mettre l'accent sur une fiche placée étaient capteur de la caméra CCD sera. Si fait correctement les deux images doivent être parfocale avec les oculaires du microscope et caméra ports autres. Enfin placez l'appareil en place et d'affiner l'alignement.
- Alignement Fine Tuning optique: Utiliser la double image vue par la caméra CCD pour ajuster l'alignement optique. Utiliser une image au contraste élevé et de commencer avec grossissement plus faible, le passage à un plus fort grossissement pour l'alignement final. Positionner l'image transmise (cyan canal dans la figure 1B) pour couvrir une moitié de champ de la caméra de vision de la caméra par déplacement de la position X et Y. l'image réfléchie (canal jaune dans la figure 1B) pour couvrir l'autre moitié de la zone de voir par ajustement des deux derniers miroirs (G) dans sa trajectoire de faisceau. Optimiser concentrer en déplaçant la lentille de relais seconde pour chaque canal d'avant en arrière le long de la trajectoire du faisceau. Si elle n'est pasinchangé le système optique doit être stable et ne nécessitent rare ajustement peaufiner.
2. Préparation des échantillons et d'acquisition de données.
- Acquérir les animaux exprimant un fluorophore sensible au calcium dans le neurone d'intérêt à partir du Centre de Caenorhabditis Genetics (CCG) ou d'autres sources. Sinon animaux transgéniques peuvent être construits en utilisant la norme C. techniques elegans. Expression seule cellule n'est pas nécessaire (et parfois pas souhaitable si plusieurs neurones sont à étudier, voir 12) aussi longtemps que les images et les mesures partir de plusieurs cellules peuvent être facilement séparées. Si le transgène fluorophore n'est pas intégré dans le génome, variation significative de l'expression peut se produire à partir de l'animal à animal. Dans ce cas, la présélection des animaux avec des niveaux d'expression plus élevés en utilisant un microscope à fluorescence dissection augmente le rapport signal sur bruit et améliore les mesures. Niveaux d'expression fluorophores need soit suffisante pour être facilement imagée avec l'appareil selon les paramètres d'acquisition requis par l'expérience.
- Faire les coussinets d'agarose nécessaires à la technique d'immobilisation désiré (voir le point 2.3 ci-dessous) en appuyant sur une petite goutte d'agarose fondu entre deux lames de verre espacées de deux morceaux de ruban de laboratoire. Si nécessaire, blocs d'agarose peuvent être transférées à une lamelle de verre avant de monter les animaux. Voir la figure 2.
- Immobiliser C. elegans pour l'imagerie en utilisant une des techniques suivantes:
- Paralysie pharmacologique: Ajouter lévamisole 0,05% à 2% d'agarose (plots de le mélanger dans le agarose fondu avant de faire les plots de 2,2). Choisissez 5-10 animaux sur le tampon et couvrir avec une lamelle. Appliquer de petites quantités de mélange de cire de paraffine chaude (50% et 50% de vaseline) sur les coins de la lamelle couvre-objet pour le maintenir en position. Permettez 5-10 min pour le lévamisole à prendre effet et les animaux à become complètement immobile.
- Stiff Immobilisation Agarose: C. elegans peut être physiquement immobilisé à l'aide raides 10% coussinets d'agarose et 0,05 um de diamètre des nanoparticules de polystyrène. 10% d'agarose faire plots (10% d'agarose dans du tampon NGM en poids) que dans 2,2. Ajouter ~ 3 pl de solution de talon (1:10 en polystyrène NGM microsphères en volumes) au début du tampon. Rapidement, choisissez 5-10 C. elegans dans la piscine de solution de billes sur le tapis et recouvrez doucement avec une lamelle. Utiliser la cire fondue appliquée sur les coins de la lamelle couvre-objet pour le maintenir en position. (Pour plus de détails sur cette technique voir 7 ainsi que d'un article précédent JoVE 8)
- Collage: C. elegans peut être collé en place à l'aide de petites quantités d'adhésif de qualité vétérinaire appliquée sur un côté de l'animal.
- Dispositifs microfluidiques: De nombreux dispositifs microfluidiques ont été conçus pour tenir physiquement C. elegans en place pour l'imagerie.
- Placer les lames préparées sur le microscope et de se concentrer sur le neurone désiré. Il est souvent plus facile de trouver le C. elegans en utilisant un éclairage en fond clair et un faible grossissement. Puis passer à fort grossissement et l'imagerie de fluorescence de trouver et de se concentrer sur le neurone spécifique.
- Stimulus: Si une réponse neuronale à un stimulus spécifique est souhaitée (lumière, champ électrique, les indices gustatifs et olfactifs, température, etc), le dispositif de relance doit être conçu dans la configuration du microscope, de sorte qu'il peut être administré à des animaux dans le préparation de l'échantillon tandis que l'imagerie.
- Acquérir des images à l'aide de la caméra CCD microscope. Les temps d'exposition et le niveau de lumière d'excitation dépend du signal de référence et le niveau d'expression du fluorophore, avec des signaux plus faibles nécessitant des temps d'exposition plus longs avec une résolution temporelle de façon concordante moins. Nous utilisons généralement ~ 300 msec temps d'exposition.
- Acquérir les images individuellement ou en tant que timoi-lapse film. Parce C. neurones elegans généralement afficher une dynamique d'activation lente (c'est à dire qu'ils manquent de potentiels d'action à base de sodium), des cadences relativement lentes de ~ 1 sec sont souvent suffisantes pour mesurer la dynamique des neurones. Le taux d'acquisition jusqu'à ~ 90 images par seconde ont été utilisés, bien que ceux-ci peuvent être limités par le temps d'intégration nécessaire pour la fluorescence est faible. Les films individuels d'un seul neurone peut facilement s'étendre pendant plusieurs minutes (min ~ 5-10) ou plus si la préparation immobilisation est stable et le taux de trame relativement lente.
3. Analyse des données
- Il ya un certain nombre de différents logiciels d'imagerie fluorescentes disponibles avec des capacités d'analyse dynamique et ratiométrique y compris ImageJ et NIS-Elements. Nous utilisons une simple coutume MATLAB programme qui mesure le signal fluorescent moyenne sur une zone d'intérêt sélectionnée.
- Pour les images individuelles (ou time-lapse films qui restentparfaitement immobile), sélectionnez une région d'intérêt (ROI) dans le neurone imagé et une région séparée proximité pour la mesure de fond. Pour sélectionner des images ratiométriques ROI similaire et régions de fond pour chacune des images doubles.
- Un léger mouvement du neurone imagé dans un film time-lapse nécessite une analyse complémentaire pour sélectionner automatiquement le retour sur investissement pour chaque image, ce qui peut être accompli en utilisant de nombreux systèmes de suivi d'objets. Notre programme affiche une image compressée de toutes les images dans le film à partir de laquelle une frontière rugueuse (englobant l'objet d'intérêts dans tous les cadres) est sélectionné manuellement et une région de fond indépendant choisi. Pour la première trame, une ROI est sélectionné manuellement à partir de l'intérieur de la zone limite. Pour chaque trame suivante, le programme sélectionne les pixels les plus clairs dans la zone de limite afin de générer un retour sur investissement de la bonne taille (c'est à dire le même nombre de pixels que la première trame d'emploi ROI). Pour les images, où l'objectift d'intérêts est suffisamment brillante alors le fond environnant dans la région frontière de ce protocole sélectionne un retour sur investissement raisonnable pour chaque trame.
- Le signal fluorescent, F, pour chaque trame est calculée comme l'intensité de pixel moyenne dans la région d'intérêt moins l'intensité moyenne dans la région de fond. Ratiométriques valeurs sont calculées comme le rapport des deux signaux (YFP-YFP fond) / (PCP PCP-fond) -0,65. Le facteur de 0,65 compense purge par le biais du canal PCP dans le canal YFP, qui sera fonction des fluorophores ainsi que l'ensemble filtre particulier utilisé (cette valeur est généralement d'environ 0,6 pour les configurations cameleon).
- Le niveau de calcium par rapport à chaque trame est calculée comme étant la variation en pour cent intensité normalisée à une valeur de référence initiale mesurée à partir de la première image (ou d'une série de trames): AF / F = (F (t)-F o) / F o, où F (t) est la fluorescence à l'instant t et F oest la valeur de base initiale.
- Un retour sur investissement sélectionnant le corps de la cellule génère les signaux les plus forts les plus robustes, mais il est également possible de sélectionner et mesurer des signaux à partir d'un retour sur investissement sur les processus nerveux.
4. Résolution de problèmes
- Blanchiment: Exposition à la lumière d'excitation peut causer un blanchiment du fluorophore et est marquée par une baisse constante du signal qui dépend des niveaux d'exposition. Mesures ratiométrique aider à compenser cela. Cependant sélective de blanchiment d'une longueur d'onde peut encore se produire (en général des agents de blanchiment de la PCP rapide puis YFP). Si blanchiment se réduire le niveau d'exposition de la lumière par la réduction des temps d'exposition et / ou de l'intensité d'excitation (avec filtres de densité neutre dans la voie de l'illumination). Si nécessaire, on peut compenser de blanchiment en cours d'exécution par des essais simulés (avec la même exposition excitation mais aucun stimulus neuronale) et la quantification de la constante de temps de décroissance du signal.
- Immobilisation: Pour l'analyse d'image simple décrite ici, il est essentiel que l'animal reste relativement immobile pendant toute la période d'enregistrement C.. elegans répondre à la lumière d'exposition et les stimuli expérimentaux, ce qui les rend plus susceptibles de se déplacer au moment de l'enregistrement. Un léger mouvement peut introduire un bruit important dans la mesure en particulier lors de la mesure des processus axone. Analyse radiométrique permet d'atténuer ces effets dans une certaine mesure et les mesures du corps cellulaire sont plus robustes. Une exécution soignée et le raffinement des procédures d'immobilisation se traduira par encore complètement les animaux.
- Sélection Contexte: sélection soigneuse d'une région de fond est nécessaire pour l'analyse d'image réussie. Régions d'arrière-plan doit être raisonnablement uniforme et sombre alors le neurone imagé. Il doit être suffisamment éloigné pour éviter la lumière diffusée (et donc un signal de capteur) du neurone imagé. Nous trouvons une région uniforme 20-50 um du ROI fonctionne bien dans la plupart des cas.
- Optique ratiométriques: Corriger l'alignement de l'optique d'imagerie est essentielle pour produire une image claire double. Accessoires de microscope pour l'imagerie ratiométrique commerciaux sont disponibles. Une autre technique consiste à utiliser l'imagerie rapide séquentiel en utilisant une roue de filtre rapide pour passer rapidement entre les longueurs d'onde d'émission tout en enregistrant des images séparées pour chaque.
- Analyse radiométrique: L'analyse décrite ici est une technique relativement simple qui génère des signaux robustes en vertu de moyenne sur un retour sur investissement. Il nécessite un objet lumineux reconnue pour sélectionner le retour sur investissement. Plus sophistiqué d'analyse ratiométrique est possible par la cartographie et aligner avec précision les images doubles telles que le rapport fluorescent peut être calculée pixel par pixel.
Résultats
Nous présentons ici les résultats de deux expériences distinctes. Le premier emploie GCaMP pour mesurer la réponse d'un neurone sensoriel spécifique à un stimulus externe définie, ce qui donne un bon exemple de la façon dont les journalistes de calcium fluorescents peuvent être utilisés pour surveiller optiquement l'activité neuronale dans intacts C. elegans. La seconde emploie cameleon pour mesurer le calcium intracellulaire transitoire déclenché dans le neurone en réponse aux dommages laser spécifique, ce qui illustre comment la physiologie de calcium peut être mesurée dans une seule cellule in vivo. De se concentrer sur les aspects techniques de chaque mesure les résultats d'essais individuels sont présentés et discutés en détail. Souvent, la réponse moyenne au cours du temps (calculée comme étant la réponse moyenne à chaque point dans le temps par rapport à la stimulation) ou une mesure spécifique (comme l'amplitude moyenne de la réponse) sont calculées sur l'ensemble de nombreuses épreuves. Typiquement 10-20 essais sont nécessaires pour générer une mesure moyenne acceptable, mais tson nombre dépendra de la variabilité inhérente de la réponse. Une telle analyse de données pour les expériences présentées ici peuvent être trouvés dans 12 et 13.
GCaMP mesure de la réponse sensorielle: Lorsqu'il est soumis à un fort champ électrique externe (≥ 3 V / cm), C. elegans activement ramper vers le pôle négatif du champ avec le mouvement dirigé précis. Nous avons déjà montré que ce comportement electrotactic est principalement médiée par les neurones ASJ gauche et droite, amphid neurones sensoriels situés dans la tête de l'animal 12. Pour visualiser cette réponse, nous avons utilisé une souche transgénique exprimant GCaMP3 spécifiquement dans les neurones ASJ gauche et à droite par l'AMP-9 promoteur. Nous immobilisé animaux pour l'imagerie utilisant des tampons d'agarose contenant du lévamisole 0,05% en sandwich entre deux lamelles (comme décrit dans les procédures). La stimulation électrique a été administré à l'aide d'une chambre d'imagerie sur mesure qui s'adapte à laplatine d'un microscope inversé Nikon Ti (voir 12). En bref, la préparation lamelle est placée (avec le côté ver le bas) sur un trou dans une petite chambre en matière plastique permettant un accès pour les objectifs ci-dessous et le niveau d'imagerie à travers la lamelle. La chambre a été remplie avec 0,25 mM de NaCl et 50 mM de tampon glycérol et le stimulus de champ électrique appliqué au moyen de deux électrodes de platine le long des extrémités de la chambre. Comme décrit ci-dessus, un seul neurone ASJ exprimer CGaMP a été imagées par un X100 1.4 Objectif NA immersion dans l'huile et le niveau GFP jeu de filtres. Un film time-lapse a été acquis pour 80 secondes (1 image / s, 300 ms de temps d'exposition), tout en soumettant l'animal à un écran externe 3 V / cm champ électrique pendant trois procès distincts d'une durée 10 sec (figure 3). Nous avons mesuré l'intensité de fluorescence au niveau du corps cellulaire en utilisant l'analyse d'image décrite ci-dessus. La vidéo affiche des fautes légères à la fois le mouvement et la dérive accent au cours de l'expérience. La strength du signal GCaMP demeure robuste mais montrant une grande augmentation d'environ 250% de la fluorescence en réponse à la fois le 1 er et 3 ème stimuli. Le résultat des stimuli seconde est considérablement réduit démontrant la variabilité dans la réponse neuronale. Le blanchiment est faible comme en témoigne le retour à un niveau de base cohérente.
Cameleon mesure de physiologie cellulaire de calcium: traumatique des lésions cellulaires déclenche une grande calcium transitoire dans un neurone qui joue un rôle essentiel dans le destin dicter la réponse physiologique cellulaire (mort cellulaire soit par rapport à l'initiation du processus de réparation). On peut mesurer cette réponse aux dommages induits in vivo en utilisant un laser femtoseconde à rompre individuelle C. elegans neurones 14, tandis que la mesure simultanée de signaux calciques cellulaires en utilisant cameleon YC3.60 13, 15. Animaux exprimant cameleon YC3.60 dans les six neurones mécano (sous lamec-4 promoteur), ont été immobilisés en utilisant 10% d'agarose et le polystyrène nanoparticules comme décrit dans les procédures. Nous avons utilisé une optique d'imagerie double pour enregistrer des signaux à la fois de la CFP et YFP canaux de fluorescence comme décrit dans les procédures. Nous imager un seul neurone ALM et laser ciblé l'axone ~ 20 um du corps cellulaire (figure 4A). L'axone a été coupée par une brève (<1 sec) exposition à la lumière d'un laser pulsé infrarouge femtoseconde centré au point cible long de l'axone par l'objectif de reproduction (voir 13 pour plus de détails sur la chirurgie au laser). Time-lapse images à une trame toutes les 3 secondes, avec 400 msec temps d'exposition ont été enregistrées pour 320 s tandis que la chirurgie au laser et les niveaux de calcium calculées en utilisant une analyse ratiométrique.
Signaux ont été mesurés indépendamment sur le corps de cellule (figure 4B) et pour le segment en 5 um axone du point de coupure (figure 4C). Les chiffres montrent à la fois la CPF intensités et YFP ainsi que le rapport qui en résultent FRET. La mesure au niveau du corps cellulaire se comporte bien avec la PCP diminue rapidement et la YFP augmenter en réponse aux dommages laser à sec t = 0 (flèche rouge). Il en résulte immédiatement une augmentation de 200% ~ dans le signal ratiométrique (AF / F) qui se maintient pendant ~ 90 secondes avant de retomber à des niveaux de base près. Le blanchiment est faible comme le montre la ligne de base cohérente.
Dans le segment de l'axone à proximité du point de coupure, la quantité locale de fluorophore varie au cours de l'expérience, ce qui complique le signal. La chirurgie au laser rompt l'axone et rompt brièvement la membrane, ce qui permet fluorophore à s'échapper et à réduire temporairement sa concentration cytoplasmique locale. Cela est évident à partir d'une baisse initiale de la trace YFP à la figure 4C et une comparaison du segment axone près du point de dégâts dans les images YFP aux temps t = 0 s et t = 6 s, la figure 4A. À later points dans le temps, l'extrémité coupée gonfle dans le cadre de sa reprise continue, ce qui entraîne fluorophore localisé plus et une augmentation de l'intensité. Cela est particulièrement évident dans la trace augmente lentement PCP à la figure 4C et une comparaison du segment axonal dans les images de la PCP au temps t = 0 s et t = 270 s, la figure 4A. Cependant, ces variations affectent les deux canaux de manière égale et le rapport FRET compense efficacement. La mesure qui en résulte montre une réponse semblable au corps cellulaire avec un ~ immédiate augmentation de 150% du signal (AF / F), un redressement spectaculaire de base à près de ~ 90 secondes, puis une, plus petite réponse secondaire à ~ 150 sec. L'analyse ratiométrique est essentiel à cette mesure, car il serait extrêmement difficile de séparer le signal de calcium à partir des autres effets, qui peuvent varier considérablement d'un neurone à neurone et de la chirurgie à la chirurgie. Le signal d'axone a plus de bruit par rapport au signal de corps cellulaire en raison principalement de gradateur de fluorescence etle plus petit retour sur investissement au sens étroit axone.

Figure 1. Configuration de base et de l'optique ratiométriques. A) La photo montre le montage expérimental constitué d'un microscope inversé et composé optique d'imagerie ratiométrique. B) Un diagramme schématique illustrant l'optique d'imagerie nécessaires pour les ratiométriques FRET base de mesures. L'image est divisée en deux longueurs d'onde ou des canaux, qui sont prévus côte-à-côte sur la matrice CCD.

Figure 2. Préparation de l'échantillon. C. elegans sont montés sur des plots d'agarose minces pour l'imagerie. A coussinets d'agarose) sont faites en prenant en sandwich une petite goutte deagarose fondu entre deux lames de microscope espacées par deux morceaux de ruban de laboratoire. B) Les animaux sont transférés sur le bloc d'agarose et recouverte d'une lamelle couvre-objet, maintenu en place par une petite quantité de cire à chacun des quatre coins.

Figure 3. Des exemples de données GCaMP. GCaMP Le signal, AF / F, enregistrée in vivo du corps cellulaire d'un neurone ASJ réponse à une alternance de marche / arrêt de champ électrique (vert trace). D'épaisses lignes grisées indiquent les périodes où le champ électrique externe (3 V / cm) a été appliquée à l'animal. La barre d'échelle représente une augmentation de 100% de l'intensité de fluorescence.
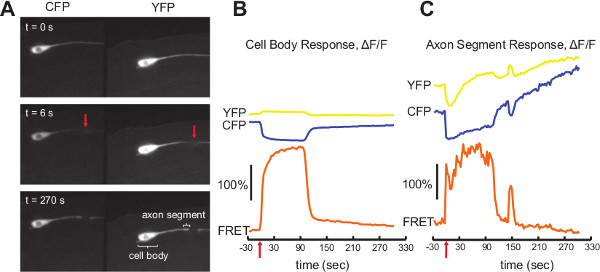
Figure 4. Exemple des données Cameleon. A) Trois cadres séparés montrant la double imagevoir d'un neurone ALM avant et après la chirurgie laser de l'axone 20 um à partir du corps cellulaire. La flèche rouge sur le panneau du milieu indique le point de coupure. Le panneau du bas montre le corps cellulaire et le segment de l'axone produire des signaux à B et C. B) Le cameleon YC3.60 signal mesuré au niveau du corps cellulaire du neurone ALM avant et après la chirurgie au laser (flèche rouge). C) Le YC3 cameleon 0,60 signal mesuré sur le segment des axones dans les 5 um du point de coupe avant et après la chirurgie au laser. Traces jaunes indiquent les signaux YFP, des traces bleues indiquent les signaux de la PCP et des traces oranges sont la résultante FRET rapport. Tous les temps sont fonction du temps de la chirurgie au laser. Barres d'échelle représentent une augmentation de 100% de l'intensité de fluorescence. Cliquez ici pour agrandir la figure .
Discussion
Indicateurs de calcium génétiquement codés ont été largement utilisés dans C. elegans neurobiologie. De nombreux groupes ont utilisé ces techniques pour étudier la réponse des neurones sensoriels primaires à des stimuli externes comme démontré ici avec la réponse ASJ à un champ électrique. Exemples les plus notables figurent sensation du toucher mécanique, des produits chimiques spécifiques, de la température et un champ électrique 12, 16-19. L'activité des interneurones et les cellules musculaires ont également été contrôlée à la fois en réponse à des stimuli et dans le contrôle du comportement animal. Beaucoup de ces études ont poussé ces techniques un peu plus loin en utilisant la reconnaissance d'image et de techniques de suivi pour permettre l'enregistrement des neurones chez les animaux partiellement restreints ou même se déplacer librement ainsi que l'enregistrement des neurones simultanément. D'autres études ont porté sur d'autres aspects de la physiologie de calcium tels que la réponse aux lésions neuronales 13, 20, présenté ici, ainsi quedégénérescence neuronale sur des échelles de temps plus longues 21.
Lors de la conception d'une expérience particulière, chacune des techniques alternatives concernant les reporters de calcium couramment utilisés et immobilisation des animaux doit être examinée attentivement. Techniques d'immobilisation sera dicté par les aspects techniques tels que la nécessité d'un accès physique à l'animal, la possibilité de récupérer les animaux suite à l'imagerie ou la nécessité d'un débit élevé. Différents journalistes de calcium fluorescents ont des avantages et des inconvénients spécifiques aussi bien. GCaMP emploie seule analyse simple image de la chaîne et le grand signal-sur-bruit le rend applicable à de nombreuses situations. Cameleon d'autre part nécessite une imagerie plus complexe et l'analyse qui en résulte, mais la mesure ratiométrique peut être critique dans des situations avec des objets potentiellement importants. Par exemple, les fluctuations de la quantité de fluorophore (comme dans l'exemple endommagement laser) peut également se produire sur de longues périodes(H) en raison de changements dans les niveaux d'expression. D'autres stratégies d'imagerie à double sont également possibles tels que GCaMP co-exprimé avec (ou physiquement liés à) un fluorophore DP. Bien que n'étant pas FRET en fonction ce serait de profiter de la large gamme dynamique des variantes GCaMP modernes tout en utilisant le canal rouge comme une mesure de référence en temps réel.
Il est important de noter que de nombreux systèmes à deux canaux microscope d'imagerie et des logiciels d'analyse sont disponibles dans le commerce qui, bien que souvent plus cher, peut être attrayante pour les chercheurs hésitent à construire le système de construction d'une habitation décrite ici. Les systèmes commerciaux d'imagerie double (DualView2-DV2, Photometrics) utilisent généralement des optiques similaires à notre système maison construite, mais sont contenues dans une pièce jointe microscope simple avec des procédures standardisées d'alignement. Alternativement, filtre rapide des systèmes d'échange (Lambda DG-4/DG-5 De plus, Sutter Instruments) permettre l'octroi rapide imagerie en temps réel séquentielle de deux canaux de couleur wiThout optique d'imagerie supplémentaires, mais sont également coûteux et nécessitent une synchronisation précise entre l'échange du filtre et acquisition de la caméra.
En résumé, C. elegans présente un certain nombre d'avantages comme système d'imagerie in vivo. Les fluorophores codés génétiquement sont souvent cellule spécifique et peut éliminer la nécessité pour l'injection ou l'administration de fluorophores exogènes. C. elegans accessibilité optique permet d'imagerie dans les animaux intacts qui sont facile et rentable de maintenir, ne nécessitent pas de dissection compliquée ou la culture neuronale et de préserver la physiologie cellulaire. En outre, C. elegans possède de grandes capacités pour l'analyse génétique d'un grand nombre de réactifs disponibles génétiques et des techniques bien établies. Il ya des inconvénients de cours sur le système, la principale préoccupation étant peut-être qu'il est un invertébré. En outre, les fluorophores signaler les changements relatifs dans rathe concentration de calciumr à une valeur absolue et la résolution temporelle des mesures peuvent être limitées par deux la dynamique du fluorophore mais également les temps d'intégration nécessaires de faibles signaux de fluorescence. Enfin, bien que le calcium est une partie intégrante de l'activité neuronale et de signalisation des fluorophores ne pas rapporter directement le niveau de tension de membrane telle que mesurée avec les techniques d'électrophysiologie. Néanmoins illustré par les procédures présentées ici, C. elegans est un attrayant, relativement simple et rentable du système pour un large éventail d'études d'imagerie neuronale.
Déclarations de divulgation
Les auteurs déclarent n'avoir aucun conflit d'intérêts financiers.
Remerciements
Plusieurs personnes ont contribué aux travaux décrits dans le présent document. CVG a construit le dispositif expérimental, et LS, SHC, et CVG a effectué les expériences. CVG et SHC a écrit le manuscrit. Tous les auteurs par la suite participé au processus de révision et approuvé la version finale du manuscrit. Nous remercions Paul Sternberg pour la souche GCaMP. Certaines souches de nématodes utilisées dans ce travail ont été fournies par le Centre de Caenorhabditis Genetics (CCG), qui est financé par le NIH Centre National de Ressources de recherche (NCRR). Le programme MATLAB analyse d'image a été adaptée de celle utilisée dans 18 ans. Les auteurs ont été pris en charge par l'Université de Boston et le Massachusetts Life Sciences Center.
matériels
| Name | Company | Catalog Number | Comments |
| Eclipse Ti-U inverted microscope | Nikon | ||
| Intensilight HG Illuminator | Nikon | C-HGFI | Fluorescent light source |
| CFI Plan Apo VC 60X Oil | Nikon | ||
| Optical table or 3'X3' optical grade breadboard | Thor Labs | If an optical table is not used an optical grade breadboard on a solid laboratory bench should suffice. | |
| Clara Interline Camera | Andor Technology | High-sensitivity CCD camera | |
| wtGFP Longpass Emission | Chroma Technology Corp. | 41015 | GFP filter set for imaging GCaMP |
| Filter 440 +/- 10 nm | Chroma | D440/20x EX | excitation filter for cameleon |
| Dichroic mirror > 455 nm longpass | Chroma | 455DCLP BS | microscope dichroic for cameleon imaging |
| Dichroic mirror > 515 nm longpass | Chroma | 515DCLP BS | dichroic mirror for cameleon imaging |
| Filter 535 +/- 15 nm | Chroma | D535/30m EM | YFP emission filter |
| Filter 480 +/- 20 nm | Chroma | D485/40m EM | CFP emission filter |
| Lens, 200 mm, Achromat | Thor Labs | AC508-200-A1 | Relay lens for FRET optics (3) |
| Silver broadband mirror | Thor Labs | ME2S-P01 | FRET optics (2) |
| NGM buffer | |||
| Levamisole | Sigma | ||
| Polybead Microspheres | Polysciences, Inc. | 08691-10, 2.5% by volume, 50 nm diameter | polystyrene nanoparticles for C. elegans immobilization |
| Transgenic strain, Strain gpa-9::GCaMP3(in pha-1; him-5 bkg) | Sternberg Lab | Strain PS6388 | |
| Transgenic strain, mec- 4::YC3.60 | Gabel Lab | Strain CG1B |
Références
- Miyawaki, A., Llopis, J., Heim, R., McCaffery, J. M., Adams, J. A., Ikura, M., Tsien, R. Y. Fluorescent indicators for Ca2+ based on green fluorescent proteins and calmodulin. Nature. 388, 882-887 (1997).
- Nakai, J., Ohkura, M., Imoto, K. A high signal-to-noise Ca(2+) probe composed of a single green fluorescent protein. Nat. Biotechnol. 19, 137-141 (2001).
- Kerr, R. Imaging the activity of neurons and muscles. WormBook. , (2006).
- Tian, L., Hires, S. A., Mao, T., Huber, D., Chiappe, M. E., Chalasani, S. H., Petreanu, L., Akerboom, J., McKinney, S. A., Schreiter, E. R., et al. Imaging neural activity in worms, flies and mice with improved GCaMP calcium indicators. Nat. Methods. 6, 875 (2009).
- Reiff, D. F., Ihring, A., Guerrero, G., Isacoff, E. Y., Joesch, M., Nakai, J., Borst, A. In vivo performance of genetically encoded indicators of neural activity in flies. J. Neurosci. 25, 4766-4778 (2005).
- Rand, J. B. Acetylcholine. WormBook. , (2005).
- Kim, E., Sun, L., Gabel, C. V., Fang-Yen, C. Long-term imaging of Caenorhabditis elegans using nanoparticle-mediated immobilization. PLoS ONE. 8 (1), e53419 (2013).
- Byrne, A. B., Edwards, T. J., Hammarlund, M. In vivo Laser Axotomy in C. elegans. J. Vis. Exp. (51), e2707 (2011).
- Kerr, R., Lev-Ram, V., Baird, G., Vincent, P., Tsien, R. Y., Schafer, W. R. Optical imaging of calcium transients in neurons and pharyngeal muscle of C. elegans. Neuron. 26, 583-594 (2000).
- Chronis, N., Zimmer, M., Bargmann, C. I. Microfluidics for in vivo imaging of neuronal and behavioral activity in Caenorhabditis elegans. Nat. Methods. 4, 727-731 (2007).
- Hulme, S. E., Shevkoplyas, S. S., Apfeld, J., Fontana, W., Whitesides, G. M. A microfabricated array of clamps for immobilizing and imaging C. elegans. Lab. Chip. 7, 1515-1523 (2007).
- Gabel, C. V., Gabel, H., Pavlichin, D., Kao, A., Clark, D. A., Samuel, A. D. Neural circuits mediate electrosensory behavior in Caenorhabditis elegans. J. Neurosci. 27, 7586-7596 (2007).
- Pinan-Lucarre, B., Gabel, C. V., Reina, C. P., Hulme, S. E., Shevkoplyas, S. S., Slone, R. D., Xue, J., Qiao, Y., Weisberg, S., Roodhouse, K., et al. The Core Apoptotic Executioner Proteins CED-3 and CED-4 Promote Initiation of Neuronal Regeneration in Caenorhabditis elegans. PLoS Biol. 10, e1001331 (2012).
- Chung, S. H., Clark, D. A., Gabel, C. V., Mazur, E., Samuel, A. D. The role of the AFD neuron in C. elegans thermotaxis analyzed using femtosecond laser ablation. BMC Neurosci. 7, 30 (2006).
- Nagai, T., Yamada, S., Tominaga, T., Ichikawa, M., Miyawaki, A. Expanded dynamic range of fluorescent indicators for Ca(2+) by circularly permuted yellow fluorescent proteins. Proc. Natl. Acad. Sci. U.S.A. 101, 10554-10559 (2004).
- Kindt, K. S., Quast, K. B., Giles, A. C., De, S., Hendrey, D., Nicastro, I., Rankin, C. H., Schafer, W. R. Dopamine mediates context-dependent modulation of sensory plasticity in C. elegans. Neuron. 55, 662-676 (2007).
- Chalasani, S. H., Chronis, N., Tsunozaki, M., Gray, J. M., Ramot, D., Goodman, M. B., Bargmann, C. I. Dissecting a circuit for olfactory behaviour in Caenorhabditis elegans. Nature. 450, 63-70 (2007).
- Clark, D. A., Gabel, C. V., Gabel, H., Samuel, A. D. Temporal activity patterns in thermosensory neurons of freely moving Caenorhabditis elegans encode spatial thermal gradients. J. Neurosci. 27, 6083-6090 (2007).
- Biron, D., Shibuya, M., Gabel, C., Wasserman, S. M., Clark, D. A., Brown, A., Sengupta, P., Samuel, A. D. A diacylglycerol kinase modulates long-term thermotactic behavioral plasticity in C. elegans. Nat. Neurosci. 9, 1499-1505 (2006).
- Ghosh-Roy, A., Wu, Z. L., Goncharov, A., Jin, Y. S., Chisholm, A. D. Calcium and Cyclic AMP Promote Axonal Regeneration in Caenorhabditis elegans and Require DLK-1 Kinase. Journal of Neuroscience. 30, 3175-3183 (2010).
- Bianchi, L., Gerstbrein, B., Frokjaer-Jensen, C., Royal, D. C., Mukherjee, G., Royal, M. A., Xue, J., Schafer, W. R., Driscoll, M. The neurotoxic MEC-4(d) DEG/ENaC sodium channel conducts calcium: implications for necrosis initiation. Nat. Neurosci. 7, 1337-1344 (2004).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon