Method Article
탠덤 동질 정제를 사용하여 단백질 나누기 파트너의 식별
요약
탠덤 친화 정화 단백질 바인딩 파트너의 식별을위한 강력한 접근이다. 개념 증명으로서,이 방법론은 숙주 세포의 요인 번역 개시에 관여 공동 침전물에 잘 특성화 번역 개시 인자의 eIF4E에 적용되었다. 이 방법은 쉽게 다른 세포 또는 바이러스성 단백질에 적응하고 있습니다.
초록
호스트 및 바이러스 단백질의 기능을 이해하는데 중요하며 종종 제한 단계는 세포 또는 바이러스성 단백질 파트너를 상호 작용의 신분증입니다. 상호 작용하는 효모 두 하이브리드 시스템을 포함한 파트너,뿐만 아니라 재조합 단백질 및 대량 분석법 식별 1 다음 내생 단백질의 immunoprecipitation을 사용하여 assays를 풀다운의 식별을 허용 여러 방법이 있습니다. 최근 연구는 상호 작용하는 단백질의 식별에 두 특정 용출 단계와 결합 이중 친화 태그 중재 정화의 유틸리티를 강조했습니다. 이러한 접근 방식은, 되나 탠덤 동질 정화 (TAP)는 처음 효모 2,3에 사용되었지만 최근에는 포유 동물 세포에서 4-8를 사용하는 적응되었습니다.
Proof-Of-Concept, 개념으로서 우리는 잘 특성화 진핵세포 번역 개시 포워드 액티브를 사용하여 탠덤 선호도 정화 (TAP) 메서드를 설립토르 eIF4E 9,10 있습니다. 셀룰러 번역 팩터 eIF4E는 캡 종속 번역 개시 10에 관련된 세포 eIF4F 복합 중요한 구성 요소입니다. 현재 연구에 사용되는 TAP 태그는 두 단백질 G 단위로 구성되어와 streptavidin 바인딩 펩타이드는 담배 엣지 바이러스 (TEV) 단백 분해 효소 절단 순서로 구분됩니다. 현재 연구에 사용되는 TAP 태그는 두 단백질 G 단위로 구성되어와 streptavidin 바인딩 펩타이드는 담배 엣지 바이러스로 구분 (TEV) 단백 분해 효소 절단 순서 8이다. clonal 세포 라인의 생성에 대한 필요성을 ...없이 지내다하기 위해, 우리는 pMEP4 (Invitrogen)에 근거 episomally 유지 플라스미드의 TAP-태그를 미끼 단백질의 표현에 의존 빠른 시스템을 개발했습니다. 이 플라스미드의 태그를 murine eIF4E 표현은 카드뮴 염화물 inducible의 metallothionein 모터를 사용하여 통제되었다.
R에 바인딩을 통해 표현하는 세포와 후속 친화 정화의 용해abbit IgG 아가로 오스, TEV 프로 테아제 절단은 streptavidin 연결된 아가로 오스로 묶는 방식과 (혼자 TAP 태그를 표현하는 세포 라인을 제어하는 비교시) 이후 비오틴의 용출은 풀다운 eIF4E에 분명히 특정 다수의 단백질을 발견. 단백질의 정체성은 1D SDS-PAGE와 후속 탠덤 질량 분광법에서 밴드의 절단에 의해 획득되었다. 식별된 구성 요소는 알려진 eIF4E 구속력 eIF4G 단백질과 4EBP-1을 포함시켰습니다. 또한, eIF4F 복합 다른 구성 요소는 eIF4E는 구성 요소가 eIF4A 및 폴리-결합 단백질 즉, 식별되었습니다이다 중. 알려진 직접적인 구속력이 파트너뿐만 아니라, 이차 상호 작용하는 단백질뿐만 아니라, 식별하는 능력은 더욱 알 수없는 함수의 단백질의 특성이 접근 방식의 유틸리티를 강조 표시합니다.
프로토콜
1. 세포 라인의 생성 : pMEP4 transfection / 표현
- pMEP4 발현 벡터와 세포를 Transfect 모든 모의 transfected 세포를 죽였으니 때까지 hygromycin B / ML (로슈)의 100 μg으로 선택합니다. pMEP4 플라스미드는 특정 클론을 격리시킬 필요가 없습니다 episomally 때문에 유지됩니다.
- pMEP4 벡터를 포함하는 세포는 16 시간 동안 10 μm의 CdCl 2 치료에 의해 유도된 수 있습니다. 표현과 inducibility은 세포 라인 증폭 전에 작은 규모로 확정해야한다. 단백질 G 도메인은 거의 모든 종류의 항체에 바인딩으로 TAP으로 태그가 추가된 단백질은 쉽게 감지가 가능하다. 대규모 purifications 들면 세포의 일반적으로 10 합류 175cm 2 flasks이 필요합니다. 이것은 약 2 X10 8 표현 세포로 equates.
2. 세포 lysate 준비
- PBS로 세포를 데리고 한 50 ML 튜브로 결합되어 있습니다. 1200X GF 던가5 분 (이것은 세척 후 1.5 ML로 감소하는으로 시작하는 포장 세포로부터 2-3 ML 초래한다).
- 얼음처럼 차가운 PBS (50 MLS 때마다)에 세포를 세 번 씻는다.
- 5 ML의 용해 완충액 (에서 세포를 Lyse 50 MM 트리스-HCL (산도 7.5) 125 MM NaCl, 5 % 글리세롤, 0.2 % NP-40, 1.5 밀리미터 MgCl 2, 25 MM NaF, 1 ㎜ 나 3 조종 4 테아제 억제제 ). 참고 : NaF, 나 세 조종 4 테아제 억제제는 신선한 추가됩니다. 얼음에서 5 분 출발 전에 10 배 아래로 피펫합니다. 얼음에 5 분간 얼음에 다시 나가기 전에 무딘 바늘을 이용하여 주사기 위아래로 5-10 시간. syringing를 반복하고 얼음에 추가로 5 분 둡니다.
- (액체 N 2 / 또는 드라이 아이스와 에탄올) 두 번 lysate를 냉동 해동. 예제는 4보다 큰 ° C.에 도달하도록 허용하지 마십시오 참고 : 처리 시간 ° C 때까지 -80에서이 샘플을 저장할 수 있습니다.
- 1.5 ML 튜브로 나누어지는 샘플을하고 제거 unlysed 세포와 D원심 분리 (4 10 분 ° C, 16,000 X G)에 의해 ebris.
- 뜨는 복구, 15 ML 팔콘 튜브에 결합하고 (옵션) 단백질 항복 부량 위해 20 μl 채취하기 전에 필터 0.45 μm의 통과. 이후의 분석 (예제 1)에 추가로 50 μl 나누어지는를 제거합니다.
3. 토끼 IgG-아가로 오스에 바인딩할
(참고 : 모든 핑핑이 별도로 명시되지 않는 한, 1 분 4 ° C에서 냉장 원심 분리기에 1200X g에서 실시되어야 함)
- 부드럽게 병을 소용돌이에 의해 토끼 IgG-아가로 오스 솔루션 (시그마 - 올드 리치)를 resuspend. IgG 아가로 오스 (커팅 1ml 피펫 팁 사용) 380 μl를 타고 1 분 원심 분리에 의해 운송 / 방부제 솔루션을 제거합니다. 차가운 용해 완충액 (4 ℃) 명확히하기 위해 원심 분리를 사용하여.에 아가로 오스 세 번 씻으십시오 아가로 오스의 최종 수율은 포장 구슬 약 250 μl 있어야합니다.
- 2.6 (15 ML 매 욕조에에서 지워 세포 lysate 추가E) 4에서 3 시간 동안 빨아서 토끼 IgG 아가로 오스와 부화 (또는 야간)에 ° C 회전 믹서를 사용합니다.
- 4 ° C에서 5 분 아가로 오스 비즈를 돌려서 후속 분석 (예제 2) 뜨는을 제거합니다. 참고 : 단백질 태그를 TAP 이제 비즈와 관련된되어야한다.
4. TEV 프로 테아제 절단
(참고 : 모든 핑핑이 별도로 명시되지 않는 한, 1 분 4oC에서 냉장 원심 분리기에 1200X g에서 실시되어야 함)
- 차가운 용해 완충액에 토끼 IgG 아가로 오스 비즈 세 번 씻는다 (4 ° C) (참고 : 용해 버퍼 테아제 억제제가 없어야합니다) 명확히하기 위해 원심 분리를 사용하여. 케어는 세정 단계 동안 구슬을 제거하거나 잃지 않도록 촬영해야합니다.
- 명확히하기 위해 원심 분리를 사용하여 TEV-단백 분해 효소 절단 버퍼 (10 MM 트리스-HCL (산도 7.5), 100 MM NaCl 및 0.2 % NP-40)와 함께 비즈에게 추가로 두 번 씻는다. 마지막 세척 후 신중하게 모든 리를 제거구슬에서 파운드.
- TEV 단백 분해 효소 절단 믹스를 준비해, 각 샘플은 467.5 μl H 2 O 25 μl 20x TEV 버퍼 (Invitrogen), 5 μl 0.1M DTT와 2.5 μl (25 U) TEV 프로 테아제 (Invitrogen)를 포함합니다. 포장 구슬의 각 샘플이 TEV 절단 믹스 500 μl을 넣고 1.7 ML 미리 윤활 튜브 (Costar)로 전체 믹스를 전송합니다. 사전 배양은 이후 분석 (예제 3) 30 μl 나누어지는를 제거합니다.
- 4에서 하룻밤 TEV 단백 분해 효소 반응을 품어 ° C에서 회전 믹서를 사용합니다. 짧은 incubations 시간은 경험적으로 결정되어야 미끼 단백질과 TEV 단백 분해 효소 절단 사이트지만 최소 배양 시간의 접근의 성격에 따라 사용할 수 있습니다.
5. 고정화 Streptavidin 플러스 구슬을 Ultralink에 바인딩할
(참고 : 모든 핑핑이 별도로 명시되지 않는 한, 1 분 4 ° C에서 냉장 원심 분리기에 1200X g에서 실시되어야 함)
- 1200X g (4 ℃)에서 5 분 동안 토끼 IgG 아가로 오스 비즈를 포함 TEV 절단 반응을 원심 분리기. 분석을 위해 명확히 뜨는의 20 μl 나누어지는 (예제 4) 삭제
- 신선 1.5 ML 사전 윤활 튜브 (Costar)에 남은 뜨는 (약 480 μl)를 전송하고 얼음에서이 작업을 둡니다. 이 뜨는 버리 지마 - 이것이 바로 너의 TEV 죽습 미끼 단백질과 연관된 바인딩 단백질이 포함되어 있습니다.
- 나머지 토끼 IgG 아가로 오스 비즈와 resuspend에 차가운 용해 완충액 500 μl (제 2.3) 추가합니다. 뜨는을 제거하고 단계 5.2에서 그걸로 결합하기 전에 구슬을 명확히하기 위해이 혼합물을 원심 분리기. (지금 샘플 ~ 980 μl를 포함한다) 얼음에이 튜브를 남겨주세요.
- 이후 분석을 위해 토끼 IgG 아가로 오스 비즈 (예제 5) 유지. 참고 : SDS-PAGE 젤 (또는 서쪽 얼룩)에서이 샘플을 실행하면 그것으로 인해 IgG 무거운 가벼운 존재로 배경을 많이 줄 것이다체인.
- 한편 부드럽게 Ultralink이 병을 소용돌이하여 Streptavidin 플러스 아가로 오스 비즈 (피어스)를 고정화 resuspend. 미리 윤활 1.5 ML 튜브로 끝 잘라내기, 나누어지는 샘플 당 streptavidin 구슬의 70 μl로 200 μl 피펫 팁을 사용하고 원심 분리하여 운송 / 방부제 솔루션을 제거합니다. 참고 :이 구슬은 매우 작고 그래서 "오리 청구"또는 평평 / 좁은 엔드 팁이 씻는 동안 비드 손실을 최소화하는 데 사용할 수 있습니다.
- streptavidin 구슬에게 차가운 용해 완충액에 세 번 씻는다 (4 ° C)에 명확히하기 위해 원심 분리를 사용하여. 이것은 튜브 당 포장 구슬의 약 45-50 μl를 떠나해야합니다.
- 전송 사에서 3 시간 (또는 특급)에 대한 형편없는 streptavidin 비즈와 부화를 포함한 튜브에 TEV-단백 분해 효소 절단에 뜨는 (즉 5.3 단계에서 시료의 980의 μl) ° C 회전 믹서를 사용합니다.
- 4 ° C에서 5 분간 streptavidin 구슬을 아래로 돌리고 (후속 분석을 위해 뜨는을 제거 샘ple 6). streptavidin 구슬에게 차가운 용해 완충액에 세 번 씻는다 (4 ° C)에 명확히하기 위해 원심 분리를 사용하여. 최종 세척 후 신중하게 남아있는 모든 세차 버퍼를 제거합니다.
6. streptavidin 바인딩 펩타이드와 미끼 단백질의 비오틴의 용출
(참고 : 모든 핑핑이 별도로 명시되지 않는 한, 1 분 4 ° C에서 냉장 원심 분리기에 1200X g에서 실시되어야 함)
- 비오틴 (1 MM D-비오틴)과 회전 믹서를 사용 3시간 (또는 야간)에 대해 4 ° C에서 잠복기 : PBS 500 μl를 추가하여 streptavidin 비즈에서 태그가 지정된 단백질 Elute.
- 4 ° C에서 5 분간 streptavidin 구슬을 아래로 돌리고 1.5 ML 미리 윤활 튜브 (참고로 뜨는을 제거 :이 최종 샘플 / 용리 (예제 7)입니다.
- 나머지 streptavidin 비즈로 PBS와 회전 믹서를 사용 2-3시간 (또는 야간)에 대해 4 ° C에서 품어 : 또 다른 500 μl 비오틴을 추가합니다.
- 다시이탄은 6.2 단계로 두 elutions (예제 7) 결합. 이것은 최종 용리는 -80 ° C.에 저장될 수
- 비오틴의 용출의 효율성을 평가하기 위해 나중에 SDS 샘플 버퍼 (예제 8) (피셔에서 LaneMarker 5 배 감소 샘플 버퍼 권장)에 남아있는 streptavidin 비즈를 동결하고 끓여야.
7. 단백질 농도
- 최종 eluate (예제 7) 때문에 낮은 단백질 농도와 상대적으로 높은 볼륨의 사전 분석에 집중해야합니다. 이것은 낮은 분자량 (<5 KDa) Vivaspin의 스핀 컬럼 (Vivascience)를 사용하여 얻을 수 있습니다. 미만 100 μl로 볼륨을 집중하고자합니다. 이 최종 샘플 (피셔에서 LaneMarker 5 배 감소 샘플 버퍼 권장) 삶은과 단백질 샘플 버퍼에 저장할 수 있습니다.
8. 분석
- 샘플은 1-8 풀다운의 효율성을 결정하기 위해 서양의 얼룩으로 분석할 수 있습니다. 참고 : 대부분의 이차 항체됩니다융합 단백질의 단백질 G 도메인과 교차 반응을하지만, 이것은 TEV 단백 분해 효소 절단 후 제거됩니다.
- 샘플 7 1D 또는 2D SDS-PAGE에 의해 분석할 수 있습니다. 염색법은 은색 또는 Coomassie을 (SilverQuest 실버 염색법과 Invitrogen에서 콜로이드 블루 Coomassie 염색법의 키트 권장)를 사용하여 수행할 수 있습니다. 단백질 식별은 질량 분광법을 사용하여 수행할 수 있습니다.
9. 대표 결과
TAP 태그가 eIF4E의 바인딩 파트너를 식별하려면이 프로토콜에서 최종 용리 (예제 7) 1D SDS-PAGE 분석의 예제는 그림 2에 제공됩니다. 이 대표 겔은 세포의 다른 단백질과 상호 작용 eIF4E의 복잡하고 풍부한 자연을 반영합니다. 전용 TAP 태그를 표현 세포주에서 생성된 또한 그림 2에 표시된 부정적인 통제와 비교, 풀다운 baited이 eIF4E의 특이성을 보여줍니다. 농축 최종 용리 인스턴스 15%에서 (샘플7) Invitrogen에서 Silverquest 실버 염색법 키트를 사용 물들일되기 전에 시판 프리 캐스트 기울기 젤을 사용하여 1D SDS-PAGE에 의해 분석되었다.
일반적으로 남아있는 농축 최종 용리 (예제 7) 50-85%은 콜로이드 Coomassie은 (Invitrogen) 얼룩으로 분석됩니다. 전체 차선의 표본 (겔 조각 / 밴드)가 대량 분석법에 의해 추출하여 분석되었다.
풀다운 eIF4E에서 확인된 단백질이 아닌 특정 바인딩 파트너를 식별하기 위해 부정적인 컨트롤의 바인딩 파트너에 대해 필터링되었습니다. TAP 태그 eIF4E의이 프로세스를 통해 확인된 최종 단백질은이 기술을 사용하여 식별 정상적인 단백질의 대표 그림 2에서 볼 수 있습니다. 또한, eIF3 subunits의 숫자도 (데이터가 표시되지 않음)가 발견되었다.

1 그림. 의 개략도탠덤 친화 정화 절차는. 여섯 단계 탠덤 선호도 정화 (TAP) 프로토콜은 세포주 생성, 세포 용해, 토끼 IgG 아가로 오스 immuno-강수량, TEV 프로 테아제 절단, streptavidin 비드 친화 정화하고 마지막 비오틴 용출을 포함한다.
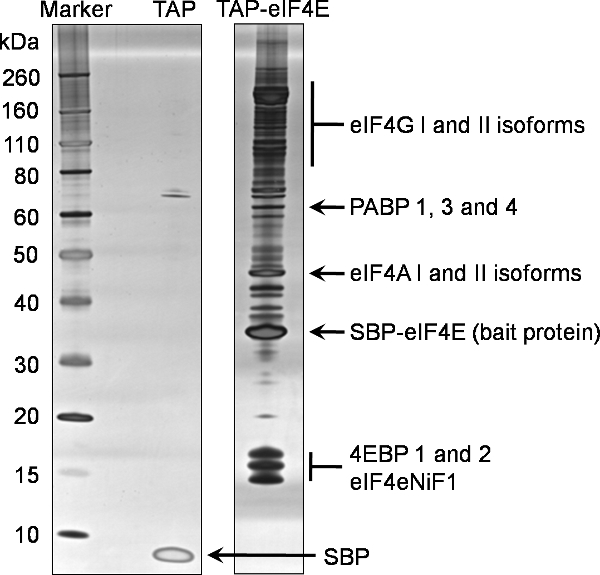
그림 2. murine eIF4E의 단백질 탠덤 친화 정화가. 말기 태그를 누르 N의 파트너를 나누기 eIF4E가 첨부된 프로토콜을 사용하여 진핵 HEK293 세포에서 정화되었다. 최종 용리 (예제 7)의 20 % 분율은 미리 캐스트 4-12%의 기울기 겔 (TAP-eIF4E 차선)에서 SDS-PAGE에 의해 분석되었다. 상응 분석은 혼자 태그 (TAP의 차선)에 대해 수행되었다. 단백질은 실버 염색법을 사용하여 확인되었다. 이후 동일한 샘플의 질량 분광법에 의해 확인된 단백질이 젤에 강조 표시됩니다.
약어 : eIF4G; 진핵세포 번역 개시 F배우 4 감마, PABP; polyA 바인딩 단백질, eIF4A : 진핵세포의 번역 개시 인자 4 알파, SBP-eIF4e, 진핵세포의 번역 개시 인자의 4E 바인딩, 진핵세포 번역 개시 인자의 4E로 융합, 4EBPs streptavidin 바인딩 펩타이드를 포함하는 나머지 트는 미끼 단백질 단백질, eIF4eNiF1l 진핵세포 번역 개시 인자의 4E 핵 수입 팩터 1, SBP, TEV unfused 트는 펩타이드의 남은 streptavidin 바인딩 펩타이드.
토론
여기에 그림과 TAP 태그 기술은 진핵 세포의 미끼 단백질의 바인딩 파트너를 격리를위한 매우 구체적이고 엄격한 방법을 보여줍니다. 이 접근법은 세포와 바이러스 모두 단백질에 적용할 수 있습니다. 우리가 알기로,이 같은 기술이 번역 개시 인자의 eIF4E에 적용되었습니다 처음이다. 이 기법을 사용하여 알려진 eIF4E 바인딩 단백질의 eIF4G 및 4EBPs의 확인은 이러한 접근 방식의 유효성을 확인. 또한, eIF4F 복합 나머지 구성 요소의 식별은, 즉 eIF4A 및 PABP는 간접 상호 작용과 차 단지는 정화 과정에서 그대로 유지 인증해줍니다. 정식 eIF4e 바인딩 단백질의 여러 isoforms의 신분도 분명했습니다. 이들은 그림 2에 자세히 설명되어 있습니다.
접근 방식의 한계로 돌아가서 특정주의 선택에 관련하여 복용해야미끼 단백질과 N-또는 C-말단에 태그 태그를 추가할지 여부. 그것은 기능적 분석을 수행하거나 태그를 유도체가 작동하기 위해 사전에 전격적인 정화에 현미경으로 융합 단백질의 지방화를 검토 권할 수도 있습니다. 적분 막이나 핵 단백질은 반드시 용해 단계에서 설명한 비교적 순한 세제를 조건으로 석방되지 않을 수 있습니다. 모든 immunoprecipitations 및 유사 풀다운 assays와 마찬가지로, 수정은 용해의 효율성을 높일 수있는 용해 완충액에서 자연과 세제의 농도로 만들 수 있습니다. 용해 및 세척 버퍼의 이온 농도는 정화의 엄중을 늘리거나 줄일 수정할 수 있습니다. 그것은 표준 온화한 조건 (위에서 설명한)에서 초기 정화를 수행하는 것도 가능하지만, 이후 연속적으로 증가하는 이온 사기꾼 아래 씻어 수 4-5 aliquots에 streptavidin 구슬 (섹션 5.8), 나누다ditions. 이것은 사용자가 아닌 특정 상호 작용하는 단백질을 제거 최적의 조건을 확인할 수 있습니다. 전체 프로세스는 또한 과도 상호 작용하는 파트너 알려져 transfection 이후 서부의 얼룩에 의해서만 결정의 존재 또는 부재를 사용하여 수행할 수 있습니다. 이 경우 우리는 각각의 플라스미드 표현 8 μg으로 transfected 세포의 두 100cm 두 요리를 제안합니다. 알려진 바인딩 파트너들과 상호 작용하기 위해 TAP-융합 단백질의 돌연변이 유도체의 능력을 조사 때 수정 절차는 쓸모없는 것입니다.
실버 스테인드 SDS-PAGE의 젤 (또는 서양 얼룩에 의한 항체를 사용할 수있는 경우) 8을 통해 샘플 1을 분석하는 것은 문제 해결의 좋은 방법이며, 기술 수용 결과를 생성하는 데 실패한다. 각 친화력 기반의 강수량 및 특정 용리의 효율성이 체계적인 표본 추출 방법을 사용하여 분석할 수 있습니다. 샘플 8-1는 optim 동안 복용해야각각의 새 미끼를위한 프로토콜의 ization.
TAP 태그 기술은 GST와 같은 다른 접근 방식 당겨 - 다운 등 이중 친화 정화 및 특정 용출 단계 (TEV 절단과 비오틴의 용출이)로 유지되는 특이성과 엄중를 제공 효모 두 하이브리드 assays를 대한 강력하고 강력한 대안을 제공합니다 정화 절차 전반에 걸쳐 높은 수준. 비판적으로이 기법은 모든 단백질에 적용할 수 있으므로 관심있는 단백질 표적에 대한 바인딩 파트너를 식별하기위한 탁월한 방법을 나타냅니다.
공개
관심의 어떠한 충돌 선언 없습니다.
감사의 말
이 연구는 박사 이안 Goodfellow에게 수여 Wellcome 트러스트 수석의 원정대에 의해 후원되었다.
자료
| Name | Company | Catalog Number | Comments |
| 시약의 이름 | 회사 | 카탈로그 번호 | |
| Hygromycin B | 로슈 | 10843555001 | |
| 토끼 IgG 아가로 오스 | 시그마 | A2909 | |
| AC-TEV 프로 테아제 | Invitrogen | 12575-015 | |
| 테아제 억제제 칵테일 | Calbiochem | 539,134 | |
| Ultralink는 Streptavidin 플러스 비즈를 고정화 | 찌르다 | 53,116 | |
| Vivaspin 500 원심 농축기 (5KDa) | Vivaspin | V50112 | |
| SilverQuest 실버 염색법 키트 | Invitrogen | LC6070 | |
| Novex 콜로이드 블루 Coomassie의 염색법 키트 | Invitrogen | LC6025 | |
| 1.7ml prelubricated 튜브 | Costar | 3207 | |
| 피펫 팁 Microcapillary | VWR | 37001-150 | |
| NuPage 4~12% 비스 - 트리스 그라디언트 젤 | Invitrogen | NP0322BOX | |
| CdCl 2 | 시그마 | 202,908 | |
| 5 배 SDS 샘플 버퍼 | 어부 | PN39000 |
참고문헌
- Williamson, M. P., Sutcliffe, M. J. Protein-protein interactions. Biochem. Soc. Trans. 38 (4), 875-878 (2010).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat. Biotechnol. 17 (10), 1030-1032 (1999).
- Blackwell, C., Brown, J. D. The application of tandem-affinity purification to Candida albicans. Methods Mol. Biol. 499, 133-148 (2009).
- Cochrane, A. Stable complex formation between HIV Rev and the nucleosome assembly protein, NAP1, affects Rev function. Virology. 388 (1), 103-111 (2009).
- Fernandez, E. Targeted tandem affinity purification of PSD-95 recovers core postsynaptic complexes and schizophrenia susceptibility proteins. Mol. Syst. Biol. 5, 269-269 (2009).
- Gloeckner, C. J. Tandem affinity purification of protein complexes from mammalian cells by the Strep/FLAG (SF)-TAP tag. Methods Mol. Biol. 564, 359-372 (2009).
- Holowaty, M. N. Protein profiling with Epstein-Barr nuclear antigen-1 reveals an interaction with the herpesvirus-associated ubiquitin-specific protease HAUSP/USP7. J. Biol. Chem. 278 (32), 29987-29994 (2003).
- Burckstummer, T. An efficient tandem affinity purification procedure for interaction proteomics in mammalian cells. Nat. Methods. 3 (12), 1013-1019 (2006).
- Goodfellow, I. Calicivirus translation initiation requires an interaction between VPg and eIF 4 E. EMBO Rep. 6 (10), 968-972 (2005).
- Goodfellow, I. G., Roberts, L. O. Eukaryotic initiation factor 4E. Int. J. Biochem. Cell Biol. 40 (12), 2675-2680 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유