Method Article
막 단백질 폴딩의 열역학은 형광 분광학에 의해 측정
요약
트립토판 형광으로 막 단백질 폴딩의 깁스 자유 에너지를 얻기 위해이 동영상 기사 세부 실험 절차.
초록
막 단백질 접힘은 기본적인 건강 관련 모두 의미있는 새로운 주제입니다. 세포의 underlies 단백질이 유비 쿼터스 가족의 접는 종합 학습에 대한 필요성의 막 단백질의 풍부. 또한, misfolded 단백질과 관련된 질병의 특징 우리의 방위 능력에 대한 발전은 단백질 폴딩의 분야에서 상당한 실험 및 이론적인 노력을 동기 있습니다. 이 중요한 분야에서 급속한 진전은 불행하게도 막 단백질과 접는 메커니즘의 복잡과 관련된 고유의 도전에 의해 방해합니다. 여기, 우리는 E. 대표 일체형 멤브레인 단백질에 대한, denaturant, Δ G ° H 2 O의 부재에서 펼쳐의 깁스 자유 에너지의 열역학적 특성을 측정하기위한 실험 절차를 설명합니다 대장균. 이 프로토콜은 denaturant 농도의 함수로 접힌 및 펼쳐진 상태의 평형 인구를 결정하기 위해 형광 분광법의 응용 프로그램에 초점을 맞추고 있습니다. 합성 지질 vesicles뿐 아니라 데이터 분석 절차의 주요 단계의 준비를 위해 실험적인 고려 사항이 강조 표시됩니다. 이 기술은 다양한이며 온도와 산도,뿐만 아니라 lipids과 micelles의 다양한 환경을 포함하여 접는 denaturant의 종류와 추구있을 수 있습니다. 현재 프로토콜은 아래에 설명되어 기준 집합을 충족하는 막이나 가용성 단백질에 일반 수있는 하나입니다.
프로토콜
1. 막 단백질 폴딩에 대한 ~ 50 나노미터 직경 소형 Unilamellar Vesicles (포드 SUV)의 준비
- 1,2 - dimyristoyl - SN - glycero - 3 - phosphocholine (DMPC) 클로로포름에 lipids의 솔루션은 스토리지를위한 유리병 수량 당 20 밀리그램에서 구입한 깨끗한 유리 튜브에 aliquotted입니다. 질소 가스 층은 지질 산화를 방지하기 위해 각 유리병에 추가하고, 유리병은 뚜껑과 parafilm과 함께 봉인하고 있습니다. 튜브는 사용 전까지 -20 ° C의 냉동고에 저장됩니다.
- 클로로포름 20 MG의 지질의 나누어지는를 포함 하나의 약병은 각 실험에 사용됩니다. 유리병의 내용은없이 용매 남아 때까지 1 시간 동안 질소 가스의 흐름을 사용하여 건조합니다.
- 말린 lipids 20 MM의 칼륨 인산 버퍼 1 ML에 resuspended 아르 ~ 30 초 동안 물 목욕 sonicator를 사용하여 (산도 = 7.3). 정지 지방질의이 솔루션은 흐림 나타납니다, 그리고 원뿔 바닥과 플라스틱 15 ML 튜브로 전송됩니다. 인산염 버퍼의 또 다른 한 ML의 나누어지는 원래 지질을 포함 빈 유리관에 추가하고, sonication이 반복되며 솔루션은 다음 같은 15 ML 튜브에 추가됩니다. 튜브의 마지막 볼륨이 재고 소포 솔루션 5 MG / ML의 지질 농도의 결과, 4 ML 때까지이 과정은 4 회 총 반복됩니다.
- 지질 소포 솔루션의 4 ML 볼륨에 배치됩니다 따뜻한 (~ 30 ° C) 물 목욕, 및 50 % 듀티 사이클에서 1 시간 ultrasonicator의 microtip를 사용하여 sonicated. 물 목욕의 목적은 두 가지입니다. 첫째, 그것은 때문에 sonication 프로세스의 너무 뜨거운되는에서 지질 솔루션을 방지할 수 있습니다. 둘째, 따뜻한 목욕은 수성 지질 솔루션의 온도가 sonication 동안 이중층 위상 전이 온도 이상 유지 보장, DMPC 들어,이 전이 온도는 ~ 23 ° C.
- sonicated 솔루션은 sonicator 팁에서 파편을 제거하고 필터링 솔루션은 37 하룻밤 equilibrated입니다 필터 0.22 μm의 주사기 ° C. 통해 전달된다
2. 초기 형광 펼쳐 곡선에 대한 샘플 준비
- 20 MM의 인산 버퍼 (산도 7.3) 10 M의 요소의 주식 솔루션은 이루어집니다. 이 요소의 많은 수량이 솔루션에서 중요한 볼륨을 차지하고 있기 때문에 물이 고체 (아니라 그 반대)에 추가하는 것이 중요합니다. 이 요소 솔루션은 깨끗하고, 빈 병 solutes를 추가하고 의도한 최종 볼륨에 물을 추가하여 만들 수 있습니다. 이 솔루션은 물 목욕이나 용질을 용해하는 감동과 함께 뜨거운 접시에 온난 화를 요구할 수 있습니다. 요소는 흡습이므로, 우레아 주식 솔루션의 실제 농도는 굴절률을 사용하여 결정한다 1.
- 20 MM 인산 (산도 7.3)의 주식 버퍼 솔루션은 이루어집니다.
- 의 주식 솔루션은 단백질이 준비가되어 펼쳐진 거죠. 이 주식 단백질 솔루션 8 M의 요소, 20 MM 인산 버퍼에서 ~ 200 μm의 단백질의 농도가 있어야합니다.
- 형광 연구에 대한 샘플은 다음과 같은 방법으로 준비하고 있습니다. 재고 단백질의 적절한 볼륨 (섹션 2.3), 주식 지질 솔루션 (5 MG / ML 지질, 제 1 항), 주식 10 M의 요소 솔루션 (섹션 2.1), 주식 인산 버퍼 (섹션 2.2)은 ~ 4를 포함하는 샘플을 만들어 결합 μm의 단백질, 1 MG / ML 지질, 1 M의 단위 0-8 M의 요소. 각 샘플의 총 부피는 200 μL입니다. 예를 들어 스프레드 시트 (표 1) 목록의 볼륨이 200 μm의 주식 단백질 솔루션을 사용하는 데 필요한 것이 포함되어 있습니다.
- 빈 샘플 섹션 2.4에서 설명한대로 만들어진, 그러나, 단백질이 추가되지 않습니다. 다른 구성 요소의 농도 섹션 2.4들에게 동일하므로 단백질 대신에, 8 M의 요소 솔루션 4 μL를 추가할 수 있습니다. 이러한 공백은 산란과 단백질의 형광 스펙트럼에 나타나는 다른 배경 신호를 빼야하는 데 사용됩니다.
- 섹션 2.4와 2.5의 샘플이 완성 접는와 평형을 보장하기 위해 형광 스펙트럼 측정하기 전에 최소한 2 시간 동안 37 ° C에서 부화 사용할 수 있습니다.
3. 형광 스펙트럼 측정
각각의 샘플 및 빈의 트립토판의 형광은 정상 상태 fluorometer를 사용하여 측정됩니다. 형광 스펙트럼은 티로신 잔류물의 여기를 피하기 위해 290 nm의 파장의 여기로 기록된하고, 305-500 nm의에서 스캔해야합니다. 일반 입구와 출구 밴드는 3 NM입니다. 파장 단위 및 통합 시간은 신호 대 잡음 비율에 대해 최적화할 수 있습니다. 파장 단위 및 통합 시간에 대한 일반적인 값은 1 NM / 단계 각각 0.5 초 / 단계입니다. 막은 온도가 이중층 위상 전이 온도 이상의 경우에만 합성 lipids에 일반적으로 배 단백질. 따라서, DMPC의 경우, 시료의 온도는 30 일정 열립니다 ° C.를 160 μL 용량 microvolume 융합 실리카 쿠베트는이 전직에 활용periments.
4. 펼쳐 막 단백질의 깁스 자유 에너지의 초기 전개 곡선 및 견적 생성
- XY의 데이터 세트의 형태로 형광 스펙트럼은 같은 이고르 프로, Matlab, 유래, 또는 Excel과 같은 소프트웨어에로드됩니다.
- 요소 및 지질 소포 배경에서 신호가 다음 절차를 사용하여 빼서해야합니다
지질 vesicles 및 요소의 특정 농도의 존재에있는 단백질의 A = 원시 형광 스펙트럼 스펙트럼.
스펙트럼 B 지질 vesicles와 같은 요소 농도를 포함 해당 빈 샘플의 형광 스펙트럼 = 원료 것과 스펙트럼에서, 어떤 단백질이 비어 샘플에 없습니다.
수정된 스펙트럼 = 스펙트럼 - C * 스펙트럼 B. C가 1.0으로 일반적으로 동일 스칼라입니다. 어떤 경우에는, C 때문에 원인이 산란 문제 이하 1.0보다 큰 이상 또는 ~ 305-320 nm의 영역에 가까운 빼기 이하. - 최대 형광, λ 최대의 파장은 각 요소 농도에 대한 수정 스펙트럼에서 tabulated 있습니다. 완벽에 대한 일반적인 가치는 접힌 단백질의 그 ~ 330 nm의 상태에서 막 단백질 350 NM입니다 펼쳐진 거죠. Tabulated 파장가 펼쳐졌 인구의 분율에 λ 최대의 가치를 상호 연관시킬 1.0 범위 0.0에 λ 최대 값 (~ 350 nm의로 ~ 330)의 범위를 변환하여 펼쳐 분수로 변환됩니다. 예를 들면, 330 nm의 최대의 λ 값이 0.0에 해당하는 350 nm의 1.0에 해당하고, 340 nm의이 분수의 관점에서 0.5에 해당 펼쳐진 거죠. 펼쳐 단백질의이 분수는 다음 요소 농도 역모를 꾸몄다입니다. 위에서 언급한 바와 같이, 요소의 농도는 굴절률을 측정하여 실험적으로 결정되어야합니다.
- 우리는 단백질이 두 가지 상태 중 하나에 존재 할 수 있다고 가정합니다 : 접으면 또는 펼쳐진 거죠. 분수의 줄거리는 F, 펼쳐, 대 요소의 농도, C는 방정식에 맞게 수 : 2

계수 m은 denaturant 농도와 관련하여 자유 에너지의 변화의 속도에 해당하고, C M은 접힌 인구가 펼쳐 인구와 동일되는 미드의 요소 농도에 해당합니다. 이 값은 R은 (0.001987 kcal / 몰 • K) 가스 법률 상수입니다. 데이터 분석 소프트웨어를 사용하여 최소 제곱 피팅에서 얻은 피팅 변수이며, T는 (303 K) 온도입니다. - 맞지에서 얻은 계수는 요소의 부재에서 펼쳐의 깁스 자유 에너지 (kcal / 몰) 결정하기 위해 활용됩니다
 .
.
5. 펼쳐의 깁스 자유 에너지의보다 정확한 측정 곡선을 펼쳐 최적화.
- 위에서 설명한 펼쳐 커브가 λ 최대의 가장 큰 변화를 일으키는 요소의 농도의 범위를 나타낸다. 이 범위는 일반적으로 소형이며, 전개의 대부분이 작은 범위 내에서 발생합니다. 펼쳐의 자유 에너지를 정확하게 결정하기 위해 추가 샘플은 최적화된 최소 제곱 피팅에 필요한 많은 데이터 포인트를 포함하는 음모를 얻기 위해이 지역에서 분석하고 있습니다. 보다 정확하게 펼쳐 곡선이 중요한 지역의 모양을 나타내기 위해 0.2 M의 증가 4 M의 요소 - 단백질 2 및 4 M의 요소 사이에 펼쳐집니다 예를 들어, 샘플 2가 포함되어있다는 사실을 만들 수 있습니다. 그것은 각 요소의 농도에서 빈 스펙트럼을 측정하기 위해 필요하지 않습니다, 그것은 모든 ~ 0.5 M 단계 빈 스펙트럼을 측정하기 충분하다.
- 이 음모를 얻은 펼쳐의 자유 에너지는 원래의 전개 곡선에서 얻은 것과 약간 다를 수 있지만,보다 정확한 가치를 반영 수 있습니다.
6. 대표 결과 :
| 견본 | 마지막 [요소], M | 재고 단백질 (μL) | 재고 지질 (μL) | 재고 10 M 우레아 (μL) | 주식 버퍼 (μL) |
| 1 | ~ 0.16 | 4 | 40 | 0 | 156 |
| 2 | 1 | 4 | 40 | 20 | 136 |
| 3 | 2 | 4 | 40 | 40 | 116 |
| 4 | 3 | 4 | 40 | 60 | 96 |
| 5 | 4 | 4 | 40 | 80 | 76 |
| 6 | 5 | 4 | 40 | 100 | 56 |
| 7 | 6 | 4 | 40 | 120 | 36 |
| 8 | 7 | 4 | 40 | 140 | 16 |
표 1. 형광 샘플을하기 위해 필요한 재고 솔루션 볼륨

그림 1. 단일 트립토판 성분을 포함하고 ~ 5 μm의 대표 막 단백질의 트립토판 형광 스펙트럼. 단백질의 (A) 생 형광 스펙트럼 (스펙트럼 4.2에서) 빈의 (B) 생 형광 스펙트럼은 (4.2에서 스펙트럼 B) (C) 4.2에서 스펙트럼을 교정.
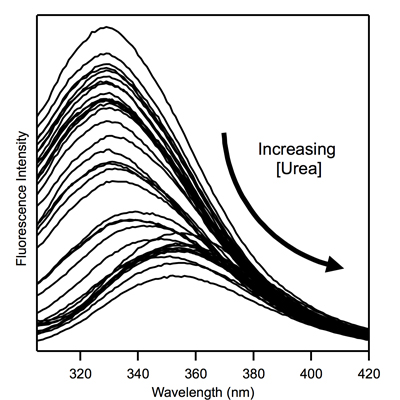
그림 2. 다양한 요소의 농도에 대한 그림 1에서 막 단백질의 트립토판 형광 스펙트럼을 교정.
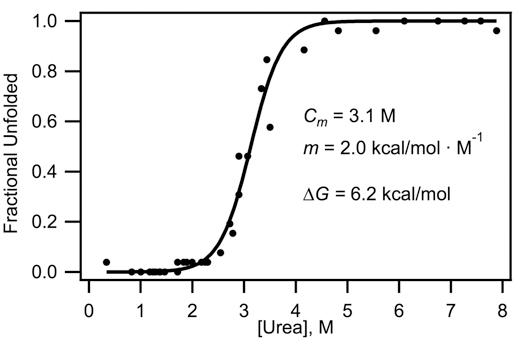
그림 3. 4.4 방정식에 맞게으로 그림 2에있는 데이터에서 얻은 곡선을 펼쳐. 깁스 자유 에너지는 섹션 4.5에 따라 계산됩니다.
토론
현재 프로토콜은 트립토판 잔류물을 포함하는 막 - 관련 단백질과 펩티드의 곡선을 펼쳐의 생성을 설명합니다. 여기, 그것은 트립토판의 형광이 단백질이 접힌 및 합성 지질 vesicles에 삽입하거나, 용액에 펼쳐진 여부를 반영하는 것으로 간주됩니다. 이러한 두 상태 폴딩 및 denaturant 농도와 자유 에너지의 선형 의존성과 같은 추가 가정은, 현재의 보고서에서 만들어집니다,. 다른 방정식에서 이러한 가정의 결과의 수정 2 실험 프로토콜은 쉽게 다른 spectroscopic observables을 활용하는 수정할 수 있습니다, 이러한 원형 dichroism, 흡수, 또는 불순물 염료의 형광 3뿐만 아니라 겔 전기 영동으로 4. 또한, 같은 음이온 lipids 같은 guanidinium, 산성 솔루션, 또는 온도뿐만 아니라 대체 lipids / vesicles와 같은 다른 denaturants,, 대형 unilamellar vesicles, 또는 micelles는 마지막으로 5,6, 프로토콜 어떤 멤브레인 단백질, 막 - 관련 펩티드 및 가역 접는의 기준을 충족 수용성 단백질 / 펩타이드에 적용할 수 있습니다. 활용, 그것은 전시 수있는 spectroscopic 또는 기타 다른 conformational 상태에 대한 관찰 마커. 가용성 단백질의 경우, vesicles은 분명 프로토콜에서 생략됩니다.
펼쳐의 깁스 자유 에너지는 biomolecules 안정화 noncovalent 상호 작용에 대한 통찰력을 제공합니다. 우리가 실험실에서, 우리는 다른 위치에 하나의 트립토판 잔류물을 포함 바깥 막 단백질 (OmpA)의 돌연변이에 대한 곡선을 전개 측정하고, 돌연변이 500 원시 트립토판의 잔류물이 들어있는 야생 형 단백질에 상대적으로 불안 정한다고보고있다. 7 이러한 전개 연구 분자 예를 들어 세부, 수소 결합 및 안정성의 변화를 기초 pairwise 상호 작용을 명료하게하다에 vibrational 분광법 등 다른 기법,에 의해 구비하고 있습니다. 요약에서 펼쳐 곡선의 비교적 간단 기법 막과 단백질 접힘과 관련된 열역학을 나타내기 위해 수용성 단백질에 적용할 수 있습니다.
공개
감사의 말
우리는 그녀의 데이터를 사용하기 위해 베이징 우 감사합니다. 이 작품은 JEK에 NSF 경력 보너스에 의해 지원되었다
자료
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| DMPC | Avanti Polar Lipids | 850345C | ||
| Urea | MP Biochemicals | 04821527 | ||
| Potassium Phosphate Dibasic | Fisher | P288 | ||
| Potassium Phosphate Monobasic | Fisher | P285 |
참고문헌
- Shirley, B. A., Shirley, B. A. . Protein Folding and Stability. , 177-190 (1995).
- Pace, C. N. Determination and Analysis of Urea and Guanidine Hydrochloride Denaturation Curves. Methods Enzymol. 131, 266-279 (1986).
- Lau, F. W., Bowie, J. U. A Method for Assessing the Stability of a Membrane Protein. Biochemistry. 36, 5884-5892 (1997).
- Burgess, N. K., Dao, T. P., Stanley, A. M., Fleming, K. G. β-Barrel Proteins that Reside in the Escherichia coli Outer Membrane in Vivo Demonstrate Varied Folding Behavior in Vitro. J. Biol. Chem. 283, 26748-26758 (2008).
- Booth, P. J., Curnow, P. Folding scene investigation: membrane proteins. Curr. Opin. Struct. Biol. 19, 8-13 (2009).
- Hong, H., Tamm, L. K. Elastic coupling of integral membrane protein stability to lipid bilayer forces. Proc. Natl. Acad. Sci. U.S.A. 101, 4065-4070 (2004).
- Sanchez, K. M., Gable, J. E., Schlamadinger, D. E., Kim, J. E. Effects of Tryptophan Microenvironment, Soluble Domain, and Vesicle Size on the Thermodynamics of Membrane Protein Folding: Lessons from the Transmembrane Protein OmpA. Biochemistry. 47, 12844-12852 (2008).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유