Method Article
תרמודינמיקה של קיפול חלבונים ממברנה נמדד על ידי הקרינה ספקטרוסקופיה
In This Article
Summary
מאמר זה לפרטים וידאו הליך ניסיוני להשגת אנרגיה חופשית של גיבס קיפול חלבונים על ידי קרום טריפטופן פלואורסצנטי.
Abstract
חלבון קיפול ממברנה הוא נושא המתעוררים עם משמעות הן היסוד הקשורים לבריאות. שפע של חלבונים בממברנה של תאים בבסיס הצורך במחקר מקיף של קיפול של משפחה זו נפוצה של חלבונים. בנוסף, ההתקדמות יכולתנו לאפיין מחלות הקשורות חלבונים misfolded יש מוטיבציה המאמצים ניסיונית תיאורטי משמעותי בתחום של קיפול חלבונים. ההתקדמות המהירה בתחום חשוב זה מתעכבת לצערי על ידי האתגרים הכרוכים הקשורים חלבונים בממברנה ואת המורכבות של מנגנון קיפול. כאן, אנו המתאר הליך הניסוי למדידת רכוש התרמודינמית של האנרגיה החופשית של גיבס התגלגלות בהעדר denaturant, Δ G ° H 2 O, חלבון קרום נציג בלתי נפרד מן ה coli. פרוטוקול זה מתמקד ביישום של ספקטרוסקופיה פלואורסצנציה לקבוע אוכלוסיות שיווי משקל של מדינות מקפלת כפונקציה של ריכוז denaturant. שיקולים ניסויית להכנת שלפוחית שומנים סינתטי כמו גם שלבים עיקריים בהליך ניתוח נתונים מודגשים. טכניקה זו היא המגוונת ניתן רדף עם סוגים שונים של denaturant, כולל טמפרטורה ו-pH, כמו גם בסביבות קיפול שונים של שומנים micelles. הפרוטוקול הנוכחי הוא אחד כי ניתן להכליל את קרום או חלבון מסיס אשר עונה על סדרה של קריטריונים בהמשך.
Protocol
1. הכנת ~ 50 ננומטר קוטר שלפוחית Unilamellar קטנים (רכבי השטח) עבור קיפול חלבונים ממברנה
- הפתרון של 1,2-dimyristoyl-SN-glycero-3-phosphocholine (DMPC) שומנים כלורופורם הוא רכש aliquotted לתוך צלוחיות זכוכית נקי 20 מ"ג כמויות בקבוקון לאחסון. שכבה של גז חנקן מתווסף בקבוקון אחד כדי למנוע חמצון של שומנים בדם, ואת צלוחיות חתומות עם כובעים parafilm. צלוחיות מאוחסנים מקפיא ° C -20 עד לשימוש.
- בקבוקון אחד המכיל aliquot של שומנים 20 מ"ג כלורופורם משמש עבור כל ניסוי. תוכנו של הבקבוקון הם יבשים באמצעות זרם של גז חנקן שעה 1 עד לא נשאר ממס.
- שומנים הם יבשים resuspended ב 1 מ"ל של 20 mM אשלגן זרחתי חיץ (pH = 7.3) באמצעות אמבט מים sonicator עבור ~ 30 שניות. זה פתרון של השומנים מושעה יופיעו מעונן, והוא הועבר צינור פלסטיק 15 מ"ל עם תחתית קונית. Aliquot עוד 1 מ"ל של חיץ פוספט מתווסף בקבוקון זכוכית ריק שהכיל במקור שומנים בדם, ו sonication חוזר: פתרון נוסף לאחר מכן הצינור 15 מ"ל אותו. תהליך זה חוזר בסך הכל 4 פעמים עד נפח סופי הצינור הוא 4 מ"ל, וכתוצאה מכך ריכוז השומנים של 5 מ"ג / מ"ל בפתרון זה שלפוחית המניות.
- נפח 4 מ"ל של תמיסת שלפוחית השומנים ממוקם חמה (~ 30 ° C) אמבט מים, sonicated באמצעות microtip ultrasonicator שעה 1 על מחזור של 50%. המטרה של מים באמבטיה היא כפולה. ראשית, הוא מונע את פתרון השומנים מלהפוך חם מדי כי התהליך sonication. שנית, אמבטיה חמה מבטיחה את הטמפרטורה של התמיסה מימית השומנים נשאר מעל טמפרטורת המעבר bilayer שלב במהלך sonication; עבור DMPC, טמפרטורת המעבר הזה הוא ~ 23 ° C.
- הפתרון sonicated עובר דרך מזרק 0.22 מיקרומטר לסנן להסיר פסולת מקצה sonicator, וזה פתרון המסוננים equilibrated לילה בשעה 37 ° C.
2. לדוגמא הכנה Curve ראשוני השתלשלות פלואורסצנטי
- פתרון המניות של אוריאה M 10 במאגר 20 מ"מ פוספט (pH 7.3) הוא עשה. זה חיוני כי מים ניתן להוסיף מוצק (ולא להיפך), כי כמות גדולה של אוריאה תופסת נפח משמעותי לפתרון. פתרון זה אוריאה יכול להתבצע על ידי הוספת מומסים לבקבוק נקי וריק הוספת מים עד נפח סופי המיועד. פתרון זה עשוי לדרוש ההתחממות באמבט מים או על פלטה חשמלית עם בוחש לפזר את המומס. האוריאה הוא hygroscopic ולכן ריכוז בפועל של פתרון המניות אוריאה צריך להיקבע באמצעות מקדם השבירה 1.
- חיץ מניות פתרון של פוספט 20 מ"מ (pH 7.3) הוא עשה.
- פתרון המניות של פרש חלבון מוכן. זה פתרון חלבון המניות צריך ריכוז של חלבון ~ 200 מיקרומטר אוריאה M 8, 20 פוספט חוצץ מ"מ.
- דוגמאות למחקרים הקרינה מוכנים באופן הבא. כמויות מתאימות של חלבונים המניות (סעיף 2.3), שומנים מניות פתרון (5 מ"ג / מ"ל שומנים בדם, סעיף 1), 10 מניות פתרון M אוריאה (סעיף 2.1), ואת פוספט למלאי (סעיף 2.2) הם חברו יחד כדי להפוך דגימות המכילות ~ 4 חלבון מיקרומטר, 1 מ"ג / מ"ל השומנים, ו 0-8 אוריאה M ב 1 במרווחים ז. הנפח הכולל של כל דגימה היא 200 μL. גיליון דוגמא (טבלה 1) נכלל כי כרכים רשימות הנדרשים באמצעות מיקרומטר 200 מניות פתרון חלבון.
- דגימות ריק נעשים כמתואר בסעיף 2.4, לעומת זאת, החלבון אינו הוסיף. במקום חלבון, 4 μL של פתרון M 8 אוריאה ניתן להוסיף כל כך ריכוזי מרכיבים אחרים זהים לאלה בסעיף 2.4. חללים אלה משמשים לחסר פיזור האות רקע אחר המופיע הספקטרום של חלבון פלואורסצנטי.
- דוגמאות מן הסעיפים 2.4 ו -2.5 מותר לדגור על 37 מעלות צלזיוס לפחות 2 שעות לפני מדידת ספקטרום הקרינה כדי להבטיח איזון קיפול מלא.
3. מדידה של ספקטרה פלואורסצנטי
הקרינה טריפטופן המדגם כל ריק נמדדת באמצעות fluorometer היציב. ספקטרום הקרינה צריכה להיות מוקלט עם אורך גל של 290 ננומטר עירור להימנע עירור של שאריות טירוזין, וסרקתי 305-500 ננומטר. הכניסה טיפוסיים bandpass היציאה 3 ננומטר. תוספת אורך הגל וזמן שילוב יכול להיות מותאם עבור יחס אות לרעש. ערכים טיפוסיים עבור תוספת אורך הגל וזמן אינטגרציה הם 1 ננומטר / צעד 0.5 שניות / צעד, בהתאמה. ממברנה חלבונים לקפל לתוך כלל שומנים סינתטי רק כאשר הטמפרטורה היא מעל הטמפרטורה bilayer שלב המעבר. לכן, במקרה זה של DMPC, הטמפרטורה של המדגם מתקיים קבוע ב 30 ° C. קובט סיליקה התמזגו microvolume עם קיבולת 160 μL מנוצל לשעבר הללוperiments.
4. דור Curve השתלשלות אמידה ראשונית של אנרגיה חופשית של גיבס חלבון ממברנה השתלשלות
- ספקטרום הקרינה בצורה של בסיס הנתונים xy נטענים לתוך התוכנה כגון איגור Pro, Matlab, מוצא, או Excel.
- אותות מרקע אוריאה השומנים שלפוחית חייב להיות מופחתים באמצעות ההליך הבא:
ספקטרום הקרינה = ספקטרום הגלם של החלבון בנוכחות שלפוחית שומנים ריכוז מסוים של אוריאה.
ספקטרום B = ספקטרום הקרינה הגלם של מדגם ריק המקביל שלפוחית המכילה שומנים ריכוז אוריאה זהה לזה ספקטרום; חלבון אין בדגימות ריק.
ספקטרום תוקן = קשת - C * קשת ב C הוא סקלר שווה בדרך כלל 1.0. במקרים מסוימים, C הוא פחות או יותר 1.0 בגלל בעיות פיזור שגורמים מעל או מתחת חיסור ליד האזור 305-320 ננומטר ~. - אורך הגל של הקרינה המרבית, λ max, הוא tabulated מן הספקטרום תיקן ריכוז כל אוריאה. ערך אופייני לגמרי פרש חלבון הממברנה הוא 350 ננומטר בעוד זה של חלבון מקופל הוא ~ 330 ננומטר. אורכי גל tabulated מומרים חלק נפרשו ידי המרת טווח הערכים λ max (~ 330 ל ~ 350 ננומטר) לטווח 0.0-1.0 לקשר בין ערך מקסימום λ לשבר של האוכלוסייה פרש. לדוגמה, ערך מרבי λ של 330 nm המתאים 0.0, 350 nm המתאים 1.0, ו - 340 nm המתאים 0.5 במונחים של חלק פרש. חלק זה של חלבון פרש אז הוא זמם נגד ריכוז אוריאה. כאמור לעיל, ריכוז אוריאה צריך להיקבע באופן ניסיוני על ידי מדידת מקדם השבירה.
- אנו מניחים כי החלבון יכול להתקיים באחד משני מצבים: מקופלת או פרש. העלילה של שבריר פרש, F, לעומת ריכוז אוריאה, C, ניתן להתאים את המשוואה: 2

מ מקדם מתאים שיעור השינוי של האנרגיה החופשית ביחס ריכוז denaturant, ו-C מ מתאים ריכוז אמצע אוריאה שבו האוכלוסייה מקופל שווה האוכלוסייה פרש. ערכים אלה הם המשתנים הולם המתקבל הפחות ריבועים הולם על ידי תוכנת ניתוח נתונים. R (0.001987 kcal / mol • K) הוא חוק גז קבוע, ו-T הוא הטמפרטורה (303 K). - המקדמים המתקבלים מתאים מנוצלים כדי לקבוע את תשלום גיבס אנרגיה (קלוריות / mol) של התגלגלות בהעדר אוריאה:
 .
.
5. אופטימליים השתלשלות Curve למדידה מדויקת יותר של אנרגיה חופשית של גיבס התגלגלות.
- עקומת ההתפתחות שתוארו לעיל מגלה את טווח ריכוזי שתנן שגורם השינוי הגדול ביותר מקסימום λ. מגוון זה הוא קטן בדרך כלל, ורוב התגלגלות מתרחשת בטווח הקטן הזה. על מנת לקבוע במדויק את האנרגיה החופשית של התגלגלות, דוגמאות נוספות הם ניתחו באזור זה על מנת לקבל עלילה המכיל הרבה נקודות נתונים הדרושים הולם הפחות ריבועים אופטימיזציה. לדוגמה, אם החלבון מתרחשת בין 2 ל 4 אוריאה M, דוגמאות ניתן שמכילים 2-4 אוריאה M ב 0.2 M במרווחים באופן מדויק יותר לחשוף את הצורה של האזור הזה חשוב עקומת התגלגלות. אין צורך למדוד ספקטרום ריק בריכוז כל אוריאה, זה מספיק כדי למדוד ספקטרום ריק כל ~ 0.5 M צעד.
- אנרגיה חופשית של התגלגלות המתקבל עלילה זו עשויים להיות שונים במקצת מזה שהושג עקומת התגלגלות המקורי, אבל משקפת ערך מדויק יותר.
6. נציג תוצאות:
| מדגם | סופי [דשן], M | חלבון מניות (μL) | מניות השומנים (μL) | המניה 10 M אוריאה (μL) | מניות חיץ (μL) |
| 1 | ~ 0.16 | 4 | 40 | 0 | 156 |
| 2 | 1 | 4 | 40 | 20 | 136 |
| 3 | 2 | 4 | 40 | 40 | 116 |
| 4 | 3 | 4 | 40 | 60 | 96 |
| 5 | 4 | 4 | 40 | 80 | 76 |
| 6 | 5 | 4 | 40 | 100 | 56 |
| 7 | 6 | 4 | 40 | 120 | 36 |
| 8 | 7 | 4 | 40 | 140 | 16 |
טבלה 1. Volume של פתרונות המניות הנדרשת כדי להפוך דגימות פלואורסצנטי

באיור 1. טריפטופן ספקטרום הקרינה של ~ 5 מיקרומטר חלבון נציג קרום המכיל שאריות טריפטופן יחיד. (א) ספקטרום הקרינה גלם של חלבון (ספקטרום מ 4.2) (ב) ספקטרום הקרינה גלם של ריק (ספקטרום B מ 4.2); (ג) תוקן ספקטרום מ 4.2.
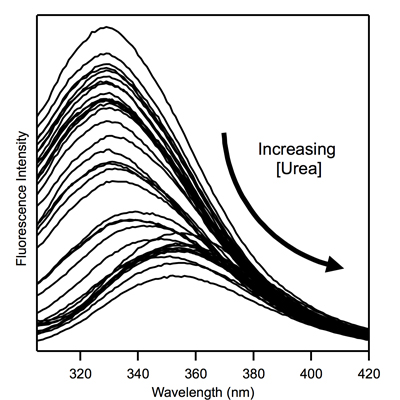
איור 2. מתוקן טריפטופן ספקטרום הקרינה של חלבון הממברנה מ איור 1 עבור ריכוזי שתנן רבים.
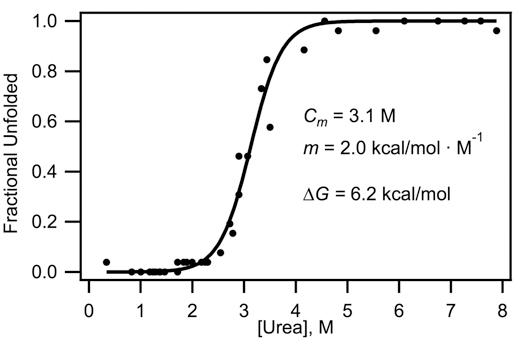
איור 3. השתלשלות עקומת התקבל מנתונים באיור 2, עם לנכון משוואה 4.4. אנרגיה חופשית גיבס מחושב לפי סעיף 4.5.
Discussion
הפרוטוקול הנוכחי מתאר את הדור של התגלגלות עקומות של הממברנה הקשורים חלבונים ופפטידים המכילים שאריות טריפטופן. כאן, ההנחה היא כי הקרינה טריפטופן משקף אם החלבון מקופל ונוסף שלפוחית שומנים סינתטי, או פרש בתמיסה. הנחות נוספות, כגון קיפול של שתי מדינות ותלות ליניארית של אנרגיה חופשית עם ריכוז denaturant, עשויים בדו"ח הנוכחי;. שינוי התוצאה הנחות אלה במשוואות שונות 2 פרוטוקול הניסוי יכול בקלות להיות שונה לנצל observables ספקטרוסקופיות שונות, כגון כמו dichroism קליטה עגול, או הקרינה מן לצבוע חיצונית, 3 וכן ג'ל אלקטרופורזה. 4 בנוסף, denaturants שונים, כגון guanidinium, פתרונות חומצי, או הטמפרטורה, כמו גם שומנים אלטרנטיבית / שלפוחית, כגון שומנים anionic, גדול שלפוחית unilamellar, או micelles, יכול להיות מנוצל. 5,6 לבסוף, את הפרוטוקול יכול להיות מיושם על כל חלבון ממברנה, קרום הקשורים פפטיד, חלבון פפטיד ו / מסיסים אשר עונה על הקריטריונים של קיפול הפיך, וכי תערוכות ספקטרוסקופיות או אחרים סמן הנצפה עבור מדינות קונפורמציה שונה. במקרה של חלבונים מסיסים, שלפוחית מושמטים ברור מן הפרוטוקול.
אנרגיה חופשית של גיבס התגלגלות מספק תובנה על יחסי הגומלין noncovalent כי לייצב ביומולקולות. במעבדה שלנו, יש לנו למדוד התגלגלות עקומות עבור מוטציות של חלבון הממברנה החיצונית (OmpA) המכילים שאריות טריפטופן יחיד במקומות שונים, דיווחו כי היו מוטנטים ערער ביחס חלבון wild-type אשר מכיל חמישה שאריות טריפטופן יליד 7. מחקרים אלה התגלגלות משלימים טכניקות אחרות, כולל ספקטרוסקופיה הרטט, להבהיר פרטים המולקולרי של, למשל, מליטה מימן ואינטראקציות pairwise כי ביסוד וריאציה יציבות. לסיכום, הטכניקה פשוטה יחסית של עקומות התגלגלות יכול להיות מיושם על הממברנה וחלבונים מסיסים לחשוף התרמודינמיקה הקשורים קיפול חלבונים.
Disclosures
Acknowledgements
אנו מודים בייג'ינג וו עבור השימוש בנתונים שלה. עבודה זו נתמכה על ידי בפרס קריירה NSF כדי JEK
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| DMPC | Avanti Polar Lipids | 850345C | ||
| Urea | MP Biochemicals | 04821527 | ||
| Potassium Phosphate Dibasic | Fisher | P288 | ||
| Potassium Phosphate Monobasic | Fisher | P285 |
References
- Shirley, B. A., Shirley, B. A. . Protein Folding and Stability. , 177-190 (1995).
- Pace, C. N. Determination and Analysis of Urea and Guanidine Hydrochloride Denaturation Curves. Methods Enzymol. 131, 266-279 (1986).
- Lau, F. W., Bowie, J. U. A Method for Assessing the Stability of a Membrane Protein. Biochemistry. 36, 5884-5892 (1997).
- Burgess, N. K., Dao, T. P., Stanley, A. M., Fleming, K. G. β-Barrel Proteins that Reside in the Escherichia coli Outer Membrane in Vivo Demonstrate Varied Folding Behavior in Vitro. J. Biol. Chem. 283, 26748-26758 (2008).
- Booth, P. J., Curnow, P. Folding scene investigation: membrane proteins. Curr. Opin. Struct. Biol. 19, 8-13 (2009).
- Hong, H., Tamm, L. K. Elastic coupling of integral membrane protein stability to lipid bilayer forces. Proc. Natl. Acad. Sci. U.S.A. 101, 4065-4070 (2004).
- Sanchez, K. M., Gable, J. E., Schlamadinger, D. E., Kim, J. E. Effects of Tryptophan Microenvironment, Soluble Domain, and Vesicle Size on the Thermodynamics of Membrane Protein Folding: Lessons from the Transmembrane Protein OmpA. Biochemistry. 47, 12844-12852 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved