(紫外-可視) 紫外可視分光法
概要
ソース: 研究所博士 b. ジル Venton - ヴァージニアの大学の
(紫外-可視) 紫外可視分光法は、それは非常に汎用性とほぼすべての分子を検出することができるので最も人気のある分析手法の一つです。紫外可視分光法、紫外-可視光が試料を通過、サンプルによる光の透過率を測定します。透過率 (T) から = ログ (T) として吸光度を計算できます。吸光度スペクトルが得られ、異なる波長で化合物の吸光度を示しています。任意の波長で吸光度の量は、分子の化学構造によるものです。
紫外-可視は、機能グループを識別または吸光度スペクトルを照合することによって化合物の id を確認する質的な方法で使用できます。試料の濃度はビールの法則を使用して吸光度に関連して、定量的な方法では使用もできます。紫外可視分光法を使用して、DNA や水の分析のため、各種クロマトグラフィーの検出器としてサンプルの蛋白質の量を定量化します。化学反応速度論も、時間をかけて繰り返し紫外-可視計測することで紫外可視分光法による測定されます。紫外-可視計測は、分光光度計で一般的に撮影されます。それは多くの化合物を検出できるため、紫外-可視は、またクロマトグラフィーなどの他の分析技術の非常に人気のある器です。
通常、紫外-可視は短いパスの長さにわたっていない多くの光が吸収されるため、最も敏感な分光法ではありません。蛍光など他の分光学の技術はより高い感度が、ほとんどの分子は蛍光ではないと一般にできるが。紫外可視赤外分光法などの他の吸光度測定に似たような感性があります。
原則
紫外-可視紫外-可視波長範囲でほとんどの分子が吸収するので一般的な手法と呼ばれます。紫外線は 100-400 nm、400-700 nm の可視スペクトルから拡張します。100-200 nm の波長範囲を深い紫外線と呼びます。光源は、それが日常的に紫外-可視計測に使用されないように、この範囲の見つけることは困難です。典型的な紫外可視分光器は、350-2,500 nm からの光を生成する生成が表示、170-375 nm のタングステン フィラメント電球からライト、UV の重水素ランプを使用します。
光子は分子に当たるし、吸収は、分子はより興奮しているエネルギッシュな状態に昇格されます。紫外可視光より高い電子状態、最低非占有分子軌道 (LUMO) を最高占有分子軌道 (ホモ) から電子を促進するために十分なエネルギーがあります。ヒトと、LUMO のエネルギーの違いは、バンド ギャップと呼ばれます。通常、これらの軌道は、接合及び反結合軌道と呼ばれます。光子のエネルギー吸収する光子のバンド ギャップと正確に一致する必要があります。したがって、異なるエネルギー バンド ギャップと異なる光吸収スペクトル化学構造の異なる分子があります。紫外-可視範囲に最も一般的な遷移は、π-π * と n-π *。Pi の軌道関数が二重結合を生じ、n 軌道、非結合電子のため。Pi スターは、反結合軌道 π 軌道です。したがって、最高の紫外可視吸収は分子の二重結合を含むです。互いに隣接して接続するいると呼ばれる共役 π 軌道は通常吸収を増加します。シグマ-つの単一結束に関連付けられた σ * 遷移、高いエネルギーは、日常的な使用のためにより少なく有用、深紫に落ちる。ブロード バンドまたは紫外-可視の構造上肩の外観は、多数振動・回転状態を分子の別のわずかに異なるエネルギーのエネルギー バンド ギャップにつながるためです。
可視領域に吸収を持つ分子の化合物がしばしば色付き表示されます。しかし、一般的な誤解は化合物の (λmax) ピークの吸収の波長が表示される色であります。赤で表示されている化合物には、スペクトルの赤色領域で多くの吸収はありません。代わりに、緑色、λmaxのため赤く見える化合物です。化合物の色は、光の波長が、試料を透過する選択的に、従って彼らは吸収されないためにを発生します。カラー ホイールは、化合物を吸収する色、どのような範囲、λmaxになります、, カラーからホイールを横切って直接色が最も吸収が色を決定するのに便利です。
吸収後ビールの法律、A εbC、ε はモルの減衰係数、b はパスの長さと C は濃度を =。モルの減衰係数は特定波長を吸収するための個々 の化合物の特性と官能、活用等により、このプロパティは。化合物に高い減衰係数が設定されていない場合は、その吸光度を高める適切なグループでタグでした。パスの長さは一般的にキュヴェットのサイズに関連で、標準的な分光光度計で 1 cm。
紫外-可視より多くの現代板読者に伝統的な分光光度計から、楽器の様々 な実行されます。フィルターまたは分光器を使用するか、吸収波長を選択する必要があります。分光器は、波長の光を空間的に分離し、光の所望の波長が、出口スリットを配置しますデバイスです。モノクロ メーターは、全体の吸光度スペクトルを提供するためにスキャンできます。また、ダイオード アレイ装置により、試料を透過する光のすべての色、光空間波長が分かれてし、フォト ダイオードを使用して検出されました。ダイオード アレイ探傷器におけるスペクトルを高速収集しますが、より複雑でより高価。
手順
1. 分光計をキャリブレーションします。
- 紫外可視分光光度計をオンにし、適切な期間 (約 20 分) それらを安定させるためのウォーム アップするランプを許可します。
- サンプルの溶剤とキュベットを埋める、外側がきれいかどうかを確認します。これは空白として使用し、溶媒による吸収や散乱による光損失を考慮を助けます。
- 分光計のキュヴェットを配置します。正しくキュヴェットを合わせて確認してください、頻繁にキュヴェットが (溝があります) 処理のためのもので光を当てる必要はありません 2 つの側面を持っています。
- ダミーのための読書を取る。吸光度は、最小限にする必要がありますが、任意の吸光度を将来のサンプルから減算する必要があります。いくつかの楽器は、空白データを格納し、自動的に減算を実行可能性があります。
2. 吸光度スペクトルを実行します。
- サンプルでキュヴェットを埋めます。転送が定量的であることを確認、サンプルで二回キュベットをリンスし、完全な 3/4 の塗りつぶします。外に指紋等のきれいなことを確認します。
- 正しい方向に分析計のキュヴェットを配置します。
- 周囲の任意の光を防ぐためにキュベットをカバーします。
- 異なる波長をスキャンし、吸光度を収集器により吸光度スペクトルを収集します。波長範囲は、特定のサンプルについての情報を設定できますが、200-800 nm の範囲が標準。フォト ダイオード アレイ計測器は 1 つ実行中全体の吸光度スペクトルを収集することができます。
- 収集された吸光度スペクトルから吸光度の最大値 (λmax) を決定します。Λmaxで誤差の見積もりを取得するスペクトルのコレクションを繰り返します。
- 較正曲線をするためには、さまざまな濃度の異なるサンプルの紫外-可視スペクトルを収集します。分光線形の範囲に限られているし、1.5 より大きい吸光値を測定することはできません。サンプルの吸光度値が測定器の線形範囲外なら、線形の範囲内の値を取得するサンプルを希釈します。
3 紫外可視分光法を用いた速度実験
- 紫外-可視は、時間をかけて吸光度の変化を調べることによって反応速度論の実験に使用できます。反応速度論の実験では、サンプルの最初の読み取りを取る。
- すぐに化学反応を始める試薬を追加します。
- それをかき混ぜるもサンプルと混合します。少量を追加すると、これはキュベットで行うことができます。または、サンプルと試薬を混合し、迅速測定キュベットにいくつかを注ぐ。
- 時間をかけて、λmaxのための興味の analyte の吸光度を測定します。測定されている試薬を使用している場合 (すなわち吸光度が上がって吸収する以下の試薬があるので)、腐食は反作用の順序を指定します。
- 検量線を使用すると、吸光度値濃度に変換、検体濃度対時間のプロットを作る。そこから、反応速度定数を決定する、適切な式でこのグラフを合うことができます。
結果
紫外-可視色化合物のスペクトルを取得する使用できます。図 1 a、青色色素の吸光度スペクトルが表示されます。背景は、可視スペクトルの光の色を示しています。青い色素は、オレンジ/レッドの λ の最大吸光度です。図 1 bは、λmaxで緑と赤の染料スペクトルを示しています。
速度は、時間をかけて 1 つの波長で吸光度のプロットから測定できます。図 2は、青色色素の吸光度のプロットを示しています (630 で nm) それは漂白剤と反応しています。
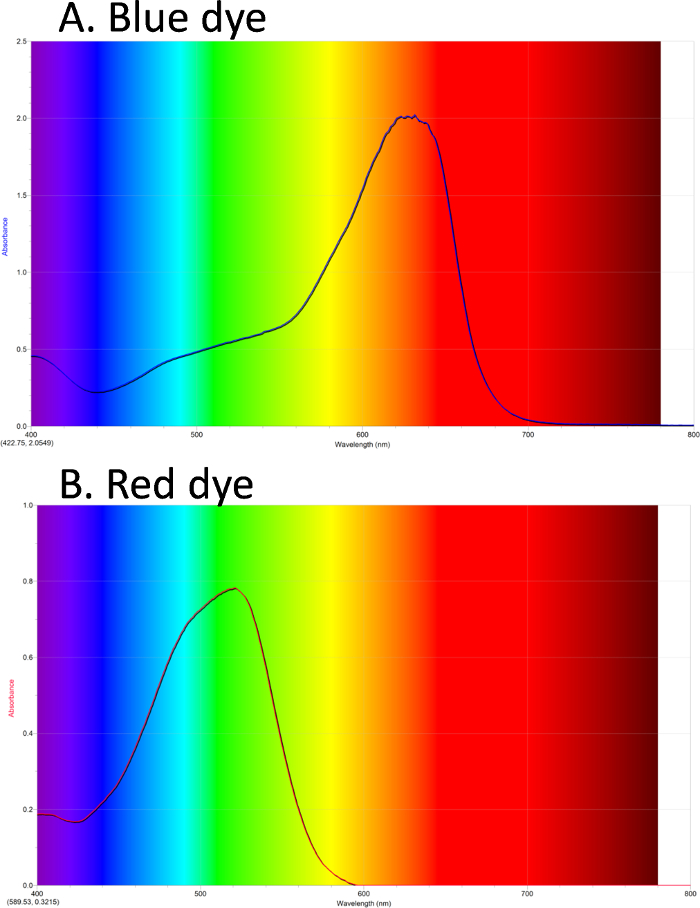
図 1。紫外可視吸光度スペクトル。A.青の染料 #1 は、赤/オレンジの最大吸光度。B.赤染料 #40 は、緑の最大吸光度。この図の拡大版を表示するのにはここをクリックしてください。

図 2。紫外-可視速度のため。吸光度青色色素 #1 としてそれを漂白剤と反応します。曲線は、指数関数的減衰、最初順序の動力学を示すと合うことができます。この図の拡大版を表示するのにはここをクリックしてください。
申請書と概要
紫外-可視は、多くの化学分析で使用されます。ほとんどの蛋白質は 280 で強く吸収するので、溶液中の蛋白質の量を量的に使用されます nm。図 3は、スペクトル チトクロム C, ヘム グループのため 280、450 高吸光度を持っているの例を示します。260 ですべての拠点を強く吸収するので紫外-可視が、サンプルの DNA 量を定量化する標準的な技術として使用はまた nm。260 RNA および蛋白質はまた吸収するので、干渉をチェックする他の波長での吸光度を測定できます。具体的には、タンパク質を吸収強く 280 nm、280/260 で吸光度の比率はサンプルの DNA に蛋白質の比率の測定を与えることができるので。
最も簡単な分析は、同時に吸光度の 1 つの波長を測定します。しかしより化学物質情報は同時に多くの波長で測定を行う場合です。フォト ダイオード アレイ機器キャプチャ、送信されるすべての光はプリズムやホログラム回折格子を使用して別の色に光を分割し、フォト ダイオードの線形配列で異なる波長で吸光度をキャプチャします。この方法の利点は、多くの異なった分子を同時に測定できる有用なことです。

図 3。タンパク質の紫外-可視スペクトル。ピーク 280 nm は蛋白質を示す。チトクローム c. ヘムグループの吸光度が 450 でピーク
タグ
スキップ先...
このコレクションのビデオ:

Now Playing
(紫外-可視) 紫外可視分光法
Analytical Chemistry
621.9K 閲覧数

試料分析の準備のため
Analytical Chemistry
84.3K 閲覧数

社内基準
Analytical Chemistry
204.4K 閲覧数

標準添加法
Analytical Chemistry
319.4K 閲覧数

検量線
Analytical Chemistry
794.8K 閲覧数

ラマン分光を用いた化学分析
Analytical Chemistry
51.0K 閲覧数

蛍光 x 線 (XRF)
Analytical Chemistry
25.3K 閲覧数

炎イオン化検出ガスクロマトグラフィー (GC)
Analytical Chemistry
281.1K 閲覧数

高速液体クロマトグラフィー (HPLC)
Analytical Chemistry
383.1K 閲覧数

イオン交換クロマトグラフィー
Analytical Chemistry
263.9K 閲覧数

キャピラリー電気泳動 (CE)
Analytical Chemistry
93.4K 閲覧数

質量分析への紹介
Analytical Chemistry
112.0K 閲覧数

走査型電子顕微鏡 (SEM)
Analytical Chemistry
86.8K 閲覧数

ポテンショスタット/Galvanostat を使用して担持触媒の電気化学測定
Analytical Chemistry
51.3K 閲覧数

サイクリックボルタンメトリー (CV)
Analytical Chemistry
124.3K 閲覧数
Copyright © 2023 MyJoVE Corporation. All rights reserved