Method Article
無細胞発現系のカプセル化による細菌グルタミン酸受容体チャネルの再構成
* これらの著者は同等に貢献しました
要約
このプロトコルは、脂質二重層へのモデル膜タンパク質の合成および取り込みの研究のために、巨大単層小胞(GUV)内に無細胞発現(CFE)システムをカプセル化するために使用される逆エマルジョン法を説明しています。
要約
無細胞発現(CFE)システムは、合成生物学における強力なツールであり、合成細胞におけるバイオセンシングやエネルギー再生などの細胞機能のバイオミミクリーを可能にします。しかし、広範囲の細胞プロセスを再構築するには、膜タンパク質を合成細胞の膜にうまく再構成する必要があります。可溶性タンパク質の発現は通常、一般的なCFEシステムで成功しますが、合成細胞の脂質二重層における膜タンパク質の再構成は困難であることが証明されています。本研究では、モデル膜タンパク質である細菌のグルタミン酸受容体(GluR0)を巨大単層小胞(GUV)に再構成する方法を、合成細胞内でCFE反応をカプセル化し、インキュベーションすることに基づいて、モデル合成細胞として紹介します。このプラットフォームを利用して、GluR0のN末端シグナルペプチドをプロテオロドプシンシグナルペプチドに置き換えることで、GluR0のハイブリッドGUVの膜への共翻訳転座の成功に対する効果が実証されます。この方法は、合成細胞中のさまざまな膜タンパク質を無細胞で再構成することを可能にする堅牢な手順を提供します。
概要
ボトムアップ合成生物学は、バイオエンジニアリング、ドラッグデリバリー、再生医療など、数多くの応用が期待できる新興分野として、過去10年間で関心が高まっています1,2。特に、ボトムアップ合成生物学の礎石としての合成細胞の開発は、合成細胞の有望な応用と、in vitro生物物理学的研究を容易にするその細胞様の物理的および生化学的特性により、幅広い科学コミュニティを引き付けています3,4,5,6 .合成細胞は、多くの場合、細胞サイズの巨大単層小胞(GUV)で操作され、そこでさまざまな生物学的プロセスが再現されます。細胞細胞骨格の再構成7,8、光依存性エネルギー再生9、細胞コミュニケーション10,11、およびバイオセンシング12は、合成細胞における細胞様挙動を再構築するためになされた努力の例である。
一部の細胞プロセスは可溶性タンパク質に依存していますが、センシングやコミュニケーションなどの天然細胞の多くの特性は、イオンチャネル、受容体、トランスポーターなどの膜タンパク質を利用することがよくあります。合成細胞の発生における大きな課題は、膜タンパク質の再構成です。脂質二重層における膜タンパク質再構成の従来の方法は、界面活性剤を介した精製に依存していますが、このような方法は手間がかかり、発現宿主に毒性のあるタンパク質には効果がなく、GUVの膜タンパク質再構成には適していないことがよくあります13。
タンパク質発現の代替方法は、無細胞発現(CFE)システムです。CFEシステムは、細胞溶解物または精製転写翻訳装置14を用いて、さまざまなタンパク質のin vitro発現を可能にする合成生物学における強力なツールである。CFEシステムは、GUVにカプセル化することもでき、したがって、光収集合成細胞9または機械感受性バイオセンサー15,16の作成など、さまざまなアプリケーション向けにプログラム可能な区画化されたタンパク質合成反応を可能にする。組換えタンパク質発現法と同様に、CFEシステムでは膜タンパク質発現が困難です17。CFEシステムにおける凝集、ミスフォールディング、翻訳後修飾の欠如は、CFEシステムを用いた膜タンパク質合成の成功を妨げる主要なボトルネックです。CFEシステムを用いたボトムアップ膜タンパク質再構成の難しさは、シグナルペプチド、シグナル認識粒子、トランスロコン、シャペロン分子に依存する複雑な膜タンパク質生合成経路が存在しないことが一因です。しかし、最近では、翻訳中にミクロソームやリポソームなどの膜構造が存在すると、膜タンパク質の発現が成功することが複数の研究で示唆されています18,19,20,21。さらに、EaglesfieldらおよびSteinküherらは、シグナルペプチドとして知られる特定の疎水性ドメインを膜タンパク質のN末端に含めることで、その発現を有意に改善できることを発見した22,23。全体として、これらの研究は、合成細胞における膜タンパク質の再構成の課題は、タンパク質の翻訳がGUV膜の存在下で行われ、適切なN末端シグナルペプチドが利用されれば克服できることを示唆しています。
ここでは、GUVにおける膜タンパク質再構成のための組換え要素(PURE)CFE反応を用いたタンパク質合成のカプセル化のためのプロトコールを紹介します。モデル膜タンパク質として細菌のグルタミン酸受容体24 (GluR0)を選択し、そのN末端シグナルペプチドが膜再構成に及ぼす影響について研究しています。Eaglesfieldらによって膜タンパク質再構成効率を改善することが示されたプロテオロドプシンシグナルペプチドの効果について、PRSP-GluR0と表記されるGluR0の変異変異体を構築することで検討し、その天然シグナルペプチドを保有する野生型GluR0(以下、WT-GluR0)との発現と膜局在を比較する。このプロトコルは、逆エマルジョン法25 に基づいており、CFEカプセル化に対して堅牢になるように修正されている。提示された方法では、CFE反応は、最初に油中脂質溶液を使用して乳化され、CFEシステムを含み、脂質単分子膜によって安定化されるミクロンサイズの液滴が生成されます。次に、エマルジョン液滴は、別の脂質単層で飽和した油水界面の上に層状になります。次に、エマルジョン液滴は遠心力を介して油水界面を横切って移動するように強制されます。このプロセスを通じて、液滴は別の単層を獲得し、二重層脂質小胞を生成します。次に、CFE反応を含むGUVをインキュベートし、その間に膜タンパク質を発現させてGUV膜に取り込む。このプロトコルは、GluR0の無細胞発現のために指定されているが、他の膜タンパク質の無細胞合成や、細胞骨格再構成や膜融合研究26などの異なる合成細胞応用に用いることができる。
プロトコル
この研究に使用した試薬と機器は、 資料表に記載されています。
1. 小さな単層小胞(SUV)の存在下でのバルクCFE反応
- SUVの準備
注:この手順は、クロロホルムの使用に関する安全指示に従って、ドラフト内で実行する必要があります。- ガラスバイアルに5 mM 1-パルミトイル-2-オレオイル-グリセロ-3-ホスホコリン(POPC)SUVを調製するには、クロロホルムに溶解した25 mg/mL POPCストック溶液76 μLを移します。
- ガラスバイアルを静かに回転させながら、アルゴンをバイアルに穏やかに吹き込み、底に乾燥脂質の膜を形成します。次に、ガラスバイアルをデシケーターに移し、キャップを緩くねじ込んで余分なクロロホルムを蒸発させます。
- ガラスバイアルをデシケーターに1時間保管します。その後、0.5mLの超純脱イオン水を加えて脂質膜を溶解し、約2分間ボルテックスします。
- 2つのフィルターサポートを脱イオン水に浸し、それらを各内膜サポートに配置することにより、ミニ押出装置をセットアップします。次に、100 nmのポリカーボネートフィルターを浸し、エクストルーダーのアウターケーシングとリテーナーナットで一緒に保持されている2つの内部メンブレンサポートの間に置きます。このセットアップをエクストルーダースタンドに置きます。
- 2つの1 mL気密シリンジを超高純度脱イオン水で3回洗い流します。
- 脂質と水の混合物のサンプルを1 mLの気密シリンジの1つにロードし、スイングアームクリップを使用してシリンジを所定の位置に保持するミニエクストルーダーの一方の端に置きます。2番目のシリンジをミニエクストルーダーのもう一方の端に挿入し、完全に押し下げられていることを確認します。
注意: シリンジに脂質と水の混合物をセットするときは、シリンジをミニ押出機に通す前に、シリンジに空気がないことを確認してください。 - 元のシリンジからの脂質と水の混合物をミニ押出機装置を介して空のシリンジに静かに通過させます。.この手順を11回繰り返して、SUVを形成します。SUVを1.5mLの微量遠心チューブに移します。
注:SUV溶液は、4°Cで最大2週間保存できます。
- CFE反応アセンブリ
- CFE反応は、以下で詳述するわずかな変更を加えたメーカーが提供する無細胞発現プロトコルに従って組み立てます。
- 溶液1(アミノ酸、NTP、tRNAおよび酵素用基質、および必要な緩衝液を含む)10μL、溶液2(タンパク質20%グリセロール中タンパク質)1μL、溶液3(リボソーム(20μM))2μL、可溶性sfGFP-sfCherry(1-10)27(以下、可溶性sfGFPと呼ぶ)、WT-GluR0-sfGFP、またはPRSP-GluR0-sfGFP(10-60ng/1000塩基対)を10μL混合し、 1 μLマウスRNAse阻害剤、および膜タンパク質用の5 mM SUV溶液4 μLまたは可溶性タンパク質用の4 μLの水。
- 超高純度の脱イオン水を加えて、反応の最終容量を20 μLにします。
注意: CFEシステムを組み立てるときは、すべてのコンポーネントを氷の上に置いておく必要があります。すべての材料は温度に敏感であり、室温に達すると劣化する可能性があります。
- CFE反応のインキュベーションとモニタリング
- CFE溶液を96ウェル円錐形V底プレートに移します。反応中の蒸発を防ぐために、シーリングフィルムを使用してプレートを覆います。
- プレートリーダーでプレートを37°Cで4〜5時間インキュベートし、CFE反応をモニタリングしながら、488 nm/528 nmの励起/発光波長で2分ごとに100のゲインでGFPシグナルを測定します。
2. GUVに封入されたCFE反応
- GUVアウターバッファー溶液の調製
- 1.5 mLの微量遠心チューブに、1 Mスペルミジン1.5 μL、100 mM ATP37.5 μL、100 mM GTP25 μL、100 mM CTP12.5 μL、100 mM CTP12.5 μL、100 mM UTP25 μL、1 Mクレアチンリン酸25 μL、1 M酢酸マグネシウム18 μL、3 Mグルタミン酸カリウム93.33 μLを混合します。 50 μL の 1 M HEPES KOH (pH 7.4)、1.15 μL の 332 mM フォリン酸、100 μL の 2 M グルコース、および 50 μL の 20 アミノ酸のそれぞれの 6 mM 混合物のストック溶液 (Sun et al.28 に記載されているプロトコルに従って調製)。
- 超精製脱イオン水を加えて、溶液の最終容量を1 mLにします。
注意: すべてのコンポーネントは氷上に保管する必要があります。アミノ酸の枯渇を避けるために、最後にアミノ酸混合物を追加します28。溶液は330μLのアリコートに分注し、使用するまで-20°Cで保存できます。
- 油中脂質混合物の調製
注:この手順は、クロロホルムの使用に関する安全指示に従って、ドラフト内で実行する必要があります。- ドラフト内で、17.3 μLの25 mg/mL POPCストック溶液と1.08 μLの50 mg/mLポリ(ブタジエン)-b-ポリ(エチレンオキシド)(PEO-b-PBD)共重合体を15 mLガラスバイアルに混合します。
注:最終的な油中脂質溶液には、0.5 mMの脂質と95%および5%のPOPCおよびPEO-b-PBDが含まれています。PEO-b-PBDは、タンパク質発現中の膜安定性を高めるために使用されましたが、脂質分子29,30から分離したミセルに凝集するコポリマーの傾向を減らすために、低分子比に保たれました。 - ガラスバイアルにアルゴンガスをゆっくりと吹き込み、バイアルを回転させてクロロホルムを蒸発させます。
- 乾燥脂質が入った15mLのガラスバイアルに1.2mLの軽質鉱物油をピペットで入れます。
- 脂質と油を最高速度で10〜20秒間ボルテックスして混合します。溶解した脂質-共重合体混合物は白濁して見えます。
- オイル中の脂質凝集体がすべて完全に溶解し、オイル全体に分散するようにするには、ガラスバイアルを約50°Cのオーブンに20分間入れてから、最大速度でさらに10〜20秒間ボルテックスします。
- ドラフト内で、17.3 μLの25 mg/mL POPCストック溶液と1.08 μLの50 mg/mLポリ(ブタジエン)-b-ポリ(エチレンオキシド)(PEO-b-PBD)共重合体を15 mLガラスバイアルに混合します。
- CFE反応の組み立てとカプセル化(図1 は以下のステップをまとめたものです)。
- ステップ 2.1 で調製した CFE 外部緩衝液 270 μL、5 M NaCl 15 μL、4.5 M KCl 15 μL を混合して、1.5 mL の微量遠心チューブに 300 μL の GUV 外部溶液を調製します。
注:このステップでは、0.45 μLの1 M 1,4-ジチオスレイトール(DTT)をGUV外部溶液に加えます。NaClとKClを添加する目的は、外側の溶液の浸透圧を内側のCFE溶液と一致するように調整することです。NaClとKClの正確な量は、所望の浸透圧調整に依存します。NaClまたはKClのいずれか、あるいは両方を追加して浸透圧を調整できます。 - 300 μLの脂質中油混合物をGUV外部溶液の上に静かにピペットで移します。
注:脂質と油の混合物を添加するときは、油が水溶液と混ざらないことが重要です。添加後、脂質中油混合物とGUV外部溶液との間には目に見える界面があるはずです。 - 油-水界面を室温で2時間インキュベートし、脂質単層が界面で形成および安定化するのを待ちます。
- その間、セクション1.2.1に従って、膜タンパク質バリアントまたは可溶性GFPをコードするプラスミドDNAを含むCFE反応を組み立てます。4 μL の 5 mM SUV 溶液または水を 4 μL の 1 M スクロースと交換します。この反応がGUV内部溶液になります。
注:浸透圧計を使用して、内部溶液と外部溶液の浸透圧を測定しました。次に、外側の溶液の浸透圧は、NaClまたは水の添加によってそれに応じて調整されました。CFE反応の浸透圧は通常約1600 mOsm/Kgで、反応にスクロースを添加すると内部溶液密度が増加し、遠心分離ステップ中に小胞が油水界面を横切って移動できるようになります。スクロースの代替品は、Opti-Prep密度グラジエントソリューションです。 - CFE反応液を収めた微量遠心チューブに600μLの脂質-油混合物を加え、~1分間激しく上下にピペットで動かして、油中脂質溶液中で反応液を乳化させ、合成細胞の周囲に脂質単層を形成します。
注:最終的な溶液には気泡がなく、不透明に見える必要があります。 - 油水界面が設定された1.5mL微量遠心チューブの油層の上に、内液エマルジョンを静かにピペットで移します。
メモ: インターフェースを邪魔したり、不安定にしたりしないように注意してください。 - 2,000 x g 、4°Cで10分間遠心分離します。
注:遠心分離速度は、このプロトコル用に最適化されています。Adir et al.31 は、異なる遠心分離速度を報告しました。 - 遠心分離が終了したら、ピペッターを使用して、余分な油と外部溶液をマイクロ遠心チューブから慎重に取り除きます。残りの容量が約100μLになるまで、外部溶液を取り出します。
注:GUVのペレットは通常、微量遠心チューブの底に見えます。しかし、目に見えるペレットがないからといって、必ずしもGUVの収量がないわけではありません。ピペッターを使用する代わりに、外側の溶液の上にある余分な油分を吸引して取り除くことができます。油中脂質溶液が完全に除去されていることを確認することが重要です。GUV溶液中の油分汚染は、低品質の画像を引き起こす可能性があります。 - ピペッティングで静かに上下させて、残りの100 μL溶液にGUVペレットを再懸濁します。次に、GUV溶液をきれいな96ウェルクリアフラットボトムプレートに移してインキュベートします。
- ステップ 2.1 で調製した CFE 外部緩衝液 270 μL、5 M NaCl 15 μL、4.5 M KCl 15 μL を混合して、1.5 mL の微量遠心チューブに 300 μL の GUV 外部溶液を調製します。
3. カプセル化されたCFE反応のインキュベーションとイメージング
- プレートをシールフィルムで覆い、蒸発を防ぎます。プレートを37°Cで5〜6時間インキュベートします。プレートリーダーを使用し、ステップ1.3.2に従って、インキュベーションステップ用のプレートリーダーを準備できます。
- インキュベーションが終了したら、EMCCDカメラ(またはsCMOSカメラ)、DAQ-MX制御レーザー(または統合レーザーコンバイナーシステム)、およびCSU-X1スピニングディスク共焦点(またはレーザー走査型共焦点)を備えた倒立顕微鏡のイメージングステージに96ウェルプレートを置きます。GUVを含むROIに注目し、Plan-Apochromat 60 x/1.4 NA対物レンズを使用して488 nmの励起波長で画像を撮影します。
- GUVの画像を.tiff形式で保存します。
- 画像処理ソフトウェア(ImageJやFijiなど)で画像を開きます。 明るさ/コントラスト 設定パネルを開きます。蛍光タンパク質が見えるように、明るさとコントラストを適切な設定に調整します。
- 発現した異なるタンパク質のシグナル強度を比較することが目的である場合は、まず、Image > Stacksサブメニューの下にあるImages to Stackパネルを使用して、異なるタンパク質を含むGUVの個々の画像をスタックします。次に、明るさ/コントラストパネルを使用して、すべての画像の明るさとコントラストを調整します。
結果
CFE反応をカプセル化する前に、未変性シグナルペプチドとプロテオロドプシンシグナルペプチド(シグナルペプチド配列は 補足表1に示されています)を持つGluR0-sfGFPの2つのバリアントと可溶性sfGFPをバルク反応で個別に発現させ、プレートリーダーを使用してsfGFPシグナルを検出することによりそれらの発現をモニターしました(図2A)。).膜タンパク質は、100 nm SUVの非存在下または存在下で発現しました。さらに、sfGFPシグナルをその濃度に相関させる検量線(補足図1)を用いて、合成タンパク質の濃度を推定しました(補足表2)。明らかに、可溶性sfGFPは3つのタンパク質の中で最も高い発現を示しており、これは膜タンパク質の発現がCFEシステムに負荷をかけ、反応を遅らせ、その収量を低下させることを示唆しています。さらに、平均して、SUVの存在下で膜タンパク質を発現する反応は、SUVを欠く反応と比較して高いsfGFPシグナルを示しました。この観察結果は、膜タンパク質の発現がCFEシステムのタンパク質産生能力を低下させることを示したSteinküherらの知見と一致している23。それにもかかわらず、バルクCFE反応におけるタンパク質発現の実証が成功したことを考えると、カプセル化されたCFEはGUV内のタンパク質も合成すると推論できます。
次に、個々のCFE反応を逆エマルジョン法を用いてGUVにカプセル化し、GluR0の変異体、すなわちWT-GluR0、PRSP-GluR0、および可溶性sfGFPを発現させました。WT-GluR0は、GluR0のネイティブシグナルペプチドを保有しており、優れた発現と膜局在を示しましたが(図2B左パネル)、プロテオロドプシンN末端シグナルペプチドを持つPRSP-GluR0は、同様の強い膜局在を示しませんでした。PRSP-GluR0は、凝集と点状形成を起こしやすいことがわかりました(図2B、中央パネル)。予想通り、可溶性sfGFPはGUVで発現し、GUV内腔に留まりました(図2B、右パネル、GUVのコホートの画像については 補足図2 を参照)。
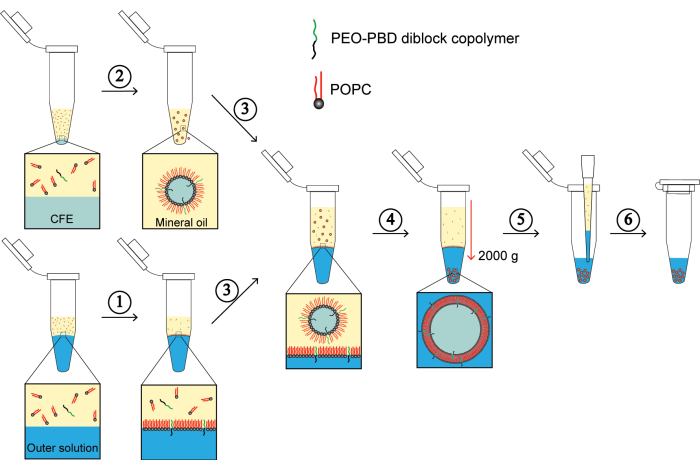
(1)プロトコルのステップ2.3.1からステップ2.3.3を可視化して、脂質-油混合物と外部緩衝液の界面における脂質単層の集合を実証する。(2)プロトコールのステップ2.3.5の可視化は、内部CFE溶液をカプセル化する乳化液滴の周りの脂質単層の形成を表すためにここに示されています。(3)プロトコルのステップ2.3.6は、脂質-油混合物と外部緩衝液の界面に脂質単層を有する微量遠心チューブへの単層GUVの添加を示しています。(4)ステップ2.3.7がここに描かれており、遠心分離により外部溶液中にGUVペレットが形成されます。(5)ステップ2.3.8は、余分な油中脂質混合物と外部溶液を除去するプロセスを示しています。(6)最後に、ステップ2.3.9をここに示し、GUVペレットを外部溶液に再懸濁し、GUVをインキュベーションする準備が整い、続いてイメージングを行います。この図の拡大版を表示するには、ここをクリックしてください。
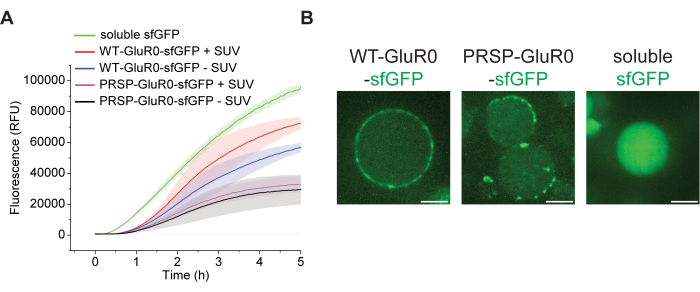
図2:バルクCFE反応およびCFE反応をカプセル化したGUVにおけるタンパク質発現 (A)WT-GluR0-sfGFP、PRSP-GluR0-sfGFP、および可溶性sfGFPを発現する個々のバルクCFE反応の蛍光読み出し。可溶性sfGFPグラフは、プレートリーダー測定値の過飽和を避けるために、2.5 μLの反応(標準反応量は20 μL)からのシグナルを表しています。データは平均± S.D、 n = 3として表されます。(B)左:WT-GluR0-sfGFPを発現するGUV内包CFE反応の代表的な共焦点像。中央:PRSP-GluR0-sfGFPを発現するCFE反応を内包したGUVの代表的な共焦点像。右:可溶性sfGFPを発現するCFE反応をカプセル化したGUVの代表的な共焦点像。スケールバー:10μmこの 図の拡大版を表示するには、ここをクリックしてください。
補足図1:sfGFPシグナル検量線とそれに対応する線形回帰分析。このファイルをダウンロードするには、ここをクリックしてください。
補足図2:(左)WT-GluR0-sfGFP、(中央)PRSP-GluR0-sfGFP、(右)可溶性sfGFPを発現するGUVコホートの代表的な共焦点画像。 スケールバー:10μmこの ファイルをダウンロードするには、ここをクリックしてください。
補足表1:野生型およびプロテオロドプシンシグナルペプチドのアミノ酸配列。このファイルをダウンロードするには、ここをクリックしてください。
補足表2:バルクCFE反応における合成タンパク質の濃度。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
細胞シグナル伝達や細胞の興奮など、細胞膜を介した分子や情報の伝達に依存するほぼすべての細胞プロセスには、膜タンパク質が必要です。このように、膜タンパク質の再構成は、さまざまなアプリケーション向けのさまざまな合成細胞設計を実現する際の主要なボトルネックとなっています。従来の界面活性剤による生体膜中の膜タンパク質の再構成には、緩やかな膨潤や電気形成などのGUV生成方法が必要です。膨潤アプローチは、通常、小さなサイズの小胞を生じ、複雑な溶液(合成細胞を生成するときにしばしばそうである)がカプセル化されると、電気形成の収率は著しく低下する32。さらに、界面活性剤は膜タンパク質を可溶化し、再構成プロセス中にそれらを除去すると、タンパク質のミスフォールディングを引き起こす可能性があります33,34。一方、ここで提示されたアプローチは、膜タンパク質の脂質二重層への共翻訳取り込みに依存しており、これは細胞の天然タンパク質生合成経路により類似している22。
技術的な観点からは、提示されたプロトコルは、電気形成および連続液滴界面交差カプセル化7,8,35,36(cDICE)などの他の一般的なカプセル化方法よりも有利であり、GUV生成に必要な唯一の実験装置が遠心分離機であるため、実装が容易です。電気形成とは対照的に、逆エマルジョン法では、さまざまな濃度の分子のさまざまな組み合わせをカプセル化できます。さらに、元の倒立エマルジョン技術25と比較して、このアプローチは、CFEライセートまたはPUREシステムのカプセル化に適した、より安定したGUVを生成する。GUVの安定性が高いのは、GUVメンブレン37の組成物中にジブロック共重合体が存在することと、油水界面が長時間インキュベーションされ、界面が脂質分子で飽和することを可能にするためです。最後に、マイクロ流体アプローチとは対照的に、ここで紹介するプロトコルでは小さなチャネルやチューブは必要ありません。そのため、CFE反応は組み立てるとすぐにカプセル化でき、流れの不足や目詰まりの可能性によるGUVの組み立て時間が短いため、CFE反応の早期開始を防ぐことができます。このプロトコールでの膜タンパク質発現の実証はPUREfrex反応に限ったことですが、この方法を拡張して、ライセートベースの細菌や哺乳類のCFEシステムなど、利用可能なさまざまなCFEシステムを使用してタンパク質を合成することができます。
ここで提示されたアプローチには、GUV形成プロセスの石油依存性および安定したGUVを持つという意図によって引き起こされる制限があります。このアプローチは、界面の安定化と高いGUV収率に必要な油水界面のインキュベーション時間が長いため、通常、cDICEやマイクロ流体工学などの他の方法と比較して長くなります。さらに、脂質組成は、主にPOPCと少量の他の脂質またはブロック共重合体に限定されますが、電気形成などの他の方法は、異なる物理的および化学的特性を持つ脂質の取り込みにより適しています。この方法のGUV膜組成は、CFEの収率を最大化するためにPOPCとPBD-PEOの混合物ですが、GUV膜組成の変動の可能性を試験することができます。ただし、他の膜タンパク質については、パラメーターのさらなる最適化が必要になる場合があります。液滴の乳化は手動ピペッティングによって行われるため、この方法で生成されたGUVは多分散しており、サイズは非常に不均一です。さらに、脂質が有機相に溶解するという事実は、時折、GUV膜の2つの弁尖の間に油の層を引き起こしたり、画像品質に悪影響を与える可能性のある油でイメージングチャンバーを汚染する可能性があります。残留油の課題に対する可能な回避策は、Tsumoto et al.38が示すように、鉱油をジエチルエーテルなどの揮発性有機溶媒に置き換えて、GUV形成中の遠心分離とともに溶媒蒸発に依存することです。
この研究では、再構成されたメカノまたは光感受性のチャネル機能を調べるために使用された以前のアッセイに触発されて、チャネル機能の実証はありませんが、蛍光顕微鏡ベースのアッセイの概要を示します。GluR0チャネルの開口は、K + イオン24の膜伝導性を増加させることが報告されています。CFE反応にはすでに高濃度のK+が含まれているため、一般的なカリウムインジケーターはチャネル機能の評価には適していません。しかし、カリウムの流入は膜電位を変化させるため、DiBAC4(3)22やBeRST 139 などの敏感な膜電位指標は、グルタミン酸の存在下でGluR0活性を報告する可能性があります。
合成細胞における膜タンパク質の再構成が成功すれば、天然細胞をより忠実に模倣した前例のない能力を持つ合成細胞を作製するための多くの可能性が開かれます。合成細胞の現在の主な欠点は、エネルギーを再生およびリサイクルできないことです。しかし、膜タンパク質に大きく依存する光および化学物質依存のエネルギー再生スキームにより、長持ちする合成細胞を想像することができる40。CFEシステムを利用することで、特定のタスクをまとめて実行できる複数の膜タンパク質を再構成することができます。例えば、ここで述べたGluR0と同様のリガンド依存性イオンチャネルを再構成し、さまざまな電位依存性イオンチャネルとともに、興奮性ニューロン様合成細胞の構築につながる可能性があります。
開示事項
著者は、利益相反を宣言しません。
謝辞
APLは、全米科学財団(EF1935265)、国立衛生研究所(R01-EB030031およびR21-AR080363)、および陸軍研究局(80523-BB)からの支援を認めています
資料
| Name | Company | Catalog Number | Comments |
| 100 nm polycarbonate filter | STERLITECH | 1270193 | |
| 96 Well Clear Bottom Plate | ThermoFisher Scientific | 165305 | |
| BioTek Synergy H1M Hybrid Multi-Mode Reader | Agilent | 11-120-533 | |
| Creatine phosphate | Millipore Sigma | 10621714001 | |
| CSU-X1 Confocal Scanner Unit | Yokogawa | CSU-X1 | |
| Density gradient medium (Optiprep) | Millipore Sigma | D1556 | Optional to switch with sucrose in inner solution |
| Filter supports | Avanti | 610014 | |
| Fisherbrand microtubes (1.5 mL) | Fisher Scientific | 05-408-129 | |
| Folinic acid calcium salt hydrate | Millipore Sigma | F7878 | |
| Glucose | Millipore Sigma | 158968 | |
| HEPES | Millipore Sigma | H3375 | |
| iXon X3 camera | Andor | DU-897E-CS0 | |
| L-Glutamic acid potassium salt monohydrate | Millipore Sigma | G1501 | |
| Light mineral oil | Millipore Sigma | M5904 | |
| Magnesium acetate tetrahydrate | Millipore Sigma | M5661 | |
| Mini-extruder kit (including syringe holder and extruder stand) | Avanti | 610020 | |
| Olympus IX81 Inverted Microscope | Olympus | IX21 | |
| Olympus PlanApo N 60x Oil Microscope Objective | Olympus | 1-U2B933 | |
| PEO-b-PBD | Polymer Source | P41745-BdEO | |
| pET28b-PRSP-GluR0-sfGFP plasmid DNA | Homemade | N/A | |
| pET28b-sfGFP-sfCherry(1-10) plasmid DNA | Homemade | N/A | |
| pET28b-WT-GluR0-sfGFP plasmid DNA | Homemade | N/A | |
| POPC lipid in chloroform | Avanti | 850457C | |
| Potassium chloride | Millipore Sigma | P9541 | |
| PUREfrex 2.0 | Cosmo Bio USA | GFK-PF201 | |
| Ribonucleotide Solution Set | New England BioLabs | N0450 | |
| RNase Inhibitor, Murine | New England BioLabs | M0314S | |
| RTS Amino Acid Sampler | Biotechrabbit | BR1401801 | |
| Sodium chloride | Millipore Sigma | S9888 | |
| Spermidine | Millipore Sigma | S2626 | |
| Sucrose | Millipore Sigma | S0389 | |
| VAPRO Vapor Pressure Osmometer Model 5600 | ELITechGroup | VAPRO 5600 |
参考文献
- Liu, A. P., Fletcher, D. A. Biology under construction: In vitro reconstitution of cellular function. Nat Rev Mol Cell Biol. 10 (9), 644-650 (2009).
- Lin, A. J., Sihorwala, A. Z., Belardi, B. Engineering tissue-scale properties with synthetic cells: Forging one from many. ACS Synth Biol. 12 (7), 1889-1907 (2023).
- Powers, J., Jang, Y. Advancing biomimetic functions of synthetic cells through compartmentalized cell-free protein synthesis. Biomacromolecules. 24 (12), 5539-5550 (2023).
- Jiang, W., et al. Artificial cells: Past, present and future. ACS Nano. 16 (10), 15705-15733 (2022).
- Groaz, A., et al. Engineering spatiotemporal organization and dynamics in synthetic cells. WIREs Nanomed Nanobiotech. 13 (3), 1685 (2021).
- Sharma, B., Moghimianavval, H., Hwang, S. W., Liu, A. P. Synthetic cell as a platform for understanding membrane-membrane interactions. Membranes. 11 (12), 912 (2021).
- Bashirzadeh, Y., et al. Actin crosslinker competition and sorting drive emergent GUV size-dependent actin network architecture. Commun Biol. 4 (1), 1-11 (2021).
- Bashirzadeh, Y., Moghimianavval, H., Liu, A. P. Encapsulated actomyosin patterns drive cell-like membrane shape changes. iScience. 25 (5), 104236 (2021).
- Berhanu, S., Ueda, T., Kuruma, Y. Artificial photosynthetic cell producing energy for protein synthesis. Nat Commun. 10 (1), 1325 (2019).
- Ji, Y., Chakraborty, T., Wegner, S. V. Self-regulated and bidirectional communication in synthetic cell communities. ACS Nano. 17 (10), 8992-9002 (2023).
- Moghimianavval, H., Loi, K. J., Hwang, S. W., Bashirzadeh, Y., Liu, A. P. Light-based juxtacrine signaling between synthetic cells. bioRxiv. , (2024).
- Boyd, M. A., Thavarajah, W., Lucks, J. B., Kamat, N. P. Robust and tunable performance of a cell-free biosensor encapsulated in lipid vesicles. Science Advances. 9 (1), 6605 (2023).
- Schneider, B., et al. Membrane Protein expression in cell-free systems. Methods Mol Biol. 601, 165-186 (2010).
- Noireaux, V., Liu, A. P. The new age of cell-free biology. Annu Rev Biomed Eng. 22 (1), 51-77 (2020).
- Majumder, S., et al. Cell-sized mechanosensitive and biosensing compartment programmed with DNA. Chem. Commun. 53 (53), 7349-7352 (2017).
- Poddar, A., et al. Membrane stretching activates calcium permeability of a putative channel Pkd2 during fission yeast cytokinesis. MBoC. 33 (14), (2022).
- Sachse, R., Dondapati, S. K., Fenz, S. F., Schmidt, T., Kubick, S. Membrane protein synthesis in cell-free systems: From bio-mimetic systems to bio-membranes. FEBS Letters. 588 (17), 2774-2781 (2014).
- Dondapati, S. K., et al. Functional reconstitution of membrane proteins derived from eukaryotic cell-free systems. Front Pharmacol. 10, 917 (2019).
- Majumder, S., et al. In vitro synthesis and reconstitution using mammalian cell-free lysates enables the systematic study of the regulation of LINC complex assembly. Biochemistry. 61 (14), 1495-1507 (2022).
- Niwa, T., et al. Comprehensive study of liposome-assisted synthesis of membrane proteins using a reconstituted cell-free translation system. Sci Rep. 5 (1), 18025 (2015).
- Moghimianavval, H., Hsu, Y. Y., Groaz, A., Liu, A. P. In vitro reconstitution platforms of mammalian cell-free expressed membrane proteinsmembrane proteins. Methods Mol Biol. 2433, 105-120 (2022).
- Eaglesfield, R., Madsen, M. A., Sanyal, S., Reboud, J., Amtmann, A. Cotranslational recruitment of ribosomes in protocells recreates a translocon-independent mechanism of proteorhodopsin biogenesis. iScience. 24 (5), 102429 (2021).
- Steinküher, J., et al. Improving cell-free expression of membrane proteins by tuning ribosome cotranslational membrane association and nascent chain aggregation. bioRxiv. , (2023).
- Chen, G. Q., Cui, C., Mayer, M. L., Gouaux, E. Functional characterization of a potassium-selective prokaryotic glutamate receptor. Nature. 402 (6763), 817-821 (1999).
- Pautot, S., Frisken, B. J., Weitz, D. A. Production of unilamellar vesicles using an inverted emulsion. Langmuir. 19 (7), 2870-2879 (2003).
- Hsu, Y. Y., et al. Calcium-triggered DNA-mediated membrane fusion in synthetic cells. Chemical Communications. 59 (57), 8806-8809 (2023).
- Moghimianavval, H., et al. Engineering functional membrane-membrane interfaces by interspy. Small. 19 (13), 2202104 (2023).
- Sun, Z. Z., et al. Protocols for implementing an Escherichia coli based TX-TL cell-free expression system for synthetic biology. J Vis Exp. (79), e50762 (2013).
- Jacobs, M. L., Boyd, M. A., Kamat, N. P. Diblock copolymers enhance folding of a mechanosensitive membrane protein during cell-free expression. PNAS. 116 (10), 4031-4036 (2019).
- Kostarelos, K., Tadros, T. F., Luckham, P. F. Physical conjugation of (tri-) block copolymers to liposomes toward the construction of sterically stabilized vesicle systems. Langmuir. 15 (2), 369-376 (1999).
- Adir, O., et al. Preparing protein producing synthetic cells using cell free bacterial extracts, liposomes and emulsion transfer. J Vis Exp. (158), e60829 (2020).
- van de Cauter, L., van Buren, L., Koenderink, G. H., Ganzinger, K. A. Exploring giant unilamellar vesicle production for artificial cells - current challenges and future directions. Small Methods. 7 (12), 2300416 (2023).
- Seddon, A. M., Curnow, P., Booth, P. J. Membrane proteins, lipids and detergents: Not just a soap opera. Biochim Biophys Acta Biomembr. 1666 (1), 105-117 (2004).
- Guo, Y. Detergent-free systems for structural studies of membrane proteins. Biochem Soc Trans. 49 (3), 1361-1374 (2021).
- Bashirzadeh, Y., Wubshet, N., Litschel, T., Schwille, P., Liu, A. P. Rapid encapsulation of reconstituted cytoskeleton inside giant unilamellar vesicles. J Vis Exp. (177), e63332 (2021).
- Hwang, S. W., et al. Hybrid vesicles enable mechano-responsive hydrogel degradation. Angew Chemie Int Ed. 62 (41), e202308509 (2023).
- Rideau, E., Dimova, R., Schwille, P., Wurm, F. R., Landfester, K. Liposomes and polymersomes: a comparative review towards cell mimicking. Chem Soc Rev. 47 (23), 8572-8610 (2018).
- Tsumoto, K., Hayashi, Y., Tabata, J., Tomita, M. A reverse-phase method revisited: Rapid high-yield preparation of giant unilamellar vesicles (GUVs) using emulsification followed by centrifugation. Colloids Surf A: Physicochem Eng Asp. 546, 74-82 (2018).
- Huang, Y. L., Walker, A. S., Miller, E. W. A photostable silicon rhodamine platform for optical voltage sensing. J Am Chem Soc. 137 (33), 10767-10776 (2015).
- Bailoni, E., et al. Minimal out-of-equilibrium metabolism for synthetic cells: A membrane perspective. ACS Synth Biol. 12 (4), 922-946 (2023).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved