Method Article
三叉神経障害性疼痛を研究するためのマウスにおける遠位眼窩下神経の慢性狭窄損傷(DIoN-CCI)
要約
マウスにおける眼窩遠位神経の慢性狭窄損傷は、継続的な疼痛や異痛症の徴候である触覚刺激(フォン・フレイ毛髪刺激に対する過敏性)に応答した自発行動(顔面グルーミング活動の増加)や夜間防御行動の変化を誘発し、三叉神経障害性疼痛のモデルとなる。
要約
動物モデルは、神経障害性疼痛を研究するために必要なツールであり続けています。この原稿では、マウスの三叉神経因性疼痛を研究するための遠位眼窩下神経慢性狭窄損傷(DIoN-CCI)モデルについて説明します。これには、慢性狭窄損傷を実施するための外科的処置と、進行中の痛みと機械的異痛症の兆候である自発的および誘発された行動の変化を評価するための術後行動試験が含まれます。方法と行動の読み出しは、ラットの眼窩下神経慢性狭窄損傷(IoN-CCI)モデルと似ています。ただし、IoN-CCIモデルをマウスに適合させるためには、重要な変更が必要です。まず、眼窩内アプローチは、目とひげパッドの間に切開を行う、より吻側アプローチに置き換えられます。したがって、IoNは眼窩腔の外側で遠位にライゲーションされます。第二に、マウスの自発運動活動が高いため、ラットが小さなケージ内で自由に動くことができるようにすることは、マウスをカスタム設計および構築された拘束装置に入れることによって置き換えられます。DIoN結紮後、マウスは、IoN-CCIラットと同様のフォンフレイ毛刺激に対する自発的行動および応答性の変化、すなわち、IoN領域のフォンフレイ毛髪刺激に対する指向性顔面グルーミングおよび過敏性の増加を示します。
概要
神経障害性疼痛は、体性感覚神経系の損傷から生じ、感覚信号の脳への異常な伝達につながります。体性感覚神経の損傷は必ずしも神経障害性疼痛につながるわけではありませんが、臨床神経障害の重症度とともに有病率は増加します1,2。神経障害性疼痛患者は、自発的な感覚(灼熱感、ピンと針、電気感覚)や、無害または有害な刺激に対する異常に強いまたは長期にわたる痛みなどの特定の症状を経験します。これらは慢性化し、従来の鎮痛剤による治療に抵抗する傾向があります3。神経障害性疼痛研究の分野における大きな進歩は、ラットの坐骨神経の周りの結紮糸を緩く収縮させると、人間の神経障害性疼痛状態に似た行動を引き起こすという発見に起因しています4。動物は、熱、寒さ、および機械的刺激に対して閾値が低下し、夜警行動を示します。ヒトとげっ歯類の疼痛処理には生物学的な違いが根付いているにもかかわらず、動物モデルは神経障害性疼痛の発症の根本的なメカニズムを研究し、新たに提案された治療戦略を検証するための貴重なツールである。
感覚反射に基づく疼痛検査パラダイムは、神経障害性疼痛モデルで広く使用されていますが、進行中の疼痛やその他の頻繁に伴う障害(睡眠障害、うつ病、不安)の測定は、これらが生活の質に影響を与える一般的な臨床症状であることを考慮すると、十分な注意が払われていません5,6,7,8 .ラットの顔面グルーミング行動は、眼窩下神経(IoN)の慢性狭窄損傷(CCI)後の自発的な神経因性疼痛の尺度として文書化されています9,10。さらに、ラットは、IoN領域の軽度の触覚刺激に対しても過敏性を発達させますが、これは機械的アロディニアを示しています。
マウスと比較して、ラットはサイズが大きいため、外科的損傷に適しています。しかし、マウスはコストとスペース効率が高く、必要な薬剤の量も少なくて済みます。また、トランスジェニック技術の出現により、マウスの使用がさらに増加しました11,12。したがって、この手順の全体的な目標は、マウスで外科的眼窩下神経損傷を行うことです、ラットの場合と同様に、三叉神経因性疼痛の研究のために自発的および誘発された行動の変化を誘発します。
プロトコル
動物は、国際疼痛研究協会の意識のある動物における疼痛研究のガイドラインに従って、また、フランドルおよびヨーロッパの動物研究に関する規制およびARRIVEガイドラインに沿って治療および世話をされます。この議定書は、機関の倫理委員会によって承認されています。
1. 動物たち
- 雌雄のC57BL/6Jマウス(Janvier、到着時10週齢)を使用してください。
- ハウスマウスは、湿度40%〜60%、室温(RT)が21〜1°Cのコロニールームで、標準的な固体底マウスケージに入れ±メスマウスを別々に飼育します。
- 水 と食料を自由に提供します。
- マウスを通常の12:12時間の暗/明度のサイクルの下に保ちます(08:00にライトが点灯します)。
2. 手術
- マウスごとに、長さ約6 cmのクロミック腸結紮糸(6-0)を1枚調製し、乾燥して硬くなってもろくなるのを防ぐために滅菌生理食塩水に入れます。
- マウスにケタミン/キシラジン(75/15 mg / kg、腹腔内、注射量10 mL / kg)で麻酔をかけます。.足の指の間に皮膚を挟んで麻酔の深さを確認します。マウスが脚を曲げないようにしてください。必要に応じて、動物が完全に麻酔されるまで待つか、追加のケタミン/キシラジンを投与します。.
注:三叉神経因性 ?? 痛の発症を妨げる可能性のある先制的な鎮痛効果を避けるために、補助的な鎮痛薬を投与しないでください。. - ひげパッドと目の間の頬毛をそっと剃り、眼窩下孔まで吻側だけで約4mmの切開を行います。ひげを傷つけないように注意してください、これは行動テストに影響を与える可能性があるためです。
- マウスの頭を脳定位固定装置フレームに固定するか、頭を固定します。マウスを加熱されたパッドの上に置くか、体温を維持するように注意してください。
- 乾燥を避けるために両目に軟膏を塗ります。坊主頭の部分をアルコールでこすり、次にベタジンでこすります。坊主頭の部分を露出させる外科用ドレープを置きます。
- 手順2.7から2.14に顕微鏡を使用します。
- ウィスカーパッドの端と目のほぼ中間、眼窩下孔のすぐ吻側、目の中心とウィスカーパッドの中心との間の線を中心に、正中線に垂直に4mmの皮膚切開を行います。
- 表在性結合組織を鈍く分離することにより、IoNを露出させます。筋肉組織の損傷を最小限に抑え、運動神経線維を避けるように注意してください。IoNの胴体(直径1〜1.5 mm)が、頭蓋骨から出てからウィスカーパッドに分岐する場所までの間に約3 mmの深さでアクセスできることを確認します(図1)。
- 回転運動を使用して、神経を傷つけないように注意しながら、フック付き結紮助手の頭をIoNの下に滑り込ませます。
- 結紮助剤の先端にある穴にクローミック腸結紮糸を通し、結紮助剤を引っ込めて、結紮糸がIoNの下に留まり、結紮糸の両端がIoNからほぼ等距離になるようにします。
- 結紮糸の両端から「スリップノット」を結び、結び目をIoNに対してスライドさせます。スリップノットがスムーズな動作を可能にすることを確認し、収縮の程度を正確に制御できるようにします。結び目をさらにスライドさせ、IoNを収縮させます。神経の直径を目立つだけ小さくします4.スリットノットの上に通常の結び目を乗せて、滑りにくくします。
- 結紮糸の端をカットし、結び目がほどけるのを防ぐために、約1.5mmの自由端を残します。
- 手順2.2〜2.8に従って偽の手術を行います。
- 合成吸収性縫合糸(6-0)を使用して皮膚切開部を閉じ、動物が加熱パッドまたは赤外線加熱ランプの下で回復するのを待ちます。
3. 行動テスト
- 術前試験の少なくとも8日前に、マウスをハウジング条件に順応させます。
- 術前検査の前に、マウスを少なくとも1日1回、3日間テスト手順に慣れさせます。
- 通常の照明条件でテストを実施します。必要に応じて、外部ノイズによる妨害を最小限に抑えるために、バックグラウンドノイズを提供します。
- 顔のグルーミング行動の観察
- 1匹のマウスをハウジングから試験室まで、寝具を使わずに蓋付きのプラスチックケージに入れて運びます。動物を輸送している間は、外部からの刺激を避けてください。
- ビデオカメラの前で、寝具のない蓋付きの透明なプラスチック製ケージ(長さ x 幅 x 高さ: 12 cm x 12 cm x 17 cm)にマウスを置きます。鏡を置いて view 動物がカメラに背を向けているときの顔。
- マウスの動作を10分間記録します。録音中は、実験者が部屋にいないことを確認してください。
- 次の動物を記録した後、観察ケージを清掃します。
- マウスの実験条件を知らない観察者に、記録された行動を分析させます。
- 10分間の録画を分析しながら、各顔のグルーミングエピソードに注意してください。顔のグルーミングとは、動物が前足を顔の部分に接触させる動きのパターンです。
- 孤立した顔のグルーミングとボディグルーミング中の顔のグルーミング行動を区別します9。シーケンスの前後にボディグルーミングがない場合、そのエピソードは孤立した顔のグルーミングとラベル付けされます。ボディグルーミングとは、前足、舌、または切歯を顔や前足以外の体の領域に接触させる動きのパターンとして定義されます。ボディグルーミングがフェイスグルーミングシーケンスの前または後に存在する場合、そのエピソードはボディグルーミング中にフェイスグルーミングとラベル付けされます。
- 顔のグルーミング エピソードの数を決定するには、4 秒のカットオフ基準を適用します。グルーミング アクションの間隔が 4 秒未満の場合、1 つのエピソード内の一時停止として定義されます。4 秒を超える期間は、2 つのエピソード間でグルーミング アクションが完全に中断されたと定義されます。
- 機械的刺激試験
- マウスを最大6匹のグループで飼育室から試験室まで、寝具付きの屋根付きケージに入れて運びます。繰り返しになりますが、外部からの刺激を避けるように注意してください。
- マウスを一度に1匹ずつテーブルの上に置きます。
- マウスのテールを柔らかいシリコンclに置きますclamp clを固定し、clをテーブルの上の金属板に磁気的に取り付けます。シリコン素材により、テールがクランプから滑り落ちるのを防ぎながら、テールへの圧力を最小限に抑えます。
- 3層構造のプラスチックホルダー(65 mm x 25 mm x 23 mm)を動物の上に置き、マウスの頭だけが容器から突き出るようにします。ホルダーのサイズは、頭と前足の動きを可能にしますが、動物がその中で向きを変えるのを防ぎます。最後に、ホルダーの上に重りを置いて、ホルダーを所定の位置に保持します(図2)。
- 4つのフォン・フレイの髪の毛のグラデーションシリーズを使用します。毛を曲げるのに必要な力は、0.02g、0.16g、0.4g、1.0gです。
- マウスを拘束装置に慣れさせ、10分間手を伸ばす動きをします。30秒ごとに、動物ごとにリーチングムーブメントを行います。
- 動物がリラックスした状態にあるとき、フォンフレイの髪が曲がるまで、ビブリッサの中心近くのIoN領域内で最も軽いフォンフレイの髪をゆっくりと適用します。刺激が1秒以内であることを確認してください。
- 刺激に対する動物の反応を採点して、次の応答カテゴリのいずれかに当てはめます。
- 応答がない場合は、スコア0を与えます。
- 検出に1のスコアを与える、すなわち、マウスは刺激物体に頭を向け、次に刺激物体を探索します。
- 離脱反応、つまり、刺激が加えられたときにマウスが頭をそっと背に向けるか、すばやく後方に引っ張る、という点数で2点を付けます。時々、刺激された領域に対して同側の単一の顔の拭き取りが発生します。
- 攻撃、つまり、マウスが刺激対象を攻撃し、噛んだりつかんだりする動きをすることに対して3のスコアを与えます。
- 非対称の顔面グルーミングに4点を与える、すなわち、マウスは、刺激された顔面領域に向けられた少なくとも3回の洗顔ストロークの連続を途切れることなく示す。
- 各マウスについて、フォンフレイの毛を強度の昇順で適用し、同側と反対側をランダムに刺激します。各刺激強度を両側に1回ずつ適用します。
- 各動物内の 4 本のフォン・フレイ毛に対する応答から平均スコアを計算します。同側と反対側の側に別々のスコアを計算します。
結果
DIoN-CCIマウスは、孤立した顔面グルーミングに費やす時間と孤立した顔面グルーミングエピソードの数が術後に大幅に増加しました(図3)。最も強い増加は術後の最初の週に発生し、その後の数週間で小さくなりますが、少なくとも 6 週間は大幅に増加します。ボディグルーミング中の顔のグルーミングは、多かれ少なかれ影響を受けません。
DIoN-CCIマウスは、DioN-CCI後の最初の1週間は、同側IoN領域への同側の機械的刺激に対してほぼ完全に反応しません(図4)。次の数週間で、この低反応性は、少なくとも6週間持続する過敏性に置き換えられます。また、対側の機械的刺激に対する応答性がわずかに増加する場合もあります。
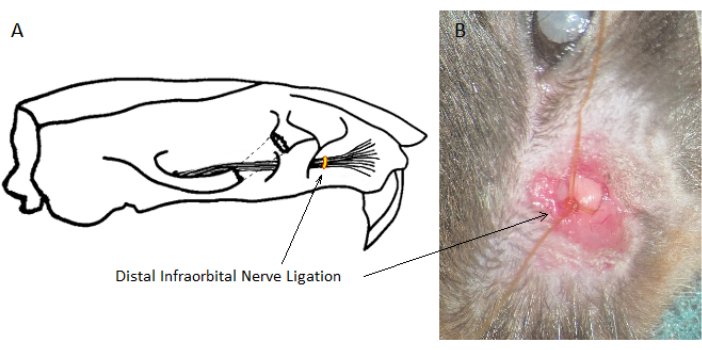
図1:遠位眼窩下神経結紮の位置。 遠位眼窩下神経結紮の位置は、頭蓋骨からの出口に対しては吻側ですが、ウィスカーパッドに分岐する場所まで尾側にあります。(A)右IoNの模式図。(B)左側に結紮されたIoNの外科的見解。 この図の拡大版を表示するには、ここをクリックしてください。

図2:機械的刺激試験に使用される拘束装置。マウスのテールは、テーブル上の(B)金属プレートに磁気的に取り付けられた(A)柔らかいシリコンクランプによって所定の位置に保持されます。(C)プラスチック製のホルダーは、頭と前足の動きを可能にしますが、動物がその中で向きを変えるのを防ぎます。金属製のおもりがホルダーを所定の位置に保持します。この図の拡大版を表示するには、ここをクリックしてください。

図3:DIoN-CCI後の孤立した顔面グルーミング行動の術後の変化。 データ ポイントは、(A) 孤立した顔面グルーミングに費やされた時間 (平均 ± SEM; グループあたり n = 15) と (B) DIoN 手術の 1 日前 (術前) と術後 3 日目から 42 日目に孤立した顔面グルーミング エピソードの数 (平均 ± SEM; グループあたり 15) を示します。 この図の拡大版を表示するには、ここをクリックしてください。

図4:機械的刺激に対する応答性に対するDIoN-CCIの影響の経時変化。 データ ポイントは、(A) 結紮神経の領域と (B) 対側側の領域に対するフォン フレイの髪刺激に対する反応スコア (平均 ± SEM; n = 15/グループあたり 15) と DIoN 手術の 1 日前 (術前) と 3-42 日後を示しています。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
ラットでは、振動触覚弁当における複雑なウィキングパターンを制御する無傷の微細な筋肉組織の重要性と、皮膚眼窩下神経領域10への正中線切開の相対距離を考慮すると、IoNへの眼窩内アプローチが望ましいと以前に主張されてきた。他の人は、バイブリッサルパッドへの毛深い皮膚の尾部への切開による遠位アプローチには、多くの利点があると主張しています13,14。外科的には、侵襲性が低く、より簡単な技術です。脳定位固定装置フレームを使用せずに、より短時間で行うことができます。どちらの技術も、誘発された痛みの行動と誘発されない痛みの行動の両方で、同等の術後行動効果をもたらします。さらに、この手順は、手順中に眼窩内容物をそらし、神経結紮と目との間の接触を刺激する可能性のある原因となる可能性のある目の不快感を回避します。マウスでは、サイズが小さいため、眼窩内アプローチは標準的な手順として使用するには難しすぎることがわかりました。したがって、この手順は、遠位アプローチを使用してマウスの眼窩下神経損傷を外科的に誘発し、三叉神経因性疼痛の研究に使用できる自発的で誘発された疼痛行動の発達につながることを目的としています。
このモデルを適用する際の重要なステップは、他の神経結紮誘発性慢性疼痛動物モデルと同様に、眼窩下神経4,15,16の周囲に適切な量の狭窄を持つ結紮糸を配置することである。行動の結果は、神経収縮の程度が異なる動物では大きく異なります17。マウスの眼窩下神経直径に対するクロム腸のサイズ(6-0)の比率は、サイズ5-0が使用されるラットのそれと同じではありません。マウスでは、2つの結紮糸がラットよりも高いレベルの神経損傷を誘発することがわかりました。サイズ6-0は、見つけることができる最小のクロム腸であったため、本研究では、ラットと同様の行動結果をもたらした単一の結紮糸を使用することを選択しました。サイズ7-0の2つの非クロム腸結紮糸も同様の結果をもたらす可能性があります。
フォン・フレイの毛でIoN領域を刺激するには、動物が比較的動かないことが必要です。ラットでは、これは動物を観察ケージに慣れさせることによって達成できます。マウスでは、自発運動活性が高いため、この方法を使用すると、IoN領域を高精度に刺激することが困難になります。動物を手で抱きしめることは、刺激に対する動物の反応の有効性と信頼性を著しく損なうストレスの多い方法です。動物を小さな高台に置くことも研究で使用されています18。動きはより制限されていますが、プラットフォームは、動物がIoN領域を正確に刺激し、適切に制御された曲げ力で必要以上に動き回ることを可能にしていることがわかりました。抑制方法を考案し、一部を3Dプリントを使用して私たちの研究室で製造しました。3層構造のプラスチック製ホルダーと重量は、Krzyzanowska et al.(2011)が使用したものと似ていますが、動物の尻尾を所定の位置に保持する方法は異なります19。重要なのは、このデバイスにより、動物は前足や頭の動きなど、刺激に対してより自然な方法で反応できるようになることです。ただし、このデバイスは、動物が体を遠ざけて、刺激とのさらなる接触を避けるのを防ぎます。観察ケージ内で自由に動く動物では、後者の行動は刺激をつかむか噛むことと同等です(反応スコアカテゴリー3)。
本論文は、マウスのDIoN-CCIが、IoN-CCIラットと同様であるフォンフレイ毛髪刺激に応答して自発的行動の変化を誘発する、すなわち、IoN領域のフォンフレイ毛髪刺激に対する指向性顔面グルーミングおよび過敏性の増加を誘発することを示している10。マウスにおける孤立した顔面グルーミングエピソードの平均持続時間はラットよりも短かった(2秒対10秒)が、孤立した顔面グルーミングエピソードの平均ピーク数はマウスの方が高かった(13秒対5秒)。これが純粋に生来のグルーミングパターンの違いを反映しているのか、それとも自発的な痛みの感覚の性質に関連しているのかは不明です。
開示事項
著者には、開示すべき利益相反はありません。
謝辞
著者には謝辞はありません。
資料
| Name | Company | Catalog Number | Comments |
| Chromic catgut (6-0) | Dynek | CG602D | ligatures |
| Cotton applicator | Pharmacy | ||
| Digital video camera | Sony | HDR-CX330E | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Dumont forceps - Micro-blunted tips (#5/45) | Fine Science Tools | 11253-25 | |
| Duratears | Alcon | 0037-820 | ophthalmic ointment |
| Hooked ligation aid | Fine Science Tools | 18062-12 | |
| Ketalar | Pfizer | ketamine (50 mg/mL) | |
| Operation microscope | Kaps | SOM 62 | |
| Precision cotton swab | Qosina | 10225 | |
| Precision trimmer | Philips | HP6392/00 | |
| Rompun | Bayer | xylazine (2%) | |
| Scissors - blunt tips | Fine Science Tools | 14574-09 | |
| Semmes-Weinstein Von Frey Aesthesiometer kit | Stoelting | 58011 | |
| Vicryl Rapide | Ethicon | MPVR489H | sutures |
参考文献
- Costigan, M., Scholz, J., Woolf, C. J. Neuropathic pain: a maladaptive response of the nervous system to damage. Annu Rev Neurosci. 32, 1-32 (2009).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain. 7, 281-289 (2006).
- Jensen, T. S., Gottrup, H., Sindrup, S. H., Bach, F. W. The clinical picture of neuropathic pain. Eur J Pharmacol. 429 (1-3), 1-11 (2001).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Backonja, M. M., Stacey, B. Neuropathic pain symptoms relative to overall pain rating. J Pain. 5, 491-497 (2004).
- Basbaum, A. I., Campbell, J. N., et al. Measurrement and New Technologies. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Mogil, J. S., Crager, S. E. What should we be measuring in behavioral studies of chronic pain in animals. Pain. 112, 12-15 (2004).
- Vierck, C. J., Campbell, J. N., et al. Animal Studies of Pain: Lessons for Drug Development. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Deseure, K., Adriaensen, H. Nonevoked facial pain in rats following infraorbital nerve injury a parametric analysis. Physiol Behav. 81 (4), 595-604 (2004).
- Deseure, K., Hans, G. H. Chronic constriction injury of the rat's infraorbital nerve (IoN-CCI) to study trigeminal neuropathic pain. J Vis Exp. (103), e53167 (2015).
- Mogil, J. S. Animal models of pain: progress and challenges. Nat Rev Neurosci. 10 (4), 283-294 (2009).
- Wilson, S. G., Mogil, J. S. Measuring pain in the (knockout) mouse: big challenges in a small mammal. Behav Brain Res. 125 (1-2), 65-73 (2001).
- Ding, W., et al. An improved rodent model of trigeminal neuropathic pain by unilateral chronic constriction injury of distal infraorbital nerve. J Pain. 18 (8), 899-907 (2017).
- Hardt, S., Fischer, C., Vogel, A., Wilken-Schmitz, A., Tegeder, I. Distal infraorbital nerve injury: a model for persistent facial pain in mice. Pain. 160 (6), 1431-1447 (2019).
- Krzyzanowska, A., Avendaño, C. Behavioral testing in rodent models of orofacial neuropathic and inflammatory pain. Brain Behav. 2 (5), 678-697 (2012).
- Martin, Y. B., Malmierca, E., Avendaño, C., Nuñez, A. Neuronal disinhibition in the trigeminal nucleus caudalis in a model of chronic neuropathic pain. Eur J Neurosci. 32 (3), 399-408 (2010).
- Deseure, K., Hans, G. Behavioral study of non evoked orofacial pain following different types of infraorbital nerve injury in rats. Physiol Behav. 138, 292-296 (2015).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. J Headache Pain. 20 (1), 11 (2019).
- Krzyzanowska, A., et al. Assessing nociceptive sensitivity in mouse models of inflammatory and neuropathic trigeminal pain. J Neurosci Methods. 201 (1), 46-54 (2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved