Method Article
Chronische Einschnürungsverletzung des distalen Nervus infraorbitalis (DIoN-CCI) bei Mäusen zur Untersuchung von trigeminalen neuropathischen Schmerzen
In diesem Artikel
Zusammenfassung
Eine chronische Einschnürungsverletzung des distalen Nervus infraorbitalis bei Mäusen führt zu Veränderungen des spontanen Verhaltens (erhöhte Aktivität bei der Gesichtspflege) und des nozifensiven Verhaltens als Reaktion auf taktile Stimulation (Überempfindlichkeit auf von-Frey-Haarstimulation), die Anzeichen von anhaltenden Schmerzen und Allodynie sind und als Modell für trigeminale neuropathische Schmerzen dienen.
Zusammenfassung
Tiermodelle sind nach wie vor notwendige Werkzeuge, um neuropathische Schmerzen zu untersuchen. Dieses Manuskript beschreibt das Modell der distalen Nervus infraorbitalis chronic constriction injury (DIoN-CCI) zur Untersuchung von trigeminalen neuropathischen Schmerzen bei Mäusen. Dazu gehören die chirurgischen Eingriffe zur Durchführung der chronischen Verengungsverletzung und die postoperativen Verhaltenstests zur Bewertung der Veränderungen des spontanen und evozierten Verhaltens, die Anzeichen für anhaltende Schmerzen und mechanische Allodynie sind. Die Methoden und Verhaltensdaten ähneln dem Modell der chronischen Constriction Injury (IoN-CCI) des Nervus infraorbitalis bei Ratten. Für die Adaption des IoN-CCI-Modells an Mäuse sind jedoch wichtige Änderungen notwendig. Zunächst wird der intraorbitale Zugang durch einen rostraleren Zugang mit einem Schnitt zwischen dem Auge und dem Schnurrhaarpolster ersetzt. Das IoN wird somit distal außerhalb der Orbitalhöhle ligiert. Zweitens wird aufgrund der höheren Bewegungsaktivität bei Mäusen die freie Bewegung von Ratten in kleinen Käfigen durch das Setzen von Mäusen in speziell entwickelte und konstruierte Rückhaltevorrichtungen ersetzt. Nach der DIoN-Ligation zeigen Mäuse Veränderungen im spontanen Verhalten und als Reaktion auf die von-Frey-Haarstimulation, die denen bei IoN-CCI-Ratten ähneln, d.h. eine erhöhte gerichtete Gesichtspflege und eine Hyperreagibilität auf die von-Frey-Haarstimulation des IoN-Territoriums.
Einleitung
Neuropathische Schmerzen entstehen durch eine Schädigung des somatosensorischen Nervensystems, die zu einer abnormalen Übertragung von sensorischen Signalen an das Gehirn führt. Eine somatosensorische Nervenschädigung führt nicht immer zu neuropathischen Schmerzen, aber die Prävalenz nimmt mit dem Schweregrad der klinischen Neuropathie zu 1,2. Neuropathische Schmerzpatienten erleben spezifische Symptome wie spontane Empfindungen (Brennen, Kribbeln, elektrische Empfindungen) und ungewöhnlich intensive oder anhaltende Schmerzen bei harmloser oder schädlicher Stimulation, die dazu neigen, chronisch und resistent gegen die Behandlung mit herkömmlichen Schmerzmitteln zu werden3. Bedeutende Fortschritte auf dem Gebiet der neuropathischen Schmerzforschung ergeben sich aus der Entdeckung, dass das lockere Einschnüren der Ligaturen um den Ischiasnerv bei Ratten zu Verhaltensweisen führt, die den menschlichen neuropathischen Schmerzzuständen ähneln4. Die Tiere weisen eine reduzierte Schwelle zu Hitze, Kälte und mechanischer Stimulation auf und zeigen nozifensives Verhalten. Trotz der inhärenten biologischen Unterschiede in der Schmerzverarbeitung zwischen Menschen und Nagetieren sind Tiermodelle ein wertvolles Werkzeug, um die zugrundeliegenden Mechanismen bei der Entwicklung neuropathischer Schmerzen zu untersuchen und neu vorgeschlagene Behandlungsstrategien zu testen.
Sensorische reflexbasierte Schmerztestparadigmen wurden in neuropathischen Schmerzmodellen ausgiebig verwendet, aber die Messung anhaltender Schmerzen oder anderer häufig begleiteter Störungen (Schlafstörungen, Depressionen, Angstzustände) hat nicht genügend Aufmerksamkeit erhalten, wenn man bedenkt, dass es sich hierbei um häufige klinische Symptome handelt, die die Lebensqualität beeinträchtigen 5,6,7,8 . Das Gesichtspflegeverhalten bei Ratten wurde als Maß für spontane neuropathische Schmerzen nach chronischer Verengungsverletzung (CCI) des Nervus infraorbitalis (IoN) dokumentiert9,10. Darüber hinaus entwickeln Ratten auch eine Überempfindlichkeit auf eine leichte taktile Stimulation des IoN-Territoriums, was auf eine mechanische Allodynie hinweist.
Im Vergleich zu Mäusen sind Ratten aufgrund ihrer größeren Größe besser für chirurgische Verletzungen geeignet. Mäuse bieten jedoch Kosten- und Platzeffizienz und benötigen kleinere Medikamentenmengen. Auch das Aufkommen der transgenen Technologie hat die Verwendung von Mäusen weiter vorangetrieben11,12. Daher besteht das übergeordnete Ziel dieses Verfahrens darin, eine chirurgische infraorbitale Nervenverletzung bei Mäusen durchzuführen, ähnlich der bei Ratten, die Veränderungen im spontanen und evozierten Verhalten zur Untersuchung von trigeminalen neuropathischen Schmerzen induziert.
Protokoll
Die Tiere werden gemäß den Richtlinien für die Schmerzforschung an bewussten Tieren der International Association for the Study of PAIN und in Übereinstimmung mit den flämischen und europäischen Vorschriften für Tierversuche und den ANARRIVE-Richtlinien behandelt und gepflegt. Das Protokoll wird von der institutionellen Ethikkommission genehmigt.
1. Tiere
- Verwenden Sie männliche und weibliche C57BL/6J-Mäuse (Janvier, bei Ankunft 10 Wochen alt).
- Männliche und weibliche Mäuse getrennt in Standardkäfigen mit festem Boden in einem Kolonieraum mit einer Luftfeuchtigkeit von 40%-60% und einer Raumtemperatur (RT) von 21 ± 1 °C unterbringen.
- Stellen Sie Wasser und Nahrung ad libitum zur Verfügung.
- Halten Sie Mäuse unter einem normalen Dunkel-/Hell-Zyklus von 12:12 Uhr (Licht an um 08:00 Uhr).
2. Chirurgie
- Bereiten Sie pro Maus ein etwa 6 cm langes Stück chromische Darmligatur (6-0) vor und legen Sie es in sterile Kochsalzlösung, um ein Austrocknen und Steifheit und Spröde zu vermeiden.
- Betäuben Sie die Maus mit Ketamin/Xylazin (75/15 mg/kg, intraperitoneal, Injektionsvolumen 10 ml/kg). Überprüfen Sie die Narkosetiefe, indem Sie die Haut zwischen den Zehen einklemmen. Stellen Sie sicher, dass die Maus ihr Bein nicht beugt. Warten Sie gegebenenfalls, bis das Tier vollständig betäubt ist, und/oder verabreichen Sie zusätzliches Ketamin/Xylazin.
HINWEIS: Ergänzende Analgetika sollten nicht verabreicht werden, um präventive analgetische Wirkungen zu vermeiden, die die Entwicklung von trigeminalen neuropathischen Schmerzen beeinträchtigen können. - Rasieren Sie das bukkale Haar vorsichtig zwischen dem Schnurrhaarpolster und dem Auge, um einen Schnitt von ca. 4 mm gerade rostral zum Foramen infraorbitalis zu machen. Achten Sie darauf, die Schnurrhaare nicht zu beschädigen, da dies die Verhaltenstests beeinträchtigen kann.
- Fixieren Sie den Kopf der Maus in einem stereotaktischen Rahmen oder fixieren Sie den Kopf auf andere Weise. Stellen Sie die Maus auf ein beheiztes Pad oder achten Sie darauf, die Körpertemperatur ansonsten zu halten.
- Tragen Sie die Salbe auf beide Augen auf, um ein Austrocknen zu vermeiden. Schrubben Sie den rasierten Kopfbereich mit Alkohol und anschließend mit Betadin. Legen Sie ein OP-Abdecktuch an, das den rasierten Kopfbereich freilegt.
- Verwenden Sie für die Schritte 2.7 bis 2.14 ein Mikroskop.
- Machen Sie einen 4 mm dicken Hautschnitt senkrecht zur Mittellinie etwa auf halbem Weg zwischen dem Rand des Schnurrhaarpolsters und dem Auge, gerade rostral zum Foramen infraorbitalis und zentriert um die Linie zwischen der Mitte des Auges und der Mitte des Schnurrhaarpolsters.
- Legen Sie das IoN frei, indem Sie das oberflächliche Bindegewebe stumpf abtrennen. Achten Sie darauf, Muskelschäden zu minimieren und die motorischen Nervenfasern zu vermeiden. Stellen Sie sicher, dass der Rumpf des IoN (1-1,5 mm Durchmesser) zwischen dem Austritt aus dem Schädel und der Verzweigung zum Whisker-Pad in einer Tiefe von etwa 3 mm zugänglich ist (Abbildung 1).
- Schieben Sie den Kopf einer hakenförmigen Ligaturhilfe mit einer rotierenden Bewegung unter das IoN und achten Sie darauf, den Nerv nicht zu beschädigen.
- Platzieren Sie die chromische Darmligatur durch das Loch an der Spitze der Ligaturhilfe und ziehen Sie die Ligatur so zurück, dass die Ligatur unter dem IoN verbleibt und beide Enden der Ligatur mehr oder weniger gleich weit vom IoN entfernt sind.
- Binden Sie einen "Slip-Knoten" von den beiden Enden der Ligatur und schieben Sie den Knoten gegen das IoN. Stellen Sie sicher, dass der Schlupfknoten einen reibungslosen Lauf ermöglicht, damit der Grad der Einschnürung genau kontrolliert werden kann. Schieben Sie den Knoten weiter und verengen Sie das IoN. Reduzieren Sie den Durchmesser des Nervs nur um einen spürbaren Betrag4. Lege einen normalen Knoten auf den geschlitzten Knoten, um ein Verrutschen zu verhindern.
- Schneiden Sie die Enden der Ligatur ab und lassen Sie ca. 1,5 mm freie Enden, um zu verhindern, dass sich der Knoten löst.
- Führen Sie die Scheinoperation gemäß den Schritten 2.2-2.8 durch.
- Verschließen Sie den Hautschnitt mit synthetischen resorbierbaren Nähten (6-0) und lassen Sie das Tier auf einem beheizten Pad oder unter einer Infrarot-Wärmelampe sich erholen.
3. Verhaltenstests
- Gewöhnen Sie die Maus vor dem präoperativen Test mindestens 8 Tage lang an die Gehäusebedingungen.
- Gewöhnen Sie die Maus vor dem präoperativen Test mindestens einmal täglich für 3 Tage an das Testverfahren.
- Führen Sie die Tests bei normalen Lichtverhältnissen durch. Stellen Sie bei Bedarf Hintergrundgeräusche bereit, um Störungen durch Außengeräusche zu minimieren.
- Beobachtung des Gesichtspflegeverhaltens
- Tragen Sie eine einzelne Maus vom Gehäuse in den Testraum in einem abgedeckten Kunststoffkäfig ohne jegliches Einstreumaterial. Vermeiden Sie äußere Reize beim Transport der Tiere.
- Stellen Sie die Maus in einen abgedeckten, transparenten Kunststoffkäfig ohne Einstreu (L x B x H: 12 cm x 12 cm x 17 cm) vor eine Videokamera. Platzieren Sie einen Spiegel, um das Gesicht des Tieres zu sehen, wenn es mit dem Rücken zur Kamera steht.
- Zeichnen Sie das Verhalten der Maus 10 Minuten lang auf. Stellen Sie während der Aufzeichnung sicher, dass der Experimentator nicht im Raum anwesend ist.
- Nachdem Sie das nächste Tier aufgenommen haben, reinigen Sie den Beobachtungskäfig.
- Lassen Sie einen Beobachter, der für die experimentellen Bedingungen der Maus blind ist, das aufgezeichnete Verhalten analysieren.
- Notieren Sie sich jede Gesichtspflege-Episode, während Sie die 10-minütige Aufzeichnung analysieren. Beim Face Grooming handelt es sich um Bewegungsmuster, bei denen das Tier seine Vorderpfoten in Kontakt mit der Gesichtspartie bringt.
- Unterscheiden Sie zwischen isolierter Gesichtspflege und Gesichtspflegeverhalten während der Körperpflege9. Wenn einer Sequenz keine Körperpflege vorausgeht oder folgt, wird die Episode als isolierte Gesichtspflege bezeichnet. Bodygrooming ist definiert als Bewegungsmuster, bei denen Pfoten, Zunge oder Schneidezähne mit einem anderen Körperbereich als dem Gesicht oder den Vorderpfoten in Kontakt kommen. Wenn Bodygrooming vor oder nach einer Gesichtspflegesequenz stattfindet, wird die Episode als Gesichtspflege während der Körperpflege bezeichnet.
- Bestimmen Sie die Anzahl der Gesichtspflegeepisoden, indem Sie ein Cut-off-Kriterium von 4 s anwenden. Ein Zeitraum zwischen den Pflegeaktionen von weniger als 4 s ist definiert als eine Pause innerhalb einer einzelnen Episode. Ein Zeitraum von mehr als 4 s ist definiert als eine vollständige Unterbrechung der Pflegeaktionen zwischen zwei Episoden.
- Mechanische Stimulationsprüfung
- Transportieren Sie Mäuse in Gruppen von bis zu 6 Tieren in einem überdachten Käfig mit Einstreu vom Stall in den Versuchsraum. Achten Sie auch hier darauf, äußere Stimulation zu vermeiden.
- Legen Sie die Mäuse nacheinander auf einen Tisch.
- Legen Sie den Schwanz der Maus in eine weiche Silikonklammer und befestigen Sie die Klemme magnetisch an einer Metallplatte auf dem Tisch. Das Silikonmaterial verhindert, dass der Schwanz von der Klemme rutscht, und minimiert gleichzeitig den Druck auf den Schwanz.
- Platzieren Sie eine dreiwandige Kunststoffhalterung (65 mm x 25 mm x 23 mm) über das Tier, sodass nur der Kopf der Maus aus dem Behälter herausragt. Die Größe des Halters ermöglicht Bewegungen von Kopf und Vorderpfote, verhindert aber, dass sich das Tier darin umdreht. Platzieren Sie abschließend ein Gewicht auf dem Halter, um den Halter an Ort und Stelle zu halten (Abbildung 2).
- Verwenden Sie eine abgestufte Serie von vier von Frey-Haaren. Die Kraft, die zum Biegen der Haare erforderlich ist, beträgt 0,02 g, 0,16 g, 0,4 g und 1,0 g.
- Gewöhnen Sie die Mäuse 10 Minuten lang an den Rückhalte- und Reichweitenbewegungen. Alle 30 s eine Greifbewegung pro Tier machen.
- Wenn sich das Tier in einem entspannten Zustand befindet, tragen Sie langsam das hellste von-Frey-Haar innerhalb des IoN-Territoriums in der Nähe der Mitte der Vibrissen auf, bis sich das von-Frey-Haar biegt. Stellen Sie sicher, dass die Stimulation nicht länger als 1 s dauert.
- Bewerten Sie die Reaktion des Tieres auf die Stimulation so, dass sie in eine der folgenden Reaktionskategorien passt.
- Geben Sie eine Punktzahl von 0 an, wenn keine Antwort erfolgt.
- Geben Sie eine Punktzahl von 1 für die Erkennung, d.h. die Maus dreht ihren Kopf in Richtung des stimulierenden Objekts und erkundet dann das Reizobjekt.
- Geben Sie eine Punktzahl von 2 für die Entzugsreaktion an, d.h. die Maus dreht den Kopf sanft weg oder zieht ihn schnell nach hinten, wenn die Stimulation angewendet wird; Manchmal kommt es zu einem einzigen Gesichtswischen, das ipsilateral zum stimulierten Bereich verläuft.
- Geben Sie eine Punktzahl von 3 für das Angreifen, d.h. die Maus greift das Reizobjekt an, indem sie Beiß- und/oder Greifbewegungen ausführt.
- Geben Sie eine Punktzahl von 4 für asymmetrisches Face Grooming, d.h. die Maus zeigt eine ununterbrochene Serie von mindestens drei Gesichtswaschbewegungen, die auf die stimulierte Gesichtspartie gerichtet sind.
- Tragen Sie für jede Maus Von-Frey-Haare in aufsteigender Reihenfolge der Intensität auf und stimulieren Sie nach dem Zufallsprinzip die ipsilaterale und die kontralaterale Seite. Wenden Sie jede Reizintensität einmal auf jede Seite an.
- Berechnen Sie den Mittelwert aus den Antworten auf die vier von-Frey-Haare in jedem Tier. Berechnen Sie getrennte Noten für die ipsilaterale und die kontralaterale Seite.
Ergebnisse
DIoN-CCI-Mäuse zeigen eine starke postoperative Zunahme der Zeit, die für die isolierte Gesichtspflege aufgewendet wurde, und der Anzahl der isolierten Gesichtspflegeepisoden (Abbildung 3). Der stärkste Anstieg tritt in der ersten postoperativen Woche auf und wird dann in den folgenden Wochen kleiner, ist aber für mindestens 6 Wochen deutlich erhöht. Die Gesichtspflege während des Bodygroomings ist davon mehr oder weniger unberührt.
DIoN-CCI-Mäuse reagieren in der ersten Woche nach der DioN-CCI fast vollständig nicht auf eine ipsilaterale mechanische Stimulation des ipsilateralen IoN-Territoriums (Abbildung 4). In den nächsten Wochen wird diese Hyporeagibilität durch eine Hyperreagibilität ersetzt, die mindestens 6 Wochen anhält. Es kann auch zu einer geringfügigen Zunahme der Reaktionsfähigkeit auf kontralaterale mechanische Stimulation kommen.
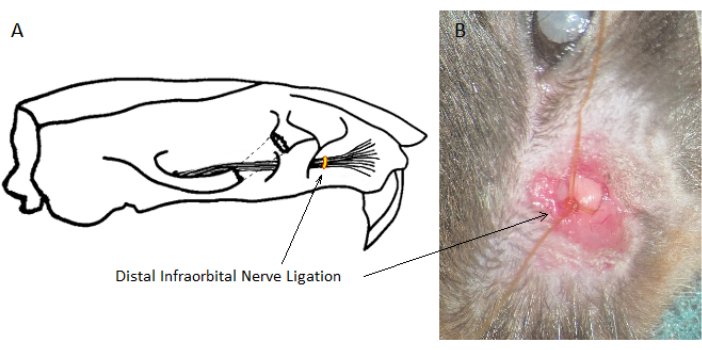
Abbildung 1: Lokalisation der distalen Ligatur des Nervus infraorbitalis. Die Lage der distalen Ligatur des Nervus infraorbitalis ist rostral zum Ausgang aus dem Schädel, aber kaudal bis zu der Stelle, an der sie sich zum Schnurrhaarpolster verzweigt. (A) Schematische Darstellung des rechten IoN. (B) Chirurgische Ansicht eines ligierten IoN auf der linken Seite. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 2: Rückhaltevorrichtung, die für mechanische Stimulationstests verwendet wird. Der Schwanz der Maus wird von einer (A) weichen Silikonklemme an Ort und Stelle gehalten, die magnetisch an einer (B) Metallplatte auf dem Tisch befestigt ist. (C) Ein Kunststoffhalter ermöglicht Bewegungen von Kopf und Vorderpfote, verhindert aber, dass sich das Tier darin umdreht. Ein Metallgewicht hält den Halter an Ort und Stelle. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 3: Postoperative Veränderungen des isolierten Gesichtspflegeverhaltens nach DIoN-CCI. Die Datenpunkte bezeichnen die (A) Zeit, die (A) für die isolierte Gesichtspflege aufgewendet wurde (mittlere ± SEM; n = 15 pro Gruppe) und die (B) Anzahl (mittlere ± SEM; n = 15 pro Gruppe) der isolierten Gesichtspflegeepisoden 1 Tag vor der DIoN-Operation (vor der Operation) und an den postoperativen Tagen 3-42. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Zeitlicher Verlauf der Auswirkungen von DIoN-CCI auf die Reaktionsfähigkeit auf mechanische Stimulation. Die Datenpunkte bezeichnen das Ansprechen (mittlerer ± SEM; n = 15 pro Gruppe) auf die von-Frey-Haarstimulation des Territoriums des (A) ligierten Nervs und der (B) kontralateralen Seite 1 Tag vor (Pre-op) und 3-42 Tage nach der DIoN-Operation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Bei Ratten wurde zuvor argumentiert, dass ein intraorbitaler Zugang zum IoN vorzuziehen ist, unter Berücksichtigung der Bedeutung einer intakten feinen Muskulatur zur Kontrolle komplexer Quirlmuster bei der vibrissotaktilen Unterscheidung und des relativen Abstands des Mittellinienschnitts zum Gebiet des kutanen infraorbitalen Nervs10. Andere haben argumentiert, dass ein distaler Zugang über einen Schnitt in die behaarte Haut kaudal des Vibrissalpolsters eine Reihe von Vorteilen hat13,14. Chirurgisch handelt es sich um eine einfachere Technik, die minimalinvasiv ist. Es kann ohne Verwendung eines stereotaktischen Rahmens und in kürzerer Zeit durchgeführt werden. Beide Techniken führen zu vergleichbaren postoperativen Verhaltenseffekten, sowohl evoziertem als auch nicht evoziertem Schmerzverhalten. Darüber hinaus vermeidet das Verfahren mögliche Augenbeschwerden, die durch die Ablenkung des Orbitainhalts während des Eingriffs und einen möglicherweise irritierenden Kontakt zwischen den Nervenligaten und dem Auge entstehen. Bei Mäusen fanden wir den intraorbitalen Zugang aufgrund ihrer geringeren Größe zu schwierig, um ihn als Standardverfahren anzuwenden. Daher zielt dieses Verfahren darauf ab, einen distalen Ansatz zu verwenden, um eine infraorbitale Nervenverletzung bei einer Maus chirurgisch zu induzieren, was zur Entwicklung eines spontanen und evozierten Schmerzverhaltens führt, das zur Untersuchung von trigeminalen neuropathischen Schmerzen verwendet werden kann.
Ein entscheidender Schritt bei der Anwendung dieses Modells, wie bei anderen Tiermodellen, die durch Nervenligatur induziert werden, besteht darin, die Ligatur mit der richtigen Menge an Verengung um den Nervus infraorbitaliszu platzieren 4,15,16. Die Verhaltensergebnisse sind bei Tieren mit unterschiedlichem Grad an Nervenverengung sehr unterschiedlich17. Das Verhältnis der Größe des Chromdarms (6-0) zum Durchmesser des infraorbitalen Nervs der Maus ist nicht das gleiche wie bei Ratten, bei denen die Größe 5-0 verwendet wird. Bei Mäusen wurde festgestellt, dass zwei Ligaturen ein höheres Maß an Nervenverletzung induzierten als bei Ratten. Da die Größe 6-0 der kleinste Chromdarm war, der gefunden werden konnte, entschieden wir uns in der vorliegenden Studie für eine einzelne Ligatur, die ähnliche Verhaltensergebnisse wie bei Ratten erzeugte. Zwei chromfreie Darmligaturen der Größe 7-0 könnten möglicherweise ebenfalls zu ähnlichen Ergebnissen führen.
Die Stimulation des IoN-Territoriums mit von-Frey-Haaren erfordert, dass die Tiere relativ bewegungslos sind. Bei Ratten kann dies erreicht werden, indem die Tiere an einen Beobachtungskäfig gewöhnt werden. Bei Mäusen ist es aufgrund ihrer hohen lokomotorischen Aktivität schwierig, das IoN-Territorium mit hoher Präzision zu stimulieren. Das Tier an der Hand zu halten ist eine stressige Methode, die die Gültigkeit und Zuverlässigkeit der Reaktion des Tieres auf einen Reiz stark beeinträchtigt. Das Absetzen der Tiere auf einer kleinen erhöhten Plattform wurde auch in Studienverwendet 18. Obwohl die Bewegungen eingeschränkter sind, wurde festgestellt, dass die Plattform es den Tieren ermöglicht, sich mehr zu bewegen, als erforderlich ist, um das IoN-Territorium mit Genauigkeit und einer gut kontrollierten Biegekraft zu stimulieren. In unserem Labor wurde eine Fixierungsmethode entwickelt und teilweise mit Hilfe des 3D-Drucks hergestellt. Der dreiwandige Kunststoffhalter und das Gewicht ähneln denen von Krzyzanowska et al. (2011), aber die Methode, den Schwanz des Tieres an Ort und Stelle zu halten, ist eine andere19. Wichtig ist, dass das Gerät es dem Tier ermöglicht, auf natürlichere Weise auf den Reiz zu reagieren, einschließlich Pfoten- und Kopfbewegungen. Das Gerät verhindert jedoch, dass das Tier seinen Körper wegbewegt, um weiteren Kontakt mit dem Reiz zu vermeiden. Bei sich frei bewegenden Tieren in einem Beobachtungskäfig ist letzteres Verhalten gleichbedeutend mit dem Greifen oder Beißen des Reizes (Response-Score Kategorie 3).
Der vorliegende Artikel zeigt, dass DIoN-CCI bei Mäusen als Reaktion auf die von-Frey-Haarstimulation Veränderungen im spontanen Verhalten induziert, die denen bei IoN-CCI-Ratten ähneln, d.h. eine erhöhte gerichtete Gesichtspflege und eine Hyperreagibilität auf die von-Frey-Haarstimulation des IoN-Territoriums10. Die durchschnittliche Dauer der isolierten Gesichtspflegeepisoden bei Mäusen war kürzer als bei Ratten (2 s vs. 10 s), aber die durchschnittliche Spitzenzahl der isolierten Gesichtspflegeepisoden war bei Mäusen höher (13 vs. 5). Es ist unklar, ob dies nur eine Reflexion von Unterschieden in den angeborenen Pflegemustern ist oder mit der Art der spontanen Schmerzempfindungen zusammenhängt.
Offenlegungen
Die Autoren haben keine Interessenkonflikte offenzulegen.
Danksagungen
Die Autoren haben keine Danksagungen.
Materialien
| Name | Company | Catalog Number | Comments |
| Chromic catgut (6-0) | Dynek | CG602D | ligatures |
| Cotton applicator | Pharmacy | ||
| Digital video camera | Sony | HDR-CX330E | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Dumont forceps - Micro-blunted tips (#5/45) | Fine Science Tools | 11253-25 | |
| Duratears | Alcon | 0037-820 | ophthalmic ointment |
| Hooked ligation aid | Fine Science Tools | 18062-12 | |
| Ketalar | Pfizer | ketamine (50 mg/mL) | |
| Operation microscope | Kaps | SOM 62 | |
| Precision cotton swab | Qosina | 10225 | |
| Precision trimmer | Philips | HP6392/00 | |
| Rompun | Bayer | xylazine (2%) | |
| Scissors - blunt tips | Fine Science Tools | 14574-09 | |
| Semmes-Weinstein Von Frey Aesthesiometer kit | Stoelting | 58011 | |
| Vicryl Rapide | Ethicon | MPVR489H | sutures |
Referenzen
- Costigan, M., Scholz, J., Woolf, C. J. Neuropathic pain: a maladaptive response of the nervous system to damage. Annu Rev Neurosci. 32, 1-32 (2009).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain. 7, 281-289 (2006).
- Jensen, T. S., Gottrup, H., Sindrup, S. H., Bach, F. W. The clinical picture of neuropathic pain. Eur J Pharmacol. 429 (1-3), 1-11 (2001).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Backonja, M. M., Stacey, B. Neuropathic pain symptoms relative to overall pain rating. J Pain. 5, 491-497 (2004).
- Basbaum, A. I., Campbell, J. N., et al. Measurrement and New Technologies. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Mogil, J. S., Crager, S. E. What should we be measuring in behavioral studies of chronic pain in animals. Pain. 112, 12-15 (2004).
- Vierck, C. J., Campbell, J. N., et al. Animal Studies of Pain: Lessons for Drug Development. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Deseure, K., Adriaensen, H. Nonevoked facial pain in rats following infraorbital nerve injury a parametric analysis. Physiol Behav. 81 (4), 595-604 (2004).
- Deseure, K., Hans, G. H. Chronic constriction injury of the rat's infraorbital nerve (IoN-CCI) to study trigeminal neuropathic pain. J Vis Exp. (103), e53167 (2015).
- Mogil, J. S. Animal models of pain: progress and challenges. Nat Rev Neurosci. 10 (4), 283-294 (2009).
- Wilson, S. G., Mogil, J. S. Measuring pain in the (knockout) mouse: big challenges in a small mammal. Behav Brain Res. 125 (1-2), 65-73 (2001).
- Ding, W., et al. An improved rodent model of trigeminal neuropathic pain by unilateral chronic constriction injury of distal infraorbital nerve. J Pain. 18 (8), 899-907 (2017).
- Hardt, S., Fischer, C., Vogel, A., Wilken-Schmitz, A., Tegeder, I. Distal infraorbital nerve injury: a model for persistent facial pain in mice. Pain. 160 (6), 1431-1447 (2019).
- Krzyzanowska, A., Avendaño, C. Behavioral testing in rodent models of orofacial neuropathic and inflammatory pain. Brain Behav. 2 (5), 678-697 (2012).
- Martin, Y. B., Malmierca, E., Avendaño, C., Nuñez, A. Neuronal disinhibition in the trigeminal nucleus caudalis in a model of chronic neuropathic pain. Eur J Neurosci. 32 (3), 399-408 (2010).
- Deseure, K., Hans, G. Behavioral study of non evoked orofacial pain following different types of infraorbital nerve injury in rats. Physiol Behav. 138, 292-296 (2015).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. J Headache Pain. 20 (1), 11 (2019).
- Krzyzanowska, A., et al. Assessing nociceptive sensitivity in mouse models of inflammatory and neuropathic trigeminal pain. J Neurosci Methods. 201 (1), 46-54 (2011).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten