Method Article
Lesione da costrizione cronica del nervo infraorbitale distale (DIoN-CCI) nei topi per studiare il dolore neuropatico del trigemino
In questo articolo
Riepilogo
La lesione cronica da costrizione del nervo infraorbitale distale nei topi induce cambiamenti nel comportamento spontaneo (aumento dell'attività di toelettatura del viso) e nel comportamento nocifensivo in risposta alla stimolazione tattile (iperreattività alla stimolazione dei capelli di von Frey) che sono segni di dolore in corso e allodinia e funge da modello per il dolore neuropatico trigemino.
Abstract
I modelli animali rimangono strumenti necessari per studiare il dolore neuropatico. Questo manoscritto descrive il modello di lesione da costrizione cronica del nervo infraorbitale distale (DIoN-CCI) per studiare il dolore neuropatico trigemino nei topi. Ciò include le procedure chirurgiche per eseguire la lesione da costrizione cronica e i test comportamentali postoperatori per valutare i cambiamenti nel comportamento spontaneo ed evocato che sono segni di dolore in corso e allodinia meccanica. I metodi e le letture comportamentali sono simili al modello di lesione da costrizione cronica del nervo infraorbitale (IoN-CCI) nei ratti. Tuttavia, sono necessari importanti cambiamenti per l'adattamento del modello IoN-CCI ai topi. In primo luogo, l'approccio intra-orbitale è sostituito da un approccio più rostrale con un'incisione tra l'occhio e il cuscinetto dei baffi. L'IoN è quindi legato distalmente al di fuori della cavità orbitale. In secondo luogo, a causa della maggiore attività locomotoria nei topi, consentire ai ratti di muoversi liberamente in piccole gabbie è sostituito dal posizionamento dei topi in dispositivi di contenzione progettati e costruiti su misura. Dopo la legatura DIoN, i topi mostrano cambiamenti nel comportamento spontaneo e in risposta alla stimolazione dei capelli di von Frey che sono simili a quelli dei ratti IoN-CCI, cioè un aumento della toelettatura diretta del viso e iperreattività alla stimolazione dei capelli di von Frey del territorio IoN.
Introduzione
Il dolore neuropatico deriva da un danno al sistema nervoso somatosensoriale, che porta a una trasmissione anomala di segnali sensoriali al cervello. Il danno ai nervi somatosensoriali non sempre porta a dolore neuropatico, ma la prevalenza aumenta con la gravità della neuropatia clinica 1,2. I pazienti con dolore neuropatico sperimentano sintomi specifici come sensazioni spontanee (bruciore, formicolio, sensazioni elettriche) e dolore anormalmente intenso o prolungato a stimolazione innocua o nociva che tendono a diventare croniche e resistenti al trattamento con farmaci antidolorifici convenzionali3. Un progresso significativo nel campo della ricerca sul dolore neuropatico deriva dalla scoperta che le legature che si restringono liberamente attorno al nervo sciatico nei ratti portano a comportamenti simili alle condizioni di dolore neuropatico umano4. Gli animali mostrano soglie ridotte al caldo, al freddo e alla stimolazione meccanica e mostrano comportamenti nocifensivi. Nonostante le differenze biologiche intrinseche nell'elaborazione del dolore tra esseri umani e roditori, i modelli animali sono uno strumento prezioso per studiare i meccanismi alla base dello sviluppo del dolore neuropatico e testare le nuove strategie di trattamento proposte.
I paradigmi di test del dolore basati sui riflessi sensoriali sono stati ampiamente utilizzati nei modelli di dolore neuropatico, ma la misurazione del dolore in corso o di altri disturbi frequentemente accompagnati (disturbi del sonno, depressione, ansia) non ha ricevuto sufficiente attenzione considerando che si tratta di sintomi clinici comuni che influenzano la qualità della vita 5,6,7,8 . Il comportamento di toelettatura del viso nei ratti è stato documentato come misura del dolore neuropatico spontaneo a seguito di lesione da costrizione cronica (CCI) del nervo infraorbitale (IoN)9,10. Inoltre, i ratti sviluppano anche iperreattività alla lieve stimolazione tattile del territorio IoN, che è indicativa di allodinia meccanica.
Rispetto ai topi, a causa delle loro dimensioni maggiori, i ratti sono più adatti per le lesioni chirurgiche. Tuttavia, i topi offrono efficienza in termini di costi e spazio e richiedono quantità di farmaci minori. Inoltre, l'avvento della tecnologia transgenica ha ulteriormente incrementato l'uso dei topi11,12. Pertanto, l'obiettivo generale di questa procedura è quello di eseguire una lesione chirurgica del nervo infraorbitale nei topi, simile a quella dei ratti, che induce cambiamenti nel comportamento spontaneo ed evocato per lo studio del dolore neuropatico trigemino.
Protocollo
Gli animali sono trattati e curati secondo le linee guida per la ricerca sul dolore negli animali coscienti dell'Associazione Internazionale per lo Studio del Dolore e in linea con le normative fiamminghe ed europee per la ricerca sugli animali e le linee guida ARRIVE. Il protocollo è approvato dal Comitato Etico istituzionale.
1. Animali
- Utilizzare topi C57BL/6J maschi e femmine (Janvier, 10 settimane all'arrivo).
- Alloggiare topi maschi e femmine separatamente in gabbie standard per topi a fondo solido in una stanza di colonia con un'umidità del 40%-60% e una temperatura ambiente (RT) di 21 ± 1 °C.
- Fornire acqua e cibo ad libitum.
- Mantieni i mouse sotto un normale ciclo di buio/luce di 12:12 h (luci accese alle 08:00).
2. Chirurgia
- Per topo, preparare un pezzo di legatura intestinale cromica (6-0) lunga circa 6 cm e metterlo in soluzione fisiologica sterile per evitare che si secchi e diventi rigido e fragile.
- Anestetizzare il topo con ketamina/xilazina (75/15 mg/kg, intraperitoneale, volume di iniezione 10 ml/kg). Controlla la profondità dell'anestesia pizzicando la pelle tra le dita dei piedi. Assicurarsi che il mouse non fletti la gamba. Se necessario, attendere che l'animale sia completamente anestetizzato e/o somministrare ulteriore ketamina/xilazina.
NOTA: Gli analgesici supplementari non devono essere somministrati per evitare effetti analgesici preventivi che possono interferire con lo sviluppo del dolore neuropatico trigemino. - Radere delicatamente i peli buccali tra il cuscinetto dei baffi e l'occhio per praticare un'incisione di circa 4 mm appena rostrale al forame infraorbitale. Fare attenzione a non danneggiare i baffi, poiché ciò potrebbe influire sui test comportamentali.
- Fissare la testa del mouse in una cornice stereotassica o fissare in altro modo la testa. Posizionare il mouse su un tappetino riscaldato o fare attenzione a mantenere la temperatura corporea in caso contrario.
- Applicare un unguento su entrambi gli occhi per evitare che si secchino. Strofina l'area della testa rasata con alcol e poi con betadine. Posizionare un telo chirurgico che esponga l'area della testa rasata.
- Utilizzare un microscopio per i passaggi da 2.7 a 2.14.
- Praticare un'incisione cutanea di 4 mm perpendicolare alla linea mediana circa a metà strada tra il bordo del cuscinetto dei baffi e l'occhio, appena rostrale rispetto al forame infraorbitale e centrata attorno alla linea tra il centro dell'occhio e il centro del cuscinetto dei baffi.
- Esporre l'IoN separando bruscamente il tessuto connettivo superficiale. Fare attenzione a ridurre al minimo i danni alla muscolatura ed evitare le fibre nervose motorie. Assicurarsi che il tronco dell'IoN (1-1,5 mm di diametro) sia accessibile a una profondità di circa 3 mm tra il punto in cui esce dal cranio e il punto in cui si dirama verso il cuscinetto dei baffi (Figura 1).
- Usando un movimento rotatorio, infilare la testa di un ausilio per legatura uncinato sotto l'IoN, facendo attenzione a non danneggiare il nervo.
- Posizionare la legatura dell'intestino cromico attraverso il foro sulla punta dell'ausilio di legatura e ritrarre l'ausilio di legatura in modo che la legatura rimanga sotto l'IoN ed entrambe le estremità della legatura siano più o meno equidistanti dall'IoN.
- Fai un "nodo scorsoio" dalle due estremità della legatura e fai scorrere il nodo contro l'IoN. Assicurarsi che il nodo scorsoio consenta un'azione fluida in modo che il grado di costrizione possa essere controllato con precisione. Far scorrere ulteriormente il nodo e restringere l'IoN. Ridurre il diametro del nervo di una quantità notevole4. Metti un nodo normale sopra il nodo a fessura per evitare che scivoli.
- Tagliare le estremità della legatura lasciando circa 1,5 mm di estremità libere per evitare che il nodo si sciolga.
- Eseguire l'intervento chirurgico fittizio seguendo i passaggi 2.2-2.8.
- Chiudere l'incisione cutanea utilizzando suture sintetiche riassorbibili (6-0) e lasciare che l'animale si riprenda su un cuscinetto riscaldato o sotto una lampada riscaldante a infrarossi.
3. Test comportamentali
- Acclimatare il topo alle condizioni di stabulazione per almeno 8 giorni prima del test preoperatorio.
- Prima del test preoperatorio, abituare il mouse alla procedura di test almeno una volta al giorno per 3 giorni.
- Eseguire test in condizioni di illuminazione normali. Se necessario, fornire rumore di fondo per ridurre al minimo i disturbi causati dai rumori esterni.
- Osservazione del comportamento di cura del viso
- Trasporta un singolo topo dall'alloggiamento alla sala prove in una gabbia di plastica coperta senza alcun materiale da lettiera. Evitare la stimolazione esterna durante il trasporto degli animali.
- Posiziona il mouse in una gabbia di plastica trasparente coperta senza lettiera (L x P x A: 12 cm x 12 cm x 17 cm) davanti a una videocamera. Posiziona uno specchio per vedere il muso dell'animale quando la sua schiena è rivolta verso la fotocamera.
- Registra il comportamento del mouse per 10 minuti. Durante la registrazione, assicurarsi che lo sperimentatore non sia presente nella stanza.
- Dopo aver registrato l'animale successivo, pulire la gabbia di osservazione.
- Chiedi a un osservatore che è cieco alle condizioni sperimentali del topo di analizzare il comportamento registrato.
- Annota ogni episodio di toelettatura del viso mentre analizzi la registrazione di 10 minuti. La toelettatura del viso è uno schema di movimento in cui l'animale porta le zampe anteriori a contatto con le aree facciali.
- Fai una distinzione tra comportamenti isolati di toelettatura del viso e comportamenti di toelettatura del viso durante la toelettatura del corpo9. Se una sequenza non è preceduta o seguita da una toelettatura del corpo, l'episodio viene etichettato come toelettatura del viso isolata. La toelettatura del corpo è definita come modelli di movimento che portano le zampe, la lingua o gli incisivi a contatto con un'area del corpo diversa dal viso o dalle zampe anteriori. Se la toelettatura del corpo è presente prima o dopo una sequenza di toelettatura del viso, l'episodio viene etichettato come toelettatura del viso durante la toelettatura del corpo.
- Determinare il numero di episodi di toelettatura del viso applicando un criterio di cut-off di 4 s. Un periodo di tempo tra le azioni di adescamento inferiore a 4 secondi è definito come una pausa all'interno di un singolo episodio. Un periodo di tempo superiore a 4 s è definito come un'interruzione completa delle azioni di adescamento tra due episodi.
- Test di stimolazione meccanica
- Trasporta i topi in gruppi di massimo 6 animali dalla stabulazione alla sala di prova in una gabbia coperta con lettiera. Anche in questo caso, fare attenzione a evitare la stimolazione esterna.
- Posiziona i topi uno alla volta su un tavolo.
- Posiziona la coda del mouse in un morsetto in silicone morbido e fissa il morsetto magneticamente a una piastra metallica sul tavolo. Il materiale siliconico impedisce alla coda di scivolare dal morsetto riducendo al minimo la pressione sulla coda.
- Posiziona un supporto di plastica a tre pareti (65 mm x 25 mm x 23 mm) sopra l'animale in modo che solo la testa del topo sporga dal contenitore. Le dimensioni del supporto consentono i movimenti della testa e della zampa anteriore, ma impediscono all'animale di girarsi al suo interno. Infine, posizionare un peso sopra il supporto per mantenerlo in posizione (Figura 2).
- Utilizzare una serie graduata di quattro peli di von Frey. La forza richiesta per piegare i peli è di 0,02 g, 0,16 g, 0,4 g e 1,0 g.
- Abituare i topi al sistema di contenzione e ai movimenti di raggiungimento per 10 min. Ogni 30 s, fai un movimento di allungamento per animale.
- Quando l'animale è in uno stato rilassato, applicare lentamente il pelo di von Frey più leggero all'interno del territorio IoN vicino al centro delle vibrisse fino a quando il pelo di von Frey non si piega. Assicurarsi che la stimolazione non duri più di 1 s.
- Assegna un punteggio alla risposta dell'animale alla stimolazione per rientrare in una delle seguenti categorie di risposta.
- Assegna un punteggio di 0 quando non c'è risposta.
- Dai un punteggio di 1 per il rilevamento, cioè il topo gira la testa verso l'oggetto stimolante e poi esplora l'oggetto stimolante.
- Dare un punteggio di 2 per la reazione di astinenza, cioè il topo gira delicatamente la testa o la tira rapidamente all'indietro quando viene applicata la stimolazione; A volte, si verifica una singola pulizia del viso omolaterale all'area stimolata.
- Assegna un punteggio di 3 per l'attacco, cioè il mouse attacca l'oggetto stimolo, facendo movimenti di morso e/o di presa.
- Dare un punteggio di 4 per la toelettatura asimmetrica del viso, cioè il topo mostra una serie ininterrotta di almeno tre colpi di lavaggio del viso diretti verso l'area facciale stimolata.
- Per ogni topo, applicare i peli di von Frey in ordine crescente di intensità e stimolare in modo casuale i lati omolaterale e controlaterale. Applicare l'intensità di ogni stimolo una volta su ciascun lato.
- Calcola il punteggio medio dalle risposte ai quattro peli di von Frey all'interno di ciascun animale. Calcola punteggi separati per i lati omolaterale e controlaterale.
Risultati
I topi DIoN-CCI mostrano un forte aumento postoperatorio del tempo dedicato alla toelettatura del viso isolata e del numero di episodi di toelettatura del viso isolati (Figura 3). L'aumento più forte si verifica durante la prima settimana postoperatoria e poi diventa più piccolo durante le settimane successive, ma è significativamente aumentato per almeno 6 settimane. La toelettatura del viso durante la toelettatura del corpo è più o meno inalterata.
I topi DIoN-CCI sono quasi completamente insensibili alla stimolazione meccanica omolaterale del territorio omolaterale dell'IoN durante la prima settimana dopo DioN-CCI (Figura 4). Durante le settimane successive, questa iporeattività viene sostituita da un'iperreattività che persiste per almeno 6 settimane. Potrebbe esserci anche un piccolo aumento della reattività alla stimolazione meccanica controlaterale.
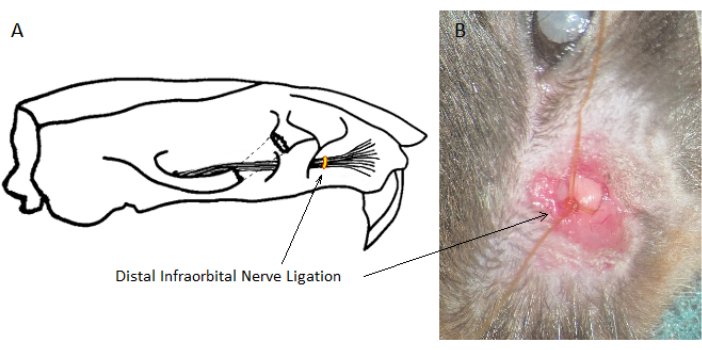
Figura 1: Posizione della legatura del nervo infraorbitale distale. La posizione della legatura del nervo infraorbitale distale è rostrale rispetto alla sua uscita dal cranio, ma caudale fino a dove si dirama verso il cuscinetto dei baffi. (A) Disegno schematico dell'IoN destro. (B) Vista chirurgica di un IoN legato sul lato sinistro. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: Dispositivo di contenzione utilizzato per i test di stimolazione meccanica. La coda del mouse è tenuta in posizione da un (A) silicone morbido clamp che è fissato magneticamente a una piastra metallica (B) sul tavolo. (C) Un supporto di plastica consente i movimenti della testa e delle zampe anteriori, ma impedisce all'animale di girarsi al suo interno. Un peso metallico mantiene il supporto in posizione. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: Cambiamenti postoperatori nel comportamento di toelettatura del viso isolato dopo DIoN-CCI. I punti dati indicano la quantità di tempo (media ± SEM; n = 15 per gruppo) per la toelettatura del viso isolata e il numero (B) (media ± SEM; n = 15 per gruppo) di episodi isolati di grooming del viso 1 giorno prima dell'intervento chirurgico DIoN (Pre-operatorio) e nei giorni postoperatori 3-42. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 4: Decorso temporale degli effetti della DIoN-CCI sulla reattività alla stimolazione meccanica. I punti dati denotano il punteggio di risposta (media ± SEM; n = 15 per gruppo) alla stimolazione dei capelli di von Frey del territorio del nervo legato (A) e del lato controlaterale (B) 1 giorno prima (Pre-operatorio) e 3-42 giorni dopo l'intervento chirurgico DIoN. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Nei ratti, è stato precedentemente sostenuto che un approccio intra-orbitale all'IoN è preferibile, considerando l'importanza di una muscolatura fine intatta che controlla i complessi modelli di frusta nella discriminazione vibrissotattile e la distanza relativa dell'incisione della linea mediana al territorio del nervo infraorbitale cutaneo10. Altri hanno sostenuto che un approccio distale attraverso un'incisione nella pelle pelosa caudale al cuscinetto vibrissale ha una serie di benefici13,14. Chirurgicamente, è una tecnica più semplice e minimamente invasiva. Può essere eseguito senza l'utilizzo di un frame stereotassico e in un lasso di tempo più breve. Entrambe le tecniche producono effetti comportamentali postoperatori comparabili, sia evocati che non evocati. Inoltre, la procedura evita possibili fastidi oculari derivanti dalla deviazione del contenuto orbitale durante la procedura e dal contatto potenzialmente irritante tra le legature nervose e l'occhio. Nei topi, a causa delle loro dimensioni ridotte, abbiamo trovato l'approccio intra-orbitale troppo difficile da utilizzare come procedura standard. Pertanto, questa procedura mira a utilizzare un approccio distale per indurre chirurgicamente una lesione del nervo infraorbitale in un topo, portando allo sviluppo di un comportamento di dolore spontaneo ed evocato che può essere utilizzato per studiare il dolore neuropatico trigemino.
Un passo cruciale nell'applicazione di questo modello, come con altri modelli animali di dolore cronico indotto dalla legatura dei nervi, è posizionare la legatura con la corretta quantità di costrizione attorno al nervo infraorbitale 4,15,16. Gli esiti comportamentali sono molto diversi negli animali con vari gradi di costrizione nervosa17. Il rapporto tra la dimensione dell'intestino cromato (6-0) e il diametro del nervo infraorbitale del topo non è lo stesso di quello nei ratti dove viene utilizzata la dimensione 5-0. Nei topi, è stato riscontrato che due legature inducevano un livello di lesione nervosa superiore a quello dei ratti. Poiché la dimensione 6-0 era il più piccolo intestino cromato che si poteva trovare, nel presente studio, abbiamo scelto di utilizzare una singola legatura, che ha prodotto risultati comportamentali simili a quelli dei ratti. Due legature intestinali non cromate di dimensione 7-0 potrebbero anche produrre risultati simili.
La stimolazione del territorio IoN con peli di von Frey richiede che gli animali siano relativamente immobili. Nei ratti, questo può essere ottenuto abituando gli animali a una gabbia di osservazione. Nei topi, a causa della loro elevata attività locomotoria, l'utilizzo di questo metodo rende difficile stimolare il territorio IoN con elevata precisione. Tenere l'animale per mano è un metodo stressante che compromette gravemente la validità e l'affidabilità della risposta dell'animale a uno stimolo. Il posizionamento degli animali su una piccola piattaforma rialzata è stato utilizzato anche negli studi18. Sebbene i movimenti siano più limitati, si è scoperto che la piattaforma consente agli animali di muoversi più del necessario per stimolare il territorio IoN con precisione e una forza di flessione ben controllata. Un metodo di contenimento è stato ideato e in parte prodotto nel nostro laboratorio mediante l'uso della stampa 3D. Il supporto in plastica a tre pareti e il peso sono simili a quelli utilizzati da Krzyzanowska et al. (2011), ma il metodo per mantenere la coda dell'animale in posizione è diverso19. È importante sottolineare che il dispositivo consente all'animale di rispondere in modo più naturale allo stimolo, compresi i movimenti delle zampe e della testa. Il dispositivo, tuttavia, impedisce all'animale di allontanare il corpo per evitare ulteriori contatti con lo stimolo. Negli animali che si muovono liberamente in una gabbia di osservazione, quest'ultimo comportamento equivale ad afferrare o mordere lo stimolo (categoria di punteggio di risposta 3).
Il presente articolo mostra che la DIoN-CCI nei topi induce cambiamenti nel comportamento spontaneo in risposta alla stimolazione dei capelli di von Frey che sono simili a quelli nei ratti IoN-CCI, cioè un aumento della toelettatura diretta del viso e iperreattività alla stimolazione dei capelli di von Frey del territorio IoN10. La durata media dell'episodio di toelettatura facciale isolata nei topi era più breve rispetto ai ratti (2 s vs. 10 s), ma il numero medio di picco di episodi di grooming facciale isolato era più alto nei topi (13 vs. 5). Non è chiaro se questo sia puramente un riflesso delle differenze nei modelli di toelettatura innati o correlato alla natura delle sensazioni di dolore spontanee.
Divulgazioni
Gli autori non hanno conflitti di interesse da rivelare.
Riconoscimenti
Gli autori non hanno riconoscimenti.
Materiali
| Name | Company | Catalog Number | Comments |
| Chromic catgut (6-0) | Dynek | CG602D | ligatures |
| Cotton applicator | Pharmacy | ||
| Digital video camera | Sony | HDR-CX330E | |
| Dumont #5 forceps | Fine Science Tools | 11251-10 | |
| Dumont forceps - Micro-blunted tips (#5/45) | Fine Science Tools | 11253-25 | |
| Duratears | Alcon | 0037-820 | ophthalmic ointment |
| Hooked ligation aid | Fine Science Tools | 18062-12 | |
| Ketalar | Pfizer | ketamine (50 mg/mL) | |
| Operation microscope | Kaps | SOM 62 | |
| Precision cotton swab | Qosina | 10225 | |
| Precision trimmer | Philips | HP6392/00 | |
| Rompun | Bayer | xylazine (2%) | |
| Scissors - blunt tips | Fine Science Tools | 14574-09 | |
| Semmes-Weinstein Von Frey Aesthesiometer kit | Stoelting | 58011 | |
| Vicryl Rapide | Ethicon | MPVR489H | sutures |
Riferimenti
- Costigan, M., Scholz, J., Woolf, C. J. Neuropathic pain: a maladaptive response of the nervous system to damage. Annu Rev Neurosci. 32, 1-32 (2009).
- Torrance, N., Smith, B. H., Bennett, M. I., Lee, A. J. The epidemiology of chronic pain of predominantly neuropathic origin. Results from a general population survey. J Pain. 7, 281-289 (2006).
- Jensen, T. S., Gottrup, H., Sindrup, S. H., Bach, F. W. The clinical picture of neuropathic pain. Eur J Pharmacol. 429 (1-3), 1-11 (2001).
- Bennett, G. J., Xie, Y. K. A peripheral mononeuropathy in rat that produces disorders of pain sensation like those seen in man. Pain. 33 (1), 87-107 (1988).
- Backonja, M. M., Stacey, B. Neuropathic pain symptoms relative to overall pain rating. J Pain. 5, 491-497 (2004).
- Basbaum, A. I., Campbell, J. N., et al. Measurrement and New Technologies. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Mogil, J. S., Crager, S. E. What should we be measuring in behavioral studies of chronic pain in animals. Pain. 112, 12-15 (2004).
- Vierck, C. J., Campbell, J. N., et al. Animal Studies of Pain: Lessons for Drug Development. Emerging Strategies for the Treatment of Neuropathic Pain. , (2006).
- Deseure, K., Adriaensen, H. Nonevoked facial pain in rats following infraorbital nerve injury a parametric analysis. Physiol Behav. 81 (4), 595-604 (2004).
- Deseure, K., Hans, G. H. Chronic constriction injury of the rat's infraorbital nerve (IoN-CCI) to study trigeminal neuropathic pain. J Vis Exp. (103), e53167 (2015).
- Mogil, J. S. Animal models of pain: progress and challenges. Nat Rev Neurosci. 10 (4), 283-294 (2009).
- Wilson, S. G., Mogil, J. S. Measuring pain in the (knockout) mouse: big challenges in a small mammal. Behav Brain Res. 125 (1-2), 65-73 (2001).
- Ding, W., et al. An improved rodent model of trigeminal neuropathic pain by unilateral chronic constriction injury of distal infraorbital nerve. J Pain. 18 (8), 899-907 (2017).
- Hardt, S., Fischer, C., Vogel, A., Wilken-Schmitz, A., Tegeder, I. Distal infraorbital nerve injury: a model for persistent facial pain in mice. Pain. 160 (6), 1431-1447 (2019).
- Krzyzanowska, A., Avendaño, C. Behavioral testing in rodent models of orofacial neuropathic and inflammatory pain. Brain Behav. 2 (5), 678-697 (2012).
- Martin, Y. B., Malmierca, E., Avendaño, C., Nuñez, A. Neuronal disinhibition in the trigeminal nucleus caudalis in a model of chronic neuropathic pain. Eur J Neurosci. 32 (3), 399-408 (2010).
- Deseure, K., Hans, G. Behavioral study of non evoked orofacial pain following different types of infraorbital nerve injury in rats. Physiol Behav. 138, 292-296 (2015).
- Vuralli, D., Wattiez, A. S., Russo, A. F., Bolay, H. Behavioral and cognitive animal models in headache research. J Headache Pain. 20 (1), 11 (2019).
- Krzyzanowska, A., et al. Assessing nociceptive sensitivity in mouse models of inflammatory and neuropathic trigeminal pain. J Neurosci Methods. 201 (1), 46-54 (2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon