Method Article
子宮頸がん細胞の増殖とシスプラチン感受性における FAM83Aの役割を検証するためのFAM83A のノックダウン
要約
ここでは、 FAM83A ノックダウンの手順を示します。子宮頸がん細胞の増殖、遊走、および浸潤に対するその影響を検出するためのアッセイ。そして、これらの細胞のシスプラチンに対する感作。この研究は、子宮頸がんの有望な標的遺伝子であり、さらなる薬物研究の参考となります。
要約
腫瘍標的遺伝子の探索は、子宮頸がんの予防と治療にとって最も重要です。この研究では、子宮頸がんにおける腫瘍標的遺伝子FAM83Aの同定に関与する手順を概説します。まず、Cancer Genome Atlasデータセットを使用して、女性におけるFAM83Aの発現と予後の重要性を検証しました。低分子干渉RNA(siRNA)は、HeLaおよびC33a細胞におけるFAM83A遺伝子のノックダウンに使用されました。次に、5-エチニル-2'-デオキシウリジン(EdU)染色を行い、腫瘍細胞の増殖能への影響を調べました。創傷治癒および多孔質メンブレンインサートアッセイを実施して、腫瘍細胞の遊走および浸潤能力を評価しました。
ウェスタンブロッティングを使用して、アポトーシス関連タンパク質レベルを定量しました。JC-1染色は、ミトコンドリア機能の変化を評価するために採用されました。さらに、シスプラチン(ジアミンジクロロプラチナ、DDP)介入を使用して、標的遺伝子の治療可能性を評価しました。フローサイトメトリーおよびコロニー形成アッセイを実施して、遺伝子の抗がん特性をさらに検証しました。その結果、 FAM83A ノックダウンは、子宮頸がん細胞の増殖、遊走、浸潤を阻害し、これらの細胞をシスプラチンに感作することが示されました。これらの包括的な方法論は、 FAM83A が腫瘍関連標的遺伝子であることを総合的に検証し、子宮頸がんの予防および治療における潜在的な治療標的として有望視されています。
概要
子宮頸がんは、婦人科悪性腫瘍の世界的な主要なタイプの1つであり、女性のがん関連死亡率の主な原因であるため、世界的な懸念事項です1。根治的手術と化学放射線療法は、一次段階での高い治癒率と関連しています。しかし、子宮頸がんの進行期に転移性疾患を発症した患者の治療成績は非常に好ましくない2。したがって、子宮頸がん細胞の遊走と浸潤の根底にある生物学的メカニズムをさらに理解し、この疾患の予防と治療のための潜在的な治療標的を特定することが重要です。
がんの進行に関与する標的遺伝子を同定し、その発現や作用を阻害する方法を見つけることは、有望な治療法の選択肢となります。本研究では、FAM83を発がん遺伝子として同定し、C33a細胞とHeLa細胞に対する阻害作用をさらに調べました。FAM83ファミリーがん遺伝子(FAM83A-H)は、ヒトのがんにおいて広く報告されている3,4。最近、FAM83Aは、肺5、乳がん6、卵巣7、および膵臓8の癌でアップレギュレーションされることが報告されており、FAM83Aが腫瘍細胞の増殖、浸潤、幹細胞様形質、および薬剤耐性を促進することにより、癌の進行に重要な役割を果たしていることが示されています。重要なことに、FAM83Aは、子宮頸部病変の進行と発がんに関連する新規候補遺伝子の1つとして同定された9。ヒト子宮頸がん細胞におけるFAM83A発現の上昇が確認されたにもかかわらず、子宮頸がんにおけるFAM83Aの特異的影響および根底にあるメカニズムは不明のままである。
この研究では、子宮頸がんの腫瘍標的遺伝子としてのFAM83Aの同定に関与するプロトコルを概説し、HeLaおよびC33a細胞のFAM83A遺伝子のノックダウンに低分子干渉RNA(siRNA)を使用します。5-エチニル-2'-デオキシウリジン(EdU)染色は、腫瘍細胞の増殖に対する効果を決定するために実施され、創傷治癒および多孔質膜挿入アッセイは、腫瘍細胞の遊走および浸潤能力の評価に役立ちました。
アポトーシス関連タンパク質のレベルを測定するためにウェスタンブロッティングを行い、ミトコンドリア機能の変化を評価するためにJC-1染色を採用しました。このように、 FAM83A は子宮頸癌の細胞増殖、転移、浸潤に重要な役割を果たしていることを報告しました。PI3K/AKT経路に関連するミトコンドリアの機能障害とアポトーシスを介して、 FAM83A ノックダウンは子宮頸がん細胞をシスプラチン(ジアミンジクロロプラチナ、DDP)に感作しました。この研究は、子宮頸がんおよびおそらく他のがんの新しい標的と、特定の化学療法薬に対するがん細胞の耐性を克服するための戦略開発の参考資料を提供します。
プロトコル
この研究は、TCGA(https://cancergenome.nih.gov/publications/publicationguidelines)が提供する出版ガイドラインに完全に準拠していました。このプロトコルで使用されるすべての材料、試薬、および機器に関連する詳細については、材料表 を参照してください。
1. データソースとバイオインフォマティクス分析
- Cancer Genome Atlas(TCGA)データベース(https://cancergenome.nih.gov)からRNAシーケンシングデータを取得し、クラスター解析を行います。TGAプロジェクトから採取したサンプルの生RNA-Seqデータを再計算するウェブベースのツールであるGEPIA(http://gepia.cancer-pku.cn/)を使用して、標準的な処理パイプラインでがん治療薬候補の標的をスクリーニングします。
注:GEPIAのWebサイトは、すべてのユーザーが無料で利用できます。 - GEPIAのホームページにアクセスし、 がんの種類の解析をクリックし、鑑 別遺伝子解析 オプションを選択して、 がん名= CESE (このウェブページでは 子宮頸部扁平上皮癌および子宮頸部腺癌 と定義)、 |Log2FC|カットオフ = 1、q値カットオフ = 0.01、微分法 = 分散分析 、染 色体分布 = 両方。次に、Listをクリックして、腫瘍群と正常群の発現の違いを示す遺伝子リストを取得します。
注:発現の異なる候補遺伝子を同定するには、広範な文献レビューが必要です。本研究では、入手可能な文献の背景を考慮し、目的の腫瘍遺伝子である FAM83Aに焦点を当てます。 - 次に、ウェブサイトの[発現DIY]オプションに進み、チャートタイプとして箱ひげ図を選択して、GEPIAを使用して子宮頸がんおよび正常組織におけるFAM83Aの発現を調べます。遺伝子パラメータフィールドにFAM83Aを入力し、以下のパラメータを設定します。 |Log2FC|カットオフ値 = 1;q値カットオフ = 0.01。がん名として CESE を選択し、Matched Normal データ フィールドに Match TCGA normal data を選択し、他のすべての設定はデフォルトのままにします。プロットをクリックし、ウェブサイトがFAM83A遺伝子の発現差を表す箱ひげ図を生成できるようにします。箱ひげ図を保存して、後で参照および分析できるようにします。
- 最後に、子宮頸がんにおけるFAM83A発現レベルが異なる腫瘍を有する患者の全生存期間を分析します。ウェブサイトのSurvival Plotsオプションに移動し、GeneをFAM83Aに設定し、解析タイプとしてOverall Survivalを選択します。腫瘍名「CESE」を追加し、[軸の単位] で [月] を選択し、その他のパラメーターはすべてデフォルト設定のままにします。[プロット] をクリックして、Web サイトに生存曲線グラフを生成させます。このチャートは、今後の参照と分析のために保存してください。
- 腫瘍における FAM83A の発現の違いと患者の生存率解析との相関の両方を考慮して、 FAM83A を子宮頸がんの潜在的な治療標的遺伝子として特定します。
2. 細胞実験
- 細胞培養
- ヒト腫瘍細胞株を改変培地中で、加湿した5%CO2 雰囲気下で37°Cで培養します。
注:細胞株の情報および培地の成分については、 材料表 を参照してください。
- ヒト腫瘍細胞株を改変培地中で、加湿した5%CO2 雰囲気下で37°Cで培養します。
- 細胞トランスフェクション
- siRNA を使用して、細胞内の FAM83A 発現をノックダウンします。
注:特定の siRNA 配列については、 表 1 を参照してください。 - 細胞を6ウェルプレートに播種し、50%〜70%のコンフルエントを達成した後、50 nM si-FAM83A またはsiRNA-NCと8 μLのトランスフェクション剤またはわずか8 μLのトランスフェクション剤の混合物で4〜6時間インキュベートします。無血清DMEMのみをネガティブコントロールに添加します。
- インキュベーション後、トランスフェクション剤を含む培地をDMEM + 10%ウシ胎児血清と交換します。さらに、トランスフェクションの48時間後に、5 μMシスプラチン(DDP)で24時間処理し、すべての細胞を回収して、トータルRNA抽出およびqRT-PCR解析を行います。
- siRNA を使用して、細胞内の FAM83A 発現をノックダウンします。
3. 細胞増殖アッセイのためのEdU検出
注:EdU Cell Proliferation Kitを使用して、製造元の指示に従って in vitro で細胞増殖を評価します。
- 細胞を6ウェルプレートに播種し、10 μMのEdU溶液で2時間インキュベートします。細胞を4%パラホルムアルデヒドで室温(RT)で15分間固定し、0.3% Triton X-100 in PBSで室温(RT)で10分間透過処理します。
- 透過処理バッファーを除去し、500 μL の 1x 反応溶液を添加します。その後、暗所の室温で30分間インキュベートし、核染色を行います。
- 細胞を4',6-ジアミジノ-2-フェニルインドール(DAPI)で染色し、蛍光顕微鏡で倍率200倍で可視化します。増殖細胞の核をEdUで染色し、赤色蛍光を調べます。
- 最後に、ソフトウェアを使用して、少なくとも10個のランダムフィールドをカウントして結果を定量化し、全細胞に対する蛍光陽性細胞の比率を使用して増殖率を計算します。
4. 創傷治癒アッセイ
- 6ウェルプレートに細胞を2×10ウェルあたり5 細胞の密度で播種します。
- 細胞のコンフルエント度が90%に達したら、滅菌済みの10 μLマイクロピペットチップを使用して、細胞単層に線状の傷を穏やかに作ります。ウェルを滅菌PBSで静かにすすぎ、引っ掻き傷によって剥がれた細胞や破片を取り除きます。
- さらに、1%FBSを含む培地中で細胞をインキュベートします。次に、倒立顕微鏡で観察し、12時間、24時間、48時間で傷ついた部分の治癒を画像化します。
5. 多孔質メンブレンインサートアッセイ
- トランスフェクションまたはコントロールC33a細胞およびHeLaを含む、所望の細胞濃度(4〜104細胞を含む)×細胞培養培地中の細胞懸濁液を調製する。細胞懸濁液をメンブレンインサートの上部チャンバーに添加し、均一に分散させます。下部チャンバーに完全な培地を追加します。
- 24時間インキュベートした後、メチルアルコールと0.1%クリスタルバイオレットを使用して、それぞれ下部チャンバーに移動する細胞の固定と染色を行います。
- 倒立顕微鏡で画像を撮影し、ImageJで少なくとも10個のランダムフィールドをカウントして、移動する細胞の数を解析します。
- ImageJ による数値分析では、ImageJ ソフトウェアで画像を開き、ツール メニューの [ 画像 ] タブに移動し、[ 調整] を選択してから [しきい値] をクリックします。必要に応じて、白い背景にセルのみが表示されるまで、しきい値の設定を調整します。
- [しきい値] ウィンドウで [適用] をクリックして、これらの設定を画像に適用します。次に、ツールバー(ウィンドウの上部にあります)からワンド(トレース)ツールを選択します。
- セルが配置されている画像の領域をクリックして、しきい値が設定された画像内のすべてのセルを選択します。セルが強調表示されたら、[ツール]メニューの[分析]に移動し、[パーティクルの分析]をクリックします。[パーティクルの解析]ウィンドウで、実験の要件に従って、必要なサイズ(0 - 無限大など)と真円度の値(0.00 - 1.00 など)を入力し、すべてのセルをカウントに含めます。
- [OK]をクリックし、ソフトウェアがセルをカウントし、新しいウィンドウに分析結果が表示されるのを待ちます。
6. コロニー形成アッセイ
- 5 μM シスプラチン(DDP)処理の有無にかかわらず、6 ウェルプレートに Si-NC および Si-FAM83A グループの 2 ×10 5 細胞を 24 時間播種します。
- 24時間の薬物処理の後、0.25%トリプシンを使用して細胞を剥離し、10%FBSを含むダルベッコ改変イーグル培地(DMEM)に再懸濁します。再懸濁した細胞を6ウェルプレートに1ウェルあたり1〜10×3 細胞の密度で播種し、5%CO2 インキュベーターで37°Cの温度でインキュベートします。
- コロニーが見える7~10日間のインキュベーション後、細胞を4%ポリオキシメチレンで固定し、Giemsa染色液で20分間染色します。
- 細胞を少し洗浄し、プレートを自然乾燥させます。顕微鏡でコロニークラスターの画像を撮影し、50個以上の細胞を含むコロニーの数を数えます。
7. JC-1色素を用いたミトコンドリア膜脱分極(MMP)解析
- Si-NCおよびSi-FAM83Aグループ由来の1.2×10個の6個の腫瘍細胞を6ウェルプレートに播種し、5 μMシスプラチン(DDP)処理の有無にかかわらず24時間培養します。
- メーカーの指示に従い、ミトコンドリア膜電位アッセイキットを使用して、37°Cで5%CO2 下で15〜20分間、1x JC-1染色溶液とインキュベートします。
- 細胞を洗浄し、JC-1の励起波長と発光波長をそれぞれ~490 nmと590 nmで使用し、200倍の倍率の蛍光顕微鏡で調べます。JC-1の蛍光を可視化するには、青色励起フィルター(450-490 nm)や赤色発光フィルター(590 nm>ロングパス)などの適切なフィルターを使用して、放出された蛍光シグナルを選択的に捕捉します。
8. mPTPのフローサイトメトリー解析
- Si-NCおよびSi-FAM83Aグループ由来の1.2×10個の6個の腫瘍細胞を6ウェルプレートに播種し、5 μMシスプラチン(DDP)処理の有無にかかわらず24時間培養します。
- 細胞から培地を取り出し、細胞をPBSに再懸濁し、細胞を均一に覆うために、それぞれ300 μL(容量1倍)のカルセインAM染色溶液と蛍光消光作動溶液を加えます。細胞を37°Cの光保護環境で30〜45分間インキュベートし、培地を37°Cで予熱した新しい培地と交換します。 細胞を37°Cの光保護環境でさらに30分間インキュベートし、細胞内エステラーゼによるカルセインAMの完全な加水分解を確実にし、細胞内の緑色蛍光カルセインを生成します。
- 培地を除去し、細胞をPBSで2〜3回洗浄し、検出バッファーを添加します。フローサイトメトリーと488 nmの励起波長を使用して細胞mPTPを検出します。
9. フローサイトメトリー
- Si-NCおよびSi-FAM83Aグループ由来の1.2×10個の6個の腫瘍細胞を6ウェルプレートに播種し、5 μMシスプラチン(DDP)処理の有無にかかわらず24時間培養します。
- 24時間の薬物処理後、細胞を200 μLの結合緩衝液に再懸濁し、10 μLのアネキシンV-FITCと5 μLのヨウ化プロピジウム(PI)を細胞懸濁液に穏やかに混合します。光を避けながら混合物を15分間インキュベートし、300 μLの結合緩衝液を細胞に加えます。励起波長488 nmのフローサイトメトリーを用いて細胞のアポトーシスを検出します。
10. RT-PCR解析
- Si-NCおよびSi-FAM83Aグループ由来の1.2×10個の6個の腫瘍細胞を6ウェルプレートに播種し、5 μMシスプラチン(DDP)処理の有無にかかわらず24時間培養します。
- RNA抽出試薬を使用して腫瘍細胞からトータルRNAを抽出し、抽出したRNAをcDNA合成ミックスで42°Cで45分間、次に95°Cで5分間インキュベートすることにより、相補的DNA(cDNA)に変換します。
- DNAポリメラーゼ、ヌクレオチド、バッファー、および設計した遺伝子特異的プライマーを含むPCR反応混合物を調製します。リアルタイムPCR反応用の反応混合物にcDNAテンプレートを添加し、95°Cで30秒間変性し、続いて95°Cで5秒間、60°Cで30秒間変性し、95°Cで15秒間の融解曲線段階の40サイクル、 60°Cで1分間、95°Cで15秒間。GAPDHを内部コントロールとして用いた2−ΔΔCq法を用いてmRNAレベルを定量する。
注:RT-PCR反応系を 表1に、プライマー配列を 表1に示します。- 2−ΔΔCq 値を計算するには、サンプル中の標的遺伝子と参照遺伝子(GAPDH)のCq値を測定します。各サンプルの標的遺伝子のCq値から参照遺伝子のCq値を差し引いてΔCqを計算します。各実験サンプルのΔCqからコントロールサンプルのΔCqを差し引いてΔΔCqを計算します。最後に、2をΔΔCq値の累乗して2−ΔΔCq 値を計算します。
注:Cq値は、蛍光シグナルが設定された閾値に達するサイクル数を表します。
- 2−ΔΔCq 値を計算するには、サンプル中の標的遺伝子と参照遺伝子(GAPDH)のCq値を測定します。各サンプルの標的遺伝子のCq値から参照遺伝子のCq値を差し引いてΔCqを計算します。各実験サンプルのΔCqからコントロールサンプルのΔCqを差し引いてΔΔCqを計算します。最後に、2をΔΔCq値の累乗して2−ΔΔCq 値を計算します。
11. ウェスタンブロット解析
- Si-NCおよびSi-FAM83Aグループ由来の1.2×10個の6個の腫瘍細胞を6ウェルプレートに播種し、5 μMシスプラチン(DDP)処理の有無にかかわらず24時間培養します。
- 培養した細胞を回収し、氷冷したリン酸緩衝生理食塩水(PBS)で洗浄して、残留増殖培地または血清を除去します。フッ化フェニルメチルスルホニル(PMSF)を含むRIPA Lysis Bufferを使用して細胞を溶解し、細胞タンパク質を遊離させます。細胞を氷上で数分間インキュベートして完全に溶解し、4°C、12,000 × g で15分間遠心分離します。上清を回収して、そのタンパク質濃度を決定します。
- 製造元の指示に従って、BCA Protein Assay Kitを使用して細胞ライセート中のタンパク質濃度を測定します。細胞溶解液をローディングバッファーと混合し、混合物を95〜100°Cで5〜10分間加熱してタンパク質を変性させ、ゲル上で均一に分離します。
- 各サンプルから、30 μgの総タンパク質をSDS-PAGEゲルにロードし、SDS-PAGEを80 Vの定電圧で泳動します。 ブロモフェノールブルーが分離ゲルの底に達したら電気泳動を停止します。
- 分離したタンパク質をゲルからポリフッ化ビニルメンブレンに、200 mAの電流で1.5時間流したアイスバス上の湿式転写システムを用いて転写します。
- 0.05% Tween-20バッファー(TBST)を含むトリス緩衝生理食塩水中の5%脱脂乳でメンブレンを室温で1時間ブロックし、 材料表に記載されているそれぞれの抗体を使用して4°Cで一晩インキュベートします。
- メンブレンをTBSTで複数回洗浄し、二次抗体(材料表)と室温で1時間インキュベートした後、TBSTで洗浄します。強化された化学発光検出キットとイメージャーシステムを使用してタンパク質バンドを可視化します。
12. 統計解析
- すべての実験データポイントは独立しているため、データを平均±SDとして提示します。 統計分析を実行します。
- 多重比較には一元配置分散分析(ANOVA)を使用し、各グループと対照群の比較にはDunnettの検定を使用します。スチューデントの t検定(対応のない両側)を使用して2つのグループを比較します。P < 0.05 が有意であると考えてください。
結果
TCGAデータベース解析とPCRバリデーション
TCGAデータベース解析から、子宮頸がん細胞306検体と正常細胞13検体におけるmRNA発現量の比較解析を行い、FAM83Aの発現差を調べた。FAM83Aは子宮頸がんにおいて発現亢進したが、正常な子宮頸部組織におけるその発現はごくわずかであった(図1A)。FAM83A発現の予後への影響についてさらに洞察を得るために、Kaplan-Meier曲線分析を実施しました。驚くべきことに、FAM83Aの発現が高い患者は、全生存期間が著しく不良でした(図1B)。子宮頸がんにおけるFAM83Aの役割を決定するために、2つの子宮頸がん細胞株(HeLaおよびC33a)および不死化子宮頸細胞株(End1/E6E7)におけるFAM83A発現レベルを調べました。qRT-PCRを用いて、HeLaおよびC33a細胞株では、End1/E6E7細胞株と比較してFAM83Aの有意な過剰発現が観察されました(図1C)。これらの知見は、子宮頸がんにおけるFAM83Aの重要性を強調している。
子宮頸癌におけるFAM83Aの生物学的機能を検証するための増殖およびアポトーシス実験
子宮頸がんにおけるFAM83Aの機能的役割を調べるために、C33aおよびHeLa細胞におけるFAM83AのsiRNAを介したノックダウンを利用しました(図2A、B)。次に、FAM83Aの抑制が細胞増殖に及ぼす影響を評価しました。EdU染色により、FAM83Aの発現低下により、C33a細胞とHeLa細胞の両方で細胞増殖が有意に阻害されることが明らかになりました(図2C-F)。不死性の悪性細胞は、極めて低いアポトーシス率と関連している10。したがって、抗アポトーシスタンパク質およびプロアポトーシスタンパク質のレベルは、対照およびsi-FAM83Aで処理された子宮頸癌細胞で評価されました。ウェスタンブロット解析により、FAM83Aの発現を抑制すると、Baxおよび切断されたカスパーゼ3タンパク質(アポトーシス促進タンパク質)の発現が増加し、Bcl-2(抗アポトーシスタンパク質)の発現が減少し、Cytcの放出が増加し(図2C-E)が明らかになり、これは、抗アポトーシスタンパク質がCytcのミトコンドリア放出を阻害することによってアポトーシスを調節するという観察結果と一致しています(図2G-J)10.これらのデータを総合すると、FAM83Aは子宮頸がん細胞の増殖とアポトーシスの調節に重要な役割を果たしていることが示唆されました。
子宮頸癌におけるFAM83Aの生物学的機能を検証するための創傷治癒および多孔質膜インサートアッセイ
子宮頸がん細胞の遊走および浸潤に対するFAM83A抑制の効果を調査するために、創傷治癒および膜挿入アッセイを実施しました。その結果、FAM83Aの発現が抑制された子宮頸がん細胞は、対照細胞よりも遊走(図3A-D)と浸潤(図3E-H)の効率が低いことが明らかになりました。
ミトコンドリア機能とPI3K/AKTシグナル伝達経路への影響
細胞アポトーシスの誘導におけるPI3K/AKTの役割を考慮し、FAM83A発現の抑制が子宮頸癌におけるPI3K/Akt/mTOR経路の構成的リン酸化を阻害するかどうかを決定することを目指しました。FAM83Aの抑制は、c333aおよびHeLa細胞におけるp-PI3K、p-Akt、およびp-mTORを含むPI3K/Akt/mTOR経路の主要なリン酸化タンパク質レベルを有意に阻害しました(図4A-D)。ミトコンドリアは、細胞代謝と細胞アポトーシス誘導に関与する細胞小器官です。がん細胞のアポトーシスは、ミトコンドリア透過性の亢進とCytcなどのアポトーシス促進分子の細胞質への放出により、内因性ミトコンドリア経路を介したミトコンドリア機能不全を伴うことを示す証拠が蓄積されています10。PI3K/AKT経路は、Baxのミトコンドリアへの移行を調節し、アポトーシス刺激に応答してCytcの放出を誘導する可能性があります。したがって、PI3K-AKTシグナル伝達経路の発がん成分は、ミトコンドリアの挙動に影響を与えることにより、細胞のアポトーシスを直接制御していると考えられます。したがって、生細胞ミトコンドリア透過性遷移細孔(mPTP)アッセイを実施して、ミトコンドリアの状態を決定しました。mPTPの開口は、アポトーシスおよび壊死細胞死と関連している11。このアッセイでは、mPTPを閉じると緑色蛍光色素(カルセインAM)が細胞質とミトコンドリアに保持され、細胞質内の色素はCoCl2によって消光され、ミトコンドリアに強い蛍光のみが残ります。その結果、ミトコンドリアで強い緑色蛍光を発する細胞集団は、FAM83A抑制後に有意に減少し、mPTPが開いていることが明らかになりました(図4E、F)。さらに、ミトコンドリア膜電位(ΔΨm)の変化をJC-1染色法を用いて調べました。JC-1は、アポトーシス細胞の低MMP下で、膜電位の高い無傷のミトコンドリアとモノマー(緑色蛍光)を含む生細胞で凝集体(赤色蛍光)を形成します。FAM83Aの抑制により、MMPは徐々に低下した(図4G)。
増殖・浸潤に対する薬剤感受性解析
シスプラチン(DDP)ベースの化学療法は、子宮頸がんの標準治療戦略です。しかし、化学療法抵抗性は依然として課題です。シスプラチンを用いた子宮頸癌治療における FAM83A の役割を調査した。コントロール細胞、si-NC処理、およびsi-FAM83A処理HeLa細胞を、5 μMシスプラチン12で処理した。さらに、 FAM83A 抑制が細胞生存率に及ぼす影響を評価した。DDPは、DDP処理のみと比較して、 FAM83A 抑制後のHeLa細胞の増殖に対してより有意な阻害効果を誘導しました(図5A および 図5C)。子宮頸がん細胞を5 μMシスプラチンで処理した後、 FAM83A 抑制は細胞浸潤も阻害しました(図5B および 図5D)。
ミトコンドリア機能の薬剤感受性解析
Si-NC処理およびsi-FAM83A処理HeLa細胞を5μMシスプラチン(DDP)で処理することにより、ミトコンドリア膜電位(MMP)を評価し、JC-1染色を用いて細胞死によるミトコンドリア損傷を評価しました。DDPは、DDP処理のみと比較して、 FAM83A ノックダウン後のJC-1モノマーの割合の減少によって明らかになったように、より多くのミトコンドリア損傷を誘発しました(図6A および 図6D)。子宮頸がん細胞を5 μMシスプラチンで処理した後、 FAM83A ノックダウンはコロニー形成を阻害し(図6B および 図6E)、細胞アポトーシスを増強しました(図6C および 図6F)。さらに、DDP存在下で のFAM83A ノックダウンは、アポトーシス促進タンパク質、Baxおよび切断されたカスパーゼ3の発現を著しく増加させ、Cytcの放出を促進し、Bcl-2の発現を減少させました(図6G、H)。これらの結果は、 FAM83A ノックダウンがアポトーシス誘導を介して子宮頸癌細胞をDDPに感作することを示しました。
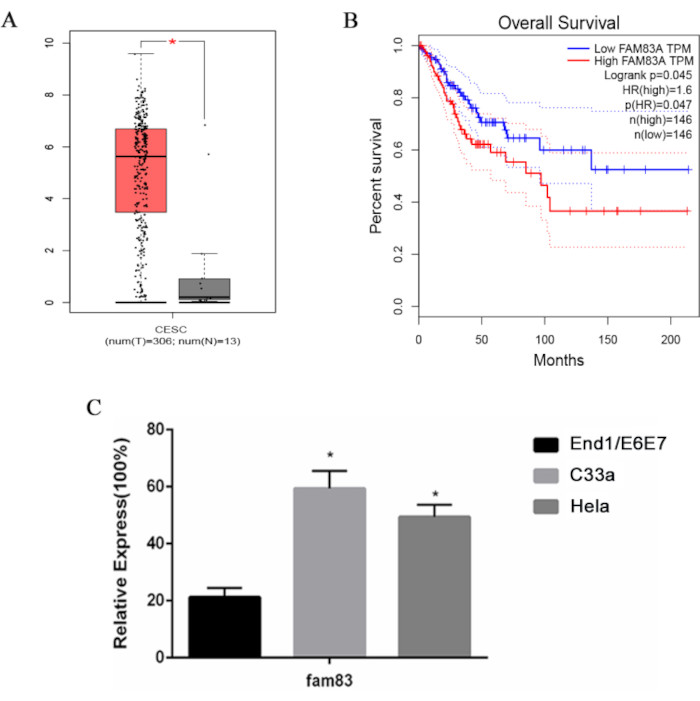
図1:子宮頸がん細胞におけるFAM83Aの過剰発現と予後不良との相関。 (A)子宮頸がん検体中のFAM83AのmRNAレベルの箱ひげ図分析。(B)子宮頸癌患者の全生存期間を決定するためのFAM83A発現のKaplan-Meier分析。(C)子宮頸がん細胞株HeLaおよびC33aおよびヒト不死化子宮頸細胞株End1/E6E7におけるFAM83Aの相対mRNAレベル。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05、一元配置分散分析を使用した End1/E6E7 細胞との比較。略語:CESE =子宮頸部扁平上皮癌および子宮頸部腺癌;HR = ハザード比。この図の拡大版をご覧になるには、ここをクリックしてください。
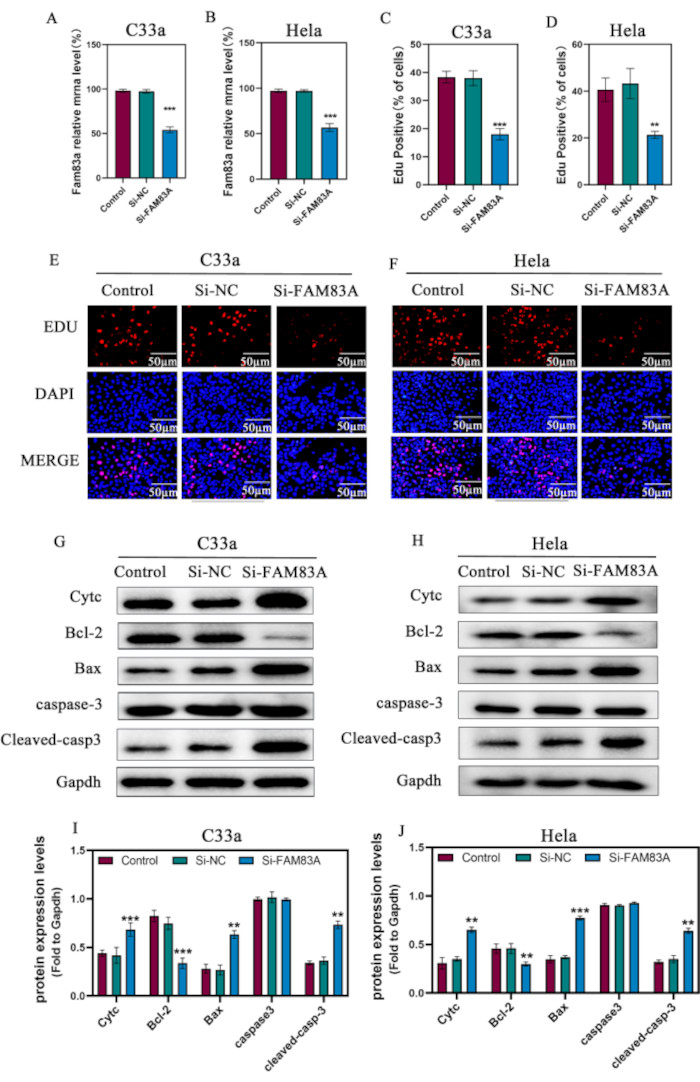
図2:子宮頸がんの増殖とアポトーシスに対するFAM83Aの抑制の効果。C33aおよびHeLa細胞にFAM83A特異的siRNAをトランスフェクションしました。(A、B)FAM83AのmRNAレベルは、qRT-PCRを使用して子宮頸癌細胞株で評価されました.(C)C33aおよび(D)HeLa細胞の細胞増殖は、EdUアッセイを使用して決定されました。(E、F)C33a細胞とHela細胞のEDU蛍光画像。(G-J)Cytc、Bcl-2、Bax、カスパーゼ3、切断カスパーゼ-3などのアポトーシス関連タンパク質のレベルを調べるためのウェスタンブロット解析。GAPDHは負荷制御として使用されました。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05;**P < 0.01;**P < 0.001、一元配置分散分析を使用した対照細胞との比較。略語:NC =ネガティブコントロール。EdU = 5-エチニル-2'-デオキシウリジン;CytC = シトクロムC. この図の拡大版をご覧になるには、ここをクリックしてください。

図3:in vitroでの子宮頸がん細胞の遊走および浸潤に対するFAM83Aの効果。 (A-D)創傷治癒アッセイを実施して、細胞遊走を評価しました。画像は0時間、24時間、48時間で撮影しました。 (E-H)トランズウェルアッセイを実施して、細胞の浸潤を調べました。スケールバー = 100 μm (E,F)。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05;**P < 0.01;**P < 0.001、一元配置分散分析を使用した対照細胞との比較。この図の拡大版をご覧になるには、ここをクリックしてください。
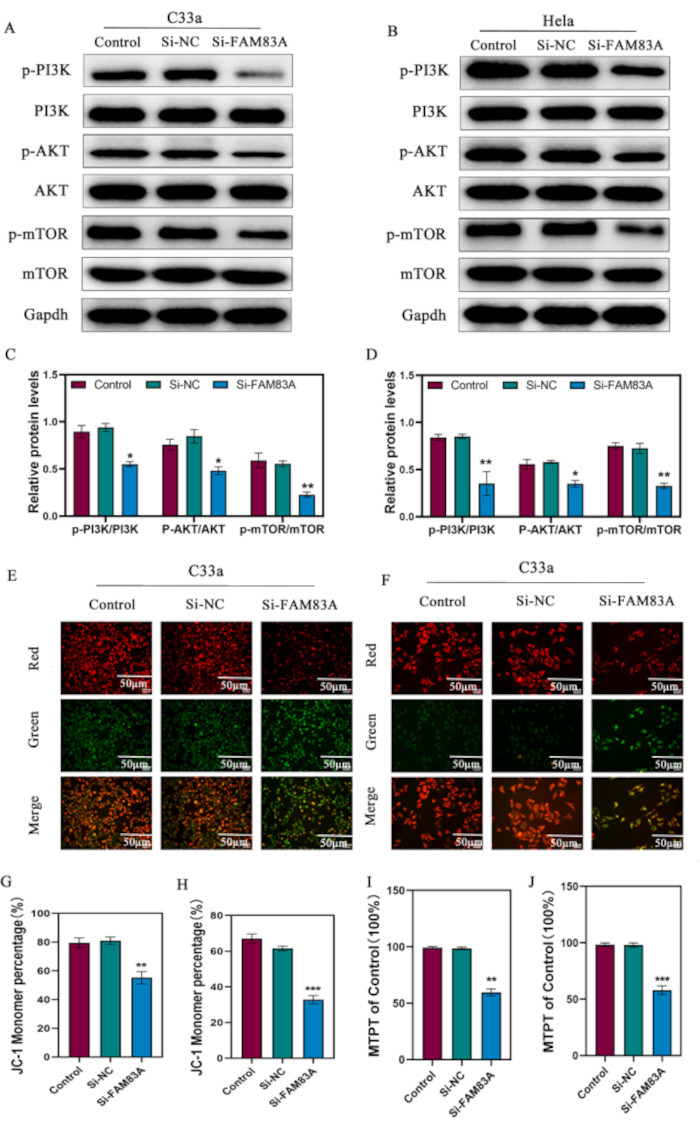
図4: PI3K/AKT/mTOR経路とミトコンドリア機能に対するFAM83A抑制の影響。(A-D)FAM83A抑制後のC33aおよびHeLa細胞におけるPI3K/AKT/mTOR経路由来のタンパク質レベルを決定するためのウェスタンブロット解析。(E-H)JC-1染色を用いたミトコンドリア膜電位解析JC-1凝集体は赤色に染色され、JC-1モノマーは緑色に染色され、MMPが低いことが示されました。(I,J)ミトコンドリア透過性は、mPTPキットとフローサイトメトリーを用いて評価しました。スケールバー = 50 μm (E, F)。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05;**P < 0.01;P < 0.001 で、一元配置分散分析を使用した対照細胞と比較した。略語:MMP =ミトコンドリア膜電位;mPTP = ミトコンドリア透過性遷移細孔。この図の拡大版をご覧になるには、ここをクリックしてください。

図5:子宮頸がん細胞の細胞増殖および浸潤に対するDDPによる阻害に対するFAM83A抑制の効果。HeLa細胞をsi-NCまたはsi-FAM83Aでトランスフェクションし、5 μM DDPで処理した。(A、C)コントロール細胞、si-NC処理、およびsi-FAM83処理HeLa細胞の細胞増殖に対するDDPの効果。(B,D)コントロール細胞、si-NC処理、およびsi-FAM83処理HeLa細胞の細胞浸潤に対するDDPの効果。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05;**P < 0.01;対照細胞と比較したP<0.001。&&P < 0.01;&&&P < 0.001、一元配置分散分析を使用したDDPとの比較。略語:DDP =ジアミンジクロロプラチナ;EdU = 5-エチニル-2'-デオキシウリジン;DAPI = 4',6-ジアミジノ-2-フェニルインドール。この図の拡大版をご覧になるには、ここをクリックしてください。
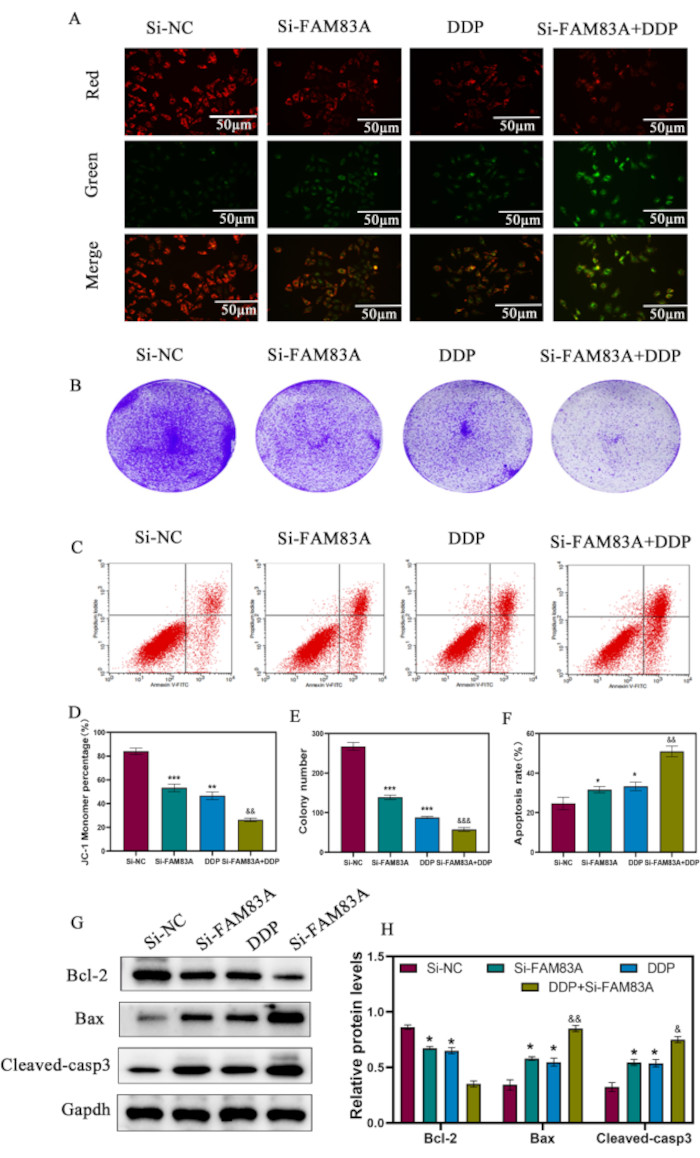
図6:子宮頸がん細胞のアポトーシスに対するDDPの効果に対するFAM83A抑制の効果。 HeLa細胞をsi-NCまたはsi-FAM83Aでトランスフェクションし、5 μM DDPで処理した。(A,D)JC-1染色を用いたMMP解析(B、E)プレートクローニングの結果。(C、F)異なる治療群のアポトーシス率を検出するフローサイトメトリー。(G,H)ミトコンドリア関連アポトーシスタンパク質(Bcl-2、Bax、Cytc、および下流の切断カスパーゼ-3を含む)のウェスタンブロット解析。GAPDHは負荷制御として使用されました。データは、3つの独立した実験の平均±SDとして表されます。*P < 0.05;**P < 0.01;対照細胞と比較したP<0.001。&P < 0.05;&&P < 0.01;&&&P < 0.001、一元配置分散分析を使用したDDPとの比較。略語:DDP =ジアミンジクロロプラチナ;EdU = 5-エチニル-2'-デオキシウリジン;DAPI = 4',6-ジアミジノ-2-フェニルインドール。この図の拡大版をご覧になるには、ここをクリックしてください。
表1:siRNA、qRTPCRプライマー、および本研究で使用したqRT-PCR反応セットアップ。 この表をダウンロードするには、ここをクリックしてください。
ディスカッション
子宮頸がんの予防と治療の両面において、腫瘍標的遺伝子の解明は極めて重要です。子宮頸がんの発生と進行に重要な役割を果たす特定の遺伝子を理解することは、子宮頸がんの根底にある分子メカニズムに関する貴重な洞察を提供します。さらに、これらの標的遺伝子を同定することで、新たな治療戦略や標的療法の開発につながる可能性があります。本研究では、TCGAデータセット解析を用いて FAM83A を標的遺伝子として同定し、子宮頸がんにおけるその機構的役割を探る方法について述べる。子宮頸がん細胞では FAM83A の発現が有意に高く、これは子宮頸がん患者の予後不良と関連しています。一連の細胞ベースの実験により、子宮頸がん細胞における FAM83A の高発現が明らかになり、細胞の増殖、遊走、浸潤の調節に重要な役割を果たしています。 FAM83A の発現を抑制すると、子宮頸がん細胞の増殖と遊走が阻害され、アポトーシスが促進されました。
FAM83Aノックダウン子宮頸がん細胞株の構築は、この研究の最も重要なステップです。siRNAは、その有効性を確保するために、標的遺伝子配列に従って設計および検証されます。さらに、子宮頸がん細胞株はsiRNAを用いてトランスフェクションされる。プラスミドトランスフェクションの成功率は、細胞密度とプラスミド密度の厳密な制御を必要とするその後の実験にとって非常に重要です。さらに、トランスフェクション効率を蛍光顕微鏡で観察し、その後の実験を確実に実施できるようにします。ウェスタンブロッティングとqRT-PCRの結果から、FAM83Aの阻害がPI3K/AKT経路を抑制し、ミトコンドリア機能障害を誘発することが確認されました。我々は、そのメカニズムが、細胞質からミトコンドリアへのBaxの転座をPI3K/AKTによって阻害し、細胞の生存を促進するという仮説を立てている13。
子宮頸がん治療の進歩により、新たな標的分子の開発が可能になりました。新規がん遺伝子の同定は、子宮頸部悪性腫瘍の臨床予後を改善するために治療的に適用することができる14,15。本研究では、HeLa細胞とC33a細胞にFAM83Aノックダウンシステムを構築することに成功し、FAM83Aノックダウンが子宮頸がん細胞に及ぼす影響を細胞レベルで検証しました。FAM83Aの阻害は子宮頸癌の治療に使用できることを提案します。
ただし、この研究にはいくつかの制限があります。まず、本研究はデータベースによる遺伝子スクリーニングのみを行っており、臨床患者の病理学的データが不足している。第二に、この研究は in vitroでの効果を検証したにすぎず、結果を検証するにはさらなる in vivo 研究が必要でした。しかし、本研究で詳述した標的遺伝子の同定、遺伝子ノックアウト、および標的治療遺伝子座を同定するための細胞検証の方法は、他の疾患の標的遺伝子の発見と検証のための研究アイデアを提供することができます。
要約すると、 FAM83A は過剰発現しており、子宮頸がんの予後不良と相関していた。 FAM83A は、子宮頸がん細胞の増殖、遊走、浸潤を調節します。 FAM83A誘導性ミトコンドリア機能障害およびアポトーシスの抑制、シスプラチンへの子宮頸癌細胞の感作。これらの結果から、 FAM83A は子宮頸がんの治療に適した研究標的であることが示されました。この研究は、子宮頸がん患者の予後を改善することを目的とした補助化学療法の進歩に貢献しました。
開示事項
著者らは、この研究に利益相反はないと報告している。
謝辞
この研究は、荊州科学技術局基金会(no.2020HC06)の支援を受けました。
資料
| Name | Company | Catalog Number | Comments |
| Cells and Medium Formulation | |||
| C33a | American Type Culture Collection | ||
| Hela | American Type Culture Collection | ||
| Modified medium | 10% fetal bovine serum and + antibiotics (100 U/mL penicillin and 100 U/mL streptomycin) | ||
| Antibody Information | |||
| AKT | 4691, Cell Signaling Technology Inc. | ‘1:1,000 | |
| Bcl2 | 26593-1-AP, Proteintech Group, Inc | ‘1:1,000 | |
| Caspase 3 | 19677-1-AP, Proteintech Group, Inc | ‘1:2,000 | |
| cleaved-caspase3 | abs132005; Absin Bioscience Inc. | ‘1:1,000 | |
| Cytc | 10993-1-AP; Proteintech Group | ‘1:1,000 | |
| GAPDH | 10494-1-AP, Proteintech Group, Inc. | ‘1:8,000 | |
| mTOR | 2983, Cell Signaling Technology Inc. | ‘1:1,000 | |
| PI3K | 4292, Cell Signaling Technology Inc | ‘1:1,000 | |
| p-AKT | 4060, Cell Signaling Technology Inc. | ‘1:1,000 | |
| p-mTOR (Ser2448) | #5536, Cell Signaling Technology Inc. | ‘1:1,000 | |
| p-PI3K p85 subunit | 17366, Cell Signaling Technology Inc. | ‘1:1,000 | |
| Secondary antibodies | GB23303, Servicebio | ‘1:2,000 | |
| Materials | |||
| 6-well plate | Corning, NPY | ||
| Alexa Fluor 555 | Beyotime | ||
| BCA Protein assay kit | Beyotime, China | P0011 | |
| ChemiDoc XRS Imager System | BioRad | ||
| Enhanced chemiluminescence detection kit | Servicebio, Inc.,China | cat. no. G2014 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, Japan | ||
| Hifair II 1st Strand cDNA Synthesis Super Mix | 11123ES60, Yeasen Biotech o., Ltd., China | ||
| Inverted microscope | Olympus, Tokyo, Japan; | ||
| Millicell transwell inserts | Millipore,Bedford, MA, USA | ||
| Mitochondrial membrane potential assay kit | Beyotime, China | ||
| PMSF | ST506, Beyotime Biotech, Jiangsu, China | #ST506 | |
| Real-time quantitative PCR instrument | Applied Biosystems, Thermo Fisher Scientific. China. | ||
| RIPA Lysis Buffer | Beyotime Biotech, Jiangsu, China | ||
| TRIzol reagent | Invitrogen | 15596026 | |
| TRIzol reagent | Takara Bio Inc., Otsu, Japan | ||
| Software | |||
| Image-Pro | plus 6.0 |
参考文献
- Arbyn, M., et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Global Health. 8 (2), e191-e203 (2020).
- Cohen, P. A., Jhingran, A., Oaknin, A., Denny, L. Cervical cancer. Lancet. 393 (10167), 169-182 (2019).
- Cipriano, R., et al. Conserved oncogenic behavior of the fam83 family regulates mapk signaling in human cancer. Molecular Cancer Research. 12 (8), 1156-1165 (2014).
- Snijders, A. M., et al. FAM83 family oncogenes are broadly involved in human cancers: an integrative multi-omics approach. Molecular Oncology. 11 (2), 167-179 (2017).
- Gan, J., Meng, Q., Li, Y. Corrigendum: systematic analysis of expression profiles and prognostic significance for fam83 family in non-small-cell lung cancer. Frontiers In Molecular Biosciences. 8, 653454 (2021).
- Jin, Y., et al. Comprehensive analysis of the expression, prognostic significance, and function of fam83 family members in breast cancer. World Journal of Surgical Oncology. 20 (1), 172 (2022).
- Lin, S., et al. Identification of prognostic biomarkers among fam83 family genes in human ovarian cancer through bioinformatic analysis and experimental verification. Cancer Management and Research. 13, 8611-8627 (2021).
- Ma, Z., et al. Identification of prognostic and therapeutic biomarkers among fam83 family members for pancreatic ductal adenocarcinoma. Disease Markers. 2021, 6682697 (2021).
- Xu, J., et al. Genome-wide profiling of cervical RNA-binding proteins identifies human papillomavirus regulation of rnaseh2a expression by viral e7 and e2f1. mBio. 10 (1), e02687-e02618 (2019).
- Wong, R. S. Apoptosis in cancer: from pathogenesis to treatment. Journal Of Experimental & Clinical Cancer Research. 30 (1), 87 (2011).
- Bonora, M., Pinton, P. The mitochondrial permeability transition pore and cancer: molecular mechanisms involved in cell death. Frontiers In Oncology. 4, 302 (2014).
- Wang, N., Hou, M. S., Zhan, Y., Shen, X. B., Xue, H. Y. MALAT1 promotes cisplatin resistance in cervical cancer by activating the pi3k/akt pathway. European Review for Medical and Pharmacological Sciences. 22 (22), 7653-7659 (2018).
- Tsuruta, F., Masuyama, N., Gotoh, Y. The phosphatidylinositol 3-kinase (pi3k)-akt pathway suppresses bax translocation to mitochondria. Journal Of Biological Chemistry. 277 (16), 14040-14047 (2002).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta - Bioenergetics. 1858 (8), 686-699 (2017).
- Pustylnikov, S., Costabile, F., Beghi, S., Facciabene, A. Targeting mitochondria in cancer: current concepts and immunotherapy approaches. Translational Research. 202, 35-51 (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved