Method Article
Eliminación de FAM83A para verificar su papel en el crecimiento de células de cáncer de cuello uterino y la sensibilidad al cisplatino
En este artículo
Resumen
Aquí, mostramos los procedimientos para el derribo de FAM83A ; los ensayos para detectar sus efectos sobre la proliferación, migración e invasión de las células de cáncer de cuello uterino; y la sensibilización de estas células al cisplatino. Este estudio proporciona un gen diana prometedor para el cáncer de cuello uterino y una referencia para futuras investigaciones farmacológicas.
Resumen
La exploración de los genes diana tumorales es de suma importancia para la prevención y el tratamiento del cáncer de cuello uterino. En este estudio, describimos los pasos involucrados en la identificación de un gen diana tumoral FAM83A en el cáncer de cuello uterino. En primer lugar, se empleó el conjunto de datos del Atlas del Genoma del Cáncer para validar la expresión y la importancia pronóstica de FAM83A en mujeres. Se utilizó un pequeño ARN interferente (siRNA) para la eliminación del gen FAM83A en las células HeLa y C33a . A continuación, se realizó la tinción con 5-etinil-2'-desoxiuridina (EdU) para determinar los efectos sobre la capacidad de proliferación de las células tumorales. Se realizaron ensayos de cicatrización de heridas e inserción de membranas porosas para evaluar la migración de las células tumorales y las capacidades de invasión.
Se utilizó Western blot para cuantificar los niveles de proteínas relacionados con la apoptosis. La tinción con JC-1 se empleó para evaluar las alteraciones de la función mitocondrial. Además, se utilizó la intervención con cisplatino (diaminidicloroplatino, DDP) para evaluar el potencial terapéutico del gen diana. Se realizaron citometrías de flujo y ensayos de formación de colonias para validar aún más las características anticancerosas del gen. Como resultado, se demostró que el knockdown de FAM83A inhibe la proliferación, migración e invasión de las células de cáncer de cuello uterino y sensibiliza a estas células al cisplatino. Estas metodologías integrales validan colectivamente FAM83A como un gen diana asociado a tumores, que es prometedor como una posible diana terapéutica en la prevención y el tratamiento del cáncer de cuello uterino.
Introducción
El cáncer de cuello uterino es una preocupación mundial, ya que es uno de los principales tipos de neoplasias malignas ginecológicas en todo el mundo y es la principal causa de mortalidad relacionada con el cáncer en las mujeres1. La cirugía radical y la quimiorradioterapia se asocian con altas tasas de curación en la etapa primaria. Sin embargo, los resultados del tratamiento para las pacientes en estadio avanzado de cáncer de cuello uterino que desarrollan enfermedad metastásica son muy desfavorables2. Por lo tanto, es crucial comprender mejor los mecanismos biológicos que subyacen a la migración e invasión de las células de cáncer de cuello uterino e identificar posibles dianas terapéuticas para la prevención y el tratamiento de esta enfermedad.
La identificación de genes diana implicados en la progresión del cáncer y la búsqueda de formas de inhibir su expresión o acción presentan opciones de tratamiento prometedoras. En este estudio, identificamos FAM83 como un gen causante de cáncer e investigamos más a fondo sus efectos inhibidores en las células C33a y HeLa. Los oncogenes de la familia FAM83 (FAM83A-H) están ampliamente reportados en cánceres humanos 3,4. Recientemente, se informó que FAM83A está regulado al alza en los cánceres de pulmón5, mama6, ovario7 y páncreas8, lo que indica que FAM83A desempeña un papel importante en la progresión del cáncer al promover la proliferación, la invasión, los rasgos similares a las células madre y la resistencia a los medicamentos en las células tumorales. Es importante destacar que FAM83A se identificó como uno de los nuevos genes candidatos asociados con la progresión de las lesiones cervicales y la carcinogénesis9. A pesar de la confirmación de la expresión elevada de FAM83A en células de cáncer de cuello uterino humano, el impacto específico y los mecanismos subyacentes de FAM83A en el cáncer de cuello uterino siguen sin estar claros.
En este estudio, describimos los protocolos involucrados en la identificación de FAM83A como un gen diana tumoral en el cáncer de cuello uterino y utilizamos un pequeño ARN interferente (siRNA) para la eliminación del gen FAM83A en células HeLa y C33a . Se realizó la tinción con 5-etinil-2'-desoxiuridina (EdU) para determinar los efectos sobre la proliferación de células tumorales, mientras que la cicatrización de heridas y los ensayos de inserción de membranas porosas ayudaron a evaluar la migración de las células tumorales y las capacidades de invasión.
Se realizó Western blot para determinar los niveles de proteínas relacionadas con la apoptosis, y se empleó la tinción de JC-1 para evaluar las alteraciones de la función mitocondrial. Por lo tanto, informamos que FAM83A desempeña un papel crítico en la proliferación celular, la metástasis y la invasión en el cáncer de cuello uterino. A través de la disfunción mitocondrial y la apoptosis asociadas a la vía PI3K/AKT, FAM83A sensibilizó las células de cáncer de cuello uterino al cisplatino (diaminidicloroplatino, DDP). Este estudio proporciona una nueva diana para el cáncer de cuello uterino y posiblemente otros cánceres y una referencia para el desarrollo de estrategias para superar la resistencia de las células cancerosas a ciertos fármacos quimioterapéuticos.
Protocolo
El estudio se ajustó plenamente a las directrices de publicación proporcionadas por la TCGA (https://cancergenome.nih.gov/publications/publicationguidelines). Consulte la Tabla de materiales para obtener detalles relacionados con todos los materiales, reactivos e instrumentos utilizados en este protocolo.
1. Fuente de datos y análisis bioinformático
- Obtenga datos de secuenciación de ARN de la base de datos del Atlas del Genoma del Cáncer (TCGA) (https://cancergenome.nih.gov) para el análisis de conglomerados. Utilice GEPIA (http://gepia.cancer-pku.cn/), una herramienta basada en la web para volver a calcular los datos de secuenciación de ARN sin procesar de muestras de proyectos TCGA, para detectar dianas farmacológicas candidatas contra el cáncer con una línea de procesamiento estándar.
NOTA: El sitio web de GEPIA está disponible gratuitamente para todos los usuarios. - Acceda a la página de inicio del sitio web de GEPIA y haga clic en Análisis de tipo de cáncer, seleccione la opción Análisis de genes diferenciales y establezca los siguientes parámetros: Nombre del cáncer = CESE (definido como carcinoma de células escamosas de cuello uterino y adenocarcinoma de endocuello uterino en esta página web), |Log2FC| Punto de corte = 1, valor de corte q = 0,01, métodos diferenciales = ANOVA y distribución cromosómica = ambos. A continuación, haga clic en Lista para obtener una lista de genes que muestra la expresión diferencial entre los grupos tumorales y normales.
NOTA: Se requiere una extensa revisión de la literatura para identificar genes candidatos expresados diferencialmente. En este estudio, teniendo en cuenta los antecedentes de la literatura disponible, nos centramos en el gen tumoral de interés, FAM83A. - A continuación, examine la expresión de FAM83A en el cáncer de cuello uterino y en los tejidos normales utilizando GEPIA procediendo a la opción Expression DIY en el sitio web y seleccione Boxplot como tipo de gráfico. Introduzca FAM83A en el campo de parámetros del gen y establezca los siguientes parámetros: |Log2FC| Valor de corte = 1; valor q Punto de corte = 0,01. Seleccione CESE como nombre del cáncer y Coincidir con los datos normales de TCGA para el campo de datos Normal coincidente , dejando todas las demás configuraciones en su valor predeterminado. Haga clic en Plot y permita que el sitio web genere un diagrama de caja que represente la expresión diferencial del gen FAM83A ; Guarde el diagrama de caja para futuras referencias y análisis.
- Por último, analizar la supervivencia global de pacientes portadoras de tumores con diferentes niveles de expresión de FAM83A en cáncer de cuello uterino. Vaya a la opción Survival Plots en el sitio web, establezca el gen en FAM83A y seleccione Overall Survival como tipo de análisis. Agregue el nombre del tumor CESE, elija Meses para las Unidades del eje y deje todos los demás parámetros en su configuración predeterminada. Haga clic en Trazar y deje que el sitio web genere un gráfico de curva de supervivencia; Guarde este gráfico para futuras referencias y análisis.
- Tener en cuenta tanto la expresión diferencial de FAM83A en tumores como su correlación con el análisis de supervivencia de las pacientes para identificar FAM83A como un gen diana terapéutica potencial en el cáncer de cuello uterino.
2. Experimentos basados en células
- Cultivo celular
- Cultivo de líneas celulares tumorales humanas en el medio modificado a 37 °C en una atmósfera humidificada con 5% de CO2 .
NOTA: Consulte la Tabla de materiales para obtener información sobre la línea celular y los componentes del medio de cultivo.
- Cultivo de líneas celulares tumorales humanas en el medio modificado a 37 °C en una atmósfera humidificada con 5% de CO2 .
- Transfección celular
- Utilice siRNA para reducir la expresión de FAM83A en las células.
NOTA: Consulte la Tabla 1 para ver la secuencia específica de siRNA. - Células de siembra en placas de 6 pocillos e incubar con la mezcla de 50 nM de si-FAM83A o siRNA-NC y 8 μL de agente de transfección o solo 8 μL de agente de transfección durante 4-6 h después de alcanzar una confluencia del 50%-70%. Agregue solo DMEM sin suero al control negativo.
- Después de la incubación, reemplace el medio que contiene el agente de transfección con DMEM + suero fetal para terneros al 10%. Además, 48 h después de la transfección, tratar con 5 μM de cisplatino (DDP) durante 24 h según lo previsto y recolectar todas las células para la extracción de ARN total y el análisis qRT-PCR.
- Utilice siRNA para reducir la expresión de FAM83A en las células.
3. Detección de EdU para el ensayo de proliferación celular
NOTA: Utilice el kit de proliferación celular EdU para evaluar la proliferación celular in vitro de acuerdo con las instrucciones del fabricante.
- Siembre las células en placas de 6 pocillos e incorpórelas con 10 μM de solución de EdU durante 2 h. Fijar las células con paraformaldehído al 4% durante 15 min a temperatura ambiente (RT) y permeabilizar con Triton X-100 al 0,3% en PBS durante 10 min a RT.
- Retire el tampón de permeabilización y agregue 500 μL de solución de reacción 1x. A continuación, incubar durante 30 minutos a RT en la oscuridad para la tinción nuclear.
- Tiñir las células con 4',6-diamidino-2-fenilindol (DAPI) y visualizarlas bajo un microscopio de fluorescencia con un aumento de 200x. Tiñir los núcleos de las células en proliferación con EdU y examinarlos en busca de fluorescencia roja.
- Por último, utilice un software para cuantificar los resultados contando al menos 10 campos aleatorios y calcule las tasas de proliferación utilizando la proporción de células fluorescentes positivas con respecto al total de células.
4. Ensayo de cicatrización de heridas
- Células de siembra en placas de 6 pocillos a una densidad de 2 × 105 celdas por pocillo.
- Cuando las células alcancen el 90 % de confluencia, utilice una punta de micropipeta estéril de 10 μL para crear suavemente un rasguño lineal en la monocapa celular. Enjuague suavemente los pocillos con PBS estéril para eliminar las células desprendidas y los residuos causados por el rascado.
- Además, incube las células en un medio que contenga 1% de FBS. Luego, observe y tome imágenes con el microscopio invertido para la curación de la región herida a las 12, 24 y 48 h.
5. Ensayo de inserto de membrana porosa
- Preparar una suspensión celular en medio de cultivo celular a la concentración celular deseada (que contenga 4 × 104 células), incluidas las células C33a transfectadas o de control y HeLa. Agregue la suspensión celular a la cámara superior de los insertos de membrana, asegurando una distribución uniforme. Agregue medio completo a la cámara inferior.
- Después de la incubación durante 24 h, utilizar alcohol metílico y violeta cristalino al 0,1% para la fijación y tinción de las células que migran a las cámaras inferiores, respectivamente.
- Utilice un microscopio invertido para tomar imágenes y, a continuación, analice el número de células migratorias contando al menos 10 campos aleatorios con ImageJ.
- Para el análisis de números con ImageJ, abra la imagen en el software ImageJ, vaya a la pestaña Imagen en el menú de herramientas, seleccione Ajustar y luego haga clic en Umbral. Ajuste la configuración del umbral, si es necesario, hasta que solo las celdas sean visibles sobre un fondo blanco.
- Haga clic en Aplicar en la ventana Umbral para aplicar esta configuración a la imagen. Ahora, seleccione la herramienta Varita (trazado) de la barra de herramientas (ubicada en la parte superior de la ventana).
- Haga clic en el área de la imagen donde se encuentran las celdas para seleccionar todas las celdas de la imagen con umbral. Después de resaltar las celdas, vaya a Analizar en el menú Herramienta y luego haga clic en Analizar partículas. En la ventana Analizar partículas, introduzca el tamaño deseado (p. ej., 0 - infinito) y los valores de circularidad (p. ej., 0,00 - 1,00) de acuerdo con los requisitos experimentales para incluir todas las celdas en el recuento.
- Haga clic en Aceptar y espere a que el software cuente las celdas y a que aparezca una nueva ventana con los resultados del análisis.
6. Ensayo de formación de colonias
- Siembre 2 × 105 células por pocillo de los grupos Si-NC y Si-FAM83A en una placa de 6 pocillos con o sin tratamiento con cisplatino (DDP) de 5 μM durante 24 h.
- Después de un período de 24 horas de tratamiento farmacológico, separar las células con tripsina al 0,25% y volver a suspenderlas en el medio Eagle modificado (DMEM) de Dulbecco que contiene un 10% de FBS. Siembre las células resuspendidas en una placa de 6 pocillos a una densidad de 1 × 103 celdas por pocillo, y luego incube en una incubadora de CO2 al 5% a una temperatura de 37 °C.
- Después de la incubación durante ~7-10 días cuando las colonias son visibles, fije las células con polioximetileno al 4% y tiña con solución de tinción Giemsa durante 20 minutos.
- Lave ligeramente las celdas y deje que las placas se sequen al aire. Tome imágenes de los grupos de colonias con el microscopio y cuente el número de colonias que contienen más de 50 células.
7. Análisis de despolarización de la membrana mitocondrial (MMP) con colorante JC-1
- Siembre 1,2 × 106 células tumorales de los grupos Si-NC y Si-FAM83A en una placa de seis pocillos y cultivo durante 24 h con o sin tratamiento con cisplatino (DDP) de 5 μM.
- Incubar con 1x solución de tinción JC-1 durante 15-20 min bajo 5% de CO2 a 37 °C utilizando un kit de ensayo de potencial de membrana mitocondrial de acuerdo con las instrucciones del fabricante.
- Lave las células y examínelas bajo un microscopio fluorescente a un aumento de 200x utilizando longitudes de onda de excitación y emisión para JC-1 a ~490 nm y 590 nm, respectivamente. Para visualizar la fluorescencia JC-1, utilice los filtros adecuados, como un filtro de excitación azul (450-490 nm) y un filtro de emisión rojo (paso largo > 590 nm) para capturar selectivamente la señal de fluorescencia emitida.
8. Análisis citométrico de flujo de mPTP
- Siembre 1,2 × 106 células tumorales de los grupos Si-NC y Si-FAM83A en una placa de seis pocillos y cultivo durante 24 h con o sin tratamiento con cisplatino (DDP) de 5 μM.
- Retire el medio de cultivo de las células, vuelva a suspender las células en PBS y agregue 300 μL cada una (1x volumen) de solución de tinción de Calceína AM y solución de trabajo de extinción de fluorescencia para cubrir las células de manera uniforme. Incubar las células a 37 °C en un ambiente protegido de la luz durante 30-45 min, y sustituir el medio por medio de cultivo fresco precalentado a 37 °C. Incubar las células a 37 °C en un ambiente protegido de la luz durante 30 minutos adicionales para asegurar la hidrólisis completa de la Calceína AM por esterasas intracelulares, lo que da como resultado la generación de Calceína verde fluorescente intracelular.
- Retire el medio de cultivo, lave las células 2-3 veces con PBS y agregue un tampón de detección. Detecte mPTP celular mediante citometría de flujo y una longitud de onda de excitación de 488 nm.
9. Citometría de flujo
- Siembre 1,2 × 106 células tumorales de los grupos Si-NC y Si-FAM83A en una placa de seis pocillos y cultivo durante 24 h con o sin tratamiento con cisplatino (DDP) de 5 μM.
- Después de 24 h de tratamiento farmacológico, vuelva a suspender las células en 200 μL de solución tampón de unión y mezcle suavemente 10 μL de anexina V-FITC y 5 μL de yoduro de propidio (PI) en la suspensión celular. Incubar la mezcla durante 15 minutos evitando la luz y añadir 300 μL de solución tampón aglutinante a las células. Detecte la apoptosis celular mediante citometría de flujo a una longitud de onda de excitación de 488 nm.
10. Análisis RT-PCR
- Siembre 1,2 × 106 células tumorales de los grupos Si-NC y Si-FAM83A en una placa de seis pocillos y cultivo durante 24 h con o sin tratamiento con cisplatino (DDP) de 5 μM.
- Extraiga el ARN total de las células tumorales utilizando el reactivo de extracción de ARN y convierta el ARN extraído en ADN complementario (ADNc) con la mezcla de síntesis de ADNc incubando a 42 °C durante 45 min y luego a 95 °C durante 5 min.
- Prepare la mezcla de reacción de PCR que contiene ADN polimerasa, nucleótidos, tampón y los cebadores específicos del gen diseñados. Añadir la plantilla de ADNc a la mezcla de reacción para la reacción de PCR en tiempo real y realizar la PCR en el instrumento de PCR cuantitativa en tiempo real con las siguientes condiciones de termociclado: desnaturalización a 95 °C durante 30 s, seguida de 40 ciclos de 95 °C durante 5 s y 60 °C durante 30 s, y la etapa de curva de fusión a 95 °C durante 15 s, 60 °C durante 1 min y 95 °C durante 15 s. Cuantificar los niveles de ARNm mediante el método 2−ΔΔCq utilizando GAPDH como control interno.
NOTA: El sistema de reacción RT-PCR se muestra en la Tabla 1 y las secuencias de cebadores se muestran en la Tabla 1.- Para calcular el valor 2−ΔΔCq , mida los valores de Cq para el gen diana y el gen de referencia (GAPDH) en las muestras. Calcule el ΔCq restando el valor de Cq del gen de referencia del valor de Cq del gen objetivo para cada muestra. Calcule el ΔΔCq restando el ΔCq de una muestra de control del ΔCq de cada muestra experimental. Por último, calcula el valor 2−ΔΔCq elevando 2 a la potencia del valor ΔΔCq.
NOTA: El valor Cq representa el número de ciclo en el que la señal de fluorescencia alcanza el umbral establecido.
- Para calcular el valor 2−ΔΔCq , mida los valores de Cq para el gen diana y el gen de referencia (GAPDH) en las muestras. Calcule el ΔCq restando el valor de Cq del gen de referencia del valor de Cq del gen objetivo para cada muestra. Calcule el ΔΔCq restando el ΔCq de una muestra de control del ΔCq de cada muestra experimental. Por último, calcula el valor 2−ΔΔCq elevando 2 a la potencia del valor ΔΔCq.
11. Análisis de Western blot
- Siembre 1,2 × 106 células tumorales de los grupos Si-NC y Si-FAM83A en una placa de seis pocillos y cultivo durante 24 h con o sin tratamiento con cisplatino (DDP) de 5 μM.
- Recoja las células cultivadas y lávelas con solución salina tamponada con fosfato (PBS) helada para eliminar cualquier medio de crecimiento o suero residual. Lisar las células utilizando el tampón de lisis RIPA que contiene fluoruro de fenilmetilsulfonilo (PMSF) para liberar las proteínas celulares. Incubar las células en hielo durante unos minutos para asegurar una lisis completa y centrifugar a 4 °C, 12.000 × g durante 15 min. Recoja el sobrenadante para determinar su concentración de proteína.
- Determine la concentración de proteínas en el lisado celular utilizando un kit de ensayo de proteínas BCA de acuerdo con las instrucciones del fabricante. Mezclar el lisado celular con un tampón de carga y calentar la mezcla a 95-100 °C durante 5-10 min para desnaturalizar las proteínas y asegurar una separación uniforme en el gel.
- De cada muestra, cargue 30 μg de proteína total en un gel SDS-PAGE y haga funcionar el SDS-PAGE a un voltaje constante de 80 V. Detenga la electroforesis cuando el azul de bromofenol llegue al fondo del gel de separación.
- Transfiera las proteínas separadas del gel a una membrana de difluoruro de polivinilo utilizando un sistema de transferencia húmeda en un baño de hielo con una corriente de 200 mA durante 1,5 h.
- Bloquear la membrana con leche descremada al 5% en solución salina tamponada con Tris con tampón Tween-20 al 0,05% (TBST) durante 1 h a RT e incubar durante la noche a 4 °C con los anticuerpos respectivos indicados en la Tabla de Materiales.
- Lavar la membrana varias veces con TBST e incubar con los anticuerpos secundarios (Tabla de Materiales) durante 1 h en RT, seguido de lavado con TBST. Visualice las bandas de proteínas utilizando un kit de detección de quimioluminiscencia mejorado y un sistema de generación de imágenes.
12. Análisis estadístico
- Como todos los puntos de datos experimentales serán independientes, presente los datos como la media ± DE. Realice análisis estadísticos.
- Utilice el análisis de varianza unidireccional (ANOVA) para comparaciones múltiples y la prueba de Dunnett para comparar cada grupo con el grupo de control. Utilice la prueba t de Student (dos colas no apareadas) para comparar dos grupos; consideran que P < 0,05 son significativos.
Resultados
Análisis de la base de datos TCGA y validación de PCR
A partir del análisis de la base de datos TCGA, realizamos un análisis comparativo de los niveles de expresión de ARNm en 306 muestras de células de cáncer de cuello uterino y 13 muestras de células normales para investigar la expresión diferencial de FAM83A. FAM83A fue regulado al alza en el cáncer de cuello uterino, mientras que su expresión en el tejido cervical normal fue insignificante (Figura 1A). Para obtener más información sobre las implicaciones pronósticas de la expresión de FAM83A , realizamos un análisis de la curva de Kaplan-Meier. Sorprendentemente, los pacientes con mayor expresión de FAM83A mostraron una supervivencia global marcadamente peor (Figura 1B). Para determinar el papel de FAM83A en el cáncer de cuello uterino, examinamos los niveles de expresión de FAM83A en dos líneas celulares de cáncer de cuello uterino, HeLa y C33a, así como en una línea celular de cuello uterino inmortalizada, End1/E6E7. Mediante qRT-PCR, observamos una sobreexpresión significativa de FAM83A en las líneas celulares HeLa y C33a en comparación con la línea celular End1/E6E7 (Figura 1C). Estos hallazgos subrayan la importancia de FAM83A en el contexto del cáncer de cuello uterino.
Experimentos de proliferación y apoptosis para verificar la función biológica de FAM83A en cáncer de cuello uterino
Para investigar el papel funcional de FAM83A en el cáncer de cuello uterino, utilizamos la eliminación mediada por siRNA de FAM83A en células C33a y HeLa (Figura 2A, B). A continuación, evaluamos el impacto de la supresión de FAM83A en la proliferación celular. La tinción con EdU reveló que la disminución de la expresión de FAM83A inhibió significativamente la proliferación celular tanto en las células C33a como en las HeLa (Figura 2C-F). Las células malignas inmortales se asocian con tasas de apoptosis extremadamente bajas10. Por lo tanto, se evaluaron los niveles de proteínas anti y proapoptóticas en las células de cáncer de cuello uterino control y tratadas con si-FAM83A. Los análisis de Western blot revelaron que la expresión suprimida de FAM83A aumentaba la expresión de las proteínas Bax y caspasa3 escindida (proteínas proapoptóticas), disminuía la expresión de Bcl-2 (proteína antiapoptótica) y aumentaba la liberación de Cytc (Figura 2C-E), lo que es consistente con la observación de que las proteínas antiapoptóticas regulan la apoptosis bloqueando la liberación mitocondrial de Cytc (Figura 2G-J)10. En conjunto, estos datos sugirieron que FAM83A desempeña un papel importante en la regulación de la proliferación y la apoptosis de las células de cáncer de cuello uterino.
Ensayos de cicatrización de heridas e inserción de membranas porosas para verificar la función biológica de FAM83A en el cáncer de cuello uterino
Se realizaron ensayos de cicatrización de heridas e inserción de membranas para explorar los efectos de la supresión de FAM83A en la migración e invasión de células de cáncer de cuello uterino. Los resultados revelaron que las células de cáncer de cuello uterino con expresión suprimida de FAM83A migraron (Figura 3A-D) e invadieron (Figura 3E-H) de manera menos eficiente que las células de control.
Efectos sobre la función mitocondrial y la vía de señalización PI3K/AKT
Dado el papel de PI3K/AKT en la inducción de la apoptosis celular, nos propusimos determinar si la supresión de la expresión de FAM83A inhibiría la fosforilación constitutiva de la vía PI3K/Akt/mTOR en el cáncer de cuello uterino. La supresión de FAM83A inhibió significativamente los niveles clave de proteínas fosforiladas en la vía PI3K/Akt/mTOR, incluyendo p-PI3K, p-Akt y p-mTOR en células c333a y HeLa (Figura 4A-D). Las mitocondrias son los orgánulos responsables del metabolismo celular y de la inducción de la apoptosis celular. La evidencia acumulada indica que la apoptosis de las células cancerosas implica una disfunción mitocondrial a través de la vía mitocondrial intrínseca debido a una mayor permeabilidad mitocondrial y la liberación de moléculas proapoptóticas como Cytc en el citoplasma10. La vía PI3K/AKT podría regular la translocación de Bax en las mitocondrias, induciendo la liberación de Cytc en respuesta a estímulos apoptóticos. Por lo tanto, es concebible que los componentes oncogénicos de la vía de señalización PI3K-AKT regulen la apoptosis celular directamente influyendo en el comportamiento mitocondrial. Por lo tanto, se realizó un ensayo de poros de transición de permeabilidad mitocondrial (mPTP) de células vivas para determinar el estado mitocondrial. La apertura de mPTP se asocia con la muerte celular apoptótica y necrótica11. En este ensayo, un colorante verde fluorescente (calceína AM) se retiene en el citoplasma y las mitocondrias cuando se cierra el mPTP, mientras que el colorante en el citoplasma se apaga con CoCl2, dejando solo la fluorescencia intensiva en las mitocondrias. Los resultados revelaron que las poblaciones celulares con fluorescencia verde intensa en las mitocondrias disminuyeron significativamente después de la supresión de FAM83A, lo que indica un mPTP abierto (Figura 4E,F). Además, examinamos los cambios en el potencial de membrana mitocondrial (ΔΨm) utilizando la tinción de JC-1. JC-1 forma agregados (fluorescencia roja) en células vivas que contienen mitocondrias intactas con alto potencial de membrana y monómeros (fluorescencia verde) bajo MMP bajo MMP en células apoptóticas. La supresión de FAM83A disminuyó gradualmente la MMP (Figura 4G).
Análisis de susceptibilidad a fármacos para la proliferación y la invasión
La quimioterapia a base de cisplatino (DDP) es una estrategia de tratamiento estándar para el cáncer de cuello uterino. Sin embargo, la quimiorresistencia sigue siendo un desafío. Investigamos el papel de FAM83A en el tratamiento del cáncer de cuello uterino con cisplatino. Las células HeLa control, tratadas con si-NC y tratadas con si-FAM83A se trataron con o sin cisplatino 5 μM12. Además, se evaluaron los efectos de la supresión de FAM83A sobre la viabilidad celular. La DDP indujo un efecto inhibidor más significativo sobre la proliferación de células HeLa después de la supresión de FAM83A , en comparación con el tratamiento solo con DDP (Figura 5A y Figura 5C). Después de tratar las células de cáncer de cuello uterino con cisplatino 5 μM, la supresión de FAM83A también inhibió la invasión celular (Figura 5B y Figura 5D).
Análisis de susceptibilidad a fármacos para la función mitocondrial
Al tratar las células HeLa tratadas con Si-NC y si-FAM83A con o sin cisplatino (DDP) de 5 μM, evaluamos el potencial de membrana mitocondrial (MMP) y evaluamos el daño mitocondrial causado por la muerte celular mediante tinción JC-1. DDP indujo más daño mitocondrial, como lo revela una disminución en el porcentaje de monómero JC-1 después de la eliminación de FAM83A , en comparación con solo el tratamiento con DDP (Figura 6A y Figura 6D). Después de tratar las células de cáncer de cuello uterino con 5 μM de cisplatino, la eliminación de FAM83A también inhibió la formación de colonias (Figura 6B y Figura 6E) y mejoró la apoptosis celular (Figura 6C y Figura 6F). Además, la reducción de FAM83A en presencia de DDP aumentó notablemente la expresión de proteínas proapoptóticas, Bax y caspasas escindidas3, promovió la liberación de Cytc y disminuyó la expresión de Bcl-2 (Figura 6G, H). Estos resultados indicaron que el knockdown de FAM83A sensibilizó las células de cáncer de cuello uterino a DDP a través de la inducción de la apoptosis.
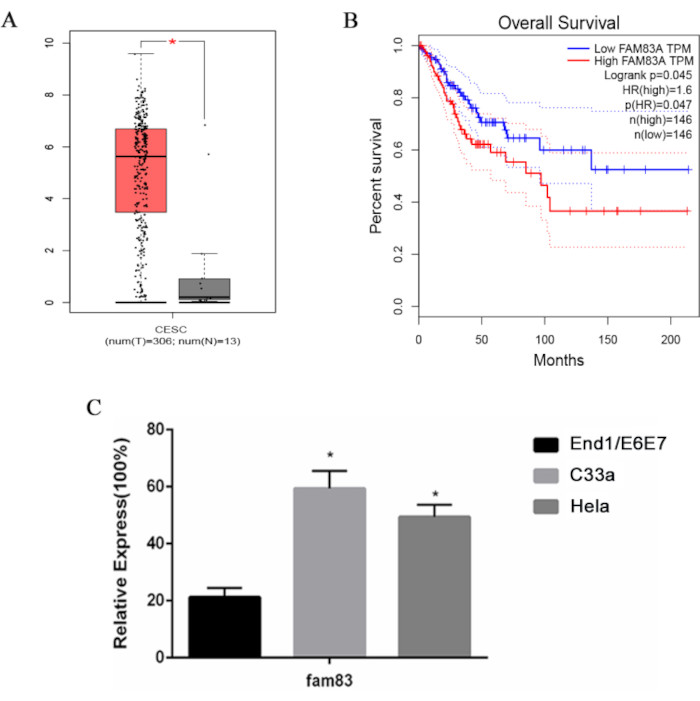
Figura 1: Sobreexpresión de FAM83A en células de cáncer de cuello uterino y correlación con peor pronóstico. (A) Análisis de diagrama de caja de los niveles de ARNm de FAM83A en muestras de cáncer de cuello uterino. (B) Análisis de Kaplan-Meier de la expresión de FAM83A para la determinación de la supervivencia global en pacientes con cáncer de cuello uterino. (C) Niveles relativos de ARNm de FAM83A en las líneas celulares de cáncer de cuello uterino HeLa y C33a y en la línea celular de cáncer de cuello uterino inmortalizada humana End1/E6E7. Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05, en comparación con las células End1/E6E7 que utilizan ANOVA de un factor. Abreviaturas: CESE = Carcinoma de células escamosas cervical y adenocarcinoma endocervical; HR = cociente de riesgo. Haga clic aquí para ver una versión más grande de esta figura.
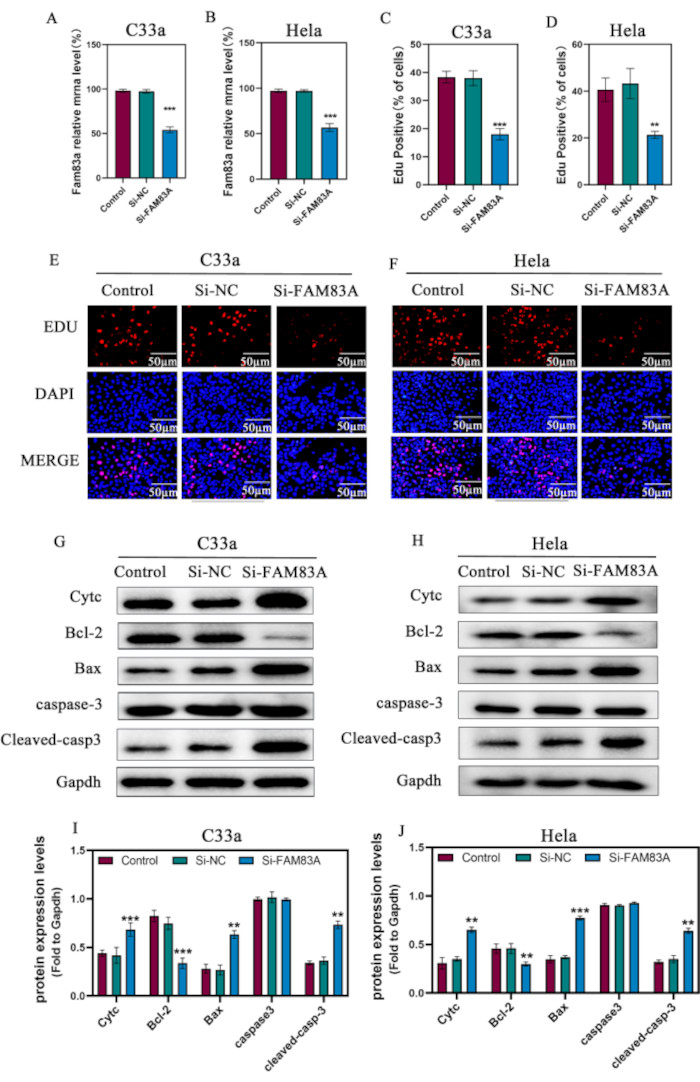
Figura 2: Efectos de la supresión de FAM83A sobre la proliferación y apoptosis del cáncer de cuello uterino. Las células C33a y HeLa se transfectaron con siRNAs específicos de FAM83A. Se evaluaron los niveles de ARNm (A,B) de FAM83A en líneas celulares de cáncer de cuello uterino mediante qRT-PCR. La proliferación celular en células (C) C33a y (D) HeLa se determinó mediante el ensayo EdU. (E,F) Las imágenes de fluorescencia EDU de las células C33a y Hela. (G-J) Análisis de Western blot para examinar los niveles de proteínas relacionadas con la apoptosis, incluidas Cytc, Bcl-2, Bax, caspasa3 y caspasa-3 escindida; Se utilizó GAPDH como control de carga. Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05; **P < 0,01; **P < 0,001, en comparación con las células de control que utilizan ANOVA de un factor. Abreviaturas: NC = control negativo; EdU = 5-etinil-2'-desoxiuridina; CytC = citocromo C. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: Efecto de FAM83A en la migración e invasión de células de cáncer de cuello uterino in vitro. (A-D) Se realizó un ensayo de cicatrización de heridas para evaluar la migración celular. Las imágenes se tomaron a las 0, 24 y 48 h. (E-H) Se realizaron ensayos Transwell para examinar la invasión celular. Barras de escala = 100 μm (E,F). Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05; **P < 0,01; **P < 0,001, en comparación con las células de control que utilizan ANOVA de un factor. Haga clic aquí para ver una versión más grande de esta figura.
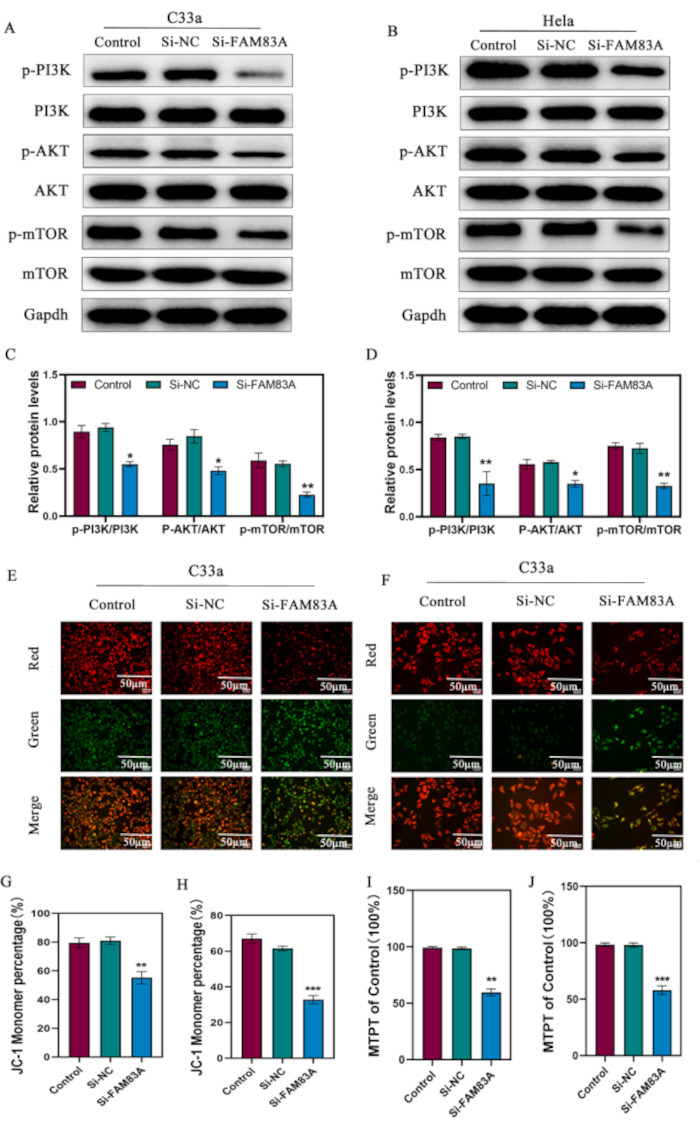
Figura 4: Efecto de la supresión de FAM83A en la vía PI3K/AKT/mTOR y en la función mitocondrial. (A-D) Análisis de Western blot para determinar los niveles de proteínas de la vía PI3K/AKT/mTOR en células C33a y HeLa después de la supresión de FAM83A. (E-H) Análisis del potencial de membrana mitocondrial mediante tinción JC-1. Los agregados de JC-1 se tiñeron en rojo y los monómeros de JC-1 se tiñeron en verde, lo que indica una MMP más baja. (I,J) La permeabilidad mitocondrial se evaluó mediante un kit de mPTP y citometría de flujo. Barras de escala = 50 μm (E, F). Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05; **P < 0,01; P < 0,001, en comparación con las células de control que utilizaron ANOVA de un factor. Abreviaturas: MMP = potencial de membrana mitocondrial; mPTP = poro de transición de permeabilidad mitocondrial. Haga clic aquí para ver una versión más grande de esta figura.

Figura 5: Efectos de la supresión de FAM83A en la inhibición por DDP sobre la proliferación celular y la invasión de células de cáncer de cuello uterino. Las células HeLa se transfectaron con si-NC o si-FAM83A y se trataron con o sin DDP de 5 μM. (A,C) Efecto del DDP sobre la proliferación celular en células HeLa control, tratadas con si-NC y tratadas con si-FAM83. (B,D) Efecto de DDP sobre la invasión celular en células HeLa control, tratadas con si-NC y tratadas con si-FAM83. Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05; **P < 0,01; P < 0,001, en comparación con las células de control. &&P < 0,01; &&&P < 0,001, en comparación con DDP utilizando ANOVA de un factor. Abreviaturas: DDP = diaminidicloroplatino; EdU = 5-etinil-2'-desoxiuridina; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
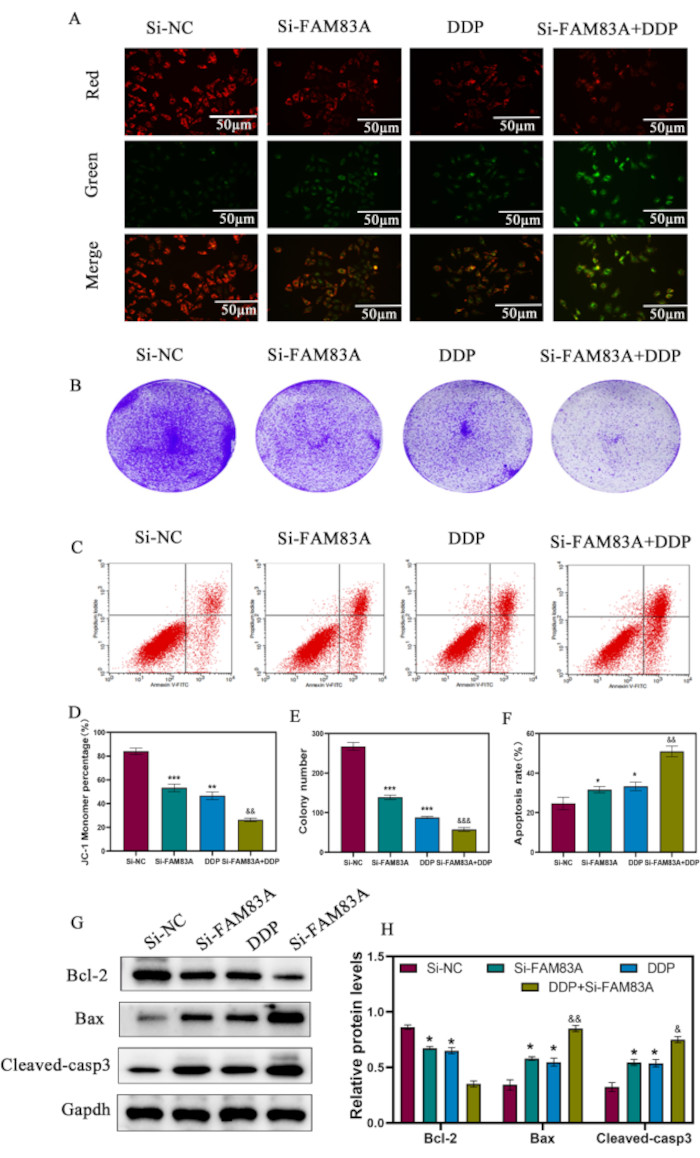
Figura 6: Efectos de la supresión de FAM83A en los efectos de DDP sobre la apoptosis en células de cáncer de cuello uterino. Las células HeLa se transfectaron con si-NC o si-FAM83A y se trataron con o sin DDP de 5 μM. (A,D) Análisis de MMP mediante tinción JC-1. (B,E) Resultados de la clonación de placas. (C,F) Citometría de flujo detectando tasas de apoptosis en diferentes grupos de tratamiento. (G,H) Análisis de Western blot de proteínas apoptóticas relacionadas con las mitocondrias, incluidas Bcl-2, Bax, Cytc y la caspasa-3 escindida aguas abajo. Se utilizó GAPDH como control de carga. Los datos se presentan como la media ± DE para tres experimentos independientes. *P < 0,05; **P < 0,01; P < 0,001, en comparación con las células de control. &P < 0,05; &&P < 0,01; &&&P < 0,001, en comparación con DDP utilizando ANOVA de un factor. Abreviaturas: DDP = diaminidicloroplatino; EdU = 5-etinil-2'-desoxiuridina; DAPI = 4',6-diamidino-2-fenilindol. Haga clic aquí para ver una versión más grande de esta figura.
Tabla 1: siRNA, cebadores de qRTPCR y la configuración de reacción de qRT-PCR utilizada en este estudio. Haga clic aquí para descargar esta tabla.
Discusión
La investigación de los genes diana tumorales es de suma importancia tanto para la prevención como para el tratamiento del cáncer de cuello uterino. La comprensión de los genes específicos que desempeñan un papel importante en el desarrollo y la progresión del cáncer de cuello uterino proporciona información valiosa sobre los mecanismos moleculares subyacentes de la enfermedad. Además, la identificación de estos genes diana puede conducir al desarrollo de nuevas estrategias terapéuticas y terapias dirigidas. En este estudio, describimos el uso del análisis del conjunto de datos TCGA para identificar FAM83A como un gen diana e investigar sus funciones mecanicistas en el cáncer de cuello uterino. Observamos una expresión significativamente alta de FAM83A en las células de cáncer de cuello uterino, lo que se asocia con un mal pronóstico de las pacientes con cáncer de cuello uterino. Una serie de experimentos basados en células reveló una alta expresión de FAM83A en las células de cáncer de cuello uterino, que desempeña un papel fundamental en la regulación de la proliferación, migración e invasión celular. La supresión de la expresión de FAM83A inhibió la proliferación y la migración y promovió la apoptosis en las células de cáncer de cuello uterino.
La construcción de líneas celulares de cáncer de cuello uterino FAM83A es el paso más crítico de este estudio. Los siRNAs se diseñan y validan de acuerdo con las secuencias de genes diana para garantizar su efectividad. Además, las líneas celulares de cáncer de cuello uterino se transfectan mediante siRNA. La tasa de éxito de la transfección de plásmidos es crucial para experimentos posteriores, que requieren un control estricto de la densidad celular y la densidad de plásmidos. Además, la eficiencia de la transfección se observa bajo un microscopio de fluorescencia para garantizar que se puedan realizar experimentos posteriores. Los resultados de Western blot y qRT-PCR confirman que la inhibición de FAM83A suprimió la vía PI3K/AKT e indujo disfunción mitocondrial. Nuestra hipótesis es que el mecanismo implica la inhibición de la translocación de Bax del citoplasma a las mitocondrias por PI3K/AKT, lo que promueve la supervivencia celular13.
Los avances en el tratamiento del cáncer de cuello uterino han permitido desarrollar nuevas moléculas diana. La identificación de un nuevo oncogén puede ser aplicada terapéuticamente para mejorar el pronóstico clínico de las neoplasias malignas cervicales14,15. En este estudio, construimos con éxito un sistema de knockdown de FAM83A en células HeLa y C33a y verificamos los efectos de la knockdown de FAM83A en células de cáncer de cuello uterino a nivel celular. Proponemos que la inhibición de FAM83A se puede utilizar para tratar el cáncer de cuello uterino.
Sin embargo, este estudio tiene algunas limitaciones. En primer lugar, este estudio solo realiza el cribado genético a través de la base de datos y carece de datos patológicos de pacientes clínicos. En segundo lugar, este estudio solo ha validado el efecto in vitro, y se necesitaron más estudios in vivo para verificar los resultados. Sin embargo, los métodos de identificación de genes diana, knockout de genes y validación celular para identificar loci terapéuticos específicos elaborados en este estudio pueden proporcionar ideas de investigación para el descubrimiento y validación de genes diana para otras enfermedades.
En resumen, FAM83A se sobreexpresó y se correlacionó con un peor pronóstico en el cáncer de cuello uterino. FAM83A regula la proliferación, migración e invasión de las células de cáncer de cuello uterino. Supresión de la disfunción mitocondrial inducida por FAM83A y apoptosis, sensibilizando las células de cáncer de cuello uterino al cisplatino. Estos resultados indicaron que FAM83A es una diana de investigación adecuada para el tratamiento del cáncer de cuello uterino. Este estudio contribuyó a los avances en quimioterapia adyuvante con el objetivo de mejorar el pronóstico de las pacientes con cáncer cervicouterino.
Divulgaciones
Los autores no reportan conflictos de interés en este trabajo.
Agradecimientos
Este trabajo contó con el apoyo de la Fundación de la Oficina de Ciencia y Tecnología de Jingzhou (n.º 2020HC06).
Materiales
| Name | Company | Catalog Number | Comments |
| Cells and Medium Formulation | |||
| C33a | American Type Culture Collection | ||
| Hela | American Type Culture Collection | ||
| Modified medium | 10% fetal bovine serum and + antibiotics (100 U/mL penicillin and 100 U/mL streptomycin) | ||
| Antibody Information | |||
| AKT | 4691, Cell Signaling Technology Inc. | ‘1:1,000 | |
| Bcl2 | 26593-1-AP, Proteintech Group, Inc | ‘1:1,000 | |
| Caspase 3 | 19677-1-AP, Proteintech Group, Inc | ‘1:2,000 | |
| cleaved-caspase3 | abs132005; Absin Bioscience Inc. | ‘1:1,000 | |
| Cytc | 10993-1-AP; Proteintech Group | ‘1:1,000 | |
| GAPDH | 10494-1-AP, Proteintech Group, Inc. | ‘1:8,000 | |
| mTOR | 2983, Cell Signaling Technology Inc. | ‘1:1,000 | |
| PI3K | 4292, Cell Signaling Technology Inc | ‘1:1,000 | |
| p-AKT | 4060, Cell Signaling Technology Inc. | ‘1:1,000 | |
| p-mTOR (Ser2448) | #5536, Cell Signaling Technology Inc. | ‘1:1,000 | |
| p-PI3K p85 subunit | 17366, Cell Signaling Technology Inc. | ‘1:1,000 | |
| Secondary antibodies | GB23303, Servicebio | ‘1:2,000 | |
| Materials | |||
| 6-well plate | Corning, NPY | ||
| Alexa Fluor 555 | Beyotime | ||
| BCA Protein assay kit | Beyotime, China | P0011 | |
| ChemiDoc XRS Imager System | BioRad | ||
| Enhanced chemiluminescence detection kit | Servicebio, Inc.,China | cat. no. G2014 | |
| Fluorescence microscope | Olympus Corporation, Tokyo, Japan | ||
| Hifair II 1st Strand cDNA Synthesis Super Mix | 11123ES60, Yeasen Biotech o., Ltd., China | ||
| Inverted microscope | Olympus, Tokyo, Japan; | ||
| Millicell transwell inserts | Millipore,Bedford, MA, USA | ||
| Mitochondrial membrane potential assay kit | Beyotime, China | ||
| PMSF | ST506, Beyotime Biotech, Jiangsu, China | #ST506 | |
| Real-time quantitative PCR instrument | Applied Biosystems, Thermo Fisher Scientific. China. | ||
| RIPA Lysis Buffer | Beyotime Biotech, Jiangsu, China | ||
| TRIzol reagent | Invitrogen | 15596026 | |
| TRIzol reagent | Takara Bio Inc., Otsu, Japan | ||
| Software | |||
| Image-Pro | plus 6.0 |
Referencias
- Arbyn, M., et al. Estimates of incidence and mortality of cervical cancer in 2018: a worldwide analysis. Lancet Global Health. 8 (2), e191-e203 (2020).
- Cohen, P. A., Jhingran, A., Oaknin, A., Denny, L. Cervical cancer. Lancet. 393 (10167), 169-182 (2019).
- Cipriano, R., et al. Conserved oncogenic behavior of the fam83 family regulates mapk signaling in human cancer. Molecular Cancer Research. 12 (8), 1156-1165 (2014).
- Snijders, A. M., et al. FAM83 family oncogenes are broadly involved in human cancers: an integrative multi-omics approach. Molecular Oncology. 11 (2), 167-179 (2017).
- Gan, J., Meng, Q., Li, Y. Corrigendum: systematic analysis of expression profiles and prognostic significance for fam83 family in non-small-cell lung cancer. Frontiers In Molecular Biosciences. 8, 653454 (2021).
- Jin, Y., et al. Comprehensive analysis of the expression, prognostic significance, and function of fam83 family members in breast cancer. World Journal of Surgical Oncology. 20 (1), 172 (2022).
- Lin, S., et al. Identification of prognostic biomarkers among fam83 family genes in human ovarian cancer through bioinformatic analysis and experimental verification. Cancer Management and Research. 13, 8611-8627 (2021).
- Ma, Z., et al. Identification of prognostic and therapeutic biomarkers among fam83 family members for pancreatic ductal adenocarcinoma. Disease Markers. 2021, 6682697 (2021).
- Xu, J., et al. Genome-wide profiling of cervical RNA-binding proteins identifies human papillomavirus regulation of rnaseh2a expression by viral e7 and e2f1. mBio. 10 (1), e02687-e02618 (2019).
- Wong, R. S. Apoptosis in cancer: from pathogenesis to treatment. Journal Of Experimental & Clinical Cancer Research. 30 (1), 87 (2011).
- Bonora, M., Pinton, P. The mitochondrial permeability transition pore and cancer: molecular mechanisms involved in cell death. Frontiers In Oncology. 4, 302 (2014).
- Wang, N., Hou, M. S., Zhan, Y., Shen, X. B., Xue, H. Y. MALAT1 promotes cisplatin resistance in cervical cancer by activating the pi3k/akt pathway. European Review for Medical and Pharmacological Sciences. 22 (22), 7653-7659 (2018).
- Tsuruta, F., Masuyama, N., Gotoh, Y. The phosphatidylinositol 3-kinase (pi3k)-akt pathway suppresses bax translocation to mitochondria. Journal Of Biological Chemistry. 277 (16), 14040-14047 (2002).
- Guerra, F., Arbini, A. A., Moro, L. Mitochondria and cancer chemoresistance. Biochimica et Biophysica Acta - Bioenergetics. 1858 (8), 686-699 (2017).
- Pustylnikov, S., Costabile, F., Beghi, S., Facciabene, A. Targeting mitochondria in cancer: current concepts and immunotherapy approaches. Translational Research. 202, 35-51 (2018).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados