Method Article
歯髄幹細胞の初代培養
要約
この記事では、外植片培養法を使用した歯髄幹細胞の初代培養を確立するための段階的なガイドと、ICSCRTガイドラインに基づくこれらの細胞の特性評価について説明します。このプロトコルによって単離された細胞は、さらなるアプリケーションのための間葉系幹細胞と見なすことができます。
要約
ヒトの歯髄は、抜歯した歯から採取できる卓越した再生能力を備えた有望な多能性幹細胞リザーバーです。歯髄幹細胞(DPSC)の神経堤由来の外部間葉系起源は、組織の修復と再生におけるその多面的な利点に起因する高度な可塑性をもたらします。成体幹細胞を回収、維持、増殖させるための実用的な方法が数多くあり、再生医療での使用が検討されています。本研究では、外植片培養法による歯科組織からの初代間葉系幹細胞培養の確立を実証する。単離された細胞は紡錘形をしており、培養プレートのプラスチック表面に付着していました。これらの幹細胞の表現型の特徴付けは、CD90、CD73、CD105などのMSCの国際細胞治療学会(ISCT)が推奨する細胞表面マーカーの陽性発現を示しました。さらに、造血マーカー(CD45)および内皮マーカー(CD34)の発現はごくわずかであり、HLA-DRマーカーの発現は2%未満であり、DPSC培養の均一性と純度が確認されました。さらに、脂肪形成系、骨形成系、軟骨形成系への分化に基づいて、それらの多能性を示しました。また、これらの細胞を対応する刺激媒体を添加することにより、肝臓様細胞および神経細胞様細胞に分化するように誘導しました。この最適化されたプロトコルは、実験室や前臨床試験に利用される間葉系幹細胞の高度に拡張可能な集団の培養に役立ちます。同様のプロトコルは、DPSCベースの治療を実践するための臨床セットアップに組み込むことができます。
概要
成体幹細胞は、その可塑性、パラクリンメカニズム、および免疫調節特性により、細胞指向治療および治療のための強力な治療ツールに成長しました1,2,3。幹細胞を用いた前臨床試験から得られた有望なデータは、研究者がベンチからベッドサイドへの翻訳に取り組むきっかけとなりました。幹細胞治療に使用される幹細胞の種類は、成功した結果に重要な役割を果たします。前臨床試験および臨床試験において、間葉系幹細胞(MSC)の最も広く報告されている供給源は依然として骨髄です4,5。しかし、骨髄由来幹細胞(BMSC)を使用することの主な欠点は、その希少な集団、単離のための高侵襲的な手順、および増殖能力が限られていることです。したがって、MSCの代替供給源が調査されています。この点で、歯科組織は、そのアクセスの容易さ、巨大な可塑性、高い再生能力、および高い増殖能力により、現在、幹細胞6,7,8,9,10の豊富で潜在的な代替供給源と見なされています。
歯髄幹細胞(DPSC)は、2000年にGronthosによって単離され、特徴付けられた最初のタイプの歯科幹細胞でした11。DPSCは、その高い増殖率、有意な差別化の可能性、容易な培養によるアクセスの容易さ、そして最も重要なこととして、倫理的な懸念なしに廃棄された歯から得られる能力により、組織工学の応用で注目を集めています12。BMSCや脂肪由来幹細胞(ADSC)などの他の幹細胞源が単離し、自己複製能力が不十分であるという制限は、DPSCによって回避されます13。ヒトDPSCは、ヒトの乳歯、永久歯、親知らず、剥離した乳歯(SHED)、および頂端乳頭から取得できます。さらに、DPSCは、一般的に廃棄される過剰な歯からも分離することができます14。DPSCは神経堤関連マーカーを発現し、in vitroおよびin vivoの両方で神経細胞に分化する可能性を秘めています15。その神経原性の可能性に加えて、DPSCは、特定の分化条件が与えられると、骨形成性、軟骨形成性、脂肪形成性、肝臓性、および筋原性などの他の細胞系統に分化することができる13。したがって、これらの多能性細胞は、細胞ベースの治療に大きな可能性を秘めており、さまざまな組織の再生に使用できます。また、角膜の再建16、心筋梗塞の修復17、四肢虚血18、アルツハイマー病19、パーキンソン病20、老化21などの疾患におけるDPSCの潜在的な治療的役割についても、研究報告されています。したがって、歯科組織由来幹細胞は、歯科の再生だけでなく、目16、心臓17、肝臓22、骨23などの非歯科臓器の修復および再生にも使用できる。
髄組織からMSC集団を単離するための2つの特定の方法があります - 酵素消化と外植片培養24,25。DPSCの量と特性に大きな違いを伴わない初代培養の成功した確立は、これらの両方の方法によって報告されています26。この研究では、外植片法によるDPSCの単離に焦点を当てました27、なぜなら、この方法は造血細胞および内皮細胞の汚染なしにDPSCを生成するため、線維芽細胞の汚染をもたらす可能性のある酵素消化と比較して28。
プロトコル
この研究に記載されているすべての手順は、チャンディーガルのPGIMERの研究所倫理委員会(IEC#9195 / PG-12 ITRG / 2571-72)によって承認されています。細胞培養に関連するすべての実験は、無菌技術に従ってクラスII生物学的安全キャビネット(BSC)で実施する必要があります。歯髄は、歯列矯正上の理由で第三大臼歯抜歯を受けた3人(F / 14、M / 14、およびM / 20)の患者の健康な歯から採取されました。サンプル収集の前に、チャンディーガルの PGIMER の倫理委員会が提供するガイドラインに従って、患者/保護者から書面によるインフォームド コンセントが得られました。
1. ヒト歯科組織からの歯髄幹細胞(DPSC)の初代培養の確立
注:虫歯は使用しないでください。
- 歯髄サンプルの収集と組織培養ラボへの輸送
- 非外傷性および無菌条件下で抜歯手順を実行します。抜歯した歯を滅菌生理食塩水で十分にすすぎ、血液の残りを取り除きます。
- 抜歯した歯を超硬亀裂バーを使用して縦に2つに切断し、滅菌生理食塩水で一定の灌漑を行い、歯髄を露出させます。
- 抜歯した歯と無傷の歯髄を、氷上に保持された無菌α最小限の必須培地(α-MEM)に入れて、細胞および組織培養ラボに輸送します。
注:理想的には、受け取ったすべてのサンプルを細胞培養のために2時間以内に処理します。しかし、最近の報告では、24時間後でも歯のサンプルを処理してもDPSCの生存率と増殖に影響を与えなかったが、その機能を低下させたことが示唆されている29。
2. 歯からの歯髄組織の除去とDPSCの細胞培養(時間:60-120分)
注:歯の輸送後のすべてのステップは、バイオセーフティキャビネットレベル2内の細胞および組織培養ラボで行われています。
- 歯のサンプルを滅菌培養シャーレに置き、1x滅菌リン酸緩衝生理食塩水(PBS)溶液で十分にすすぎます(3〜4回)。
- 鋭利な掘削機と鉗子の助けを借りて、歯髄腔から歯髄組織を慎重に取り除きます。
- 果肉を取り除いたら、滅菌PBSで完全に洗浄し、血液の残りを取り除きます。
- ペトリ皿の中の外科用刃の助けを借りて、歯髄組織を約2〜3mmの小片に切断します。
- 各領域に1〜2mLの滅菌PBSを入れて、皿の表面積を4つの部分に分割します。歯髄組織サンプルをPBSで1つの領域に入れ、外科用ブレードで組織を可能な限り最小の断片に切断します(断片が小さいほど、幹細胞が組織から移動しやすくなります)。この後、各ピースをPBSで別の領域に持ち上げて、4番目の領域まで移動させ、ティッシュピースが適切に洗浄され、汚染物質がなくなるようにします。
- その間、約0.8〜1mLの非必須アミノ酸を含むα-MEMを10%ウシ胎児血清(FBS)および抗生物質カクテル(すなわち、ペニシリンおよびストレプトマイシン)を6ウェルプレートのウェルに注ぎます。プレートを動かしてメディアを均一に分散させ、ウェル表面に均一に広げます。
- 鉗子の助けを借りてパルプ組織または外植片の小片を6ウェルプレートの単一のウェル(ウェルあたり4〜6個)に播種し、バイオセーフティフード内でプレートを5分間邪魔しないようにします。
注:このステップにより、培養プレートの処理された表面への組織/外植片の接着が可能になります/補助されます。 - 培養プレートを37°Cの温度と5%CO2 レベルの加湿雰囲気に維持します。
- 翌日、外植片を乱さずにウェルから培地を慎重に吸引し、それに新鮮な培地を追加します。このステップでは、乾燥を防ぐために、メディアを隔日で交換します。インキュベーターのトレイに十分な水があることを確認し、余分な蒸発によってプレートウェル内の培地が乾燥しないようにします。
注:これは非常に重要なステップであり、外植片がその位置から外れると、外植片が外れる可能性があります。メディアの移し替え中に外植片がその位置から外れた場合は、メディアを完全に取り外してウェル表面に接着させて、外植片を再度取り付けてみてください。培地は、外植片を乱さずに井戸の壁に沿って慎重に追加する必要があります、さもなければそれらは再び剥がれるかもしれません。倒立顕微鏡(4倍または10倍)で細胞培養プレートを定期的に観察します。DPSCは、プラスチック表面に付着する能力と紡錘形の形態によって識別します。 - 十分な細胞が外植片から移動したら、組織を取り出し、細胞を増殖させて最適な70%〜75%の細胞合流に達するのを待ってから、継代培養します。このステップで10%FBSを含むα-MEMの容量を2 mLまで増やすことで、細胞がより速く分裂できるようになります。この段階では、3日ごとにメディアを交換してください。
3. DPSCの拡張
- DPSCのコンフルエントT75培養フラスコ(コンフルエント:70%-80%)をPBS(10mL)で2回洗浄します。
- 2.5 mLの0.25%トリプシン-エチレンジアミン四酢酸(EDTA)をT75フラスコの側面に加え、トリプシン-EDTAがDPSCの細胞シート全体または単層を覆うように穏やかに渦巻かせます。
- フラスコをフード内に37°Cで3〜5分間保管します。3分後、フラスコを軽くたたいて、細胞の解離を確認します。
- 中和剤として5 mLの完全培地(α-MEM、10% FBS)または250 μLのFBS(使用したトリプシン量の10%)を添加して、トリプシン活性を不活性化します。解離したDPSCの全細胞懸濁液を、新鮮な15 mLコニカル遠心チューブに移します。
- 解離した細胞を500 x g で室温で2分間遠心分離し、細胞ペレットを得ます。
- ピペットを使用してすべての上清を吸引し、フラスコに5〜10 mLのPBSを加えて残りの細胞を収集し、穏やかなピペッティングでPBSで細胞を洗い流し、細胞を500 x g で2分間再度遠心分離します。必要に応じて繰り返します。
- 上清を慎重に除去し、穏やかなピペッティングを行った後、細胞ペレットを1 mLの完全培地(α-MEM with 10% FBS)に再懸濁して、シングルセル懸濁液を得ます。
- 細胞を分割し、等量で播種して、それぞれに10 mLの完全培地を含む2つのT75培養フラスコに播種します。フラスコをフードの内側に37°Cに保ちます。
- 翌日、メディアを吸引し、新しい完全なメディアと交換します。
注:トリプシン治療を延長すると、細胞表面タンパク質と細胞外マトリックスタンパク質を切断することにより、細胞の完全性、生存率、および細胞機能が損なわれる可能性があります。
4. 幹細胞表現型マーカーの同定(時間:90〜120分)
注:歯髄組織から採取した細胞の特性評価には、3番目と5番目の継代の間の細胞を使用してください。
- DPSC の 70%-80% (~3-4 x 106 細胞; 画像ベースのサイトメーターまたは血球計算盤を使用して細胞をカウント) 2 つのコンフルエント T75 培養フラスコを使用し、10 mL の PBS で細胞を 2 回洗浄します。
- 0.25%トリプシン-EDTAを2.5mL加え、フラスコをフード内に37°Cで3〜5分間保持します。中和剤として5 mLの完全培地または250 μLのFBS(使用したトリプシン容量の10%)を添加して、トリプシン活性を不活性化します。
- ピペットを使用して、15 mLの円錐形遠心チューブに細胞を採取します。解離した細胞を500 x g で室温で2分間遠心分離し、細胞ペレットを得ます。
- ピペットですべての上清を吸引し、フラスコにPBSを5 mL加えて残存細胞を採取し、穏やかなピペッティングでPBSで細胞を洗い流し、再び細胞を500 x g で2分間遠心分離します。
- 上清を慎重に除去した後、ペレットを1 mLのPBSに再懸濁し、穏やかなピペッティングを行って単一細胞懸濁液を得ます。
- 利用可能性に応じて、画像ベースのサイトメーターまたは血球計算盤を使用して細胞をカウントし、1 x 104 細胞/チューブの微量遠心チューブに細胞を分配します。細胞を0.5%-1%ウシ血清アルブミン(BSA)で0.5-1時間インキュベートします。
- 各チューブに、分化クラスター(CD)マーカー(CD90 [0.4 μg]、CD73 [0.8 μg]、CD105 [0.4 μg]、CD34 [0.8 μg]、CD45 [0.4 μg]、およびHLA-DR [0.08 μg])6,7,8,9用のフルオレセインイソチオシアネート抗体およびフィコエリトリン(PE)標識を1〜2 μL加え、室温で暗所で0.5時間インキュベートします。
- 0.5時間後、500 x g で5分間遠心分離することにより、細胞をペレット化します。上清を吸引し、細胞のペレットをPBSで洗い流し、再度遠心分離します。
- 遠心分離後、ペレットをPBS(200 μL/チューブ)に再懸濁し、細胞懸濁液をフローサイトメトリーチューブに移し、フローサイトメーターを使用して取得します。市販のソフトウェアを使用して、さまざまな抗体の陽性細胞の割合をさらに分析できます。
注意: 手順4.7から4.9は、室温の暗闇で実行する必要があります。適切なアイソタイプコントロールと未染色のサンプルを使用して、細胞のバックグラウンド蛍光を省略する必要があります。
5. DPSCの複数系統への分化
注:マルチポテンシーの評価には、3番目から5番目の継ぎでDPSCの75%〜80%のコンフルエント培養を使用してください。α-MEMを含むコントロールセルグループは、以下に説明するすべてのタイプの分化に使用する必要があります。
- DPSCの骨形成分化、アリザリン赤色染色、および定量
- ステップ4.2で説明したように、0.25%トリプシン-EDTAを使用してシングルセル懸濁液を調製し、細胞ペレットを完全なα-MEMに再懸濁します。
- 細胞をカウントし、0.4〜0.5 mLの完全培地を含む2 x 10 4細胞/ウェル細胞密度の2 x 104 細胞/ウェルで、37°Cおよび5%CO2で48時間播種します。
- 48時間後、培地をウェルから取り出し、0.4〜0.5 mLの骨形成誘導培地(すなわち、βグリセロリン酸[5 mM]、リン酸一カリウム[1.8 mM]、デキサメタゾンリン酸二ナトリウム[0.01 mM]などの骨形成誘導因子を含むα-MEM)8。骨形成誘導因子(コントロール培地)を含まない完全なα-MEMのみを含むコントロールウェル(非誘導細胞)を調製します。
注:50μMのアスコルビン酸の添加も、骨形成分化を促進すると報告されています30,31。3日おきに、誘導培地とコントロール培地を新鮮な培地と21日間(3週間)交換します。導入期間の終了時に、培地を培養プレートから取り出し、0.5 mLのPBSを加え、2回洗浄します。 - PBS洗浄後、細胞を10%中性緩衝ホルマリン(NBF)溶液0.5mLに室温で20〜30分間固定します。ヒューム/ケミカルフードで固定を行います。
- アリザリンレッド染色
- アリザリンレッドSの1 gを50 mLの二重蒸留水(ddH2O)に溶解し、塩酸(HCL)または水酸化アンモニウム(NH4OH)の助けを借りてpHを4.0〜4.2に調整することにより、アリザリンレッドS染色(2%)を調製します。濾紙で汚れをろ過します。汚れは暗所(4°C)に保管してください。
- 細胞を二重蒸留水(ddH2O)で2回洗浄し、アリザリンレッドS染色を加え、室温で30〜45分間インキュベートします。
- すべてのウェルから汚れを取り除き、細胞をddH2Oで4〜5回洗浄して、結合していない汚れを取り除きます。明視野顕微鏡を使用して画像をキャプチャします。
- 定量分析のためのアリザリン赤染色抽出
- 染色したウェル(0.4 mL/ウェル)に塩化セチルピリジニウム(CPC)緩衝液(pH 7.0)を添加し、細胞を37°Cで2時間インキュベートします。 さらに、細胞は、アリザリン赤色結晶32の適切な溶解のために、10%酢酸とインキュベートすることもできる。プレートをプレートロッカーまたはシェーカーに保管します。
- インキュベーション後、上清(抽出色素)を回収し、96ウェルプレートに移し、405nmでプレートまたはサンプルを読み取ります。空白の値を取得するには、CPC (同じボリューム) バッファーのみを追加し、32,33 を読み取ります。
6. DPSCの脂肪分化、オイルレッドO染色、定量
注:播種の最初のステップは上記と同じです(つまり、骨形成分化ステップ5.1)。
- 48時間後、培地をウェルから取り出し、0.4〜0.5 mLの脂肪原性誘導培地(すなわち、イソブチルメチルキサンチン[IBMX; 0.5 mM]、デキサメタゾン[1 μM]、インドメタシン[200 μM]、インスリン[10 μM]などの脂肪原性誘導因子を含むα-MEM)を加えます。誘導されていない細胞を含むコントロールウェルを調製します(すなわち、誘導因子なしでα-MEMのみで培養{コントロール培地])。
- 3日ごとに培地を補充し、細胞を3週間培養します。3週間後、培養プレートから培地を吸引し、0.5 mLのPBSを加えて細胞を2回洗浄します。
- PBS洗浄後、細胞を10%NBF溶液に室温で20〜30分間固定します。
- 細胞を二重蒸留水(ddH2O)で2回洗浄し、オイルレッドO染色を加え、室温で30〜40分間インキュベートします。
- すべてのウェルから汚れを取り除き、細胞を含むウェルをddH2Oで透明になるまで繰り返しすすぎます(2〜4回)。顕微鏡で観察し、画像を撮影します。
- 定量分析のためのオイルレッドO抽出
- 染色したウェルに0.4 mLの100% 2-プロパノールを加え、プレートを30分間適切に覆って室温でインキュベートします。プレートをプレートロッカーまたはシェーカーに置いておきます。
- インキュベーション後、上清を回収し、96ウェルプレートに移し、510nmでプレートまたはサンプルを読み取ります。ブランキングには100%2-プロパノールを使用してください。
7. DPSCの軟骨形成分化、アルシアンブルー染色、定量
注:軟骨形成分化は、DPSCの単層培養で誘導されました。播種の最初のステップは上記と同じです(つまり、骨形成の分化ステップ5.1)。
- 48時間後、培地をウェルから取り出し、0.4〜0.5mLの軟骨誘発培地(すなわち、軟骨原性分化に特異的な誘導因子を含むα-MEM、アスコルビン酸[0.2M]、ピルビン酸ナトリウム[1mM]、形質転換成長因子-β3[TGF-β3;10μM]、デキサメタゾン[1mM]、および1x ITSプレミックス[インスリン、トランスフェリン、およびセレン酸]10。誘導されていない細胞を含むコントロールウェルを調製します(すなわち、誘導因子[コントロール培地]を使用せずにα-MEMのみで培養します)。
- 3日ごとに培地を補充し、細胞を3週間培養します。導入期間終了後、培養プレートから培地を吸引し、0.5 mLのPBSを加えて細胞を2回洗浄します。
- PBS洗浄後、細胞を10%NBF溶液に室温で15〜20分間固定します。細胞を二重蒸留水(ddH2O)で2〜3回洗浄し、アルシアンブルー染色液を加え、室温で45分間インキュベートします。
- すべてのウェルから汚れを取り除き、続いて0.1 N HCLで2〜3回すすぎます。細胞を4回洗浄するか、ddH2Oで時間を与えます。
- 細胞のプロテオグリカン(青色)を顕微鏡で観察し、画像を撮影します。
- アルシアンブルーの定量では、6 M グアニジン-HCl を使用して色素を抽出し、595 nm の光学密度(OD)でサンプルを読み取ります。この研究で使用したアルシアンブルーキットは、軟骨中の酸性プロテオグリカンを染色し、軟骨細胞のマトリックスに存在する硫酸化グリコサミノグリカン(GAG)に特異的に結合します10。
8. DPSCの肝臓様系統への分化と特性評価
- 上記のようにトリプシン処理により細胞の単一細胞懸濁液を作製し、細胞ペレットを完全なα-MEMに再懸濁します。
- 細胞をカウントし、2 x 104 細胞/ウェルで24ウェル処理した培養プレートに播種し、0.4〜0.5 mLの完全培地を48時間含みます。
- 48時間後、培地をウェルから取り出し、細胞を肝臓誘導培地と14日間インキュベートします。導入培地は、デキサメタゾン(0.5 μM)、上皮成長因子(EGF; 2 ng/mL)、ITS+ プレミックス(50 mg/mL)、および肝細胞成長因子 (HGF; 20 ng/mL) 6 を含む低グルコース ダルベッコの修飾イーグル培地 (DMEM) で構成されています。
- 14日後、培地をさらに14日間熟成培地(オンコスタチンM[OSM;20 ng/mL]、ITSプレミックス[50 mg/mL]、およびデキサメタゾン[0.5 μM ]を添加したα-MEM)と交換します6。3日ごとに新しいメディアをメディアに補充します。
- 免疫組織化学分析と低密度リポタンパク質(LDL)アッセイを実施して、肝臓様分化を確認します。
- LDLの取り込みとLDL受容体の免疫蛍光染色
注:分化後の肝細胞様細胞は、キットの指示に従ってLDL取り込みアッセイキットによって特徴付けられました。LDL-550蛍光色素は、生状態での分化細胞におけるLDL取り込みの評価に使用され、LDL受容体抗体は、固定後の分化細胞におけるLDL受容体の検出に使用されました。- 分化後、生細胞をLDL-550(1:100)で3〜4時間染色します。3〜4時間後、染色溶液を培地に交換し、ヨウ化プロピジウム(PI)励起波長と発光波長がそれぞれ537nmと617nmの蛍光顕微鏡でLDLの取り込みを観察します。
- 細胞を固定液中で10分間固定します。細胞固定後、ブロッキング溶液中で細胞を30分間ブロックします。
- 細胞を一次LDL受容体抗体と1時間インキュベートし、1x PBSで3回洗浄した後、暗所で488二次抗体(1:100)と1時間インキュベートします。
- 細胞をPBSで3回洗浄し、余分な二次抗体を除去します。核染色として4',6-ジアミジノ-2-フェニルインドール(DAPI)を添加します。
- 蛍光顕微鏡で細胞を観察します。DAPI、PI、FITCの励起/発光範囲の波長を測定できる蛍光顕微鏡で画像を撮影します。
注:シングルセル強度パラメータを記録して、LDL受容体抗体の発現とLDL取り込みを定量化できます。免疫蛍光染色には、二次抗体のみから生じるバックグラウンド蛍光を省略するために、適切な二次抗体コントロールを使用する必要があります。
- LDLの取り込みとLDL受容体の免疫蛍光染色
9. DPSCの神経分化による神経細胞様系統への同定とキャラクタリゼーション
- 細胞のプレーティング後、上述したように、細胞をα-MEMで48時間培養する。
- 培地を吸引し、0.5% G5 サプリメント、0.2% N2 サプリメント、20 ng/mL 上皮成長因子、20 ng/mL 塩基性線維芽細胞成長因子、B27 サプリメント (1%) などの成長因子を含む神経基礎培地と交換します。この培地で細胞を25〜41日間培養します7.
- 細胞による代謝に応じて、2日または3日ごとに培地を交換します。効率的なニューロンの成熟とより多くの微小管関連タンパク質-2(MAP-2+)ニューロンを達成するには、ニューロン誘導段階(14日)後にEGFおよび線維芽細胞成長因子2(FGF2)を除去します。
注:時間の経過とともに、また培地交換を繰り返した後、分化したニューロンは接着性が低いためにプレートウェルからの剥離を示すことがあり、その結果、長期培養でニューロンが失われます。これを回避するには、プレートウェルをラミニンまたはフィブロネクチン(オプション)でコーティングします。 - 免疫組織化学解析を行い、ニューロン様分化を確認します。
- 分化したDPSCの免疫染色
注:DPSCのニューロン様分化を確認するために、神経原性系統特異的タンパク質であるMAP-2およびニューロフィラメント(NFM)抗体を用いて、分化した細胞で免疫細胞化学を行った7。- 分化が完了したら、培地を取り出します。PBSを追加し、プレートを静かに回転させ、ピペットを使用してPBSを取り外します。この手順を繰り返します。
- 10%NBFまたは4%パラホルムアルデヒドを使用して、室温で20〜30分間細胞を固定します。
- 固定液を取り出し、細胞を1x PBSで2〜3回洗浄します。透過処理溶液(Triton-X-100;0.1%)を添加し、細胞を5分間インキュベートします。
- PBS洗浄を2〜3回行い、0.5%-1%ブロッキング剤(BSA)で細胞を37°Cで1時間または4°Cで一晩ブロックします。 ブロッキング剤を取り外し、細胞を1x PBSで洗浄します。
- 一次抗体(0.1% BSA、NFM [1:50]、およびMAP-2 [1:200]で調製)を使用して細胞を一晩インキュベートします。
- 一次抗体を取り出し、細胞を1x PBSで3〜4回洗浄して、未結合の抗体を除去します。
- 二次抗体(ウサギ抗マウス1:2,000)を添加し、暗所で室温1.5-2時間インキュベートします。細胞をPBSで洗浄します(2〜3回)。
- DAPIで細胞を10分間インキュベートし、再度PBSで洗浄します。サンプルの乾燥を避けるために、残留量を保管してください。蛍光顕微鏡で観察します。
注:さらに、核型の安定性10 および老化特性評価も実施して、細胞の純度および機能性についてよりよく理解することができます。
- 分化したDPSCの免疫染色
結果
ここでは、研究者がエクスプラント法6,7,8,9,10を用いてDPSCの純粋な培養を確立し、それらを複数の系統に誘導して、下流のアプリケーションのための培養の純度を確立する方法について説明します。
図1Aに示すように、患者の第三大臼歯から抽出した歯髄の小さな組織からDPSCの初代培養を確立しました。当初、外植片播種後4日目と5日目に、外植片または組織のすぐ近くで丸みを帯びた細胞はほとんど観察されませんでした。しかし、12日目までに外植片から出てきた細胞の数が増え、2週目の終わり(14日〜16日)には、ほとんどの外植片が紡錘形の形態を持つ多くの接着細胞に囲まれるようになりました。この時点で、外植片をプレートから除去することができ、細胞を完全な培地の存在下で増殖させることができました。70%-75%のコンフルエンスに達した後(3週目)、細胞を継代培養し、さらなる実験セットアップのために増殖させた。エクスプラント法により、MSC CDマーカーCD90、CD105、CD73が陽性で、他の細胞タイプである内皮細胞マーカーCD34および造血細胞マーカーCD45のほぼ無視できる細胞集団を含む幹細胞の均一な培養が得られました(図1B)。
また、DPSCは、骨細胞の石灰化顆粒におけるアリザリンレッド染色の陽性取り込みによって明らかなように骨形成系統の細胞、分化した脂肪細胞の脂肪滴によるオイルレッドO染色の取り込みによって示される脂肪形成系統、および陽性のアルシアンブルー染色によって示される軟骨形成系統への分離に成功しました(図2).DPSCはまた、典型的な立方体の形態と生細胞(図3A)染色によるLDL-550の取り込みによって明らかなように、肝臓様系統への効率的な分化を示しました。分化した肝細胞様細胞を固定し、LDL受容体抗体で染色しました。 図3B は、LDL−550と共に分化した肝細胞様細胞におけるLDL受容体の陽性発現を示す。また、DPSCは、典型的なニューロンタンパク質であるMAP-2およびNFMの陽性染色が示すように、ニューロン様細胞に分化する顕著な能力を示しました(図4)。一言で言えば、私たちの研究は、DPSCを純粋な集団として分離および培養し、幹細胞マーカーの純度が>95%で、細胞治療、薬物試験、疾患モデリングなどのさらなる下流アプリケーションのためにさまざまな系統に分化できることを示しています。

図1:DPSCの一次培養(A)。DPSC初代培養の発達のさまざまな段階を示す微分干渉コントラスト(DIC)画像:1)播種2日目に歯の組織から丸みを帯びた泡タイプの細胞が出てくる最初の出芽段階での外植片。2)4日目に組織から出てくる細胞の混乱したネットワークの確立。3)13日目に合流点で完全な紡錘形の形態を持つ細胞と、組織除去後の培養皿の全面を覆う細胞。スケールバー = 100 μm, (B).DPSCにおける幹細胞マーカーの正の発現と非幹細胞マーカーの負の発現を示すヒストグラムと棒グラフを用いたフローサイトメトリーによる幹細胞マーカーの特性評価(n = 3)。各実験は、少なくとも3回、三重に繰り返された。この図の拡大版を表示するには、ここをクリックしてください。

図2:DPSCの多系統分化。 DPSCにおける骨分化後のアリザリン赤色染色、脂肪分化後のオイルレッドO染色、および軟骨分化後のアルシアンブルー染色を示す明視野顕微鏡画像。各実験は、少なくとも3回、三重に繰り返された。 この図の拡大版を表示するには、ここをクリックしてください。
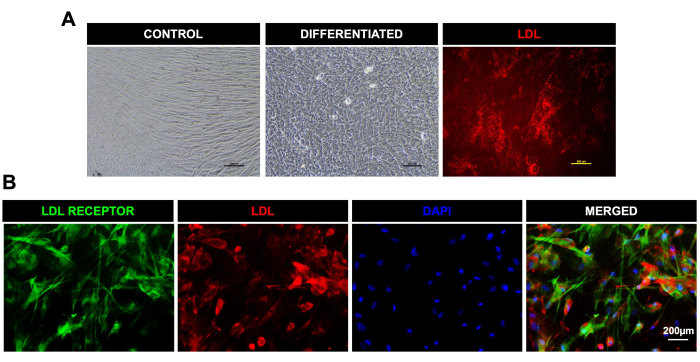
図3:DPSCの肝細胞様細胞への分化とLDLの取り込み。 (A). DPSCから分化したコントロールおよび肝臓様細胞のための光学顕微鏡画像。右端の最後の画像は、生きた分化細胞でのLDLの取り込みを示しています。(B).肝分化後のDPSCにおけるLDL受容体の発現(緑)とLDL-550(赤)(固定細胞)の取り込みを示す蛍光顕微鏡画像。DAPIは核の汚れとして使われた。スケールバー = 200 μm (n = 3)。各実験は、少なくとも3回、三重に繰り返された。 この図の拡大版を表示するには、ここをクリックしてください。
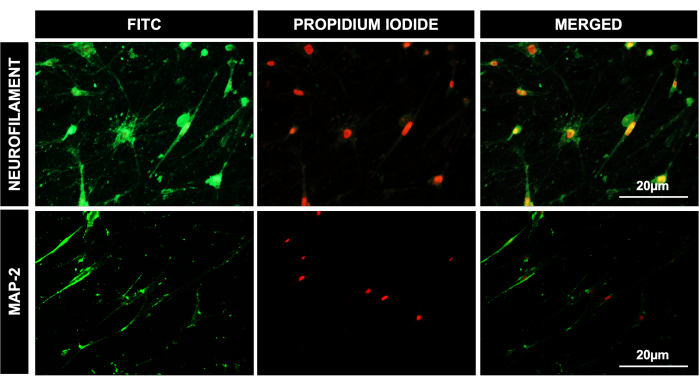
図4:DPSCのニューロン系統への分化。 神経分化の41日後のDPSCの蛍光顕微鏡画像、神経系統特異的抗体のニューロフィラメントとMAP-2の陽性発現を示す。PIは核染色として使用されました。スケールバー = 20 μm (n = 3)。各実験は、少なくとも3回、三重に繰り返された。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
幹細胞は、その可塑性、堅牢性、免疫調節特性、パラクリンメカニズム、ホーミング効率により、多くの病気を治癒する望みを抱いてきました。歯髄組織は、幹細胞の最も強力で貴重な供給源と考えられており、優れた可塑性と再生能力を備えています。ここでは、広く採用されている外植片培養法を用いて、細胞が歯髄組織または外植片から移動して、紡錘形の線維芽細胞様細胞に形態学的に似た均質な細胞培養に成長するDPSCの単離を実証します。外植片法は、DPSCの培養34のための酵素的手順中に残る内皮細胞および周皮細胞のような他の細胞型を欠く、DPSCのより均一な培養をもたらす。 エクスプラント法により得られたDPSCは、CD90、CD73、CD105などのISCT推奨間葉系細胞表面CDマーカーを発現することを示しました。また、CD45、CD34、HLA-DRマーカー発現細胞を欠いており、これはDPSC培養の均一性と純度を示しています。また、HLA-DRがないため、移植目的にも適しており、拒絶反応の可能性は最小限に抑えられています。DPSC培養の効率と純度を確保するためのプロトコルには、いくつかの重要なステップがあります。外植片は、汚染を避けるために、培養プレートに入れる前にPBSで少なくとも4回洗浄する必要があります。また、外植片は、分離した外植片が細胞を生じさせないため、培養井の表面によく付着する必要があります。したがって、培地交換時の外植片の取り扱いには細心の注意を払う必要があります。培地は、外植片を乱さないように、井戸の角に沿って慎重に滴下する必要があります。プレートウェルで細胞が増殖したら、周囲の細胞を傷つけないように、先端を使用して組織片を慎重に除去する必要があります。プレートウェルからの最初の継代でDPSCを回収する際には、細胞が非常に少なく、遠心分離後のチューブ内に見える細胞ペレットが見えなくなることがあります。また、一部の細胞は遠心分離管の壁にくっついているため、アップスケーリングプロセス中に細胞を取得するのが難しくなります。カルチャープレートと15mLチューブをPBSでよくすすぎ、できるだけ多くの細胞を回収するように注意する必要があります。すべての細胞ベースの分化実験は、継代数が8番未満のDPSCで実施する必要があります。継代が高いと、遺伝的異常や自然分化の蓄積につながり、結果に影響を与える可能性があるためです。
また、このプロトコルにはいくつかの制限があります。外植片の培養は遅いプロトコルであり、培養の15-20日後にのみ十分な細胞を産出する。その間、汚染のリスクがあり、外植片(歯髄片)がプレート表面から剥がれてしまい、後で細胞が生成されなくなります。したがって、メディアを交換する際には細心の注意を払う必要があります。また、歯には口腔内の微生物叢が豊富に含まれており、適切な洗浄が行われないと培養物が汚染される可能性が非常に高いため、外植片を播種する前にPBS洗浄を繰り返すことが重要です。ヒトDPSCは、起源が外胚葉性であり、歯の発達中です。それらは神経堤から移動し、後に間葉系細胞に分化します。これは、彼らに中胚葉系と外胚葉系の両方の系統の特別な特性を与えます34。Arthurらは、神経堤由来の細胞は神経分化の素因があると仮定しました35。DPSCの自発的な神経分化もKimらによって報告されました.36。別の研究では、遠位C末端L型電位依存性カルシウムチャネルが、DPSCにニューロン表現型37を達成するように指示する潜在的な役割が示されています。以前、私たちの研究室では、これらのDPSCを-80°Cで5年間保存することにより、これらのDPSCの凍結保存効率を実証しました10。これらの細胞は、幹細胞性、増殖、分化能力を維持し、構造的または数値的な異常なしに安定した核型を維持することができました。また、比較解析では、当研究室では、DPSCがBMSCと比較して神経原性7 系統と骨形成8 系統に対して優れた傾向を示していることも示されました。その優れた能力と骨形成および神経系統への遺伝的傾向により、これらの細胞は骨障害および神経変性疾患の幹細胞治療に最適な候補となっています。
全体として、ここでは、幹細胞マーカーの発現と多系統分化能力によって明らかなように、外植片法によってDPSCの純粋な集団を得るための効率的なプロトコルについて説明します。
開示事項
著者は、金銭的または非金銭的な利益相反を宣言しません。
謝辞
私たちは、インド政府ICMRの保健研究省(DHR)からAKへの資金援助に感謝します(DHR-NRI助成金#R.12015/01/2022-HR)。SRはICMR、インド政府(Grant # 2020-7593/SCR-BMS)から資金提供を受けており、PSはCSIR、インド政府からフェローシップを受けています。また、フローサイトメトリーの支援を提供してくださったSandhya Tokhi氏とBhupinder Kaur氏、インフラストラクチャのサポートを提供してくださったCentral Sophisticated Instrumentation Core(CSIC)とチャンディーガルのPGIMERにも感謝しています。
資料
| Name | Company | Catalog Number | Comments |
| 6 well cell culture plate | Costar | 3516 | For cell culture |
| Alcian blue stain | EZstain chondrocyte staining kit, HiMedia | CCK029 | |
| alizarin red S stain | Sigma-Aldrich | TMS-008 | Osteogenic stain |
| Antibiotic cocktail | Himedia | A002-5X50ML | To prevent culture contamination |
| Ascorbic Acid | Himedia | TC094-25G | Chondrogenic induction |
| B27 supplement | Gibco | 17504044 | For neural induction |
| bFGF ( basic Fibroblast Growth Factor) | Gibco | PHG0024 | For neural induction |
| CD 105 | BD-Pharmingen | 560839 | |
| CD 35 | Biolegend | 343604 | |
| CD 45 | Biolegend | 304006 | |
| CD 73 | Biolegend | 344016 | |
| CD 90 | Biolegend | 328107 | Characterization |
| cetyl pyridinium chloride (CPC) | Sigma-Aldrich | 1104006 | For Alizarin Red extraction |
| Dexamethasone 21-phosphate disodium | Sigma-Aldrich | D1159-100MG | |
| Dulbecco's Phosphate Buffered Saline | Himedia | TS1006-5L | For washing purpose |
| EGF (Epidermal Growth Factor) | Gibco | PHG0311 | For hepatic and neural induction |
| EVOS LED microscope | Invitrogen | For fluorescence imaging | |
| EZ stain Chondrocyte staining kit | Himedia | CCK029-1KT | Chondro stain Kit |
| FACS Canto flow cytometer | BD Biosciences | For cell characterization | |
| Fetal Bovine Serum | Gibco | 16000044 | For primary culture |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | For cell culture |
| G5 supplement | Gibco | 17503012 | For neural induction |
| HGF( Hepatocyte Growth Factor) | Sigma-Aldrich | H1404 | For hepatic Induction |
| HLA-DR | Biolegend | 307605 | |
| Human TGF-β3 | Peprotech | #100-36E-10U | |
| Insulin-Transferrin-Selenous acid premix | Sigma-Aldrich | I3146 | For hepatic Induction |
| ITS premix | Corning | 354350 | |
| LDL Uptake Assay kit | Abcam | ab133127 | For hepatic characterization |
| Low glucose DMEM | Gibco | 11885-084 | For hepatic induction |
| MAP2 antibody | Sigma-Aldrich | M4403 | For neural characterization |
| N2 supplement | Gibco | 17502048 | For neural induction |
| Neural Basal Media | Gibco | 21103049 | For neural induction |
| NFM antibody | Sigma-Aldrich | N4142 | For neural characterization |
| Nikon Elipse TS100 microscope | Nikon | For fluorescence imaging | |
| Oil Red O | Sigma-Aldrich | 01391-250Ml | Adipogenic stain |
| Oncostatin M | R&D Systems | 295-OM-010/CF | For hepatic Induction |
| Petridish | Tarson | 460090-90MM | For tissue cutting |
| Potassium phosphate monobasic | Sigma-Aldrich | 15655-100G | Osteogenic induction |
| Propan-2-ol | Thermo Fisher | Q13827 | For Oil Red O extraction |
| Sodium pyruvate solution | Sigma life sciences | S8636-100ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | For cell passaging |
| Whatman filter paper | merck | WHA1001325 | filter paper |
| α- Minimum Essential Media (α-MEM) | Sigma-Aldrich | M0643-10X 1L | Media for primary culture |
| β-glycerophosphate disodium salt hydrate | Sigma-Aldrich | G9422-50G |
参考文献
- Bhattacharyya, S., Kumar, A., Lal Khanduja, K. The voyage of stem cell toward terminal differentiation: a brief overview. Acta Biochimica et Biophysica Sinica. 44 (6), 463-475 (2012).
- Prentice, D. A. Adult stem cells. Circulation Research. 124 (6), 837-839 (2019).
- Raik, S., Kumar, A., Bhattacharyya, S. Insights into cell-free therapeutic approach: Role of stem cell "soup-ernatant". Biotechnology and Applied Biochemistry. 65 (2), 104-118 (2018).
- Rodriguez-Fuentes, D. E., et al. Mesenchymal stem cells current clinical applications: a systematic review. Archives of Medical Research. 52 (1), 93-101 (2021).
- Yamazaki, K., Kawabori, M., Seki, T., Houkin, K. Clinical trials of stem cell treatment for spinal cord injury. International Journal of Molecular Sciences. 21 (11), 3994(2020).
- Kumar, A., et al. Molecular spectrum of secretome regulates the relative hepatogenic potential of mesenchymal stem cells from bone marrow and dental tissue. Scientific Reports. 7 (1), 15015(2017).
- Kumar, A., Kumar, V., Rattan, V., Jha, V., Bhattacharyya, S. Secretome cues modulate the neurogenic potential of bone marrow and dental stem cells. Molecular Neurobiology. 54 (6), 4672-4682 (2017).
- Kumar, A., Kumar, V., Rattan, V., Jha, V., Bhattacharyya, S. Secretome proteins regulate comparative osteogenic and adipogenic potential in bone marrow and dental stem cells. Biochimie. 155, 129-139 (2018).
- Kumar, A., Bhattacharyya, S., Rattan, V. Effect of uncontrolled freezing on biological characteristics of human dental pulp stem cells. Cell Tissue Bank. 16 (4), 513-522 (2015).
- Raik, S., et al. Assessment of post-thaw quality of dental mesenchymal stromal cells after long-term cryopreservation by uncontrolled freezing. Applied Biochemistry and Biotechnology. 191 (2), 728-743 (2020).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Tsutsui, T. W. Dental pulp stem cells: advances to applications. Stem Cells and Cloning. 13, 33-42 (2020).
- Huang, G. T. -J., Gronthos, S., Shi, S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. Journal of Dental Research. 88 (9), 792-806 (2009).
- La Noce, M., et al. Dental pulp stem cells: state of the art and suggestions for a true translation of research into therapy. Journal of Dentistry. 42 (7), 761-768 (2014).
- Xiao, L., Tsutsui, T. Characterization of human dental pulp cells-derived spheroids in serum-free medium: stem cells in the core. Journal of Cellular Biochemistry. 114 (11), 2624-2636 (2013).
- Kumar, A., Yun, H., Funderburgh, M. L., Du, Y. Regenerative therapy for the cornea. Progress in Retinal and Eye Research. 87, 101011(2022).
- Gandia, C., et al. Human dental pulp stem cells improve left ventricular function, induce angiogenesis, and reduce infarct size in rats with acute myocardial infarction. Stem Cells. 26 (3), 638-645 (2008).
- Yong, Z., et al. Comparison of the angiogenic ability between SHED and DPSC in a mice model with critical limb ischemic. Tissue Engineering and Regenerative Medicine. 19 (4), 861-870 (2022).
- Zhang, X. M., et al. Therapeutic potential of dental pulp stem cell transplantation in a rat model of Alzheimer's disease. Neural Regeneration Research. 16 (5), 893-898 (2021).
- Kabir, R., et al. Imperative role of dental pulp stem cells in regenerative therapies: a systematic review. Nigerian Journal of Surgery. 20 (1), 1-8 (2014).
- Kumar, A., et al. Dental pulp stem cell secretome ameliorates d-galactose induced accelerated aging in rat model. Cell Biochemistry and Function. 40 (5), 535-545 (2022).
- Hirata, M., et al. Multifaceted therapeutic benefits of factors derived from dental pulp stem cells for mouse liver fibrosis. Stem Cells Translational Medicine. 5 (10), 1416-1424 (2016).
- Fujii, Y., et al. regeneration by human dental pulp stem cells using a helioxanthin derivative and cell-sheet technology. Stem Cell Research & Therapy. 9 (1), 24(2018).
- Ferrua, C. P., et al. How has dental pulp stem cells isolation been conducted? A scoping review. Brazilian Oral Research. 31, e87(2017).
- Pilbauerova, N., Soukup, T., Suchankova Kleplova, T., Suchanek, J. Enzymatic isolation, amplification and characterization of dental pulp stem cells. Folia Biologica. 65 (3), 124-133 (2019).
- Tatullo, M., Marrelli, M., Shakesheff, K. M., White, L. J. Dental pulp stem cells: function, isolation and applications in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 1205-1216 (2015).
- Hilkens, P., et al. Effect of isolation methodology on stem cell properties and multilineage differentiation potential of human dental pulp stem cells. Cell and Tissue Research. 353 (1), 65-78 (2013).
- Hendijani, F. Explant culture: An advantageous method for isolation of mesenchymal stem cells from human tissues. Cell Proliferation. 50 (2), e12334(2017).
- Aryal Ac, S., Islam, M. S., Samsudin, A. R. Investigation of the effect of a time delay on the characteristics and survival of dental pulp stem cells from extracted teeth. Archives of Oral Biology. 119, 104896(2020).
- Langenbach, F., Handschel, J. Effects of dexamethasone, ascorbic acid and β-glycerophosphate on the osteogenic differentiation of stem cells in vitro. Stem Cell Research & Therapy. 4, 117(2013).
- Jaiswal, N., Haynesworth, S. E., Caplan, A. I., Bruder, S. P. Osteogenic differentiation of purified, culture-expanded human mesenchymal stem cells in vitro. Journal of Cellular Biochemistry. 64 (2), 295-312 (1997).
- Bernar, A., Gebetsberger, J. V., Bauer, M., Streif, W., Schirmer, M. Optimization of the alizarin red S assay by enhancing mineralization of osteoblasts. International Journal of Molecular Sciences. 24 (1), 723(2022).
- Coe, C. L., Lubach, G. R., Schneider, M. L., Dierschke, D. J., Ershler, W. B. Early rearing conditions alter immune responses in the developing infant primate. Pediatrics. 90, 505-509 (1992).
- Bakopoulou, A., et al. Assessment of the impact of two different isolation methods on the osteo/odontogenic differentiation potential of human dental stem cells derived from deciduous teeth. Calcified Tissue International. 88 (2), 130-141 (2011).
- Arthur, A., Rychkov, G., Shi, S., Koblar, S. A., Gronthos, S. Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues. Stem Cells. 26 (7), 1787-1795 (2008).
- Kim, B. C., et al. Osteoblastic/cementoblastic and neural differentiation of dental stem cells and their applications to tissue engineering and regenerative medicine. Tissue Engineering. Part B, Reviews. 18 (3), 235-244 (2012).
- Ge, J., et al. Distal C terminus of CaV1.2 channels plays a crucial role in the neural differentiation of dental pulp stem cells. PLoS One. 8 (11), e81332(2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved