Method Article
Cultivo primario de células madre de pulpa dental
En este artículo
Resumen
Este artículo proporciona una guía paso a paso para establecer un cultivo primario de células madre de pulpas dentales utilizando el método de cultivo de explantes y la caracterización de estas células basada en las directrices del ICSCRT. Las células aisladas por este protocolo pueden considerarse como células madre mesenquimales para aplicaciones posteriores.
Resumen
La pulpa dental humana representa un prometedor reservorio de células madre multipotente con una competencia regenerativa preeminente que se puede extraer de un diente extraído. El origen ectomesenquimal derivado de la cresta neural de las células madre de la pulpa dental (DPSC) otorga un alto grado de plasticidad que se debe a sus beneficios multifacéticos en la reparación y regeneración de tejidos. Existen varias formas prácticas de recolectar, mantener y proliferar células madre adultas que se están investigando para su uso en medicina regenerativa. En este trabajo, demostramos el establecimiento de un cultivo primario de células madre mesenquimales a partir de tejido dental mediante el método de cultivo de explantes. Las células aisladas tenían forma de huso y se adherían a la superficie plástica de la placa de cultivo. La caracterización fenotípica de estas células madre mostró una expresión positiva de los marcadores de superficie celular recomendados por la Sociedad Internacional de Terapia Celular (ISCT) para MSC, como CD90, CD73 y CD105. Además, la expresión insignificante de marcadores hematopoyéticos (CD45) y endoteliales (CD34), y menos del 2% de expresión de marcadores HLA-DR, confirmaron la homogeneidad y pureza de los cultivos DPSC. Además, ilustramos su multipotencia basada en la diferenciación a linajes adipogénicos, osteogénicos y cronogénicos. También indujimos a estas células a diferenciarse en células de tipo hepático y neuronales mediante la adición de los medios de estimulación correspondientes. Este protocolo optimizado ayudará en el cultivo de una población altamente expandible de células madre mesenquimales para ser utilizada en el laboratorio o para estudios preclínicos. Se pueden incorporar protocolos similares en las configuraciones clínicas para practicar tratamientos basados en DPSC.
Introducción
Las células madre adultas se han convertido en una poderosa herramienta terapéutica para tratamientos y terapias dirigidas a células debido a su plasticidad, mecanismos paracrinos y propiedades inmunomoduladoras 1,2,3. Los datos alentadores de los estudios preclínicos basados en células madre han inspirado a los investigadores a trabajar en la traducción del laboratorio a la cabecera del paciente. El tipo de células madre utilizadas para la terapia con células madre desempeña un papel importante en los resultados exitosos. En estudios preclínicos y clínicos, la fuente más ampliamente reportada de células madre mesenquimales (MSC) sigue siendo la médula ósea 4,5. Sin embargo, los principales inconvenientes del uso de células madre derivadas de la médula ósea (BMSC) incluyen su población rara, procedimientos altamente invasivos para el aislamiento y su capacidad limitada para expandirse. Por lo tanto, se están explorando fuentes alternativas de MSC. En este sentido, los tejidos dentales, con su facilidad de accesibilidad, enorme plasticidad, alto potencial regenerativo y alta capacidad proliferativa, han sido considerados como una fuente alternativa rica y potencial de células madre 6,7,8,9,10.
Las células madre de la pulpa dental (DPSC) fueron el primer tipo de células madre dentales en ser aisladas y caracterizadas por Gronthos en el año 200011. Las DPSC han captado la atención de las aplicaciones de ingeniería de tejidos debido a su alta tasa de proliferación, su importante potencial de diferenciación, su facilidad de acceso con un cultivo sin esfuerzo y, lo que es más importante, su capacidad para obtenerse de un diente desechado sin ninguna preocupación ética12. Las limitaciones que plantean otras fuentes de células madre, como las BMSC y las células madre derivadas del tejido adiposo (ADSC), en su aislamiento y en su inadecuada capacidad de autorrenovación, son eludidas por las DPSC13. Las DPSC humanas se pueden obtener de dientes primarios humanos, dientes permanentes, muelas del juicio, dientes deciduos exfoliados (SHED) y papilas apicales. Además, las CPDP también pueden aislarse de dientes supernumerarios, que generalmente se descartan14. Las DPSCs expresan marcadores asociados a la cresta neural y tienen el potencial de diferenciarse en células neuronales tanto in vitro como in vivo15. Además de su potencial neurogénico, las DPSC pueden diferenciarse en otros linajes celulares, como osteogénicos, condrogénicos, adipogénicos, hepáticos y miogénicos, cuando se les dan condiciones de diferenciación específicas13. Por lo tanto, estas células multipotentes tienen un gran potencial para la terapia basada en células y pueden emplearse para la regeneración de varios tejidos. Los estudios también han informado sobre el papel potencial de las DPSC en la reconstrucción de la córnea16, la reparación del infarto de miocardio17 y su posible papel terapéutico en enfermedades como la isquemia de las extremidades18, el Alzheimer 19, el Parkinson 20 y el envejecimiento21. Por lo tanto, las células madre derivadas de tejidos dentales se pueden utilizar no solo para la regeneración dental, sino también para la reparación y regeneración de órganos no dentales como ojos16, corazones17, hígados22, huesos23 , etc.
Existen dos métodos particulares para el aislamiento de una población de MSC a partir de tejido pulposo: la digestión enzimática y el cultivo de explantes24,25. Ambos métodos han reportado el establecimiento exitoso de cultivos primarios sin ninguna diferencia significativa en la cantidad y las propiedades de las DPSC26. En este estudio, nos hemos centrado en el aislamiento de DPSCs por el método del explante27, ya que este método genera DPSCs sin contaminación de las células hematopoyéticas y endoteliales, en comparación con la digestión enzimática que puede resultar en contaminación de fibroblastos28.
Protocolo
Todos los procedimientos descritos en el estudio han sido aprobados por el Comité de Ética del Instituto (IEC# 9195/PG-12 ITRG/2571-72) de PGIMER, Chandigarh. Todos los experimentos relacionados con el cultivo celular deben realizarse en una cabina de seguridad biológica (BSC) de Clase II siguiendo una técnica aséptica. La pulpa dental se obtuvo de dientes sanos de tres pacientes (F/14, M/14 y M/20) sometidos a extracciones de terceros molares por razones ortodóncicas. Antes de la recolección de la muestra, se obtuvo el consentimiento informado por escrito del paciente/tutor de acuerdo con las directrices proporcionadas por el comité de ética de PGIMER, Chandigarh.
1. Establecimiento de cultivo primario de células madre de pulpa dental (DPSC) a partir de tejido dental humano
NOTA: No se deben utilizar dientes cariados.
- Recolección de muestras de pulpa dental y transporte al laboratorio de cultivo de tejidos
- Realizar un procedimiento de extracción dental en condiciones no traumáticas y asépticas. Enjuague bien el diente extraído con una solución salina estéril para eliminar los restos de sangre.
- Cortar el diente extraído longitudinalmente en dos pedazos utilizando una fresa de fisura de carburo con irrigación constante con solución salina normal estéril para exponer la pulpa.
- Transportar el diente extraído junto con la pulpa intacta en medios estériles α-mínimo esencial (α-MEM) mantenidos en hielo hasta el laboratorio de cultivo de células y tejidos.
NOTA: Lo ideal es procesar todas las muestras recibidas en un plazo de 2 horas para el cultivo celular. Sin embargo, un informe reciente ha sugerido que el procesamiento de la muestra de diente, incluso después de 24 h, no afectó la viabilidad y proliferación de las DPSC, sin embargo, sí redujo su funcionalidad29.
2. Extracción de tejido pulpar del diente y cultivo celular de DPSCs (tiempo: 60-120 min)
NOTA: Todos los pasos posteriores al transporte dental se han realizado en el laboratorio de cultivo de células y tejidos dentro de un gabinete de bioseguridad de nivel 2.
- Coloque la muestra de diente en placas de Petri de cultivo estériles y enjuague bien (tres o cuatro veces) con 1 solución salina estéril tamponada con fosfato (PBS).
- Retire con cuidado el tejido pulpar de la cavidad pulpar con la ayuda de una excavadora afilada y pinzas.
- Una vez que se retira la pulpa, límpiela a fondo con PBS estéril para eliminar cualquier resto de sangre.
- Cortar el tejido pulpar en trozos pequeños de aproximadamente 2-3 mm con la ayuda de una cuchilla quirúrgica en una placa de Petri.
- Divida el área de superficie del plato en cuatro partes colocando 1-2 mL de PBS estéril en cada área. Coloque la muestra de tejido pulpar en un área con PBS y corte el tejido en los pedazos más pequeños posibles con una cuchilla quirúrgica (cuanto más pequeño sea el trozo, más fácil será que las células madre migren fuera del tejido). Después de esto, transfiera cada pieza levantándola a otra área con PBS, y así sucesivamente hasta la cuarta área, para que las piezas de tejido estén correctamente lavadas y libres de contaminantes.
- Mientras tanto, vierta aproximadamente 0,8-1 mL de α-MEM que contiene aminoácidos no esenciales con un 10% de suero fetal bovino (FBS) y un cóctel de antibióticos (es decir, penicilina y estreptomicina) en los pocillos de una placa de 6 pocillos. Distribuya el medio uniformemente moviendo la placa, de modo que se extienda uniformemente sobre la superficie del pocillo.
- Siembre los pequeños trozos de pulpa, tejido o explantes con la ayuda de pinzas en un solo pocillo (de cuatro a seis trozos por pocillo) de la placa de 6 pocillos y mantenga la placa intacta durante 5 minutos en una campana de bioseguridad.
NOTA: Este paso permite/ayuda en la adherencia de tejidos/explantes a las superficies tratadas de las placas de cultivo. - Mantenga la placa de cultivo en una atmósfera humidificada con una temperatura de 37 °C y un nivel de CO2 del 5%.
- Al día siguiente, aspire cuidadosamente los medios de los pozos sin perturbar los explantes y agrégueles medios frescos. Cambie el medio cada dos días en este paso para evitar que se seque. Asegúrese de que la incubadora tenga suficiente agua en la bandeja para que la evaporación adicional no haga que los medios en los pozos de placas se sequen.
NOTA: Este es un paso muy crucial, y la perturbación puede hacer que los explantes se desprendan de su posición. Si las piezas del explante se desprenden de su posición durante la transferencia del medio, intente volver a unirlas retirando el medio por completo y dejando que se adhieran a la superficie del pocillo. Los medios deben agregarse cuidadosamente a lo largo de la pared del pozo sin alterar los explantes, de lo contrario, podrían desprenderse nuevamente. Observe las placas de cultivo celular regularmente bajo un microscopio invertido (aumento de 4x o 10x). Identifique las DPSC por su capacidad de adherirse a la superficie plástica y su morfología en forma de huso. - Una vez que suficientes células migran de los explantes, se eliminan los tejidos y se permite que las células proliferen y alcancen la confluencia celular óptima del 70%-75% antes del subcultivo. El volumen de α-MEM que contiene un 10% de FBS se puede aumentar a 2 ml en este paso para que las células puedan dividirse más rápido. Cambie los medios cada tres días en esta etapa.
3. Expansión de DPSC
- Lave el matraz de cultivo T75 confluente (confluencia: 70%-80%) de DPSC dos veces con PBS (10 mL).
- Añadir 2,5 mL de ácido tripsina-etilendiaminotetraacético (EDTA) al 0,25% en el lateral del matraz T75 y agitarlo suavemente para asegurarse de que la tripsina-EDTA cubre toda la lámina celular o la monocapa de DPSC.
- Mantenga el matraz dentro de la campana a 37 °C durante 3-5 min. Después de 3 minutos, golpee suavemente el matraz para asegurar la disociación de las células.
- Añadir 5 mL de medio completo (α-MEM con 10% de FBS) o 250 μL de FBS (10% del volumen de tripsina utilizado) como agente neutralizante para inactivar la actividad de la tripsina. Transfiera la suspensión celular completa de DPSC disociadas en un tubo de centrífuga cónico nuevo de 15 mL.
- Centrifugar las células disociadas a 500 x g durante 2 min a temperatura ambiente para obtener el pellet de la célula.
- Aspire todo el sobrenadante con la pipeta, añada 5-10 mL de PBS al matraz para recoger las células remanentes, lave la célula en PBS con un pipeteo suave y vuelva a centrifugar las células a 500 x g durante 2 min. Repita si es necesario.
- Vuelva a suspender el pellet de celda en 1 mL de medio completo (α-MEM con 10% de FBS) después de retirar cuidadosamente el sobrenadante y realizar un pipeteo suave para obtener una suspensión de una sola célula.
- Divida las células y siembrójelas (volumen igual) en dos matraces de cultivo T75, cada uno de los cuales contiene 10 mL de medio completo. Mantenga el matraz dentro de la campana a 37 °C.
- Al día siguiente, aspire el medio y reemplácelo con el medio completo nuevo.
NOTA: El tratamiento prolongado con tripsina puede comprometer la integridad celular, la viabilidad y la función celular al escindir la proteína de la superficie celular y la proteína de la matriz extracelular.
4. Identificación de marcadores fenotípicos de células madre (tiempo: 90 - 120 min)
NOTA: Para la caracterización de las células extraídas del tejido de la pulpa, utilice las células entre el tercer y el quinto paso.
- Utilice dos matraces de cultivo T75 confluentes de DPSC al 70%-80% (~3-4 x 106 células; cuente las células con un citómetro o hemocitómetro basado en imágenes) y lave las células dos veces con 10 ml de PBS.
- Añadir 2,5 mL de tripsina-EDTA al 0,25% y mantener el matraz dentro de la campana a 37 °C durante 3-5 min. Añadir 5 mL de medio completo o 250 μL de FBS (10% del volumen de tripsina utilizado) como agente neutralizante para inactivar la actividad de la tripsina.
- Recoja las células con una pipeta en un tubo de centrífuga cónico de 15 ml. Centrifugar las células disociadas a 500 x g durante 2 min a temperatura ambiente para obtener el pellet de la célula.
- Aspire todo el sobrenadante con la pipeta, añada 5 ml de PBS al matraz para recoger las células remanentes, lave la célula en PBS con un pipeteo suave y vuelva a centrifugar las células a 500 x g durante 2 min.
- Vuelva a suspender el pellet en 1 mL de PBS después de retirar cuidadosamente el sobrenadante y realice un pipeteo suave para obtener una suspensión unicelular.
- Cuente las células utilizando un citómetro o hemocitómetro basado en imágenes, dependiendo de la disponibilidad, y distribúyalas en tubos de microcentrífuga a 1 x 104 células/tubo. Incubar las células en albúmina sérica bovina (BSA) al 0,5%-1% durante 0,5-1 h.
- A cada tubo, agregue 1-2 μL de anticuerpos conjugados con isotiocianato de fluoresceína (FITC) y ficoeritrina (PE) para los marcadores de grupo de diferenciación (CD) (es decir, CD90 [0,4 μg], CD73 [0,8 μg], CD105 [0,4 μg], CD34 [0,8 μg], CD45 [0,4 μg] y HLA-DR [0,08 μg])6,7,8,9 e incube durante 0,5 h en la oscuridad a temperatura ambiente.
- Después de 0,5 h, granular las células centrifugando a 500 x g durante 5 min. Aspire el sobrenadante, lave la pastilla de células con PBS y vuelva a centrifugar.
- Después de la centrifugación, vuelva a suspender el pellet en PBS (200 μL/tubo), transfiera la suspensión celular a los tubos de citometría de flujo y adquimítalos utilizando un citómetro de flujo. Se puede utilizar cualquier software comercial para analizar más a fondo el porcentaje de células positivas para varios anticuerpos.
NOTA: Los pasos 4.7 a 4.9 deben realizarse en la oscuridad a temperatura ambiente. Se deben utilizar controles de isotipo adecuados y muestras sin tinción para omitir la fluorescencia de fondo de las células.
5. Diferenciación de DPSC en múltiples linajes
NOTA: Utilice cultivos confluentes de 75%-80% de DPSC en el tercer a quinto paso para la evaluación de la multipotencia. Se debe utilizar un grupo de células de control que contenga α-MEM para todos los tipos de diferenciaciones que se describen a continuación.
- Diferenciación osteogénica de DPSC, tinción con rojo de alizarina y cuantificación
- Realice una suspensión de una sola célula utilizando tripsina-EDTA al 0,25%, como se describe anteriormente en el paso 4.2, y vuelva a suspender el gránulo de célula en α-MEM completo.
- Cuente las células y siembrójelas en placas tratadas con cultivo de tejidos de 24 pocillos a una densidad de células de 2 x 104 células/pocillo que contengan 0,4-0,5 mL de medio completo durante 48 h a 37 °C y 5% de CO2.
- Después de 48 h, retire el medio de los pocillos y agregue 0,4-0,5 mL de medio inductivo osteogénico (es decir, α-MEM con factores inductivos osteogénicos como beta glicerofosfato [5 mM], fosfato monopotásico [1,8 mM] y dexametasona fosfato disódico [0,01 mM])8. Prepare pozos de control (células no inducidas) que contengan α-MEM completo solamente, sin ningún factor inductivo osteogénico (medios de control).
NOTA: También se ha informado que la adición de 50 μM de ascorbato mejora la diferenciación osteogénica 30,31. Después de cada tercer día, reemplace los medios de inducción y los medios de control con medios y cultivos nuevos durante 21 días (3 semanas). Al final del período de inducción, retire los medios de las placas de cultivo, agregue 0,5 ml de PBS y lave dos veces. - Después del lavado con PBS, fije las células en 0,5 ml de solución de formalina tamponada neutra (NBF) al 10% durante 20-30 minutos a temperatura ambiente. Realice la fijación en una campana de humos/productos químicos.
- Tinción de rojo de alizarina
- Prepare la tinción de rojo de alizarina S (2%) disolviendo 1 g de rojo de alizarina S en 50 mL de agua bidestilada (ddH2O) y ajustando el pH a 4,0-4,2 con la ayuda de ácido clorhídrico (HCL) o hidróxido de amonio (NH4OH). Filtra la mancha con papel de filtro. Guarde la mancha en la oscuridad (4 °C).
- Lavar las células dos veces con agua bidestilada (ddH2O), añadir la tinción roja de alizarina S e incubar a temperatura ambiente durante 30-45 min.
- Retire la mancha de todos los pocillos y lave las celdas cuatro o cinco veces con ddH2O para eliminar cualquier mancha no vinculada. Capture las imágenes con un microscopio de campo claro.
- Extracción de tinción roja de alizarina para análisis cuantitativo
- Añadir tampón de cloruro de cetilo piridinio (CPC) (pH 7,0) a los pocillos teñidos (0,4 mL/pocillo) e incubar las células durante 2 h a 37 °C. Además, las células también pueden ser incubadas con ácido acético al 10% para la correcta disolución de los cristales rojos de alizarina32. Mantenga los platos en un balancín o agitador de platos.
- Después de la incubación, recoja el sobrenadante (tinte extraído), transfiéralo a una placa de 96 pocillos y lea la placa o las muestras a 405 nm. Para obtener un valor en blanco, agregue solo el búfer CPC (mismo volumen) y lea32,33 .
6. Diferenciación adipogénica de DPSC, tinción de O rojo aceite y cuantificación
NOTA: Los pasos iniciales de la siembra son los mismos que los anteriores (es decir, el paso de diferenciación osteogénica 5.1).
- Después de 48 h, retire el medio de los pocillos y agregue 0,4-0,5 mL de medio inductivo adipogénico (es decir, α-MEM con factores inductivos adipogénicos como isobutil-metilxantina [IBMX; 0,5 mM], dexametasona [1 μM], indometacina [200 μM] e insulina [10 μM])8. Preparar pocillos de control que contengan células no inducidas (es decir, cultivadas en α-MEM solamente sin factores inductivos {medios de control]).
- Reponga el medio cada tres días y cultive las células durante 3 semanas. Después de 3 semanas, aspire los medios de las placas de cultivo y agregue 0,5 mL de PBS para lavar las células dos veces.
- Después del lavado con PBS, fije las celdas en una solución de NBF al 10% durante 20-30 minutos a temperatura ambiente.
- Lave las células dos veces con agua destilada doble (ddH2O), agregue aceite rojo O tinte e incube a temperatura ambiente durante 30-40 min.
- Retire la mancha de todos los pocillos y enjuague los pocillos que contienen células repetidamente con ddH2O hasta que se aclare (de dos a cuatro veces). Observe bajo el microscopio y capture imágenes.
- Extracción de aceite rojo O para análisis cuantitativo
- Agregue 0,4 mL de 2-propanol al 100% a los pocillos teñidos e incube a temperatura ambiente cubriendo adecuadamente la placa durante 30 min. Mantenga el plato en un balancín o agitador de platos.
- Después de la incubación, recoja el sobrenadante, transfiéralo a una placa de 96 pocillos, lea la placa o las muestras a 510 nm. Use 100% 2-propanol para el borrado.
7. Diferenciación condrogénica de DPSC, tinción con azul alcián y cuantificación
NOTA: La diferenciación condrogénica se indujo en el cultivo monocapa de DPSC. Los pasos iniciales de la siembra son los mismos que los anteriores (es decir, el paso de diferenciación osteogénica 5.1).
- Después de 48 h, retire el medio de los pocillos y agregue 0,4-0,5 mL de medio de inducción condrogénico (es decir, α-MEM con factores inductivos específicos para la diferenciación condrogénica, ácido ascórbico [0,2 M], piruvato de sodio [1 mM], factor de crecimiento transformante-beta 3 [TGF-β3; 10 μM], dexametasona [1 mM] y 1x premezcla ITS [insulina, transferrina y ácido selenoso)10. Preparar pocillos de control que contengan células no inducidas (es decir, cultivadas en α-MEM solo sin factores inductivos [medios de control]).
- Reponga el medio cada tres días y cultive las células durante 3 semanas. Una vez finalizado el período de inducción, aspire los medios de las placas de cultivo y añada 0,5 ml de PBS para lavar las células dos veces.
- Después del lavado con PBS, fije las celdas en una solución de NBF al 10% durante 15-20 minutos a temperatura ambiente. Lavar las células dos o tres veces con agua bidestilada (ddH2O), añadir tinte azul alcián e incubar a temperatura ambiente durante 45 min.
- Retire la mancha de todos los pocillos, seguido de un enjuague con 0,1 N HCL dos o tres veces. Lave las celdas cuatro o dé tiempos con ddH2O.
- Observe las células en busca de proteoglicanos (color azul) bajo el microscopio y capture las imágenes.
- Para la cuantificación del azul alcián, extraiga el colorante utilizando guanidina-HCl 6 M y lea las muestras a una densidad óptica (OD) de 595 nm. El kit de azul alcián utilizado en este estudio tiñe los proteoglicanos ácidos en el cartílago y se une especialmente a los glicosaminoglicanos sulfatados (GAG) presentes en la matriz de los condrocitos10.
8. Diferenciación de las DPSCs hacia un linaje de tipo hepático y caracterización
- Realice una suspensión de células unicelular mediante tratamiento con tripsina, como se describió anteriormente, y vuelva a suspender el pellet celular en α-MEM completo.
- Cuente las células y siembrójelas en 24 placas de cultivo tratadas con pocillo a 2 x 104 células/pocillo que contengan 0,4-0,5 mL de medio completo durante 48 h.
- Después de 48 h, retire el medio de los pocillos e incube las células con medio de inducción hepática durante 14 días. El medio de inducción consiste en medio de águila modificado de Dulbecco (DMEM) bajo en glucosa que contiene dexametasona (0,5 μM), factor de crecimiento epidérmico (EGF; 2 ng/mL), premezcla ITS+ (50 mg/mL) y factor de crecimiento de hepatocitos (HGF; 20 ng/mL) 6.
- Después de 14 días, reemplace el medio con medio de maduración durante otros 14 días (α-MEM suplementado con oncostatina M [OSM; 20 ng/mL], premezcla de ITS [50 mg/mL] y dexametasona [0,5 μM]) 6. Reponga los medios con medios nuevos después de cada tercer día.
- Realizar un análisis inmunohistoquímico y un ensayo de lipoproteínas de baja densidad (LDL) para confirmar la diferenciación similar a la hepática.
- Absorción de LDL y tinción inmunofluorescente para el receptor de LDL
NOTA: Las células similares a los hepatocitos después de la diferenciación se caracterizaron mediante el kit de ensayo de absorción de LDL según las instrucciones del kit. El fluorocromo LDL-550 se utilizó para evaluar la absorción de LDL en células diferenciadas en estado vivo y el anticuerpo del receptor de LDL se utilizó para la detección de receptores de LDL en células diferenciadas después de la fijación.- Después de la diferenciación, tiñir las células vivas con LDL-550 (1:100) durante 3-4 h. Después de 3-4 h, reemplace la solución de tinción con medios de cultivo y observe la absorción de LDL bajo un microscopio fluorescente capaz de excitar el yoduro de propidio (PI) y las longitudes de onda de emisión a 537 y 617 nm, respectivamente.
- Fije las células en la solución fijadora durante 10 min. Después de la fijación celular, bloquee las células en la solución de bloqueo durante 30 min.
- Incubar las células con un anticuerpo primario del receptor de LDL durante 1 h, lavar con 1x PBS tres veces y luego incubar con 488 anticuerpo secundario (1:100) durante 1 h en la oscuridad.
- Lave las células con PBS tres veces para eliminar el exceso de anticuerpos secundarios. Agregue 4′,6-diamidino-2-fenilindol (DAPI) como tinción nuclear.
- Observe las células bajo un microscopio de fluorescencia. Tome imágenes utilizando un microscopio fluorescente capaz de medir longitudes de onda en el rango de excitación/emisión de DAPI, PI y FITC.
NOTA: Los parámetros de intensidad de una sola célula se pueden registrar para cuantificar la expresión de anticuerpos del receptor de LDL y la absorción de LDL. Se deben utilizar controles adecuados de anticuerpos secundarios para la tinción de inmunofluorescencia a fin de omitir la fluorescencia de fondo resultante únicamente del anticuerpo secundario.
- Absorción de LDL y tinción inmunofluorescente para el receptor de LDL
9. Diferenciación neuronal de las DPSCs hacia un linaje y caracterización de tipo neuronal
- Después de la siembra de las células, como se ha descrito anteriormente, cultive las células en α-MEM durante 48 h.
- Aspire el medio y reemplácelo con medios neurobasales que contengan factores de crecimiento como el suplemento de G5 al 0,5%, el suplemento de N2 al 0,2%, el factor de crecimiento epidérmico de 20 ng/mL, el factor de crecimiento básico de fibroblastos de 20 ng/mL y el suplemento de B27 (1%). Cultive las células en este medio durante 25-41 días7.
- Cambie el medio cada segundo o tercer día, dependiendo de su metabolismo por parte de las células. Para lograr una maduración neuronal eficiente y más neuronas de proteína-2 asociadas a microtúbulos (MAP-2+), se eliminan el EGF y el factor de crecimiento de fibroblastos 2 (FGF2) después de la etapa de inducción neuronal (14 días).
NOTA: Con el tiempo y después de repetidos cambios de medio, las neuronas diferenciadas pueden mostrar desprendimiento de los pocillos de la placa debido a la baja adherencia, lo que resulta en la pérdida de neuronas en el cultivo a largo plazo. Para evitar esto, cubra los pocillos de la placa con laminina o fibronectina (opcional). - Realizar análisis inmunohistoquímicos para confirmar la diferenciación neuronal.
- Inmunotinción de CPDP diferenciadas
NOTA: Para confirmar la diferenciación de tipo neuronal de las DPSC, se realizó inmunocitoquímica en las células diferenciadas utilizando anticuerpos MAP-2 y neurofilamento (NFM), que son proteínas específicas del linaje neurogénico7.- Retire los medios de cultivo una vez completada la diferenciación. Agregue PBS, agite suavemente la placa y retire el PBS con la ayuda de una pipeta. Repita el paso.
- Fije las celdas con 10% de NBF o 4% de paraformaldehído durante 20-30 minutos a temperatura ambiente.
- Retire el fijador y lave las celdas con 1x PBS dos o tres veces. Añadir solución de permeabilización (Triton-X-100; 0,1%) e incubar las células durante 5 min.
- Realice el lavado con PBS dos o tres veces y bloquee las células con un agente bloqueante (BSA) al 0,5%-1% durante 1 h a 37 °C o toda la noche a 4 °C. Retire el agente bloqueador y lave las células con 1x PBS.
- Incubar las células durante la noche con anticuerpo primario (preparado en BSA al 0,1%, NFM [1:50] y MAP-2 [1:200]).
- Retire el anticuerpo primario y lave las células con 1x PBS tres o cuatro veces para eliminar los anticuerpos no unidos.
- Añadir anticuerpo secundario (conejo anti-ratón 1:2.000) e incubar las células a temperatura ambiente durante 1,5-2 h en la oscuridad. Lave las células con PBS (dos o tres veces).
- Incubar las células en DAPI durante 10 min y lavar de nuevo con PBS. Conserve el volumen residual para evitar el secado de la muestra. Observar bajo el microscopio de fluorescencia.
NOTA: Además, también se puede realizar la caracterización de la estabilidad del cariotipo10 y la senescencia para tener una mejor idea de la pureza y funcionalidad de las células.
- Inmunotinción de CPDP diferenciadas
Resultados
Aquí, describimos cómo los investigadores pueden establecer un cultivo puro de DPSC a través del método de explante 6,7,8,9,10 e inducirlos hacia múltiples linajes para establecer la pureza del cultivo para aplicaciones posteriores.
Establecimos un cultivo primario de CPDP a partir del pequeño tejido de pulpa extraído del tercer molar de los pacientes, como se muestra en la Figura 1A. Inicialmente, se observaron muy pocas células redondeadas en las inmediaciones de los explantes o tejidos en el cuarto y quinto día después de la siembra del explante. Sin embargo, al12º día, el recuento de células que emergieron de los explantes aumentó, y al final de la segunda semana (14º-16º día), la mayoría de los explantes quedaron rodeados de muchas células adherentes con morfología en forma de huso. En este momento, el explante podía ser extraído de las placas y se dejaba que las células crecieran en presencia de medios completos. Después de alcanzar una confluencia del 70%-75% (tercera semana), las células se subcultivaron y expandieron para una configuración experimental posterior. A través del método de explante, obtuvimos un cultivo uniforme de células madre con positividad de los marcadores CD90, CD105, CD73 de MSC, y una población celular casi insignificante de otro tipo de células, el marcador de células endoteliales CD34 y el marcador de células hematopoyéticas CD45 (Figura 1B).
También diferenciamos con éxito las DPSC en células de linaje osteogénico, como lo demuestra la absorción positiva de tinción con rojo de alizarina en gránulos calcificados en osteocitos, linaje adipogénico, como lo demuestra la absorción de la tinción de O rojo de aceite por gotas de lípidos en adipocitos diferenciados, y linaje condrogénico, como se muestra con tinción positiva con azul alcián (Figura 2). Las DPSCs también mostraron una diferenciación eficiente hacia un linaje similar al hepático, como lo demuestra la morfología cuboidal típica y la absorción de LDL-550 mediante tinción con células vivas (Figura 3A). Las células diferenciadas similares a los hepatocitos se fijaron y procesaron para teñirlas con el anticuerpo receptor de LDL. La Figura 3B muestra la expresión positiva del receptor de LDL en células diferenciadas similares a hepatocitos junto con LDL-550. Las DPSCs también demostraron una marcada capacidad para diferenciarse en células similares a las neuronales, como lo demuestra la tinción positiva de MAP-2 y NFM, proteínas neuronales típicas (Figura 4). En pocas palabras, nuestro estudio muestra que las DPSC pueden aislarse y cultivarse como una población pura, con una pureza del >95% para los marcadores de células madre, y diferenciarse en varios linajes para aplicaciones posteriores como la terapia celular, las pruebas de fármacos y el modelado de enfermedades.

Figura 1: Cultivo primario de los DPSC. (A). Imágenes de contraste de interferencia diferencial (DIC) que muestran varias etapas en el desarrollo del cultivo primario de DPSC: 1) explante en la etapa inicial de gemación con células de tipo burbuja redondeadas que salen del tejido dental en el segundo día de siembra; 2) establecimiento de una red de células que salen del tejido al cuarto día; 3) células con morfología fusiforme completa en confluencia al día 13 y células que cubren toda la superficie de la placa de cultivo después de la extracción de tejido. Barra de escala = 100 μm, (B). Caracterización de marcadores de células madre por citometría de flujo con histogramas y un gráfico de barras que muestra la expresión positiva de los marcadores de células madre y la expresión negativa de los marcadores de células no madre en las DPSC (n = 3). Cada experimento se repitió por triplicado al menos tres veces. Haga clic aquí para ver una versión más grande de esta figura.

Figura 2: Diferenciación multilinaje de DPSC. Imágenes microscópicas de campo claro que muestran tinción con rojo de alizarina después de la diferenciación osteogénica, tinción con O rojo aceite después de la diferenciación adipogénica y tinción con azul alcián después de la diferenciación condrogénica en DPSC. Barra de escala = 100 μm (n = 3). Cada experimento se repitió por triplicado al menos tres veces. Haga clic aquí para ver una versión más grande de esta figura.
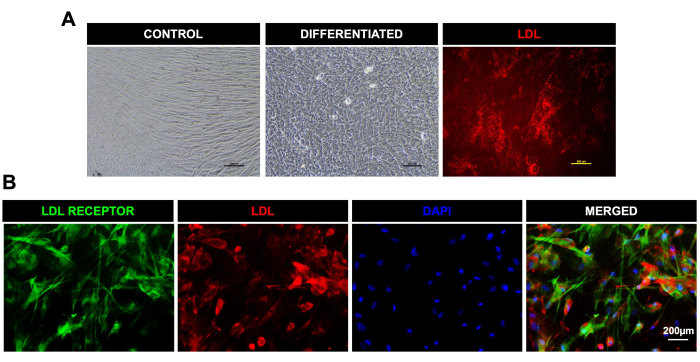
Figura 3: Diferenciación de las DPSCs hacia células similares a los hepatocitos y absorción de LDL. (A). Imágenes microscópicas ópticas para control y células hepáticas diferenciadas de las DPSC; la última imagen en el extremo derecho muestra la absorción de LDL en las células diferenciadas vivas. (B). Imágenes microscópicas fluorescentes que muestran la expresión del receptor de LDL (verde) y la captación de LDL-550 (rojo) (células fijas) en las DPSC después de la diferenciación hepática. El DAPI se utilizó como tinte nuclear. Barra de escala = 200 μm (n = 3). Cada experimento se repitió por triplicado al menos tres veces. Haga clic aquí para ver una versión más grande de esta figura.
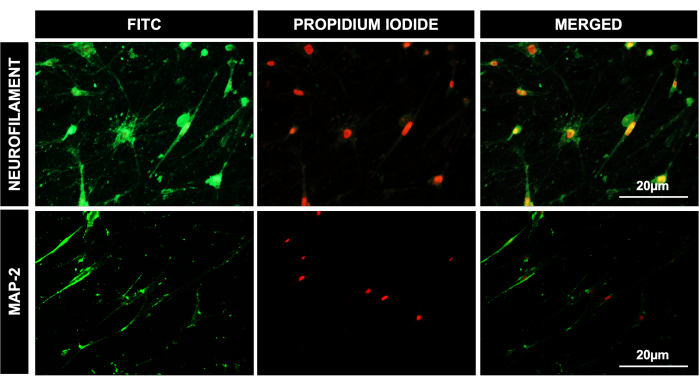
Figura 4: Diferenciación de las DPSCs al linaje neuronal. Imágenes microscópicas fluorescentes para DPSCs después de 41 días de diferenciación neuronal, que muestran una expresión positiva del neurofilamento y MAP-2 de los anticuerpos específicos del linaje neuronal. El PI se utilizó como tinción nuclear. Barra de escala = 20 μm (n = 3). Cada experimento se repitió por triplicado al menos tres veces. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Las células madre han depositado la esperanza de curar numerosas enfermedades, debido a su plasticidad, robustez, propiedades inmunomoduladoras, mecanismos paracrinos y eficiencias de búsqueda. El tejido de la pulpa dental se considera la fuente más potente y valiosa de células madre, con una plasticidad eminente y una capacidad regenerativa. Aquí, demostramos el aislamiento de DPSC, utilizando el método de cultivo de explantes ampliamente adoptado, en el que las células migran de trozos de tejido de pulpa o explantes para crecer en un cultivo celular homogéneo que morfológicamente se asemeja a las células similares a fibroblastos en forma de huso. El método del explante produce cultivos más uniformes de DPSC, desprovistos de otros tipos de células como las células endoteliales y los pericitos, que permanecen durante el procedimiento enzimático para el establecimiento del cultivo de DPSC34. Demostramos que las DPSCs derivadas por el método de explante expresan marcadores CD de superficie celular mesenquimal recomendados por ISCT, como CD90, CD73 y CD105. También están desprovistos de células que expresan marcadores CD45, CD34 y HLA-DR, lo que indica la homogeneidad y pureza del cultivo de DPSC. La falta de HLA-DR también los hace adecuados para el trasplante, con mínimas posibilidades de rechazo. Hay algunos pasos críticos en el protocolo para garantizar la eficiencia y la pureza de la cultura DPSC. Los explantes deben lavarse al menos cuatro veces con PBS antes de colocarlos en las placas de cultivo para evitar cualquier posible contaminación. Además, los explantes deben adherirse bien a la superficie del pozo de cultivo, ya que los explantes separados no producirán células. Por lo tanto, se debe tener sumo cuidado al manipular los explantes durante el cambio de medio. Los medios deben agregarse con cuidado, gota a gota a lo largo de las esquinas del pozo, para no perturbar los explantes. Una vez que las células crecen en los pocillos de la placa, los trozos de tejido deben extraerse con cuidado con la punta, para no dañar ninguna de las células circundantes. Durante la recuperación de DPSC en el primer paso de los pocillos de placa, es posible que haya muy pocas células, lo que hace imposible ver ningún gránulo de célula visible en el tubo después de la centrifugación. Algunas células también pueden adherirse a las paredes del tubo de centrífuga, lo que dificulta la obtención de células durante el proceso de escalado. Se debe tener cuidado de enjuagar bien la placa de cultivo y el tubo de 15 ml con PBS para extraer la mayor cantidad posible de células. Todos los experimentos de diferenciación basados en células deben realizarse en DPSCs por debajo del pasaje número ocho, ya que los pasajes más altos podrían conducir a la acumulación de aberraciones genéticas y diferenciación espontánea, lo que afectaría los resultados.
También hay algunas limitaciones del protocolo. El cultivo de explantes es un protocolo lento y produce suficientes células después de 15-20 días de cultivo solamente. En el medio, existe el riesgo de contaminación, y el explante (piezas de pulpa dental) puede desprenderse de la superficie de la placa, lo que no produciría ninguna célula más adelante. Por lo tanto, se debe tener sumo cuidado al cambiar los medios. Además, los lavados repetidos de PBS son importantes antes de sembrar los explantes, ya que los dientes son ricos en microflora oral y hay muy altas posibilidades de contaminación en el cultivo si no se realiza un lavado adecuado. Las DPSC humanas son ectodérmicas en su origen y durante el desarrollo de los dientes; Migran desde la cresta neural y luego se diferencian en células mesenquimales. Esto les confiere propiedades especiales tanto de linaje mesodérmico como ectodérmico34. Arthur et al. postularon que las células derivadas de la cresta neural están predispuestas a la diferenciación neuronal35; la diferenciación neural espontánea de las DPSCs también fue reportada por Kim et al.36. Otro estudio ha indicado el papel potencial del canal de calcio distal C-terminal L de tipo L en la dirección de las DPSC para alcanzar un fenotipo neuronal37. Anteriormente, nuestro laboratorio demostró la eficiencia de la criopreservación de estas DPSC al preservarlas a -80 °C durante 5 años10. Estas células fueron capaces de mantener las características de madre, proliferación y capacidad de diferenciación, así como un cariotipo estable sin anomalías estructurales o numéricas. Además, en un análisis comparativo, nuestro laboratorio también demostró la tendencia superior de las DPSC hacia los linajes neurogénicos7 y osteogénicos8 , en comparación con las BMSC. Su competencia superior y su tendencia heredada hacia el linaje osteogénico y neuronal hacen de estas células las candidatas más adecuadas para las terapias con células madre en trastornos óseos y enfermedades neurodegenerativas.
En conjunto, describimos aquí un protocolo eficiente para obtener una población pura de DPSCs por el método del explante, como lo demuestra su capacidad de expresión de marcadores de células madre y diferenciación multilinaje.
Divulgaciones
Los autores declaran no tener conflicto de intereses financieros o no financieros.
Agradecimientos
Reconocemos el apoyo financiero a AK por parte del Departamento de Investigación en Salud (DHR), ICMR, Gobierno de la India (Subvención DHR-NRI # R.12015/01/2022-HR). SR ha recibido fondos de ICMR, Gobierno de la India (Subvención # 2020-7593/SCR-BMS) y PS ha recibido una beca del CSIR, Gobierno de la India. También agradecemos a la Sra. Sandhya Tokhi y a la Sra. Bhupinder Kaur por su asistencia en citometría de flujo y núcleo central de instrumentación sofisticada (CSIC) y a PGIMER, Chandigarh por proporcionar apoyo a la infraestructura.
Materiales
| Name | Company | Catalog Number | Comments |
| 6 well cell culture plate | Costar | 3516 | For cell culture |
| Alcian blue stain | EZstain chondrocyte staining kit, HiMedia | CCK029 | |
| alizarin red S stain | Sigma-Aldrich | TMS-008 | Osteogenic stain |
| Antibiotic cocktail | Himedia | A002-5X50ML | To prevent culture contamination |
| Ascorbic Acid | Himedia | TC094-25G | Chondrogenic induction |
| B27 supplement | Gibco | 17504044 | For neural induction |
| bFGF ( basic Fibroblast Growth Factor) | Gibco | PHG0024 | For neural induction |
| CD 105 | BD-Pharmingen | 560839 | |
| CD 35 | Biolegend | 343604 | |
| CD 45 | Biolegend | 304006 | |
| CD 73 | Biolegend | 344016 | |
| CD 90 | Biolegend | 328107 | Characterization |
| cetyl pyridinium chloride (CPC) | Sigma-Aldrich | 1104006 | For Alizarin Red extraction |
| Dexamethasone 21-phosphate disodium | Sigma-Aldrich | D1159-100MG | |
| Dulbecco's Phosphate Buffered Saline | Himedia | TS1006-5L | For washing purpose |
| EGF (Epidermal Growth Factor) | Gibco | PHG0311 | For hepatic and neural induction |
| EVOS LED microscope | Invitrogen | For fluorescence imaging | |
| EZ stain Chondrocyte staining kit | Himedia | CCK029-1KT | Chondro stain Kit |
| FACS Canto flow cytometer | BD Biosciences | For cell characterization | |
| Fetal Bovine Serum | Gibco | 16000044 | For primary culture |
| Fetal Bovine Serum | Sigma-Aldrich | F2442 | For cell culture |
| G5 supplement | Gibco | 17503012 | For neural induction |
| HGF( Hepatocyte Growth Factor) | Sigma-Aldrich | H1404 | For hepatic Induction |
| HLA-DR | Biolegend | 307605 | |
| Human TGF-β3 | Peprotech | #100-36E-10U | |
| Insulin-Transferrin-Selenous acid premix | Sigma-Aldrich | I3146 | For hepatic Induction |
| ITS premix | Corning | 354350 | |
| LDL Uptake Assay kit | Abcam | ab133127 | For hepatic characterization |
| Low glucose DMEM | Gibco | 11885-084 | For hepatic induction |
| MAP2 antibody | Sigma-Aldrich | M4403 | For neural characterization |
| N2 supplement | Gibco | 17502048 | For neural induction |
| Neural Basal Media | Gibco | 21103049 | For neural induction |
| NFM antibody | Sigma-Aldrich | N4142 | For neural characterization |
| Nikon Elipse TS100 microscope | Nikon | For fluorescence imaging | |
| Oil Red O | Sigma-Aldrich | 01391-250Ml | Adipogenic stain |
| Oncostatin M | R&D Systems | 295-OM-010/CF | For hepatic Induction |
| Petridish | Tarson | 460090-90MM | For tissue cutting |
| Potassium phosphate monobasic | Sigma-Aldrich | 15655-100G | Osteogenic induction |
| Propan-2-ol | Thermo Fisher | Q13827 | For Oil Red O extraction |
| Sodium pyruvate solution | Sigma life sciences | S8636-100ML | |
| Trypsin-EDTA | Sigma-Aldrich | T4049 | For cell passaging |
| Whatman filter paper | merck | WHA1001325 | filter paper |
| α- Minimum Essential Media (α-MEM) | Sigma-Aldrich | M0643-10X 1L | Media for primary culture |
| β-glycerophosphate disodium salt hydrate | Sigma-Aldrich | G9422-50G |
Referencias
- Bhattacharyya, S., Kumar, A., Lal Khanduja, K. The voyage of stem cell toward terminal differentiation: a brief overview. Acta Biochimica et Biophysica Sinica. 44 (6), 463-475 (2012).
- Prentice, D. A. Adult stem cells. Circulation Research. 124 (6), 837-839 (2019).
- Raik, S., Kumar, A., Bhattacharyya, S. Insights into cell-free therapeutic approach: Role of stem cell "soup-ernatant". Biotechnology and Applied Biochemistry. 65 (2), 104-118 (2018).
- Rodriguez-Fuentes, D. E., et al. Mesenchymal stem cells current clinical applications: a systematic review. Archives of Medical Research. 52 (1), 93-101 (2021).
- Yamazaki, K., Kawabori, M., Seki, T., Houkin, K. Clinical trials of stem cell treatment for spinal cord injury. International Journal of Molecular Sciences. 21 (11), 3994(2020).
- Kumar, A., et al. Molecular spectrum of secretome regulates the relative hepatogenic potential of mesenchymal stem cells from bone marrow and dental tissue. Scientific Reports. 7 (1), 15015(2017).
- Kumar, A., Kumar, V., Rattan, V., Jha, V., Bhattacharyya, S. Secretome cues modulate the neurogenic potential of bone marrow and dental stem cells. Molecular Neurobiology. 54 (6), 4672-4682 (2017).
- Kumar, A., Kumar, V., Rattan, V., Jha, V., Bhattacharyya, S. Secretome proteins regulate comparative osteogenic and adipogenic potential in bone marrow and dental stem cells. Biochimie. 155, 129-139 (2018).
- Kumar, A., Bhattacharyya, S., Rattan, V. Effect of uncontrolled freezing on biological characteristics of human dental pulp stem cells. Cell Tissue Bank. 16 (4), 513-522 (2015).
- Raik, S., et al. Assessment of post-thaw quality of dental mesenchymal stromal cells after long-term cryopreservation by uncontrolled freezing. Applied Biochemistry and Biotechnology. 191 (2), 728-743 (2020).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Tsutsui, T. W. Dental pulp stem cells: advances to applications. Stem Cells and Cloning. 13, 33-42 (2020).
- Huang, G. T. -J., Gronthos, S., Shi, S. Mesenchymal stem cells derived from dental tissues vs. those from other sources: their biology and role in regenerative medicine. Journal of Dental Research. 88 (9), 792-806 (2009).
- La Noce, M., et al. Dental pulp stem cells: state of the art and suggestions for a true translation of research into therapy. Journal of Dentistry. 42 (7), 761-768 (2014).
- Xiao, L., Tsutsui, T. Characterization of human dental pulp cells-derived spheroids in serum-free medium: stem cells in the core. Journal of Cellular Biochemistry. 114 (11), 2624-2636 (2013).
- Kumar, A., Yun, H., Funderburgh, M. L., Du, Y. Regenerative therapy for the cornea. Progress in Retinal and Eye Research. 87, 101011(2022).
- Gandia, C., et al. Human dental pulp stem cells improve left ventricular function, induce angiogenesis, and reduce infarct size in rats with acute myocardial infarction. Stem Cells. 26 (3), 638-645 (2008).
- Yong, Z., et al. Comparison of the angiogenic ability between SHED and DPSC in a mice model with critical limb ischemic. Tissue Engineering and Regenerative Medicine. 19 (4), 861-870 (2022).
- Zhang, X. M., et al. Therapeutic potential of dental pulp stem cell transplantation in a rat model of Alzheimer's disease. Neural Regeneration Research. 16 (5), 893-898 (2021).
- Kabir, R., et al. Imperative role of dental pulp stem cells in regenerative therapies: a systematic review. Nigerian Journal of Surgery. 20 (1), 1-8 (2014).
- Kumar, A., et al. Dental pulp stem cell secretome ameliorates d-galactose induced accelerated aging in rat model. Cell Biochemistry and Function. 40 (5), 535-545 (2022).
- Hirata, M., et al. Multifaceted therapeutic benefits of factors derived from dental pulp stem cells for mouse liver fibrosis. Stem Cells Translational Medicine. 5 (10), 1416-1424 (2016).
- Fujii, Y., et al. regeneration by human dental pulp stem cells using a helioxanthin derivative and cell-sheet technology. Stem Cell Research & Therapy. 9 (1), 24(2018).
- Ferrua, C. P., et al. How has dental pulp stem cells isolation been conducted? A scoping review. Brazilian Oral Research. 31, e87(2017).
- Pilbauerova, N., Soukup, T., Suchankova Kleplova, T., Suchanek, J. Enzymatic isolation, amplification and characterization of dental pulp stem cells. Folia Biologica. 65 (3), 124-133 (2019).
- Tatullo, M., Marrelli, M., Shakesheff, K. M., White, L. J. Dental pulp stem cells: function, isolation and applications in regenerative medicine. Journal of Tissue Engineering and Regenerative Medicine. 9 (11), 1205-1216 (2015).
- Hilkens, P., et al. Effect of isolation methodology on stem cell properties and multilineage differentiation potential of human dental pulp stem cells. Cell and Tissue Research. 353 (1), 65-78 (2013).
- Hendijani, F. Explant culture: An advantageous method for isolation of mesenchymal stem cells from human tissues. Cell Proliferation. 50 (2), e12334(2017).
- Aryal Ac, S., Islam, M. S., Samsudin, A. R. Investigation of the effect of a time delay on the characteristics and survival of dental pulp stem cells from extracted teeth. Archives of Oral Biology. 119, 104896(2020).
- Langenbach, F., Handschel, J. Effects of dexamethasone, ascorbic acid and β-glycerophosphate on the osteogenic differentiation of stem cells in vitro. Stem Cell Research & Therapy. 4, 117(2013).
- Jaiswal, N., Haynesworth, S. E., Caplan, A. I., Bruder, S. P. Osteogenic differentiation of purified, culture-expanded human mesenchymal stem cells in vitro. Journal of Cellular Biochemistry. 64 (2), 295-312 (1997).
- Bernar, A., Gebetsberger, J. V., Bauer, M., Streif, W., Schirmer, M. Optimization of the alizarin red S assay by enhancing mineralization of osteoblasts. International Journal of Molecular Sciences. 24 (1), 723(2022).
- Coe, C. L., Lubach, G. R., Schneider, M. L., Dierschke, D. J., Ershler, W. B. Early rearing conditions alter immune responses in the developing infant primate. Pediatrics. 90, 505-509 (1992).
- Bakopoulou, A., et al. Assessment of the impact of two different isolation methods on the osteo/odontogenic differentiation potential of human dental stem cells derived from deciduous teeth. Calcified Tissue International. 88 (2), 130-141 (2011).
- Arthur, A., Rychkov, G., Shi, S., Koblar, S. A., Gronthos, S. Adult human dental pulp stem cells differentiate toward functionally active neurons under appropriate environmental cues. Stem Cells. 26 (7), 1787-1795 (2008).
- Kim, B. C., et al. Osteoblastic/cementoblastic and neural differentiation of dental stem cells and their applications to tissue engineering and regenerative medicine. Tissue Engineering. Part B, Reviews. 18 (3), 235-244 (2012).
- Ge, J., et al. Distal C terminus of CaV1.2 channels plays a crucial role in the neural differentiation of dental pulp stem cells. PLoS One. 8 (11), e81332(2013).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados