Method Article
アルデヒドデヒドロゲナーゼ1A1活性に基づく卵巣癌細胞の層別化へのAlDeSenseの応用
* これらの著者は同等に貢献しました
要約
生細胞におけるALDH1A1活性を測定する方法は、幹細胞性のバイオマーカーとしての地位から、がん研究において極めて重要です。この研究では、アイソフォーム選択的蛍光発生プローブを使用して、5つの卵巣癌細胞株のパネルにおけるALDH1A1活性の相対レベルを決定しました。
要約
がん治療後の再発は、がん幹細胞(CSC)として知られる腫瘍細胞の亜集団の持続に起因することが多く、顕著な腫瘍開始能力と自己複製能力が特徴です。腫瘍の起源(卵巣など)に応じて、CSC表面バイオマーカープロファイルは劇的に異なる可能性があるため、免疫組織化学染色 による そのような細胞の同定は困難な作業になります。それどころか、アルデヒドデヒドロゲナーゼ1A1(ALDH1A1)は、CSCを含むほぼすべての前駆細胞で発現プロファイルが保存されているため、CSCを同定するための優れたマーカーとして浮上しています。ALDH1A1アイソフォームは、対応するカルボン酸生成物への様々な内因性および生体異物アルデヒドの酸化に関与する19の酵素のスーパーファミリーに属する。Chanらは最近、ALDH1A1活性を検出するためのアイソフォーム選択的「ターンオン」プローブであるAlDeSenseと、オフターゲット染色を説明するための非反応性マッチング制御試薬(Ctrl-AlDeSense)を開発しました。このアイソフォーム選択ツールは、K562骨髄性白血病細胞、マンモスフェア、および黒色腫由来のCSC異種移植片におけるALDH1A1活性の検出を通じて、汎用性の高い化学ツールであることがすでに実証されています。この記事では、プローブの有用性を、追加の蛍光測定、共焦点顕微鏡、およびフローサイトメトリー実験を通じて紹介し、5つの卵巣癌細胞株のパネルで相対的なALDH1A1活性を測定しました。
概要
がん幹細胞(CSC)は、幹細胞のような特性を示す腫瘍細胞の亜集団です1。非癌性の対応物と同様に、CSCは自己再生および増殖する並外れた能力を持っています。ATP結合カセットトランスポーターのアップレギュレーションなどの他の組み込みメカニズムとともに、CSCは、最初の外科的デバルキング作業やその後の補助療法から免れることがよくあります2。CSCは、治療抵抗性3、再発4、および転移5において重要な役割を果たすため、がん研究の優先事項となっています。CSCの同定に使用できる細胞表面抗原(CD133など)はさまざまですが6、細胞質に見られるアルデヒドデヒドロゲナーゼ(ALDH)の酵素活性を活用することは、魅力的な代替手段として浮上しています7。ALDHは、対応するカルボン酸生成物8への反応性内因性および生体異物アルデヒドの酸化を触媒する19の酵素のスーパーファミリーである。
一般に、アルデヒド解毒は、幹細胞の完全性を損なう可能性のある望ましくない架橋事象や酸化ストレスから細胞を保護する上で非常に重要です9。さらに、1A1アイソフォームはレチノイン酸代謝を制御し、レチノイン酸代謝はレチンアルデヒドシグナル伝達を介してステムネスに影響を与えます10。AlDeSense 11,12は、ALDH1A1活性を選択的に検出するための低分子活性ベースのセンシング(ABS)プローブであり、最近開発されました。ABS設計は、結合イベントではなく化学変化によって分析物検出を実現し、高い選択性とオフターゲット応答の減少を可能にします13,14,15,16。アイソフォーム選択的蛍光発生プローブの設計原理は、プローブ18の蛍光シグネチャを抑制するのに役立つアルデヒド官能基に由来するドナー光誘起電子移動(d-PeT)消光機構17に依存しています。ALDH1A1を介したカルボン酸への変換時に、放射緩和が解除され、蛍光性の高い生成物が得られます。d-PeT消光は100%効率的ではないため、このアッセイを確立する際には、細胞内で一致する光物理的特性(量子収率など)と同一の細胞質染色パターンを備えた非応答試薬であるCtrl-AlDeSenseの開発を通じて、偽陽性の結果につながる可能性のある残留蛍光が考慮されました。このユニークなペアリングを併用することで、蛍光測定、分子イメージング、フローサイトメトリーにより、ALDH1A1活性の高い細胞と低レベルを示す細胞を確実に区別することができます。いくつかの重要な利点は、従来の免疫組織化学的方法よりもアイソフォーム選択的活性化可能な色素を使用することに関連しています。たとえば、CSCは腫瘍の奥深くに埋もれていると仮定されているため、大きな抗体に比べて小分子にアクセスしやすくなります19。さらに、ターンオーバーした蛍光産物は細胞成分を共有結合的に修飾しないため、洗浄サイクルで容易に除去し、CSCを未修飾の状態のままにすることができます。最後に、ターンオン応答は、NAD+補因子に依存しているため、MTTアッセイと同様に、生細胞と機能のみを識別します。
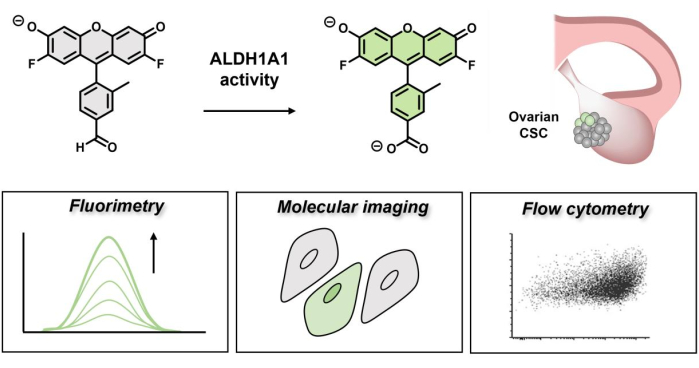
図1:AlDeSenseの蛍光ターンオンを示す回路図。 アイソフォーム選択的色素はALDH1A1によって活性化され、蛍光測定、分子イメージング、およびフローサイトメトリー を介して 卵巣癌細胞におけるALDH1A1活性の上昇を特定するために使用できます。 この図の拡大版を表示するには、ここをクリックしてください。
過去の研究では、アイソフォーム選択的蛍光発生プローブアッセイは、K562ヒト慢性白血病細胞、MDA-MB-231ヒト乳がん細胞、およびB16F0マウス黒色腫細胞において、ALDH低(ALDH-)細胞からALDH高(ALDH+)細胞を層別化することに成功しました。多くの種類のがんにとって、ALDH1A1タンパク質の発現が高いことは臨床予後が悪いことを意味するため、これは重要です20。これは、ALDH1A1のレベルの上昇が、治療を回避し、耐性を発達させ、全身に広がる可能性のあるCSCを示していると想定しています。しかし、卵巣がんの場合、反対の所見(ALDH1A1の高発現は患者の生存率の改善につながる)を報告する研究があります21,22,23,24。これは一見矛盾しているように見えるかもしれませんが、発現は必ずしも酵素活性と相関しているわけではなく、腫瘍微小環境の変化(pHフラックス、酸素勾配など)、NAD+補因子またはアルデヒド基質の利用可能性、カルボン酸のレベル(生成物阻害)、および酵素活性を変化させる可能性のある翻訳後修飾によって影響を受ける可能性があります25.さらに、卵巣がんは5つの主要な組織型(高悪性度漿液性、低悪性度漿液性、子宮内膜症、明細胞性、粘液性)に分けられ、ALDH1A1活性のさまざまなレベルを特徴とすると仮定します26。卵巣腫瘍におけるALDH1A1活性を調査することを目的として、アイソフォーム選択的蛍光発生プローブアッセイを使用して、上記の異なる組織型に属する5つの卵巣癌細胞株のパネルにおけるALDH1A1+集団を同定しました。この研究でテストされた細胞株には、BG-1、Caov-3、IGROV-1、OVCAR-3、およびPEO4細胞が含まれ、明細胞および漿液性組織型をカバーしています。ここでは、プローブの汎用性と一般化可能性が強調され、他の不死化癌細胞株および患者サンプルで同様の研究を実施しようとする研究者のためにCSCを同定しました。AlDeSenseの使用は、複雑な組織微小環境におけるCSC維持に関与する生化学的経路に光を当て、予後を決定し、癌の攻撃性を測定するための臨床ツールとして役立つ可能性があります。
プロトコル
1 . 卵巣がん 細胞ホモジネート中のALDH1A1総活性を蛍光測定で測定
- T25細胞培養フラスコ中の1×106 個の細胞を5 mL以下の細胞培養培地で解凍します。
- IGROV-1およびPEO4:10%ウシ胎児血清(FBS)および1%ペニシリン/ストレプトマイシン(P / S)を含むロズウェルパーク記念研究所(RPMI)1640培地。
- BG-1およびCaov-3:10%FBSおよび1%P / Sのダルベッコ改変イーグル培地(DMEM)。
- OVCAR-3:20%FBS、1%P / S、および0.01 mg / mLインスリンを含むRPMI 1640。
- 細胞をインキュベーター内で37°Cおよび5%CO2 で2〜3回継代維持する。継代する前に、細胞が80%〜90%のコンフルエントを超えないようにしてください。.
- 細胞を0.25%トリプシンで10分間トリプシン処理し、自動セルカウンターを使用してカウントし、25°Cで5分間遠心分離(180 × g)を介して1×107細胞をペレット化します。
- 吸引 によって 上清を注意深く除去し、1 mLの1x PBSに細胞を再懸濁してペレットを洗浄し、ステップ4に記載したのと同じ条件下で遠心分離 によって 細胞を再ペレット化します。
- 細胞を1x PBS中の1xプロテアーゼ阻害剤の溶液に再懸濁します。2.5 ×10 6 細胞あたり1 mLのこの溶液を使用してください。.
- 細胞ホモジナイザープローブで2分間(1秒パルス、40%振幅)氷上で細胞懸濁液を超音波処理する。
- 不溶性/膜画分を25°Cで15分間遠心分離(3,200 × g) して ペレット化します。上清を除去して保持します, これは後続のステップで使用されるホモジネートであるため.ホモジネートを3つのキュベットに分けて、3連で実験を行います。
- プローブをホモジネートに加え、4 μMの最終プローブ濃度を得ます。 ピペットで上下に3回、溶液をよく混合します。
- 蛍光計で、添加直後および希望のインキュベーション時間後に蛍光シグナルを測定します。インキュベーション時間は、最大倍率ターンオン(この実験では1時間)を確認するように最適化できます。インキュベーション時間は、比較するすべての細胞株にわたって一定でなければなりません。
- 励起波長を496nmに設定します。
- 発光を510〜600nmに設定します。
- スリット幅を0.5mmに設定します。
- 溶液を1 mLの石英キュベットにピペットで入れ、蛍光計に入れてスキャンを押します。
- 516 nm(最大蛍光波長)での最終蛍光強度を最初の読み取り値と同じ波長の強度で割って、アイソフォーム選択性色素のフォールド活性化を決定します。
2. ALDH1A1活性の高い細胞をイメージングするための蛍光顕微鏡の使用
- T25細胞培養フラスコ中の1×106 細胞を5mLの適切な細胞培養培地中で解凍する。
- 細胞をインキュベーター内で37°Cおよび5%CO2 で2〜3回継代維持する。継代する前に、細胞が80%〜90%のコンフルエントを超えないようにしてください。.
- 共焦点イメージングの前日に、プレート4×105 細胞を8ウェルチャンバースライドに入れた。
- 各ウェルの底部をポリ-L-リジン(0.1 mg/mL、1ウェルあたり100 μL)で10分間コーティングし、その後吸引します。
- 細胞培養グレードの水(ウェルあたり100 μL)を加えて吸引することにより、各ウェルを3回洗浄します。
- 細胞を0.25%トリプシンで10分間トリプシン処理し、自動セルカウンターを使用してカウントし、ウェルあたり4 ×10 5 細胞で細胞をプレートします。
- 細胞を落ち着かせ、一晩(12〜16時間)付着させます。
- 増殖培地を吸引し、無血清培地(ウェルあたり500 μL)を添加し、2 μMのプローブまたはコントロールプローブを添加します。
- プローブを室温で30分間インキュベートし、細胞をすぐにイメージングします。
- 共焦点顕微鏡の電源を入れ、サンプルに合わせて調整します。
- 最低倍率でサンプルを慎重にロードします。適切な配置を確実にするためにセルを見つけます。
- 対物レンズの倍率が10倍であることを確認し、セルを見つけます。
- この実験には、FITCチャネル(励起:488 nmレーザー、発光:516-521 nm)とT-PMT(透過光)チャネルが必要です。T-PMTを使用して細胞を見つけて焦点を合わせ、実験全体にわたって同じz平面に焦点を合わせ、バイアスを除去します。
- レーザー出力とFITCゲインを適切な設定に調整し、Ctrl-AlDeSense AMサンプルからの信号が最小限に検出可能でありながら、AlDeSense AMサンプルの信号が見えるようにします。各パラメータは、対応するバーをスライドさせることで調整できます。正しいパラメータを識別するために、設定を数回調整する必要がある場合があります。最適化が完了したら、同じパラメーターを使用して、その細胞株内で残りの実験を完了します。
- 1ウェルあたり3枚の画像をスナップし、処理条件ごとに合計3枚のウェルをスナップします(合計9枚)。蛍光チャンネルや合成画像を使用するのではなく、バイアスを避けるためにT-PMTを使用して適切な平面に焦点を合わせます。
- 画像を処理して、ALDH1A1+細胞の割合を決定します。
- 画像処理ソフトウェアを使用して、cziファイルを異なるチャネルに分割します。
- 細胞の総数と蛍光細胞の総数を数えます。
- ALDH1A1+細胞の割合を決定するには、蛍光細胞の数を各画像内の細胞の総数で割ります。たとえば、明るさを調整すると交絡変数が追加される可能性があるため、画像を操作せずに各画像について同じ方法でカウントすることが不可欠です。
3. フローサイトメトリーによるALDH1A1活性の高い細胞の同定
- T25細胞培養フラスコ中の1×106 細胞を5mLの適切な細胞培養培地中で解凍する。
- 細胞をインキュベーター内で37°Cおよび5%CO2 で2〜3回継代維持する。継代する前に、細胞が80%〜90%のコンフルエントを超えないようにしてください。.
- 細胞をトリプシン処理、カウント、および15 mL遠沈管で25°Cで5分間遠心分離(180 × g) して ペレット化します。
- 細胞をPBS中の1 mLの2 μMプローブ/コントロールプローブ溶液に再懸濁します。細胞を室温で60分間揺り動かして、色素への曝露が均一になるようにします。
- インキュベーション期間の後、25°Cで5分間の遠心分離(180 × g) を介して 細胞をペレット化します。細胞を0.5 mLのPBSに再懸濁します。細胞をセルストレーナー(35 μmナイロンメッシュ)に通し、フローサイトメーターを詰まらせる可能性のある細胞塊を取り除きます。すぐに細胞を氷の上に置きます。
- 機器の電源を入れ、起動プロトコルを実行します。
- シース液と空の廃棄物がないか確認してください。
- 10%の漂白剤と水でそれぞれ5分間ラインを実行します。
- 品質管理ビーズを実行して、適切な機能を確保します。
- 設定タブで、蛍光フィルターに FSC(前方散乱)、SSC(側方散乱)、およびFITC(フルオレセインイソチオシアネート) を選択します。
- 次のグラフを描画して、生存率、一重項、および蛍光をゲートします。レーザー出力(ユーザーの機器に固有)を最適化して、細胞集団がさらなる分析のために指定されたパラメータ内に収まるようにします。
- FSC-A対SSC-A散布図:メインセル集団はグラフの中央近くにあります。
- FSC-A対FSC-W散布図:(細胞塊ではなく)一重項を示す狭い水平バンド。
- FITC-A対FSC-A散布図:アイソフォーム選択蛍光発生ターンオンプローブでソートされた細胞の分布を観察します。
- FITC-Aヒストグラム:FITCに基づいて集団の変化を観察し、ALDH1A1+細胞の割合を決定します。
- FITCレーザー出力を最適化するには、ヒストグラム曲線の右裾が最大FITC-A信号に近づくようにプローブでサンプルを実行します。続いて、コントロールプローブでサンプルを実行します。最大ダイナミックレンジを明らかにするために、ポピュレーションシフトを観察できる必要があります。レーザー出力の最適化ステップを複数回繰り返す必要がある場合がありますが、実験の設定が指定された後は、サンプル間でレーザー出力を変更しないでください。
- 各サンプルを10,000カウント実行します(3回で行います)。
- 細胞株ごとにステップ3.12を繰り返しますが、取り込みとALDH1A1活性にはばらつきがあります。
- サンプル収集が完了したら、10%漂白剤と水でラインをそれぞれ5分間実行し、機器のシャットダウンを開始します。
- フローサイトメトリーソフトウェアを使用してデータを処理し、目的の細胞集団をゲートします。すべてのイベントが ALDH1A1- ゲートまたは ALDH1A1+ ゲートのいずれかに入るようにゲートを設定します。矩形ゲート選択を使用して、コントロールプローブサンプルのイベントの>99.5%がこのゲート内で発生するようにALDH1A1-ゲートを設定します。残りのセルはALDH1A1+と見なされます。次に、これらの同じゲートをプローブサンプルに適用して、ALDH1A1-およびALDH1A1+と見なされるイベントの数を定量化できます。
結果
卵巣癌細胞ホモジネートの総ALDH1A1活性
このアッセイから得られた各細胞株の平均倍率ターンオンは、BG-1(1.12±0.01)である。IGROV-1 (1.30 ± 0.03);Caov-3 (1.72 ± 0.06);PEO4 (2.51 ± 0.29);およびOVCAR-3(10.25 ± 1.46)(図2)。

図2:蛍光測定で測定した各卵巣癌細胞株のホモジネート中のアイソフォーム選択的色素のフォールド蛍光ターンオン(平均±標準偏差)(n = 3)。 この図の拡大版を表示するには、ここをクリックしてください。
培養卵巣癌細胞におけるALDH1A1+亜集団の分子イメージング
細胞をプローブまたはコントロールプローブと共にインキュベートする際に、各細胞株におけるALDH1A1+細胞の割合を測定した。Ctrl-AlDeSense AM処理サンプルのシグナルを最小限に抑えるようにレーザー出力とゲインを調整することにより、AlDeSense AM処理細胞の蛍光シグナルを最適化しました(図3)。ALDH1A1+細胞の数を数えることにより、ALDH1A1+細胞の割合はBG-1(3.2%±1.6%)であると決定された。PEO4(18.0%±3.6%);OVCAR-3 (39.8% ± 3.9%);IGROV-1(51.7%±5.4%);Caov-3(93.7%±3.4%)(図4)。

図3:代表的な共焦点画像 。 (A,C,E,G,I) Ctrl-AlDeSense AM染色細胞および(B,D,F,H,J)アルデセンスAM染色細胞。左から右に、画像は明視野、蛍光、およびマージを示します。スケールバーは50μmです。 この図の拡大版を表示するには、ここをクリックしてください。

図4:共焦点顕微鏡で測定した各卵巣癌細胞株におけるALDH1A1+細胞の平均割合(平均±標準偏差)(n=9)。 ALDH1A1 +細胞の割合はBG-1です(3.2%±1.6%)。PEO4(18.0%±3.6%);OVCAR-3 (39.8% ± 3.9%);IGROV-1(51.7%±5.4%);Caov-3(93.7%±3.4%)。 この図の拡大版を表示するには、ここをクリックしてください。
フローサイトメトリーを用いたALDH1A1+細胞の集団同定
アイソフォーム選択的蛍光発生プローブの適用により、ALDH1A1+細胞の集団は、さまざまな卵巣癌細胞株にわたって同定されることに成功しました。実験後のデータ解析では、各細胞株内のALDH1A1+細胞集団を、Ctrl-AlDeSense AM処理集団内の最も明るい細胞の上位0.5%をゲーティングすることで定量化することができました(図5)。卵巣癌細胞のパネルの分析により、ALDH1A1 +細胞の割合はBG-1(4.9%±0.4%)であることが明らかになりました。PEO4(5.66%±0.9%);OVCAR-3 (7.6% ± 0.1%);IGROV-1(35.4%±2.8%);Caov-3(70.1%±2.4%)(図6)。
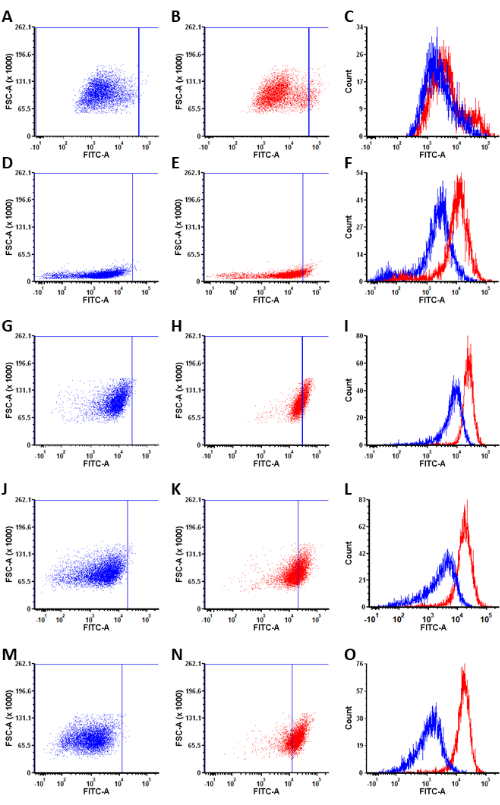
図 5: 代表的な散布図とヒストグラム オーバーレイ。 (A,D,G,J,M) 細胞との1時間のインキュベーション後のCtrl-AlDeSense AM染色の代表的な散布図。(B,E,H,K,N)細胞との1時間のインキュベーション後のAlDeSense AM染色の代表的な散布図。(C,F,L,J,O)これらの条件のCtrl-AlDeSense AMおよびAlDeSense AM染色のヒストグラムオーバーレイ。染色される細胞株は、(A-C)BG-1、(D-F)PEO4、(G-I)OVCAR-3、(J-L)IGROV-1、および(M-O)Caov-3である。この図の拡大版を表示するには、ここをクリックしてください。
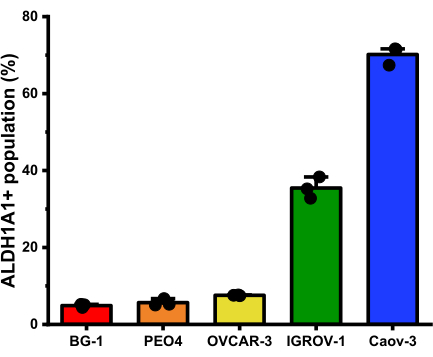
図6:フローサイトメトリーで測定した各卵巣癌細胞株におけるALDH1A1+細胞の平均割合(平均±標準偏差)(n=3)。 ALDH1A1+細胞の割合はBG-1でした(4.9%±0.4%)。PEO4(5.66%±0.9%);OVCAR-3 (7.6% ± 0.1%);IGROV-1(35.4%±2.8%);Caov-3(70.1%±2.4%)。 この図の拡大版を表示するには、ここをクリックしてください。
いくつかのALDHアイソフォーム(すなわち、ALDH1A1、ALDH1A2、ALDH1A3、およびALDH3A1)がCSCにリンクされていますが、卵巣癌の状況では発現レベルが上昇しているため、ALDH1A1がこの研究の標的として選択されました21,27、そしてこのアイソフォームは薬剤耐性を悪化させ28,29、腫瘍形成を増強することが示されています30,31.共焦点イメージングとフローサイトメトリーの結果は、ALDH1A1+細胞の集団の増加の順に一致しています。さらに、細胞ホモジネート実験は、細胞株内の平均活性を明らかにします。併せて、各細胞株のALDH1A1+亜集団内の活性量に関する結論を外挿することができます。BG-1はALDH1A1活性が最も低く、ALDH1A1+集団が最も低いと結論付けることができます。注目すべきことに、ALDH1A1の発現がごくわずかであるため、この研究でネガティブコントロールとして使用するBG1細胞株を選択しました。さらに、共焦点イメージングとフローサイトメトリーでは、Caov-3細胞でALDH1A1+細胞の割合が最も大きいことが明らかになりましたが、細胞株の全体的な活性は3番目に高かっただけです。あるいは、OVCAR-3細胞は3番目に高いALDH1A1+集団を含んでいたが、最も高い全体的な活性を示した。これらの結果から外挿すると、ALDH1A1+ OVCAR-3細胞の亜集団は、ALD1A1+ Caov-3細胞の亜集団よりも高い活性を有する。細胞株または組織サンプル内のALDH1A1集団をさらに分析することにより、ALDH1A1の役割をさらに解明し、ALDH1A1活性の上昇の結果としての表現型の変化を調べることができます。
| 細胞株 | 組織学的タイプ | 蛍光測定(折り畳みオン) | 共焦点(%ポジティブ) | 流量(正の割合) | ||
| BG-1 | 低分化型腺癌 | 1.12 | 3.2 | 4.9 | ||
| PEO4 | 高悪性度漿液性嚢胞腺癌 | 2.51 | 18.0 | 5.7 | ||
| OVCAR-3 | 高悪性度漿液性腺癌 | 10.25 | 39.8 | 7.6 | ||
| イグロフ-1 | 類内膜腺癌 | 1.30 | 51.7 | 35.4 | ||
| Caov-3 | 高悪性度漿液性腺癌 | 1.72 | 93.7 | 70.1 | ||
表1:細胞ホモジネート、共焦点顕微鏡、およびフローサイトメトリーの結果の要約。
ディスカッション
汎選択性は、多くのALDHプローブの主要な制限です。しかしながら、いくつかのアイソフォーム選択的例が最近報告されている32、33、34、35、36、37、38、39、40、41。この研究で使用されたアイソフォーム選択蛍光発生プローブは、大量に存在する競合酵素の存在下でも、ALDH1A1アイソフォームとのみ反応する最初の合理的に設計されたプローブを表しています11,12。このプローブのもう一つの際立った特徴は、プローブ活性化前の蛍光発光が低いという特徴を持つ独特の蛍光発生性です。これは、常に「オン状態」にある蛍光基質(BODIPYアミノアセトアルデヒド[BAAA])を特徴とするALDEFLUORアッセイなどの市販のキットとは対照的です32。BAAAは、活性化されたカルボン酸産物(同様に蛍光性)がALDHを高レベルで発現する細胞においてより多く保持されるという前提に基づいてALDH+細胞を同定します。ALDH細胞におけるプローブの非特異的蓄積を説明するために、対照試料中に存在するALDHをブロックするために阻害剤を適用しなければならない。ただし、これにはいくつかの顕著な欠点が伴います。第一に、ALDH1A1活性を介してCSCを同定することが目的である場合、阻害剤戦略の適用は、他のアイソフォームもさまざまな程度でブロックするため、失敗します。第二に、阻害剤の非特異的挙動は、細胞がグローバルレベルで反応性アルデヒドを解毒する能力を損なう可能性があります。これらの懸念事項の最初のものは、上記のように単一のアイソフォームとのみ反応するため、AlDeSenseの設計で対処されています(補足図1)。2番目の懸念を改善するために、Ctrl-AlDeSenseは阻害剤の役割を置き換えます。具体的には、コントロール試薬は、不活性化されたAlDeSenseとほぼ同一の蛍光シグナルを示し、細胞に同程度まで取り込まれ、主に細胞質に局在します。したがって、コントロールによって確立されたベースラインを超えるシグナルは、ALDH1A1を介したプローブの活性化を表す必要があります。
補足図1:アルデセンスとアルデフルオールの反応性。 (A)各ALDHアイソフォームとのインキュベーション後のAlDeSenseの正規化された蛍光ターンオン、および(B)各ALDHアイソフォームとのALDEFLUORの反応性。すべての測定は三重で行われました。エラーバーはSD±されています。 このファイルをダウンロードするには、ここをクリックしてください。
ハイライトとして選択されたアイソフォーム選択的蛍光発生プローブの最初のアプリケーションは、細胞ホモジネート中のALDH1A1活性の測定です。共焦点顕微鏡やフローサイトメーターなどの特殊な機器が利用できない状況では、一般的な蛍光計を使用することで、サンプル内のALDH1A1の総活性を迅速に報告できます。これらの方針に沿って、サンプル調製の容易さ(細胞培養から切除組織までのサンプルからホモジネートにアクセスできます)により、このアッセイの適用可能性が広がります。ホモジネートで使用するためにアイソフォーム選択的蛍光発生プローブを最適化する際に考慮しなければならないいくつかの重要なパラメータがあります。1つ目は、ライセートサンプルあたりの細胞数の調節です。例えば、蛍光シグナルの変化の程度として定義されるダイナミックレンジが十分に低い場合、サンプルあたりの細胞数を増やすことができます。同様に、インキュベーション時間は、より多くの蛍光発生プローブを活性化してより強い蛍光読み出しを得ることができるように調整することもできる。しかしながら、この方法の主要な制限は、様々なレベルのALDH1A1活性を示す細胞の亜集団を区別できないことであることは注目に値する。細胞はALDH1A1の状態に関係なく結合および溶解されるため、酵素活性の量はサンプルに存在するすべての細胞で平均化されます。これにより、共焦点顕微鏡やフローサイトメトリー分析(報告されているALDH+細胞の割合)とは異なる結果が得られます。BG-1細胞は、最も低いフォールドターンオン応答を示し、ALDH1A1+細胞の集団も最小ですが、残りの4つの細胞株の順序は一貫性がなくなります。例えば、ホモジネートアッセイでは、OVCAR-3細胞がALDH1A1の全体的な活性が最も高いことが特定されますが、共焦点顕微鏡とフローサイトメトリーでは3位にとどまります。このデータの解釈は、ALDH1A1+細胞はさまざまなレベルの活性を持っている必要があるということです。最後に、このタイプの「ターンオン」実験は、蓄積ベースのプローブでは不可能であることに注意することが重要です。
さらに、アイソフォーム選択的蛍光発生プローブは、ALDH1A1+細胞集団を可視化するための分子イメージング剤です。注目すべきは、このデモンストレーションでは共焦点顕微鏡を使用しましたが、この蛍光発生プローブは、自動セルカウンター、落射蛍光顕微鏡、広視野照明装置など、さまざまなイメージングセットアップと互換性があります。この実験の最も重要なステップの1つは、Ctrl-AlDeSenseを使用して適切な閾値パラメータ(ピンホールサイズ、レーザー出力、FITCゲインなど)を確立することです。この点で、Ctrl-AlDeSense信号がバックグラウンドのすぐ上になるように設定を調整する必要があります。ユーザーがこの信号を見るためにレーザー出力を上げる必要があることに気付いた場合は、光毒性の増加またはプローブの漂白のためにレーザー出力を増やす(50%以上)よりも、色素染色期間または負荷濃度を延長することをお勧めします。共焦点イメージングの制限は、Ctrl-AlDeSenseを使用したゲーティング時の変動性です。この警告にもかかわらず、ALDH1A1+細胞の割合の増加に基づいて観察された細胞株の順序は、フローサイトメトリー で 得られた結果と同じでした。可視化される細胞の最大数が視野によって制限される分子イメージングとは異なり、一般的なフローサイトメトリー実験では、最大数万個の細胞を分析します。染色時間と負荷濃度の考慮事項は、分子イメージングで説明したものと同様です。考慮しなければならない追加の要素は、偽陽性のALDH1A1+集団が誤認されないようにするための細胞懸濁液中の色素染色です。
最後に、この記事では、卵巣がん細胞を例に、さまざまなモダリティに合わせてAlDeSenseを最適化するプロセスに焦点を当てます。これは、このがん21,22,23,24型におけるALDH1A1発現に関して矛盾する報告が存在する理由に答えるための重要な第一歩である。私たちが示したことを超えて、このアイソフォーム選択的蛍光発生プローブは、薬剤候補として出現する可能性のあるALDH1A1選択的阻害剤を特定するためのハイスループットスクリーニングキャンペーンで使用できると想定しています。さらに、このプローブは、最初の出版物11で実証したように、生きている動物のCSCを識別するために引き続き使用される可能性があります。アイソフォーム選択的蛍光発生プローブの緑色発光特性は、赤色発光蛍光タンパク質、低分子色素、または分析種応答性プローブと組み合わせて使用できるマルチプレックス実験に最適です。さらに、アイソフォーム選択的蛍光発生プローブの赤色バージョンが存在し、このマルチプレックス容量をさらに拡大することができる12。最後に、医療面では、このプローブは、ポイントオブケア治療の意思決定のための臨床現場での予後ツールとして使用できます。ALDH1A1活性およびALDH1A1+細胞集団を定量化することは、がんの攻撃性を判断する方法として役立ち、より良い生活の質のための個別化された治療戦略を可能にする。さらに、AlDeSenseを使用すると、読み出しを数時間で配信および解釈できます。
開示事項
AlDeSense技術に関する出願中の特許(US20200199092A1)を開示します。
謝辞
この研究は、国立衛生研究所(R35GM133581からJC)およびイリノイ州がんセンター大学院奨学金(SGに授与)の支援を受けました。JCは、カミーユとヘンリー・ドレフュス財団の支援に感謝します。著者らは、AlDeSenseとAlDeSense AMの株式の準備に最初に貢献したThomas E. Bearrood博士に感謝しています。オリバー・D・ピチャルド・ペゲーロ氏とジョセフ・A・フォルツァーノ氏には、さまざまな合成前駆体の調製にご協力いただき、ありがとうございました。Caov-3、IGROV-1、およびPEO4細胞について、Erik Nelson教授(UIUC分子統合生理学部門)に感謝します。BG-1細胞を提供してくれたPaul Hergenrother教授(UIUC化学科)に感謝します。Zeiss LSM 700共焦点顕微鏡と対応するソフトウェアにアクセスしてくださったCarl R. Woese Institute for Genomic Biologyのコア施設に感謝します。BD LSR II CMtO Analyzerへのアクセスを提供してくださったフローサイトメトリー施設に感謝します。細胞培養培地の調製を支援してくれたサンドラ・マクマスターズ博士と細胞培地施設に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
参考文献
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved