Method Article
Applicazione di AlDeSense per stratificare cellule tumorali ovariche basate sull'attività dell'aldeide deidrogenasi 1A1
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
I metodi per misurare l'attività di ALDH1A1 nelle cellule vive sono fondamentali nella ricerca sul cancro a causa del suo status di biomarcatore della staminalità. In questo studio, abbiamo impiegato una sonda fluorogenica isoform-selettiva per determinare i livelli relativi di attività di ALDH1A1 in un pannello di cinque linee cellulari di cancro ovarico.
Abstract
La recidiva dopo il trattamento del cancro è spesso attribuita alla persistenza di una sottopopolazione di cellule tumorali note come cellule staminali tumorali (CSC), che sono caratterizzate dalla loro notevole capacità di iniziare il tumore e di auto-rinnovarsi. A seconda dell'origine del tumore (ad esempio, ovaie), il profilo del biomarcatore di superficie CSC può variare notevolmente, rendendo l'identificazione di tali cellule tramite colorazione immunoistochimica uno sforzo impegnativo. Al contrario, l'aldeide deidrogenasi 1A1 (ALDH1A1) è emersa come un eccellente marcatore per identificare le CSC, grazie al suo profilo di espressione conservato in quasi tutte le cellule progenitrici, comprese le CSC. L'isoforma ALDH1A1 appartiene a una superfamiglia di 19 enzimi responsabili dell'ossidazione di varie aldeidi endogene e xenobiotiche ai corrispondenti prodotti di acido carbossilico. Chan et al. hanno recentemente sviluppato AlDeSense, una sonda "turn-on" selettiva per l'isoforma per il rilevamento dell'attività di ALDH1A1, nonché un reagente di controllo di corrispondenza non reattivo (Ctrl-AlDeSense) per tenere conto della colorazione fuori bersaglio. Questo strumento selettivo per le isoforme ha già dimostrato di essere uno strumento chimico versatile attraverso la rilevazione dell'attività di ALDH1A1 nelle cellule di leucemia mieloide K562, nelle mammosfere e negli xenotrapianti CSC derivati dal melanoma. In questo articolo, l'utilità della sonda è stata mostrata attraverso ulteriori esperimenti di fluorimetria, microscopia confocale e citometria a flusso in cui la relativa attività di ALDH1A1 è stata determinata in un pannello di cinque linee cellulari di cancro ovarico.
Introduzione
Le cellule staminali tumorali (CSC) sono una sottopopolazione di cellule tumorali che presentano proprietà simili alle cellule staminali1. Simili alle loro controparti non cancerose, le CSC possiedono la straordinaria capacità di auto-rinnovarsi e proliferare. Insieme ad altri meccanismi incorporati, come la sovraregolazione dei trasportatori di cassette che legano ATP, le CSC sono spesso risparmiate dagli sforzi iniziali di debulking chirurgico, nonché dalla successiva terapia adiuvante2. A causa del loro ruolo critico nella resistenza al trattamento3, recidiva4 e metastasi5, le CSC sono diventate una priorità nella ricerca sul cancro. Sebbene ci sia una varietà di antigeni di superficie cellulare (ad esempio, CD133) che possono essere utilizzati per identificare le CSCs6, sfruttare l'attività enzimatica delle aldeidi deidrogenasi (ALDH) trovate nel citoplasma è emerso come un'alternativa attraente7. Gli ALDH sono una superfamiglia di 19 enzimi responsabili della catalizzazione dell'ossidazione delle aldeidi reattive endogene e xenobiotiche nei corrispondenti prodotti di acido carbossilico8.
In generale, la disintossicazione da aldeide è fondamentale per proteggere le cellule da eventi di reticolazione indesiderati e stress ossidativo che possono danneggiare l'integrità delle cellule staminali9. Inoltre, l'isoforma 1A1 controlla il metabolismo dell'acido retinoico, che a sua volta influenza la staminalità attraverso la segnalazione10 della retinaldeide. AlDeSense 11,12, una sonda di rilevamento basato sull'attività (ABS) a piccole molecole per rilevare selettivamente l'attività di ALDH1A1, è stata recentemente sviluppata. I progetti ABS ottengono il rilevamento dell'analita attraverso un cambiamento chimico piuttosto che un evento di legame, consentendo un'elevata selettività e una riduzione delle risposte fuori bersaglio13,14,15,16. Il principio di progettazione della sonda fluorogenica selettiva per isoforme si basa su un meccanismo di spegnimento17 del trasferimento elettronico fotoindotto da donatore (d-PeT), originato dal gruppo funzionale aldeidico, che serve a sopprimere la firma fluorescente della sonda18. Dopo la conversione mediata da ALDH1A1 nell'acido carbossilico, il rilassamento radiativo viene sbloccato per produrre un prodotto altamente fluorescente. Poiché la tempra d-PeT non è mai efficiente al 100%, la fluorescenza residua che può portare a possibili risultati falsi positivi è stata considerata quando si stabilisce questo test attraverso lo sviluppo di Ctrl-AlDeSense, un reagente non reattivo con caratteristiche fotofisiche corrispondenti (ad esempio, resa quantica) e un identico modello di colorazione citoplasmatica nelle cellule. Se utilizzato in tandem, questo accoppiamento unico può distinguere in modo affidabile le cellule con elevata attività di ALDH1A1 da quelle che presentano bassi livelli tramite fluorimetria, imaging molecolare e citometria a flusso. Diversi vantaggi chiave sono associati all'uso di coloranti attivabili isoform-selettivi rispetto ai metodi immunoistochimici tradizionali. Ad esempio, si ipotizza che le CSC siano sepolte in profondità all'interno di un tumore, e quindi sono più accessibili a una piccola molecola rispetto ai grandi anticorpi19. Inoltre, il prodotto fluorescente capovolto non modifica covalentemente alcun componente cellulare, il che significa che può essere facilmente rimosso tramite cicli di lavaggio per lasciare un CSC in uno stato non modificato. Infine, la risposta di accensione identifica solo cellule e funzioni vitali, proprio come il test MTT, a causa della sua dipendenza dal cofattore NAD +.
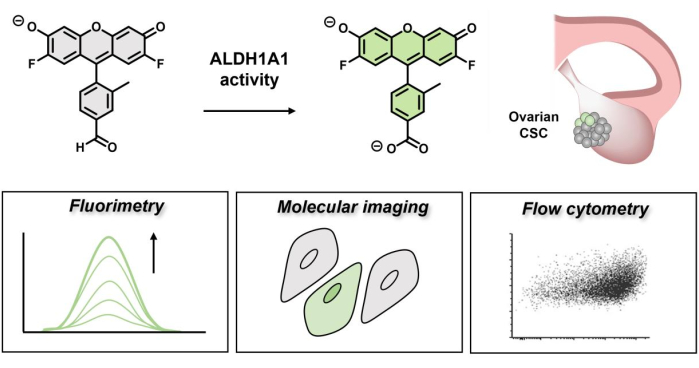
Figura 1: Schema che dimostra l'accensione fluorescente di AlDeSense. Il colorante isoform-selettivo è attivato da ALDH1A1 e può essere utilizzato per identificare un'elevata attività di ALDH1A1 nelle cellule tumorali ovariche tramite fluorimetria, imaging molecolare e citometria a flusso. Fare clic qui per visualizzare una versione ingrandita di questa figura.
In lavori precedenti, il test della sonda fluorogenica selettiva per isoforme ha stratificato con successo cellule ALDH alte (ALDH +) da cellule ALDH basse (ALDH-) in cellule di leucemia cronica umana K562, cellule di cancro al seno umano MDA-MB-231 e cellule di melanoma murino B16F0. Questo è importante perché, per molti tipi di cancro, un'elevata espressione della proteina ALDH1A1 significa una prognosi clinica peggiore20. Ciò presuppone che livelli elevati di ALDH1A1 siano indicativi di CSC che possono eludere il trattamento, sviluppare resistenza e diffondersi in tutto il corpo. Tuttavia, nel caso del carcinoma ovarico, ci sono studi che riportano il risultato opposto (un'elevata espressione di ALDH1A1 è legata a una migliore sopravvivenza della paziente)21,22,23,24. Sebbene ciò possa sembrare contraddittorio a prima vista, l'espressione non è necessariamente correlata all'attività enzimatica, che può essere influenzata da cambiamenti nel microambiente tumorale (ad esempio, flusso di pH, gradienti di ossigeno), disponibilità del cofattore NAD+ o substrati aldeidici, livelli di acidi carbossilici (inibizione del prodotto) e modifiche post-traduzionali che possono alterare l'attività enzimatica25 . Inoltre, il carcinoma ovarico è diviso in cinque tipi istologici principali (sieroso di alto grado, sieroso di basso grado, endometrioide, a cellule chiare e mucinoso), che ipotizziamo saranno caratterizzati da livelli variabili di attività ALDH1A126. Con l'obiettivo di studiare l'attività di ALDH1A1 nei tumori ovarici, è stato utilizzato un saggio di sonda fluorogenica selettiva per identificare le popolazioni di ALDH1A1+ in un pannello di cinque linee cellulari di cancro ovarico appartenenti ai diversi tipi istologici sopra menzionati. Le linee cellulari testate in questo studio includono cellule BG-1, Caov-3, IGROV-1, OVCAR-3 e PEO4, che coprono istotipi a cellule chiare e sierosi. Qui, la versatilità e la generalizzabilità della sonda è stata evidenziata per identificare le CSC per i ricercatori che cercano di eseguire studi simili in altre linee cellulari tumorali immortalizzate e campioni di pazienti. L'uso di AlDeSense farà luce sui percorsi biochimici coinvolti nel mantenimento delle CSC in microambienti tissutali complessi e potenzialmente servirà come strumento clinico per determinare la prognosi e misurare l'aggressività del cancro.
Protocollo
1. Misurare l'attività totale di ALDH1A1 negli omogenati delle cellule tumorali ovariche tramite fluorimetria
- Scongelare 1 × 106 cellule in un matraccio di coltura cellulare T25 in 5 mL dei seguenti terreni di coltura cellulare:
- IGROV-1 e PEO4: Roswell Park Memorial Institute (RPMI) 1640 terreno con 10% siero bovino fetale (FBS) e 1% penicillina/streptomicina (P/S).
- BG-1 e Caov-3: Modified Eagle's Medium (DMEM) di Dulbecco con 10% FBS e 1% P/S.
- OVCAR-3: RPMI 1640 con 20% FBS, 1% P/S e 0,01 mg/mL di insulina.
- Mantenere le cellule in un incubatore a 37 °C e al 5% di CO2 per due o tre passaggi. Assicurarsi che le celle non superino l'80% -90% di confluenza prima di passare.
- Tripsinizzare le cellule in tripsina allo 0,25% per 10 minuti, contarle utilizzando un contatore automatico di celle e pellettare 1 × 107 cellule mediante centrifugazione (180 × g) a 25 °C per 5 minuti.
- Rimuovere accuratamente il surnatante tramite aspirazione, lavare il pellet risospendendo le cellule in 1 mL di 1x PBS e ripellettare le cellule tramite centrifugazione nelle stesse condizioni descritte al punto 4.
- Risospendere le cellule in una soluzione di 1x inibitore della proteasi in 1x PBS. Utilizzare 1 mL di questa soluzione per 2,5 × 106 cellule.
- Sonicare la sospensione cellulare sul ghiaccio per 2 minuti (impulso 1 s, ampiezza 40%) con una sonda omogeneizzatore cellulare.
- Frazioni insolubili/membrana di pellet tramite centrifugazione (3.200 × g) a 25 °C per 15 min. Rimuovere e mantenere il surnatante, in quanto questo è l'omogenato che verrà utilizzato nei passaggi successivi. Separare gli omogenati in tre cuvette per eseguire l'esperimento in triplice copia.
- Aggiungere la sonda all'omogenato per ottenere una concentrazione finale della sonda di 4 μM. Pipettare su e giù tre volte per miscelare bene la soluzione.
- Misurare il segnale fluorescente immediatamente dopo l'aggiunta e dopo i tempi di incubazione desiderati su un fluorimetro. Il tempo di incubazione può essere ottimizzato per vedere la massima accensione della piega (1 ora in questo esperimento). Il tempo di incubazione deve essere costante su tutte le linee cellulari confrontate.
- Impostare la lunghezza d'onda di eccitazione su 496 nm.
- Impostare l'emissione su 510-600 nm.
- Impostare la larghezza della fessura su 0,5 mm.
- Pipetta la soluzione in una cuvetta al quarzo da 1 ml, inserirla nel fluorimetro e premere la scansione.
- Dividere l'intensità finale di fluorescenza a 516 nm (lunghezza d'onda fluorescente massima) per l'intensità alla stessa lunghezza d'onda dalla lettura iniziale per determinare l'attivazione della piega del colorante selettivo per isoforme.
2. Uso della microscopia a fluorescenza per l'immagine di cellule con elevata attività di ALDH1A1
- Scongelare 1 × 106 cellule in un matraccio di coltura cellulare T25 in 5 mL del terreno di coltura cellulare appropriato.
- Mantenere le cellule in un incubatore a 37 °C e al 5% di CO2 per due o tre passaggi. Assicurarsi che le celle non superino l'80% -90% di confluenza prima di passare.
- Il giorno prima dell'imaging confocale, la piastra 4 × 105 celle in un vetrino a 8 pozzetti.
- Rivestire il fondo di ciascun pozzetto con poli-L-lisina (0,1 mg/ml, 100 μL per pozzetto) per 10 minuti, aspirando successivamente.
- Lavare ogni pozzetto 3 volte aggiungendo acqua per coltura cellulare (100 μL per pozzetto) e aspirando.
- Tripsinizzare le cellule in tripsina allo 0,25% per 10 minuti, contarle usando un contatore automatico delle cellule e placcare le cellule a 4 × 105 cellule per pozzetto.
- Lasciare che le cellule si depositino e si attacchino durante la notte (12-16 h).
- Aspirare il terreno di coltura e aggiungere mezzi privi di siero (500 μL per pozzetto), integrati con 2 μM della sonda o della sonda di controllo.
- Incubare con la sonda a temperatura ambiente per 30 minuti e visualizzare immediatamente le cellule.
- Accendere il microscopio confocale e regolare il campione.
- Caricare il campione con attenzione al minor ingrandimento; Trova le celle per garantire il corretto posizionamento.
- Assicurarsi che l'obiettivo abbia un ingrandimento 10x e individuare le celle.
- Per questo esperimento sono necessari il canale FITC (eccitazione: laser 488 nm; emissione: 516-521 nm) e il canale T-PMT (luce trasmessa). Individuare e concentrarsi sulle cellule utilizzando T-PMT per concentrarsi sullo stesso piano z per l'intero esperimento per rimuovere la distorsione.
- Regolare la potenza del laser e il guadagno FITC sull'impostazione appropriata, in cui il segnale proveniente dai campioni AM Ctrl-AlDeSense è minimamente rilevabile, pur continuando a vedere il segnale nei campioni AM AlDeSense. Ogni parametro può essere regolato facendo scorrere la barra corrispondente. Potrebbe essere necessario regolare alcune volte le impostazioni per identificare i parametri corretti. Una volta ottimizzato, completa il resto dell'esperimento all'interno di quella linea cellulare usando parametri identici.
- Scatta tre immagini per pozzetto per un totale di tre pozzetti per condizione di trattamento (nove immagini in totale). Concentrati sul piano corretto usando T-PMT per evitare distorsioni piuttosto che utilizzare il canale di fluorescenza o l'immagine unita.
- Elaborare le immagini per determinare la percentuale di cellule ALDH1A1+.
- Utilizzando il software di elaborazione delle immagini, dividere il file czi in diversi canali.
- Contare il numero totale di celle e il numero totale di celle fluorescenti.
- Per determinare la percentuale di celle ALDH1A1+, dividere il numero di celle fluorescenti per il numero totale di celle in ciascuna immagine. È imperativo contare allo stesso modo per ogni immagine senza manipolare le immagini, poiché, ad esempio, la regolazione della luminosità può aggiungere una variabile confondente.
3. Applicazione della citometria a flusso per identificare cellule con elevata attività di ALDH1A1
- Scongelare 1 × 106 cellule in un matraccio di coltura cellulare T25 in 5 mL del terreno di coltura cellulare appropriato.
- Mantenere le cellule in un incubatore a 37 °C e al 5% di CO2 per due o tre passaggi. Assicurarsi che le celle non superino l'80% -90% di confluenza prima di passare.
- Tripsinizzare, contare e pellettare le celle in una provetta da centrifuga da 15 mL mediante centrifugazione (180 × g) a 25 °C per 5 minuti.
- Risospendere le cellule in 1 mL di soluzione sonda da 2 μM/sonda di controllo in PBS. Scuotere le cellule a temperatura ambiente per 60 minuti per garantire che l'esposizione al colorante sia uniforme.
- Dopo il periodo di incubazione, pellettare le cellule mediante centrifugazione (180 × g) a 25 °C per 5 minuti. Risospendere le cellule in 0,5 ml di PBS. Far passare le cellule attraverso un filtro cellulare (rete di nylon da 35 μm) per rimuovere i grumi di cellule che potrebbero ostruire il citometro a flusso. Posizionare immediatamente le celle sul ghiaccio.
- Accendere lo strumento ed eseguire il protocollo di avvio.
- Verificare la presenza di liquidi per guaine e rifiuti vuoti.
- Fai funzionare le linee con candeggina al 10% e acqua per 5 minuti ciascuna.
- Eseguire perline di controllo qualità per garantire il corretto funzionamento.
- Nella scheda delle impostazioni, selezionare FSC (forward scatter), SSC (side scatter) e FITC (fluorescein isothiocyanate) per il filtro a fluorescenza.
- Disegna i seguenti grafici per rilevare vitalità, canottiere e fluorescenza. Ottimizzare la potenza del laser (specifica per lo strumento dell'utente) in modo che le popolazioni cellulari rientrino nei parametri indicati per ulteriori analisi.
- Grafico a dispersione FSC-A contro SSC-A: la popolazione cellulare principale è vicina al centro del grafico.
- Grafico a dispersione FSC-A contro FSC-W: banda orizzontale stretta indicativa di singoletti (piuttosto che grumi di cellule).
- Grafico a dispersione FITC-A versus FSC-A: osservare la distribuzione delle cellule ordinate dalla sonda fluorogenica selettiva per isoforme.
- Istogramma FITC-A: osservare lo spostamento della popolazione basato su FITC per determinare la percentuale di cellule ALDH1A1+.
- Per ottimizzare la potenza del laser FITC, eseguire un campione con la sonda in modo che la coda destra della curva dell'istogramma sia vicina al segnale FITC-A massimo. Successivamente, eseguire un campione con la sonda di controllo. Uno spostamento della popolazione dovrebbe essere osservabile per rivelare la gamma dinamica massima. La fase di ottimizzazione della potenza del laser potrebbe dover essere ripetuta più volte, ma la potenza del laser non dovrebbe essere alterata tra i campioni una volta che un'impostazione è stata designata per un esperimento.
- Eseguire ogni campione per 10.000 conteggi (operazione eseguita in triplice copia).
- Ripetere il passaggio 3.12 per ciascuna linea cellulare, poiché ci sarà variabilità nell'assorbimento e nell'attività di ALDH1A1.
- Dopo aver completato la raccolta dei campioni, eseguire le linee con candeggina al 10% e acqua per 5 minuti ciascuna, quindi avviare lo spegnimento dello strumento.
- Elaborare i dati utilizzando il software di citometria a flusso e controllare la popolazione cellulare desiderata. Impostare le porte in modo che tutti gli eventi rientrino nella porta ALDH1A1- o ALDH1A1+. Utilizzando la selezione del gate rettangolare, impostare il gate ALDH1A1- in modo che il >99,5% degli eventi nei campioni della sonda di controllo si verifichi all'interno di questo gate. Le celle rimanenti saranno considerate ALDH1A1+. Queste stesse porte possono quindi essere applicate al campione di sonda per quantificare il numero di eventi considerati ALDH1A1- e ALDH1A1+.
Risultati
Attività totale di ALDH1A1 degli omogenati delle cellule tumorali ovariche
I turn-on di piegatura medi per ciascuna linea cellulare ottenuta da questo test sono: BG-1 (1,12 ± 0,01); IGROV-1 (1,30 ± 0,03); Caov-3 (1,72 ± 0,06); PEO4 (2,51 ± 0,29); e OVCAR-3 (10,25 ± 1,46) (Figura 2).

Figura 2: L'accensione fluorescente del colorante selettivo per isoforme negli omogenati di ciascuna linea cellulare di cancro ovarico misurata mediante fluorimetria (deviazione media ± standard) (n = 3). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Imaging molecolare di sottopopolazioni ALDH1A1+ in cellule tumorali ovariche in coltura
Dopo aver incubato le cellule con una sonda o una sonda di controllo, la percentuale di cellule ALDH1A1+ è stata determinata in ciascuna linea cellulare. Regolando la potenza e il guadagno del laser per ridurre al minimo il segnale nel campione trattato con Ctrl-AlDeSense AM, il segnale di fluorescenza è stato ottimizzato nelle celle trattate con AlDeSense AM (Figura 3). Contando il numero di cellule ALDH1A1+, la percentuale di cellule ALDH1A1+ è stata determinata essere: BG-1 (3,2% ± 1,6%); PEO4 (18,0% ± 3,6%); OVCAR-3 (39,8% ± 3,9%); IGROV-1 (51,7% ± 5,4%); e Caov-3 (93,7% ± 3,4%) (Figura 4).

Figura 3: Immagini confocali rappresentative . (A,C,E,G,I) Ctrl-AlDeSense AM cellule colorate e (B,D,F,H,J) AlDeSense AM cellule colorate. Da sinistra a destra, le immagini mostrano campo luminoso, fluorescenza e fusione. Le barre della scala sono 50 μm. Fare clic qui per visualizzare una versione ingrandita di questa figura.

Figura 4: La percentuale media di cellule ALDH1A1+ in ciascuna linea cellulare di cancro ovarico misurata mediante microscopia confocale (deviazione standard media ±) (n = 9). La percentuale di cellule ALDH1A1+ è BG-1 (3,2% ± 1,6%); PEO4 (18,0% ± 3,6%); OVCAR-3 (39,8% ± 3,9%); IGROV-1 (51,7% ± 5,4%); e Caov-3 (93,7% ± 3,4%). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Identificazione della popolazione di cellule ALDH1A1+ mediante citometria a flusso
Con l'applicazione della sonda fluorogenica isoform-selettiva, la popolazione di cellule ALDH1A1+ è stata identificata con successo attraverso diverse linee cellulari di cancro ovarico. Durante l'analisi dei dati post-sperimentali, la popolazione cellulare ALDH1A1+ all'interno di ciascuna linea cellulare potrebbe essere quantificata mediante il gating per lo 0,5% superiore delle cellule più luminose all'interno della popolazione trattata con Ctrl-AlDeSense AM (Figura 5). L'analisi del pannello di cellule tumorali ovariche ha rivelato che le percentuali di cellule ALDH1A1+ sono: BG-1 (4,9% ± 0,4%); PEO4 (5,66% ± 0,9%); OVCAR-3 (7,6% ± 0,1%); IGROV-1 (35,4% ± 2,8%); e Caov-3 (70,1% ± 2,4%) (Figura 6).
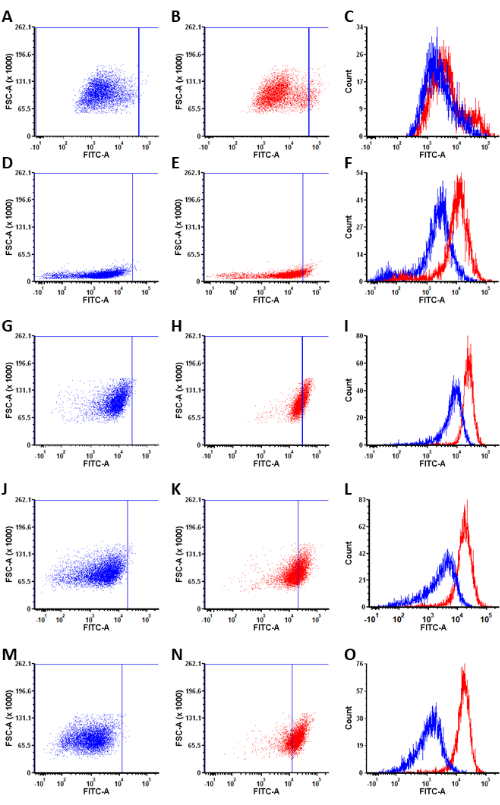
Figura 5: Grafici a dispersione rappresentativi e sovrapposizione dell'istogramma. (A,D,G,J,M) Grafici a dispersione rappresentativi della colorazione Ctrl-AlDeSense AM dopo un'incubazione di 1 ora con cellule. (B,E,H,K,N) Grafici a dispersione rappresentativi della colorazione AM AlDeSense dopo un'incubazione di 1 ora con cellule. (C,F,L,J,O) Sovrapposizione istogramma di Ctrl-AlDeSense AM e AlDeSense AM colorazione di queste condizioni. Le linee cellulari colorate sono (A-C) BG-1, (D-F) PEO4, (G-I) OVCAR-3, (J-L) IGROV-1 e (M-O) Caov-3. Fare clic qui per visualizzare una versione ingrandita di questa figura.
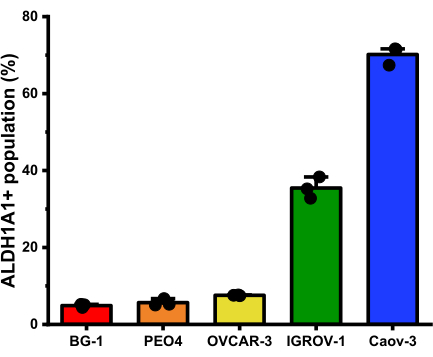
Figura 6: La percentuale media di cellule ALDH1A1+ in ciascuna linea cellulare di cancro ovarico misurata mediante citometria a flusso (deviazione standard media ±) (n = 3). La percentuale di cellule ALDH1A1+ era BG-1 (4,9% ± 0,4%); PEO4 (5,66% ± 0,9%); OVCAR-3 (7,6% ± 0,1%); IGROV-1 (35,4% ± 2,8%); e Caov-3 (70,1% ± 2,4%). Fare clic qui per visualizzare una versione ingrandita di questa figura.
Mentre diverse isoforme di ALDH (cioè ALDH1A1, ALDH1A2, ALDH1A3 e ALDH3A1) sono state collegate alle CSCs, ALDH1A1 è stato selezionato come bersaglio per questo studio perché, nel contesto del carcinoma ovarico, i livelli di espressione sono elevati 21,27, e questa isoforma ha dimostrato di esacerbare la resistenza ai farmaci28,29 e migliorare la tumorigenesi 30,31 . I risultati dell'imaging confocale e della citometria a flusso sono in accordo nell'ordine della crescente popolazione di cellule ALDH1A1+. Inoltre, gli esperimenti sull'omogenato cellulare rivelano l'attività media all'interno di una linea cellulare. In concomitanza, è possibile estrapolare conclusioni sulla quantità di attività all'interno delle sottopopolazioni ALDH1A1+ di ciascuna linea cellulare. Si può concludere che BG-1 ha la più bassa attività ALDH1A1 e la più bassa popolazione ALDH1A1+. Da notare, abbiamo selezionato la linea cellulare BG1 da utilizzare come controllo negativo in questo studio, a causa della trascurabile espressione di ALDH1A1. Inoltre, l'imaging confocale e la citometria a flusso hanno rivelato la più grande percentuale di cellule ALDH1A1+ nelle cellule Caov-3, ma l'attività complessiva della linea cellulare era solo la terza più alta. In alternativa, le cellule OVCAR-3 contenevano la terza più alta popolazione di ALDH1A1+, ma mostravano la più alta attività complessiva. Estrapolando da questi risultati, la sottopopolazione delle cellule ALDH1A1+ OVCAR-3 ha un'attività maggiore rispetto alla sottopopolazione delle cellule ALD1A1+ Caov-3. Attraverso un'ulteriore analisi della popolazione di ALDH1A1 all'interno di linee cellulari o campioni di tessuto, il ruolo di ALDH1A1 può essere ulteriormente chiarito e possono essere studiati i cambiamenti fenotipici a seguito di un'elevata attività di ALDH1A1.
| Linea cellulare | Tipo istologico | Fluorimetria (piega accesa) | Confocale (% positivo) | Flusso (% positivo) | ||
| BG-1 · | Adenocarcinoma scarsamente differenziato | 1.12 | 3.2 | 4.9 | ||
| PEO4 | Cistoadenocarcinoma sieroso di alto grado | 2.51 | 18.0 | 5.7 | ||
| OVCAR-3 | Adenocarcinoma sieroso di alto grado | 10.25 | 39.8 | 7.6 | ||
| IGROV-1 | Adenocarcinoma endometrioide | 1.30 | 51.7 | 35.4 | ||
| Caov-3 | Adenocarcinoma sieroso di alto grado | 1.72 | 93.7 | 70.1 | ||
Tabella 1: Riassunto dei risultati degli omogenati cellulari, della microscopia confocale e della citometria a flusso.
Discussione
La panselettività è una delle principali limitazioni di molte sonde ALDH; Tuttavia, sono stati recentemente riportati diversi esempi selettivi per isoforme 32,33,34,35,36,37,38,39,40,41. La sonda fluorogenica isoform-selettiva utilizzata in questo studio rappresenta la prima sonda progettata razionalmente che reagisce solo con l'isoforma ALDH1A1, anche in presenza di enzimi concorrenti che sono presenti in grandi quantità in eccesso11,12. Un'altra caratteristica distintiva di questa sonda è la sua natura fluorogenica unica, che è caratterizzata da una bassa emissione di fluorescenza prima dell'attivazione della sonda. Ciò è in contrasto con i kit commerciali come il saggio ALDEFLUOR, che presenta un substrato fluorescente (BODIPY aminoacetaldeide [BAAA]) che è sempre in uno stato "on-state"32. BAAA identifica le cellule ALDH+ sulla base della premessa che il prodotto carbossilato attivato (che è ugualmente fluorescente) è trattenuto in misura maggiore nelle cellule che esprimono ALDH a livelli elevati. Per tenere conto dell'accumulo non specifico della sonda nelle cellule ALDH, deve essere applicato un inibitore per bloccare gli ALDH presenti in un campione di controllo. Tuttavia, questo è accompagnato da diversi notevoli inconvenienti. In primo luogo, se l'intento è quello di identificare le CSCs tramite l'attività di ALDH1A1, l'applicazione della strategia inibitrice fallisce perché blocca anche altre isoforme in misura variabile. In secondo luogo, il comportamento non specifico dell'inibitore può compromettere la capacità di una cellula di disintossicare le aldeidi reattive a livello globale. La prima di queste preoccupazioni è affrontata nella progettazione di AlDeSense, perché reagisce solo con una singola isoforma come menzionato sopra (Figura supplementare 1). Per migliorare la seconda preoccupazione, Ctrl-AlDeSense sostituisce il ruolo dell'inibitore. In particolare, il reagente di controllo presenta un segnale fluorescente quasi identico a quello di AlDeSense inattivato, viene assorbito in egual misura dalle cellule e localizza prevalentemente nel citoplasma. Qualsiasi segnale oltre la linea di base stabilita dal controllo deve quindi rappresentare l'attivazione della sonda mediata da ALDH1A1.
Figura supplementare 1: La reattività di AlDeSense e ALDEFLUOR. (A) Attivazione normalizzata della fluorescenza di AlDeSense dopo l'incubazione con ciascuna isoforma di ALDH e (B) reattività di ALDEFLUOR con ciascuna isoforma di ALDH. Tutte le misurazioni sono state effettuate in triplice copia; le barre di errore sono ± SD. Clicca qui per scaricare questo file.
La prima applicazione della sonda fluorogenica isoform-selettiva scelta per evidenziare è la misura dell'attività di ALDH1A1 negli omogenati cellulari. In circostanze in cui non sono disponibili strumentazioni specializzate come microscopi confocali o citometri a flusso, l'uso di fluorimetri comuni può riportare rapidamente l'attività totale di ALDH1A1 all'interno di un campione. In questo senso, la facilità di preparazione del campione (gli omogenati sono accessibili da campioni che vanno dalle colture cellulari al tessuto asportato) amplia l'applicabilità di questo test. Ci sono alcuni parametri chiave che devono essere considerati quando si ottimizza la sonda fluorogenica selettiva per l'isoforma per l'uso con omogenati. Il primo riguarda la modulazione del numero di cellule per campione di lisato. Ad esempio, se la gamma dinamica, definita come l'estensione del cambiamento del segnale fluorescente, non è sufficientemente bassa, il numero di celle per campione può essere aumentato. Allo stesso modo, il tempo di incubazione può anche essere regolato in modo tale che più sonda fluorogenica possa essere attivata per produrre una lettura fluorescente più forte. Tuttavia, è interessante notare che una delle principali limitazioni di questo metodo è l'incapacità di distinguere tra sottopopolazioni di cellule che mostrano diversi livelli di attività di ALDH1A1. Poiché le cellule sono combinate e lisate indipendentemente dal loro stato di ALDH1A1, la quantità di attività enzimatica viene mediata su tutte le cellule presenti nel campione. Ciò si traduce in un risultato diverso rispetto alla microscopia confocale e alle analisi di citometria a flusso, dove viene riportata la percentuale di cellule ALDH+. Mentre le cellule BG-1 mostrano la risposta di accensione della piega più bassa, così come la più piccola popolazione di cellule ALDH1A1+, l'ordine delle restanti quattro linee cellulari diventa incoerente. Ad esempio, il test omogenato identifica le cellule OVCAR-3 come aventi la più alta attività complessiva di ALDH1A1, mentre si colloca solo al terzo posto sulla base della microscopia confocale e della citometria a flusso. La nostra interpretazione di questi dati è che una cella ALDH1A1+ deve avere diversi livelli di attività. Infine, è importante notare che questo tipo di esperimento "turn-on" non sarebbe possibile utilizzando sonde basate sull'accumulo.
Inoltre, la sonda fluorogenica selettiva per isoforme è un agente di imaging molecolare per la visualizzazione di popolazioni cellulari ALDH1A1+. Da notare che, sebbene la microscopia confocale sia stata impiegata in questa dimostrazione, questa sonda fluorogenica è compatibile con un vasto assortimento di configurazioni di imaging, inclusi contatori cellulari automatizzati, microscopi a epifluorescenza e strumenti di illuminazione ad ampio campo. Uno dei passaggi più importanti in questo esperimento è l'uso di Ctrl-AlDeSense per stabilire i parametri di soglia appropriati (ad esempio, dimensione del foro stenopeico, potenza laser, guadagno FITC). A questo proposito, le impostazioni devono essere regolate in modo tale che il segnale Ctrl-AlDeSense sia appena sopra lo sfondo. Nel caso in cui un utente ritenga necessario aumentare la potenza del laser per vedere questo segnale, si consiglia di estendere il periodo di colorazione del colorante o la concentrazione di carico rispetto all'aumento della potenza del laser (superiore al 50%) a causa dell'aumento della fototossicità o dello sbiancamento della sonda. Una limitazione dell'imaging confocale è la variabilità durante il gating con Ctrl-AlDeSense. Nonostante questo avvertimento, l'ordine delle linee cellulari osservato basato su percentuali crescenti di cellule ALDH1A1+ era identico ai risultati ottenuti tramite citometria a flusso. A differenza dell'imaging molecolare, in cui il numero massimo di cellule visualizzate è limitato dal campo visivo, un tipico esperimento di citometria a flusso analizza fino a decine di migliaia di cellule. Le considerazioni relative al tempo di colorazione e alla concentrazione di carico sono simili a quelle discusse per l'imaging molecolare. Un ulteriore elemento che deve essere considerato è anche la colorazione del colorante nella sospensione cellulare per garantire che le popolazioni di ALDH1A1+ false positive non vengano identificate erroneamente.
In conclusione, questo articolo evidenzia il processo per ottimizzare AlDeSense per una varietà di modalità, utilizzando le cellule tumorali ovariche come esempio. Questo rappresenta un primo passo importante per rispondere al motivo per cui esistono rapporti contraddittori riguardanti l'espressione di ALDH1A1 in questo tipo di cancro21,22,23,24. Al di là di ciò che abbiamo mostrato, prevediamo che questa sonda fluorogenica selettiva per isoforme possa essere utilizzata in una campagna di screening ad alto rendimento per identificare inibitori selettivi di ALDH1A1 che potrebbero emergere come candidati farmacologici. Inoltre, questa sonda potrebbe continuare a trovare uso per identificare le CSC negli animali vivi, come abbiamo dimostrato nella nostra pubblicazione iniziale11. La caratteristica emissiva a luce verde della sonda fluorogenica selettiva per isoforme la prepara per esperimenti di multiplexing in cui può essere utilizzata in tandem con proteine fluorescenti che emettono rosso, coloranti a piccole molecole o sonde sensibili all'analita. Inoltre, esiste una versione rossa della sonda fluorogenica isoform-selettiva, che può espandere ulteriormente questa capacità di multiplexing12. Infine, sul fronte medico, questa sonda può essere utilizzata come strumento prognostico in ambito clinico per il processo decisionale sul trattamento point-of-care. Quantificare l'attività di ALDH1A1 e le popolazioni cellulari di ALDH1A1+ può servire come metodo per determinare l'aggressività del cancro, consentendo strategie di trattamento personalizzate per una migliore qualità della vita. Inoltre, utilizzando AlDeSense, una lettura può essere consegnata e interpretata in poche ore.
Divulgazioni
Divulghiamo un brevetto in corso (US20200199092A1) per la tecnologia AlDeSense.
Riconoscimenti
Questo lavoro è stato sostenuto dal National Institutes of Health (R35GM133581 a JC) e dal Cancer Center at Illinois Graduate Scholarship (assegnato a SG). JC ringrazia la Fondazione Camille e Henry Dreyfus per il supporto. Gli autori ringraziano il Dr. Thomas E. Bearrood per il suo contributo iniziale alla preparazione delle scorte di AlDeSense e AlDeSense AM. Ringraziamo Oliver D. Pichardo Peguero e Joseph A. Forzano per la loro assistenza nella preparazione di vari precursori sintetici. Ringraziamo il Prof. Erik Nelson (Dipartimento di Fisiologia Molecolare e Integrativa, UIUC) per le cellule Caov-3, IGROV-1 e PEO4. Ringraziamo il Prof. Paul Hergenrother (Dipartimento di Chimica, UIUC) per le cellule BG-1. Ringraziamo le strutture principali del Carl R. Woese Institute for Genomic Biology per l'accesso al microscopio confocale Zeiss LSM 700 e al software corrispondente. Si ringrazia la Flow Cytometry Facility per l'accesso all'analizzatore BD LSR II CMtO. Ringraziamo la dott.ssa Sandra McMasters e la Cell Media Facility per l'assistenza nella preparazione dei terreni di coltura cellulare.
Materiali
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
Riferimenti
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon