Method Article
AlDeSense在基于醛脱氢酶1A1活性的卵巢癌细胞分层中的应用
* 这些作者具有相同的贡献
摘要
测量活细胞中 ALDH1A1 活性的方法在癌症研究中至关重要,因为它是干性的生物标志物。在这项研究中,我们采用了亚型选择性荧光探针来确定一组五种卵巢癌细胞系中 ALDH1A1 活性的相对水平。
摘要
癌症治疗后的复发通常归因于称为癌症干细胞(CSC)的肿瘤细胞亚群的持续存在,其特征在于其显着的肿瘤起始和自我更新能力。根据肿瘤的起源(例如卵巢),CSC表面生物标志物谱可能会有很大差异,这使得通过免疫组织化学染色 鉴定 此类细胞是一项具有挑战性的工作。相反,醛脱氢酶 1A1 (ALDH1A1) 因其在几乎所有祖细胞(包括 CSC)中的保守表达谱而成为鉴定 CSC 的极好标志物。ALDH1A1 亚型属于 19 种酶的超家族,负责将各种内源性和异生素醛氧化成相应的羧酸产物。Chan等人最近开发了AlDeSense,这是一种用于检测ALDH1A1活性的亚型选择性"开启"探针,以及一种非反应性匹配对照试剂(Ctrl-AlDeSense),用于解决脱靶染色。这种亚型选择工具已被证明是一种多功能化学工具,可检测 K562 骨髓性白血病细胞、乳腺球和黑色素瘤衍生的 CSC 异种移植物中的 ALDH1A1 活性。在本文中,通过额外的荧光法、共聚焦显微镜和流式细胞术实验展示了探针的实用性,其中在一组五种卵巢癌细胞系中测定了相对 ALDH1A1 活性。
引言
癌症干细胞(CSC)是具有干细胞样特性的肿瘤细胞亚群1。与非癌性对应物类似,CSC具有非凡的自我更新和增殖能力。与其他内置机制(例如ATP结合盒转运蛋白的上调)一起,CSC通常免于初始手术减瘤工作以及随后的辅助治疗2。由于CSCs在治疗耐药性3,复发4和转移5中的关键作用,已成为癌症研究的优先事项。尽管有多种细胞表面抗原(例如CD133)可用于鉴定CSC6,但利用细胞质中发现的醛脱氢酶(ALDH)的酶活性已成为一种有吸引力的替代方法7。ALDHs 是 19 种酶的超家族,负责催化反应性内源性和异生素醛氧化为相应的羧酸产物8。
一般来说,醛解毒对于保护细胞免受可能损害干细胞完整性的不良交联事件和氧化应激至关重要9。此外,1A1亚型控制视黄酸代谢,而视黄酸代谢又通过视黄醛信号传导影响干性10。AlDeSense 11,12 是一种基于活性的小分子传感 (ABS) 探针,用于选择性检测 ALDH1A1 活性,最近被开发出来。ABS设计通过化学变化而不是结合事件实现分析物检测,从而实现高选择性和减少脱靶响应13,14,15,16。亚型选择性荧光探针的设计原理依赖于供体光诱导电子转移(d-PeT)猝灭机制17,该机制源自醛官能团,用于抑制探针18的荧光特征。在 ALDH1A1 介导的转化为羧酸后,辐射松弛被解锁以产生高荧光产物。由于d-PeT猝灭从来都不是100%有效的,因此在通过开发Ctrl-AlDeSense(一种具有匹配的光物理特性(例如,量子产率)和细胞中相同细胞质染色模式的非响应试剂)建立该测定时,考虑了可能导致假阳性结果的残留荧光。当同时使用时,这种独特的配对可以通过荧光、分子成像和流式细胞术可靠地区分具有高 ALDH1A1 活性的细胞和低水平细胞。与传统的免疫组织化学方法相比,使用亚型选择性可活化染料有几个关键优势。例如,假设CSCs深埋在肿瘤中,因此相对于大抗体更容易被小分子接近19。此外,翻转的荧光产物不会共价修饰任何细胞成分,这意味着它可以通过洗涤循环轻松去除,使CSC处于未修饰状态。最后,开启反应仅识别活细胞和功能,与MTT测定非常相似,因为它依赖于NAD +辅因子。
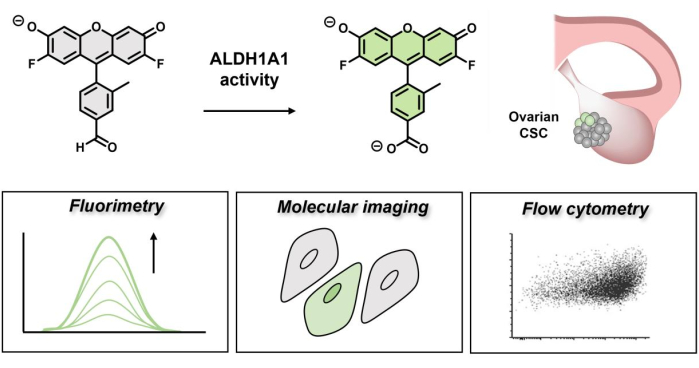
图 1:演示 AlDeSense 荧光开启的示意图。 这种亚型选择性染料由 ALDH1A1 激活,可用于通过荧光、分子成像和流式细胞术 鉴定 卵巢癌细胞中升高的 ALDH1A1 活性。 请点击此处查看此图的大图。
在过去的工作中,亚型选择性荧光探针测定成功地从K562人慢性白血病细胞、MDA-MB-231人乳腺癌细胞和B16F0小鼠黑色素瘤细胞中的ALDH低(ALDH-)细胞中分层了ALDH高(ALDH+)细胞。这一点很重要,因为对于许多癌症类型,高 ALDH1A1 蛋白表达意味着临床预后较差20。这假设 ALDH1A1 水平升高表明 CSC 可以逃避治疗、产生耐药性并传播到全身。然而,在卵巢癌的情况下,有研究报告了相反的发现(高 ALDH1A1 表达与改善患者生存率有关)21,22,23,24。虽然乍一看这似乎是矛盾的,但表达不一定与酶活性相关,酶活性可能受到肿瘤微环境变化(例如pH通量、氧梯度)、NAD+辅因子或醛底物的可用性、羧酸水平(产物抑制)以及可能改变酶活性的翻译后修饰的影响25.此外,卵巢癌分为五种主要的组织学类型(高级别浆液性、低级别浆液性、子宫内膜样、透明细胞和粘液),我们假设其 ALDH1A1 活性水平不同26。为了研究卵巢肿瘤中的 ALDH1A1 活性,采用亚型选择性荧光探针测定法鉴定属于上述不同组织学类型的五种卵巢癌细胞系中的 ALDH1A1+ 群体。本研究中测试的细胞系包括BG-1,Caov-3,IGROV-1,OVCAR-3和PEO4细胞,涵盖透明细胞和浆液组织型。本文强调了探针的多功能性和可推广性,以鉴定CSC,以便寻求在其他永生化癌细胞系以及患者样本中进行类似研究的研究人员使用CSC。AlDeSense的使用将揭示复杂组织微环境中CSC维持所涉及的生化途径,并可能作为确定预后和测量癌症侵袭性的临床工具。
研究方案
1. 通过荧光法 测量 卵巢癌细胞匀浆中的总 ALDH1A1 活性
- 在 5 mL 以下细胞培养基中的 T25 细胞培养瓶中解冻 1 ×10 6 个细胞:
- IGROV-1 和 PEO4:罗斯威尔公园纪念研究所 (RPMI) 1640 培养基,含 10% 胎牛血清 (FBS) 和 1% 青霉素/链霉素 (P/S)。
- BG-1和Caov-3:Dulbecco的改良鹰培养基(DMEM),具有10%FBS和1%P / S。
- OVCAR-3:RPMI 1640,含 20% FBS、1% P/S 和 0.01 mg/mL 胰岛素。
- 将细胞保持在37°C和5%CO2 的培养箱中两到三次传代。在传代前,确保细胞的汇合度不超过80%-90%。
- 将细胞在0.25%胰蛋白酶中胰蛋白酶消化10分钟,使用自动细胞计数器计数,并通过在25°C下离心(180×g)沉淀1×107个细胞5分钟。
- 通过抽吸 小心 地除去上清液,通过将细胞重悬于1 mL 1x PBS中来洗涤沉淀,并在与步骤4相同的条件下通过离心 重新 沉淀细胞。
- 将细胞重悬于1x PBS中的1x蛋白酶抑制剂溶液中。每 2.5 × 106 个细胞使用 1 mL 该溶液。
- 用细胞匀浆器探针在冰上超声处理细胞悬液2分钟(1秒脉冲,40%振幅)。
- 通过在25°C下离心(3,200×g) 沉淀 不溶物/膜级分15分钟。取出并保留上清液,因为这是将在后续步骤中使用的匀浆。将匀浆分离成三个比色皿,一式三份进行实验。
- 将探针添加到匀浆中以获得4μM的最终探针浓度。 上下移液三次以使溶液充分混合。
- 在荧光计上添加后和所需孵育时间后立即测量荧光信号。可以优化孵育时间以查看最大折叠开启(本实验中为1小时)。孵育时间在比较的所有细胞系中必须是恒定的。
- 将激发波长设置为 496 nm。
- 将发射设置为 510-600 nm。
- 将狭缝宽度设置为 0.5 mm。
- 将溶液移液到 1 mL 石英比色皿中,放入荧光计中,然后进行扫描。
- 将516nm处的最终荧光强度(最大荧光波长)除以初始读数相同波长的强度,以确定亚型选择性染料的折叠活化。
2. 使用荧光显微镜对具有高 ALDH1A1 活性的细胞进行成像
- 在 5 mL 适当细胞培养基中的 T25 细胞培养瓶中解冻 1 ×10 6 个细胞。
- 将细胞保持在37°C和5%CO2 的培养箱中两到三次传代。在传代前,确保细胞的汇合度不超过80%-90%。
- 在共聚焦成像的前一天,在8孔室载玻片中将板4×105 个细胞。
- 用聚-L-赖氨酸(0.1mg / mL,每孔100μL)涂覆每个孔的底部10分钟,随后吸出。
- 通过加入细胞培养级水(每孔 100 μL)并吸出,将每个孔洗涤 3 次。
- 将细胞在0.25%胰蛋白酶中胰蛋白酶消化10分钟,使用自动细胞计数器计数,并将细胞接种在每孔4×105 个细胞。
- 让细胞沉淀并附着过夜(12-16小时)。
- 吸出生长培养基并加入无血清培养基(每孔 500 μL),并补充 2 μM 探针或对照探针。
- 用探针在室温下孵育30分钟并立即对细胞进行成像。
- 打开共聚焦显微镜并针对样品进行调整。
- 以最低放大倍率小心地加载样品;找到单元格以确保正确定位。
- 确保物镜处于10倍放大倍率并定位细胞。
- 对于本实验,需要FITC通道(激发:488nm激光;发射:516-521nm)和T-PMT(透射光)通道。使用T-PMT定位并聚焦细胞,在整个实验中聚焦在同一z平面上以消除偏差。
- 将激光功率和FITC增益调整到适当的设置,此时来自Ctrl-AlDeSense AM样本的信号可检测性极小,同时在AlDeSense AM样本中仍能看到信号。每个参数都可以通过滑动相应的条来调整。可能需要调整几次设置才能识别正确的参数。优化后,使用相同的参数完成该细胞系内的其余实验。
- 每孔拍摄三张图像,每个处理条件总共三张孔(总共九张图像)。使用T-PMT专注于正确的平面以避免偏差,而不是使用荧光通道或合并图像。
- 处理图像以确定 ALDH1A1+ 细胞的百分比。
- 使用图像处理软件,将czi文件拆分为不同的通道。
- 计算细胞总数和荧光细胞总数。
- 要确定 ALDH1A1+ 细胞的百分比,请将荧光细胞的数量除以每张图像中的细胞总数。必须在不操作图像的情况下以相同的方式对每个图像进行计数,因为例如,调整亮度可能会添加混杂变量。
3. 流式细胞术在鉴定ALDH1A1活性高的细胞中的应用
- 在 5 mL 适当细胞培养基中的 T25 细胞培养瓶中解冻 1 ×10 6 个细胞。
- 将细胞保持在37°C和5%CO2 的培养箱中两到三次传代。在传代前,确保细胞的汇合度不超过80%-90%。
- 胰蛋白酶消化,计数和沉淀细胞在15mL离心管中,通过在25°C下离心(180×g)5分钟。
- 将细胞重悬于 PBS 中的 1 mL 2 μM 探针/对照探针溶液中。在室温下摇动细胞60分钟,以确保暴露于染料均匀。
- 孵育期后,通过在25°C下离心(180×g) 沉淀 细胞5分钟。将细胞重悬于 0.5 mL PBS 中。通过细胞过滤器(35μm尼龙网)运行细胞,以去除可能堵塞流式细胞仪的细胞团块。立即将细胞放在冰上。
- 打开仪器并运行启动协议。
- 检查鞘液和空废物。
- 用10%漂白剂和水运行生产线,每次5分钟。
- 运行质量控制珠以确保功能正常。
- 在设置选项卡中,为荧光滤光片选择 FSC(前向散射)、SSC(侧向散射)和 FITC(异硫氰酸荧光素 )。
- 绘制以下图表以门控活性、单线态和荧光。优化激光功率(特定于用户的仪器),使细胞群在给定参数范围内以进行进一步分析。
- FSC-A 与 SSC-A 散点图:主细胞群靠近图的中心。
- FSC-A 与 FSC-W 散点图:指示单线态(而不是细胞团块)的窄水平带。
- FITC-A 与 FSC-A 散点图:观察由亚型选择性荧光开启探针分选的细胞分布。
- FITC-A 直方图:观察基于 FITC 的群体变化,以确定 ALDH1A1+ 细胞的百分比。
- 为了优化FITC激光功率,请使用探头运行样品,使直方图曲线的右尾接近最大FITC-A信号。随后,用对照探头运行样品。应该可以观察到种群偏移以显示最大动态范围。激光功率优化步骤可能必须重复多次,但一旦为实验指定了设置,就不应在样品之间改变激光功率。
- 运行每个样品进行 10,000 次计数(一式三份)。
- 对每个细胞系重复步骤 3.12,因为摄取和 ALDH1A1 活性会有所不同。
- 完成样品收集后,用10%漂白剂和水运行管线,每次5分钟,然后启动仪器关闭。
- 使用流式细胞术软件处理数据并门控所需的细胞群。设置门,使所有事件都落入 ALDH1A1- 或 ALDH1A1+ 门。使用矩形门选择,设置 ALDH1A1- 门,使对照探头样品中 >99.5% 的事件发生在此门内。其余细胞将被视为 ALDH1A1+。然后,可以将这些相同的门应用于探针样品,以量化被视为 ALDH1A1- 和 ALDH1A1+ 的事件数量。
结果
卵巢癌细胞匀浆的总 ALDH1A1 活性
从该测定中获得的每个细胞系的平均折叠开启为:BG-1(1.12±0.01);IGROV-1(1.30 ± 0.03);Caov-3(1.72 ± 0.06);PEO4 (2.51 ± 0.29);和OVCAR-3(10.25±1.46)(图2)。

图 2:通过荧光法测量的每个卵巢癌细胞系匀浆中亚型选择性染料的折叠荧光开启(平均±标准偏差)(n = 3)。 请点击此处查看此图的大图。
培养的卵巢癌细胞中 ALDH1A1+ 亚群的分子成像
用探针或对照探针孵育细胞后,测定每个细胞系中 ALDH1A1+ 细胞的百分比。通过调整激光功率和增益以最小化Ctrl-AlDeSense AM处理样品中的信号,优化了AlDeSense AM处理细胞中的荧光信号(图3)。通过计数 ALDH1A1+ 细胞的数量,确定 ALDH1A1+ 细胞的百分比为:BG-1(3.2% ± 1.6%);PEO4 (18.0% ± 3.6%);OVCAR-3(39.8%±3.9%);IGROV-1(51.7%±5.4%);和Caov-3(93.7%±3.4%)(图4)。

图3:代表性共聚焦图像 。 (A,C,E,G,I)Ctrl-AlDeSense AM染色细胞和(B,D,F,H,J)AlDeSense AM染色细胞。从左到右,图像表现出明场、荧光和合并。比例尺为 50 μm。 请点击此处查看此图的大图。

图 4:通过共聚焦显微镜测量的每个卵巢癌细胞系中 ALDH1A1+ 细胞的平均百分比(平均±标准偏差)(n = 9)。 ALDH1A1+ 细胞的百分比为 BG-1(3.2% ± 1.6%);PEO4 (18.0% ± 3.6%);OVCAR-3(39.8%±3.9%);IGROV-1(51.7%±5.4%);和Caov-3(93.7%±3.4%)。 请点击此处查看此图的大图。
使用流式细胞术鉴定 ALDH1A1+ 细胞群
通过应用亚型选择性荧光探针,在不同的卵巢癌细胞系中成功鉴定了 ALDH1A1+ 细胞群。在实验后数据分析期间,每个细胞系内的 ALDH1A1+ 细胞群可以通过对 Ctrl-AlDeSense AM 处理群体中最亮的细胞中的前 0.5% 进行门控来量化(图 5)。对卵巢癌细胞组的分析显示,ALDH1A1+ 细胞的百分比为:BG-1(4.9% ± 0.4%);PEO4 (5.66% ± 0.9%);OVCAR-3(7.6%±0.1%);IGROV-1(35.4%±2.8%);和Caov-3(70.1%±2.4%)(图6)。
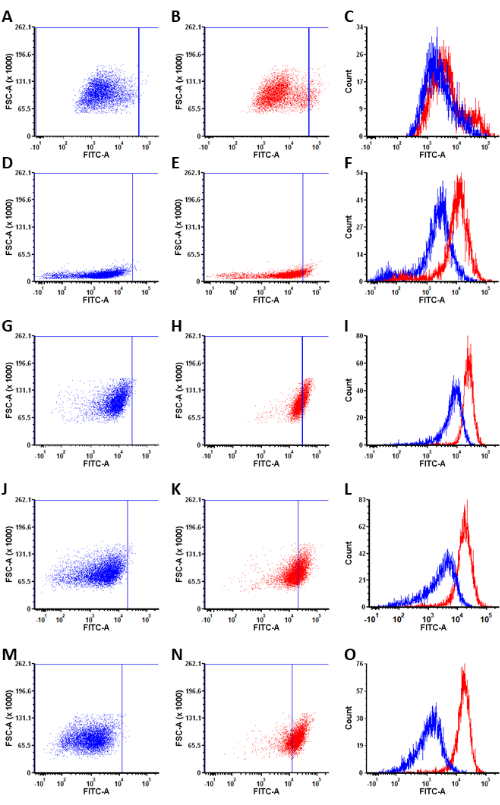
图 5:代表性散点图和直方图叠加。 (A,D,G,J,M)与细胞孵育1小时后Ctrl-AlDeSense AM染色的代表性散点图。(B,E,H,K,N)与细胞孵育1小时后AlDeSense AM染色的代表性散点图。(C,F,L,J,O)这些条件的Ctrl-AlDeSense AM和AlDeSense AM染色的直方图叠加。被染色的细胞系是(A-C)BG-1,(D-F)PEO4,(G-I)OVCAR-3,(J-L)IGROV-1和(M-O)Caov-3。请点击此处查看此图的大图。
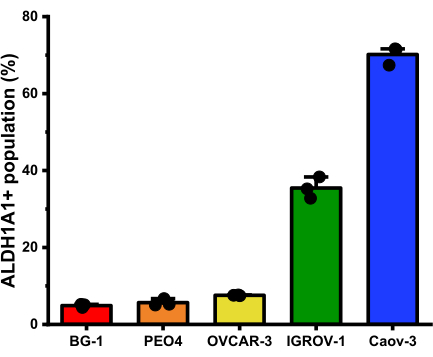
图 6:通过流式细胞术测量的每个卵巢癌细胞系中 ALDH1A1+ 细胞的平均百分比(平均±标准偏差)(n = 3)。 ALDH1A1+ 细胞的百分比为 BG-1(4.9% ± 0.4%);PEO4 (5.66% ± 0.9%);OVCAR-3(7.6%±0.1%);IGROV-1(35.4%±2.8%);和Caov-3(70.1%±2.4%)。 请点击此处查看此图的大图。
虽然几种 ALDH 功能亚型(即 ALDH1A1、ALDH1A2、ALDH1A3 和 ALDH3A1)与 CSC 相关,但 ALDH1A1 被选为本研究的靶标,因为在卵巢癌的背景下,表达水平升高 21,27,并且这种亚型已被证明会加剧耐药性28,29 并增强肿瘤发生30,31.共聚焦成像和流式细胞术的结果与 ALDH1A1+ 细胞数量的增加一致。此外,细胞匀浆实验揭示了细胞系内的平均活性。同时,可以推断出每个细胞系的 ALDH1A1+ 亚群内活性量的结论。可以得出结论,BG-1 的 ALDH1A1 活性最低,ALDH1A1+ 群体最低。值得注意的是,由于ALDH1A1的表达可以忽略不计,我们选择了BG1细胞系作为本研究的阴性对照。此外,共聚焦成像和流式细胞术显示Caov-3细胞中ALDH1A1+细胞的比例最大,但细胞系的整体活性仅排名第三。或者,OVCAR-3 细胞含有第三高的 ALDH1A1+ 群体,但表现出最高的总活性。根据这些结果推断,ALDH1A1+ OVCAR-3 细胞亚群比 ALD1A1+ Caov-3 细胞亚群具有更高的活性。通过进一步分析细胞系或组织样本中的 ALDH1A1 群体,可以进一步阐明 ALDH1A1 的作用,并研究由于 ALDH1A1 活性升高而导致的表型变化。
| 细胞系 | 组织学类型 | 荧光法(折叠打开) | 共聚焦(% 阳性) | 流量(%正) | ||
| BG-1 | 低分化腺癌 | 1.12 | 3.2 | 4.9 | ||
| PEO4 | 高级别浆液性囊腺癌 | 2.51 | 18.0 | 5.7 | ||
| 奥夫卡-3 | 高级别浆液性腺癌 | 10.25 | 39.8 | 7.6 | ||
| 伊格罗夫-1 | 子宫内膜样腺癌 | 1.30 | 51.7 | 35.4 | ||
| 考夫-3 | 高级别浆液性腺癌 | 1.72 | 93.7 | 70.1 | ||
表1:细胞匀浆、共聚焦显微镜和流式细胞术的结果总结。
讨论
泛选择性是许多 ALDH 探头的主要限制;然而,最近报道了几种亚型选择性实例32,33,34,35,36,37,38,39,40,41。本研究中使用的亚型选择性荧光探针是第一个合理设计的探针,即使存在大量过量的竞争酶,也仅与 ALDH1A1 亚型反应11,12。该探针的另一个显着特征是其独特的荧光性质,其特点是探针激活前的低荧光发射。这与ALDEFLUOR测定等商业试剂盒相反,ALDEFLUOR测定具有始终处于"开启状态"的荧光底物(BODIPY氨基乙醛[BAAA])32。BAAA 识别 ALDH+ 细胞的前提是,活化的羧酸盐产物(同样具有荧光)在高水平表达 ALDH 的细胞中保留在更大程度上。为了解决探针在 ALDH- 细胞中的非特异性积累,必须使用抑制剂来阻断对照样品中存在的 ALDH。然而,这伴随着几个显着的缺点。首先,如果目的是通过 ALDH1A1 活性识别 CSC,则抑制剂策略的应用会失败,因为它也会在不同程度上阻断其他亚型。其次,抑制剂的非特异性行为会损害细胞在全球范围内解毒活性醛的能力。第一个问题在AlDeSense的设计中得到了解决,因为它只与上述单一亚型发生反应(补充图1)。为了改善第二个问题,Ctrl-AlDeSense取代了抑制剂的作用。具体而言,对照试剂表现出与未活化的AlDeSense几乎相同的荧光信号,被细胞吸收的程度相同,并且主要定位于细胞质。因此,任何超出对照建立的基线的信号都必须代表 ALDH1A1 介导的探针激活。
补充图1:AlDeSense和ALDEFLUOR的反应性。 (A) 与每种 ALDH 亚型孵育后 AlDeSense 的归一化荧光开启和 (B) ALDEFLUOR 与每种 ALDH 亚型的反应性。所有测量一式三份;误差线± SD。 请点击此处下载此文件。
选择强调的亚型选择性荧光探针的第一个应用是测量细胞匀浆中的 ALDH1A1 活性。在没有共聚焦显微镜或流式细胞仪等专用仪器的情况下,使用普通荧光计可以快速报告样品中的总 ALDH1A1 活性。沿着这些思路,样品制备的便利性(可以从从细胞培养物到切除组织的样品中获得匀浆)拓宽了该测定的适用性。在优化用于匀浆的亚型选择性荧光探针时,必须考虑几个关键参数。第一种涉及调节每个裂解物样品的细胞数。例如,如果定义为荧光信号变化程度的动态范围不够低,则可以增加每个样品的细胞数。同样,也可以调整孵育时间,以便可以激活更多的荧光探针以产生更强的荧光读数。然而,值得注意的是,这种方法的一个主要局限性是无法区分表现出不同水平 ALDH1A1 活性的细胞亚群。由于无论细胞的 ALDH1A1 状态如何,细胞都会被组合和裂解,因此样品中存在的所有细胞的酶活性量都是平均的。与共聚焦显微镜和流式细胞术分析相比,这导致了不同的结果,在共聚焦显微镜和流式细胞术分析中,报告的 ALDH+ 细胞百分比。虽然 BG-1 细胞显示出最低的折叠开启响应,以及最小的 ALDH1A1+ 细胞群,但其余四个细胞系的顺序变得不一致。例如,匀浆测定确定 OVCAR-3 细胞具有最高的整体 ALDH1A1 活性,而根据共聚焦显微镜和流式细胞术,它仅排名第三。我们对这些数据的解释是,ALDH1A1+ 细胞必须具有不同水平的活性。最后,重要的是要注意这种类型的"开启"实验是使用基于积累的探针无法实现的。
此外,亚型选择性荧光探针是一种分子成像剂,用于可视化 ALDH1A1+ 细胞群。值得注意的是,尽管本演示使用了共聚焦显微镜,但该荧光探针与各种成像设置兼容,包括自动细胞计数器、落射荧光显微镜和宽场照明仪器。本实验中最重要的步骤之一是使用Ctrl-AlDeSense建立适当的阈值参数(例如,针孔尺寸,激光功率,FITC增益)。在这方面,应调整设置,使 Ctrl-AlDeSense 信号刚好位于背景上方。如果用户发现有必要增加激光功率才能看到该信号,由于光毒性增加或探针漂白,建议延长染料染色期或上样浓度,而不是增加激光功率(50%以上)。共聚焦成像的一个限制是使用 Ctrl-AlDeSense 进行选门时的可变性。尽管有此警告,但基于ALDH1A1+细胞百分比增加的观察到的细胞系顺序与通过流式细胞术 获得 的结果相同。与分子成像不同,分子成像的最大可见细胞数受视场限制,典型的流式细胞术实验可分析多达数万个细胞。染色时间和上样浓度的考虑因素与分子成像所讨论的相似。必须考虑的另一个因素是在细胞悬液中进行染料染色,以确保假阳性 ALDH1A1+ 群体不会被误识别。
最后,本文以卵巢癌细胞为例,重点介绍了针对各种模式优化AlDeSense的过程。这是回答为什么存在关于ALDH1A1在这种癌症类型21,22,23,24中的表达的矛盾报告的重要的第一步。除了我们展示的内容之外,我们还设想这种亚型选择性荧光探针可用于高通量筛选活动,以鉴定可能作为候选药物出现的 ALDH1A1 选择性抑制剂。此外,该探针可能会继续用于识别活体动物中的CSC,正如我们在最初的出版物11中所证明的那样。亚型选择性荧光探针的绿光发射特性使其可用于多重实验,可与红光荧光蛋白、小分子染料或分析物响应探针串联使用。此外,存在亚型选择性荧光探针的红色版本,其可以进一步扩展这种多路复用能力12。最后,在医学方面,该探针可用作临床环境中的预后工具,用于即时治疗决策。量化 ALDH1A1 活性和 ALDH1A1+ 细胞群可以作为确定癌症侵袭性的方法,从而制定个性化的治疗策略,以提高生活质量。此外,使用AlDeSense,可以在几个小时内提供和解释读数。
披露声明
我们披露了AlDeSense技术的待定专利(US20200199092A1)。
致谢
这项工作得到了美国国立卫生研究院(R35GM133581至JC)和伊利诺伊州癌症中心研究生奖学金(授予SG)的支持。JC感谢Camille和Henry Dreyfus基金会的支持。作者感谢Thomas E. Bearrood博士为准备AlDeSense和AlDeSense AM股票所做的初步贡献。我们感谢奥利弗·皮查多·佩盖罗先生和约瑟夫·福尔扎诺先生协助制备各种合成前体。我们感谢Erik Nelson教授(UIUC分子与综合生理学系)的Caov-3,IGROV-1和PEO4细胞。我们感谢Paul Hergenrother教授(UIUC化学系)的BG-1细胞。我们感谢Carl R. Woese基因组生物学研究所的核心设施使用蔡司LSM 700共聚焦显微镜和相应的软件。我们感谢流式细胞术设施使用BD LSR II CMtO分析仪。我们感谢Sandra McMasters博士和细胞培养基设施在制备细胞培养基方面的帮助。
材料
| Name | Company | Catalog Number | Comments |
| 0.25% Trypsin, 0.1% EDTA in HBSS w/o Calcium, Magnesium and Sodium Bicarbonate | Corning | 25-050-CI | |
| 1x Phosphate Buffer Saline | Corning | 21-040-CMX12 | |
| AccuSpin Micro 17R | Fisher Scientific | 13-100-675 | |
| AlDeSense | Synthesized in-house | ||
| BG-1 | A gift provided by the Prof. Paul Hergenrother Lab, University of Illinois Urbana-Champaign | ||
| BioLite 25cm2 Flask | Thermo Fisher Scientific | 130189 | |
| Biosafety Cabinet 1300 series A2 | Thermo Fisher Scientific | ||
| Caov-3 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Cell homogenizer | Fisher Scientific | ||
| Centrifuge 5180R | Eppendorf | 22627040 | |
| Contrl-AlDeSense | Synthesized in-house | ||
| DMEM, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| Falcon Round-Bottom Polystyrene Test Tubes with Cell Strainer Snap Cap, 5mL | Corning | 352003 | |
| FCS Express 6 | Provided by UIUC CMtO | ||
| FL microscope | EVOS | ||
| Fluorometer | Photon Technology International | ||
| Forma Series II Water-Jacketed CO2 Incubator | Fisher Scientific | 3110 | |
| IGROV-1 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| ImageJ | NIH | ||
| Innova 42R Incubated Shaker | |||
| LSM 700 | Zeiss | ||
| LSR II | BD | ||
| Nunc Lab-Tek Chambered #1.0 Borosicilate Coverglass System | Thermo Fisher Scientific | 155383 | |
| OVCAR-3 | ATCC | HTB-161 | |
| PEO4 | A gift provided by the Prof. Erik Nelson Lab, University of Illinois Urbana-Champaign | ||
| Pierce Protease Inhibitor Tablets | Thermo Scientific | A32963 | |
| Poly-L-Lysine | Cultrex | 3438-100-01 | |
| Rocker | VWR | ||
| RPMI, 10% FBS, 1% P/S | Prepared by UIUC cell media facility | ||
| RPMI, 20% FBS, 1% P/S, 0.01 mg/mL Insulin | Prepared by UIUC cell media facility |
参考文献
- Bonnet, D., Dick, J. E. Human acute myeloid leukaemia is organised as a heirarchy that originates from a primitive haematopoetic cell. Nature Medicine. 3 (7), 730-737 (1997).
- Begicevic, R. R., Falasca, M. ABC transporters in cancer stem cells: Beyond chemoresistance. International Journal of Molecular Sciences. 18 (11), 2362 (2017).
- Cojoc, M., Mäbert, K., Muders, M. H., Dubrovska, A. A role for cancer stem cells in therapy resistance: Cellular and molecular mechanisms. Seminars in Cancer Biology. 31, 16-27 (2015).
- Islam, F., Gopalan, V., Smith, R. A., Lam, A. K. Y. Translational potential of cancer stem cells: A review of the detection of cancer stem cells and their roles in cancer recurrence and cancer treatment. Experimental Cell Research. 335 (1), 135-147 (2015).
- Li, F., Tiede, B., Massagué, J., Kang, Y. Beyond tumorigenesis: Cancer stem cells in metastasis. Cell Research. 17 (1), 3-14 (2007).
- Kim, W. T., Ryu, C. J. Cancer stem cell surface markers on normal stem cells. BMB Reports. 50 (6), 285-298 (2017).
- Pors, K., Moreb, J. S. Aldehyde dehydrogenases in cancer: An opportunity for biomarker and drug development. Drug Discovery Today. 19 (12), 1953-1963 (2014).
- Jackson, B., et al. Update on the aldehyde dehydrogenase gene (ALDH) superfamily. Human Genomics. 5 (4), 283-303 (2011).
- Vasiliou, V., Pappa, A., Petersen, D. R. Role of aldehyde dehydrogenases in endogenous and xenobiotic metabolism. Chemico-Biological Interactions. 129 (1-2), 1-19 (2000).
- Tomita, H., Tanaka, K., Tanaka, T., Hara, A. Aldehyde dehydrogenase 1A1 in stem cells and cancer. Oncotarget. 7 (10), 11018-11032 (2016).
- Anorma, C., et al. Surveillance of cancer stem cell plasticity using an isoform-selective fluorescent probe for aldehyde dehydrogenase 1A1. ACS Central Science. 4 (8), 1045-1055 (2018).
- Bearrood, T. E., Aguirre-Figueroa, G., Chan, J. Rational design of a red fluorescent sensor for ALDH1A1 displaying enhanced cellular uptake and reactivity. Bioconjugate Chemistry. 31 (2), 224-228 (2020).
- Chan, J., Dodani, S. C., Chang, C. J. Reaction-based small-molecule fluorescent probes for chemoselective bioimaging. Nature Chemistry. 4 (12), 973-984 (2012).
- East, A. K., Lucero, M. Y., Chan, J. New directions of activity-based sensing for in vivo NIR imaging. Chemical Science. 12 (10), 3393-3405 (2021).
- Yadav, A. K., et al. Activity-based NIR bioluminescence probe enables discovery of diet-induced modulation of the tumor microenvironment via nitric oxide. ACS Central Science. 8 (4), 461-472 (2022).
- Yadav, A. K., et al. An activity-based sensing approach for the detection of cyclooxygenase-2 in Live Cells. Angewandte Chemie. 59 (8), 3307-3314 (2020).
- Ueno, T., et al. Rational principles for modulating fluorescence properties of fluorescein. Journal of the American Chemical Society. 126 (43), 14079-14085 (2004).
- Tanaka, F., Mase, N., Barbas 3rd, C. F. Design and use of fluorogenic aldehydes for monitoring the progress of aldehyde transformations. Journal of the American Chemical Society. 126 (12), 3692-3693 (2004).
- Thurber, G. M., Schmidt, M. M., Wittrup, K. D. Antibody tumor penetration: transport opposed by systemic and antigen-mediated clearance. Advanced Drug Delivery Reviews. 60 (12), 1421-1434 (2008).
- Marcato, P., Dean, C. A., Giacomantonio, C. A., Lee, P. W. K. Aldehyde dehydrogenase its role as a cancer stem cell marker comes down to the specific isoform. Cell Cycle. 10 (9), 1378-1384 (2011).
- Meng, E., et al. ALDH1A1 maintains ovarian cancer stem cell-like properties by altered regulation of cell cycle checkpoint and DNA repair network signaling. PLoS One. 9 (9), e107142 (2014).
- Kaipio, K., et al. ALDH1A1-related stemness in high-grade serous ovarian cancer is a negative prognostic indicator but potentially targetable by EGFR/mTOR-PI3K/aurora kinase inhibitors. The Journal of Pathology. 250 (2), 159-169 (2020).
- Deng, S., et al. Distinct expression levels and patterns of stem cell marker, aldehyde dehydrogenase isoform 1 (ALDH1), in human epithelial cancers. PLoS One. 5 (4), e10277 (2010).
- Chang, B., et al. ALDH1 expression correlates with favorable prognosis in ovarian cancers. Modern Pathology. 22 (6), 817-823 (2009).
- Gardner, S. H., Reinhardt, C. J., Chan, J. Advances in activity-based sensing probes for isoform-selective imaging of enzymatic activity. Angewandte Chemie. 60 (10), 5000-5009 (2021).
- Reid, B. M., Permuth, J. B., Sellers, T. A. Epidemiology of ovarian cancer: a review. Cancer Biology and Medicine. 14 (1), 9-32 (2017).
- Tulake, W., et al. Upregulation of stem cell markers ALDH1A1 and OCT4 as potential biomarkers for the early detection of cervical carcinoma. Oncology Letters. 16 (5), 5525-5534 (2018).
- Nwani, N. G., et al. A novel ALDH1A1 inhibitor targets cells with stem cell characteristics in ovarian cancer. Cancers. 11 (4), 502 (2019).
- Roy, M., Connor, J., Al-Niaimi, A., Rose, S. L., Mahajan, A. Aldehyde dehydrogenase 1A1 (ALDH1A1) expression by immunohistochemistry is associated with chemo-refractoriness in patients with high-grade ovarian serous carcinoma. Human Pathology. 73, 1-6 (2018).
- Landen Jr, C. N., et al. Targeting aldehyde dehydrogenase cancer stem cells in ovarian cancer. Molecular Cancer Therapeutics. 9 (12), 3186-3199 (2010).
- Condello, S., et al. β-catenin-regulated ALDH1A1 is a target in ovarian cancer spheroids. Oncogene. 34 (18), 2297-2308 (2015).
- Storms, R. W., et al. Isolation of primitive human hematopoietic progenitors on the basis of aldehyde dehydrogenase activity. Proceedings of the National Academy of Sciences. 96 (16), 9118-9123 (1999).
- Duellman, S. J., et al. A bioluminescence assay for aldehyde dehydrogenase activity. Analytical Biochemistry. 434 (2), 226-232 (2013).
- Minn, I., et al. A red-shifted fluorescent substrate for aldehyde dehydrogenase. Nature Communications. 5, 3662 (2014).
- Dollé, L., Boulter, L., Leclercq, I. A., van Grunsven, L. A. Next generation of ALDH substrates and their potential to study maturational lineage biology in stem and progenitor cells. American Journal of Physiology. Gastrointestinal and Liver Physiology. 308 (7), 573-578 (2015).
- Yagishita, A., et al. Development of highly selective fluorescent probe enabling flow-cytometric isolation of ALDH3A1-positive viable cells. Bioconjugate Chemistry. 28 (2), 302-306 (2017).
- Maity, S., et al. Thiophene bridged aldehydes (TBAs) image ALDH activity in cells: Via modulation of intramolecular charge transfer. Chemical Science. 8 (10), 7143-7151 (2017).
- Koenders, S. T. A., et al. Development of a retinal-based probe for the profiling of retinaldehyde dehydrogenases in cancer cells. ACS Central Science. 5 (12), 1965-1974 (2019).
- Oe, M., et al. Deep-red/near-infrared turn-on fluorescence probes for aldehyde dehydrogenase 1A1 in cancer stem cells. ACS Sensors. 6 (9), 3320-3329 (2021).
- Yagishita, A., Ueno, T., Tsuchihara, K., Urano, Y. Amino BODIPY-based blue fluorescent probes for aldehyde dehydrogenase 1-expressing cells. Bioconjugate Chemistry. 32 (2), 234-238 (2021).
- Okamoto, A., et al. Identification of breast cancer stem cells using a newly developed long-acting fluorescence probe, C5S-A, targeting ALDH1A1. Anticancer Research. 42 (3), 1199-1205 (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。