Method Article
ゼブラフィッシュの心リンパ機能研究のための心筋内注射
要約
本プロトコルは、蛍光マイクロスフェア(MS)および量子ドット(QD)を生きた魚の心筋に効率的かつ安定的に送達することを可能にする。
要約
ゼブラフィッシュは、胚発生後および再生中の心血管形成および機能を研究するための重要なモデルであることが証明されています。本プロトコルは、ゼブラフィッシュの心筋に蛍光トレーサーを注入して、間質液および破片の心臓リンパ管への取り込みを研究する方法を説明しています。そのために、ミクロスフェア(直径200 nm)と量子ドット(直径< 10 nm)を生体ゼブラフィッシュの心筋に導入し、 ex vivo 共焦点顕微鏡を使用して追跡できます。次に、これらのトレーサーを数時間にわたって断続的に追跡して、心筋から心臓リンパ管へのクリアランスを追跡します。量子ドットは心臓から離れた心臓リンパ管を通って輸送されますが、より大きなマイクロスフェアは注射部位に3週間以上留まります。この心筋内注射の方法は、心臓の標的領域に局所的に細胞、タンパク質、または目的の化合物を放出するためのカプセル化されたMSまたはハイドロゲルの注射を含む、他の用途に拡張することができます。
概要
リンパ系は、組織と体液のバランスを維持し、損傷後の免疫応答の調節、および腸内での脂質の吸収に不可欠です1。蓄積された証拠は、さまざまな疾患および発生状況におけるリンパ系の広範な役割を裏付けています。しかし、リンパ管は可視化しにくく、その機能が不確実なため、機構研究は妨げられています。初期のイメージング技術は、注入されたトレーサーを間質的に吸収し、リンパ管ネットワークを介して輸送するリンパ系の自然な能力に依存していました1。この方法は、リンパ管を視覚化するために使用できるだけでなく、組織から液体や高分子を取り込みます能力を定量化するためにも使用できます。
この広大なリンパ管網は、ゼブラフィッシュの再生に不可欠な役割を果たすことが示されている心臓リンパ系も包含しています2,3,4。異なる種間のリンパ機能の違いと類似点を理解することは、この知識を臨床的に活用するために重要です。したがって、異なるモデル生物5,6のリンパ機能を測定および視覚化できる技術を探求する必要があります。リンパ管は、組織7から離れて一方向に体液を輸送する鈍末の血管です。心臓組織からのリンパドレナージを観察するには、蛍光色素の心筋内注射が必要です。心筋内注射は、臨床的および前臨床の哺乳類モデルで、幹細胞や前駆細胞、またはヒドロゲルなどの外因性化合物を移植して、心筋梗塞後の心機能の改善をテストするためにも使用されています8,9,10。ゼブラフィッシュの心筋内注射は詳細に説明されていないため、ゼブラフィッシュの心臓に対するこのような実験的アプローチの使用は限られています。
ゼブラフィッシュの心膜腔への注射と心臓の内腔内の全身血流は以前に詳細に説明されており11,12、成体のゼブラフィッシュにおける蛍光トレーサーの心筋内注射の成功が報告されています2。本稿では、成体ゼブラフィッシュにおける心筋内注射を実施するための詳細なプロトコルを提供します。いくつかのトランスジェニックゼブラフィッシュ系統は、リンパ管を同定できます。しかし、リンパドレナージを理解するためのアプローチや、トランスジェニックマーカーがない場合のリンパ管を可視化するためのアプローチを模索する必要があります。ここでは、蛍光トレーサー、マイクロスフェア(MS)、および量子ドット(QD)を使用して、心臓リンパ管への注入部位と流体の流れを視覚化します。QDは、直径<10nmの蛍光ナノ結晶であり、その光学特性を調整し、多くの生物医学的応用に適合させることができる13,14。QDはリンパ管に容易に取り込まれるが、間質的に注射されると血液血管系には取り込まれない15,16。MSは、直径約200nmの蛍光被覆ポリスチレンビーズである15。そのため、MSはQDよりもかなり大きく、心筋に注入すると大幅に持続性が高いため、注射部位を一貫して特定できます。この方法は、心臓再生中のリンパ機能の研究に役立ちますが、コーティングされたビーズ、ハイドロゲル、または細胞調製物の安定した局所導入を使用して、心臓生物学のさまざまな側面を研究するために適用できます。
プロトコル
すべての動物用処置は、ワイル・コーネル・メディスンの動物管理・使用委員会(プロトコル2020-0027)によって承認され、適切なガイドラインに従っています。以下の実験は、成体の場合は受精後14〜20か月、幼体の場合は受精後35日齢の雌のAB野生型ゼブラフィッシュで行われました。
1. 針引きと試薬調製
- 外径1.2 mm(外径)の標準ホウケイ酸ガラスキャピラリーを、ニードルプラー(図1A、B)( 材料表を参照)を使用して、最適な設定を使用して2本の針に引っ張ります。この場合、熱525;65を引っ張ります。速度60;時間250。
- Vortexは、MS(水中の1%固形分)およびQD(2μM、 材料の表を参照)のコロイド溶液を市販に入手しました。
注:MSコロイド溶液は白色で、注入すると簡単に見えます。 - 500 μLのMSストックコロイド溶液を0.45 μmシリンジフィルター( 材料表を参照)でろ過し、針の詰まりを最小限に抑えます。
- MSのみの作業コロイド溶液を調製するには、ろ過したMSコロイド溶液100 μLを1x PBS(リン酸緩衝生理食塩水)100 μLで希釈します。
- MSおよびQDの作業コロイド溶液を調製するには、ろ過したMSコロイド溶液100μLとQDコロイド溶液100μLを混合します。
注:実験に応じて、MSとQDを混合または個別に注入することができます。 - 図 1D に示すように、ステレオスコープ、ウェットスポンジ、マイクロマニピュレーター、インジェクター、20μLピペット、トリカイン溶液、ストレート虹彩切除ハサミ、鉗子、プルドニードル、マイクロローダーフェムトチップ、回収タンク、ネットなど、必要な試薬と機器を準備し、配置します( 材料の表を参照)。
- インジェクターの空気供給をオンにし、時限注入パルスではなくゲート注入パルスを設定します。
注:インストゥルメンタルの詳細については、 資料の表を参照してください。一部の機器では、インジェクションペダルを機器の背面にあるゲート付き入力ポートに挿入する必要があります。
2. インジェクションステーションの準備とゼブラフィッシュの準備
- 解剖顕微鏡の電源を入れ、ピントを調整します。
- マイクロローダーピペットチップを使用して、制御溶液(例:1x PBS中の0.05%フェノールレッド)をロードします。
- マイクロインジェクターのニードルホルダーに針を挿入します。
- 解剖顕微鏡下で、引っ張った針を鉗子を使用して先端から1mmで切断します。
注:針をできるだけ細く切ることが、心筋を突き刺すのに最適です。ただし、針が細すぎると、心臓組織を貫通しようとしたときに針が曲がってしまうことがあります。 - 適切な注入圧力を約0.50 kPa/7.3 psiに設定し、バランス圧力を約0 psiに設定して、ニードルに液体が引き込まれないようにします(図1C)。
- 目的の圧力に達したら、注入セットアップをテストし、直径 1 mm (<0.5 μL) 未満の鉱物油に溶液のボーラスを注入するのにかかった時間を記録します。
注:理想的には、注入で約50 nL/sで流体を放出し、5秒で約0.8mmのボーラス径を得る必要があります。針の先端径に応じて、時間と圧力を調整して、5秒の注入で1匹の魚に0.25〜0.3μLを注入することができます。注入中に高い間質組織圧を克服できるようにするためには、注入時間を長くするよりも、より高い注入圧力が望ましいです。 - 選択した容量(例:10-15 μL、 図1B)の注射液を針にロードし、手順2.5-2.6を繰り返します。
注:ゲート注射では、フットペダルを踏んでいる限り注射することができ、適切な組織内注射部位が見つかるまで先端位置を調整することができます。 - 注入液をロードしたニードルをマイクロインジェクターのニードルホルダーに挿入します。
3.インジェクション
- 真ん中に魚のような輪郭を彫って溝のあるスポンジを準備します。
- 結晶化皿で4.2 mLの原液(4 mg / mL)を100 mLの魚施設の水( 材料の表を参照)に希釈して、トリカインの使用濃度を調製します。.
- ゼブラフィッシュをトリカイン溶液で麻酔し、えらの動きが減少して遊泳が止まるまで麻酔します。
注:テールをつまんで、麻酔をかけたゼブラフィッシュの応答の喪失を確認します。 - ゼブラフィッシュの腹側を対物レンズに向けて、解剖顕微鏡下の湿らせた溝付きスポンジに置きます(図2A および 図3A)。
- 虹彩切除ハサミを使用して、胸鰭のレベルで小さな横切開を行い、胸腔を開きます(補足ビデオ1)。
- 鉗子を使用して、心膜をそっと剥がして心臓の頂点を露出させます(図3B)。
- ロードされたニードルホルダーを手にして、針を体軸に対して<30°の鋭角で心室の頂点に向けます。
- 0.1〜0.2 mmの針を心室に深く挿入しないように心臓に挿入します(図2B および 図3B)。
注:針の先端が血液で満たされている場合は、MSとQDが心室内腔に注入されないように、針を少し引っ込めてください。. - 針を心臓の頂点に挿入した状態で、針先を心臓の基部に向けて動かしながら、針と体の軸の間の角度を小さくして、心室を体から少し離します(図2C および 図3C)。
注:針は心筋壁を通してかすかに見える場合があります。 - 針の先端が心筋表面に向かって動くように、針をさらに頭に向かって押します。
- マイクロインジェクションデバイスのペダルを 1 ~ 5 秒間、または心臓組織内に白い斑点が見えるまで押して注入します (図 2C および 図 3C、D)。
- 注入中に胸腔が注射液で満たされ始めた場合は、針先が心筋を完全に貫通したことを示しています(図2D)。組織内にマイクロビーズの蓄積が見えるまで、針をゆっくりと引き抜きます。
- 液体が心室内腔に注入され、その後の心拍でクリアされる場合は、針先を再配置します(図2E)。このような状況では、針の先端を持ち上げ、注射圧力によって組織に白い斑点ができるまで針を頭の方向に押します。
- 白い液体や斑点が見えない場合は、注射針が詰まっています。このような場合は、針を完全に引っ込めてください。実験を続けるには、針の先端を少し折るか、針を交換します。どちらの場合も、心筋を再注入する前に注入フローを確認してください。.
- 注射が成功したら、針を心筋からゆっくりと引き抜き(図3F)、すぐにゼブラフィッシュを魚施設の水が入った回収タンクに移します。
- 魚がトリカインから完全に回復するまで魚を監視します。
- 回収した魚を2.8Lのタンクに移し、心臓抽出の希望の時点まで魚施設に置きます。
4.心臓の抽出とイメージング
- 結晶化皿で4.2 mLのストック溶液(4 mg / mL)を100 mLの魚施設の水に希釈することにより、トリカインの使用濃度を調製します。.
- ゼブラフィッシュをトリカイン溶液で終末的に麻酔し、えらの動きが止まり、反応しなくなるまで麻酔をかけます。
- ゼブラフィッシュを、対物レンズに面した腹側に配置された解剖顕微鏡の下で湿らせた溝付きスポンジに移します。
- 胸鰭のレベルで虹彩切除術のはさみで胸の腹壁を開きます。
- 心嚢を開き、心臓の流出経路を見つけます。鉗子を使用して、球状動脈(BA)の前方にある大動脈をつかみ、心室の基部で慎重に引き上げます。
- 心臓の前極を上げた状態で、腹側大動脈/静脈洞を切開して心臓を解放し、PBSを含む35mmのペトリ皿に入れます。
- 鉗子を使用して血栓を取り除き、心臓を4%PFA(wt / vol)で15分間固定します。
- 使用した蛍光波長を取得できる顕微鏡で心臓を画像化します。
注:この例の日付では、405、488、567、および647レーザーラインを備えた共焦点顕微鏡を使用しました。 - ImageJ/Fijiソフトウェア( 資料表参照)を使用して画像解析を行います。
注:QDまたはMS濃縮の計算は、高 または低閾値 を使用して実行され、リンパ管チャネルで 選択関数を作成して 、最初にリンパ管の領域と血管信号がない領域を選択しました。次に、 Measure 関数を使用して、QDまたはMSチャネルのピクセル強度を測定し、そこから2つの選択の比率を計算しました。
結果
注射の直後に、心筋壁の小さな白い領域が見えなければなりません(図3F)。この領域は、注入されたMSおよびQDの明るい蛍光標識を示します(図4B、E)。さらに、処置後の心膜腔の任意のQDおよびMSからの心臓の外面に弱く散発的な蛍光点がある場合があります(図4B、E)。注入されたトレーサーは、時間の経過とともに追跡できます。これを行うには、魚を安楽死させ、心臓を採取し、前述の16のように共焦点顕微鏡下に置く必要がある。
MSは注射の1日後も注射部位で観察され、一部は心房と球根状動脈(BA)の外面に閉じ込められています(図4B)。MSは心筋内で3週間以上安定しており(図4C、D)、外因性化合物または細胞の導入に使用できることが示唆されています(補足図1)。
MS(直径 200 nm)とは対照的に、より小さな量子ドット(直径 <10 nm)は、注入部位により一過性に位置付けられます。注射後1時間後(hpi)、MSとQDの両方が注射部位で発見されました(図4E)。12〜24時間の時間枠で、小さいQDはMSよりも注射部位から分散し、BAのリンパ管系を含むリンパ内皮内により集中していました(図4F、G;図 4 I-K)。大きい方のMSは注射部位に留まり、小さい方のQDが間質液とともに分散し、この液体とともにリンパ管に取り込まれることを示唆しています。QDチャネルにおける蛍光シグナルの濃度の増加は、リンパトランスジェニック蛍光(図4G、H)と重複することが観察され、リンパ管の取り込みを追跡するために使用できます(図4K)。
間質液と高分子のリンパクリアランスをテストした後、このアッセイを適用して、リンパ機能が未発達または増強された遅延クリアランスを調べることができます。これを実証するために、機能的な心臓リンパ管を欠くゼブラフィッシュの稚魚(35 dpf)にQDを注射し、QDの取り込みは観察されませんでした(図4H)。
注入した MS の安定性(図 4C、D)を考慮して、この方法を使用して外因性化合物を送達する方法を検討することにしました。これを行うために、MSをトランスジェニックゼブラフィッシュに注射する前に、4-ヒドロキシタモキシフェン(4OHT)の10 mM溶液に一晩浸しました。4OHTを注入したトランスジェニックゼブラフィッシュは、心室に局在するCreERt2活性を示し(補足図1)、適切なMS調製または必要に応じてカプセル化されたMSの使用により、このようなアプローチが可能であることを示唆しています。

図1:心筋内注射用の装置のセットアップ(A)ニードルプラー。(B)注射液で引っ張られた針。(C)インジェクターの設定のクローズアップ view。(D)インジェクションステーションの一般的なセットアップ。1)ステレオスコープはニードルホルダーとマニピュレーターに接続されています。2)90mmの皿に濡れたスポンジをかぶせて、麻酔をかけた成魚のゼブラフィッシュを挟む。3)注射の間に針を保持するマイクロマニピュレーター(注、注射はフリーハンドで行われます)。4)インジェクターデバイス。5) 20 uL ピペット。6) トリカイン溶液。7) QDとMSの解決策 8) ストレート虹彩切除術用ハサミ。9)一対の鉗子.10)引っ張られた針。11)マイクロローダーフェムトチップ。12)回収タンク。13)ネット。この図の拡大版を表示するには、ここをクリックしてください。
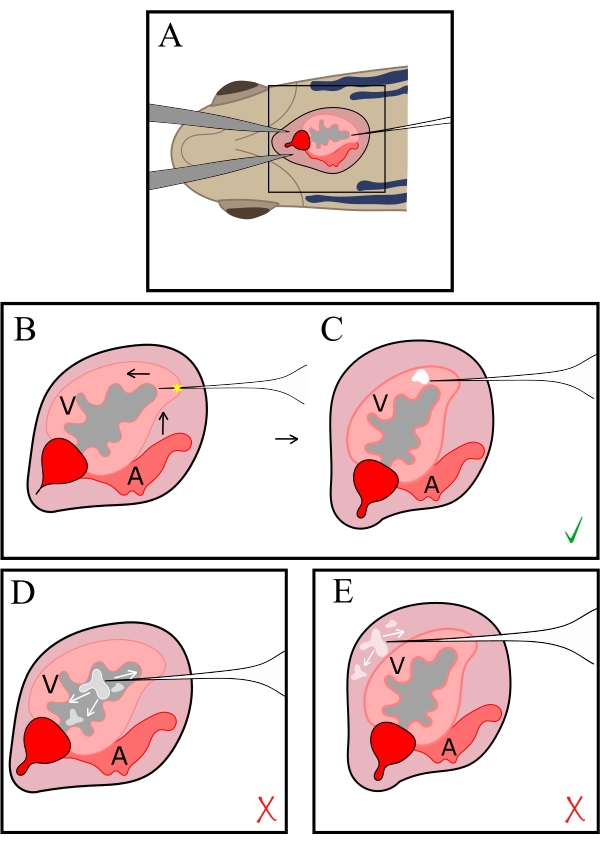
図2:インジェクションの概略図。 針は胸部の開口部(A)から胸部に導入され、次に頂点(B)で心臓に挿入されます。針先を持ち上げて頭に向かって動かし、心筋の腹側に注入します。アスタリスクは穿刺部位を示し、濃縮された白い塊は注入部位を示します(C)。先端は、内腔内に配置されるのに十分な距離(D)または心膜腔(E)に前方に押し戻されすぎて、注入液の拡散と一時的な放出を引き起こしてはなりません。.V、心室;A、アトリウム。 この図の拡大版を表示するには、ここをクリックしてください。
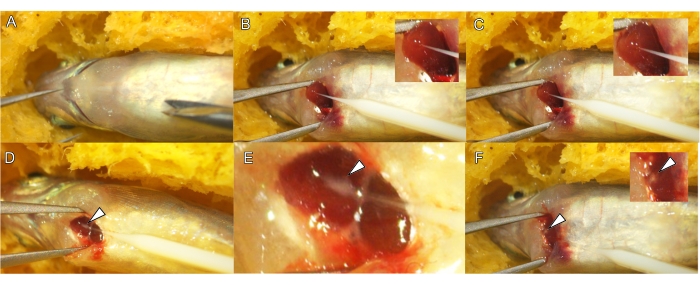
図3:成魚の心筋内注射(A)腹側を上にした麻酔ゼブラフィッシュの配置。(B)針を心室の頂点(矢じり)に配置します。心室内の先端の前方への動きで心筋に針を挿入する(C)。QDおよびMS溶液を心筋層の間質腔に注入して、小さな白い塊(白い矢印、D、およびE)を形成します。注射混合物の白い点は、針を抜いた後も心筋に見えるままです(白い矢印、F)。この図の拡大版を表示するには、ここをクリックしてください。
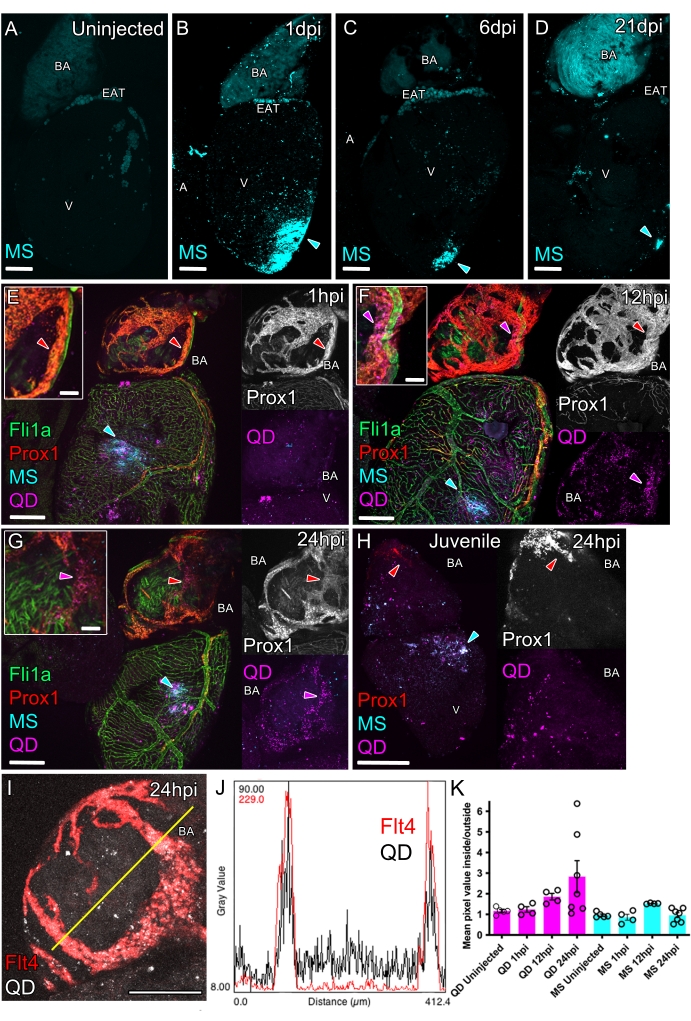
図4:心臓リンパ管の機能を研究するための心筋内注射。汎内皮マーカーfli1a:GFP(緑、E-G)およびリンパ内皮マーカーprox1:Gal4-UAS:RFP(E-Hの赤)またはflt4:mCitrine(Iの赤)を発現する、心筋内注射された成人の非トランスジェニック野生型(A-D)およびトランスジェニックゼブラフィッシュの心臓のホールマウント共焦点イメージング。注射されていないコントロール心臓 (A) は強い蛍光を欠いていますが、球状動脈 (BA) と心外膜脂肪組織 (EAT) に自家蛍光があります。200 nm MS(シアン)の心筋内注射では、1 (B)、6 (C)、および 21 dpi (D) の注入部位 (シアンの矢じり) で持続的かつ局所的な蛍光が発せられます。MS(200 nm、シアン)とQD(10 nm、マゼンタ)の併用心筋内注射により、両方が注入部位に沈着します(E-H、シアンの矢じり)。(E)注射後1時間(hpi)では、MSは注射部位に残り、QDはより分散していますが、BAのリンパ管に強く濃縮されていません(挿入図、赤い矢印、成人、14 mpf / 36 mm)。(F) 12 hpiでは、QDは心室と流出路全体にランダムに分布します(成人、16 mpf / 29 mm)。また、QDは、prox1:Gal4-UAS:RFP陽性信号(赤とマゼンタの矢印)と重なってBA上のリンパ管に部分的に排出されます。(G)24 hpiでは、QDはprox1:Gal4-UAS:RFP陽性信号(赤とマゼンタの矢印、成人、19 mpf / 34 mm)と重なってBA上のリンパ管内に非常に集中しています。(H) 心機能リンパ管を欠損する若年(赤矢印)では、QDは注射部位(シアン色の矢印)に集中し、成人(若年、1 mpf / 10 mm)で観察されるように、BAおよび心室にびまん性QDが見られます。(I)flt4:mシトリン標識リンパ管(赤)とQD(灰色)を心室内心室に24時間前に注入したBAの共焦点画像の例(成人、19 mpf / 34 mm)。黄色の線は、ヒストグラムが表示されるピクセル強度の平面を示します (J)。(K)BA上のflt4:mCitrine/prox1:Gal4-UAS:RFP陽性血管内のQDチャネル強度を、同じBA上の血管外のQD強度に正規化した定量化。QD 強度は注入後に血管内でますます濃縮されますが、MS の強度は濃縮されないままです (SEM では、時点あたり n = 4-7 の平均)。スケールバー:200 μm(A-I)および50 μm(インセット、E-G)。 略語:BA =動脈球、EAT=心外膜脂肪組織、V =心室、A =心房、MS =マイクロスフェア、QD =量子ドット、mpf =受精後数ヶ月、mm =ミリメートル単位の標準ゼブラフィッシュの長さ。この図の拡大版を表示するには、ここをクリックしてください。
補足図1:4OHT浸漬MSの心筋内注射。 (A)cmlc2の概略図:CreERT2発現コンストラクトの生成に用いたCreERT2発現コンストラクトは、4OHTが存在する場合にcmlc2陽性心筋細胞においてmCherry(およびGata4、dnGata4のドミナントネガティブ型)の発現を誘導できるトランスジェニックゼブラフィッシュを生成するために用いられた17。(B)導入後14日目のゼブラフィッシュの心臓におけるmCherry(赤)の発現(幼若;35 dpf;13.5 mm)。4OHTの10 mMストック溶液をシステム水で最終濃度10 μMまで希釈し、ゼブラフィッシュを6時間浸漬します。 (C,D) 4OHT浸漬MS(D;青)を成魚のゼブラフィッシュ(190 dpf; 24.5 mm)で捕獲した。スケールバー:50 μm(B)および100 μm(C、D)。このファイルをダウンロードするには、ここをクリックしてください。
補足ビデオ1: QD + MSの心筋内マイクロインジェクションの成功を実演する代表的なビデオです 。このファイルをダウンロードするには、ここをクリックしてください。
ディスカッション
本稿では、ゼブラフィッシュの心筋に外因性物質を導入する方法について述べた。この技術は、QDとMSを心筋に導入して、恒常性と再生におけるリンパ機能を研究するために開発されました2,18。同様のアプローチは、心筋梗塞後のリンパ管の存在と機能を調査するために、マウスの心筋にQDを導入するためにも使用されてきた19,20。
心筋への針先の浸透と位置決めは、この手順の重要なステップです。ガラス毛細血管は、密集した心筋組織を貫通するのに十分な鋭さと、注射部位を配置するときに心臓を持ち上げる力で曲がらないように十分な剛性を備えている必要があります。これら2つの先端特性の最適なバランスは、鉗子で先端サイズをどれだけ縮小するかを変えることによって達成できます。鋭角注入角度は、先端を心筋壁に押し込むのに最適です。選択した部位での注射は、心臓の鼓動運動のために困難です。したがって、注射は、最初に先端を鼓動する心臓に置き、それをわずかに動かして注射部位を調整することにより、制御された方法で行う必要があります。先端が鼓動する心臓に接触して、最終的に心筋を穿刺するのに十分な力を加えるときに2つを垂直に保つために、注入角度をさらに調整する必要があります。
心臓組織に入ると、針で心臓の頂点を上げ、先端を伸ばし続けることで先端の位置を操作します。そうしないと、循環器への管腔注射が行われます。魚の前方にさらに圧力が加えられると、針が心筋の基部に向かって再侵入するか、または移動し続けるときに、針が組織に見えることがよくあります。この時点で、注入圧力の短いパルスが正確な先端位置と、それが目的の注入位置にあるかどうかを示します。注入される材料の最終的な量は、それが組織内に存在する時間に影響を与えます。量が多いほどクリアするのに時間がかかり、QDはリンパ管でより長く見えます。目に見える取り込みが始まるまでにかかる時間は、注射部位と心臓リンパ管との間の相対距離の関数でもあります。リンパ管の近位に注入された材料は、遠くにある材料よりも早く取り込まれます。成体のゼブラフィッシュでは、リンパ管の被覆率が年齢やサイズによって異なるため、この手法を使用した実験を計画する際に考慮すべきアッセイのばらつきがさらに生じます2。
リンパ系による蛍光トレーサーの特異的な取り込みは、トレーサー21のサイズに依存する。100nm未満の粒子サイズは、リンパ管22で容易に採取できる。QDのサイズは<10nmです。したがって、QD の大部分は、心筋内注射後 24 時間以内にリンパ系に取り込まれることが観察されました。注射された蛍光トレーサーがどのような免疫応答を誘導し、それがゼブラフィッシュにどのくらい持続するかは不明です。しかし、マウスを用いた以前の研究では、空/ブランクMSの注射は有意な免疫応答を誘発しないことが示されており23,24、この処置による典型的な生存率は成体のゼブラフィッシュで100%であることが示されています。
心筋内注射は、哺乳類モデルで臨床的および実験的に使用されており、幹細胞および前駆細胞の心筋内注射による心筋梗塞後の心機能のテストまたは改善のために、またはヒドロゲル8,9,10などの外因性化合物。近年、MSはドラッグデリバリーや再生の分野で大きな注目を集めています25。ゼブラフィッシュにおけるMSの心筋注射が可能であり、注射後3週間以上安定していることを実証しました。さらに、私たちの予備的なデータは、この方法がゼブラフィッシュの心臓に外因性化合物を送達するために使用できる可能性があることを示唆しています。このプロトコールを応用して機能的MSを使用し、ゼブラフィッシュの心臓に外因性化合物や細胞を導入し、多くの研究分野に幅広く応用することは興味深いことです。
開示事項
著者は何も開示していません。
謝辞
魚の世話をしてくれたAdedeji Afolalu氏、Chaim Shapiro氏、Soji Hosten氏、Chelsea Quies氏(Weill Cornell Medicine)、原稿を批判的に読んでくれたCaroline Pearson氏(Weill Cornell Medicine)に感謝します。Jingli Cao (Weill Cornell Medicine) は、原稿の批判的な読み取りに加えて、解剖スコープとカメラを使用して手順を記録しました。Nathan Lawson (マサチューセッツ大学医学部)、Brant Weinstein (NICHD)、Elke Ober (コペンハーゲン大学)、Stephan Schulte-Merker (WWU Münster) の遺伝子組換えゼブラフィッシュ株。Daniel Castranova (NICHD) は QD とイメージングに関するアドバイスを、Yu Xia (Weill Cornell Medicine) はスコープビデオキャプチャの解剖に関するガイダンスを提供します。この研究は、NMへのNYSTEMフェローシップ、American Heart Association Career Development Award(AHA941434)、National Institutes of Health(NIH)の助成金(R01NS126209)、およびMHへのWeill Cornell Medicine Startup Fundによって支援されました。
資料
| Name | Company | Catalog Number | Comments |
| Crystallization dish | VWR | 89000-288 | |
| Dissection Scope | Zeiss | 495010-0007-000 | |
| Fish facility water | N/A | N/A | RO water with sea salt and sodium bicarbonate added to a conductivity of 226uS and pH of 7.35 |
| Forceps | Dumont | 11252-20 | |
| Glass Capillaries | WPI | 1B120-3 | no filament |
| ImageJ | https://imagej.nih.gov/ij/download.html | ||
| Iridectomy scissors | Fine Scientific Tools | 15000-00 | |
| Microinjector | Warner Instruments | 64-1735 | |
| Microloader femtotips | Eppendorf | 5242 956.003 | |
| Micropipette puller | Sutter Instrument | P-97 | Gated pedal input |
| Microspheres | Thermo Fisher Scientific | B200 | Blue |
| PBS | Corning | 46-013-CM | |
| Quantum dots (QD) | Thermo Fisher Scientific | Q21061MP | Qtracker705 vascular label |
| Sponge | any | any | (1.5 × 5 × 3 cm) with groove (0.5 × 2.5 cm) |
| Syringe filter | Corning | 431220 | |
| Tricaine | Sigma-Aldrich | A5040 | concentration: 4 mg/mL |
参考文献
- Munn, L. L., Padera, T. P. Imaging the lymphatic system. Microvascular Research. , 55 (2014).
- Harrison, M. R., et al. Late developing cardiac lymphatic vasculature supports adult zebrafish heart function and regeneration. eLife. 8, 42762 (2019).
- Gancz, D., et al. Distinct origins and molecular mechanisms contribute to lymphatic formation during cardiac growth and regeneration. eLife. 8, 44153 (2019).
- Vivien, C. J., et al. Vegfc/d-dependent regulation of the lymphatic vasculature during cardiac regeneration is influenced by injury context. NPJ Regenerative Medicine. 4, 18 (2019).
- Cueni, L. N., Detmar, M. The lymphatic system in health and disease. Lymphatic Research and Biology. 6 (3-4), 109 (2008).
- Schwartz, N., et al. Lymphatic function in autoimmune diseases. Frontiers in Immunology. 10, 519 (2019).
- Feng, X., Travisano, S., Pearson, C. A., Lien, C. L., Harrison, M. R. M. The lymphatic system in zebrafish heart development, regeneration and disease modeling. Journal of Cardiovascular Development and Disease. 8 (2), 1-14 (2021).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479 (2012).
- Williams, A. R., et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: Functional recovery and reverse remodeling. Circulation Research. 108 (7), 792-796 (2011).
- Rodell, C. B., et al. Injectable shear-thinning hydrogels for minimally invasive delivery to infarcted myocardium to limit left ventricular remodeling. Circulation: Cardiovascular Interventions. 9 (10), 004058 (2016).
- Bise, T., Jaźwińska, A. Intrathoracic injection for the study of adult zebrafish heart. Journal of Visualized Experiments. (147), e59724 (2019).
- Konantz, J., Antos, C. L. Reverse genetic morpholino approach using cardiac ventricular injection to transfect multiple difficult-to-target tissues in the zebrafish larva. Journal of Visualized Experiments. (88), e51595 (2014).
- Wagner, A. M., Knipe, J. M., Orive, G., Peppas, N. A. Quantum dots in biomedical applications. Acta Biomaterialia. 94, 44 (2019).
- Rizvi, S. B., Ghaderi, S., Keshtgar, M., Seifalian, A. M. Semiconductor quantum dots as fluorescent probes for in vitro and in vivo bio-molecular and cellular imaging. Nano Reviews. 1 (1), 5161 (2010).
- Van Nguyen, T., et al. Size determination of polystyrene sub-microspheres using transmission spectroscopy. Applied Sciences. 10 (15), 5232 (2020).
- Harrison, M. R. M., et al. Chemokine-guided angiogenesis directs coronary vasculature formation in zebrafish. Developmental Cell. 33 (4), 442-454 (2015).
- Gupta, V., et al. An injury-responsive gata4 program shapes the zebrafish cardiac ventricle. Current Biology. 23 (13), 1221-1227 (2013).
- El-Sammak, H., et al. A Vegfc-Emilin2a-Cxcl8a signaling axis required for zebrafish cardiac regeneration. Circulation Research. 130 (7), 1014-1029 (2022).
- Harris, N. R., et al. VE-Cadherin is required for cardiac lymphatic maintenance and signaling. Circulation Research. 130 (1), 5-23 (2022).
- Henri, O., et al. Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction. Circulation. 133 (15), 1484-1497 (2016).
- Rao, D. A., Forrest, M. L., Alani, A. W. G., Kwon, G. S., Robinson, J. R. Biodegradable PLGA based nanoparticles for sustained regional lymphatic drug delivery. Journal of Pharmaceutical Sciences. 99 (4), 2018-2031 (2010).
- Casley-Smith, J. R. The fine structure and functioning of tissue channels and lymphatics. Lymphology. 13 (4), (1980).
- Liu, Y., et al. Experimental vaccine induces Th1-driven immune responses and resistance to Neisseria gonorrhoeae infection in a murine model. Mucosal Immunology. 10, 1594-1608 (2017).
- Wang, D., et al. Poly(D,L-Lactic-co-Glycolic Acid) microsphere delivery of adenovirus for vaccination. Journal of Pharmaceutical Sciences. 10 (2), 217-230 (2007).
- Li, Q., Chang, B., Dong, H., Liu, X. Functional microspheres for tissue regeneration. Bioactive Materials. , (2022).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
ISSN 2578-2746
Copyright © 2023 MyJoVE Corporation. All rights reserved
当社はcookieを使用しています。
「続行」をクリックすることで、当社のcookieへの同意となります。