Method Article
用于斑马鱼心脏淋巴功能研究的心肌内注射
摘要
本方案允许将荧光微球 (MS) 和量子点 (QD) 高效稳定地输送到活鱼的心肌中,这些微球可以随着时间的推移进行跟踪(追踪)。
摘要
斑马鱼已被证明是研究胚胎后发育和再生过程中心血管形成和功能的重要模型。本方案描述了一种将荧光示踪剂注射到斑马鱼心肌中以研究间质液和碎片摄取到心脏淋巴管中的方法。为此,将微球(直径 200 nm)和量子点(直径 <10 nm)引入活斑马鱼的心肌中,可以使用 离体 共聚焦显微镜进行跟踪。然后在数小时内间歇性地跟踪这些示踪剂,以跟踪从心肌进入心脏淋巴管的清除情况。量子点通过心脏淋巴管从心脏输送出去,而较大的微球在注射部位停留超过三周。这种心肌内注射方法可以扩展到其他用途,包括注射封装的 MS 或水凝胶,以将感兴趣的细胞、蛋白质或化合物局部释放到心脏的目标区域。
引言
淋巴系统对于维持组织-液体平衡、损伤后免疫反应的调节以及肠道脂质的吸收至关重要1。越来越多的证据支持淋巴系统在各种疾病和发育环境中的广泛作用。然而,机制研究受到阻碍,因为淋巴管可能难以可视化,并且它们的功能可能不确定。早期的成像技术依赖于淋巴系统的自然能力,即间歇性地吸收注射的示踪剂,然后通过淋巴管网络运输它们,从而实现检测和可视化1。这种方法不仅可以用于可视化淋巴管,还可以用于量化它们从组织中吸收液体和大分子的能力。
庞大的淋巴网络还包括心脏淋巴系统,该系统已被证明在斑马鱼的再生中起着不可或缺的作用 2,3,4。了解不同物种淋巴功能的差异和相似之处对于在临床上利用这些知识至关重要。因此,需要探索可以测量和可视化不同模式生物淋巴功能的技术 5,6。淋巴管是钝端血管,可沿一个方向输送液体,远离组织7。需要心肌内注射荧光染料以观察心脏组织的淋巴引流。心肌内注射也已用于临床和临床前哺乳动物模型,以移植干细胞和祖细胞或外源化合物(如水凝胶),以测试心肌梗死后心脏功能的改善 8,9,10。斑马鱼心肌内注射尚未详细描述,这限制了此类实验方法对斑马鱼心脏的使用。
之前已经详细描述了斑马鱼心包腔注射和心脏腔内的全身血流11,12,并且已经报道了成年斑马鱼成功心肌内注射荧光示踪剂2。本文提供了对成年斑马鱼进行心肌内注射的详细方案。几种转基因斑马鱼品系可以识别淋巴管;然而,有必要探索了解淋巴引流的方法,或者在没有转基因标志物的情况下可视化淋巴管。此处使用荧光示踪剂、微球 (MS) 和量子点 (QD) 来可视化注射部位和流入心脏淋巴管的液体。QD 是直径为 <10 nm 的荧光纳米晶体,其光学特性可以调整和适应,以服务于许多生物医学应用 13,14。QD 在间层注射时很容易被淋巴管吸收,但不被血管吸收15,16。MS 是直径约为 200 nm 的荧光包被聚苯乙烯微珠15。因此,MS 比 QD 大得多,并且在注射到心肌时明显更持久,从而可以一致地识别注射部位。该方法可用于研究心脏再生过程中的淋巴功能,但可以使用包被珠、水凝胶或细胞制剂的稳定局部引入来适应研究心脏生物学的各个方面。
研究方案
所有动物程序均已获得威尔康奈尔医学院机构动物护理和使用委员会的批准(协议 2020-0027)并遵循适当的指南。以下实验是对成年受精后 14 至 20 个月和幼鱼受精后 35 天的雄性和雌性 AB 野生型斑马鱼进行的实验。
1. 拔针和试剂制备
- 使用拔针器(图 1A、B)(参见 材料表)将 1.2 mm OD(外径)标准硼硅酸盐玻璃毛细管拉入两个针中,使用最佳设置。在这种情况下,热量 525;拉 65;速度 60;时间 250.
- 涡旋市售的 MS(1% 水溶液)和 QD(2 μM,参见 材料表)的胶体储备液。
注:MS 胶体溶液为白色,注射时很容易看到。 - 通过 0.45 μm 注射器过滤器过滤 500 μL MS 原液胶体溶液(参见 材料表),以尽量减少针头堵塞。
- 要制备仅 MS 的工作胶体溶液,请用 100 μL 1x PBS(磷酸盐缓冲盐水)稀释 100 μL 过滤后的 MS 胶体溶液。
- 要制备 MS 和 QD 的工作胶体溶液,请将 100 μL 过滤后的 MS 胶体溶液与 100 μL QD 胶体溶液混合。
注:根据实验,MS 和 QD 可以混合或单独进样。 - 准备并安排必要的试剂和设备:立体镜、湿海绵、显微作器、注射器、20 μL 移液器、三卡因溶液、直虹膜切除术剪刀、镊子、拉针、微型装载机飞秒针、回收罐和网,如图 1D 所示(参见 材料表)。
- 打开喷油器气源并设置门控注射脉冲,而不是定时注射脉冲。
注:有关乐器的详细信息,请参阅 材料表。某些仪器需要将进样踏板插入仪器背面的门控输入端口。
2. 注射站准备和斑马鱼准备
- 打开解剖显微镜并调整焦距。
- 使用微量加载器移液器吸头,加载对照溶液(例如,1x PBS 中的 0.05% 酚红)。
- 将针头插入显微注射器的持针器中。
- 在解剖显微镜下,使用镊子在距尖端 1 毫米处切割拉出的针头。
注意:将针头剪得尽可能窄是刺穿心肌的最佳选择。但是,如果针头太窄,它在尝试穿透心脏组织时可能会弯曲。 - 将适当的注射压力设置为约 0.50 kPa/7.3 psi,并将平衡压力设置为 0 psi 左右,这样液体就不会回缩到针中(图 1C)。
- 达到所需压力后,测试进样设置,并记录将溶液推注到直径小于 1 mm 的矿物油 (<0.5 μL) 中所需的时间。
注:理想情况下,注射必须以大约 50 nL/s 的速度释放液体,以便在 5 秒内得到大约 0.8 mm 的推注直径。根据针头的尖端直径,可以调整时间和压力,在 5 秒的注射时间内将 0.25-0.3 μL 注射到一条鱼中。与较长的注射时间相反,需要更高的注射压力,以确保在注射过程中可以克服高间质组织压力。 - 用所选体积(例如,10-15 μL, 图 1B)的注射溶液装入针头,然后重复步骤 2.5-2.6。
注意:只要踩下脚踏板,门控注射就允许注射,从而可以调整尖端位置,直到找到正确的组织内注射部位。 - 将装有注射液的针头插入显微注射器的针架中。
3. 注射
- 通过在中间刻出鱼状的轮廓来准备一块带槽的海绵。
- 通过在结晶皿中将 4.2 mL 储备溶液 (4 mg/mL) 稀释到 100 mL 鱼类设施水中(参见 材料表)来制备三卡因的工作浓度。
- 在三卡因溶液中麻醉斑马鱼,直到鳃的运动减少并且它停止游泳。
注意:捏住尾巴以确认麻醉斑马鱼的反应丧失。 - 将斑马鱼的腹侧面向物镜放置在解剖显微镜下湿润的凹槽海绵中(图 2A 和 图 3A)。
- 使用虹膜切除术剪刀在胸鳍水平做一个小的横向切口并打开胸腔(补充视频 1)。
- 用镊子轻轻剥开心包,露出心尖(图 3B)。
- 手持加载的持针器,将针头以与体轴成 <30° 的锐角指向心室尖端。
- 将 0.1-0.2 毫米的针头插入心脏,不要太深地插入心室(图 2B 和 图 3B)。
注:如果针头的尖端充满血液,请稍微缩回针头,以避免将 MS 和 QD 注射到心室腔中。 - 将针头插入心尖后,通过减小针头与体轴之间的角度,同时将针尖移向心脏底部,将心室稍微抬离身体(图 2C 和 图 3C)。
注意:针头可能透过心肌壁隐约可见。 - 将针头进一步推向头部,使针尖朝心肌表面移动。
- 通过踩下显微注射装置的踏板 ~1-5 秒或直到心脏组织内可见白点进行注射(图 2C 和图 3C,D)。
- 如果注射时胸腔开始充满注射液,则表明针尖已完全穿透心肌(图 2D)。慢慢抽出针头,直到在组织内看到微珠堆积。
- 如果液体被注射到心室腔中并随着随后的心跳清除,请重新定位针尖(图 2E)。在这种情况下,抬起针尖并将针头推向头部方向,直到注射压力导致组织中出现白点。
- 如果看不到白色液体或斑点,则注射针被堵塞。在这种情况下,请完全缩回针头。要继续实验,请稍微折断针尖或更换针头。在这两种情况下,在再次注射心肌之前检查注射流程。
- 注射成功后,轻轻地将针头从心肌中抽出(图 3F),并立即将斑马鱼转移到装有鱼类设施水的回收罐中。
- 监测鱼,直到它从三卡因中完全恢复。
- 将回收的鱼转移到 2.8 L 水箱中,并将其放入鱼类设施中,直到所需的心脏提取时间点。
4. 心脏提取和成像
- 在结晶皿中将 4.2 mL 储备溶液 (4 mg/mL) 稀释到 100 mL 鱼类设施水中,制备三卡因的工作浓度。
- 在三卡因溶液中对斑马鱼进行最终麻醉,直到鳃的运动停止并且没有反应。
- 将斑马鱼转移到解剖显微镜下的湿润凹槽海绵中,解剖显微镜位于面向物镜的腹侧。
- 在胸鳍水平用虹膜切除术剪刀打开胸腹壁。
- 打开心包囊,找到心脏的流出轨迹。使用镊子抓住球状动脉 (BA) 前主动脉,然后小心地用心室底部将它们拉起。
- 在心脏前杆抬起的情况下,切开腹侧主动脉/静脉窦以释放心脏并放入含有 PBS 的 35 毫米培养皿中。
- 使用镊子去除任何血凝块并将心脏固定在 4% PFA (wt/vol) 中 15 分钟。
- 使用能够获取所用荧光波长的显微镜对心脏进行成像。
注:在示例日期中,使用了具有 405、488、567 和 647 激光线的共聚焦显微镜。 - 使用 ImageJ/Fiji 软件(参见 材料表)进行图像分析。
注:使用高阈值或低 阈值 进行 QD 或 MS 富集的计算,并使用淋巴管 通道创建选择 函数,以首先选择淋巴管的区域和缺乏血管信号的区域。然后,使用 Measure 函数测量 QD 或 MS 通道的像素强度,从中计算两个选择的比率。
结果
注射后,必须立即看到心肌壁的一个小白色区域(图 3F)。该区域将显示进样的 MS 和 QD 的明亮荧光标记(图 4B、E)。此外,手术后心包腔中的任何 QD 和 MS 在心脏外表面可能存在微弱和零星的荧光点(图 4B、E)。可以随着时间的推移跟踪注入的示踪剂。为此,需要对鱼实施安乐死,收集心脏并置于共聚焦显微镜下,如前所述16。
注射后 1 天仍在注射部位观察到 MS,一些被困在心房和球动脉 (BA) 的外表面(图 4B)。MS 在心肌中稳定超过 3 周(图 4C、D),表明它们可用于引入外源性化合物或细胞(补充图 1)。
与 MS(直径 200 nm)相比,较小的 QD(直径 <10 nm)更瞬时地位于注射部位。注射后 1 小时 (hpi) 后,在注射部位发现 MS 和 QD(图 4E)。在 12-24 小时的时间范围内,较小的 QD 比 MS 更分散于注射部位,并且更集中在淋巴内皮内,包括 BA 上的淋巴管系统(图 4F,G;图 4 I-K)。较大的 MS 保留在注射部位,表明较小的 QD 与间质液一起分散,然后与这些液体一起进入淋巴管。观察到 QD 通道中荧光信号浓度的增加与淋巴转基因荧光重叠(图 4G,H),可用于跟踪淋巴摄取(图 4K)。
在测试了间质液和大分子的淋巴清除率后,该测定法可用于研究淋巴功能发育不全或增强的延迟清除。为了证明这一点,将 QD 注射到缺乏功能性心脏淋巴管且未观察到 QD 摄取的幼年斑马鱼 (35 dpf) 中(图 4H)。
鉴于进样 MS 的稳定性(图 4C、D),我们决定研究使用该方法递送外源性化合物。为此,在注射到转基因斑马鱼中之前,将 MS 在 10 mM 4-羟基他莫昔芬 (4OHT) 溶液中浸泡过夜。注射 4OHT 的转基因斑马鱼在心室中显示出局部 CreERt2 活性(补充图 1),表明这种方法可以通过适当的 MS 制备或使用封装的 MS (如适用)来实现。

图 1:用于心肌内注射的装置设置。 (A) 拔针器。(B) 带有注射液的拉针。(C) 喷油器设置的特写视图。(D) 注射站的一般设置。1) 立体镜连接到持针器和机械手。2) 将湿海绵放在 90 毫米的培养皿上,以容纳麻醉的成年斑马鱼。3) 显微作器,用于在两次注射之间保持针头(注意,注射是徒手进行的)。4) 喷油器装置。5) 20 μL 移液器。6) 三卡因溶液。7) QD 和 MS 的解决方案。8) 直虹膜切除术剪刀。9) 一对镊子.10) 拉针。11) Microloader 飞秒针。12) 回收罐。13) 网。 请单击此处查看此图的较大版本。
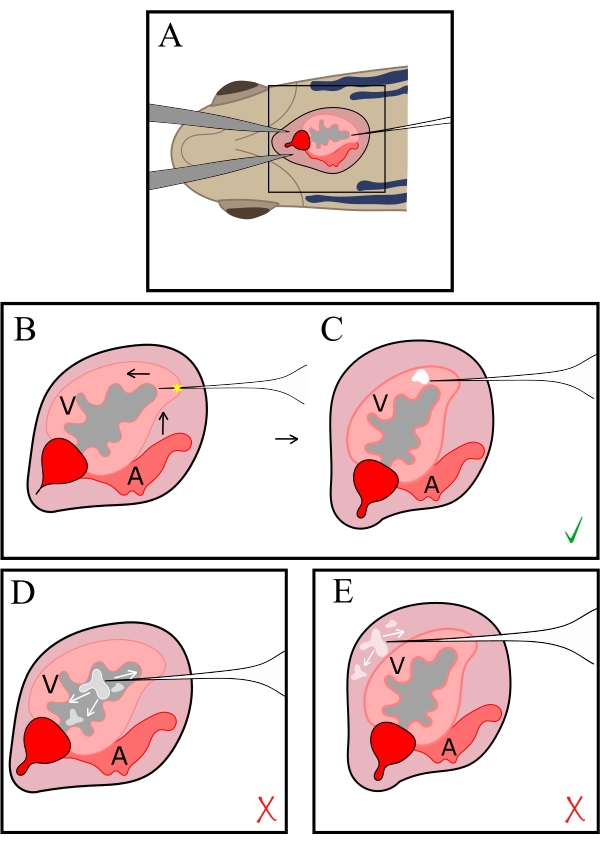
图 2:注射的示意图。 针头通过胸部的开口 (A) 引入胸腔,然后在心尖 (B) 插入心脏。针尖抬起并移向头部,在心肌腹侧注射;星号表示穿刺部位,而集中的白色质量表示注射部位 (C)。尖端不得足够远以定位在管腔内 (D) 或向前推得太远,以穿过心包腔 (E),从而导致注射液的分解和瞬时释放。V, 心室;A,中庭。 请单击此处查看此图的较大版本。
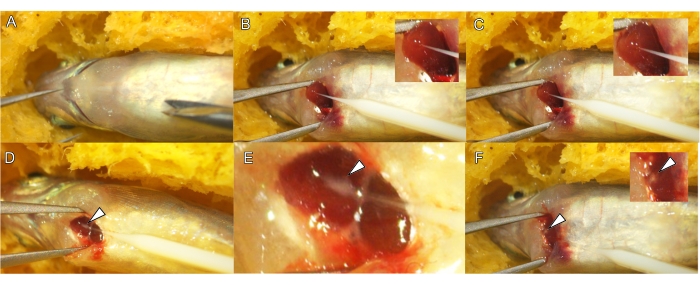
图 3:成年鱼的心肌内注射。 (A) 放置麻醉斑马鱼,腹侧朝上。(B) 将针头放入心室的心尖(箭头)。将针头插入心肌,尖端在心室内以 30° 或更低的角度向前移动 (C)。将 QD 和 MS 溶液注射到心肌层的间质间隙中,形成一个小的白色肿块(白色箭头、 D 和 E)。拔针后,注射混合物的白点在心肌中仍然可见(白色箭头, F)。 请单击此处查看此图的较大版本。
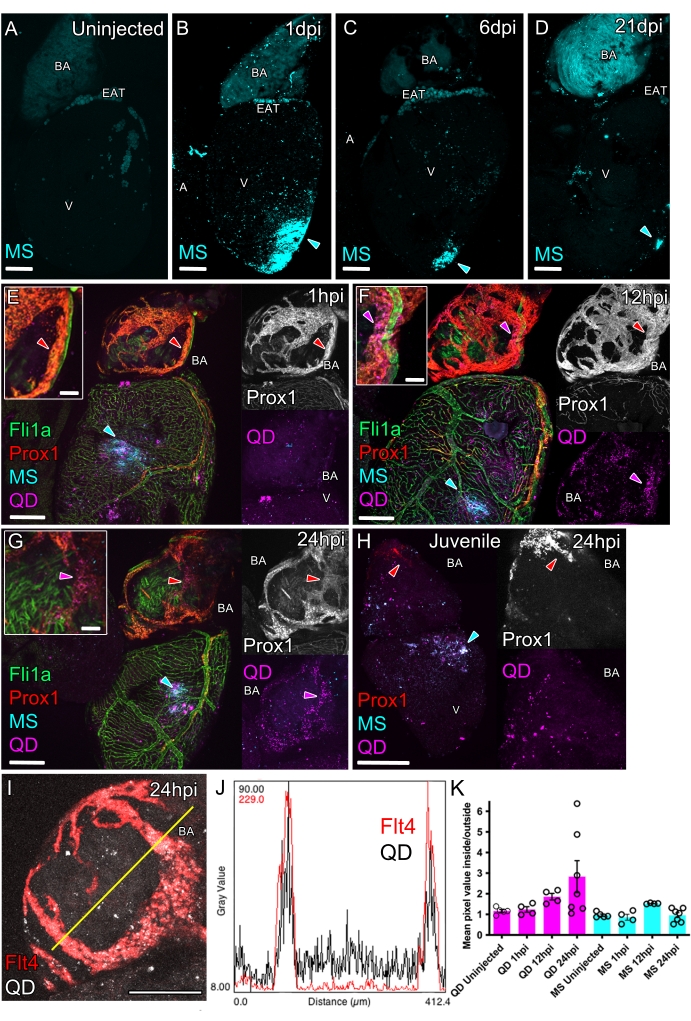
图 4:心肌内注射以研究心脏淋巴管系统的功能。心肌内注射的成年非转基因野生型 (A-D) 和转基因斑马鱼心脏的全装共聚焦成像,表达泛内皮标志物 fli1a:GFP(绿色,EG)和淋巴内皮标志物 prox1:Gal4-UAS:RFP(EH 中为红色)或 flt4:mCitrine(I 中为红色)。未注射的对照心脏 (A) 缺乏强荧光,但在球状动脉 (BA) 和心外膜脂肪组织 (EAT) 中有自发荧光。心肌内注射 200 nm MS(青色)导致注射部位(青色箭头)在 1 (B)、6 (C) 和 21 dpi (D) 处产生持续和局部荧光。MS (200 nm,青色) 和 QD (10 nm,品红色) 的联合心肌内注射导致两者沉积在注射部位 (E-H,青色箭头)。(E) 在注射后 1 小时 (hpi),MS 保留在注射部位,QD 在 BA 上的淋巴管中更分散但不是强烈富集(插图,红色箭头;成人,14 mpf/36 mm)。(F) 在 12 hpi 时,QD 随机分布在整个心室和流出道(成人,16 mpf/29 mm)。此外,QD 部分引流到 BA 上的淋巴管中,与 prox1:Gal4-UAS:RFP 阳性信号(红色和洋红色箭头)重叠。(G) 在 24 hpi 时,QD 高度集中在 BA 上的淋巴管内,与 prox1:Gal4-UAS:RFP 阳性信号重叠(红色和洋红色箭头;成人,19 mpf/34 mm)。(H) 在缺乏心脏功能淋巴管(红色箭头)的青少年中,QD 集中在注射部位(青色箭头),在 BA 和心室腔上发现一些弥漫性 QD,如成人(青少年,1 mpf/10 mm)。(I) 24 小时前将 flt4:mCitrine 标记的淋巴管(红色)和 QD(灰色)注射到心室内心肌内的 BA 共聚焦图像示例(成人,19 mpf/34 mm)。黄线表示显示直方图的像素强度平面 (J)。(K) BA 上 flt4:mCitrine/prox1:Gal4-UAS:RFP 阳性血管内 QD 通道强度的定量与同一 BA 上血管外的强度归一化。注射后,QD 强度在血管内越来越富集,而 MS 的强度仍未富集(平均值,使用 SEM,每个时间点 n = 4-7)。比例尺:200 μm (AI) 和 50 μm(插图,EG)。缩写:BA = 动脉球,EAT = 心外膜脂肪组织,V = 心室,A = 心房,MS = 微球,QD = 量子点,mpf = 受精后月数,mm = 标准斑马鱼长度,以毫米为单位。请单击此处查看此图的较大版本。
补充图 1:4OHT 浸泡的 MS 的心肌内注射。 (A) 当存在 4OHT 时,用于生成能够在 cmlc2 阳性心肌细胞中诱导表达 mCherry(以及 Gata4 的显性阴性形式、dnGata4)的转基因斑马鱼的 cmlc2:CreERT2 表达构建体的示意图17。(B) 诱导后 14 天斑马鱼心脏中 mCherry(红色)的表达(幼鱼;35 dpf;13.5 mm)。将 10 mM 的 4OHT 储备溶液在系统水中稀释至终浓度为 10 μM,将斑马鱼浸入其中 6 小时。(C,D) 心肌内注射 4OHT 浸泡的 MS 后 3 天,mCherry(C;红色)在斑马鱼心脏中的表达 (D;蓝色)。比例尺:50 μm (B) 和 100 μm (C,D)。请点击此处下载此文件。
补充视频 1: 演示 QD + MS 成功心肌内显微注射的代表性视频。 请单击此处下载此文件。
讨论
本文描述了一种将外源性物质引入斑马鱼心肌的方法。该技术旨在将 QD 和 MS 引入心肌,以研究稳态和再生中的淋巴功能 2,18。类似的方法也被用于将 QD 引入小鼠的心肌,以研究心肌梗死后淋巴管的存在和功能19,20。
针尖在心肌中的穿透和定位是该程序的关键步骤。玻璃毛细管需要足够锋利以穿透致密的心肌组织,并且足够坚硬,以便在定位注射部位时不会在抬起心脏的力下弯曲。通过改变镊子减小的尖端尺寸,可以实现这两个尖端特性之间的最佳平衡。急性注射角度最适合迫使尖端穿过心肌壁。由于心脏的跳动运动,在所选部位注射具有挑战性。因此,注射必须以受控的方式进行,首先将尖端放在跳动的心脏上,然后稍微移动它以调整注射部位。当尖端接触跳动的心脏时,必须进一步调整注射角度,以便在最终施加足够的力穿刺心肌时保持两者垂直。
一旦进入心脏组织,通过用针头抬起心脏的心尖,然后继续伸展尖端来纵尖端位置。否则将导致管腔注射到循环中。随着对鱼的前部施加进一步的压力,当针头重新进入或继续向心肌底部移动时,针头通常在组织中可见。此时,注射压力的短脉冲将指示准确的喷嘴位置以及它是否位于所需的注射位置。注射材料的最终量会影响它在组织内停留的时间。较大的量需要更长的时间才能清除,并且 QD 将在淋巴管中可见的时间更长。可见摄取开始所需的时间也是注射部位和心脏淋巴管之间相对距离的函数。靠近淋巴管的注射材料会比远处的材料更快地被吸收。由于成年斑马鱼的淋巴管覆盖率因年龄和大小而异,因此在使用该技术计划实验时应考虑测定的额外可变性2。
淋巴系统对荧光示踪剂的特异性摄取取决于示踪剂的大小21。小于 100 nm 的粒径很容易被淋巴管取走 22。QD 的大小为 <10 nm;因此,观察到大部分 QD 在心肌内注射后 24 小时内被淋巴系统吸收。目前尚不清楚注射荧光示踪剂会诱导什么免疫反应,以及这种情况在斑马鱼中持续多长时间。然而,先前对小鼠的研究表明,注射空/空白 MS 不会诱导显着的免疫反应23,24,并且成年斑马鱼该手术的典型存活率为 100%。
心肌内注射已在哺乳动物模型中用于临床和实验,以测试或改善心肌梗死后心肌梗死后通过心肌内注射干细胞和祖细胞或外源化合物(如水凝胶)8,9,10 来改善心脏功能。近年来,MS 在药物递送和再生领域引起了极大的关注25。我们已经证明,斑马鱼心肌注射 MS 是可能的,并且在注射后 3 周以上保持稳定。此外,我们的初步数据表明,这种方法可用于将外源化合物输送到斑马鱼心脏。应用该方案使用功能性 MS 将外源性化合物和细胞引入斑马鱼心脏将会很有趣,在许多研究领域具有广泛的应用。
披露声明
作者没有什么可披露的。
致谢
我们感谢 Adedeji Afolalu、Chaim Shapiro、Soji Hosten 和 Chelsea Quaies 的鱼类护理 (Weill Cornell Medicine),感谢 Caroline Pearson (Weill Cornell Medicine) 对手稿的批判性阅读。Jingli Cao (Weill Cornell Medicine) 除了批判性阅读手稿外,还使用解剖镜和相机来记录过程。Nathan Lawson(马萨诸塞大学医学院)、Brant Weinstein (NICHD)、Elke Ober(哥本哈根大学)和 Stephan Schulte-Merker(WWU 明斯特分校)的转基因斑马鱼品系。Daniel Castranova (NICHD) 提供有关 QD 和成像的建议,Yu Xia (Weill Cornell Medicine) 提供有关解剖镜视频捕获的指导。这项工作得到了 NM 的 NYSTEM 奖学金、美国心脏协会职业发展奖 (AHA941434)、美国国立卫生研究院 (NIH) 赠款 (R01NS126209) 和 MH 的威尔康奈尔医学启动基金的支持。
材料
| Name | Company | Catalog Number | Comments |
| Crystallization dish | VWR | 89000-288 | |
| Dissection Scope | Zeiss | 495010-0007-000 | |
| Fish facility water | N/A | N/A | RO water with sea salt and sodium bicarbonate added to a conductivity of 226uS and pH of 7.35 |
| Forceps | Dumont | 11252-20 | |
| Glass Capillaries | WPI | 1B120-3 | no filament |
| ImageJ | https://imagej.nih.gov/ij/download.html | ||
| Iridectomy scissors | Fine Scientific Tools | 15000-00 | |
| Microinjector | Warner Instruments | 64-1735 | |
| Microloader femtotips | Eppendorf | 5242 956.003 | |
| Micropipette puller | Sutter Instrument | P-97 | Gated pedal input |
| Microspheres | Thermo Fisher Scientific | B200 | Blue |
| PBS | Corning | 46-013-CM | |
| Quantum dots (QD) | Thermo Fisher Scientific | Q21061MP | Qtracker705 vascular label |
| Sponge | any | any | (1.5 × 5 × 3 cm) with groove (0.5 × 2.5 cm) |
| Syringe filter | Corning | 431220 | |
| Tricaine | Sigma-Aldrich | A5040 | concentration: 4 mg/mL |
参考文献
- Munn, L. L., Padera, T. P. Imaging the lymphatic system. Microvascular Research. 0, 55(2014).
- Harrison, M. R., et al. Late developing cardiac lymphatic vasculature supports adult zebrafish heart function and regeneration. eLife. 8, 42762(2019).
- Gancz, D., et al. Distinct origins and molecular mechanisms contribute to lymphatic formation during cardiac growth and regeneration. eLife. 8, 44153(2019).
- Vivien, C. J., et al. Vegfc/d-dependent regulation of the lymphatic vasculature during cardiac regeneration is influenced by injury context. NPJ Regenerative Medicine. 4, 18(2019).
- Cueni, L. N., Detmar, M. The lymphatic system in health and disease. Lymphatic Research and Biology. 6 (3-4), 109(2008).
- Schwartz, N., et al. Lymphatic function in autoimmune diseases. Frontiers in Immunology. 10, 519(2019).
- Feng, X., Travisano, S., Pearson, C. A., Lien, C. L., Harrison, M. R. M. The lymphatic system in zebrafish heart development, regeneration and disease modeling. Journal of Cardiovascular Development and Disease. 8 (2), 1-14 (2021).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479(2012).
- Williams, A. R., et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: Functional recovery and reverse remodeling. Circulation Research. 108 (7), 792-796 (2011).
- Rodell, C. B., et al. Injectable shear-thinning hydrogels for minimally invasive delivery to infarcted myocardium to limit left ventricular remodeling. Circulation: Cardiovascular Interventions. 9 (10), 004058(2016).
- Bise, T., Jaźwińska, A. Intrathoracic injection for the study of adult zebrafish heart. Journal of Visualized Experiments. (147), e59724(2019).
- Konantz, J., Antos, C. L. Reverse genetic morpholino approach using cardiac ventricular injection to transfect multiple difficult-to-target tissues in the zebrafish larva. Journal of Visualized Experiments. (88), e51595(2014).
- Wagner, A. M., Knipe, J. M., Orive, G., Peppas, N. A. Quantum dots in biomedical applications. Acta Biomaterialia. 94, 44(2019).
- Rizvi, S. B., Ghaderi, S., Keshtgar, M., Seifalian, A. M. Semiconductor quantum dots as fluorescent probes for in vitro and in vivo bio-molecular and cellular imaging. Nano Reviews. 1 (1), 5161(2010).
- Van Nguyen, T., et al. Size determination of polystyrene sub-microspheres using transmission spectroscopy. Applied Sciences. 10 (15), 5232(2020).
- Harrison, M. R. M., et al. Chemokine-guided angiogenesis directs coronary vasculature formation in zebrafish. Developmental Cell. 33 (4), 442-454 (2015).
- Gupta, V., et al. An injury-responsive gata4 program shapes the zebrafish cardiac ventricle. Current Biology. 23 (13), 1221-1227 (2013).
- El-Sammak, H., et al. A Vegfc-Emilin2a-Cxcl8a signaling axis required for zebrafish cardiac regeneration. Circulation Research. 130 (7), 1014-1029 (2022).
- Harris, N. R., et al. VE-Cadherin is required for cardiac lymphatic maintenance and signaling. Circulation Research. 130 (1), 5-23 (2022).
- Henri, O., et al. Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction. Circulation. 133 (15), 1484-1497 (2016).
- Rao, D. A., Forrest, M. L., Alani, A. W. G., Kwon, G. S., Robinson, J. R. Biodegradable PLGA based nanoparticles for sustained regional lymphatic drug delivery. Journal of Pharmaceutical Sciences. 99 (4), 2018-2031 (2010).
- Casley-Smith, J. R. The fine structure and functioning of tissue channels and lymphatics. Lymphology. 13 (4), http://journals.librarypublishing.arizona.edu/lymph/article/id/4218 (1980).
- Liu, Y., et al. Experimental vaccine induces Th1-driven immune responses and resistance to Neisseria gonorrhoeae infection in a murine model. Mucosal Immunology. 10, 1594-1608 (2017).
- Wang, D., et al. Poly(D,L-Lactic-co-Glycolic Acid) microsphere delivery of adenovirus for vaccination. Journal of Pharmaceutical Sciences. 10 (2), 217-230 (2007).
- Li, Q., Chang, B., Dong, H., Liu, X. Functional microspheres for tissue regeneration. Bioactive Materials. , (2022).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。