Method Article
הזרקה ללב לחקר תפקוד הלימפה הלבבי בדג הזברה
In This Article
Summary
הפרוטוקול הנוכחי מאפשר אספקה יעילה ויציבה של מיקרוספירות פלואורסצנטיות (MS) ונקודות קוונטיות (QD) לשריר הלב של דגים חיים שניתן לעקוב אחריהם לאורך זמן.
Abstract
דג הזברה הוכיח את עצמו כמודל חשוב לחקר היווצרות ותפקוד לב וכלי דם במהלך התפתחות והתחדשות פוסט-עוברית. הפרוטוקול הנוכחי מתאר שיטה להזרקת עוקבים פלואורסצנטיים לשריר הלב של דג הזברה כדי לחקור את ספיגת הנוזל הבין-רקמתי והפסולת לכלי הלימפה הלבביים. לשם כך, מיקרוספירות (קוטר 200 ננומטר) ונקודות קוונטיות (קוטר <10 ננומטר) מוחדרות לשריר הלב של דג זברה חי, שניתן לעקוב אחריהן באמצעות מיקרוסקופיה קונפוקלית ex vivo . לאחר מכן עוקבים אחר עוקבים אלה לסירוגין במשך מספר שעות כדי לעקוב אחר פינוי משריר הלב לכלי הלימפה הלבביים. נקודות קוונטיות מועברות דרך כלי לימפה לבביים הרחק מהלב, בעוד שמיקרוספירות גדולות יותר נשארות באתר ההזרקה במשך למעלה משלושה שבועות. ניתן להרחיב שיטה זו של הזרקה לתוך קרדיוקרדיאל לשימושים אחרים, כולל הזרקת טרשת נפוצה או הידרוג'לים במעטפת לשחרור מקומי של תאים, חלבונים או תרכובות מעניינות לאזור ממוקד של הלב.
Introduction
מערכת הלימפה חיונית לשמירה על איזון רקמות-נוזלים, לווסת את התגובה החיסונית לאחר פציעה ולספיגת שומנים במעיים1. עדויות מצטברות תומכות בתפקידים הרחבים של מערכת הלימפה בהקשרים שונים של מחלות והתפתחות. עם זאת, מחקרים מכניסטיים נפגעים מכיוון שכלי לימפה יכולים להיות קשים להדמיה, והפונקציונליות שלהם יכולה להיות לא ודאית. טכניקות הדמיה מוקדמות הסתמכו על היכולת הטבעית של מערכת הלימפה לספוג באופן אינטרסטילי עוקבים מוזרקים, ולאחר מכן להעביר אותם דרך רשת כלי הלימפה, מה שמאפשר זיהוי והדמיה1. לא רק שניתן להשתמש בשיטה זו כדי לדמיין את הלימפה, אלא ניתן להשתמש בה גם כדי לכמת את יכולתם לספוג נוזלים ומקרומולקולות מהרקמה.
רשת הלימפה העצומה מקיפה גם את מערכת הלימפה הלבבית, שהוכחה כממלאת תפקיד אינטגרלי בהתחדשות דג הזברה 2,3,4. הבנת ההבדלים והדמיון בתפקוד הלימפה בין מינים שונים היא חיונית לניצול ידע זה מבחינה קלינית. לכן, יש צורך לחקור את הטכנולוגיות שיכולות למדוד ולדמיין את תפקוד הלימפה על פני אורגניזמים מודלים שונים 5,6. לימפה היא כלי דם קהים המעבירים נוזלים בכיוון אחד, הרחק מהרקמה7. נדרשת הזרקה תוך-קרדיוקרדיאלית של צבעים פלואורסצנטיים כדי לצפות בניקוז הלימפה מרקמת הלב. זריקות אינטרמיוקרדיאליות שימשו גם קלינית ובמודלים פרה-קליניים של יונקים להשתלת תאי גזע ואב או תרכובות אקסוגניות כגון הידרוג'ל כדי לבדוק שיפור בתפקוד הלב לאחר אוטם שריר הלב 8,9,10. הזרקה פנימית של דג הזברה לא תוארה בפירוט, מה שהגביל את השימוש בגישות ניסיוניות כאלה ללב דג הזברה.
הזרקות לחלל קרום הלב של דג הזברה וזרימת הדם המערכתית בתוך לומן הלב תוארו בפירוט בעבר11,12, ודווח על הזרקה תוך-קרדיוקרדיאלית מוצלחת של עוקבים פלואורסצנטיים בדג זברה בוגר2. המאמר הנוכחי מספק פרוטוקול מפורט לביצוע הזרקות תוך-קרדיוקרדיאליות בדגי זברה בוגרים. מספר קווי דג זברה טרנסגניים יכולים לזהות כלי לימפה; עם זאת, יש צורך לחקור גישות להבנת ניקוז הלימפה או לדמיין לימפה בהיעדר סמנים טרנסגניים. עוקבים פלואורסצנטיים, מיקרוספירות (MS) ונקודות קוונטיות (QD) משמשים כאן כדי לדמיין את אתר ההזרקה וזרימת הנוזל לתוך הלימפה הלבבית. QD הם ננו-גבישים פלואורסצנטיים בקוטר <10 ננומטר שניתן לכוונן ולהתאים את התכונות האופטיות שלהם כדי לשרת יישומים ביו-רפואיים רבים13,14. QD נקלט בקלות על ידי כלי לימפה אך לא על ידי כלי דם כאשר הוא מוזרק באופן אינטרסטיציאלי15,16. MS הם חרוזי פוליסטירן מצופים פלואורסצנטי בקוטר של כ-200 ננומטר15. ככזה, טרשת נפוצה גדולה משמעותית מ-QD ומתמשכת משמעותית כאשר היא מוזרקת לשריר הלב, מה שמאפשר זיהוי עקבי של אתר ההזרקה. שיטה זו שימושית לחקר תפקוד הלימפה במהלך התחדשות הלב, אך ניתן להתאים אותה לחקר היבטים שונים של ביולוגיה של הלב באמצעות החדרה מקומית יציבה של חרוזים מצופים, הידרוג'לים או תכשירי תאים.
Protocol
כל ההליכים בבעלי חיים אושרו על ידי הוועדה המוסדית לטיפול ושימוש בבעלי חיים ב-Weill Cornell Medicine (פרוטוקול 2020-0027) ופעלו לפי הנחיות מתאימות. הניסויים הבאים בוצעו עם זכר ונקבה של דג זברה מסוג בר AB בגילאי 14 עד 20 חודשים לאחר ההפריה למבוגרים, ו-35 יום לאחר ההפריה לצעירים.
1. משיכת מחט והכנת ריאגנטים
- משוך נימי זכוכית בורוסיליקט סטנדרטיים בגודל 1.2 מ"מ OD (קוטר חיצוני) באמצעות מושך מחט (איור 1A,B) (ראה טבלת חומרים), לשתי מחטים באמצעות הגדרות אופטימליות. במקרה זה, חום 525; למשוך 65; מהירות 60; זמן 250.
- וורטקס השיגה באופן מסחרי תמיסות קולואידיות מלאי של MS (1% מוצקים במים) ו-QD (2 מיקרומטר, ראה טבלת חומרים).
הערה: התמיסה הקולואידית של MS היא בצבע לבן ונראית בקלות בעת הזרקה. - סנן 500 מיקרוליטר של תמיסה קולואידית במלאי MS דרך מסנן מזרק של 0.45 מיקרומטר (ראה טבלת חומרים) כדי למזער את סתימת המחט.
- כדי להכין את התמיסה הקולואידית העובדת של MS בלבד, יש לדלל 100 מיקרוליטר מהתמיסה הקולואידית המסוננת של MS ב-100 מיקרוליטר של 1x PBS (מי מלח חוצצים פוספט).
- כדי להכין את התמיסה הקולואידית העובדת של MS ו-QD, מערבבים 100 מיקרוליטר של התמיסה הקולואידית המסוננת של MS עם 100 מיקרוליטר של התמיסה הקולואידית QD.
הערה: בהתאם לניסוי, ניתן לערבב או להזריק MS ו-QD בנפרד. - הכן וסדר את הריאגנטים והציוד הדרושים: סטריאוסקופ, ספוג רטוב, מיקרומניפולטור, מזרק, פיפטה 20 מיקרוליטר, תמיסת טריקאין, מספריים לכריתת אירידקטומיה ישרה, מלקחיים, מחטים משוכות, קצות פמטו-מעמיס מיקרו, מיכלי התאוששות ורשתות כפי שמוצג באיור 1D (ראה טבלת חומרים).
- הפעל את אספקת האוויר של המזרק והגדר את דופק ההזרקה המגודר במקום את דופק ההזרקה המתוזמן.
הערה: לפרטים האינסטרומנטליים, אנא ראה טבלת חומרים. מכשירים מסוימים דורשים הכנסת דוושת ההזרקה ליציאת הקלט המגודרת בצד האחורי של המכשיר.
2. הכנת תחנת הזרקה והכנת דג הזברה
- הפעל את מיקרוסקופ החיתוך והתאם את המיקוד.
- עם קצות פיפטה של מיקרו-מעמיס, טען את תמיסת הבקרה (למשל, 0.05% פנול אדום ב-1x PBS).
- הכנס את המחט למחזיק המחט של המיקרו-מזרק.
- מתחת למיקרוסקופ הניתוח, חותכים את המחט הנמשכת במרחק של 1 מ"מ מהקצה בעזרת מלקחיים.
הערה: חיתוך המחט צר ככל האפשר הוא אופטימלי לניקוב שריר הלב. עם זאת, אם המחט צרה מדי, היא עלולה להתכופף כאשר מנסים לחדור לרקמת הלב. - הגדר את לחץ ההזרקה המתאים לסביבות 0.50 kPa/7.3 psi, ואת לחץ האיזון לסביבות 0 psi כך שלא תהיה נסיגת נוזל לתוך המחט (איור 1C).
- לאחר הגעה ללחץ הרצוי, בדוק את מערך ההזרקה ורשום את הזמן שלוקח להזריק בולוס של תמיסה לשמן מינרלי שקוטרו פחות מ-1 מ"מ (<0.5 מיקרוליטר).
הערה: באופן אידיאלי, ההזרקה חייבת לשחרר את הנוזל במהירות של כ-50 nL/s כדי לתת קוטר בולוס משוער של 0.8 מ"מ ב-5 שניות. בהתאם לקוטר קצה המחט, ניתן לבצע התאמות בזמן ובלחץ כדי להזריק 0.25-0.3 מיקרוליטר לדג בודד במהלך הזרקה של 5 שניות. לחץ הזרקה גבוה יותר, בניגוד לזמן הזרקה ארוך יותר, רצוי כדי להבטיח שניתן יהיה להתגבר על לחץ הרקמה הבין-רקמתי הגבוה במהלך ההזרקה. - טען את המחט בנפח שנבחר (למשל, 10-15 מיקרוליטר, איור 1B) של תמיסת ההזרקה וחזור על שלבים 2.5-2.6.
הערה: זריקות מגודרות יאפשרו להזריק כל עוד לוחצים על דוושת כף הרגל, מה שמאפשר לבצע התאמות של מיקום הקצה עד למציאת אתר ההזרקה התוך-רקמתי הנכון. - הכנס את המחט העמוסה בתמיסת הזרקה לתוך מחזיק המחט של המיקרו-מזרק.
3. הזרקה
- הכן ספוג מחורץ על ידי גילוף מתאר דמוי דג באמצע.
- הכן את ריכוז העבודה של טריקאין על ידי דילול 4.2 מ"ל של תמיסת מלאי (4 מ"ג/מ"ל) ל-100 מ"ל מי מתקן דגים (ראה טבלת חומרים) בצלחת מתגבשת.
- הרדמו את דג הזברה בתמיסת טריקאין עד שתנועת הזימים מופחתת והוא הפסיק לשחות.
הערה: צבט את הזנב כדי לאשר את אובדן התגובה בדג זברה מורדם. - מקם את דג הזברה כשהצד הגחוני שלו פונה לעדשת האובייקט בספוג המחורץ-לח מתחת למיקרוסקופ החיתוך (איור 2A ואיור 3A).
- השתמש במספריים לכריתת אירידקטומיה כדי לבצע חתך רוחבי קטן בגובה סנפירי החזה ולפתוח את חלל החזה (סרטון משלים 1).
- בעזרת מלקחיים, קלפו בעדינות את קרום הלב כדי לחשוף את קודקוד הלב (איור 3B).
- עם מחזיק המחט הטעון ביד, כוון את המחט לכיוון קודקוד החדר בזווית חדה של <30° לציר הגוף.
- הכניסו מחט של 0.1-0.2 מ"מ ללב מבלי לחדור עמוק מדי לתוך החדר (איור 2B ואיור 3B).
הערה: אם קצה קצה המחט מתמלא בדם, משוך מעט את המחט כדי למנוע הזרקת MS ו-QD ללומן החדר. - כאשר המחט מוכנסת לקודקוד הלב, הרימו מעט את החדר הרחק מהגוף על ידי הקטנת הזווית בין המחט לציר הגוף תוך הזזת קצה המחט לכיוון בסיס הלב (איור 2C ואיור 3C).
הערה: המחט עשויה להיראות במעומעם דרך דופן שריר הלב. - דחוף את המחט עוד יותר לכיוון הראש כך שקצה המחט ינוע לכיוון פני השטח של שריר הלב.
- הזרקו על ידי לחיצה על הדוושה של מכשיר המיקרו-הזרקה למשך ~1-5 שניות או עד שנראה כתם לבן בתוך רקמת הלב (איורים 2C ואיור 3C,D).
- אם חלל החזה מתחיל להתמלא בנוזל הזרקה בזמן ההזרקה, זה מצביע על כך שקצה המחט חדר לחלוטין לשריר הלב (איור 2D). משוך את המחט לאט עד שהצטברות של מיקרו-חרוזים נראית בתוך הרקמה.
- מקם מחדש את קצה המחט אם הנוזל מוזרק ללומן החדר ומתנקה עם פעימות הלב הבאות (איור 2E). במצב כזה, הרם את קצה המחט ודחף את המחט לכיוון הראש עד שלחץ ההזרקה יביא לנקודה לבנה ברקמה.
- אם לא נראה נוזל לבן או כתם לבן, מחט ההזרקה חסומה. במצב כזה, משוך את המחט במלואה. כדי להמשיך בניסוי, שברו מעט את קצה המחט או החליפו את המחט. בשני המקרים, בדוק את זרימת ההזרקה לפני הזרקה חוזרת של שריר הלב.
- אחרי הזרקה מוצלחת, משכו בעדינות את המחט משריר הלב (איור 3F) והעבירו מיד את דג הזברה לתוך מיכל התאוששות עם מי מתקן הדגים.
- עקוב אחר הדג עד שהוא מתאושש לחלוטין מהטריקאין.
- מעבירים את הדגים המוחזרים למיכל של 2.8 ליטר ומניחים אותו במתקן הדגים, עד לנקודת הזמן הרצויה למיצוי הלב.
4. מיצוי לב והדמיה
- הכן את ריכוז העבודה של טריקאין על ידי דילול 4.2 מ"ל של תמיסת ציר (4 מ"ג/מ"ל) ל-100 מ"ל מי מתקן דגים בצלחת מתגבשת.
- הרדמה סופנית של דג הזברה בתמיסת טריקאין עד שתנועת הזימים נעצרה והוא אינו מגיב.
- העבירו את דג הזברה לספוג מחורץ לח מתחת למיקרוסקופ הניתוח הממוקם בצד הגחון הפונה לעדשת האובייקט.
- פתח את דופן הגחון של החזה בעזרת מספריים לכריתת אירידקטומיה בגובה סנפירי החזה.
- פתח את שק קרום הלב ואתר את מסלול הזרימה של הלב. השתמש במלקחיים כדי לתפוס את אבי העורקים הקדמי לעורקי הבולבוס (BA) ומשוך אותם בזהירות כלפי מעלה עם בסיס החדר.
- כאשר הקוטב הקדמי של הלב מורם, חותכים את אבי העורקים הגחוני/סינוס וריד כדי לשחרר את הלב ומניחים בצלחת פטרי 35 מ"מ המכילה PBS.
- בעזרת מלקחיים, הסר את כל קרישי הדם וקבע את הלב ב-4% PFA (משקל/נפח) למשך 15 דקות.
- דמיין את הלבבות באמצעות מיקרוסקופ המסוגל לרכוש את אורכי הגל הפלואורסצנטיים שבהם נעשה שימוש.
הערה: בתאריך לדוגמה, נעשה שימוש במיקרוסקופ קונפוקלי עם קווי לייזר 405, 488, 567 ו-647. - השתמש בתוכנת ImageJ/Fiji (ראה טבלת חומרים) לניתוח תמונה.
הערה: חישוב העשרת QD או MS בוצע באמצעות הסף הגבוה או הנמוך ויצירת פונקציות בחירה עם תעלת כלי הלימפה כדי לבחור תחילה אזורים של כלי לימפה ואלה חסרי אות כלי דם. לאחר מכן, נעשה שימוש בפונקציית המדידה למדידת עוצמת הפיקסלים של ערוץ QD או MS שממנו חושב יחס בין שתי הבחירות.
תוצאות
מיד לאחר ההזרקה, אזור לבן קטן בדופן שריר הלב חייב להיות גלוי (איור 3F). אזור זה יציג תיוג פלואורסצנטי בהיר של MS ו-QD המוזרקים (איור 4B,E). בנוסף, תיתכן פונקטה פלואורסצנטית חלשה וספורדית על פני השטח החיצוניים של הלב מכל QD וטרשת נפוצה בחלל קרום הלב לאחר ההליך (איור 4B,E). ניתן לעקוב אחר העוקבים המוזרקים לאורך זמן. כדי לעשות זאת, יש להמית את הדגים ולאסוף לבבות ולהניח אותם תחת מיקרוסקופ קונפוקלי כפי שתואר קודם לכן16.
טרשת נפוצה עדיין נצפית באתר ההזרקה יום אחד לאחר ההזרקה, כאשר חלקן לכודות על פני השטח החיצוניים של הפרוזדורים והעורקים הבולבוסיים (BA) (איור 4B). טרשת נפוצה יציבה בשריר הלב במשך יותר מ-3 שבועות (איור 4C,D), מה שמרמז על כך שניתן להשתמש בהם כדי להכניס תרכובות או תאים אקסוגניים (איור משלים 1).
בניגוד ל-MS (קוטר 200 ננומטר), QD קטן יותר (קוטר <10 ננומטר) ממוקם באופן ארעי יותר באתר ההזרקה. לאחר שעה אחת לאחר ההזרקה (hpi) נמצאו גם טרשת נפוצה וגם QD באתר ההזרקה (איור 4E). במהלך מסגרת הזמן של 12-24 שעות, ה-QD הקטן יותר היה מפוזר יותר מאשר טרשת נפוצה מאתר ההזרקה, כמו גם מרוכז יותר בתוך האנדותל הלימפטי, כולל כלי הדם הלימפטי ב-BA (איור 4F,G; איור 4 I-K). הטרשת הנפוצה הגדולה יותר נשארה במקום ההזרקה, מה שמרמז על כך שה-QD הקטן יותר מתפזר עם הנוזל הבין-תאי ואז נקלט עם הנוזל הזה לתוך כלי הלימפה. הריכוז המוגבר של אות הקרינה בערוץ QD נצפה חופף לפלואורסצנציה טרנסגנית לימפטית (איור 4G,H), שניתן להשתמש בה כדי לעקוב אחר קליטה לימפטית (איור 4K).
לאחר בדיקת הפינוי הלימפטי של הנוזל הבין-רקמתי והמקרומולקולות, ניתן ליישם בדיקה זו כדי לחקור פינוי מושהה עם תפקוד לימפה לא מפותח או משופר. כדי להדגים זאת, QD הוזרק לדגי זברה צעירים (35 dpf) שחסרים כלי לימפה לבביים פונקציונליים ולא נצפו ספיגה של QD (איור 4H).
בהתחשב ביציבות של הטרשת הנפוצה המוזרקת (איור 4C,D) החלטנו לחקור את השימוש בשיטה זו להעברת תרכובות אקסוגניות. לשם כך, טרשת נפוצה הושרה למשך הלילה בתמיסה של 10 מ"מ של 4-הידרוקסיטאמוקסיפן (4OHT) לפני ההזרקה לדג זברה מהונדס. דג זברה טרנסגני שהוזרק עם 4OHT הראה פעילות CreERt2 מקומית בחדר (איור משלים 1), מה שמצביע על גישה כזו אפשרית עם הכנה מתאימה של טרשת נפוצה או שימוש בטרשת נפוצה עטופה לפי העניין.

איור 1: הגדרת מכשיר להזרקה תוך-קרדיוקרדיאלית. (A) מושך מחט. (B) מחט משוכה עם נוזל הזרקה. (ג) מבט מקרוב על הגדרות המזרק. (ד) הקמה כללית של תחנת הזרקה. 1) סטריאוסקופ המחובר למחזיק מחט ומניפולטור. 2) ספוג רטוב מונח על צלחת 90 מ"מ כדי להחזיק דג זברה בוגר מורדם. 3) מיקרומניפולטור להחזקת מחט בין הזרקות (שימו לב, ההזרקות מבוצעות ביד חופשית). 4) מכשיר מזרק. 5) פיפטה 20 uL. 6) תמיסת טריקאין. 7) פתרון של QD ו- MS. 8) מספריים ישרים לכריתת אירית. 9) זוג מלקחיים.10) מחטים משוכות. 11) טיפים של מיקרו-מעמיסים. 12) מיכלי חילוץ. 13) נטס. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
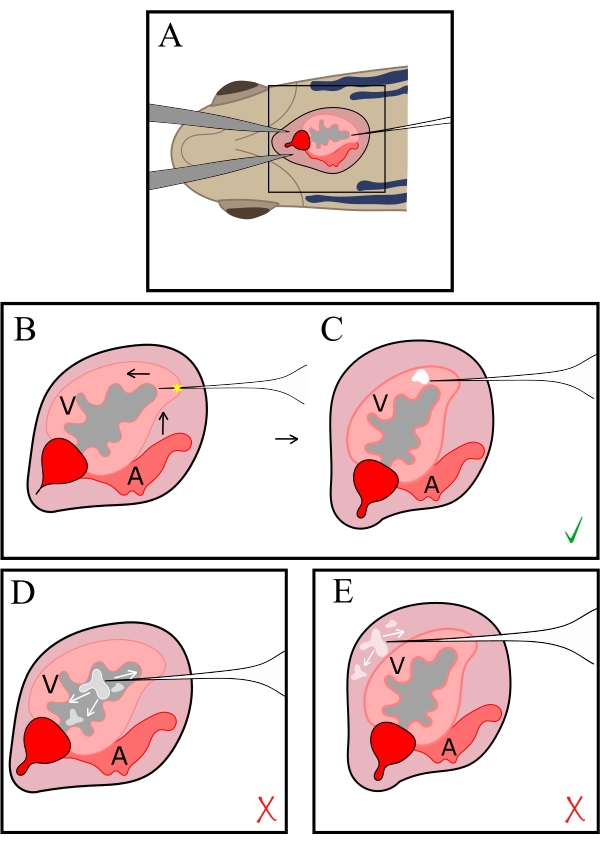
איור 2: ייצוג סכמטי של הזרקה. המחט מוחדרת לבית החזה דרך פתח בחזה (A), ואז מוחדרת ללב בקודקוד (B). קצה המחט מורם ומועבר לכיוון הראש כדי להזריק בתוך הצד הגחוני של שריר הלב; הכוכבית מציינת את אתר הניקוב, ואילו המסה הלבנה המרוכזת מציינת את אתר ההזרקה (C). אסור שהקצה יהיה רחוק מספיק כדי להיות ממוקם בתוך הלומן (D) או לדחוף אותו רחוק מדי קדימה לאחור לתוך חלל קרום הלב (E), וכתוצאה מכך לנטרל ושחרור חולף של נוזל ההזרקה. V, חדר; א, אטריום. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
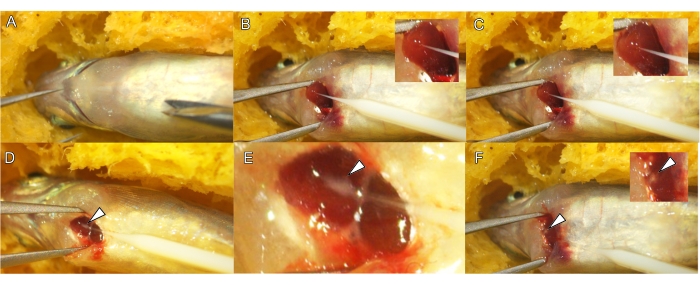
איור 3: הזרקה תוך-קרדיוקרדיאלית של דגים בוגרים. (A) מיקום של דג זברה מורדם כשהצד הגחוני פונה כלפי מעלה. (B) מיקום המחט לתוך הקודקוד (ראש החץ) של החדר. החדרת המחט לשריר הלב עם תנועה קדמית של הקצה בתוך חדר הלב בזווית של 30 מעלות ומטה (C). הזרקת תמיסת QD ו-MS לחלל הביניים בשכבת שריר הלב ליצירת מסה לבנה קטנה (ראש חץ לבן, D ו-E). נקודה לבנה של תערובת ההזרקה נשארת גלויה בשריר הלב לאחר הסרת המחט (ראש חץ לבן, F). אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
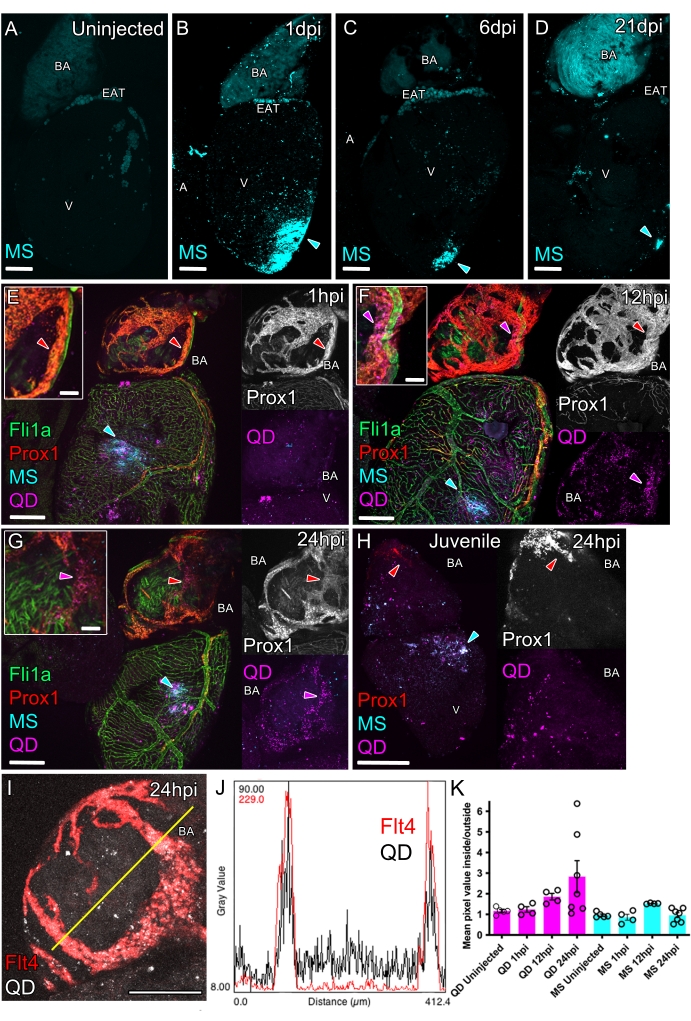
איור 4: הזרקה תוך-קרדיוקרדיאלית לחקר תפקוד כלי הדם הלימפתיים הלבביים. הדמיה קונפוקלית שלמה של לבבות בוגרים לא טרנסגניים (A-D) ודגי זברה טרנסגניים המוזרקים בטרמיוקרדיאלי המבטאים את הסמן הפאן-אנדותליאלי fli1a:GFP (ירוק, E-G) וסמן אנדותל לימפטי prox1:Gal4-UAS:RFP (אדום ב-E-H) או flt4:mCitrine (אדום ב-I). לבבות הבקרה הלא מוזרקים (A) חסרים פלואורסצנטיות אינטנסיבית אך יש להם אוטופלואורסצנטיות בעורקי הבולבוסי (BA) וברקמת השומן האפיקרדיאלית (EAT). הזרקה תוך-קרדיוקרדיאלית של 200 ננומטר MS (ציאן) מביאה לפלואורסצנטיות מתמשכת ומקומית באתר ההזרקה (ראשי חץ ציאן) ב-1 (B), 6 (C) ו-21 dpi (D). הזרקה משולבת של טרשת נפוצה (200 ננומטר, ציאן) ו-QD (10 ננומטר, מג'נטה) גורמת לשניהם להיות מופקדים באתר ההזרקה (E-H, ראשי חץ ציאן). (E) שעה אחת לאחר ההזרקה (hpi), טרשת נפוצה נשארת במקום ההזרקה, QD מפוזר יותר אך לא מועשר חזק בכלי הלימפה ב-BA (מוכנסת, ראש חץ אדום; בוגר, 14 mpf/36 מ"מ). (F) ב-12 hpi, QD מפוזר באופן אקראי בכל חדר החדר ודרכי היציאה (בוגר, 16 mpf/29 מ"מ). כמו כן, QD מתנקזים חלקית לכלי לימפה ב-BA החופפים לאות החיובי prox1:Gal4-UAS:RFP (ראשי חץ אדומים ומג'נטה). (G) ב-24 hpi, QD מרוכז מאוד בתוך כלי הלימפה ב-BA חופף לאות החיובי prox1:Gal4-UAS:RFP (ראשי חץ אדומים ומג'נטה; בוגר, 19 mpf/34 מ"מ). (H) ב-24 hpi בצעירים חסרי כלי לימפה תפקודיים לבביים (ראש חץ אדום), QD מרוכז באתר ההזרקה (ראש חץ ציאן), עם QD מפוזר שנמצא מעל ה-BA וחדר החדר כפי שנצפה במבוגרים (Juvenile, 1 mpf/10 מ"מ). (I) דוגמה לתמונה קונפוקלית של BA עם כלי לימפה מסומנים flt4:mCitrine (אדום) ו-QD (אפור) שהוזרקו לחדר 24 שעות קודם לכן (מבוגר, 19 mpf/34 מ"מ). הקו הצהוב מציין את מישור עוצמת הפיקסלים שעבורו מוצגת ההיסטוגרמה (J). (K) כימות עוצמת ערוץ QD בתוך flt4:mCitrine/prox1:Gal4-UAS: כלי דם חיוביים ל-RFP ב-BA מנורמל לזה שמחוץ לכלי באותו BA. עוצמת ה-QD מועשרת יותר ויותר בתוך כלי הדם לאחר ההזרקה בעוד שעוצמת הטרשת הנפוצה נשארת לא מועשרת (ממוצע, עם SEM, n = 4-7 לנקודת זמן). פסי קנה מידה: 200 מיקרומטר (A-I) ו-50 מיקרומטר (אינסטים, E-G). קיצור: BA = Bulbus Arteriosus, EAT = רקמת שומן אפיקרדיאלית, V = חדר, A = אטריום, MS = מיקרוספרות, QD = נקודות קוונטיות, mpf = חודשים לאחר ההפריה, מ"מ = אורך דג זברה סטנדרטי במילימטרים. אנא לחץ כאן לצפייה בגרסה גדולה יותר של איור זה.
איור משלים 1: הזרקה תוך-קרדיוקרדיאלית של טרשת נפוצה ספוגה ב-4OHT. (A) ייצוג סכמטי של cmlc2: מבנה ביטוי CreERT2 המשמש ליצירת דג זברה טרנסגני המסוגל לגרום לביטוי של mCherry (וצורה שלילית דומיננטית של Gata4, dnGata4) בקרדיומיוציטים חיוביים ל-cmlc2 כאשר 4OHT קיים17. (B) ביטוי של mCherry (אדום) בלב דג זברה 14 ימים לאחר הזירוז (Juvenile; 35 dpf; 13.5 מ"מ). תמיסת מלאי של 10 מ"מ של 4OHT מדוללת במי המערכת לריכוז סופי של 10 מיקרומטר לתוכו טובלים דגי זברה למשך 6 שעות. (C,D) ביטוי של mCherry (C; אדום) בלב דג הזברה 3 ימים לאחר הזרקה פנימית של טרשת נפוצה 4OHT ספוגה (D; כחול) בדג זברה בוגר (190 dpf; 24.5 מ"מ). פסי קנה מידה: 50 מיקרומטר (B) ו-100 מיקרומטר (C,D). אנא לחץ כאן להורדת קובץ זה.
סרטון משלים 1: סרטון מייצג להדגמת הזרקת מיקרו קרדיוקרדיאלית מוצלחת של QD + MS. אנא לחץ כאן להורדת קובץ זה.
Discussion
המאמר הנוכחי תיאר שיטה להחדרת חומר אקסוגני לשריר הלב של דג הזברה. טכניקה זו פותחה כדי להכניס QD וטרשת נפוצה לשריר הלב כדי לחקור את תפקוד הלימפה בהומאוסטזיס והתחדשות 2,18. גישה דומה שימשה גם להחדרת QD לשריר הלב של עכברים כדי לחקור את הנוכחות והתפקוד של לימפה לאחר אוטם שריר הלב19,20.
החדירה והמיקום של קצה המחט בשריר הלב היא שלב קריטי בהליך זה. נימי הזכוכית צריכים להיות חדים מספיק כדי לחדור לרקמת שריר הלב הצפופה וקשיחים מספיק כדי לא להתכופף בכוח הרמת הלב בעת מיקום מקום ההזרקה. ניתן להשיג את האיזון האופטימלי בין שתי תכונות הקצה הללו על ידי שינוי מידת הקטנת גודל הקצה באמצעות מלקחיים. זווית הזרקה חדה היא הטובה ביותר לאלץ את הקצה דרך דופן שריר הלב. ההזרקה במקום הנבחר מאתגרת בשל תנועת פעימות הלב. לכן, ההזרקה חייבת להתבצע בצורה מבוקרת על ידי הנחת הקצה על הלב הפועם והזזתו מעט כדי להתאים את מקום ההזרקה. יש לבצע התאמה נוספת של זווית ההזרקה כאשר הקצה נוגע בלב הפועם כדי לשמור על השניים בניצב כאשר לבסוף מפעיל מספיק כוח כדי לנקב את שריר הלב.
ברגע שנכנסים לרקמת הלב, מיקום הקצה מתבצע על ידי הרמת קודקוד הלב עם המחט ולאחר מכן המשך הארכת הקצה. אי ביצוע זה יביא להזרקת לומינל למחזור הדם. עם לחץ נוסף המופעל לכיוון החלק הקדמי של הדג, המחט נראית לעתים קרובות ברקמה כשהיא נכנסת מחדש או ממשיכה לנוע לכיוון בסיס שריר הלב. בשלב זה, דופק קצר של לחץ הזרקה יציין את מיקום הקצה המדויק ואם הוא נמצא במיקום ההזרקה הרצוי. הכמות הסופית של החומר המוזרק תשפיע על משך הזמן שהוא שוהה בתוך הרקמה. לכמויות גדולות יותר ייקח זמן רב יותר להתנקות, ו-QD יהיה גלוי בלימפה למשך זמן רב יותר. הזמן שלוקח לקליטה הנראית לעין להתחיל הוא גם פונקציה של המרחק היחסי בין מקום ההזרקה לכלי הלימפה הלבביים. חומר מוזרק פרוקסימלי לכלי הלימפה ייקלט מוקדם יותר מהחומר הרחוק יותר. מכיוון שכיסוי כלי הלימפה משתנה לפי גיל וגודל בדג זברה בוגר, הדבר מציג שונות נוספת בבדיקה שיש לקחת בחשבון בעת תכנון ניסויים בטכניקה זו2.
הספיגה הספציפית של עוקבים פלואורסצנטיים על ידי מערכת הלימפה תלויה בגודל העוקבים21. גדלי החלקיקים מתחת ל-100 ננומטר יכולים להילקח בקלות על ידי כלי לימפה22. גודל ה- QD הוא <10 ננומטר; לכן, נצפה כי רוב ה-QD נקלט על ידי מערכת הלימפה תוך 24 שעות לאחר ההזרקה הפנימית. לא ידוע איזו תגובה חיסונית מעוררים עוקבים פלואורסצנטיים מוזרקים וכמה זמן זה נמשך בדג הזברה. עם זאת, מחקרים קודמים בעכברים הראו כי טרשת נפוצה ריקה/ריקה בהזרקה אינה גורמת לתגובה חיסונית משמעותית23,24, וההישרדות האופיינית מההליך היא 100% בדגי זברה בוגרים.
ההזרקה התוך-קרדיוקרדיאלית שימשה הן קלינית והן ניסויית במודלים של יונקים כדי לבדוק או לשפר את תפקוד הלב לאחר אוטם שריר הלב עם הזרקה אינטרמיורקרדיאלית של תאי גזע ואב או תרכובות אקסוגניות כגון הידרוג'ל 8,9,10. לאחרונה, טרשת נפוצה משכה תשומת לב רבה בתחום מתן תרופות והתחדשות25. הוכחנו כי הזרקת טרשת נפוצה בשריר הלב בדגי הזברה אפשרית ויציבה במשך למעלה מ-3 שבועות לאחר ההזרקה. יתר על כן, הנתונים הראשוניים שלנו מצביעים על כך שניתן להשתמש בשיטה זו כדי להעביר תרכובות אקסוגניות ללב דג הזברה. יהיה מעניין ליישם פרוטוקול זה כדי להשתמש בטרשת נפוצה פונקציונלית כדי להכניס תרכובות ותאים אקסוגניים ללב דג הזברה עם יישומים נרחבים בתחומי מחקר רבים.
Disclosures
למחברים אין מה לחשוף.
Acknowledgements
אנו מודים ל-Adedeji Afolalu, Chaim Shapiro, Soji Hosten ו-Chelsea Quaies על הטיפול בדגים (Weill Cornell Medicine), לקרוליין פירסון (Weill Cornell Medicine) על הקריאה הביקורתית של כתב היד. Jingli Cao (Weill Cornell Medicine) על השימוש בהיקף הדיסקציה ובמצלמה כדי להקליט את ההליך בנוסף לקריאה ביקורתית של כתב היד. נתן לוסון (בית הספר לרפואה של אוניברסיטת מסצ'וסטס), ברנט ויינשטיין (NICHD), אלקה אובר (אוניברסיטת קופנהגן) וסטפן שולטה-מרקר (WWU מינסטר) על קווי דגי זברה טרנסגניים. דניאל קסטרנובה (NICHD) על ייעוץ בנושא QD והדמיה ויו שיה (Weill Cornell Medicine) על הדרכה לגבי ניתוח צילום וידאו בהיקף. עבודה זו נתמכה על ידי מלגת NYSTEM ל-NM, פרס פיתוח הקריירה של איגוד הלב האמריקאי (AHA941434), מענק המכונים הלאומיים לבריאות (NIH) (R01NS126209) וקרן הסטארט-אפ לרפואה של וייל קורנל ל-MH.
Materials
| Name | Company | Catalog Number | Comments |
| Crystallization dish | VWR | 89000-288 | |
| Dissection Scope | Zeiss | 495010-0007-000 | |
| Fish facility water | N/A | N/A | RO water with sea salt and sodium bicarbonate added to a conductivity of 226uS and pH of 7.35 |
| Forceps | Dumont | 11252-20 | |
| Glass Capillaries | WPI | 1B120-3 | no filament |
| ImageJ | https://imagej.nih.gov/ij/download.html | ||
| Iridectomy scissors | Fine Scientific Tools | 15000-00 | |
| Microinjector | Warner Instruments | 64-1735 | |
| Microloader femtotips | Eppendorf | 5242 956.003 | |
| Micropipette puller | Sutter Instrument | P-97 | Gated pedal input |
| Microspheres | Thermo Fisher Scientific | B200 | Blue |
| PBS | Corning | 46-013-CM | |
| Quantum dots (QD) | Thermo Fisher Scientific | Q21061MP | Qtracker705 vascular label |
| Sponge | any | any | (1.5 × 5 × 3 cm) with groove (0.5 × 2.5 cm) |
| Syringe filter | Corning | 431220 | |
| Tricaine | Sigma-Aldrich | A5040 | concentration: 4 mg/mL |
References
- Munn, L. L., Padera, T. P. Imaging the lymphatic system. Microvascular Research. 0, 55(2014).
- Harrison, M. R., et al. Late developing cardiac lymphatic vasculature supports adult zebrafish heart function and regeneration. eLife. 8, 42762(2019).
- Gancz, D., et al. Distinct origins and molecular mechanisms contribute to lymphatic formation during cardiac growth and regeneration. eLife. 8, 44153(2019).
- Vivien, C. J., et al. Vegfc/d-dependent regulation of the lymphatic vasculature during cardiac regeneration is influenced by injury context. NPJ Regenerative Medicine. 4, 18(2019).
- Cueni, L. N., Detmar, M. The lymphatic system in health and disease. Lymphatic Research and Biology. 6 (3-4), 109(2008).
- Schwartz, N., et al. Lymphatic function in autoimmune diseases. Frontiers in Immunology. 10, 519(2019).
- Feng, X., Travisano, S., Pearson, C. A., Lien, C. L., Harrison, M. R. M. The lymphatic system in zebrafish heart development, regeneration and disease modeling. Journal of Cardiovascular Development and Disease. 8 (2), 1-14 (2021).
- McCall, F. C., et al. Myocardial infarction and intramyocardial injection models in swine. Nature Protocols. 7 (8), 1479(2012).
- Williams, A. R., et al. Intramyocardial stem cell injection in patients with ischemic cardiomyopathy: Functional recovery and reverse remodeling. Circulation Research. 108 (7), 792-796 (2011).
- Rodell, C. B., et al. Injectable shear-thinning hydrogels for minimally invasive delivery to infarcted myocardium to limit left ventricular remodeling. Circulation: Cardiovascular Interventions. 9 (10), 004058(2016).
- Bise, T., Jaźwińska, A. Intrathoracic injection for the study of adult zebrafish heart. Journal of Visualized Experiments. (147), e59724(2019).
- Konantz, J., Antos, C. L. Reverse genetic morpholino approach using cardiac ventricular injection to transfect multiple difficult-to-target tissues in the zebrafish larva. Journal of Visualized Experiments. (88), e51595(2014).
- Wagner, A. M., Knipe, J. M., Orive, G., Peppas, N. A. Quantum dots in biomedical applications. Acta Biomaterialia. 94, 44(2019).
- Rizvi, S. B., Ghaderi, S., Keshtgar, M., Seifalian, A. M. Semiconductor quantum dots as fluorescent probes for in vitro and in vivo bio-molecular and cellular imaging. Nano Reviews. 1 (1), 5161(2010).
- Van Nguyen, T., et al. Size determination of polystyrene sub-microspheres using transmission spectroscopy. Applied Sciences. 10 (15), 5232(2020).
- Harrison, M. R. M., et al. Chemokine-guided angiogenesis directs coronary vasculature formation in zebrafish. Developmental Cell. 33 (4), 442-454 (2015).
- Gupta, V., et al. An injury-responsive gata4 program shapes the zebrafish cardiac ventricle. Current Biology. 23 (13), 1221-1227 (2013).
- El-Sammak, H., et al. A Vegfc-Emilin2a-Cxcl8a signaling axis required for zebrafish cardiac regeneration. Circulation Research. 130 (7), 1014-1029 (2022).
- Harris, N. R., et al. VE-Cadherin is required for cardiac lymphatic maintenance and signaling. Circulation Research. 130 (1), 5-23 (2022).
- Henri, O., et al. Selective stimulation of cardiac lymphangiogenesis reduces myocardial edema and fibrosis leading to improved cardiac function following myocardial infarction. Circulation. 133 (15), 1484-1497 (2016).
- Rao, D. A., Forrest, M. L., Alani, A. W. G., Kwon, G. S., Robinson, J. R. Biodegradable PLGA based nanoparticles for sustained regional lymphatic drug delivery. Journal of Pharmaceutical Sciences. 99 (4), 2018-2031 (2010).
- Casley-Smith, J. R. The fine structure and functioning of tissue channels and lymphatics. Lymphology. 13 (4), http://journals.librarypublishing.arizona.edu/lymph/article/id/4218 (1980).
- Liu, Y., et al. Experimental vaccine induces Th1-driven immune responses and resistance to Neisseria gonorrhoeae infection in a murine model. Mucosal Immunology. 10, 1594-1608 (2017).
- Wang, D., et al. Poly(D,L-Lactic-co-Glycolic Acid) microsphere delivery of adenovirus for vaccination. Journal of Pharmaceutical Sciences. 10 (2), 217-230 (2007).
- Li, Q., Chang, B., Dong, H., Liu, X. Functional microspheres for tissue regeneration. Bioactive Materials. , (2022).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved