Method Article
ブタ心臓における容量性免疫プローブによる神経ペプチドダイナミクスの時間分解 インビボ 測定
要約
インビボでペプチド伝達物質を測定するための確立された免疫化学的方法は、オフライン分析のためのサンプルを得るために微量透析またはバルク流体描画に依存する。しかし、これらは時空間的な制限に苦しんでいます。本プロトコールは、既存の技術の限界を克服する容量性免疫プローブバイオセンサの作製および適用を記載する。
要約
疾患進行の評価に関連するバイオマーカーを インビボで 測定する能力は、科学界および医学界にとって大きな関心事である。特定のバイオマーカーを測定する現在の方法から得られた結果の分解能は、空間的および時間的にも分解能が制限される可能性があるため、取得に数日または数週間かかることがあります(例えば、酵素結合免疫吸着アッセイ[ELISA]、高速液体クロマトグラフィー[HPLC]、または質量分析によって分析された間質液の流体区画微量透析)。したがって、タイムリーな診断と治療の指導が中断されます。本研究では、容量性免疫プローブバイオセンサ(CIプローブ)を用いて 生体内で ペプチド伝達物質を検出・測定する独自の技術が報告されている。これらのプローブの製造プロトコルおよび インビトロ 特性評価が記載されている。 インビボでの 交感神経刺激誘発性ニューロペプチドY(NPY)放出の測定が提供される。NPY放出は、参考のためにノルエピネフリンの交感神経放出と相関している。このデータは、 インビボでの神経ペプチドの迅速かつ局所的な測定のためのアプローチを実証している。将来のアプリケーションには、疾患進行の術中リアルタイム評価と、これらのプローブの低侵襲カテーテルベースの展開が含まれます。
概要
バイオマーカーを検出および定量するためのいくつかの化学的方法は、タンパク質化学および臨床診断の両方において、特に癌診断および心血管疾患進行の評価において日常的に利用されている。現在、高速液体クロマトグラフィー(HPLC)、酵素結合免疫吸着アッセイ(ELISA)、および質量分析などの方法は、バルク流体描画による血管区画1、2、3または微小透析による間質区画からのサンプル収集に依存している。微小透析は、関心領域に配置された既知の長さの半透膜チューブを採用する。収集流体は、分析5のためにサンプルを収集するために数分にわたってチューブ4を通して灌流され、したがって時間的分解能を制限する。このようにして、収集されたサンプルは、局所微小環境の経時的な平均値のみを提供し、灌流速度および十分なサンプル量の収集によって制限される。さらに、これらの方法は、実験データのプーリングとシグナル平均化を必要とする。したがって、被験者間の変動性を説明できない可能性があります。重要なことに、サンプル収集とその後のオフライン分析の間の時間は、即時の臨床介入および治療を妨げます。
本プロトコールにおいて、特異的生理活性ペプチドの時間分解電気的検出のための容量性免疫プローブバイオセンサ(CIプローブ)の使用が概説されている。神経ペプチドY(NPY)は、血管系、心内膜、心筋細胞、および心臓内神経節を神経支配する神経節後交感神経ニューロンから放出され、心血管系における主要な神経調節ペプチド伝達物質である6、7、8、9。ここで提示された方法はNPYを測定するように設計されており、実験的実現可能性はブタ心臓モデルで実証されている。しかしながら、このアプローチは、選択的抗体が利用可能である任意の生理活性ペプチドに適用される10。この方法は、機能化された先端部11、12における白金線プローブと導電性流体との間の容量性接合に依存する。本出願では、相互作用は、電極先端に結合した標的ニューロペプチド(NPY)に対する抗体を介して媒介され、導電性流体環境とインターフェースする。この官能化は、白金線プローブ10、13の先端への反応性ポリドーパミンの電着によって達成された。
抗体官能化プローブが 生体内の関心領域に配置されると、誘発された内因性NPY放出はプローブ先端上の捕捉抗体への結合をもたらし、電極表面の導電液はNPYタンパク質によって変位する。電気環境における局所的な変化は、不動の静的に荷電した分子を有する高移動度、高誘電性流体の変位をもたらす。これは、電極-流体界面、したがって、ステップ関数指令電位に応答して充電電流の変化として測定されるその静電容量を変化させる。個々の測定サイクルの直後に負の「リセット」電位を採用して、静電相互作用を介して抗体から結合NPYをはじき、その後の測定10ラウンドで抗体結合部位をクリアします。これにより、時間分解された方法でNPYを効果的に測定できます。独自のCI技術は、上記で概説した微小透析ベースの免疫化学的方法の限界を克服し、複数の実験にわたってデータプーリングやシグナル平均化を行わずに、単一の実験から動的バイオマーカーレベルを測定し、ほぼリアルタイムでデータを提供します。さらに、時間分解および局在化スケールで適切な抗体が存在する任意のバイオマーカーにこの方法を適応させる能力は、疾患進行の評価および治療介入のガイダンスのための免疫化学的測定における大きな技術的進歩を提供する。
データ収集と分析のためのソフトウェアは、IGOR Pro(完全にインタラクティブなソフトウェア環境)でカスタム作成されました。アナログ-デジタルコンバータ(A/D)システムは、コンピュータ制御下で指令電圧を発行し、カスタムアンプからデータを集録しました。アンプは、特定のユニークな機能を持っていました。これらには、4つの集録チャンネルのそれぞれに対応する帰還抵抗(切り替え可能)が含まれており、1 MOhmまたは10 MOhmのフィードバック電圧クランプ回路を選択して電極の変動性を統合することができます。また、1つのヘッドと4つの集録チャンネルすべてに対して相互のグランド/リファレンス回路を備えたステージユニットも構築され、デバイスを1つの物理モジュールに胸部の近くに配置しました。1 MOhmの帰還抵抗設定を使用して、報告されたすべてのデータを収集しました。
フィルタとゲインの設定はアンプから電信され、データファイルに記録されました。データは、10kHzでデジタル化された2極アナログベッセルフィルタを介して1kHzでフィルタリングされました。プローブと周囲の導電性溶液との間の電位の差は、プローブ先端にヘルムホルツ容量性層を作り出す。プローブ先端で抗体に結合するリガンドは、局所電荷の変化をもたらし、したがって、ヘルムホルツ容量の変化をもたらす。回路の容量性成分のこの変化は、プローブをステップ関数電圧プロトコルの電位に導くために必要な注入電荷の大きさのシフトをもたらす。したがって、機能化されたプローブへの特異的リガンドの結合は、ピーク容量性電流の変化として電極容量測定に変化をもたらす。
プロトコル
すべての動物実験は、カリフォルニア大学ロサンゼルス校動物研究委員会によって承認され、実験動物の世話と使用のための国立衛生研究所ガイド(第8版、2011)によって定められたガイドラインに従って実施されました。約75kgの成体雄ヨークシャーブタを in vivo 研究に使用した10。
1. 容量性免疫プローブの作製と機能化
- 長さ25cmのパーフルオロアルコキシ(PFA)被覆白金線( 材料表参照)を切断し、一端から約5mmのPFA被覆をメスで剥がし、白金線に切れないように注意する。
- 白金線の剥がれた端を金メッキの1mmの雄コネクタピンに挿入し、針鼻ペンチを使用して白金線の剥がれた端の周りのコネクタピンの歯を圧着します( 材料表を参照)。
- 白金線を金メッキコネクタピンにはんだ付けします。はんだを過剰に使用しないよう注意してください。
- 50 mLのドーパミンHClを10 mMリン酸緩衝生理食塩水(PBS、pH 6.0)に溶解してドーパミン溶液を調製した。
- ドーパミンが完全に溶解したら、白金線の先端を新しく作ったドーパミン補給PBSの入った容器に入れます。金色のコネクタピンをヘッドステージのチャンネルに差し込みます( 材料表を参照)。
- AgClディスク電極(接地電極、 材料表を参照)をヘッドステージの接地チャネルに接続します。ドーパミン補充PBSおよび白金線を含む容器にAgClディスクを置く;ディスク電極のみを水没させ、ワイヤやはんだの長さは入れないように注意してください。先に進む前に、ワイヤシャントをヘッドステージのリファレンスチャンネルに接続します。
- インタラクティブなデータ集録ソフトウェアを開きます( 資料表を参照)。次のパラメータを持つ鋸歯状電着コマンド電位プロトコルを準備します:開始電位= −0.6V;終端電位 = +0.65 V;スキャンレート = 0.04 V∙s-1;堆積の持続時間= 420秒。ポリドーパミン沈着プロトコルを開始し、すべてのワイヤが正しく接続されていることを確認します。
- ポリドーパミン蒸着が完了したら、AgClアースペレットと白金線の先端を容器から取り出し、白金線電極の先端を乱さないように注意する。抗体溶液が調製されるにつれて、ワイヤーの先端をPBS(pH7.4)を含むマイクロチューブに2〜5分間置く。ワイヤチップがマイクロチューブの側面または底部に接触していないことを確認します。
注:抗体溶液は、ポリドーパミン沈着中に作製することができる。しかしながら、ポリドーパミン沈着後のドーパミン含有容器からPBSのマイクロチューブへの白金線の転写はスキップされるべきではない。 - 抗体溶液を調製する。目的の抗体をPBS(pH 7.4)と1:20の比率で適切なサイズの容器(例えば、マイクロチューブ)で結合させる。
注:ここで使用した抗NPYモノクローナル抗体( 材料表を参照)は、1mg/mLで小分けされた。ここでの抗体調製の例は、76 μLのPBSに対する4 μLの抗体であろう。 - 白金電極のポリドーパミン付着チップを抗体溶液に室温で最低2時間浸し、再び白金線チップが溶液中に浮遊し、マイクロチューブの内面に載っていないことを確認します。
注:この技術の最近の実装では、後で使用するために湿式または乾式の保管ではなく、このステップの直後に白金線電極を使用することが好まれています。 - 抗体溶液に浸した後、新たに官能化した容量性免疫プローブ(CIプローブ)チップをPBS(pH7.4)で短時間リンスする。これで、プローブを使用する準備ができました。
2. ペプチドの in vitro 検出および測定のための実験セットアップ
- CIプローブの機能先端をフローチャンバ内に置き、プローブの感覚先端を損傷する可能性があるため、電極の先端をいかなる方法でも乱さないように注意してください。
注:フローチャンバは、シリコーンエラストマー( 材料表を参照)を35mmの培養皿に注ぎ、皿の中央に細長い卵形スペースフィラーを流すことによって作成されました。硬化後、卵形形状がエラストマーから除去される。次いで、チャンバーをトリス緩衝生理食塩水(TBS)で過溶させ、3mL/minの流速で許容した。流入および流出が過溶融物の潮汐作用が観察されないようにチャンバ内の流体レベルを維持するようにする。フローは、CI プローブが使用されている限り、その場にとどまる必要があります。 - 最初の実験試験の前に、TBS標準実行を実行してCIプローブをコンディショニングします。次のコマンド電圧プロトコルを設定します:正のステップ電位= +100mV。負のステップ電位 = −5mV;ステップ持続時間 = 20 ミリ秒;取得期間 = 600 秒。
注:データ取得前のサイクリングコマンド電位の初期段階でプローブの平衡化を可能にすることが重要です。 - スーパーフセートの組成を維持するために同じTBSを使用して目的のペプチドの溶液を作成します。チューブシステムやフローチャンバに気泡を導入せずに、TBSとペプチド補充TBSの間でスーパーフューセートを切り替えることができるマニホールドシステムを設定します。
注:合成ブタNPYペプチド( 材料表参照)を本研究に使用した。 - TBS標準パラメータを使用してペプチドセンシングデータ収集プロトコルを設定します(ステップ2.2を参照)。
注:この実施において、各実験試験の持続時間は360秒(120秒TBS、120秒ペプチド補充TBS、120秒TBS)であった。
3. in vivo 使用のためのCIプローブの適応
- ポリドーパミン沈着(ステップ1.7)の前に、白金線電極の露出した先端を22G皮下針に通し、針の先端から約2mm先に残す。鉗子を使用して、白金線電極の先端を静かに曲げ、皮下注射針の端から垂れ下がる「とげ」を作ります。
- 有刺鉄線の先端から針を静かに引き抜き、針が流体に接触することなく容器に入れるのに十分なワイヤーを残します。ステップ 1.4.-1.11 に進みます。
メモ: in vivo の設定によっては、25 cm を超える長さの白金線を切断する必要がある場合があります。
- 有刺鉄線の先端から針を静かに引き抜き、針が流体に接触することなく容器に入れるのに十分なワイヤーを残します。ステップ 1.4.-1.11 に進みます。
- CIプローブをヘッドステージに接続する前に、電気セットアップ全体が正しく接地されていることを確認してください。これを怠ると、実験録音中に不要な電気的干渉が発生する可能性があります。
- 以前に発表された報告書10に従って動物を麻酔する。
- 関心領域を露出させる手術を行う。
注:本研究では、心臓を露出させるために中央値胸骨切除術を行った。動物の手術の詳細については、Kluge et al.10 を参照してください。 - PBSリンスから機能化された先端を静かに取り外し(ステップ1.11)、ヒドダーム針を有刺鉄線のC.I.プローブに前進させ、金コネクタピンをヘッドステージに差し込む前に、関心のある領域に静かに埋め込みます。移植したら、皮下注射針を抜き取り、電極を所定の位置に残します。
注:本研究のために、プローブを左心室心筋10の中間側壁に配置した。 - 適切な電気的セットアップを確認したら、標準および実験的なテストプロトコル(ステップ2.2.およびステップ2.4)に進みます。
- 実験が完了したら、制度的に承認された技術に従って動物を安楽死させる。
注:本研究では、動物は心室細動の誘導 を介して 深い麻酔下で安楽死させられる10。
結果
電極の作製と特性評価
柔軟な容量性免疫プローブ(CIプローブ)を作製し、代表的な画像を 図1Aに示します。電極電位をコンピュータ制御の電圧クランプ回路(図1B)により設定し、PBS製のポリドーパミン溶液に電極を浸漬した。ポリドーパミンを官能化のために導電性電極チップ13 上に電着させた。指令電位がプローブ電圧を駆動し、クランプ電流注入を測定した。ポリドーパミン沈着の単一サイクル中に測定されたクランプ電流を 図1Cに示す。ポリドーパミン沈着の直後に、コーティングされた電極先端部を目的の抗体溶液に浸した(図2A)。全ての電極は、これらの工程の直後に使用した。
NPYのインビトロ測定
抗体官能化プローブをフローチャンバに入れ、コマンド電位の例を示す電圧クランプ回路によって駆動し、記録された電流を示します(図2B、C)。インビトロ記録は、トリス緩衝生理食塩水(TBS、pH7.4)中で行った。ステップ関数波形は、正のステップ電位(上側の青色部分、図2B)と負の「リセット」電位(下側の赤色部分、図2B)で構成されています。 このコマンド電位の範囲は、結合を効果的に測定し、プローブ感度10を劣化させることなくペプチドのその後の反発を呼び起こす。作製後、各プローブは、コマンド電位プロトコルの下で初期コンディショニングについて試験された。最も安定で再現性のある初期コンディショニングプロファイルを戻したプローブは、より小さな初期減衰とそれに続く安定したベースラインとして定義され(図2D)、インビトロおよびインビボで最も再現性のある測定値を与えたことに留意されたい。したがって、CIプローブの初期安定化を測定することは、プローブ適合性を決定するための重要な品質管理ポイントを表す。
インビトロでの電極感度と安定性の評価
容量性免疫プローブをフローチャンバーに入れ、既知濃度のニューロペプチドY(NPY、5〜150pM)を添加したTBSでスーパーフュージョンした。+100mVの分極解除のピーク振幅として測定された容量性電流を、時間に対してプロットした。フローチャンバへのNPYの流れは、ベースラインよりも容量性電流を増加させました(60pM NPY、 図2E)。5pMおよび75pM NPYの用量依存性電流応答の実証を図 3Aに示し、試験したすべての濃度で測定された標準曲線を 図3Bに示す。 図3B のデータポイントは、キャリブレーションの目的で単一の指数適合に適合していました。
CIプローブによる神経ペプチド放出プロファイルのインビボ評価
この方法論をブタ心臓製剤に適用して、以前の刊行物10に記載されているように、生物学的適用に対するその適合性を評価した。簡単に説明すると、CI電極を22G皮下注射針に通し、わずかに後ろに曲げてバーブを作成しました(図4A)。針および有刺鉄線電極を、鼓動ブタ心臓の左心室心筋に挿入した。その後、皮下ガイド針を電極から抜き取り、心筋内の所定の位置に残した。間質NPYは、60秒の両側星状神経節刺激の前および応答で測定された(シミュレーションステップの完全な説明についてはKluge et al.10を参照)。抗体官能化のない第2の負極をNPYプローブに隣接して配置した。得られた容量性免疫プローブクランプ電流をin vitro検量線に当てはめて、心臓微小環境におけるNPYの濃度の時間的に分解され、誘発された変化を提供しました。両側星状神経節の刺激中に上昇したNPYが観察され、陰性対照のC.I電流と共プロットされた(図4B、上段のプロット)。並行して、間質性ノルエピネフリンレベル(NE)は、単離細胞14、15、単離組織16、17、18、およびブタ心臓調製物19からのカテコールアミンの放出を評価するために以前に利用された技術である高速走査型サイクリックボルタンメトリー(FSCV)によっても測定された。ノルエピネフリンは、星状刺激下で共放出される交感神経伝達物質であり(図4B、下段のプロット)、NPYとの同期放出を示し、誘発交感神経応答と一致する。これらのデータは、CIアプローチを他のバイオマーカー検出方法と同時に使用して、高い時間的忠実度で間質微小環境を評価できることを実証しています。簡単に説明すると、センサ電極は、CIプローブに隣接する心筋に移植される。電極電位は、電圧クランプ回路によってトランスミッタの酸化/還元電位を介して駆動される。したがって、電極電位がNEの酸化電位に対して正になるにつれて、NEはキノン誘導体に酸化される。電子は酸化反応によって生成され、電圧クランプ電極内の補償電流として測定され、それによって局所的なNE放出の指標を提供する。電極電位を負分極に戻すとキノン生成物が減少し、カテコールアミン20を再生する。
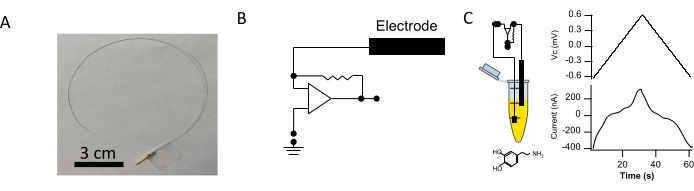
図1:白金線CIプローブの作製。(A)PFA被覆白金線(長さ25cm、直径127μm)を用いて各CIプローブを作成した。ワイヤの一端から約5mmのPFAコーティングを剥がし、その後、オスの金メッキコネクタピン(スケールバー= 3cm)にはんだ付けしました。(B)指令電位を印加するために使用される電圧クランプ回路の描写を示す。(C、左)電極の感覚先端を、5mMドーパミンを添加したPBSを含むチューブに浸漬した。(C、右)ポリドーパミンを感覚先端に電着させた。電着は、0.04V∙s-1のスキャンレートで-0.6V~+0.65Vのパラメータを持つ鋸歯状波形を使用して行った。コマンド電位(上)と結果として生じる電流(下)が表示されます。この図の拡大版を表示するには、ここをクリックしてください。
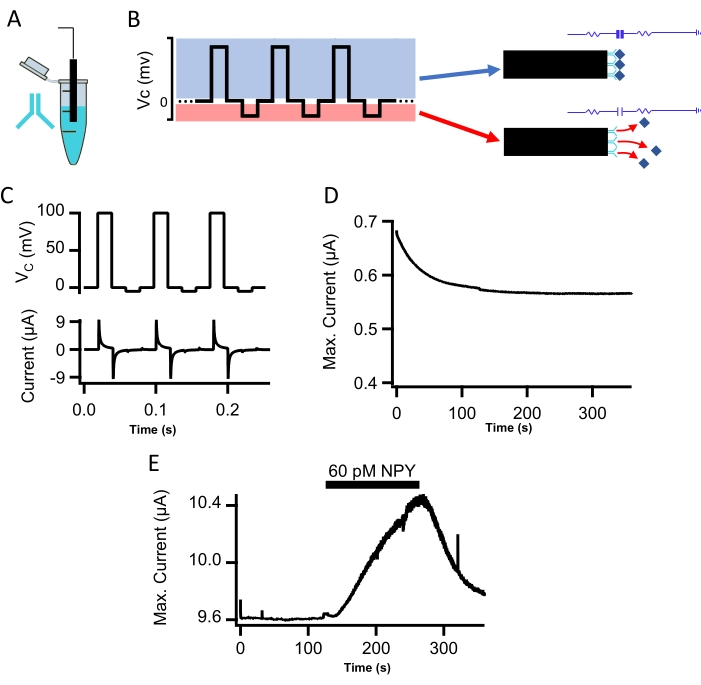
図2:CIプローブによるNPYの インビトロ 測定。 (a)ポリドーパミン官能化ワイヤーを、抗NPY抗体を添加したPBSに2時間浸漬した。これにより、抗体はプローブ先端のポリドーパミン表面に共有結合で結合することができました。(b)電圧指令電位を示す。コマンド電位の正のステップは、プローブ電圧(青色)をクランプするために必要な注入電流を測定するのに役立ち、容量性電流の測定を可能にします。負の指令電位(リセット電位)ステップは、静電反発(赤色)を介して抗体から結合したペプチドをクリアする。(C)ステップ関数コマンド波形(トップトレース、+100mV測定位相~-5mVリセット相、それぞれ20ms持続時間)は、ペプチドの時間分解、反復検出および定量を提供します。TBSとのプローブのスーパーフュージョン下でのコマンド電位および結果として生じる電流記録が示されている(下のトレース)。(D)6分間にわたるCIプローブの平衡化が示されている(ステップ2.2参照。(E)NPY官能化C.I.プローブによって測定されたピーク容量性電流を示す。CIプローブを、最初にトリス緩衝生理食塩水でスーパーフュージョンし、次に60pM NPYを添加したトリス緩衝生理食塩水、次いでNPYフリートリス緩衝生理食塩水洗浄を行った。 この図の拡大版を表示するには、ここをクリックしてください。
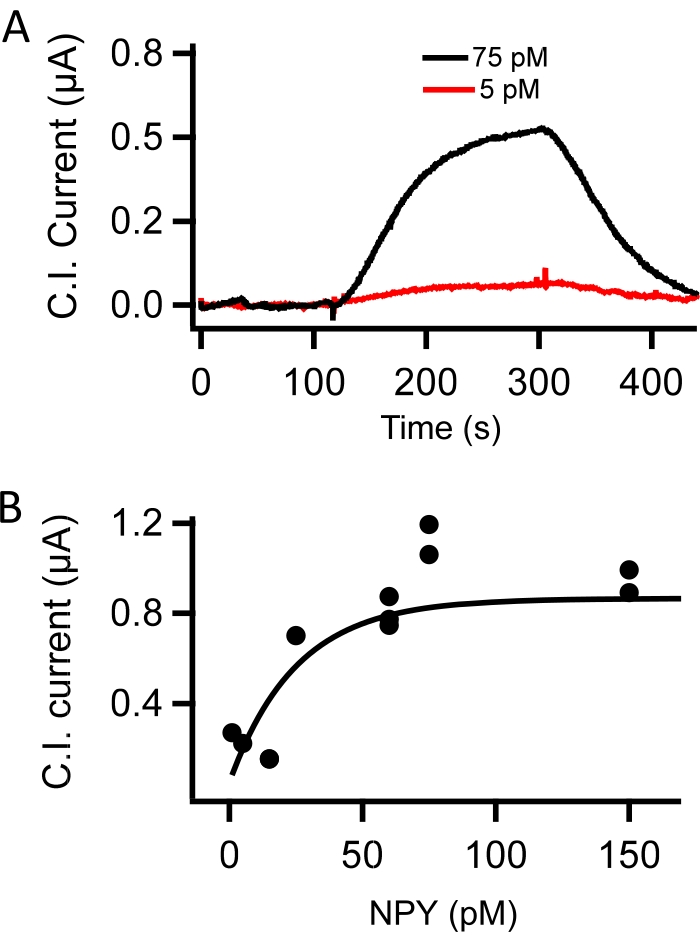
図3: CIプローブのインビトロ 較正。 (a)容量性免疫プローブ電流は、トリス緩衝生理食塩水とスーパーフュージョンしたNPY抗体官能化プローブを用いて測定した。スーパーフセートは、5pM(赤)および75pM(黒)NPYを含むように切り替えた。これらの記録は、低ピコモールNPYに感受性の高い濃度依存性シグナルを表す。(b)NPY抗体で官能化された容量性免疫プローブを、用量反応感度について試験した。レコーディングはTBSとのスーパーフュージョンの下で行われた。その後、TBSにNPY(pM単位)を補充し、1、5、15、25、60、75、および150を補充し、NPYフリーのTBSウォッシュで洗浄します。ピーク容量電流値(C.I.電流)を各NPY濃度において定常状態で測定し、NPY濃度に対してプロットした。用量反応データを、実験データの較正のための標準曲線を提供するために適合させた(Kluge et al.10から適合)。 この図の拡大版を表示するには、ここをクリックしてください。
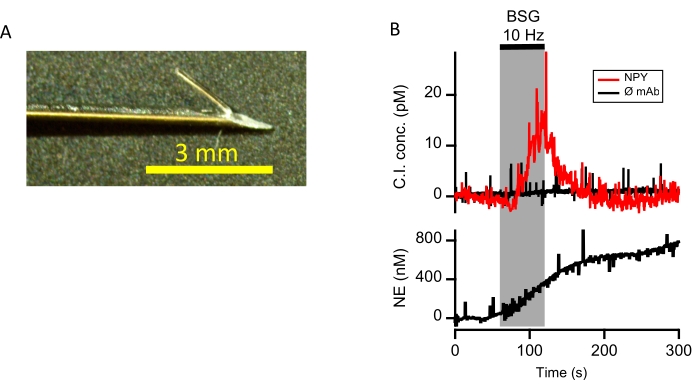
図4:両側星状刺激によって誘発されるNPYおよびNEの示差的放出。 (A)in vivo使用のための有刺鉄線端を有する CI プローブが示されている(スケールバー=3mm)。プローブを22G皮下注射針に通し、ステップ1で述べたように調製する。ステップ2。センサを挿入する前に、プローブ先端を曲げてバーブを作り、心筋に挿入すると針が引き抜かれ、それによって有刺鉄線プローブが左心室の心筋壁に固定されたままになる。(b)抗NPY抗体で官能化したプローブを左心室心筋に挿入した。抗体官能化のない同一のプローブ(ømAb)をすぐ隣に挿入し、ネガティブコントロールとして役立てた。CI電流は、10Hz(BSG、4msパルス幅、2x閾値)での両側ステレート刺激に応答して決定された。得られた電流を標準曲線に対して較正し(図3B)、プロット(上段のプロット)しました。同じ間質位置におけるノルエピネフリン放出を、高速走査型サイクリックボルタンメトリーを用いて測定した(下段のプロット)。 この図の拡大版を表示するには、ここをクリックしてください。
ディスカッション
本プロトコールは、イン ビトロおよびインビ ボの両方の設定において目的のバイオマーカーを検出および測定することができる容量性免疫プローブ( CI プローブ)の製造および試験を記載する。検出は、バイオマーカーを電極先端に捕捉することによって達成される。トラップイベントは、白金線容量性免疫プローブと周囲の導電性流体環境との間の容量性接合を変化させ、プローブ内の電位シフトに応答した電荷電流の変化として測定される。また、捕捉されたバイオマーカーをプローブ先端から静電的に忌避させることによって、検出サイクル間でイムノプローブの「リセット」を可能にする独自の電気的取得プロトコルも提示された。このバイオマーカークリアランスは、その後の測定サイクルを可能にし、したがって、時間分解測定10を提供する。この実装では、プローブ製造には、目的のバイオマーカーに対して惹起された抗体が共有結合で結合された細い白金線電極の先端上のポリドーパミン反応性層の電着が含まれる。ドーパミンとポリドーパミンは、ポリドーパミンがキノン官能基を含有する点で異なる。キノン類は、共有結合21を形成する第一級アミンによる求核攻撃の標的として作用する。このプロトコルの最も重要なステップは、機能化されたチップの摩耗によりCIプローブが使用できなくなる可能性があるため、物理ワイヤを慎重に扱うことです。
さらに、測定前にCIプローブの安定性を確保することが不可欠です。実験試験の前に、トリス緩衝生理食塩水でいくつかの対照標準を実行する必要があるかもしれません。そうすることで、実験者は結果として生じる電流の安定した過渡曲線を探しています(例えば、 図2D)。一貫した製造手法により、この過渡信号を最小限に抑えることはできますが、排除することはできません。
目的のバイオマーカーを調査する際に適切な抗体を使用することは、この技術を採用する際のもう1つの重要な要素です。この実施において、非変性タンパク質を検出する技術において適用可能であると特徴付けられる抗体は、変性タンパク質用途(ウェスタンブロット)のためのものよりもむしろ、最も適している(例えば、IHC、ELISA、 in situ ハイブリダイゼーション)。
心臓病進行の臨床診断および評価における免疫化学的方法の使用は、十分に確立された1が、主に組織生検または血管区画のサンプリングに由来するサンプルに依存し、第二に、微小透析ベースの間質液収集に依存する。サンプルは、正確な結果を提供するために特別な調製、取り扱い、および技術を必要とする場合があり、これは、せいぜい、関心のあるバイオマーカーの測定値を分レベルの時間分解能で提供する4,5。記載される容量性免疫プローブ方法論は、そのようなアプローチに勝るいくつかの利点を提供する:1)記載されたプローブ製造および適用は、重要な多くのユニークなバイオマーカーを検出するように適合させることができる。2)可撓性白金線電極は、血管系、器官、または他の流体区画に展開可能である。3)導出されたシグナルは、単一の対象において関心のあるバイオマーカーの時間分解動的放出プロファイルを提供する;4)CIプローブは、経時的に安定性を維持する。5)センサ自体の柔軟性により、機械的ストレスや動きが激しい領域でも安定した記録状態を維持できる。6)システムの可動性は、インビトロ、インビボ、ベンチ上、そして最終的にはベッドサイドで前例のない分解能で、関心のあるバイオマーカーの動的読み出しを可能にする。
上記で概説した技術は、従来の微量透析ベースのバイオマーカー検出および測定に固有の時空間的限界を克服する。この方法論は、複数の実験にわたってプールされたデータやシグナル平均化を必要とせずに、単一の被験者の動的放出プロファイルをほぼ瞬時に評価することができます。このアプローチの採用は、臨床的意思決定と治療介入を導くための関連するバイオマーカーの検出と測定における大きな技術的進歩として役立ちます。
開示事項
著者らは、金銭的またはその他の利益相反がないと宣言しています。
謝辞
Olu Ajijola博士(UCLA心臓不整脈センター)の in vivo 実験に対する専門家の支援に感謝します。この作業はNIH U01 EB025138 (JLA, CS)によってサポートされた。
資料
| Name | Company | Catalog Number | Comments |
| AgCl disc electrode | Warner Instruments (Holliston, MA) | 64-1307 | |
| Anti-NPY monoclonal antibody | Abcam, (Cambridge, MA) | ab112473 | |
| Custom multichannel amplifier/ 1 MΩ feedback resistor multichannel headstage | NPI Electronic, (Tamm, Germany) | NA | Based on NPI VA-10M multichannel amplifier |
| Dopamine HCl | Sigma Aldrich (St. Louis, MO) | H8502-10G | |
| Gold-plated male connector pin | AMP-TE Connectivity (Amplimite) | 6-66506-1 | |
| HEKA LIH 8+8 analog-to-digital/digital-to-analog device | HEKA Elektronik, (Holliston, MA) | NA | |
| Igor Pro data acquisition software, v. 7.08 | WaveMetrics, (Lake Oswego, OR) | Software driving command potential and data acquisition was custom written | |
| Masterflex L/S Standard Digital peristaltic pump | Cole Palmer, (Vernon Hills, IL) | ||
| PFA-coated platinum wire | A-M Systems, (Sequim, WA) | 773000 | 0.005” bare diameter, 0.008” coated diameter |
| Silicone elastomer | World Precision Instruments (Sarasota, FL) | SYLG184 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 |
参考文献
- Chow, S. L., et al. Role of Biomarkers for the prevention, assessment, and management of heart failure: A scientific statement from the American Heart Association. Circulation. 135 (22), 1054-1091 (2017).
- Goldstein, D. S. Adrenal responses to stress. Cellular and Molecular Neurobiology. 30 (8), 1433-1440 (2010).
- Ullman, B., Hulting, J., Lundberg, J. M. Prognostic value of plasma neuropeptide-Y in coronary care unit patients with and without acute myocardial infarction. European Heart Journal. 15 (4), 454-461 (1994).
- Farrell, D. M., et al. Angiotensin II modulates catecholamine release into interstitial fluid of canine myocardium in vivo. American Journal of Physiology-Heart and Circulatory Physiology. 281 (2), 813-822 (2001).
- Ardell, J. L., Foreman, R. D., Armour, J. A., Shivkumar, K. Cardiac sympathectomy and spinal cord stimulation attenuate reflex-mediated norepinephrine release during ischemia preventing ventricular fibrillation. JCI Insight. 4 (23), 131648(2019).
- Franco-Cereceda, A., Lundberg, J. M., Dahlof, C. Neuropeptide Y and sympathetic control of heart contractility and coronary vascular tone. Acta Physiologica Scandinavica. 124 (3), 361-369 (1985).
- Habecker, B. A., et al. Molecular and cellular neurocardiology: development, and cellular and molecular adaptations to heart disease. The Journal of Physiology. 594 (14), 3853-3875 (2016).
- Hoang, J. D., Salavatian, S., Yamaguchi, N., Swid, M. A., Vaseghi, M. Cardiac sympathetic activation circumvents high-dose beta blocker therapy in part through release of neuropeptide Y. JCI Insight. 5 (11), 135519(2020).
- Rigel, D. F. Effects of neuropeptides on heart rate in dogs: comparison of VIP, PHI, NPY, CGRP, and NT. American Journal of Physiology. 255, 311-317 (1988).
- Kluge, N., et al. Rapid measurement of cardiac neuropeptide dynamics by capacitive immunoprobe in the porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 320 (1), 66-76 (2021).
- Berggren, C., Bjarnason, B., Johansson, G. Capacitive biosensors. Electroanalysis. 13 (3), 173-180 (2001).
- Prodromidis, M. I. Impedimetric immunosensors-A review. Electrochimica Acta. 55 (14), 4227-4233 (2010).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318 (5849), 426-430 (2007).
- Leszczyszyn, D. J., et al. Secretion of catecholamines from individual adrenal medullary chromaffin cells. Journal of Neurochemistry. 56 (6), 1855-1863 (1991).
- Pihel, K., Schroeder, T. J., Wightman, R. M. Rapid and selective cyclic voltammetric measurements of epinephrine and norepinephrine as a method to measure secretion from single bovine adrenal medullary cells. Analytical Chemistry. 66 (24), 4532-4537 (1994).
- Jaffe, E. H., Marty, A., Schulte, A., Chow, R. H. Extrasynaptic vesicular transmitter release from the somata of substantia nigra neurons in rat midbrain slices. The Journal of Neuroscience. 18 (10), 3548-3553 (1998).
- Walsh, P. L., Petrovic, J., Wightman, R. M. Distinguishing splanchnic nerve and chromaffin cell stimulation in mouse adrenal slices with fast-scan cyclic voltammetry. American Journal of Physiology-Cell Physiology. 300 (1), 49-57 (2011).
- Wolfe, J. T., Wang, H., Perez-Reyes, E., Barrett, P. Q. Stimulation of recombinant Ca(v)3.2, T-type, Ca(2+) channel currents by CaMKIIgamma(C). The Journal of Physiology. 538, 343-355 (2002).
- Chan, S. A., et al. Fast in vivo detection of myocardial norepinephrine levels in the beating porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 318 (5), 1091-1099 (2020).
- Chow, R. H., von Rüden, L. Single-Channel Recording, Second Edition. Sakmann, B., Neher, E. , Plenum Press. 245-275 (1995).
- Ren, Y., et al. Facile, high efficiency immobilization of lipase enzyme on magnetic iron oxide nanoparticles via a biomimetic coating. BMC Biotechnology. 11, 63(2011).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved