Method Article
Mesure in vivo résolue dans le temps de la dynamique des neuropeptides par immunosonde capacitive dans le cœur porcin
Dans cet article
Résumé
Les méthodes immunochimiques établies pour mesurer les transmetteurs peptidiques in vivo reposent sur la microdialyse ou le prélèvement de fluide en vrac pour obtenir l’échantillon en vue d’une analyse hors ligne. Cependant, ceux-ci souffrent de limitations spatio-temporelles. Le présent protocole décrit la fabrication et l’application d’un biocapteur capacitif immunoprobe qui surmonte les limites des techniques existantes.
Résumé
La capacité de mesurer in vivo des biomarqueurs pertinents pour l’évaluation de la progression de la maladie est d’un grand intérêt pour les communautés scientifiques et médicales. La résolution des résultats obtenus à partir des méthodes actuelles de mesure de certains biomarqueurs peut prendre plusieurs jours ou semaines, car leur résolution peut être limitée à la fois spatialement et temporellement (p. ex., microdialyse du compartiment fluide du liquide interstitiel analysée par dosage immuno-enzymatique [ELISA], chromatographie liquide à haute performance [CLHP] ou spectrométrie de masse); ainsi, leur orientation du diagnostic et du traitement en temps opportun est perturbée. Dans la présente étude, une technique unique de détection et de mesure des transmetteurs peptidiques in vivo grâce à l’utilisation d’un biocapteur capacitif d’immunosonde (sonde CI) est rapportée. Le protocole de fabrication et la caractérisation in vitro de ces sondes sont décrits. Des mesures de la libération in vivo de neuropeptide Y évoqué par stimulation sympathique (NPY) sont fournies. La libération de NPY est corrélée à la libération sympathique de noradrénaline à titre de référence. Les données démontrent une approche pour la mesure rapide et localisée des neuropeptides in vivo. Les applications futures comprennent l’évaluation peropératoire en temps réel de la progression de la maladie et le déploiement mini-invasif de ces sondes par cathéter.
Introduction
Plusieurs méthodes chimiques de détection et de quantification des biomarqueurs sont couramment utilisées dans la chimie des protéines et le diagnostic clinique, en particulier dans les diagnostics de cancer et l’évaluation de la progression des maladies cardiovasculaires. Actuellement, des méthodes telles que la chromatographie liquide à haute performance (CLHP), le dosage immuno-enzymatique (ELISA) et la spectrométrie de masse reposent sur la collecte d’échantillons dans le compartiment vasculaire 1,2,3 par prélèvement de fluide en vrac ou dans le compartiment interstitiel par microdialyse. La microdialyse utilise un tube membranaire semi-perméable de longueur connue qui est placé dans une région d’intérêt. Le liquide de prélèvement est perfusé à travers le tube pendant plusieurs minutes4 pour prélever l’échantillon pour l’analyse5, limitant ainsi la résolution temporelle. De cette manière, les échantillons prélevés ne fournissent qu’une valeur moyenne dans le temps du microenvironnement local et sont limités par le taux de perfusion et la collecte d’un volume d’échantillon suffisant. De plus, ces méthodes nécessitent la mise en commun des données expérimentales et la moyenne des signaux; par conséquent, ils peuvent ne pas tenir compte de la variabilité entre les sujets. Il est important de noter que le temps écoulé entre le prélèvement de l’échantillon et l’analyse hors ligne ultérieure empêche une intervention clinique et thérapeutique immédiate.
Dans le présent protocole, l’utilisation d’un biocapteur capacitif d’immunosonde (sonde CI) pour la détection électrique résolue dans le temps de peptides bioactifs spécifiques est décrite. Le neuropeptide Y (NPY), libéré par les neurones sympathiques post-ganglionnaires qui innervent le système vasculaire, l’endocarde, les cardiomyocytes et les ganglions intracardiaques, est un transmetteur peptidique neuromodulateur majeur dans le système cardiovasculaire 6,7,8,9. La méthode présentée ici est conçue pour mesurer le NPY, et la faisabilité expérimentale est démontrée dans un modèle de cœur porcin. Cependant, cette approche s’applique à tout peptide bioactif pour lequel un anticorps sélectif est disponible10. Cette méthode repose sur la jonction capacitive entre une sonde en fil de platine et le fluide conducteur à la pointe fonctionnalisée11,12. Dans cette application, l’interaction a été médiée par un anticorps contre le neuropeptide cible (NPY), qui était lié à la pointe de l’électrode, interfaçant l’environnement fluide conducteur. Cette fonctionnalisation a été obtenue par électrodéposition de polydopamine réactive sur la pointe de la sonde de fil de platine10,13.
Lorsque la sonde fonctionnalisée par anticorps est placée in vivo dans une région d’intérêt, la libération endogène évoquée de NPY conduit à la liaison aux anticorps de piégeage sur la pointe de la sonde, et le fluide conducteur à la surface de l’électrode est déplacé par la protéine NPY. L’altération locale de l’environnement électrique entraîne le déplacement d’un fluide à haute mobilité et à haute diélectrique avec une molécule immobile chargée statiquement. Cela modifie l’interface électrode-fluide et, par conséquent, sa capacité, qui est mesurée comme un changement de courant de charge en réponse à un potentiel de commande de fonction pas à pas. Un potentiel de « réinitialisation » négatif est utilisé immédiatement après chaque cycle de mesure individuel pour repousser le NPY lié de l’anticorps par interaction électrostatique, éliminant ainsi les sites de liaison des anticorps pour les cycles de mesure suivants10. Cela permet effectivement de mesurer le NPY d’une manière résolue dans le temps. La technique unique d’IC surmonte les limites des méthodes immunochimiques basées sur la microdialyse décrites ci-dessus pour mesurer les niveaux de biomarqueurs dynamiques à partir d’une seule expérience sans mise en commun des données ni moyenne des signaux sur plusieurs expériences9, fournissant des données en temps quasi réel. De plus, la capacité d’adapter cette méthode à tout biomarqueur d’intérêt pour lequel il existe un anticorps approprié à une échelle localisée et résolue dans le temps fournit une avancée technique majeure dans la mesure immunochimique pour l’évaluation de la progression de la maladie et l’orientation des interventions thérapeutiques.
Le logiciel d’acquisition et d’analyse de données a été écrit sur mesure dans IGOR Pro (un environnement logiciel entièrement interactif). Un système de convertisseur analogique-numérique (A/N) émettait une tension de commande sous contrôle informatique et acquérait des données à partir d’un amplificateur personnalisé. L’amplificateur possédait certaines caractéristiques uniques. Ceux-ci comprenaient une résistance de rétroaction (commutable) pour chacun des quatre canaux d’acquisition, permettant de choisir des circuits de serrage de tension de rétroaction de 1 MOhm ou 10 MOhm pour intégrer la variabilité de l’électrode. Une unité de scène avec une seule tête et un circuit de terre / référence mutuel pour les quatre canaux d’acquisition a également été construite pour placer l’appareil près de la poitrine dans un seul module physique. Un réglage de résistance de rétroaction de 1 MOhm a été utilisé pour collecter toutes les données rapportées.
Les paramètres de filtre et de gain ont été télégraphiés à partir de l’amplificateur et enregistrés dans le fichier de données. Les données ont été filtrées à 1 kHz via un filtre Bessel analogique à 2 pôles numérisé à 10 kHz. La différence de potentiel entre la sonde et la solution conductrice environnante crée une couche capacitive de Helmholtz à l’extrémité de la sonde. La liaison du ligand à l’anticorps à l’extrémité de la sonde entraîne une altération de la charge locale et, par conséquent, une modification de la capacité de Helmholtz. Cette modification de la composante capacitive du circuit entraîne un changement dans l’amplitude de la charge injectée nécessaire pour amener la sonde au potentiel du protocole de tension à fonction pas à pas. Ainsi, la liaison d’un ligand spécifique à la sonde fonctionnalisée entraîne une altération de la mesure de la capacité de l’électrode sous la forme d’un changement du courant capacitif de crête.
Protocole
Toutes les expériences sur les animaux ont été approuvées par le Comité de recherche animale de l’Université de Californie à Los Angeles et réalisées conformément aux directives établies par le National Institutes of Health Guide for the Care and Use of Laboratory Animals (8e édition, 2011). Des porcs mâles adultes du Yorkshire d’environ 75 kg ont été utilisés pour des études in vivo 10.
1. Fabrication et fonctionnalisation de l’immunosonde capacitive
- Coupez un fil de platine recouvert de perfluoroalkyoxy (PFA) d’une longueur de 25 cm (voir tableau des matériaux) et dénudez environ 5 mm de revêtement PFA d’une extrémité à l’aide d’un scalpel, en prenant soin de ne pas couper dans le fil de platine.
- Insérez l’extrémité dénudée du fil de platine dans une broche de connecteur mâle plaquée or de 1 mm et sertissez les dents de la broche du connecteur autour de l’extrémité dénudée du fil de platine à l’aide d’une pince à aiguille (voir tableau des matériaux).
- Soudez le fil de platine à la broche du connecteur plaqué or. Veillez à ne pas utiliser une quantité excessive de soudure.
- Préparer la solution de dopamine en dissolvant 50 mg de dopamine HCl dans 50 mL de solution saline tamponnée au phosphate de 10 mM (PBS, pH 6,0) en remuant.
- Une fois que la dopamine est complètement dissoute, placez l’extrémité du fil de platine dans le récipient contenant le PBS supplémenté en dopamine fraîchement fabriqué. Branchez une broche de connecteur en or dans un canal de la scène de tête (voir Tableau des matériaux).
- Connectez l’électrode à disque AgCl (électrode de masse, voir Tableau des matériaux) au canal de masse dans la scène de tête. Placez le disque AgCl dans le récipient contenant du PBS supplémenté en dopamine et du fil de platine; veillez uniquement à immerger l’électrode du disque et non toute longueur du fil ou de la soudure. Connectez un shunt de fil dans les canaux de référence de la scène de tête avant de continuer.
- Ouvrez le logiciel interactif d’acquisition de données (voir Tableau des matériaux). Préparez un protocole de potentiel de commande d’électrodéposition en dents de scie avec les paramètres suivants : potentiel de départ = −0,6 V ; potentiel final = +0,65 V; taux de balayage = 0,04 V∙s-1; durée du dépôt = 420 s. Commencez le protocole de dépôt de polydopamines, en vous assurant que tous les fils sont correctement connectés.
- Après avoir terminé le dépôt de polydopamine, retirez la pastille de terre AgCl et l’extrémité du fil de platine du récipient, en prenant soin de ne pas perturber l’extrémité de l’électrode du fil de platine. Placer l’extrémité du fil dans un microtube contenant du PBS (pH 7,4) pendant 2 à 5 minutes pendant que la solution d’anticorps est préparée; assurez-vous que l’extrémité du fil n’entre pas en contact avec les côtés ou le fond du microtube.
REMARQUE: Une solution d’anticorps peut être fabriquée lors du dépôt de polydopamines; toutefois, le transfert du fil de platine du récipient contenant de la dopamine au microtube de PBS après le dépôt de polydopamines ne doit pas être ignoré. - Préparez la solution d’anticorps. Combiner l’anticorps d’intérêt avec le PBS (pH 7,4) dans un rapport de 1:20 dans un récipient d’une taille appropriée (p. ex., un microtube).
REMARQUE: L’anticorps monoclonal anti-NPY (voir tableau des matériaux) utilisé ici a été alicité à 1 mg / mL; un exemple de préparation d’anticorps ici serait 4 μL d’anticorps pour 76 μL de PBS. - Faire tremper l’extrémité déposée en polydopamine de l’électrode de platine dans une solution d’anticorps pendant au moins 2 h à température ambiante, en veillant à nouveau à ce que l’extrémité du fil de platine soit suspendue en solution et ne repose pas sur la surface intérieure du microtube.
REMARQUE: La mise en œuvre récente de cette technique a favorisé l’utilisation de l’électrode en fil de platine immédiatement après cette étape au lieu d’un stockage humide ou sec pour une utilisation ultérieure. - Après avoir trempé dans la solution d’anticorps, rincer brièvement l’embout de l’immunosonde capacitive nouvellement fonctionnalisée (sonde CI) dans le PBS (pH 7,4). La sonde est maintenant prête à l’emploi.
2. Configuration expérimentale pour la détection et la mesure in vitro du peptide
- Placez l’extrémité fonctionnelle de la sonde CI dans la chambre d’écoulement, en prenant soin de ne pas perturber la pointe de l’électrode de quelque manière que ce soit, car cela pourrait endommager la pointe sensorielle de la sonde.
REMARQUE: La chambre d’écoulement a été créée en versant de l’élastomère de silicone (voir tableau des matériaux) dans un plat de culture de 35 mm avec une charge d’espace ovoïde allongée au centre du plat. Après durcissement, la forme ovoïde est retirée de l’élastomère. La chambre est ensuite superfusée avec une solution saline tamponnée Tris (TBS) et permet un débit de 3 mL/min. Assurez-vous que l’entrée et la sortie maintiennent le niveau de fluide dans la chambre de manière à ce qu’aucune action de marée du superfusat ne soit observée. Le débit doit rester en place aussi longtemps que la sonde CI est utilisée. - Avant le premier test expérimental, effectuez une exécution standard TBS pour conditionner la sonde CI. Configurez le protocole de tension de commande suivant: potentiel de pas positif = +100 mV; potentiel de pas négatif = −5 mV; durée du pas = 20 ms; durée d’acquisition = 600 s.
REMARQUE: Il est important de permettre l’équilibrage de la sonde pendant la phase initiale du cycle du potentiel de commande avant l’acquisition des données. - Créez une solution du peptide d’intérêt en utilisant le même TBS pour maintenir la composition du superfusat. Mettre en place un système de collecteur où le superfusat peut être commuté entre TBS et TBS supplémenté en peptides sans introduire de bulles dans le système de tuyauterie ou la chambre d’écoulement.
REMARQUE : Le peptide NPY porcin synthétique (voir tableau des matériaux) a été utilisé dans la présente étude. - Configurez le protocole d’acquisition de données de détection peptidique à l’aide des paramètres standard TBS (voir étape 2.2.).
REMARQUE: Dans cette mise en œuvre, la durée de chaque test expérimental était de 360 s (TBS de 120 s, TBS supplémenté en peptides de 120 s, TBS de 120 s).
3. Adaptation de la sonde CI pour une utilisation in vivo
- Avant le dépôt de polydopamine (étape 1.7.), enfiler l’extrémité exposée de l’électrode en fil de platine à travers une aiguille hypodermique de 22 G, en laissant environ 2 mm au-delà de la pointe de l’aiguille. À l’aide d’une pince, pliez doucement l’extrémité de l’électrode en fil de platine, créant une « barbe » qui pend de l’extrémité de l’aiguille hypodermique.
- Retirez doucement l’aiguille de la pointe barbelée, en laissant suffisamment de fil à placer dans le récipient sans que l’aiguille n’entre en contact avec le liquide. Passez aux étapes 1.4.-1.11.
REMARQUE: Selon la configuration in vivo , il peut être nécessaire de couper une longueur de fil de platine de plus de 25 cm.
- Retirez doucement l’aiguille de la pointe barbelée, en laissant suffisamment de fil à placer dans le récipient sans que l’aiguille n’entre en contact avec le liquide. Passez aux étapes 1.4.-1.11.
- Avant de connecter la sonde CI à la scène de tête, assurez-vous que toute la configuration électrique est correctement mise à la terre. Ne pas le faire peut introduire des interférences électriques indésirables pendant les enregistrements expérimentaux.
- Anesthésier les animaux à la suite d’un rapport publié précédemment10.
- Effectuez une intervention chirurgicale pour exposer la région d’intérêt.
NOTE: Une sternotomie médiane a été réalisée dans la présente étude pour exposer le cœur. Veuillez consulter Kluge et al.10 pour plus de détails sur la chirurgie animale. - Retirez doucement la pointe fonctionnalisée du rinçage PBS (étape 1.11.), transférez l’aiguille hydodermique à la sonde C.I. barbelée et implantez-la doucement dans la région d’intérêt avant de brancher la broche du connecteur en or dans la scène de tête. Une fois implanté, retirez l’aiguille hypodermique en laissant l’électrode en place.
NOTE: Pour la présente étude, la sonde a été placée dans la paroi médiane latérale du myocarde ventriculaire gauche10. - Après avoir assuré une configuration électrique appropriée, procédez à des protocoles d’essai standard et expérimentaux (étape 2.2. et étape 2.4.).
- À la fin des expériences, euthanasier l’animal en suivant des techniques approuvées par l’établissement.
NOTE: Dans la présente étude, les animaux sont euthanasiés sous anesthésie profonde par induction de fibrillation ventriculaire10.
Résultats
Fabrication et caractérisation d’électrodes
Une immunosonde capacitive flexible (sondes CI) a été fabriquée et une image représentative est représentée à la figure 1A. Le potentiel de l’électrode a été défini par un circuit de serrage de tension contrôlé par ordinateur (Figure 1B), et l’électrode a été immergée dans une solution de polydopamine fabriquée dans du PBS. La polydopamine a été électrodéposée sur la pointe d’électrode conductrice13 pour la fonctionnalisation. Le potentiel de commande entraînait la tension de la sonde et l’injection de courant de serrage était mesurée. Le courant de serrage mesuré au cours d’un seul cycle de dépôt de polydopamine est illustré à la figure 1C. Immédiatement après le dépôt de polydopamines, l’extrémité de l’électrode revêtue a été trempée dans une solution d’anticorps d’intérêt (Figure 2A). Toutes les électrodes ont été utilisées immédiatement après ces étapes.
Mesure in vitro du NPY
La sonde fonctionnalisée par anticorps a été placée dans une chambre d’écoulement et entraînée par le circuit de serrage de tension avec un exemple de potentiel de commande, et le courant enregistré est montré (Figure 2B, C). Des enregistrements in vitro ont été réalisés dans une solution saline tamponnée tris (TBS, pH 7,4). La forme d’onde de la fonction pas comprend un potentiel de pas positif (partie bleue supérieure, figure 2B) et un potentiel de « réinitialisation » négatif (partie rouge inférieure, figure 2B). La portée de ce potentiel de commande mesure efficacement la liaison et évoque la répulsion ultérieure des peptides sans dégrader la sensibilité de la sonde10. Après la fabrication, chaque sonde a été testée pour le conditionnement initial selon le protocole de potentiel de commande. Il est à noter que les sondes qui ont renvoyé le profil de conditionnement initial le plus stable et le plus reproductible, défini comme une désintégration initiale plus petite suivie d’une ligne de base stable (Figure 2D), ont donné les mesures les plus reproductibles in vitro et in vivo. Ainsi, la mesure de la stabilisation initiale des sondes CI représente un point de contrôle qualité important pour déterminer l’adéquation de la sonde.
Évaluation de la sensibilité et de la stabilité des électrodes in vitro
Les immunosondes capacitives ont été placées dans une chambre d’écoulement et superfusées avec tbS complété par des concentrations connues de neuropeptide Y (NPY, 5-150 pM). Les courants capacitifs, mesurés comme l’amplitude maximale de la dépolarisation de +100 mV, ont été tracés par rapport au temps. Le flux de NPY dans la chambre d’écoulement a augmenté les courants capacitifs par rapport à la ligne de base (60 pM NPY, Figure 2E). Une démonstration de la réponse au courant dose-dépendant pour 5 pM et 75 pM NPY est illustrée à la figure 3A, et une courbe standard mesurée sous toutes les concentrations testées est fournie à la figure 3B. Les points de données de la figure 3B étaient adaptés à un seul ajustement exponentiel à des fins d’étalonnage.
Évaluation in vivo des profils de libération de neuropeptides avec sonde CI
Cette méthodologie a été appliquée à une préparation de cœur porcin afin d’évaluer son aptitude à une application biologique, comme décrit dans les publications précédentes10. En bref, une électrode CI a été enfilée à travers une aiguille hypodermique de 22 G et légèrement pliée en arrière pour créer une barbe (Figure 4A). L’aiguille et l’électrode barbelée ont été insérées dans le myocarde ventriculaire gauche d’un cœur porcin battant. L’aiguille guide hypodermique a ensuite été retirée de l’électrode, la laissant en place dans le myocarde. Le NPY interstitiel a été mesuré avant et en réponse à 60 s de stimulation ganglionnaire stellaire bilatérale (voir Kluge et al.10 pour une description complète des étapes de simulation). Une deuxième électrode de contrôle négative sans fonctionnalisation des anticorps a été placée à côté de la sonde NPY. Les courants de serrage immunosonde capacitifs obtenus ont été ajustés sur la courbe d’étalonnage in vitro pour fournir des changements évoqués et temporellement résolus dans les concentrations de NPY dans le microenvironnement cardiaque. Un NPY élevé a été observé lors de la stimulation du ganglion stellaire bilatéral et a été co-tracé avec les courants C.I témoins négatifs (Figure 4B, graphique supérieur). En parallèle, les niveaux interstitiels de noradrénaline (NE) ont également été mesurés par voltampérométrie cyclique à balayage rapide (FSCV), une technique précédemment utilisée pour évaluer la libération de catécholamine à partir de cellules isolées 14,15, de tissus isolés 16,17,18 et dans la préparation cardiaque porcine19. La noradrénaline est un neurotransmetteur sympathique co-libéré sous stimulation stellaire (Figure 4B, graphique inférieur) et montre une libération synchrone avec NPY, compatible avec une réponse sympathique évoquée. Ces données démontrent que l’approche IC peut être utilisée en même temps que d’autres méthodes de détection de biomarqueurs pour évaluer les microenvironnements interstitiels à haute fidélité temporelle. En bref, une électrode de capteur est implantée dans le myocarde adjacent à la sonde CI. Le potentiel de l’électrode est entraîné à travers les potentiels d’oxydation/réduction de l’émetteur par un circuit de serrage de tension. Par conséquent, lorsque le potentiel de l’électrode devient positif au potentiel d’oxydation du NE, le NE est alors oxydé en un dérivé de quinone. Les électrons sont générés par la réaction d’oxydation, mesurée comme un courant de compensation dans l’électrode serrée en tension, fournissant ainsi un indice de libération locale de NE. Le fait de ramener le potentiel de l’électrode à une polarisation négative diminue le produit de quinone pour régénérer la catécholamine20.
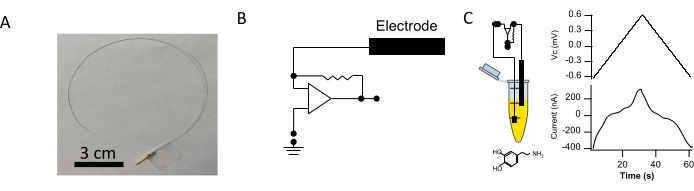
Figure 1 : Fabrication de la sonde CI à fil de platine. (A) Un fil de platine revêtu de PFA (25 cm de long et 127 μm de diamètre) a été utilisé pour créer chaque sonde CI. Environ 5 mm de revêtement PFA ont été dépouillés d’une extrémité du fil, qui a ensuite été soudé à une broche de connecteur mâle plaquée or (barre d’échelle = 3 cm). (B) Une représentation du circuit de serrage de tension utilisé pour appliquer le potentiel de commande est montrée. (C, à gauche) La pointe sensorielle de l’électrode a été immergée dans un tube contenant du PBS complété par 5 mM de dopamine. (C, à droite) La polydopamine a été électrodéposée sur la pointe sensorielle. L’électrodéposition a été réalisée par l’utilisation d’une forme d’onde en dents de scie avec les paramètres suivants : −0,6 V à +0,65 V à une vitesse de balayage de 0,04 V∙s-1. Le potentiel de commande (en haut) et le courant résultant (en bas) sont affichés. Veuillez cliquer ici pour voir une version agrandie de cette figure.
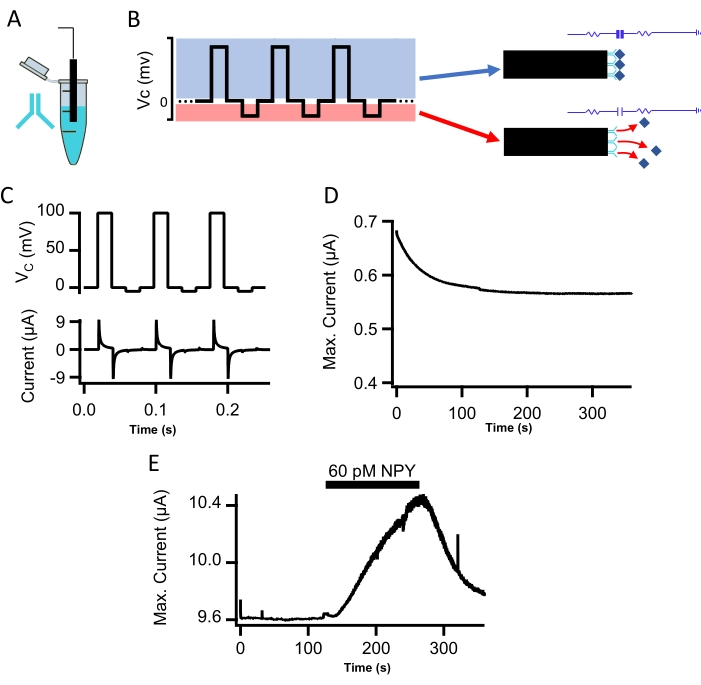
Figure 2 : Mesure in vitro du NPY avec la sonde CI. (A) Un fil fonctionnalisé en polydopamine a été immergé dans du PBS complété par un anticorps anti-NPY pendant 2 h. Cela a permis à l’anticorps de se lier de manière covalente à la surface de la polydopamine à l’extrémité de la sonde. (B) Le potentiel de commande de tension est affiché. Une étape positive dans le potentiel de commande sert à mesurer le courant d’injection nécessaire pour serrer la tension de la sonde (bleu) et permet la mesure du courant capacitif. L’étape du potentiel de commande négatif (potentiel de réinitialisation) efface le peptide lié de l’anticorps par répulsion électrostatique (rouge). (C) La forme d’onde de la commande de fonction pas (trace supérieure; phase de mesure de +100 mV à phase de réinitialisation de -5 mV, d’une durée de 20 ms chacune) permet une détection et une quantification itératives du peptide résolues dans le temps. Le potentiel de commande et l’enregistrement du courant résultant sous superfusion de la sonde avec TBS sont affichés (trace du bas). (D) L’équilibrage d’une sonde CI sur une période de 6 minutes est indiqué (voir étape 2.2.). (E) Le courant capacitif de crête mesuré par la sonde C.I. fonctionnalisée NPY est indiqué. La sonde CI a d’abord été superfusée avec une solution saline tamponnée Tris, puis une solution saline tamponnée Tris complétée par 60 pM NPY, puis suivie d’un lavage salin tamponNé Tris sans NPY. Veuillez cliquer ici pour voir une version agrandie de cette figure.
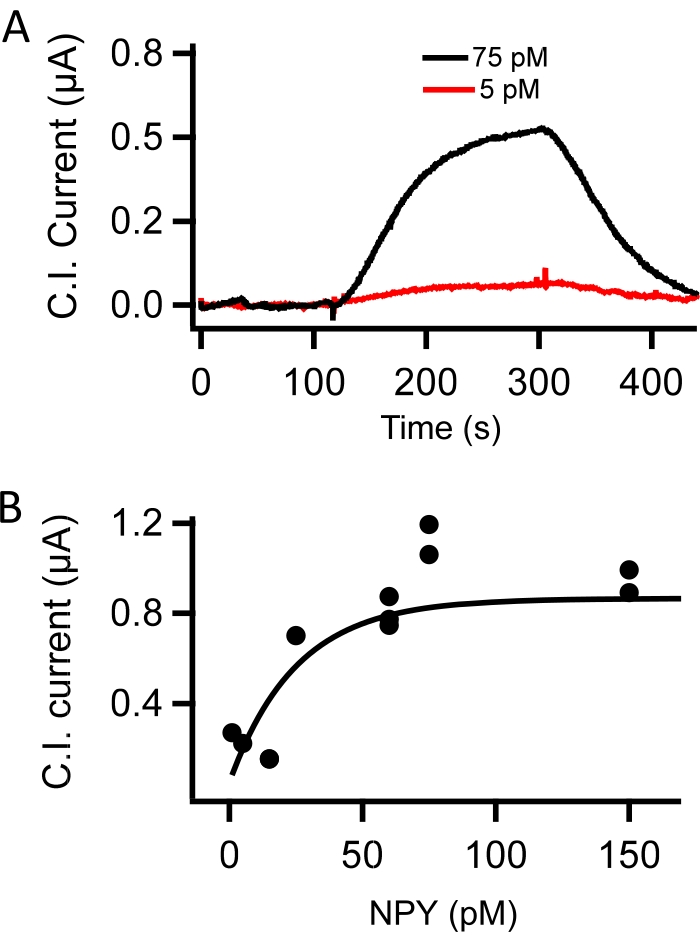
Figure 3 : Étalonnage in vitro de la sonde CI. (A) Les courants d’immunosonde capacitifs ont été mesurés à l’aide d’une sonde fonctionnalisée par anticorps NPY superfusée avec une solution saline tamponnée Tris. Le superfusat a été commuté pour contenir 5 pM (rouge) et 75 pM (noir) NPY. Ces enregistrements représentent un signal dépendant de la concentration sensible à un faible NPY picomole. (B) Les immunosondes capacitives fonctionnalisées avec l’anticorps NPY ont été testées pour la sensibilité dose-réponse. Les enregistrements ont été réalisés sous superfusion avec TBS; puis TBS complété par NPY (en pM): 1, 5, 15, 25, 60, 75 et 150, puis dans un lavage TBS sans NPY. Les valeurs de courant capacitif de crête (courant C.I.) ont été mesurées à l’état d’équilibre dans chaque concentration de NPY et tracées par rapport à la concentration de NPY. Les données dose-réponse ont été ajustées pour fournir une courbe standard pour l’étalonnage des données expérimentales (adapté de Kluge et al.10). Veuillez cliquer ici pour voir une version agrandie de cette figure.
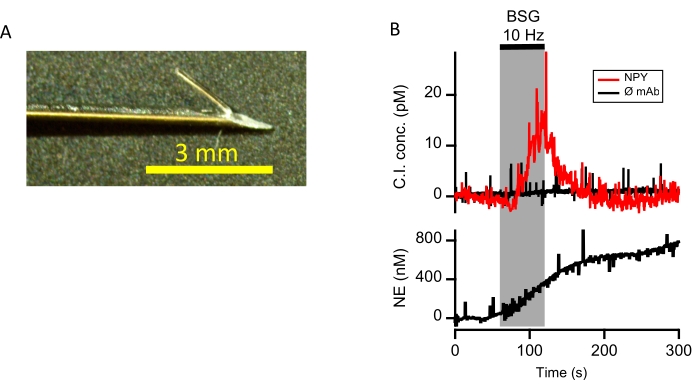
Figure 4 : Libération différentielle de NPY et de NE évoquée par stimulation stellaire bilatérale. (A) Une sonde IC avec une extrémité barbelée pour une utilisation in vivo est montrée (barre d’échelle = 3 mm). La sonde est enfilée à travers une aiguille hypodermique de 22 G et préparée comme mentionné à l’étape 1. et l’étape 2. Avant d’insérer le capteur, la pointe de la sonde est pliée pour créer une barbe et l’aiguille est retirée lors de l’insertion dans le myocarde, laissant ainsi une sonde barbelée ancrée dans la paroi myocardique du ventricule gauche. (B) Une sonde fonctionnalisée avec un anticorps anti-NPY a été insérée dans le myocarde ventriculaire gauche. Une sonde identique sans fonctionnalisation des anticorps (ø mAb) a été insérée immédiatement à côté et a servi de témoin négatif. Les courants d’IC ont été déterminés en réponse à une stimulation stellaire bilatérale à 10 Hz (BSG, largeur d’impulsion de 4 ms, seuil 2x). Les courants résultants ont été étalonnés par rapport à la courbe standard (figure 3B) et tracés (tracé supérieur). La libération de noradrénaline dans le même emplacement interstitiel a été mesurée à l’aide d’une voltampérométrie cyclique à balayage rapide (diagramme inférieur). Veuillez cliquer ici pour voir une version agrandie de cette figure.
Discussion
Le présent protocole décrit la fabrication et l’essai d’une immunosonde capacitive (sonde IC) capable de détecter et de mesurer des biomarqueurs d’intérêt in vitro et in vivo . La détection est réalisée en piégeant le biomarqueur à l’extrémité de l’électrode. L’événement de piégeage modifie la jonction capacitive entre une immunosonde capacitive à fil de platine et l’environnement de fluide conducteur environnant, mesurée comme un changement de courant de charge en réponse à un changement potentiel dans la sonde. Un protocole d’acquisition électrique unique a également été présenté qui permet de « réinitialiser » l’immunosonde entre les cycles de détection en repoussant électrostatiquement le biomarqueur piégé de la pointe de la sonde. Cette clairance des biomarqueurs permet des cycles de mesure ultérieurs, fournissant ainsi une mesure résolue dans le temps10. Dans cette mise en œuvre, la fabrication de la sonde comprenait l’électrodéposition d’une couche réactive de polydopamine à l’extrémité d’une fine électrode en fil de platine à laquelle un anticorps, élevé contre un biomarqueur d’intérêt, est lié de manière covalente. La dopamine et la polydopamine diffèrent en ce que la polydopamine contient un groupe fonctionnel de quinone. Les quinones agissent comme une cible pour l’attaque nucléophile par les amines primaires pour former une liaison covalente21. L’étape la plus cruciale de ce protocole est de manipuler le fil physique avec soin, car toute abrasion de la pointe fonctionnalisée peut rendre la sonde CI inutilisable.
De plus, il est essentiel d’assurer la stabilité de la sonde CI avant la mesure. Il peut être nécessaire d’exécuter plusieurs étalons de contrôle dans une solution saline tamponnée Tris avant les essais expérimentaux; ce faisant, l’expérimentateur recherche une courbe transitoire stable dans le courant résultant (par exemple, la figure 2D). Une pratique de fabrication cohérente peut minimiser ce signal transitoire, mais pas l’éliminer.
L’utilisation d’anticorps appropriés lors de l’étude de biomarqueurs d’intérêt est un autre facteur important lors de l’utilisation de cette technique. Dans cette mise en œuvre, les anticorps caractérisés comme applicables dans les techniques de détection de protéines non dénaturées sont les mieux adaptés (par exemple, IHC, ELISA, hybridation in situ ) plutôt que ceux destinés aux applications de protéines dénaturées (transfert western).
L’utilisation de méthodes immunochimiques dans le diagnostic clinique et l’évaluation de la progression de la maladie cardiaque, bien que bien établie1, repose principalement sur des échantillons provenant d’une biopsie tissulaire ou d’un prélèvement du compartiment vasculaire et, secondairement, sur la collecte de liquide interstitiel basée sur la microdialyse. Les échantillons peuvent nécessiter une préparation, une manipulation et une technologie spéciales pour fournir des résultats précis, qui, au mieux, fournissent une mesure du biomarqueur d’intérêt à une résolution temporelle de niveau minute 4,5. La méthodologie d’immunosonde capacitive décrite offre plusieurs avantages par rapport à de telles approches : 1) la fabrication et l’application de la sonde décrites peuvent être adaptées pour détecter de nombreux biomarqueurs uniques d’importance ; 2) les électrodes flexibles en fil de platine sont déployables dans le système vasculaire, dans les organes ou dans d’autres compartiments fluides; 3) le signal dérivé fournit des profils de libération dynamique résolus dans le temps de biomarqueurs d’intérêt chez des sujets individuels; 4) la sonde CI maintient la stabilité dans le temps; 5) une condition d’enregistrement stable peut être maintenue même dans les régions connaissant un degré élevé de contrainte mécanique ou de mouvement en raison de la flexibilité du capteur lui-même; et 6) la mobilité du système permet des lectures dynamiques de biomarqueurs d’intérêt à une résolution sans précédent in vitro, in vivo, sur le banc et finalement au chevet du patient.
La technique décrite ci-dessus surmonte les limites spatio-temporelles inhérentes à la détection et à la mesure traditionnelles de biomarqueurs basées sur la microdialyse. Cette méthodologie permet d’évaluer les profils de libération dynamiques sur une base quasi instantanée chez des sujets individuels sans avoir besoin de données regroupées ou de moyenne des signaux sur plusieurs expériences. L’utilisation de cette approche constitue une avancée technologique majeure dans la détection et la mesure de biomarqueurs pertinents pour guider la prise de décision clinique et l’intervention thérapeutique.
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts, financier ou autre.
Remerciements
Nous remercions le Dr Olu Ajijola (UCLA Cardiac Arrhythmia Center) pour son soutien expert pour les expériences in vivo . Ce travail a été soutenu par NIH U01 EB025138 (JLA, CS).
matériels
| Name | Company | Catalog Number | Comments |
| AgCl disc electrode | Warner Instruments (Holliston, MA) | 64-1307 | |
| Anti-NPY monoclonal antibody | Abcam, (Cambridge, MA) | ab112473 | |
| Custom multichannel amplifier/ 1 MΩ feedback resistor multichannel headstage | NPI Electronic, (Tamm, Germany) | NA | Based on NPI VA-10M multichannel amplifier |
| Dopamine HCl | Sigma Aldrich (St. Louis, MO) | H8502-10G | |
| Gold-plated male connector pin | AMP-TE Connectivity (Amplimite) | 6-66506-1 | |
| HEKA LIH 8+8 analog-to-digital/digital-to-analog device | HEKA Elektronik, (Holliston, MA) | NA | |
| Igor Pro data acquisition software, v. 7.08 | WaveMetrics, (Lake Oswego, OR) | Software driving command potential and data acquisition was custom written | |
| Masterflex L/S Standard Digital peristaltic pump | Cole Palmer, (Vernon Hills, IL) | ||
| PFA-coated platinum wire | A-M Systems, (Sequim, WA) | 773000 | 0.005” bare diameter, 0.008” coated diameter |
| Silicone elastomer | World Precision Instruments (Sarasota, FL) | SYLG184 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 |
Références
- Chow, S. L., et al. Role of Biomarkers for the prevention, assessment, and management of heart failure: A scientific statement from the American Heart Association. Circulation. 135 (22), 1054-1091 (2017).
- Goldstein, D. S. Adrenal responses to stress. Cellular and Molecular Neurobiology. 30 (8), 1433-1440 (2010).
- Ullman, B., Hulting, J., Lundberg, J. M. Prognostic value of plasma neuropeptide-Y in coronary care unit patients with and without acute myocardial infarction. European Heart Journal. 15 (4), 454-461 (1994).
- Farrell, D. M., et al. Angiotensin II modulates catecholamine release into interstitial fluid of canine myocardium in vivo. American Journal of Physiology-Heart and Circulatory Physiology. 281 (2), 813-822 (2001).
- Ardell, J. L., Foreman, R. D., Armour, J. A., Shivkumar, K. Cardiac sympathectomy and spinal cord stimulation attenuate reflex-mediated norepinephrine release during ischemia preventing ventricular fibrillation. JCI Insight. 4 (23), 131648(2019).
- Franco-Cereceda, A., Lundberg, J. M., Dahlof, C. Neuropeptide Y and sympathetic control of heart contractility and coronary vascular tone. Acta Physiologica Scandinavica. 124 (3), 361-369 (1985).
- Habecker, B. A., et al. Molecular and cellular neurocardiology: development, and cellular and molecular adaptations to heart disease. The Journal of Physiology. 594 (14), 3853-3875 (2016).
- Hoang, J. D., Salavatian, S., Yamaguchi, N., Swid, M. A., Vaseghi, M. Cardiac sympathetic activation circumvents high-dose beta blocker therapy in part through release of neuropeptide Y. JCI Insight. 5 (11), 135519(2020).
- Rigel, D. F. Effects of neuropeptides on heart rate in dogs: comparison of VIP, PHI, NPY, CGRP, and NT. American Journal of Physiology. 255, 311-317 (1988).
- Kluge, N., et al. Rapid measurement of cardiac neuropeptide dynamics by capacitive immunoprobe in the porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 320 (1), 66-76 (2021).
- Berggren, C., Bjarnason, B., Johansson, G. Capacitive biosensors. Electroanalysis. 13 (3), 173-180 (2001).
- Prodromidis, M. I. Impedimetric immunosensors-A review. Electrochimica Acta. 55 (14), 4227-4233 (2010).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318 (5849), 426-430 (2007).
- Leszczyszyn, D. J., et al. Secretion of catecholamines from individual adrenal medullary chromaffin cells. Journal of Neurochemistry. 56 (6), 1855-1863 (1991).
- Pihel, K., Schroeder, T. J., Wightman, R. M. Rapid and selective cyclic voltammetric measurements of epinephrine and norepinephrine as a method to measure secretion from single bovine adrenal medullary cells. Analytical Chemistry. 66 (24), 4532-4537 (1994).
- Jaffe, E. H., Marty, A., Schulte, A., Chow, R. H. Extrasynaptic vesicular transmitter release from the somata of substantia nigra neurons in rat midbrain slices. The Journal of Neuroscience. 18 (10), 3548-3553 (1998).
- Walsh, P. L., Petrovic, J., Wightman, R. M. Distinguishing splanchnic nerve and chromaffin cell stimulation in mouse adrenal slices with fast-scan cyclic voltammetry. American Journal of Physiology-Cell Physiology. 300 (1), 49-57 (2011).
- Wolfe, J. T., Wang, H., Perez-Reyes, E., Barrett, P. Q. Stimulation of recombinant Ca(v)3.2, T-type, Ca(2+) channel currents by CaMKIIgamma(C). The Journal of Physiology. 538, 343-355 (2002).
- Chan, S. A., et al. Fast in vivo detection of myocardial norepinephrine levels in the beating porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 318 (5), 1091-1099 (2020).
- Chow, R. H., von Rüden, L. Single-Channel Recording, Second Edition. Sakmann, B., Neher, E. , Plenum Press. 245-275 (1995).
- Ren, Y., et al. Facile, high efficiency immobilization of lipase enzyme on magnetic iron oxide nanoparticles via a biomimetic coating. BMC Biotechnology. 11, 63(2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon