Method Article
Misurazione in vivo risolta nel tempo della dinamica dei neuropeptidi mediante immunosonda capacitiva nel cuore suino
In questo articolo
Riepilogo
I metodi immunochimici stabiliti per misurare i trasmettitori peptidici in vivo si basano sulla microdialisi o sul prelievo di liquidi sfusi per ottenere il campione per l'analisi offline. Tuttavia, questi soffrono di limitazioni spazio-temporali. Il presente protocollo descrive la fabbricazione e l'applicazione di un biosensore immunoprobo capacitivo che supera i limiti delle tecniche esistenti.
Abstract
La capacità di misurare in vivo biomarcatori rilevanti per la valutazione della progressione della malattia è di grande interesse per la comunità scientifica e medica. La risoluzione dei risultati ottenuti dagli attuali metodi di misurazione di alcuni biomarcatori può richiedere diversi giorni o settimane per essere ottenuta, in quanto possono essere limitati nella risoluzione sia spazialmente che temporalmente (ad esempio, microdialisi del compartimento fluido del liquido interstiziale analizzato mediante saggio immunoassorbente enzimatico [ELISA], cromatografia liquida ad alte prestazioni [HPLC] o spettrometria di massa); pertanto, la loro guida di diagnosi e trattamento tempestivi viene interrotta. Nel presente studio, viene riportata una tecnica unica per rilevare e misurare i trasmettitori peptidici in vivo attraverso l'uso di un biosensore immunoprobo capacitivo (sonda CI). Vengono descritti il protocollo di fabbricazione e la caratterizzazione in vitro di queste sonde. Vengono fornite misurazioni del rilascio in vivo di neuropeptide Y (NPY) evocato dalla stimolazione simpatica. Il rilascio di NPY è correlato al rilascio simpatico di noradrenalina per riferimento. I dati dimostrano un approccio per la misurazione rapida e localizzata dei neuropeptidi in vivo. Le applicazioni future includono la valutazione intraoperatoria in tempo reale della progressione della malattia e l'implementazione minimamente invasiva basata su catetere di queste sonde.
Introduzione
Diversi metodi chimici per rilevare e quantificare i biomarcatori sono abitualmente utilizzati sia nella chimica delle proteine che nella diagnostica clinica, in particolare nelle diagnosi di cancro e nella valutazione della progressione delle malattie cardiovascolari. Attualmente, metodi come la cromatografia liquida ad alte prestazioni (HPLC), il saggio immunoassorbinte enzimatico (ELISA) e la spettrometria di massa si basano sulla raccolta di campioni dal compartimento vascolare 1,2,3 mediante prelievo di liquidi sfusi o dal compartimento interstiziale mediante microdialisi. La microdialisi impiega un tubo di membrana semipermeabile di lunghezza nota che viene collocato in una regione di interesse. Il fluido di raccolta viene perfuso attraverso la provetta per diversi minuti4 per raccogliere il campione per l'analisi5, limitando così la risoluzione temporale. In questo modo, i campioni raccolti forniscono solo un valore medio nel tempo del microambiente locale e sono limitati dalla velocità di perfusione e dalla raccolta di un volume di campione sufficiente. Inoltre, questi metodi richiedono la messa in comune di dati sperimentali e la media dei segnali; pertanto, potrebbero non riuscire a tenere conto della variabilità tra i soggetti. È importante sottolineare che il tempo tra la raccolta del campione e la successiva analisi offline preclude l'intervento clinico immediato e le terapie.
Nel presente protocollo, viene delineato l'uso di un biosensore immunoprobo capacitivo (sonda CI) per il rilevamento elettrico risolto nel tempo di specifici peptidi bioattivi. Il neuropeptide Y (NPY), rilasciato dai neuroni simpatici post-gangliari che innervano la vascolarizzazione, l'endocardio, i cardiomiociti e i gangli intracardiaci, è un importante trasmettitore peptidico neuromodulatore nel sistema cardiovascolare 6,7,8,9. Il metodo qui presentato è progettato per misurare l'NPY e la fattibilità sperimentale è dimostrata in un modello di cuore suino. Tuttavia, questo approccio si applica a qualsiasi peptide bioattivo per il quale è disponibile un anticorpo selettivo10. Questo metodo si basa sulla giunzione capacitiva tra una sonda a filo di platino e il fluido conduttivo sulla punta funzionalizzata11,12. In questa applicazione, l'interazione è stata mediata attraverso un anticorpo contro il neuropeptide bersaglio (NPY), che era legato alla punta dell'elettrodo, interfacciandosi con l'ambiente del fluido conduttivo. Questa funzionalizzazione è stata ottenuta attraverso l'elettrodeposizione di polidopamina reattiva sulla punta della sonda a filo di platino10,13.
Quando la sonda funzionalizzata con anticorpi viene posizionata in una regione di interesse in vivo, il rilascio di NPY endogeno evocato porta al legame con gli anticorpi di intrappolamento sulla punta della sonda e il fluido conduttivo sulla superficie dell'elettrodo viene spostato dalla proteina NPY. L'alterazione locale nell'ambiente elettrico provoca lo spostamento di fluido ad alta mobilità e ad alto dielettrico con una molecola immobile e caricata staticamente. Ciò altera l'interfaccia elettrodo-fluido e, quindi, la sua capacità, che viene misurata come un cambiamento nella corrente di carica in risposta a un potenziale di comando della funzione step.. Un potenziale di "reset" negativo viene impiegato immediatamente dopo ogni singolo ciclo di misurazione per respingere l'NPY legato dall'anticorpo attraverso l'interazione elettrostatica, eliminando così i siti di legame anticorpale per i successivi cicli di misurazione10. Ciò consente efficacemente la misurazione di NPY in modo risolto nel tempo. L'esclusiva tecnica CI supera i limiti dei metodi immunochimici basati sulla microdialisi sopra descritti per misurare i livelli di biomarcatori dinamici da un singolo esperimento senza pool di dati o media del segnale su diversi esperimenti9, fornendo dati in tempo quasi reale. Inoltre, la capacità di adattare questo metodo a qualsiasi biomarcatore di interesse per il quale esista un anticorpo appropriato su una scala risolta nel tempo e localizzata fornisce un importante progresso tecnico nella misurazione immunochimica per la valutazione della progressione della malattia e la guida di interventi terapeutici.
Il software per l'acquisizione e l'analisi dei dati è stato scritto su misura in IGOR Pro (un ambiente software completamente interattivo). Un sistema di convertitore analogico-digitale (A/D) emetteva una tensione di comando sotto il controllo del computer e acquisiva i dati da un amplificatore personalizzato. L'amplificatore possedeva alcune caratteristiche uniche. Questi includevano un resistore di feedback (commutabile) per ciascuno dei quattro canali di acquisizione, consentendo di scegliere circuiti di tensione di tensione di feedback da 1 MOhm o 10 MOhm per integrare la variabilità dell'elettrodo. È stata inoltre costruita un'unità di stadio con una singola testa e un circuito di terra/riferimento reciproco per tutti e quattro i canali di acquisizione per posizionare il dispositivo vicino al torace in un unico modulo fisico. Per raccogliere tutti i dati riportati è stata utilizzata un'impostazione del resistore di feedback da 1 MOhm.
Le impostazioni del filtro e del guadagno sono state telegrafate dall'amplificatore e registrate all'interno del file di dati. I dati sono stati filtrati a 1 kHz tramite un filtro Bessel analogico a 2 poli digitalizzato a 10 kHz. La differenza di potenziale tra la sonda e la soluzione conduttiva circostante crea uno strato capacitivo di Helmholtz sulla punta della sonda. Il legame del ligando all'anticorpo sulla punta della sonda provoca una carica locale alterata e, quindi, un cambiamento nella capacità di Helmholtz. Questo cambiamento nella componente capacitiva del circuito si traduce in uno spostamento dell'entità della carica iniettata necessaria per portare la sonda al potenziale nel protocollo di tensione step-function. Pertanto, il legame di un ligando specifico alla sonda funzionalizzata provoca un'alterazione nella misurazione della capacità dell'elettrodo come variazione della corrente capacitiva di picco.
Protocollo
Tutti gli esperimenti sugli animali sono stati approvati dall'Università della California, Los Angeles Animal Research Committee ed eseguiti seguendo le linee guida stabilite dal National Institutes of Health Guide for the Care and Use of Laboratory Animals (8a edizione, 2011). Suini maschi adulti dello Yorkshire di circa 75 kg sono stati utilizzati per studi in vivo 10.
1. Fabbricazione e funzionalizzazione di immunosonda capacitive
- Tagliare un filo di platino rivestito di perfluoroaltoxi (PFA) lungo 25 cm (vedi Tabella dei materiali) e rimuovere circa 5 mm di rivestimento in PFA da un'estremità usando un bisturi, facendo attenzione a non tagliare il filo di platino.
- Inserire l'estremità spogliata del filo di platino in un perno maschio da 1 mm placcato in oro e crimpare i denti del pin del connettore attorno all'estremità spogliata del filo di platino utilizzando pinze ad ago (vedere Tabella dei materiali).
- Saldare il filo di platino al pin del connettore placcato in oro. Fare attenzione a non utilizzare una quantità eccessiva di saldatura.
- Preparare la soluzione di dopamina sciogliendo 50 mg di dopamina HCl in 50 mL di 10 mM di soluzione salina tamponata con fosfato (PBS, pH 6.0) mescolando.
- Una volta che la dopamina è completamente disciolta, posizionare la punta del filo di platino nel recipiente contenente il PBS appena fatto con dopamina. Collegare un perno del connettore dorato a un canale dell'headstage (vedere Tabella dei materiali).
- Collegare l'elettrodo a disco AgCl (elettrodo di terra, vedere Tabella dei materiali) al canale di terra nell'headstage. Posizionare il disco AgCl nel recipiente contenente PBS integrato con dopamina e filo di platino; fare attenzione solo a immergere l'elettrodo del disco e non qualsiasi lunghezza del filo o della saldatura. Collegare uno shunt di filo nei canali di riferimento dell'headstage prima di procedere.
- Aprire il software di acquisizione dati interattivo (vedi Tabella dei materiali). Preparare un protocollo di potenziale di comando dell'elettrodeposizione a dente di sega con i seguenti parametri: potenziale di avvio = -0,6 V; potenziale finale = +0,65 V; velocità di scansione = 0,04 V∙s-1; durata della deposizione = 420 s. Iniziare il protocollo di deposizione di polidopamina, assicurandosi che tutti i fili siano collegati correttamente.
- Dopo aver completato la deposizione di polidopamina, rimuovere il pellet macinato AgCl e la punta del filo di platino dal recipiente, facendo attenzione a non disturbare la punta dell'elettrodo a filo di platino. Posizionare la punta del filo in un microtubo contenente PBS (pH 7,4) per 2-5 minuti mentre viene preparata la soluzione anticorpale; assicurarsi che la punta del filo non contatti i lati o il fondo del microtubo.
NOTA: La soluzione anticorpale può essere prodotta durante la deposizione di polidopamina; tuttavia, il trasferimento del filo di platino dal recipiente contenente dopamina al microtubo di PBS dopo la deposizione di polidopamina non deve essere saltato. - Preparare la soluzione anticorpale. Combinare l'anticorpo di interesse con PBS (pH 7,4) in un rapporto 1:20 in un recipiente di dimensioni appropriate (ad esempio, un microtubo).
NOTA: L'anticorpo monoclonale anti-NPY (vedi Tabella dei materiali) qui utilizzato è stato aliquotato a 1 mg/mL; un esempio di preparazione anticorpale qui sarebbe 4 μL di anticorpo contro 76 μL di PBS. - Immergere la punta depositata in polidopamina dell'elettrodo di platino in soluzione anticorpale per un minimo di 2 ore a temperatura ambiente, assicurandosi nuovamente che la punta del filo di platino sia sospesa in soluzione e non appoggiata sulla superficie interna del microtubo.
NOTA: La recente implementazione di questa tecnica ha favorito l'utilizzo dell'elettrodo a filo di platino immediatamente dopo questo passaggio invece di una conservazione a umido o a secco per un uso successivo. - Dopo l'immersione nella soluzione anticorpale, sciacquare brevemente la punta dell'immunosonda capacitiva (sonda CI) appena funzionalizzata in PBS (pH 7,4). La sonda è ora pronta per l'uso.
2. Configurazione sperimentale per il rilevamento e la misurazione in vitro del peptide
- Posizionare la punta funzionale della sonda CI nella camera di flusso, facendo attenzione a non disturbare in alcun modo la punta dell'elettrodo, in quanto ciò potrebbe danneggiare la punta sensoriale della sonda.
NOTA: La camera di flusso è stata creata versando l'elastomero siliconico (vedi Tabella dei materiali) in un piatto di coltura di 35 mm con un riempitivo di spazio ovoidale allungato al centro del piatto. Dopo l'indurimento, la forma ovoidale viene rimossa dall'elastomero. La camera viene quindi superfusa con soluzione salina Tris-buffered (TBS) e ha consentito una portata di 3 ml / min. Assicurarsi che l'afflusso e il deflusso mantengano il livello del fluido nella camera in modo tale che non si osservi l'azione di marea del superfusato. Il flusso deve rimanere in posizione per tutto il tempo in cui la sonda CI è in uso. - Prima del primo test sperimentale, eseguire un'esecuzione standard TBS per condizionare la sonda CI. Impostare il seguente protocollo di tensione di comando: potenziale di passo positivo = +100 mV; potenziale di passo negativo = −5 mV; durata del passo = 20 ms; durata dell'acquisizione = 600 s.
NOTA: è importante consentire l'equilibrio della sonda durante la fase iniziale del potenziale di comando ciclico prima dell'acquisizione dei dati. - Creare una soluzione del peptide di interesse utilizzando lo stesso TBS per mantenere la composizione del superfusato. Impostare un sistema di collettori in cui il superfusato può essere commutato tra TBS e TBS integrato con peptidi senza introdurre bolle nel sistema di tubazioni o nella camera di flusso.
NOTA: Il peptide SINTETICO NPY suino (vedi Tabella dei materiali) è stato utilizzato nel presente studio. - Impostare il protocollo di acquisizione dati con rilevamento peptidico utilizzando i parametri standard TBS (vedere il passaggio 2.2.).
NOTA: In questa implementazione, la durata di ogni test sperimentale è stata di 360 s (120 s TBS, 120 s TBS integrata con peptidi, 120 s TBS).
3. Adattamento della sonda CI per uso in vivo
- Prima della deposizione di polidopamina (fase 1.7.), infilare la punta esposta dell'elettrodo a filo di platino attraverso un ago ipodermico da 22 G, lasciando circa 2 mm oltre la punta dell'ago. Usando la pinza, piegare delicatamente la punta dell'elettrodo di filo di platino, creando una "barbetta" che pende dall'estremità dell'ago ipodermico.
- Estrarre delicatamente l'ago dalla punta spinata, lasciando abbastanza filo da posizionare nel recipiente senza che l'ago contatti il fluido. Procedere con i passaggi 1.4.-1.11.
NOTA: a seconda della configurazione in vivo , potrebbe essere necessario tagliare una lunghezza di filo di platino superiore a 25 cm.
- Estrarre delicatamente l'ago dalla punta spinata, lasciando abbastanza filo da posizionare nel recipiente senza che l'ago contatti il fluido. Procedere con i passaggi 1.4.-1.11.
- Prima di collegare la sonda CI all'headstage, assicurarsi che l'intera configurazione elettrica sia correttamente messa a terra. In caso contrario, potrebbero introdurre interferenze elettriche indesiderate durante le registrazioni sperimentali.
- Anestetizzare gli animali a seguito di un rapporto precedentemente pubblicato10.
- Eseguire un intervento chirurgico per esporre la regione di interesse.
NOTA: Nel presente studio è stata eseguita una sternotomia mediana per esporre il cuore. Si prega di consultare Kluge et al.10 per i dettagli sulla chirurgia animale. - Rimuovere delicatamente la punta funzionalizzata dal risciacquo PBS (passaggio 1.11.), inoltrare l'ago idodermico alla sonda C.I. spinata e impiantarla delicatamente nella regione di interesse prima di collegare il perno del connettore dorato alla testa. Una volta impiantato, prelevare l'ago ipodermico, lasciando l'elettrodo in posizione.
NOTA: Per il presente studio, la sonda è stata posizionata nella parete laterale centrale del miocardio ventricolare sinistro10. - Dopo aver assicurato una corretta configurazione elettrica, procedere con i protocolli di prova standard e sperimentali (passo 2.2. e passo 2.4.).
- Al termine degli esperimenti, eutanasizzare l'animale seguendo tecniche approvate istituzionalmente.
NOTA: Nel presente studio, gli animali vengono sottoposti a eutanasia in anestesia profonda tramite induzione della fibrillazione ventricolare10.
Risultati
Fabbricazione e caratterizzazione degli elettrodi
È stata fabbricata un'immunosonda capacitiva flessibile (sonde CI) e un'immagine rappresentativa è raffigurata nella Figura 1A. Il potenziale dell'elettrodo è stato impostato da un circuito di morsetto di tensione controllato da computer (Figura 1B) e l'elettrodo è stato immerso in una soluzione di polidopamina prodotta in PBS. La polidopamina è stata elettrodepositata sulla punta dell'elettrodo conduttivo13 per la funzionalizzazione. Il potenziale di comando ha guidato la tensione della sonda e l'iniezione di corrente di serraggio è stata misurata. La corrente di serraggio misurata durante un singolo ciclo di deposizione di polidopamina è mostrata nella Figura 1C. Immediatamente dopo la deposizione di polidopamina, la punta dell'elettrodo rivestito è stata immersa in una soluzione anticorpale di interesse (Figura 2A). Tutti gli elettrodi sono stati utilizzati immediatamente dopo questi passaggi.
Misurazione in vitro di NPY
La sonda funzionalizzata con anticorpi è stata collocata in una camera di flusso e azionata dal circuito a morsetto di tensione con un potenziale di comando di esempio, e viene mostrata la corrente registrata (Figura 2B,C). Le registrazioni in vitro sono state eseguite in soluzione salina tamponata con Tris (TBS, pH 7,4). La forma d'onda step-function comprende un potenziale di passo positivo (porzione blu superiore, Figura 2B) e un potenziale di "reset" negativo (porzione rossa inferiore, Figura 2B). La gamma di questo potenziale di comando misura efficacemente il legame ed evoca la successiva repulsione dei peptidi senza degradare la sensibilità della sonda10. Dopo la fabbricazione, ogni sonda è stata testata per il condizionamento iniziale sotto il protocollo del potenziale di comando. Va notato che le sonde che hanno restituito il profilo di condizionamento iniziale più stabile e riproducibile, definito come un decadimento iniziale più piccolo seguito da una linea di base stabile (Figura 2D), hanno fornito le misure più riproducibili in vitro e in vivo. Pertanto, la misurazione della stabilizzazione iniziale delle sonde CI rappresenta un importante punto di controllo della qualità per determinare l'idoneità della sonda.
Valutazione della sensibilità e della stabilità degli elettrodi in vitro
Le immunosonde capacitive sono state poste in una camera di flusso e sovrafuse con TBS integrata con concentrazioni note di neuropeptide Y (NPY, 5-150 pM). Le correnti capacitive, misurate come ampiezza di picco della depolarizzazione +100 mV, sono state tracciate contro il tempo. Il flusso di NPY nella camera di flusso ha aumentato le correnti capacitive rispetto al basale (60 pM NPY, Figura 2E). Una dimostrazione della risposta alla corrente dose-dipendente per 5 pM e 75 pM NPY è mostrata nella Figura 3A e una curva standard misurata sotto tutte le concentrazioni testate è fornita nella Figura 3B. I punti dati nella Figura 3B erano adatti a un singolo adattamento esponenziale ai fini della calibrazione.
Valutazione in vivo dei profili di rilascio di neuropeptidi con sonda CI
Questa metodologia è stata applicata a un preparato di cuore suino per valutarne l'idoneità all'applicazione biologica, come descritto nelle precedenti pubblicazioni10. In breve, un elettrodo CI è stato infilato attraverso un ago ipodermico da 22 G e piegato leggermente all'indietro per creare una barbetta (Figura 4A). L'ago e l'elettrodo spinato sono stati inseriti nel miocardio ventricolare sinistro di un cuore suino che batte. L'ago guida ipodermico è stato quindi prelevato dall'elettrodo, lasciandolo in posizione nel miocardio. L'NPY interstiziale è stato misurato prima e in risposta a 60 s di stimolazione ganglio stellata bilaterale (vedi Kluge et al.10 per una descrizione completa delle fasi di simulazione). Un secondo elettrodo di controllo negativo senza funzionalizzazione anticorpale è stato posizionato adiacente alla sonda NPY. Le correnti di bloccaggio immunosonda capacitivo ottenute sono state montate contro la curva di calibrazione in vitro per fornire cambiamenti temporalmente risolti ed evocati nelle concentrazioni di NPY nel microambiente cardiaco. L'NPY elevato è stato osservato durante la stimolazione del ganglio stellato bilaterale ed è stato co-tracciato con le correnti C.I di controllo negativo (Figura 4B, grafico superiore). Parallelamente, i livelli interstiziali di noradrenalina (NE) sono stati misurati anche mediante voltammetria ciclica a scansione rapida (FSCV), una tecnica precedentemente utilizzata per valutare il rilascio di catecolamina da cellule isolate14,15, tessuti isolati 16,17,18 e nella preparazione del cuore suino19. La noradrenalina è un neurotrasmettitore simpatico co-rilasciato sotto stimolazione stellata (Figura 4B, grafico inferiore) e mostra un rilascio sincrono con NPY, coerente con una risposta simpatica evocata. Questi dati dimostrano che l'approccio CI può essere utilizzato in concomitanza con altri metodi di rilevamento dei biomarcatori per valutare i microambienti interstiziali con alta fedeltà temporale. In breve, un elettrodo sensore viene impiantato nel miocardio adiacente alla sonda CI. Il potenziale dell'elettrodo viene guidato attraverso i potenziali di ossidazione/riduzione del trasmettitore da un circuito a morsetto di tensione. Pertanto, quando il potenziale dell'elettrodo diventa positivo al potenziale di ossidazione per NE, il NE viene quindi ossidato in un derivato chinone. Gli elettroni sono generati dalla reazione di ossidazione, misurata come corrente di compensazione nell'elettrodo bloccato in tensione, fornendo così un indice di rilascio locale di NE. Riportando il potenziale dell'elettrodo a una polarizzazione negativa diminuisce il prodotto chinone per rigenerare la catecolamina20.
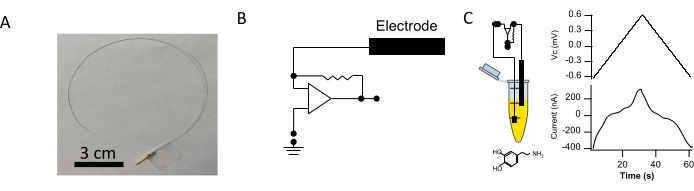
Figura 1: Fabbricazione della sonda CI a filo di platino. (A) Per creare ogni sonda CI è stato utilizzato un filo di platino rivestito in PFA (25 cm di lunghezza e 127 μm di diametro). Circa 5 mm di rivestimento in PFA sono stati rimossi da un'estremità del filo, che è stato poi saldato a un pin connettore maschio placcato in oro (barra della scala = 3 cm). (B) Viene mostrata una rappresentazione del circuito del morsetto di tensione utilizzato per applicare il potenziale di comando. (C, a sinistra) La punta sensoriale dell'elettrodo è stata immersa in un tubo contenente PBS integrato con 5 mM di dopamina. (C, a destra) La polidopamina è stata elettrodepositata sulla punta sensoriale. L'elettrodeposizione è stata eseguita mediante l'uso di una forma d'onda a dente di sega con i seguenti parametri: da -0,6 V a +0,65 V ad una velocità di scansione di 0,04 V∙s-1. Vengono mostrati il potenziale di comando (in alto) e la corrente risultante (in basso). Fare clic qui per visualizzare una versione più grande di questa figura.
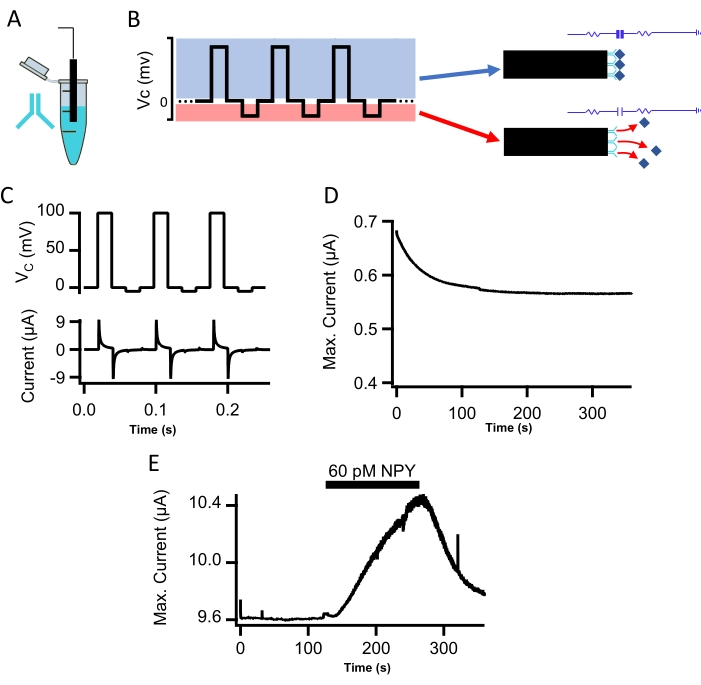
Figura 2: Misurazione in vitro di NPY con la sonda CI. (A) Un filo funzionalizzato con polidopamina è stato immerso in PBS integrato con un anticorpo anti-NPY per 2 ore. Ciò ha permesso all'anticorpo di legarsi covalentemente alla superficie della polidopamina sulla punta della sonda. (B) Viene mostrato il potenziale di comando della tensione. Un passo positivo nel potenziale di comando serve a misurare la corrente di iniezione necessaria per bloccare la tensione della sonda (blu) e consente la misurazione della corrente capacitiva. Il passo del potenziale di comando negativo (potenziale di reset) cancella il peptide legato dall'anticorpo tramite repulsione elettrostatica (rosso). (C) La forma d'onda del comando della funzione step (traccia superiore; fase di misura da +100 mV a -5 mV di reset, ciascuna della durata di 20 ms) fornisce il rilevamento iterativo risolto nel tempo e la quantificazione del peptide. Viene mostrato il potenziale di comando e la conseguente registrazione di corrente sotto sovrafusione della sonda con TBS (traccia in basso). (D) Viene mostrato l'equilibrio di una sonda CI su un periodo di 6 minuti (cfr. punto 2.2.). (E) Viene mostrata la corrente capacitiva di picco misurata dalla sonda C.I. funzionalizzata NPY. La sonda CI è stata sovrafusa prima con soluzione salina tamponata con Tris, poi con soluzione salina tamponata con 60 pM NPY, e poi seguita da un lavaggio salino Tris-buffered privo di NPY. Fare clic qui per visualizzare una versione più grande di questa figura.
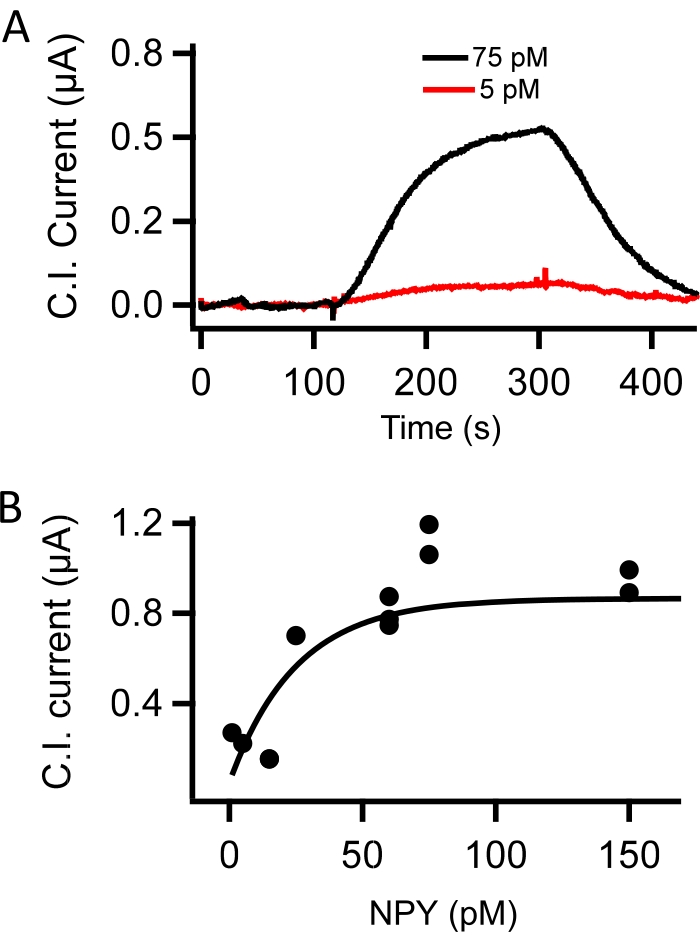
Figura 3: Calibrazione in vitro della sonda CI. (A) Le correnti immunosonda capacitive sono state misurate con una sonda funzionalizzata con anticorpi NPY superfusa con soluzione salina tamponata con Tris. Il superfusato è stato commutato per contenere 5 pM (rosso) e 75 pM (nero) NPY. Queste registrazioni rappresentano un segnale dipendente dalla concentrazione sensibile al basso NPY picomole. (B) Le immunosonde capacitive funzionalizzate con l'anticorpo NPY sono state testate per la sensibilità dose-risposta. Le registrazioni sono state eseguite sotto superfusione con TBS; quindi TBS integrato con NPY (in pM): 1, 5, 15, 25, 60, 75 e 150, e poi in un lavaggio TBS senza NPY. I valori di corrente capacitiva di picco (C.I. Current) sono stati misurati a uno stato stazionario in ciascuna concentrazione di NPY e tracciati rispetto alla concentrazione di NPY. I dati dose-risposta sono stati adattati per fornire una curva standard per la calibrazione dei dati sperimentali (adattati da Kluge et al.10). Fare clic qui per visualizzare una versione più grande di questa figura.
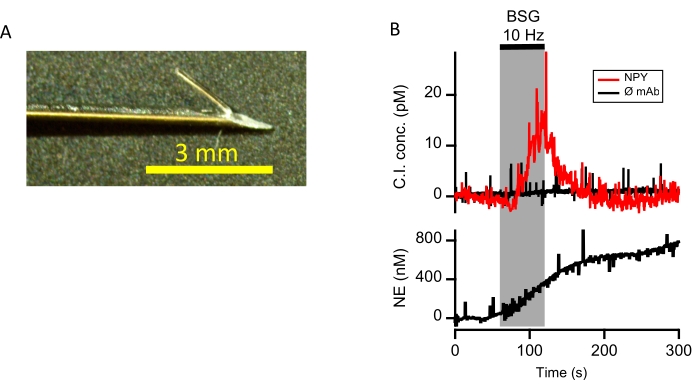
Figura 4: Rilascio differenziale di NPY e NE evocato dalla stimolazione stellata bilaterale. (A) Viene mostrata una sonda CI con un'estremità spinata per uso in vivo (barra di scala = 3 mm). La sonda viene infilata attraverso un ago ipodermico da 22 G e preparata come indicato nel passaggio 1. e passaggio 2. Prima di inserire il sensore, la punta della sonda viene piegata per creare una barbetta e l'ago viene ritirato al momento dell'inserimento nel miocardio, lasciando così una sonda spinata ancorata nella parete miocardica del ventricolo sinistro. (B) Una sonda funzionalizzata con un anticorpo anti-NPY è stata inserita nel miocardio ventricolare sinistro. Una sonda identica senza funzionalizzazione anticorpale (ø mAb) è stata inserita immediatamente adiacente e fungeva da controllo negativo. Le correnti CI sono state determinate in risposta alla stimolazione stellata bilaterale a 10 Hz (BSG, larghezza di impulso di 4 ms, soglia 2x). Le correnti risultanti sono state calibrate rispetto alla curva standard (Figura 3B) e tracciate (grafico superiore). Il rilascio di noradrenalina nella stessa posizione interstiziale è stato misurato utilizzando la voltammetria ciclica a scansione rapida (grafico inferiore). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Il presente protocollo descrive la produzione e la sperimentazione di un'immunosonda capacitiva (sonda CI) in grado di rilevare e misurare biomarcatori di interesse sia in vitro che in vivo . Il rilevamento si ottiene intrappolando il biomarcatore sulla punta dell'elettrodo. L'evento di intrappolamento altera la giunzione capacitiva tra un'immunosonda capacitiva a filo di platino e l'ambiente fluido conduttivo circostante, misurato come un cambiamento nella corrente di carica in risposta a un potenziale spostamento nella sonda. È stato inoltre presentato un protocollo di acquisizione elettrica unico che consente di "resettare" l'immunosonda tra i cicli di rilevamento respingendo elettrostaticamente il biomarcatore intrappolato dalla punta della sonda. Questa clearance del biomarcatore consente cicli di misurazione successivi, fornendo così una misura risolta nel tempo10. In questa implementazione, la produzione della sonda includeva l'elettrodeposizione di uno strato reattivo alla polidopamina sulla punta di un sottile elettrodo a filo di platino a cui un anticorpo, sollevato contro un biomarcatore di interesse, è legato covalentemente. La dopamina e la polidopamina differiscono in quanto la polidopamina contiene un gruppo funzionale chinone. I chinoni agiscono come bersaglio per l'attacco nucleofilo da parte delle ammine primarie per formare un legame covalente21. Il passo più cruciale in questo protocollo è la gestione del filo fisico con cura, poiché qualsiasi abrasione della punta funzionalizzata può rendere inutilizzabile la sonda CI.
Inoltre, è essenziale garantire la stabilità della sonda CI prima della misurazione. Potrebbe essere necessario eseguire diversi standard di controllo in soluzione salina tamponata con Tris prima delle prove sperimentali; in tal modo, lo sperimentatore è alla ricerca di una curva transitoria stabile nella corrente risultante (ad esempio, Figura 2D). Una pratica di fabbricazione coerente può ridurre al minimo questo segnale transitorio ma non eliminarlo.
L'uso di anticorpi appropriati quando si studiano i biomarcatori di interesse è un altro fattore importante quando si utilizza questa tecnica. In questa implementazione, gli anticorpi caratterizzati come applicabili nelle tecniche che rilevano proteine non denaturate sono i più adatti (ad esempio, IHC, ELISA, ibridazione in situ ) piuttosto che quelli per applicazioni proteiche denaturate (western blot).
L'uso di metodi immunochimici nella diagnosi clinica e nella valutazione della progressione della malattia cardiaca, sebbene ben consolidato1, si basa principalmente su campioni derivati da una biopsia tissutale o dal campionamento del compartimento vascolare e, secondariamente, sulla raccolta di liquido interstiziale basata sulla microdialisi. I campioni possono richiedere una preparazione, una manipolazione e una tecnologia speciali per fornire risultati accurati, che, nella migliore delle ipotesi, forniscono una misura del biomarcatore di interesse a livello di minutorisoluzione temporale 4,5. La metodologia dell'immunosonda capacitiva descritta offre diversi vantaggi rispetto a tali approcci: 1) la produzione e l'applicazione della sonda descritte possono essere adattate per rilevare molti biomarcatori unici di significato; 2) gli elettrodi flessibili a filo di platino sono dispiegabili nella vascolarizzazione, negli organi o in altri compartimenti fluidi; 3) il segnale derivato fornisce profili di rilascio dinamico risolti nel tempo di biomarcatori di interesse in singoli soggetti; 4) la sonda CI mantiene la stabilità nel tempo; 5) una condizione di registrazione stabile può essere mantenuta anche in regioni che presentano un alto grado di stress meccanico o di movimento grazie alla flessibilità del sensore stesso; e 6) la mobilità del sistema consente letture dinamiche di biomarcatori di interesse a risoluzione senza precedenti in vitro, in vivo, sul banco e, infine, al capezzale.
La tecnica sopra descritta supera i limiti spazio-temporali inerenti al rilevamento e alla misurazione dei biomarcatori tradizionali basati sulla microdialisi. Questa metodologia può valutare i profili di rilascio dinamico su base quasi istantanea in singoli soggetti senza la necessità di dati in pool o di media del segnale su diversi esperimenti. L'impiego di questo approccio funge da importante progresso tecnologico nel rilevare e misurare i biomarcatori rilevanti per guidare il processo decisionale clinico e l'intervento terapeutico.
Divulgazioni
Gli autori non dichiarano conflitti di interesse, finanziari o di altro tipo.
Riconoscimenti
Ringraziamo il Dr. Olu Ajijola (UCLA Cardiac Arrhythmia Center) per il supporto di esperti per gli esperimenti in vivo . Questo lavoro è stato supportato da NIH U01 EB025138 (JLA, CS).
Materiali
| Name | Company | Catalog Number | Comments |
| AgCl disc electrode | Warner Instruments (Holliston, MA) | 64-1307 | |
| Anti-NPY monoclonal antibody | Abcam, (Cambridge, MA) | ab112473 | |
| Custom multichannel amplifier/ 1 MΩ feedback resistor multichannel headstage | NPI Electronic, (Tamm, Germany) | NA | Based on NPI VA-10M multichannel amplifier |
| Dopamine HCl | Sigma Aldrich (St. Louis, MO) | H8502-10G | |
| Gold-plated male connector pin | AMP-TE Connectivity (Amplimite) | 6-66506-1 | |
| HEKA LIH 8+8 analog-to-digital/digital-to-analog device | HEKA Elektronik, (Holliston, MA) | NA | |
| Igor Pro data acquisition software, v. 7.08 | WaveMetrics, (Lake Oswego, OR) | Software driving command potential and data acquisition was custom written | |
| Masterflex L/S Standard Digital peristaltic pump | Cole Palmer, (Vernon Hills, IL) | ||
| PFA-coated platinum wire | A-M Systems, (Sequim, WA) | 773000 | 0.005” bare diameter, 0.008” coated diameter |
| Silicone elastomer | World Precision Instruments (Sarasota, FL) | SYLG184 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 | |
| Synthetic porcine NPY peptide | Bachem (Torrance, CA) | 4011654 |
Riferimenti
- Chow, S. L., et al. Role of Biomarkers for the prevention, assessment, and management of heart failure: A scientific statement from the American Heart Association. Circulation. 135 (22), 1054-1091 (2017).
- Goldstein, D. S. Adrenal responses to stress. Cellular and Molecular Neurobiology. 30 (8), 1433-1440 (2010).
- Ullman, B., Hulting, J., Lundberg, J. M. Prognostic value of plasma neuropeptide-Y in coronary care unit patients with and without acute myocardial infarction. European Heart Journal. 15 (4), 454-461 (1994).
- Farrell, D. M., et al. Angiotensin II modulates catecholamine release into interstitial fluid of canine myocardium in vivo. American Journal of Physiology-Heart and Circulatory Physiology. 281 (2), 813-822 (2001).
- Ardell, J. L., Foreman, R. D., Armour, J. A., Shivkumar, K. Cardiac sympathectomy and spinal cord stimulation attenuate reflex-mediated norepinephrine release during ischemia preventing ventricular fibrillation. JCI Insight. 4 (23), 131648(2019).
- Franco-Cereceda, A., Lundberg, J. M., Dahlof, C. Neuropeptide Y and sympathetic control of heart contractility and coronary vascular tone. Acta Physiologica Scandinavica. 124 (3), 361-369 (1985).
- Habecker, B. A., et al. Molecular and cellular neurocardiology: development, and cellular and molecular adaptations to heart disease. The Journal of Physiology. 594 (14), 3853-3875 (2016).
- Hoang, J. D., Salavatian, S., Yamaguchi, N., Swid, M. A., Vaseghi, M. Cardiac sympathetic activation circumvents high-dose beta blocker therapy in part through release of neuropeptide Y. JCI Insight. 5 (11), 135519(2020).
- Rigel, D. F. Effects of neuropeptides on heart rate in dogs: comparison of VIP, PHI, NPY, CGRP, and NT. American Journal of Physiology. 255, 311-317 (1988).
- Kluge, N., et al. Rapid measurement of cardiac neuropeptide dynamics by capacitive immunoprobe in the porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 320 (1), 66-76 (2021).
- Berggren, C., Bjarnason, B., Johansson, G. Capacitive biosensors. Electroanalysis. 13 (3), 173-180 (2001).
- Prodromidis, M. I. Impedimetric immunosensors-A review. Electrochimica Acta. 55 (14), 4227-4233 (2010).
- Lee, H., Dellatore, S. M., Miller, W. M., Messersmith, P. B. Mussel-inspired surface chemistry for multifunctional coatings. Science. 318 (5849), 426-430 (2007).
- Leszczyszyn, D. J., et al. Secretion of catecholamines from individual adrenal medullary chromaffin cells. Journal of Neurochemistry. 56 (6), 1855-1863 (1991).
- Pihel, K., Schroeder, T. J., Wightman, R. M. Rapid and selective cyclic voltammetric measurements of epinephrine and norepinephrine as a method to measure secretion from single bovine adrenal medullary cells. Analytical Chemistry. 66 (24), 4532-4537 (1994).
- Jaffe, E. H., Marty, A., Schulte, A., Chow, R. H. Extrasynaptic vesicular transmitter release from the somata of substantia nigra neurons in rat midbrain slices. The Journal of Neuroscience. 18 (10), 3548-3553 (1998).
- Walsh, P. L., Petrovic, J., Wightman, R. M. Distinguishing splanchnic nerve and chromaffin cell stimulation in mouse adrenal slices with fast-scan cyclic voltammetry. American Journal of Physiology-Cell Physiology. 300 (1), 49-57 (2011).
- Wolfe, J. T., Wang, H., Perez-Reyes, E., Barrett, P. Q. Stimulation of recombinant Ca(v)3.2, T-type, Ca(2+) channel currents by CaMKIIgamma(C). The Journal of Physiology. 538, 343-355 (2002).
- Chan, S. A., et al. Fast in vivo detection of myocardial norepinephrine levels in the beating porcine heart. American Journal of Physiology-Heart and Circulatory Physiology. 318 (5), 1091-1099 (2020).
- Chow, R. H., von Rüden, L. Single-Channel Recording, Second Edition. Sakmann, B., Neher, E. , Plenum Press. 245-275 (1995).
- Ren, Y., et al. Facile, high efficiency immobilization of lipase enzyme on magnetic iron oxide nanoparticles via a biomimetic coating. BMC Biotechnology. 11, 63(2011).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneEsplora altri articoli
This article has been published
Video Coming Soon