Method Article
実験的自己免疫性脳脊髄炎の誘導と多様な評価指標
* これらの著者は同等に貢献しました
要約
本プロトコルは、ミエリンオリゴデンドロサイト糖タンパク質を使用し、臨床スコアリングシステムを使用して疾患プロセスをモニタリングするマウスモデルにおける実験的自己免疫性脳脊髄炎の誘発を記載しています。実験的自己免疫性脳脊髄炎関連症状は、マウス大腿骨マイクロコンピューター断層撮影分析とオープンフィールドテストを使用して分析され、疾患プロセスを包括的に評価します。
要約
多発性硬化症(MS)は、炎症性浸潤、脱髄、および軸索損傷を特徴とする中枢神経系(CNS)の典型的な自己免疫疾患です。現在、MSを完全に治癒するための対策はありませんが、疾患の進行を制御および緩和するために、複数の疾患修飾療法(DMT)が利用可能です。実験的自己免疫性脳脊髄炎(EAE)とMS患者のCNS病理学的特徴の間には有意な類似点がある。EAEは、MS薬の有効性を判断し、MS疾患の新しい治療法の開発を探索するための代表的なモデルとして広く使用されています。マウスにおけるEAEの能動的誘導は、安定かつ再現性のある効果を有し、自己免疫性神経炎症に対する薬物または遺伝子の効果を研究するのに特に適している。C57BL/6Jマウスにミエリンオリゴデンドロサイト糖タンパク質(MOG35-55)を免疫する方法と、臨床スコアリングシステムを用いた疾患症状の日々の評価が主に共有されています。多様な臨床症状を伴うMSの複雑な病因を考えると、既存の臨床スコアリングシステムは疾患治療の評価を満たすことができません。単一の介入の欠点を回避するために、MS患者の不安様気分および骨粗鬆症の臨床症状に基づいてEAEを評価するための新しい指標が作成され、MS治療のより包括的な評価が提供されます。
概要
自己免疫疾患は、それ自体の抗原に対する免疫系の免疫応答によって引き起こされる一連の障害であり、組織の損傷または機能障害を引き起こします1。多発性硬化症(MS)は、中枢神経系(CNS)における多発ニューロパチーの慢性自己免疫疾患であり、炎症性浸潤、脱髄、およびニューロン軸索変性を特徴とする2,3。現在、MSは世界中で250万人もの人々に影響を与えており、主に20〜40歳の若者と中年の人々であり、家族や社会のバックボーンであることがよくあります。これは、家族や社会に多大な影響と害をもたらしました2,4。
MSは、多様で複雑な臨床症状を伴う多因子性疾患です。炎症性浸潤および脱髄を特徴とする古典的な神経障害に加えて、MSはしばしば視覚障害、四肢ジスキネジア、および認知および感情障害を示します5,6,7。MS患者が適切で正しい治療を受けない場合、その半数は20年後に車椅子で生活し、半数近くが抑うつ症状や不安症状を経験し、一般集団よりもはるかに高いレベルの自殺念慮につながります8,9。
長い研究期間にもかかわらず、MSの病因はとらえどころのないままであり、MSの病因はまだ解明されていません。MSの動物モデルは、げっ歯類とヒトの免疫系の間に大きな違いがあるにもかかわらず、同時にいくつかの基本原則を共有しながら、疾患の発症と新しい治療アプローチを探求するためのテストツールとして機能することを可能にしました。実験的自己免疫性脳脊髄炎(EAE)は現在、MSを研究するための理想的な動物モデルであり、ミエリンタンパク質からの自己抗原免疫を使用して感受性マウスのCNS成分に対する自己免疫を誘導し、完全なフロイントアジュバント(CFA)と百日咳毒素(PTX)を加えて体液性免疫応答を強化します。遺伝的背景および免疫抗原に応じて、MS10、11、12の様々な臨床形態を模倣するために、急性、再発寛解、または慢性を含む異なる疾患プロセスが得られる。EAEモデルの構築に一般的に使用される関連する免疫原は、ミエリン塩基性タンパク質(MBP)、プロテオリピドタンパク質(PLP)、またはミエリン希突起膠細胞糖タンパク質(MOG)などの自己CNSタンパク質に由来します。MBPまたはPLP免疫SJL/Lマウスは再発寛解型経過を発症し、MOGはC57BL/6マウスにおいて慢性進行性EAEを引き起こす11,12,13。
疾患修飾療法(DMT)の主な目的は、疾患の症状を最小限に抑え、機能を改善することです6。MSを緩和するために臨床的に使用されている薬剤はいくつかありますが、MSを完全に治癒するための薬剤はまだ使用されておらず、相乗的治療の必要性が明らかになりました。現在、トランスジェニックマウスの構築にはC57BL/6マウスが最も一般的に使用されており、この研究では、C57BL/6JマウスのMOG35-55 によって誘導されたEAEモデルを5点スケールで使用して、疾患の進行を監視しました。EAEモデルはまた、不安のような気分や骨量減少、および広く知られている脱髄病変に苦しんでいます。ここでは、オープンフィールドテストとマイクロコンピュータ断層撮影(マイクロCT)分析を用いてEAEの症状を多角的に評価する方法についても説明します。
プロトコル
同済大学の動物管理委員会は現在の作業を承認し、すべての動物飼育ガイドラインに従いました。8〜12週齢の雄または雌のC57BL / 6Jマウスを実験に使用しました。実験群では年齢と性別が同じであることが確認された。そうでなければ、病気に対する感受性が影響を受けました。マウスを、一定の条件(室温23±1°C、湿度50%±10%)で12時間の明暗サイクルを交互に行い、マウスの餌と水を自由に利用できる特定の病原体のない環境に収容しました。
1. MOG35-55 エマルジョンの調製
- 熱不活化凍結乾燥結核菌(MTB、H37Ra)を加えてフロイントアジュバント(それ自体に1 mg/mLの熱不活化MTB、H37Raを含む)を完成させ、最終的なMTB濃度は5 mg/mLになります( 材料の表を参照)。
注意: 操作全体はバイオセーフティキャビネットで完了する必要があります。吹く空気を開けないでください。 - 凍結乾燥MOG35-55 ペプチド( 材料の表を参照)を滅菌予冷リン酸緩衝生理食塩水(PBS)(カルシウムおよびマグネシウムイオンなし、pH 7.4)で溶解し、2 mg/mLの濃度で抗原溶液を調製します。
- 清潔な2 mLマイクロ遠心チューブを取り、滅菌した5 mmスチールボール( 材料の表を参照)を各チューブに1つ追加します。
- 5 mg/mLのMTBと500 μLのMOG35-55 抗原溶液を含む500 μLの完全フロイントアジュバントを、1つのスチールボールを含む上記の微量遠心チューブに追加します。
- 上記のチューブをTissueLyser( 材料の表を参照)で10分間振動させ、氷上で10分間冷却し、4回繰り返してよく混合し、最終的に白色粘性溶液を形成します。
注:良好な乳化はMOG35-55 エマルジョンを調製する上で重要なステップであるため、完全な混合が必要です。ティッシュライザーの速度は28Hzに設定されています。
2.百日咳毒素(PTX)の調製
- ddH2Oを含むPTXを100 μg/mLの濃度に調製し、4°Cで保存します。
- PTXストック溶液を滅菌1x PBS(カルシウムイオンおよびマグネシウムイオンなし、pH 7.4)で50倍に希釈して、使用する200 ng/100 μL溶液を作ります。
3. EAE動物モデルの確立
- 8〜12週齢の雄または雌のC57BL / 6Jマウスを使用してEAEモデルを構築します。免疫する前に、マウスが摂食環境に適切に順応していることを確認してください。
- 調製したMOG35-55 エマルジョン(ステップ1)を4°Cで2-3秒間遠心分離し、装置の パルス ボタン( 材料表を参照)を押して、チューブの底部にすべてのエマルジョンを沈殿させた。
注:MOG35-55 エマルジョンは、-20°Cで数日間保存できます。薬物の失敗を避けるために、できるだけ早くそれを使用することをお勧めします。 - 22 Gの針を1 mLシリンジバレルに取り付け、MOG 35-55エマルジョンを吸引し、MOG35-55エマルジョンを新しい1 mLシリンジバレルに移します。1 mLシリンジバレルと26 G針の間の接続をシーリングフィルムで固定します(材料の表を参照)。
注意: MOG35-55 エマルジョンを1mLシリンジバレルに入れるときは、気泡を避けてください。 - 注射部位を70%エタノールで拭いて消毒します。
- MOG35-55 エマルジョンをマウスの背背脊椎の両側に皮下注射し、両側に100μLを注入する。注射操作が完了した後、マウスの背側の皮膚の下に球根状の腫瘤が自動的に形成されるのを観察する。
注:経験豊富な実験者が免疫プロセスを実行し、マウスへの圧力を最小限に抑えるために注射が穏やかかつゆっくりと行われることを確認してください。 - 上記のマウスに100 μLのPTXを腹腔内に注射する(工程2)。
注:予防接種の日は0日目です。また、マウスの尾部にカラーマーカーを用いるなど、その後の日々の評価のためにマウスを正確に識別できることを確認する。 - 予防接種後2日目に同じ用量のPTXを注射します。
- 野生型(WT)マウスとして未免疫マウスの群を準備する。
4. マウスの臨床モニタリング
- EAEおよびWTマウスの体重を毎日記録する。
注:EAEの重症度はマウスの体重減少と正の相関があるため、体重も非常に重要なモニタリング指標です。 - 表1に列挙した0〜5スコアリングシステムを用いて、免疫後0〜21日目のマウスの状態をモニターする。
注:その間の症状はプラスマイナス0.5ポイントとしてカウントされます。
5.オープンフィールドテスト
注:このステップで選択された実験動物は、早期発症、ピーク、および寛解期のEAEマウスです。また、対照としてWTマウスを用いた。EAEモデリングのために不安障害を有するマウスを除外するために、全てのマウスをモデリング前に不安様行動について試験したことに留意されたい。さらに、完全な運動能力不全を有するピークおよび寛解期のEAEマウスは試験から除外された。
- 40×40×40cm3のオープンフィールド反応チャンバーと移動活動(オープンフィールド)ビデオ分析システムを準備します(材料の表を参照)。
注意: カメラはボックスを完全に覆う位置に設置され、反応室は均一に照らされ、テストルームは静かな場所にする必要があります。 - 実験開始の1時間前に、試験マウスを馴化のために試験室に置く。
- テストを開始する前に、領域全体に70%エタノールをスプレーし、清潔なペーパータオルで拭いて、反応チャンバーがきれいであることを確認します。
- 探索を開始する前に、ケージから各マウスを個別に取り出し、アリーナの同じ隅に置きます。
注意: ボックスの下部は16のグリッドに分割されており、そのうち中央の4つのグリッド領域が中央領域であり、その周辺領域が周辺領域です。 - ビデオ分析システムのメニューバーにある[ キャプチャの開始 ]ボタンをクリックし、時間を記録して、撮影を開始します。
- テストルームでは静かにしてください。
- 記録プロセス中にマウスを5分間自由に動かします。
- アクイジションシステムを停止し、ビデオを保存します。
- マウスをアリーナから取り出し、ケージに戻し、次のマウスに進みます。
注意: 臭いやその他の物質を除去するために、実行の合間に70%エタノールでテストエリアを清掃します。 - ビデオ分析システムを使用して結果を分析します。
6.骨表現型の分析
- EAEマウスとWTマウスを21日目に頸部脱臼により安楽死させる。
注:頸部脱臼手術を行う担当者は、動物の死亡中に耐える痛みを最小限に抑えるために十分な訓練を受ける必要があります。 - マウスを解剖トレイに平らに置き、四肢を固定します。
- マウスの後肢の皮膚を鉗子で持ち、マウスの皮膚と筋肉組織をハサミで開きます。
- 大腿骨を脛骨と腰の骨からハサミで慎重に分離します。
- 大腿骨に付着した筋肉をハサミで取り除き、室温で70%エタノールに大腿骨を置きます。
- 等方性ボクセルサイズ10 μm、ピークX線管電圧70 kV、X線強度0.114 mAのマイクロCTシステム( 材料表を参照)を使用して遠位大腿骨をスキャンします。
注:3Dガウスフィルターを使用すると、2Dしきい値画像のノイズ除去が可能になります。 - 中央大腿骨シャフトからスキャンされた100スライスを分析して、骨量、組織体積、骨塩密度、骨梁分離、骨梁数、小柱接続密度、小柱と皮質の厚さなどの大腿骨パラメータを測定します。
注:マウスの大腿骨遠位成長板の近位端から始めて、骨端キャップ構造を完全に欠いているセクションが見つかり、骨端小柱を特定するために、皮質表面から離れたいくつかのボクセルで手動で輪郭を描いた大腿骨近位に向かって100スライスを伸ばし続けました。 - マイクロCTシステムの輪郭領域からしきい値の2D画像を積み重ねることにより、3D再構成を作成します。
結果
マウスの免疫後、マウスの体重が毎日記録され、それらの臨床症状が上記のプロトコルに従って評価される(ステップ4)。MOGペプチドを免疫したC57BL/6Jマウスでは、病変部位が主に脊髄に限定されるため、EAEマウスの病因は尾端から頭部に広がります。疾患の開始時に、EAEマウスは尾の脱力感および垂れ下がりを示し、続いて後肢の脱力感、協調性のない動き、および麻痺を示す。病気が悪化するにつれて、それは徐々に前肢の衰弱、麻痺に発展し、そして重症の場合、マウスを動かすのを困難にし、さらには死にかけてさえも引き起こす。図1Aに示されるように、異なる程度のEAE病理を有するマウスの状態図は、無症候性から高得点のEAE症状に変化するマウス群の例示的な絵を描いている(スコア4)。EAEマウスの体重は臨床症状と相関していることも先に述べた。WTマウスと比較して、EAEマウスの体重減少は免疫後最初の数日で起こり始める可能性がありますが、EAEマウスの臨床症状は通常、免疫後6〜9日目に始まり、14〜16日目にピークに達します。この後、EAEマウスの症状は一般的に部分的に回復し、同時にマウスの体重減少が緩和されます(図1B、C)。したがって、EAE発症の経過は通常、早期発症、ピーク、寛解期間に分けられ、これらの時点の予測は、結果パラメーターを評価する上で重要です。一般に、EAE病変の部位における免疫細胞およびサイトカインの産生を分析するために、疾患のピーク時にEAEマウスの脳および脊髄における免疫細胞を単離し、さらに処理することができ、これをフローサイトメトリー14、15によって分析することができる。ピーク発症時の脊髄組織は、ヘマトキシリンおよびエオジン(H&E)染色およびルクソールファストブルー染色を調製して、脊髄の炎症性細胞浸潤および脱髄をさらに調査するのにも最適である14,16。EAEのさまざまな発症時期における免疫系の変化を監視するために、早期発症時の脾臓およびリンパ節も不可欠な選択肢である17,18。さらに、MOG免疫EAEマウスの脾臓またはリンパ節からの細胞は、導入モデルを構築するために一般的に使用され、これは、EAEマウスの受動免疫を誘導するためにインビトロでMOGの再刺激後にレシピエントマウスに移される18。
MSは、炎症性脱髄および神経細胞喪失を特徴とする中枢神経系の自己免疫性炎症誘発性脱髄病変である2,3。この疾患は通常、情動障害などの精神医学的併存疾患を伴い、そのうち不安障害はMS患者で非常に一般的であり、MS患者の最大30%が不安に苦しんでいます9,19。不安障害は、過度の感情的ストレスと心配を特徴とする精神医学的異常です。オープンフィールドテストは、げっ歯類の不安の行動を分析するためによく使用されます20,21。早期発症、ピーク、寛解期のオープンフィールド試験におけるEAEマウスの探索行動を分析することで、EAEマウスもMS患者と同様の不安様行動を示すことがわかりました(図2A)。オープンフィールドテストでは、不安なげっ歯類は、コーナーに近いことを好む、周辺領域への偏見、中央領域を探索したいという欲求の欠如など、活動が低下し、常同行動が増加する傾向があります。WTマウスと比較して、EAEマウスはまだ運動障害を持っていなかった疾患の初期発症時でさえ、疾患の3つの期間すべてにおいて歩行距離および運動時間が有意に低かった(図2B、C)。さらに、EAEマウスは、通常のマウスよりも有意に短い距離を通過し、中央領域にとどまるのが少なく、末梢領域でのみ移動し、明らかな不安様な気分を示します(図2D、E)。EAEマウスは、発症が軽度の場合、つまり運動協調性が高い場合でも、強い不安様な気分を示します。いくつかの研究は、これが軽度の神経炎症に起因する可能性があることを示唆しており、これは神経伝達物質の分泌にさらに影響を及ぼします22,23。EAEマウスの不安のような気分の引き金を監視するオープンフィールドテストは、研究者がMS精神医学的併存疾患を理解して治療するのに役立つ可能性があります。
疾患の進行に伴い、MSは本質的に最終的にジスキネジアとして現れる。研究によると、MS患者は、主に骨量の減少により、骨粗鬆症や骨折に対する感受性が高く、ジスキネジアの重症度は患者の骨密度と強く相関しています24,25。同様の現象は、EAE動物モデルを用いたマイクロCT分析によって観察することができる(図3A、H)。マウスの大腿骨骨骨の線維柱帯解析データから、EAEマウスはWTマウスと比較して骨塩密度(BMD)の有意な減少を経験し、これは骨強度に対する応答の重要な指標であり、骨粗鬆症の診断の重要な基礎である(図3B)。さらなる分析は、健康なWTマウスと比較してEAEマウスで線維柱帯の骨量減少が有意に発生し、線維柱帯接続密度、小柱数、および骨梁の厚さの減少を伴うことを示しました。これらはすべて骨量の減少の特徴であり、EAEがマウスの大腿骨骨骨梁の骨梁減少も引き起こすことを示唆しています(図3C-F)。同時に、骨梁の構造形態が変化し、骨柱の間隔が大幅に増加しました。間隔が大きいほど、骨は骨粗鬆症になります(図3G)。これは、MS患者が骨粗鬆症になりやすいという考えと一致しています。大腿骨骨幹の皮質骨では、EAEモデルの皮質骨の厚さは正常マウスのそれよりも有意に小さかった(図3I)。MSでは、運動性の低下と筋ジストロフィーの増加は、骨粗鬆症、骨折、および機械的な力の減少による骨吸収の増加と強く関連しており、骨の完全性を徐々に低下させ、それによって骨粗鬆症と骨折のリスクを高めます26。EAEマウスの大腿骨のマイクロCT分析は、骨の健康状態をよく監視することができ、介入はEAEの状態を制御するのに有益です。
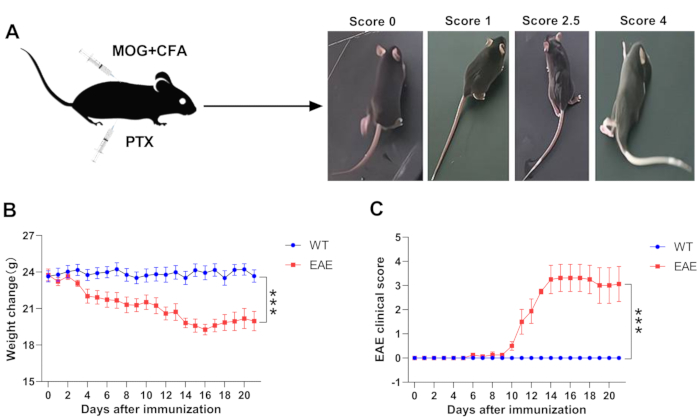
図1:EAEの臨床症状のモニタリング。 (a)異なる程度のEAE病理を有するマウスの例示的な写真。(B)WTマウスおよびEAEマウスにおける体重変化。(C)WTおよびEAEマウスにおける臨床スコア。データは、SEM±平均(n = 5)、***p < 0.001対WTマウス、二元配置分散分析として与えられる。 この図の拡大版を表示するには、ここをクリックしてください。
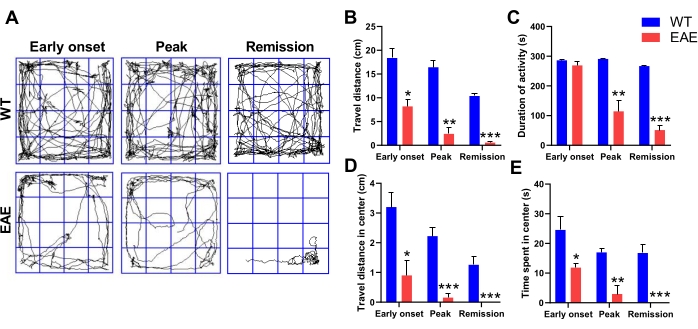
図2:オープンフィールド試験におけるEAEマウスの不安様行動。 (A)オープンフィールドテストの代表的なトラックプロット。早期発症、ピーク、および寛解期間におけるWTマウスおよびEAEマウスの移動距離(B)、活動期間(C)、中心における移動距離(D)、および中心での滞在時間(E)。データはSEM±平均(n = 3)、*p < 0.05、**p < 0.01、***p < 0.001対WTマウス、スチューデントのt検定である。この図の拡大版を表示するには、ここをクリックしてください。
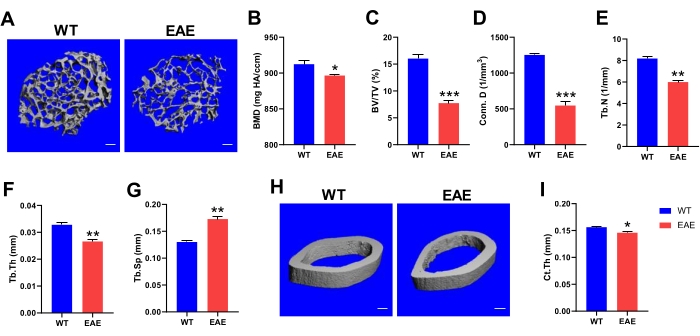
図3:EAEマウスの骨の健康に関するマイクロCT分析。 (A)大腿骨梁構造の代表的な3D画像(スケールバー、100μm)。大腿骨梁の骨塩密度(B)、骨体積/組織体積比(C)、接続密度(D)、数(E)、厚さ(F)、および分離(G)は、マイクロCT分析によって決定されました。(H)皮質骨の代表的な3D画像(スケールバー、100μm)。(I)マイクロコンピュータ断層撮影データから得られた皮質の厚さ。データはSEM±平均(n = 3)、*p < 0.05、**p < 0.01、***p < 0.001対WTマウス、スチューデントのt検定である。この図の拡大版を表示するには、ここをクリックしてください。
| スコア | 臨床徴候 | ||
| 0 | 臨床徴候なし | ||
| 0.5 | 尾の弱さ、尾の前面が落ちる | ||
| 1 | 尾が完全に麻痺している | ||
| 2 | 後肢の軽度の麻痺(後肢の脱力または片側性麻痺、協調運動のない歩行、ピンチへの反応) | ||
| 3 | 後肢の完全な麻痺、後肢の引きずりと歩行、後肢がピンチに反応しない | ||
| 4 | 後肢の麻痺と前肢の脱力感 | ||
| 5 | 臨死または死にかけている | ||
表1:臨床スコアリングシステム。
| 抗原 | 濾す | 特性 | アプリケーション | 制約 | ||
| ティッカー | SJL/J34 | 再発寛解型EAE | 臨床的再発に関与する細胞および分子事象の研究 | T細胞特異的応答に限定される。SJL/J株の特定の遺伝子と経路の研究は困難 | ||
| ティッカー | SJL/J35 | 急性麻痺からの回復後に部分的または全体的なレシピエントに続く再発性麻痺 | 神経炎症と免疫系活性化に関する研究 | T細胞特異的応答に限定される。SJL/J株の特定の遺伝子と経路の研究は困難 | ||
| モグ35-55 | C57BL/631 | 一次進行性EAE;慢性進行性EAE | 軸索損傷メカニズムの研究;トランスジェニックモデルおよびノックアウトモデルにおける分子疾患メカニズムの研究 | 一次脱髄およびミエリン再生の研究は限られた価値しかありません | ||
| 脊髄ホモジネート | ビオッツィABH36 | 再発寛解型EAE | MSに対するミエリン再生と神経保護療法の研究 | 臨床的に進行性ではなく、時間の経過とともに神経学的欠損が蓄積する。CD4 T細胞特異的応答に限定 | ||
| Theilerのマウス脳脊髄炎ウイルス | SJL/J、SWR、PL/J 12,31を含む複数の系統のマウスが罹患率が高い | 炎症性脱髄のウイルスモデル | 軸索損傷と炎症誘発性脱髄に関する研究 | MS特異的ウイルス感染は確認されていません。ミエリン再生は評価が困難であり、脱髄とミエリン再生が同時に起こる | ||
| キュプリゾン | C57BL/6マウスで広く使用されていますが、CD1株などの他の系統は銅クプリゾン誘発損傷の影響を受けにくいです37,38 | 脱髄および髄鞘再形成の毒性モデル | T細胞非依存性脱髄、特にミエリン再生と塩基性ミエリン修復過程の研究 | 有意な自発的なミエリン再生は、毒性傷害の停止後に起こる。脱髄は脳領域特異的であり、脊髄脱髄の研究には有用ではありません | ||
| リゾレシチン | SJL/J12, C57BL/639 など | 脱髄および髄鞘再形成の毒性モデル | T細胞非依存性脱髄、特にミエリン再生と塩基性ミエリン修復過程の研究 | MS中に観察された免疫応答の欠如 | ||
| エチジウムブロミド | C57BL/640など | 脱髄および髄鞘再形成の毒性モデル | 限局性脱髄病変の研究と脱髄・ミエリン再生動態の予測 | 臭化エチジウムは、細胞を含むすべての核小体に損傷を与えます。MSとの限定的な相関 | ||
表2:MSのさまざまなマウスモデル。
ディスカッション
MSはCNSの脱髄炎症性疾患であり、若者に慢性障害を引き起こす最も一般的な神経障害の1つであり、家族や社会に大きな負担をかけています3,4。MSは常に臓器特異的T細胞媒介性自己免疫疾患として分類されており、自己免疫系がCNSをゆっくりと侵食するように誘導し、これは全身の複数の系を含むであろう27。典型的な臨床症状には、視覚障害、運動障害、認知障害および感情障害などがあります6,7。MSは壊滅的な病気であり、適切に治療しないと徐々に悪化し、重度の失明と麻痺につながります28。MSの病因は、その臨床症状と病理学的進行が不均一であるため、まだ完全には理解されておらず、したがって、動物モデルはMSの治療の研究開発に不可欠です。
MSの最も頻繁に研究される動物モデルはEAEであり、主に能動免疫と受動免疫の2つのモデリング方法があります29。前者は、その単純さ、マウス照射の欠如、および短いサイクルタイムのために広く採用されています。EAE活性免疫モデルは、げっ歯類を自己ミエリン抗原またはそれに続くペプチドで免疫することにより、CNSにおける自己免疫応答を誘導し、通常は尾部脱力および四肢麻痺として現れる13。具体的には、C57BL/6JマウスにおいてMOG 35-55によって誘導されるEAEモデルは、CNS炎症、脱髄、および軸索損傷を伴う寛解-再発サイクルの交互を特徴とし、MOG35-55誘発EAEを好ましいモデルにする11,12。EAEは、MOG 35〜55ペプチドの皮下注射によって感作されたマウスにおいて十分に誘導され、MTBに富む免疫増強剤CFAで乳化され、および0〜2日目に血液脳関門破壊効果を有するPTXの腹腔内注射を与えられた30日目。EAEモデルの最大の課題は、弱い症状の発生率が低いことであり、いくつかの影響要因が実験の過程にとって重要です。(1)マウスの年齢と環境は、EAEに対する感受性に影響を与えます。したがって、実験前に同じ年齢のマウスを選択する必要があります。ケージの割り当ての前にマウスに重みを付けてランダムにグループ化し、各グループの体重を近づける必要があります。また、独立した実験間の環境条件が同等であることを確認してください。(2)PTXの濃度:PTXの主な役割は、血液脳関門の透過性を高めることであり、病原性T細胞がCNSに入り、関連するサイトカインを分泌し、炎症反応を促進し、最終的に神経軸索の外層に包まれたミエリンタンパク質の加水分解につながります。EAEマウスの疾患の発症は、PTX投与濃度の低下とともに遅延し、PTXが60%以上減少すると、疾患の重症度は弱まります。(3)MOG 35-55抗原の溶解:凍結融解を避けるために、凍結融解を避けるために、凍結乾燥されたMOG35-55抗原を別々のパッケージ、4 mg /チューブで調達することをお勧めします。また、PTXを使用してCFAで乳化する方が良いため、滅菌水の代わりにPTXを使用して溶解します。(4)MOG35-55抗原とCFAは、油中水型構造を形成するために振動によって十分に乳化する必要があり、エマルジョン液滴は水面に長時間分散せず、良好な乳化を示します。(5)マウスEAEモデリングには2点注入を用いた。注射部位は、好ましくは、マウスが皮膚を舐めたり噛んだりして、MOG35-55エマルジョンのこぼれをもたらすのを避けるために、腰の上および首の下、脊椎に近い位置にある。
しかしながら、MOG35-55抗原によって誘導されるEAEモデルには、依然としていくつかの制限がある。CD4 T細胞によって媒介される原発性軸索損傷の炎症性脳症モデルとして、主な病変は、二次脱髄およびより少ない一次脱髄を伴う大規模な軸索変性であり、これはMS病理とは異なる31、32、33である。MOG35-55によって誘導されたEAEモデルは、主にCD4 T細胞によって駆動される免疫応答を反映しているが、CD8 TおよびB細胞などの他の免疫細胞はこのモデル31への強い関与の感覚を持っていない。別の制限要因は、MOG35-55によって誘発されるEAEがMS病態生理学の免疫学的要素に対して一定のバイアスを有することであり、表2に記載されているように、脱髄およびミエリン再生プロセスの研究など、CNS病理に焦点を当てた研究を検討する際には、他の動物モデルを考慮することができる34、35、36、37、38、39、40.
EAEは、MSの自己免疫特性、およびその炎症および脱髄メカニズムを模倣する上で効果的な予測因子であり12、多くの学者はMSの他の臨床症状を無視して、その免疫調節メカニズムの研究に熱心です。 研究によると、MS関連の不安は、免疫調節不全や脳の炎症などの病態生理学的プロセスに起因することが示されています22、23,41。不安などのメンタルヘルスの問題は、MSの人々に特に一般的であり、不安障害は基本的な日常業務の実行を妨げ、生活の質に大きな影響を与える可能性があります42,43。EAEマウスの自発運動能力の変化は、神経プロセスの変化を予測する可能性があります。オープンフィールド実験では、EAEマウスで不安様行動が発生し、疾患の早期発症を開始する探索行動の減少(本質的に、臨床スコア<0.5、自発運動能力が正常マウスとほぼ同じ)の減少が含まれ、不安様行動の発症が運動障害に先行していることが示唆されました。さらに、寛解期のEAEマウスは、運動能力の増加に伴う不安様行動を改善しなかった。炎症反応の出現は、神経活動を介したEAEマウスの精神障害の原因である可能性があり、気分の変化をもたらし、炎症性サイトカインレベルのアップレギュレーションは、運動障害の発症前に線条体シナプス機能を妨害します23,41。ただし、オープンフィールドテストでは、テストルームは静かな場所でなければならず、テストマウスは新しい環境によって引き起こされる過度の圧力を避けるために1時間前に部屋に順応する必要があるという事実に注意する必要があります。最後の被験者が残した臭いやその他の物質を除去するために、試験の合間にエタノールによる追加の洗浄が必要です。オープンフィールドテストの主な制限は、EAEマウスの運動機能障害によって引き起こされる干渉であり、げっ歯類の不安様行動を評価するためのテストは、反応チャンバー内のげっ歯類の活動の距離、時間、および範囲に基づいており、不安様行動に対する運動機能障害の影響を排除することはできません。したがって、将来の研究では自発運動障害を考慮する必要があります。
骨組織関連の研究を分析する従来の方法では、2次元骨断面顕微鏡を使用することが多く、2次元平面の影響や生物試料の不均一性により、構造形態、密度分布、配向分布、その他の特性の分析が難しくなる可能性があります。多くの研究により、骨形態を記述するためのマイクロCTシステムの精度と有効性が確認されており、多くの研究44,45,46で微細構造検出結果が確認されています。Micro-CTによる骨組織の3次元イメージングにより、より直感的で正確な骨組織形態測定結果が得られます。動物を実行したり、組織標本を損傷したりすることなく、小動物や標本をスキャンすることが達成されており、組織44内部の詳細な3次元空間構造情報が可能になる。研究によると、MS患者は骨量減少と骨粗鬆症を起こしやすいことが示されています24,25;EAEマウスの大腿骨をマイクロCTシステムでスキャンしてイメージングすることにより、骨粗鬆症を発症したWTマウスと比較して、EAEマウスの大腿骨に骨マイクロアーキテクチャの明らかな悪化と骨強度の低下が観察されました。マイクロCT分析は比較的簡単に実行でき、比較的安価であり、マイクロCTライブイメージングは、EAEマウスに治療を施す際に、将来的に骨の健康状態を監視するために使用できます。しかしながら、欠点は、EAEマウスにおける骨代謝恒常性の根本的な変化を観察するために、血液サンプルまたは骨組織形態測定を通して評価された骨代謝回転マーカーが存在しないことである47。骨芽細胞と破骨細胞の調節は、将来的に研究内で検討される可能性があります。
MSは多症状の疾患であり、疾患管理の唯一の目的は疾患の症状を最小限に抑えることです。上記のプロトコルでは、MSの臨床症状は、MOG35-55 誘発EAEモデルを構築することによってシミュレートできます。EAEマウスは、運動機能障害および不安様行動、ならびに骨粗鬆症の臨床症状を示した。このプロトコルに記載されている5点スコアリングシステム、オープンフィールドテスト、およびマイクロCT分析は、EAEマウスの病理学的症状を複数の観点から監視し、EAEの治療のための参照スキームを提供できます。効果的な疾患修飾薬がない場合、相乗療法の潜在的な組み合わせは、症状を緩和し、機能を改善する最良の機会を提供することができます。
開示事項
著者は開示するものは何もありません。
謝辞
著者らは、中国国家自然科学財団(32070768、31871404、31900658、32270754)および国家重点薬物研究所からの支援を認めている。
資料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe(with 26 G needle) | Shanghai Kindly Medical Instruments Co., Ltd | 60017031 | |
| 2 mL microcentrifuge tube | HAIKELASI | KY-LXG2A | |
| 22 G needle | Shanghai Kindly Medical Instruments Co., Ltd | 60017208 | |
| Complete Freund’s Adjuvant | Sigma | F5881 | Stored at 4 °C, 1 mg of heat-inactivated MTB (H37Ra) per mL |
| Conditioned place preference system | Shanghai Jiliang Software Technology Co., Ltd | Animal behavior | |
| Ethanol | Sinopharm Chemical Reagent Co., Ltd | 10009218 | Stored at RT |
| Locomotion activity (open field) video analysis system | Shanghai Jiliang Software Technology Co., Ltd | DigBehv-002 | Animal behavior |
| MOG35-55 peptide | Gill Biochemical Co., Ltd | GLS-Y-M-03590 | Stored at -20 °C |
| Mycobacterium tuberculosis H37Ra | BD | 231141 | Stored at 4 °C |
| Open field reaction chamber | Shanghai Jiliang Software Technology Co., Ltd | Animal behavior | |
| Pertussis toxin | Calbiochem | 516560 | Stored at 4 °C |
| Phosphate Buffered Saline | Made in our laboratory | ||
| Scissor | Shanghai Medical Instrument (group) Co., Ltd | J21010 | |
| Sealing film | Heathrow Scientific | HS 234526B | |
| Sorvall Legend Micro 21R Microcentrifuge | Thermo Scientific | 75002447 | |
| Steel ball | QIAGEN | 69975 | |
| TissueLyser II | QIAGEN | 85300 | |
| Tweezer | Shanghai Medical Instrument (group) Co., Ltd | JD1060 | |
| μCT 35 desktop microCT scanner | Scanco Medical AG, Bassersdorf, Switzerland |
参考文献
- Zhernakova, A., Withoff, S., Wijmenga, C. Clinical implications of shared genetics and pathogenesis in autoimmune diseases. Nature Reviews Endocrinology. 9 (11), 646-659 (2013).
- Filippi, M., et al. Multiple sclerosis. Nature Reviews Disease Primers. 4 (1), 43(2018).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. Europen Journal of Neurology. 26 (1), 27-40 (2019).
- Rietberg, M. B., Veerbeek, J. M., Gosselink, R., Kwakkel, G., van Wegen, E. E. Respiratory muscle training for multiple sclerosis. Cochrane Database of Systematic Reviews. 12 (12), (2017).
- O'Brien, K., Gran, B., Rostami, A. T-cell based immunotherapy in experimental autoimmune encephalomyelitis and multiple sclerosis. Immunotherapy. 2 (1), 99-115 (2010).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. Lancet Neurology. 14 (2), 194-207 (2015).
- Li, H., Lian, G., Wang, G., Yin, Q., Su, Z. A review of possible therapies for multiple sclerosis. Molecular and Cellular Biochemistry. 476 (9), 3261-3270 (2021).
- Lewis, V. M., et al. depression and suicide ideation in people with multiple sclerosis. Journal of Affective Disorders. 208, 662-669 (2017).
- Boeschoten, R. E., et al. Prevalence of depression and anxiety in Multiple Sclerosis: A systematic review and meta-analysis. Journal of the Neurological Sciences. 372, 331-341 (2017).
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). British Journal of Pharmacology. 164, 1079-1106 (2011).
- Glatigny, S., Bettelli, E. Experimental Autoimmune Encephalomyelitis (EAE) as Animal Models of Multiple Sclerosis (MS). Cold Spring Harbor Perspectives in Medicine. 8 (11), 028977(2018).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Mix, E., Meyer-Rienecker, H., Hartung, H. P., Zettl, U. K. Animal models of multiple sclerosis-potentials and limitations. Progress in Neurobiology. 92 (3), 386-404 (2010).
- DiToro, D., et al. Insulin-like growth factors are key regulators of T helper 17 regulatory T cell balance in autoimmunity. Immunity. 52 (4), 650-667 (2020).
- Jain, R., et al. Interleukin-23-induced transcription factor Blimp-1 promotes pathogenicity of T helper 17 cells. Immunity. 44 (1), 131-142 (2016).
- Du, C., et al. Kappa opioid receptor activation alleviates experimental autoimmune encephalomyelitis and promotes oligodendrocyte-mediated remyelination. Nature Communications. 7, 11120(2016).
- Yang, C., et al. Betaine Ameliorates Experimental Autoimmune Encephalomyelitis by Inhibiting Dendritic Cell-Derived IL-6 Production and Th17 Differentiation. The Journal of Immunology. 200 (4), 1316-1324 (2018).
- McGinley, A. M., et al. Interleukin-17A serves a priming role in autoimmunity by recruiting IL-1β-producing myeloid cells that promote pathogenic T cells. Immunity. 52 (2), 342-356 (2020).
- Kocovski, P., et al. Differential anxiety-like responses in NOD/ShiLtJ and C57BL/6J mice following experimental autoimmune encephalomyelitis induction and oral gavage. Laboratory Animals. 52 (5), 470-478 (2018).
- Seibenhener, M. L., Wooten, M. C. Use of the Open Field Maze to measure locomotor and anxiety-like behavior in mice. Journal of Visualized Experiments. (96), e52434(2015).
- Walsh, R. N., Cummins, R. A. The Open-Field Test: a critical review. Psychological Bulletin. 83 (3), 482-504 (1976).
- Tauil, C. B., et al. Depression and anxiety disorders in patients with multiple sclerosis: association with neurodegeneration and neurofilaments. Brazilian Journal of Medical and Biological Research. 54 (3), 10428(2021).
- Gentile, A., et al. Interaction between interleukin-1beta and type-1 cannabinoid receptor is involved in anxiety-like behavior in experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 13, 231(2016).
- Hearn, A. P., Silber, E. Osteoporosis in multiple sclerosis. Multiple Sclerosis. 16, 1031-1043 (2010).
- Gibson, J. C., Summers, G. D. Bone health in multiple sclerosis. Osteoporosis International. 22, 2935-2949 (2011).
- Ye, S., Wu, R., Wu, J. Multiple sclerosis and fracture. The International Journal of Neuroscience. 123, 609-616 (2013).
- Zamvil, S. S., et al. Lupus-prone' mice are susceptible to organ-specific autoimmune disease, experimental allergic encephalomyelitis. Pathobiology. 62 (3), 113-119 (1994).
- Oh, J., Vidal-Jordana, A., Montalban, X. Multiple sclerosis: clinical aspects. Current Opinion in Neurology. 31 (6), 752-759 (2018).
- Smith, P. Animal models of multiple sclerosis. Current Protocols. 1 (6), 185(2021).
- Aharoni, R., Globerman, R., Eilam, R., Brenner, O., Arnon, R. Titration of myelin oligodendrocyte glycoprotein (MOG)-Induced experimental autoimmune encephalomyelitis (EAE) model. Journal of Neuroscience Methods. 351, 108999(2021).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathological. 133 (2), 223-244 (2017).
- Goverman, J., Perchellet, A., Huseby, E. S. The role of CD8(+) T cells in multiple sclerosis and its animal models. Current Drug Targets. Inflammation and Allergy. 4 (2), 239-245 (2005).
- Schultz, V., et al. Acutely damaged axons are remyelinated in multiple sclerosis and experimental models of demyelination. Glia. 65 (8), 1350-1360 (2017).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Zamvil, S., et al. T-cell clones specific for myelin basic protein induce chronic relapsing paralysis and demyelination. Nature. 317 (6035), 355-358 (1985).
- Jackson, S. J., Lee, J., Nikodemova, M., Fabry, Z., Duncan, I. D. Quantification of myelin and axon pathology during relapsing progressive experimental autoimmune encephalomyelitis in the Biozzi ABH mouse. Journal of Neuropathology and Experimental Neurology. 68 (6), 616-625 (2009).
- Gudi, V., Gingele, S., Skripuletz, T., Stangel, M. Glial response during cuprizone-induced de- and remyelination in the CNS: lessons learned. Frontiers in Cellular Neuroscience. 8, 73(2014).
- Yu, Q., et al. Strain differences in cuprizone induced demyelination. Cell & Bioscience. 7, 59(2017).
- Dehghan, S., Aref, E., Raoufy, M. R., Javan, M. An optimized animal model of lysolecithin induced demyelination in optic nerve; more feasible, more reproducible, promising for studying the progressive forms of multiple sclerosis. Journal of Neuroscience Methods. 352, 109088(2021).
- Kuypers, N. J., James, K. T., Enzmann, G. U., Magnuson, D. S., Whittemore, S. R. Functional consequences of ethidium bromide demyelination of the mouse ventral spinal cord. Experimental Neurology. 247, 615-622 (2013).
- Haji, N., et al. TNF-alpha-mediated anxiety in a mouse model of multiple sclerosis. Experimental Neurology. 237, 296-303 (2012).
- Butler, E., Matcham, F., Chalder, T. A systematic review of anxiety amongst people with Multiple Sclerosis. Multiple Sclerosis and Related Disorders. 10, 145-168 (2016).
- Peres, D. S., et al. TRPA1 involvement in depression- and anxiety-like behaviors in a progressive multiple sclerosis model in mice. Brain Research Bulletin. 175, 1-15 (2021).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Chappard, D., Retailleau-Gaborit, N., Legrand, E., Baslé, M. F., Audran, M. Comparison insight bone measurements by histomorphometry and microCT. Journal of Bone and Mineral Research. 20 (7), 1177-1184 (2005).
- Akhter, M. P., Lappe, J. M., Davies, K. M., Recker, R. R. Transmenopausal changes in the trabecular bone structure. Bone. 41 (1), 111-116 (2007).
- Wei, H., et al. Identification of Fibroblast Activation Protein as an Osteogenic Suppressor and Anti-osteoporosis Drug Target. Cell Reports. 33 (2), 108252(2020).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved