Method Article
Induktion und diverse Bewertungsindikatoren der experimentellen autoimmunen Enzephalomyelitis
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Das vorliegende Protokoll beschreibt die Induktion einer experimentellen autoimmunen Enzephalomyelitis in einem Mausmodell unter Verwendung von Myelin-Oligodendrozyten-Glykoprotein und die Überwachung des Krankheitsprozesses mit einem klinischen Scoring-System. Experimentelle autoimmune Enzephalomyelitis-bezogene Symptome werden mittels Mausfemur-Mikro-Computertomographie und Freilandtest analysiert, um den Krankheitsprozess umfassend zu beurteilen.
Zusammenfassung
Multiple Sklerose (MS) ist eine typische Autoimmunerkrankung des zentralen Nervensystems (ZNS), die durch entzündliche Infiltration, Demyelinisierung und axonale Schäden gekennzeichnet ist. Derzeit gibt es keine Maßnahmen, um MS vollständig zu heilen, aber mehrere krankheitsmodifizierende Therapien (DMT) sind verfügbar, um das Fortschreiten der Krankheit zu kontrollieren und zu mildern. Es gibt signifikante Ähnlichkeiten zwischen den pathologischen Merkmalen des ZNS der experimentellen autoimmunen Enzephalomyelitis (EAE) und MS-Patienten. EAE wurde häufig als repräsentatives Modell verwendet, um die Wirksamkeit von MS-Medikamenten zu bestimmen und die Entwicklung neuer Therapien für MS-Erkrankungen zu untersuchen. Die aktive Induktion von EAE bei Mäusen hat eine stabile und reproduzierbare Wirkung und eignet sich besonders für die Untersuchung der Auswirkungen von Medikamenten oder Genen auf autoimmune Neuroinflammation. Die Methode der Immunisierung von C57BL/6J-Mäusen mit Myelin-Oligodendrozyten-Glykoprotein (MOG35-55) und die tägliche Beurteilung der Krankheitssymptome mittels eines klinischen Scoring-Systems wird hauptsächlich geteilt. Angesichts der komplexen Ätiologie der MS mit verschiedenen klinischen Manifestationen kann das bestehende klinische Bewertungssystem die Bewertung der Krankheitsbehandlung nicht erfüllen. Um die Mängel einer einzelnen Intervention zu vermeiden, werden neue Indikatoren zur Beurteilung der EAE basierend auf klinischen Manifestationen von angstähnlichen Stimmungen und Osteoporose bei MS-Patienten erstellt, um eine umfassendere Bewertung der MS-Behandlung zu ermöglichen.
Einleitung
Autoimmunerkrankungen sind ein Spektrum von Erkrankungen, die durch die Immunantwort des Immunsystems auf seine eigenen Antigene verursacht werden, was zu Gewebeschäden oder Funktionsstörungen führt1. Multiple Sklerose (MS) ist eine chronische Autoimmunerkrankung der Polyneuropathie im zentralen Nervensystem (ZNS), gekennzeichnet durch entzündliche Infiltration, Demyelinisierung und neuronale axonale Degeneration 2,3. Derzeit sind weltweit bis zu 2,5 Millionen Menschen von MS betroffen, vor allem junge und Menschen mittleren Alters im Alter von 20 bis 40 Jahren, die oft das Rückgrat ihrer Familien und der Gesellschaft bilden. Dies hat erhebliche Auswirkungen und Schäden für Familien und die Gesellschaft verursacht 2,4.
MS ist eine multifaktorielle Erkrankung mit vielfältigen und komplexen klinischen Manifestationen. Neben klassischen neurologischen Erkrankungen, die durch entzündliche Infiltration und Demyelinisierung gekennzeichnet sind, zeigt MS häufig Sehstörungen, Gliedmaßendyskinesie sowie kognitive und emotionale Störungen 5,6,7. Wenn MS-Patienten nicht die richtige und korrekte Behandlung erhalten, wird die Hälfte von ihnen nach 20 Jahren im Rollstuhl leben, und fast die Hälfte von ihnen wird depressive und Angstsymptome haben, was zu einem viel höheren Maß an Suizidgedanken führt als die Allgemeinbevölkerung 8,9.
Trotz einer langen Forschungszeit bleibt die Ätiologie der MS schwer fassbar, und die Pathogenese der MS ist noch nicht aufgeklärt. Tiermodelle von MS haben es ermöglicht, als Testwerkzeuge zu dienen, um die Krankheitsentwicklung und neue therapeutische Ansätze zu erforschen, trotz der signifikanten Unterschiede zwischen dem Nagetier- und dem menschlichen Immunsystem, während gleichzeitig einige Grundprinzipien geteilt werden. Die experimentelle autoimmune Enzephalomyelitis (EAE) ist derzeit das ideale Tiermodell für die Untersuchung von MS, das Autoantigen-Immunität von Myelinproteinen verwendet, um Autoimmunität gegen ZNS-Komponenten in anfälligen Mäusen zu induzieren, mit dem Zusatz von vollständigem Freund-Adjuvans (CFA) und Keuchhustentoxin (PTX), um die humorale Immunantwort zu verstärken. Abhängig vom genetischen Hintergrund und den Immunantigenen werden verschiedene Krankheitsprozesse, einschließlich akuter, schubförmig-remittierender oder chronischer, erhalten, um verschiedene klinische Formen von MS10,11,12 nachzuahmen. Die relevanten Immunogene, die üblicherweise bei der Konstruktion von EAE-Modellen verwendet werden, stammen aus Selbst-ZNS-Proteinen wie Myelin-Basisprotein (MBP), Proteolipidprotein (PLP) oder Myelin-Oligodendrozyten-Glykoprotein (MOG). MBP- oder PLP-immunisierte SJL/L-Mäuse entwickeln einen schubförmig-remittierenden Verlauf, und MOG löst chronisch progrediente EAE bei C57BL/6-Mäusenaus 11,12,13.
Der Hauptzweck der krankheitsmodifizierenden Therapie (DMT) besteht darin, Krankheitssymptome zu minimieren und die Funktion zu verbessern6. Mehrere Medikamente werden klinisch zur Linderung von MS eingesetzt, aber noch wurde kein Medikament verwendet, um es vollständig zu heilen, was die Notwendigkeit einer synergistischen Behandlung aufzeigt. C57BL / 6-Mäuse werden derzeit am häufigsten verwendet, um transgene Mäuse zu konstruieren, und in dieser Arbeit wurde ein EAE-Modell, das durch MOG35-55 in C57BL / 6J-Mäusen mit einer 5-Punkte-Skala induziert wurde, verwendet, um das Fortschreiten der Krankheit zu überwachen. EAE-Modelle leiden auch unter angstähnlichen Stimmungen und Knochenschwund sowie den weithin bekannten demyelinisierenden Läsionen. Hier wird auch die Methode beschrieben, die Symptome der EAE aus mehreren Perspektiven mittels Freifeldtest und Mikro-Computertomographie (Mikro-CT) zu beurteilen.
Protokoll
Das Tierpflegekomitee der Tongji-Universität genehmigte die vorliegende Arbeit und alle Richtlinien für die Tierpflege wurden befolgt. Für die Experimente wurden männliche oder weibliche C57BL/6J-Mäuse im Alter zwischen 8 und 12 Wochen verwendet. Es wurde sichergestellt, dass Alter und Geschlecht in den Versuchsgruppen gleich waren; Andernfalls war die Anfälligkeit für die Krankheit beeinträchtigt. Die Mäuse wurden in einer spezifischen pathogenfreien Umgebung mit abwechselnden 12 h Hell- und Dunkelzyklen unter konstanten Bedingungen (Raumtemperatur 23 ± 1 °C, Luftfeuchtigkeit 50% ± 10%) mit freiem Zugang zu Mausfutter und Wasser untergebracht.
1. Herstellung der MOG35-55 Emulsion
- Fügen Sie das hitzeinaktivierte lyophilisierte Mycobacterium tuberculosis (MTB, H37Ra) hinzu, um das Freund-Adjuvans (das selbst 1 mg/ml wärmeinaktiviertes MTB H37Ra enthält) zu vervollständigen, was zu einer endgültigen MTB-Konzentration von 5 mg/ml führt (siehe Materialtabelle).
HINWEIS: Der gesamte Vorgang muss in der Biosicherheitswerkbank abgeschlossen werden. Öffnen Sie die Blasluft nicht. - Das lyophilisierte MOG35-55-Peptid (siehe Materialtabelle) wird mit steriler vorgekühlter phosphatgepufferter Kochsalzlösung (PBS) (ohne Calcium- und Magnesiumionen, pH 7,4) gelöst, um die Antigenlösung in einer Konzentration von 2 mg/ml herzustellen.
- Nehmen Sie ein sauberes 2-ml-Mikrozentrifugenröhrchen und fügen Sie jedem Röhrchen eine sterilisierte 5-mm-Stahlkugel (siehe Materialtabelle) hinzu.
- Das obige Mikrozentrifugenröhrchen, das eine Stahlkugel enthält, werden 500 μL komplettes Freund-Adjuvans mit 5 mg/ml MTB und 500 μL MOG35-55-Antigenlösung in das obige Mikrozentrifugenröhrchen mit einer Stahlkugel gegeben.
- Das obige Röhrchen auf einem TissueLyser (siehe Materialtabelle) für 10 min oszillieren, 10 min auf Eis abkühlen lassen und viermal wiederholen, um es gut zu mischen und schließlich eine weiße viskose Lösung zu bilden.
HINWEIS: Eine gute Emulgierung ist ein wichtiger Schritt bei der Herstellung der MOG35-55-Emulsion , daher ist ein gründliches Mischen erforderlich. Der TissueLyser ist auf eine Geschwindigkeit von 28 Hz eingestellt.
2. Herstellung von Keuchhustentoxin (PTX)
- PTX mitddH2Oin eine Konzentration von 100 μg/ml aufbereiten und bei 4 °C lagern.
- Die PTX-Stammlösung wird 50-mal mit sterilem 1x PBS (ohne Calcium- und Magnesiumionen, pH 7,4) verdünnt, um eine 200 ng/100 μL Lösung herzustellen.
3. Etablierung des EAE-Tiermodells
- Konstruieren Sie das EAE-Modell mit den 8-12 Wochen alten männlichen oder weiblichen C57BL/6J-Mäusen. Stellen Sie sicher, dass die Mäuse vor der Immunisierung ausreichend an die Futterumgebung gewöhnt sind.
- Zentrifugieren Sie die vorbereitete MOG35-55-Emulsion (Schritt 1) bei 4 °C für 2-3 s, indem Sie die Impulstaste des Geräts (siehe Materialtabelle) drücken, um alle Emulsionen am Boden des Röhrchens auszufällen.
HINWEIS: MOG35-55 Emulsion kann mehrere Tage bei -20 °C gelagert werden. Um ein Versagen des Arzneimittels zu vermeiden, wird empfohlen, es so schnell wie möglich zu verwenden. - Befestigen Sie eine 22-G-Nadel an einem 1-ml-Spritzenzylinder, saugen Sie die MOG 35-55-Emulsion ab und geben Sie die MOG35-55-Emulsion in einen neuen 1-ml-Spritzenzylinder. Sichern Sie die Verbindung zwischen dem 1-ml-Spritzenzylinder und einer 26-G-Nadel mit Siegelfolie (siehe Materialtabelle).
HINWEIS: Vermeiden Sie Luftblasen, wenn Sie die MOG35-55-Emulsion in 1-ml-Spritzenzylinder laden. - Wischen und desinfizieren Sie die Injektionsstelle mit 70% Ethanol.
- Injizieren Sie die MOG35-55-Emulsion subkutan auf jede Seite der Rückenwirbelsäule der Mäuse, 100 μL auf jeder Seite. Beobachten Sie die automatische Bildung von bauchigen Massen unter der Haut des Rückens der Mäuse nach Abschluss des Injektionsvorgangs.
HINWEIS: Stellen Sie sicher, dass erfahrene Experimentatoren den Immunisierungsprozess durchführen und dass die Injektion sanft und langsam durchgeführt wird, um den Druck auf Mäuse zu minimieren. - Injizieren Sie die oben genannten Mäuse intraperitoneal mit 100 μL PTX (Schritt 2).
HINWEIS: Der Tag der Immunisierung ist Tag 0. Stellen Sie außerdem sicher, dass die Mäuse für die anschließende tägliche Auswertung genau identifiziert werden können, z. B. mit einem Farbmarker am Schwanz der Mäuse. - Injizieren Sie die gleiche Dosis PTX am Tag 2 nach der Immunisierung.
- Bereiten Sie eine Gruppe nicht immunisierter Mäuse als Wildtyp-Mäuse (WT) vor.
4. Klinische Überwachung von Mäusen
- Zeichnen Sie täglich das Körpergewicht von EAE- und WT-Mäusen auf.
HINWEIS: Der Schweregrad der EAE korreliert positiv mit dem Gewichtsverlust von Mäusen, so dass das Körpergewicht auch ein sehr wichtiger Überwachungsindex ist. - Überwachen Sie den Status von Mäusen 0-21 Tage nach der Immunisierung mit dem in Tabelle 1 aufgeführten 0-5-Bewertungssystem.
HINWEIS: Symptome dazwischen werden mit plus oder minus 0,5 Punkten gezählt.
5. Freilandtest
HINWEIS: Die für diesen Schritt ausgewählten Versuchstiere sind EAE-Mäuse in den frühen Beginn-, Spitzen- und Remissionsphasen. Zusätzlich wurden WT-Mäuse als Kontrolle verwendet. Es ist zu beachten, dass alle Mäuse vor der Modellierung auf angstähnliches Verhalten getestet wurden, um Mäuse mit Angststörungen für die EAE-Modellierung auszuschließen. Darüber hinaus wurden EAE-Mäuse in Spitzen- und Remissionszeiten mit vollständiger motorischer Unfähigkeit vom Test ausgeschlossen.
- Bereiten Sie eine 40 × 40 × 40 cm3 offene Reaktionskammer und ein Fortbewegungsaktivitäts-Videoanalysesystem (offenes Feld) vor (siehe Materialtabelle).
HINWEIS: Die Kamera wird in einer Position installiert, die die Box vollständig abdeckt, der Reaktionsraum ist gleichmäßig beleuchtet und der Testraum muss ein ruhiger Bereich sein. - Stellen Sie die Testmäuse 1 h vor Beginn des Experiments zur Gewöhnung in den Testraum.
- Besprühen Sie den gesamten Bereich mit 70% Ethanol und wischen Sie ihn mit einem sauberen Papiertuch ab, um sicherzustellen, dass die Reaktionskammer sauber ist, bevor Sie mit dem Test beginnen.
- Entferne jede Maus einzeln aus ihrem Käfig und platziere sie in derselben Ecke der Arena, bevor du mit der Erkundung beginnst.
HINWEIS: Der Boden der Box ist in 16 Raster unterteilt, von denen der mittlere vier Rasterbereich der zentrale Bereich und die Umgebung der Randbereich ist. - Klicken Sie in der Menüleiste des Videoanalysesystems auf die Schaltfläche Aufnahme starten , nehmen Sie die Zeit auf und beginnen Sie mit der Aufnahme.
- Schweigen Sie im Testraum.
- Lassen Sie die Maus während des Aufnahmevorgangs 5 Minuten lang frei bewegen.
- Stoppen Sie das Erfassungssystem und speichern Sie das Video.
- Nimm die Maus aus der Arena, lege sie zurück in den Käfig und fahre mit der nächsten Maus fort.
HINWEIS: Reinigen Sie den Testbereich zwischen den Läufen mit 70% Ethanol, um Gerüche und andere Substanzen zu entfernen. - Analysieren Sie die Ergebnisse mit dem Videoanalysesystem.
6. Analyse des Knochenphänotyps
- Euthanasieren Sie die EAE- und WT-Mäuse am 21. Tag durch zervikale Dislokation.
HINWEIS: Personal, das zervikale Dislokationsoperationen durchführt, muss gut ausgebildet sein, um die Schmerzen während des Todes des Tieres zu minimieren. - Lassen Sie die Maus flach in einer Sezierschale liegen und fixieren Sie die Extremitäten.
- Halten Sie die Hintergliedhaut der Maus mit einer Pinzette und öffnen Sie die Maushaut und das Muskelgewebe mit einer Schere.
- Trennen Sie den Femur vorsichtig mit einer Schere von Tibia und Hüftknochen.
- Entfernen Sie den am Oberschenkelknochen haftenden Muskel mit einer Schere und legen Sie den Femur in 70% Ethanol bei Raumtemperatur.
- Scannen Sie den distalen Femur mit einem Mikro-CT-System (siehe Materialtabelle) mit einer isotropen Voxelgröße von 10 μm, einer Röntgenspitzenröhrenspannung von 70 kV und einer Röntgenintensität von 0,114 mA.
HINWEIS: Ein 3D-Gaußfilter ermöglicht das Entrauschen von 2D-Schwellenwertbildern. - Analysieren Sie die 100 Schnitte, die vom mittleren Femurschaft gescannt wurden, um Femurparameter zu messen, einschließlich Knochenvolumen, Gewebevolumen, Knochenmineraldichte, trabekuläre Trennung, trabekuläre Anzahl, trabekuläre Verbindungsdichte und trabekuläre und kortikale Dicke.
HINWEIS: Ausgehend vom proximalen Ende der distalen Femurwachstumsplatte bei Mäusen wurden Abschnitte gefunden, die völlig frei von epiphysären Kappenstrukturen waren und sich weiterhin 100 Scheiben in Richtung des proximalen Femurs erstreckten, die manuell umrissene Konturen an mehreren Voxeln von der inneren kortikalen Oberfläche entfernt waren, um epiphysäre Trabekeln zu identifizieren. - Erstellen Sie die 3D-Rekonstruktionen, indem Sie Schwellen-2D-Bilder aus Konturbereichen im Mikro-CT-System stapeln.
Ergebnisse
Nach der Immunisierung der Mäuse wird das Körpergewicht der Mäuse täglich aufgezeichnet und ihre klinischen Symptome werden gemäß dem oben beschriebenen Protokoll (Schritt 4) bewertet. Bei C57BL / 6J-Mäusen, die mit MOG-Peptid immunisiert wurden, breitet sich die Pathogenese der EAE-Mäuse vom Schwanzende bis zum Kopf aus, da die Läsion hauptsächlich auf das Rückenmark beschränkt ist. Zu Beginn der Krankheit zeigen EAE-Mäuse Schwäche und Herabhängen des Schwanzes, gefolgt von Schwäche der Hintergliedmaßen, unkoordinierten Bewegungen und Lähmungen. Wenn sich die Krankheit verschlimmert, entwickelt sie sich allmählich zur Schwäche der Vordergliedmaßen, Lähmung und verursacht in schweren Fällen Schwierigkeiten, die Mäuse zu bewegen und sogar den Tod nahe. Wie in Abbildung 1A gezeigt, zeigt das Zustandsdiagramm der Mäuse mit unterschiedlichen Graden der EAE-Pathologie ein exemplarisches Bild einer Gruppe von Mäusen, die von asymptomatischen zu hochbewerteten EAE-Symptomen wechselten (Score 4). Es wurde auch bereits erwähnt, dass das Körpergewicht von EAE-Mäusen mit klinischen Symptomen korreliert. Im Vergleich zu WT-Mäusen kann der Gewichtsverlust bei EAE-Mäusen in den ersten Tagen nach der Immunisierung auftreten, während die klinischen Symptome von EAE-Mäusen normalerweise am Tag 6-9 nach der Immunisierung beginnen und am Tag 14-16 einen Höhepunkt erreichen. Danach erholen sich die Symptome der EAE-Mäuse im Allgemeinen teilweise, und gleichzeitig wird der Gewichtsverlust der Mäuse gelindert (Abbildung 1B,C). Daher wird der Verlauf des EAE-Beginns in der Regel in früh einsetzende, Spitzen- und Remissionsperioden unterteilt, und die Vorhersage dieser Zeitpunkte ist wichtig für die Beurteilung von Ergebnisparametern. Im Allgemeinen können zur Analyse der Produktion von Immunzellen und Zytokinen am Ort der EAE-Läsionen Immunzellen im Gehirn und Rückenmark von EAE-Mäusen auf dem Höhepunkt der Erkrankung isoliert und weiterverarbeitet werden, was mittels Durchflusszytometrie14,15 analysiert werden kann. Das Rückenmarksgewebe zu Spitzenbeginn eignet sich auch am besten für die Vorbereitung der Hämatoxylin- und Eosinfärbung (H&E) und der Luxol Fast Blue-Färbung, um die entzündliche Zellinfiltration und Demyelinisierung des Rückenmarks weiter zu untersuchen14,16. Für die Überwachung von Veränderungen des Immunsystems zu verschiedenen Beginnzeiten der EAE sind Milz und Lymphknoten zu Beginn ebenfalls wesentliche Optionen17,18. Darüber hinaus werden Zellen aus der Milz oder den Lymphknoten von MOG-immunisierten EAE-Mäusen häufig verwendet, um Transfermodelle zu konstruieren, die nach Restimulation von MOG in vitro auf Empfängermäuse übertragen werden, um eine passive Immunisierung von EAE-Mäusen zu induzieren18.
MS ist eine autoimmuninduzierte demyelinisierende Läsion des zentralen Nervensystems, die durch entzündliche Demyelinisierung und neuronalen Verlust gekennzeichnetist 2,3. Diese Krankheit wird in der Regel von psychiatrischen Komorbiditäten wie affektiven Störungen begleitet, von denen Angststörungen bei MS-Patienten sehr häufig sind, wobei bis zu 30% der MS-Patienten an Angstzuständen leiden 9,19. Angststörung ist eine psychiatrische Anomalie, die durch übermäßigen emotionalen Stress und Sorgen gekennzeichnet ist. Der Open-Field-Test wird häufig verwendet, um das Verhalten für Angstzustände bei Nagetierenzu analysieren 20,21. Mit Hilfe der Analyse des Explorationsverhaltens von EAE-Mäusen in Freilandtests während früher Beginn-, Spitzen- und Remissionsphasen wurde festgestellt, dass EAE-Mäuse auch angstähnliche Verhaltensweisen ähnlich denen von MS-Patienten aufwiesen (Abbildung 2A). Im Freilandtest neigen ängstliche Nagetiere dazu, eine reduzierte Aktivität und ein erhöhtes stereotypes Verhalten zu haben, einschließlich einer Präferenz für die Nähe zu Ecken, einer Voreingenommenheit gegenüber dem peripheren Bereich und einem Mangel an Wunsch, den zentralen Bereich zu erkunden. Im Vergleich zu WT-Mäusen hatten EAE-Mäuse in allen drei Perioden der Erkrankung eine signifikant geringere Gehdistanz und Bewegungszeit, selbst im frühen Ausbruch der Krankheit, als EAE-Mäuse noch keine motorische Beeinträchtigung aufwiesen (Abbildung 2B,C). Darüber hinaus durchlaufen EAE-Mäuse signifikant weniger Distanz und bleiben weniger im zentralen Bereich als normale Mäuse und bewegen sich sogar nur im peripheren Bereich, was eine offensichtliche angstähnliche Stimmung zeigt (Abbildung 2D, E). EAE-Mäuse zeigen immer noch eine starke angstähnliche Stimmung, wenn der Beginn mild ist, dh motorische Koordination. Einige Studien deuten darauf hin, dass dies auf eine leichte Neuroinflammation zurückzuführen ist, die die Neurotransmittersekretion weiter beeinflusst22,23. Freilandtests, die angstähnliche Stimmungsauslöser bei EAE-Mäusen überwachen, könnten Forschern helfen, psychiatrische MS-Komorbiditäten zu verstehen und zu behandeln.
Mit dem Fortschreiten der Krankheit manifestiert sich MS im Wesentlichen als Dyskinesie. Studien haben gezeigt, dass MS-Patienten eine höhere Anfälligkeit für Osteoporose und Fraktur haben, hauptsächlich aufgrund von Knochenmassenverlust, und dass der Schweregrad der Dyskinesie stark mit der Knochendichte des Patienten korreliert24,25. Ein ähnliches Phänomen kann durch Mikro-CT-Analyse mit Hilfe des EAE-Tiermodells beobachtet werden (Abbildung 3A,H). Aus den trabekulären Analysedaten des Femurs bei Mäusen geht hervor, dass EAE-Mäuse im Vergleich zu WT-Mäusen eine signifikante Abnahme der Knochenmineraldichte (BMD) erfahren, was ein wichtiger Indikator für das Ansprechen auf die Knochenstärke und eine wichtige Grundlage für die Diagnose von Osteoporose ist (Abbildung 3B). Weitere Analysen zeigten, dass ein trabekulärer Knochenverlust bei EAE-Mäusen im Vergleich zu gesunden WT-Mäusen signifikant auftrat und von einer Verringerung der trabekulären Verbindungsdichte, der trabekulären Anzahl und der trabekulären Dicke begleitet wurde. Diese sind alle charakteristisch für eine reduzierte Knochenmasse, was darauf hindeutet, dass EAE auch einen trabekulären Knochenverlust im Oberschenkelknochen von Mäusen verursacht (Abbildung 3C-F). Gleichzeitig änderte sich die strukturelle Morphologie der Knochentrabekeln und der Abstand der Trabekeln nahm signifikant zu; Je größer der Abstand, desto osteoporotischer der Knochen (Abbildung 3G). Dies steht im Einklang mit der Vorstellung, dass MS-Patienten anfällig für Osteoporose sind. In kortikalen Knochen der Femurdiaphyse war die Dicke des kortikalen Knochens im EAE-Modell signifikant geringer als bei normalen Mäusen (Abbildung 3I). Bei MS sind verminderte Motilität und erhöhte Muskeldystrophie stark mit Osteoporose, Fraktur und erhöhter Knochenresorption aufgrund reduzierter mechanischer Kräfte verbunden, wodurch die Knochenintegrität allmählich verringert wird, wodurch das Risiko von Osteoporose und Fraktur erhöhtwird 26. Die Mikro-CT-Analyse des Femurs bei EAE-Mäusen kann die Knochengesundheit gut überwachen, und die Intervention ist vorteilhaft bei der Kontrolle des Zustands von EAE.
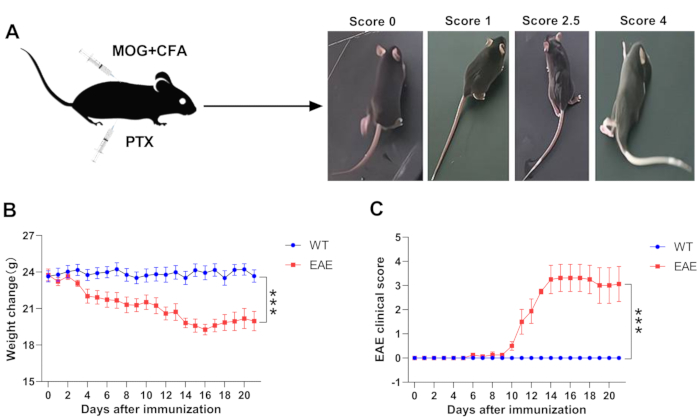
Abbildung 1: Überwachung der klinischen Symptome von EAE. (A) Das exemplarische Bild der Mäuse mit unterschiedlichen Graden der EAE-Pathologie. (B) Gewichtsveränderung bei WT- und EAE-Mäusen. (C) Klinischer Score bei WT- und EAE-Mäusen. Die Daten werden als Mittelwert ± SEM (n = 5), ***p < 0,001 im Vergleich zu WT-Mäusen, Zwei-Wege-ANOVA-Test angegeben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
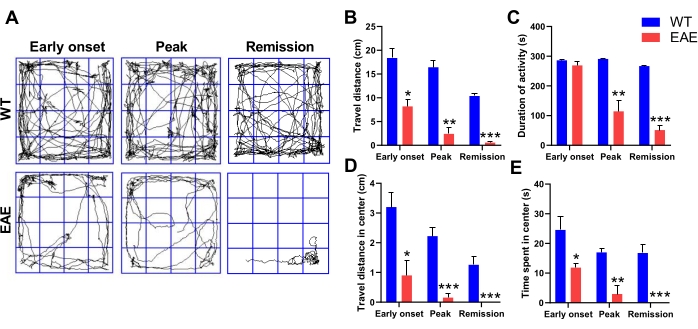
Abbildung 2: Angstähnliches Verhalten von EAE-Mäusen im Freilandtest. (A) Repräsentative Trackplots des Freilandtests. Reisedistanz (B), Dauer der Aktivität (C), Reisestrecke im Zentrum (D) und Zeit im Zentrum (E) von WT-Mäusen und EAE-Mäusen in frühen Beginn-, Spitzen- und Remissionsperioden. Die Daten sind Mittelwert ± SEM (n = 3), *p < 0,05, **p < 0,01, ***p < 0,001 versus WT-Mäuse, Student's t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
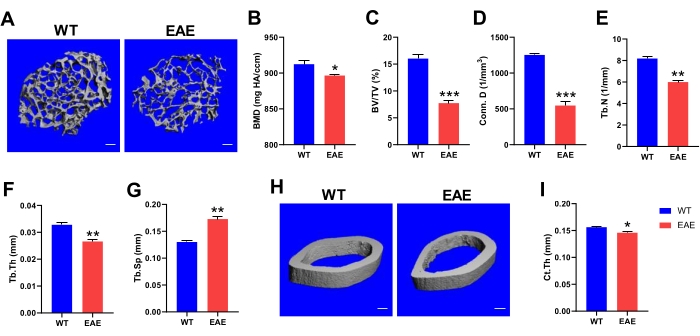
Abbildung 3: Mikro-CT-Analyse der Knochengesundheit bei EAE-Mäusen. (A) Repräsentative 3D-Bilder der femoralen trabekulären Architektur (Maßstabsbalken, 100 μm). Knochenmineraldichte (B), Knochenvolumen/Gewebevolumenverhältnis (C), Verbindungsdichte (D), Zahlen (E), Dicke (F) und Trennung (G) des femoralen Trabekels wurden mittels Mikro-CT-Analyse bestimmt. (H) Repräsentative 3D-Bilder von kortikalem Knochen (Maßstabsbalken, 100 μm). (I) Kortikale Dicke aus Mikrocomputertomographie-Daten. Die Daten sind Mittelwert ± SEM (n = 3), *p < 0,05, **p < 0,01, ***p < 0,001 versus WT-Mäuse, Student's t-Test. Bitte klicken Sie hier, um eine größere Version dieser Abbildung zu sehen.
| Punktzahl | Klinisches Zeichen | ||
| 0 | Keine klinischen Symptome | ||
| 0.5 | Schwanzschwäche, Vorderseite des Schwanzabfalls | ||
| 1 | Schwanz vollständig gelähmt | ||
| 2 | Leichte Lähmung der Hinterbeine (Schwäche beider Hinterbeine oder einseitige Lähmung, unkoordiniertes Gehen, Reaktion auf das Einklemmen) | ||
| 3 | Vollständige Lähmung der Hintergliedmaßen, Hinterbeine ziehen und gehen, Hinterbeine reagieren nicht auf Einklemmen | ||
| 4 | Lähmung der Hinterbeine und Schwäche der Vorderbeine | ||
| 5 | Dem Tod nahe oder dem Sterben | ||
Tabelle 1: Klinisches Bewertungssystem.
| Antigen | Dehnung | Charakteristisch | Anwendung | Einschränkung | ||
| PLP | SJL/J34 | Schubförmig-remittierende EAE | Untersuchung der zellulären und molekularen Ereignisse, die an einem klinischen Rückfall beteiligt sind | Beschränkt auf T-Zell-spezifische Reaktionen; Die Untersuchung spezifischer Gene und Signalwege im SJL/J-Stamm ist eine Herausforderung | ||
| MBP | SJL/J35 | Rezidivierende Lähmung bei Teil- oder Gesamtempfängern nach Genesung von akuter Lähmung | Untersuchung von Neuroinflammation und Aktivierung des Immunsystems | Beschränkt auf T-Zell-spezifische Reaktionen; Die Untersuchung spezifischer Gene und Signalwege im SJL/J-Stamm ist eine Herausforderung | ||
| MOG35-55 | C57BL/631 | Primär progressive EAE; Chronisch progrediente EAE | Untersuchung axonaler Schädigungsmechanismen; Untersuchung molekularer Krankheitsmechanismen in transgenen und Knockout-Modellen | Studien zur primären Demyelinisierung und Myelinregeneration sind von begrenztem Wert | ||
| Rückenmarkshomogenat | Biozzi ABH36 | Schubförmig-remittierende EAE | Studie zur Myelinregeneration und neuroprotektiven Therapie bei MS | Nicht klinisch progredient, mit Anhäufung neurologischer Defizite im Laufe der Zeit; Beschränkt auf CD4-T-Zell-spezifische Antworten | ||
| Theiler-Maus-Enzephalomyelitis-Virus | Mehrere Stämme von Mäusen sind sehr anfällig, einschließlich SJL/J, SWR, PL/J12,31 | Virale Modelle der entzündlichen Demyelinisierung | Untersuchung von axonalen Verletzungen und entzündungsinduzierter Demyelinisierung | Es wurden keine MS-spezifischen Virusinfektionen identifiziert; Myelinregeneration ist schwer zu beurteilen, Demyelinisierung und Myelinregeneration erfolgen gleichzeitig | ||
| Cuprizone | Weit verbreitet bei C57BL/6-Mäusen, während andere Stämme, wie der CD1-Stamm, weniger anfällig für Kupfer-Cuprizon-induzierte Schäden sind37,38 | Toxisches Modell der Demyelinisierung und Remyelinisierung | Untersuchung der T-Zell-unabhängigen Demyelinisierung, insbesondere der Myelinregeneration und grundlegender Myelinreparaturprozesse | Eine signifikante spontane Myelinregeneration tritt nach Beendigung der toxischen Verletzung auf; Demyelinisierung ist hirnregionenspezifisch und nicht nützlich für die Untersuchung der Demyelinisierung des Rückenmarks | ||
| Lysolecithin | SJL/J12, C57BL/639 usw. | Toxisches Modell der Demyelinisierung und Remyelinisierung | Untersuchung der T-Zell-unabhängigen Demyelinisierung, insbesondere der Myelinregeneration und grundlegender Myelinreparaturprozesse | Mangel an Immunantwort während MS beobachtet | ||
| Ethidiumbromid | C57BL/640 usw. | Toxisches Modell der Demyelinisierung und Remyelinisierung | Untersuchung fokaler demyelinisierender Läsionen und Vorhersage der Kinetik der Demyelinisierung und Myelinregeneration | Ethidiumbromid schädigt alle nukleolushaltigen Zellen; Begrenzte Korrelation mit MS | ||
Tabelle 2: Verschiedene Mausmodelle von MS.
Diskussion
MS ist eine demyelinisierende entzündliche Erkrankung des ZNS und eine der häufigsten neurologischen Erkrankungen, die bei jungen Menschen chronische Behinderungen verursachen und Familien und Gesellschaft enorm belasten 3,4. MS wurde schon immer als organspezifische T-Zell-vermittelte Autoimmunerkrankung klassifiziert, die das Autoimmunsystem dazu veranlasst, das ZNS langsam zu erodieren, was mehrere Systeme im ganzen Körper betrifft27. Typische klinische Symptome sind Sehstörungen, motorische Störungen, kognitive und emotionale Störungen usw. 6,7. MS ist eine verheerende Krankheit, die sich zunehmend verschlimmert, wenn sie nicht richtig behandelt wird, was zu schwerer Erblindung und Lähmung führt28. Die Pathogenese der MS ist noch nicht vollständig verstanden, da ihre klinischen Manifestationen und ihr pathologischer Verlauf heterogen sind und daher Tiermodelle für die Erforschung und Entwicklung der Behandlung von MS unerlässlich sind.
Das am häufigsten untersuchte Tiermodell für MS ist EAE, das hauptsächlich über zwei Modellierungsmethoden verfügt: aktive Immunisierung und passive Immunisierung29. Ersteres ist wegen seiner Einfachheit, fehlender Mausbestrahlung und kurzer Zykluszeit weit verbreitet. Das EAE-aktive Immunmodell induziert Autoimmunantworten im ZNS, indem es Nagetiere mit Selbstmyelin-Antigenen oder ihren nachfolgenden Peptiden immunisiert, die sich normalerweise als Schwanzschwäche und Gliedmaßenlähmung manifestieren13. Insbesondere ist das durch MOG 35-55 induzierte EAE-Modell in C57BL / 6J-Mäusen durch abwechselnde Remissions-Rezidiv-Zyklen gekennzeichnet, begleitet von ZNS-Entzündung, Demyelinisierung und axonalen Verletzungen, was die MOG35-55-induzierte EAE zum bevorzugten Modell 11,12 macht. EAE kann gut bei Mäusen induziert werden, die durch subkutane Injektion von MOG 35-55-Peptid sensibilisiert, mit Immunpotentiator CFA angereichert mit MTB emulgiert und eine intraperitoneale Injektion von PTX mit blut-Hirn-Schranke störender Wirkung an den Tagen0-2 30 verabreicht werden. Die größte Herausforderung für das EAE-Modell ist die geringe Inzidenz schwacher Symptome, und mehrere Einflussfaktoren sind für den Verlauf des Experiments entscheidend. (1) Das Alter und die Umgebung von Mäusen beeinflussen die Anfälligkeit für EAE. Daher müssen gleichaltrige Mäuse vor dem Experiment ausgewählt werden. Die Mäuse sollten vor der Käfigzuweisung gewichtet und zufällig gruppiert werden, und das Gewicht jeder Gruppe muss nahe gehalten werden. Stellen Sie außerdem sicher, dass die Umweltbedingungen zwischen unabhängigen Experimenten vergleichbar sind. (2) Die Konzentration von PTX: Die Hauptaufgabe von PTX besteht darin, die Durchlässigkeit der Blut-Hirn-Schranke zu erhöhen, wodurch pathogene T-Zellen in das ZNS eindringen können, um relevante Zytokine zu sezernieren und die Entzündungsreaktion zu fördern, was letztendlich zur Hydrolyse von Myelinproteinen führt, die in die äußere Schicht der Nervenaxone eingewickelt sind. Der Ausbruch der Erkrankung bei EAE-Mäusen verzögerte sich mit abnehmender PTX-Verabreichungskonzentration, und der Schweregrad der Erkrankung würde geschwächt, wenn PTX um mehr als 60% abnahm. (3) Die Auflösung des MOG 35-55-Antigens: Um ein Einfrieren und Auftauen zu vermeiden, wird empfohlen, das lyophilisierte MOG35-55-Antigen in separaten Packungen von 4 mg / Röhrchen zu beschaffen, um ein Einfrieren und Auftauen zu vermeiden. PTX wird auch zur Auflösung anstelle von sterilem Wasser verwendet, da es besser ist, mit CFA unter Verwendung von PTX zu emulgieren. (4) MOG35-55-Antigen und CFA müssen durch Oszillieren ausreichend emulgiert werden, um eine Wasser-in-Öl-Struktur zu bilden, und die Emulsionströpfchen verteilen sich nicht lange Zeit auf der Wasseroberfläche, was auf eine gute Emulgierung hinweist. (5) Für die EAE-Modellierung der Maus wurde die Zweipunktinjektion verwendet. Die Injektionsstelle befindet sich vorzugsweise oberhalb der Taille und unterhalb des Halses in der Nähe der Wirbelsäule, um zu vermeiden, dass Mäuse die Haut lecken und beißen, was zum Verschütten der MOG35-55-Emulsion führt.
Das durch das Antigen MOG35-55 induzierte EAE-Modell weist jedoch noch einige Einschränkungen auf. Als entzündliches Enzephalopathie-Modell der primären axonalen Verletzung, die durch CD4-T-Zellen vermittelt wird, ist die Hauptläsion eine massive axonale Degeneration mit sekundärer Demyelinisierung und weniger primärer Demyelinisierung, die sich von der MS-Pathologieunterscheidet 31,32,33. Das durch MOG 35-55 induzierte EAE-Modell spiegelt hauptsächlich die Immunantwort wider, die von CD4-T-Zellen angetrieben wird, während andere Immunzellen wie CD8-T- undB-Zellen kein starkes Gefühl der Teilnahme an diesem Modellhaben 31. Ein weiterer limitierender Faktor ist, dass EAE, induziert durch MOG 35-55, eine gewisse Voreingenommenheit gegenüber der immunologischen Komponente der MS-Pathophysiologie aufweist und andere Tiermodelle berücksichtigt werden können, wenn Studien berücksichtigt werden, die sich auf ZNS-Pathologien konzentrieren, wie die Untersuchung von Demyelinisierungs- und Myelinregenerationsprozessen 34,35,36,37,38,39,40, wie in Tabelle 2 beschrieben. .
EAE ist ein wirksamer Prädiktor bei der Nachahmung der Autoimmuneigenschaften von MS sowie ihres Entzündungs- und Demyelinisierungsmechanismus12, was viele Wissenschaftler dazu bringt, ihre immunmodulatorischen Mechanismen zu untersuchen und andere klinische Symptome von MS zu ignorieren. Studien haben gezeigt, dass MS-assoziierte Angst auf pathophysiologische Prozesse wie Immundysregulation und Gehirnentzündung zurückgeführt wird22, 23,41. Psychische Gesundheitsprobleme, wie Angstzustände, sind besonders häufig bei Menschen mit MS, und Angststörungen können die Erfüllung grundlegender täglicher Aufgaben behindern und die Lebensqualität erheblich beeinträchtigen42,43. Veränderungen in der Bewegungsfähigkeit von EAE-Mäusen können Veränderungen in neuronalen Prozessen vorhersagen. In Freilandexperimenten traten angstähnliche Verhaltensweisen bei EAE-Mäusen auf, einschließlich einer Abnahme des explorativen Verhaltens, das früh mit dem Ausbruch der Krankheit begann (im Wesentlichen Testpersonen mit klinischen Werten <0,5 und Bewegungsfähigkeit fast so gut wie normale Mäuse), was darauf hindeutet, dass der Beginn angstähnlichen Verhaltens einer motorischen Beeinträchtigung vorausgeht. Darüber hinaus verbesserten EAE-Mäuse in der Remissionsphase das angstähnliche Verhalten mit erhöhter motorischer Fähigkeit nicht. Das Auftreten der Entzündungsreaktion kann für die geistige Beeinträchtigung bei EAE-Mäusen durch neuronale Aktivität verantwortlich sein, was zu Stimmungsschwankungen führt, und eine Hochregulierung der entzündlichen Zytokinspiegel stört die striatale synaptische Funktion vor dem Beginn der motorischen Beeinträchtigung23,41. Der Freilandtest erfordert jedoch die Beachtung der Tatsache, dass der Testraum ein ruhiger Bereich sein muss und die Testmäuse sich 1 Stunde im Voraus an den Raum akklimatisieren müssen, um einen übermäßigen Druck durch die neue Umgebung zu vermeiden. Zwischen den Tests ist eine zusätzliche Reinigung mit Ethanol erforderlich, um Gerüche und andere Substanzen zu entfernen, die von der letzten Testperson hinterlassen wurden. Die Haupteinschränkung des Freilandtests ist die Interferenz, die durch motorische Dysfunktion bei EAE-Mäusen verursacht wird, und der Test zur Bewertung des angstähnlichen Verhaltens von Nagetieren basiert auf der Entfernung, der Zeit und dem Bereich der Nagetieraktivität in der Reaktionskammer und kann die Wirkung einer motorischen Dysfunktion auf angstähnliches Verhalten nicht ausschließen. Daher müssen zukünftige Studien die Beeinträchtigung des Bewegungsapparates berücksichtigen.
Traditionelle Methoden zur Analyse von Knochengewebestudien verwenden häufig die zweidimensionale Knochenschnittmikroskopie, die aufgrund des Einflusses zweidimensionaler Ebenen und der Inhomogenität biologischer Proben größere Schwierigkeiten bei der Analyse von Strukturmorphologie, Dichteverteilung, Orientierungsverteilung und anderen Merkmalen haben kann. Viele Studien haben die Genauigkeit und Wirksamkeit des Mikro-CT-Systems zur Beschreibung der Knochenmorphologie bestätigt, und viele Studien44,45,46 haben die Ergebnisse der Mikrostrukturerkennung bestätigt. Die dreidimensionale Bildgebung von Knochengewebe mittels Mikro-CT ermöglicht intuitivere und genauere Knochenhistomorphometrie-Ergebnisse. Es wurde erreicht, kleine Tiere und Proben zu scannen, ohne das Tier auszuführen oder die Gewebeprobe zu beschädigen, was detaillierte dreidimensionale räumliche Strukturinformationen innerhalb des Gewebesermöglicht 44. Studien haben gezeigt, dass MS-Patienten anfällig für Knochenmassenverlust und Osteoporosesind 24,25; Durch das Scannen und Abbilden des Femurs von EAE-Mäusen mit einem Mikro-CT-System konnte eine offensichtliche Verschlechterung der Knochenmikroarchitektur und eine verminderte Knochenstärke im Femur von EAE-Mäusen im Vergleich zu WT-Mäusen, die Osteoporose entwickelt hatten, beobachtet werden. Die Mikro-CT-Analyse ist relativ einfach durchzuführen und relativ kostengünstig, und die Mikro-CT-Live-Bildgebung kann in Zukunft zur Überwachung der Knochengesundheit bei der Behandlung von EAE-Mäusen verwendet werden. Der Nachteil ist jedoch das Fehlen von Knochenumsatzmarkern, die durch Blutproben oder Knochenhistomorphometrie bewertet werden, um grundlegende Veränderungen der Knochenstoffwechselhomöostase bei EAE-Mäusen zu beobachten47. Die Regulation von Osteoblasten und Osteoklasten könnte in Zukunft im Rahmen der Studie in Betracht gezogen werden.
MS ist eine Multisymptomerkrankung, und das einzige Ziel des Krankheitsmanagements ist es, Krankheitssymptome zu minimieren. In dem oben genannten Protokoll können die klinischen Symptome von MS simuliert werden, indem das MOG35-55-induzierte EAE-Modell konstruiert wird. EAE-Mäuse zeigten klinische Symptome von motorischen Dysfunktionen und angstähnlichem Verhalten sowie Osteoporose. Das in diesem Protokoll beschriebene 5-Punkte-Scoring-System, der Open-Field-Test und die Mikro-CT-Analyse können die pathologischen Symptome von EAE-Mäusen aus mehreren Perspektiven überwachen und ein Referenzschema für die Behandlung von EAE liefern. In Ermangelung wirksamer krankheitsmodifizierender Medikamente kann eine mögliche Kombination einer synergistischen Therapie die beste Gelegenheit bieten, Symptome zu lindern und die Funktion zu verbessern.
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Autoren würdigen die Unterstützung durch die National Natural Science Foundation of China (32070768, 31871404, 31900658, 32270754) und das State Key Laboratory of Drug Research.
Materialien
| Name | Company | Catalog Number | Comments |
| 1 mL syringe(with 26 G needle) | Shanghai Kindly Medical Instruments Co., Ltd | 60017031 | |
| 2 mL microcentrifuge tube | HAIKELASI | KY-LXG2A | |
| 22 G needle | Shanghai Kindly Medical Instruments Co., Ltd | 60017208 | |
| Complete Freund’s Adjuvant | Sigma | F5881 | Stored at 4 °C, 1 mg of heat-inactivated MTB (H37Ra) per mL |
| Conditioned place preference system | Shanghai Jiliang Software Technology Co., Ltd | Animal behavior | |
| Ethanol | Sinopharm Chemical Reagent Co., Ltd | 10009218 | Stored at RT |
| Locomotion activity (open field) video analysis system | Shanghai Jiliang Software Technology Co., Ltd | DigBehv-002 | Animal behavior |
| MOG35-55 peptide | Gill Biochemical Co., Ltd | GLS-Y-M-03590 | Stored at -20 °C |
| Mycobacterium tuberculosis H37Ra | BD | 231141 | Stored at 4 °C |
| Open field reaction chamber | Shanghai Jiliang Software Technology Co., Ltd | Animal behavior | |
| Pertussis toxin | Calbiochem | 516560 | Stored at 4 °C |
| Phosphate Buffered Saline | Made in our laboratory | ||
| Scissor | Shanghai Medical Instrument (group) Co., Ltd | J21010 | |
| Sealing film | Heathrow Scientific | HS 234526B | |
| Sorvall Legend Micro 21R Microcentrifuge | Thermo Scientific | 75002447 | |
| Steel ball | QIAGEN | 69975 | |
| TissueLyser II | QIAGEN | 85300 | |
| Tweezer | Shanghai Medical Instrument (group) Co., Ltd | JD1060 | |
| μCT 35 desktop microCT scanner | Scanco Medical AG, Bassersdorf, Switzerland |
Referenzen
- Zhernakova, A., Withoff, S., Wijmenga, C. Clinical implications of shared genetics and pathogenesis in autoimmune diseases. Nature Reviews Endocrinology. 9 (11), 646-659 (2013).
- Filippi, M., et al. Multiple sclerosis. Nature Reviews Disease Primers. 4 (1), 43(2018).
- Dobson, R., Giovannoni, G. Multiple sclerosis - a review. Europen Journal of Neurology. 26 (1), 27-40 (2019).
- Rietberg, M. B., Veerbeek, J. M., Gosselink, R., Kwakkel, G., van Wegen, E. E. Respiratory muscle training for multiple sclerosis. Cochrane Database of Systematic Reviews. 12 (12), (2017).
- O'Brien, K., Gran, B., Rostami, A. T-cell based immunotherapy in experimental autoimmune encephalomyelitis and multiple sclerosis. Immunotherapy. 2 (1), 99-115 (2010).
- Feinstein, A., Freeman, J., Lo, A. C. Treatment of progressive multiple sclerosis: what works, what does not, and what is needed. Lancet Neurology. 14 (2), 194-207 (2015).
- Li, H., Lian, G., Wang, G., Yin, Q., Su, Z. A review of possible therapies for multiple sclerosis. Molecular and Cellular Biochemistry. 476 (9), 3261-3270 (2021).
- Lewis, V. M., et al. depression and suicide ideation in people with multiple sclerosis. Journal of Affective Disorders. 208, 662-669 (2017).
- Boeschoten, R. E., et al. Prevalence of depression and anxiety in Multiple Sclerosis: A systematic review and meta-analysis. Journal of the Neurological Sciences. 372, 331-341 (2017).
- Constantinescu, C. S., Farooqi, N., O'Brien, K., Gran, B. Experimental autoimmune encephalomyelitis (EAE) as a model for multiple sclerosis (MS). British Journal of Pharmacology. 164, 1079-1106 (2011).
- Glatigny, S., Bettelli, E. Experimental Autoimmune Encephalomyelitis (EAE) as Animal Models of Multiple Sclerosis (MS). Cold Spring Harbor Perspectives in Medicine. 8 (11), 028977(2018).
- Procaccini, C., De Rosa, V., Pucino, V., Formisano, L., Matarese, G. Animal models of Multiple Sclerosis. European Journal of Pharmacology. 759, 182-191 (2015).
- Mix, E., Meyer-Rienecker, H., Hartung, H. P., Zettl, U. K. Animal models of multiple sclerosis-potentials and limitations. Progress in Neurobiology. 92 (3), 386-404 (2010).
- DiToro, D., et al. Insulin-like growth factors are key regulators of T helper 17 regulatory T cell balance in autoimmunity. Immunity. 52 (4), 650-667 (2020).
- Jain, R., et al. Interleukin-23-induced transcription factor Blimp-1 promotes pathogenicity of T helper 17 cells. Immunity. 44 (1), 131-142 (2016).
- Du, C., et al. Kappa opioid receptor activation alleviates experimental autoimmune encephalomyelitis and promotes oligodendrocyte-mediated remyelination. Nature Communications. 7, 11120(2016).
- Yang, C., et al. Betaine Ameliorates Experimental Autoimmune Encephalomyelitis by Inhibiting Dendritic Cell-Derived IL-6 Production and Th17 Differentiation. The Journal of Immunology. 200 (4), 1316-1324 (2018).
- McGinley, A. M., et al. Interleukin-17A serves a priming role in autoimmunity by recruiting IL-1β-producing myeloid cells that promote pathogenic T cells. Immunity. 52 (2), 342-356 (2020).
- Kocovski, P., et al. Differential anxiety-like responses in NOD/ShiLtJ and C57BL/6J mice following experimental autoimmune encephalomyelitis induction and oral gavage. Laboratory Animals. 52 (5), 470-478 (2018).
- Seibenhener, M. L., Wooten, M. C. Use of the Open Field Maze to measure locomotor and anxiety-like behavior in mice. Journal of Visualized Experiments. (96), e52434(2015).
- Walsh, R. N., Cummins, R. A. The Open-Field Test: a critical review. Psychological Bulletin. 83 (3), 482-504 (1976).
- Tauil, C. B., et al. Depression and anxiety disorders in patients with multiple sclerosis: association with neurodegeneration and neurofilaments. Brazilian Journal of Medical and Biological Research. 54 (3), 10428(2021).
- Gentile, A., et al. Interaction between interleukin-1beta and type-1 cannabinoid receptor is involved in anxiety-like behavior in experimental autoimmune encephalomyelitis. Journal of Neuroinflammation. 13, 231(2016).
- Hearn, A. P., Silber, E. Osteoporosis in multiple sclerosis. Multiple Sclerosis. 16, 1031-1043 (2010).
- Gibson, J. C., Summers, G. D. Bone health in multiple sclerosis. Osteoporosis International. 22, 2935-2949 (2011).
- Ye, S., Wu, R., Wu, J. Multiple sclerosis and fracture. The International Journal of Neuroscience. 123, 609-616 (2013).
- Zamvil, S. S., et al. Lupus-prone' mice are susceptible to organ-specific autoimmune disease, experimental allergic encephalomyelitis. Pathobiology. 62 (3), 113-119 (1994).
- Oh, J., Vidal-Jordana, A., Montalban, X. Multiple sclerosis: clinical aspects. Current Opinion in Neurology. 31 (6), 752-759 (2018).
- Smith, P. Animal models of multiple sclerosis. Current Protocols. 1 (6), 185(2021).
- Aharoni, R., Globerman, R., Eilam, R., Brenner, O., Arnon, R. Titration of myelin oligodendrocyte glycoprotein (MOG)-Induced experimental autoimmune encephalomyelitis (EAE) model. Journal of Neuroscience Methods. 351, 108999(2021).
- Lassmann, H., Bradl, M. Multiple sclerosis: experimental models and reality. Acta Neuropathological. 133 (2), 223-244 (2017).
- Goverman, J., Perchellet, A., Huseby, E. S. The role of CD8(+) T cells in multiple sclerosis and its animal models. Current Drug Targets. Inflammation and Allergy. 4 (2), 239-245 (2005).
- Schultz, V., et al. Acutely damaged axons are remyelinated in multiple sclerosis and experimental models of demyelination. Glia. 65 (8), 1350-1360 (2017).
- McRae, B. L., et al. Induction of active and adoptive relapsing experimental autoimmune encephalomyelitis (EAE) using an encephalitogenic epitope of proteolipid protein. Journal of Neuroimmunology. 38 (3), 229-240 (1992).
- Zamvil, S., et al. T-cell clones specific for myelin basic protein induce chronic relapsing paralysis and demyelination. Nature. 317 (6035), 355-358 (1985).
- Jackson, S. J., Lee, J., Nikodemova, M., Fabry, Z., Duncan, I. D. Quantification of myelin and axon pathology during relapsing progressive experimental autoimmune encephalomyelitis in the Biozzi ABH mouse. Journal of Neuropathology and Experimental Neurology. 68 (6), 616-625 (2009).
- Gudi, V., Gingele, S., Skripuletz, T., Stangel, M. Glial response during cuprizone-induced de- and remyelination in the CNS: lessons learned. Frontiers in Cellular Neuroscience. 8, 73(2014).
- Yu, Q., et al. Strain differences in cuprizone induced demyelination. Cell & Bioscience. 7, 59(2017).
- Dehghan, S., Aref, E., Raoufy, M. R., Javan, M. An optimized animal model of lysolecithin induced demyelination in optic nerve; more feasible, more reproducible, promising for studying the progressive forms of multiple sclerosis. Journal of Neuroscience Methods. 352, 109088(2021).
- Kuypers, N. J., James, K. T., Enzmann, G. U., Magnuson, D. S., Whittemore, S. R. Functional consequences of ethidium bromide demyelination of the mouse ventral spinal cord. Experimental Neurology. 247, 615-622 (2013).
- Haji, N., et al. TNF-alpha-mediated anxiety in a mouse model of multiple sclerosis. Experimental Neurology. 237, 296-303 (2012).
- Butler, E., Matcham, F., Chalder, T. A systematic review of anxiety amongst people with Multiple Sclerosis. Multiple Sclerosis and Related Disorders. 10, 145-168 (2016).
- Peres, D. S., et al. TRPA1 involvement in depression- and anxiety-like behaviors in a progressive multiple sclerosis model in mice. Brain Research Bulletin. 175, 1-15 (2021).
- Bouxsein, M. L., et al. Guidelines for assessment of bone microstructure in rodents using micro-computed tomography. Journal of Bone and Mineral Research. 25 (7), 1468-1486 (2010).
- Chappard, D., Retailleau-Gaborit, N., Legrand, E., Baslé, M. F., Audran, M. Comparison insight bone measurements by histomorphometry and microCT. Journal of Bone and Mineral Research. 20 (7), 1177-1184 (2005).
- Akhter, M. P., Lappe, J. M., Davies, K. M., Recker, R. R. Transmenopausal changes in the trabecular bone structure. Bone. 41 (1), 111-116 (2007).
- Wei, H., et al. Identification of Fibroblast Activation Protein as an Osteogenic Suppressor and Anti-osteoporosis Drug Target. Cell Reports. 33 (2), 108252(2020).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten