Method Article
5-エチニル-2'-デオキシウリジン/ホスホヒストンH3細胞周期進行解析用二重標識プロトコル
要約
5-エチニル-2'-デオキシウリジン(EdU)およびホスホヒストンH3(pH3)標識による細胞周期解析は、広範な最適化を必要とし得る多段階の手順である。ここでは、異なる細胞周期段階で細胞を区別するための画像解析および定量化を含む、この手順のすべてのステップを説明する詳細なプロトコルを提示する。
要約
生体細胞 周期進行解析は、有糸分裂およびDNA複製を調節する遺伝子に関する研究において日常的に行われている。5-エチニル-2'-デオキシウリジン(EdU)は、複製/S相進行を調査するために利用されているのに対し、ホスホヒストンH3に対する抗体は、有核および細胞をマークするために利用されてきた。両方のラベルの組み合わせは、G0/G1(ギャップフェーズ)、S(複製)、およびM(有糸分裂)相の分類を可能にし、有糸分裂遺伝子のノックダウンまたはヌル突然変異体が細胞周期進行に及ぼす影響を評価する重要なツールとして機能する。しかし、EdU標識細胞をマークするために使用される試薬は、いくつかの二次抗体蛍光タグと互換性がありません。これは、一次およびタグ付き二次抗体がpH3陽性有糸分裂細胞をマークするために使用される免疫染色を複雑にします。本論文では、染色体 の幼虫 神経幹細胞におけるEdUとpH3の二重標識のステップバイステッププロトコルについて説明する。さらに、画像分析と定量化のために、G0/G1、S、S、S>G2/M(SからG2/Mへの進行)、およびM相の3つの異なるカテゴリーにラベル付けされたセルを割り当てるためのプロトコルが用意されています。
概要
細胞分割サイクルは、G1相(第1ギャップ相)、複製/S相、G2(第2ギャップ相)、M(ミトティック)相で構成されています。これらの段階を経て、細胞は細胞転写、翻訳、および細胞骨格機構1,2の再構成において劇的な変化を起こします。発達的および環境的な手掛かりに応じて、細胞は一時的に分裂を停止し、静止(G0)になるか、分化し、永久に3を分割しなくなる。DNA損傷などの他のシナリオでは、早期分化またはアポトーシス3,4を引き起こす可能性があります。このようなキューへの応答は、細胞周期チェックポイントによって仲介され、細胞が分割サイクル5の次の段階にコミットする前に、本質的な細胞プロセスの完全性を確保するための監視システムとして機能する。したがって、DNA複製、チェックポイント、および有糸分裂性機械を調節する遺伝子に関する研究では、変異細胞またはこれらの遺伝子のsiRNAノックダウン時に起こり得る細胞周期進行欠陥を分析する必要があります。さらに、このような分析は、全体的な細胞の健康だけでなく、薬物治療に対する細胞応答をテストするために使用することができます。
5-ブロモ-2'-デオキシウリジン(BrdU)は、複製中にDNAに組み込まれるチミジンアナログ6.この方法は、S相の細胞を同定するために広く使用された。しかし、細胞は、抗BrdU抗体6を用いてBrdUを検出できるように、過酷なDNA変性手順を行う。この過酷な治療は、細胞エピトープを損傷し、免疫染色を介してサンプルのさらなる特性を防ぐことができます。銅触媒によるEdUの組み込みおよびその後の検出は、小さく、細胞透過性、蛍光タグ付きアジド染料による「クリック反応」は、過酷な変性手順7の必要性を排除する。したがって、この方法は、BrdUの組み込みに代わるより実用的な代替手段として浮上した。
また、pH3は、有糸分裂/M相細胞8に対する信頼できるマーカーとして説明されている。ヒストンH3は、G2後期から初期のM相の周囲でリン酸化されて、アナフェーズ8の終わりに向かって脱リン酸化されるDNA関連コアヒストンタンパク質である。いくつかの市販の抗体を使用して、標準的な免疫染色プロトコルを使用してpH3を検出することができます。したがって、EdUとpH3の二重染色は、M相と同様にS相の細胞の検出を可能にするであろう。さらに、G1およびG2初期期の細胞は、いずれのマーカーにも積極的に染色されないであろう。
ショウジョウバエ 神経幹細胞または神経芽細胞(NBs)は、細胞が非対称的に分裂して1つの同一の自己更新NBおよび神経節母細胞(GMC)を産生する、分化9のために運命づけられた十分に特徴付けられる幹細胞モデルを提供する。さらに、いくつかの遺伝子ツールとNB特異的抗体は、このシステムを遺伝子操作および生細胞イメージングに適しています。その結果、いくつかの研究は、非対称分裂および細胞運命決定9を調節する遺伝子を研究するためにNBを利用した。脳の中枢(CB)と幼虫脳の視頭葉(OL)に、異なる集団が存在する。CB NBは、現在の研究のために使用されました.これら第3のインスター幼虫CB NBは、有糸分裂性紡錘の組立を調節する因子を研究するのにも適している大細胞である。細胞周期の進行欠陥を分析するプロトコルは、このような研究において重要なツールとなるだろう。
先に公開されたプロトコルは、Click-iT EdU Alexa Fluor細胞増殖キットのような商用キットを採用しており、EdUの組み込みおよび検出用の様々なアレクサフルオール染料でタグ付けされたいくつかの反応成分とアジド染料を提供する。しかし、このようなキットに付属の試薬は、二次抗体とよく使用される蛍光タグと互換性がありません。このEdU検出キット(アレクサフルオール647-共役アジジド色素を供給するClick-iT EdU Alexa Fluor細胞増殖キット)をショ ウジョウバエ 第3のインスター幼虫NBで試験し、NBのマーカーであるpH3およびミランダに対する抗体を共染色実験した。また、Alexa Fluor 568-またはCy3タグ付き二次抗体をNBs11の血漿膜上でのミランダ標識の検出に用いた。しかし、期待されるシグナル強度および染色パターン(未発表の結果)は、EdU検出後に免疫染色を行った場合、これらの二次抗体では観察されなかった。
EdUの組み込みについては、DaulとDaulと同僚が説明したプロトコルは、EdUとブロモフェノールブルー(BPB)10と混合されたカンケル白培地で幼虫の供給を必要とした。幼虫は、幼虫の腸内で摂取すると青い色で見ることができるEdUとBPBスパイク食品に餌を与えました。この方法は、第3のインスター幼虫であるMms19機能喪失(Mms19P)のEdU組み込みには用いられたが、幼虫の腸内で青色の色がほとんど検出されなかったため、Mms19P幼虫は明らかにほとんど供給されなかった(未発表の結果)。Mms19P幼虫は劇的な発達の変形を示し、最終的に第3のインスター段階で逮捕する。これは、第3のインスター幼虫の摂食行動に何らかの影響を及ぼし、そのような場合にはEdU-給餌プロトコルを不適当にする可能性がある。
利用可能な文献を研究し、本質的なステップの標準化に広く取り組んだ後、幼虫にEdUを供給する必要のないショウジョウバエNBsのEdU / pH3デュアルラベリングのための代替アプローチが提案されました。以前の研究では、NBsの細胞周期を分析するために二重EdU / pH3染色を採用したが、詳細なプロトコル4は示さなかった。これは、このメソッドを実装しようとするラボにとって、不要なハードルを示します。さらに、各種試薬とEdUキットとの相溶性を評価し、さらなる最適化を行う場合には、時間のかかる処理が可能です。この論文では、解剖された幼虫脳におけるEdUの組み込みと抗pH3抗体による免疫染色をカバーするステップバイステップのプロトコルを提示し、続いて共焦点顕微鏡と画像分析を行い、G0/G1相、S相、S>G2/M(SからG2/Mへの進行)、およびM相の4つのカテゴリーにNBを割り当てる。最適化が必要な手順の概要と、大規模データセットの画像分析に関するヒントが示されています。さらに、野生型のNBsにおけるEdU/pH3読み出しは、分析され、最近報告されたMms19P NBsと比較され、細胞周期遅延11を示す。
プロトコル
1. クリックイットEdUアッセイ用試薬とストックの調製
注:キットに付属のキットと試薬の詳細については、 材料表 と 表1 を参照してください。
- 溶液を準備する前に、バイアルを室温にしてください。
- 2 mLのジメチルスルホキシド(DMSO、C成分)を加えて10mM EdU(成分A)ストック液を調製します。よく混ぜて-20°Cで保存してください。
- DMSO(成分C)の70μLを加えて、Alexa Fluor 647-azide(成分B)の働く溶液を準備します。よく混ぜて-20°Cで保存してください。
- この溶液の4 mLを36mLの脱イオン水と混合して、Click-iT EdU反応バッファー(成分D)の1x溶液を調製します。残りの溶液を2~6°Cで保存してください。
- 2 mLの脱イオン水を加えて、Click-iT EdU バッファー添加剤 (成分 F) の 10x ストック (200 mg/mL) を作ります。よく混ぜて-20°Cで保存してください。
- 2-6 °CでHoechst 33342(成分G)を保管してください。 DMSO(コンポーネントC)をデシケータに-20 °Cで保管してください。
メモ: 手袋は、DMSOとHoechstを扱うために使用されるべきです。
2. 第3のインスター幼虫脳の解剖とEdUの組み込み
注: 脳の切り分けのためのプロトコルは、以前に説明されています12.解剖を開始する前に、2.6 および 3.1 で説明されているように、十分な量の EdU および PFA ソリューションが準備され、解凍されていることを確認してください。
- 25.6 g Na2HPO4.7H20、80 g NaCl、2 g KCl、および 2 g KH2PO4 を 1 L の脱イオン水を加えて、10x リン酸緩衝生理食塩水 (PBS) を調製します。pHを7.4に調整し、続いて1x溶液を脱イオン水で調製します。
- シュナイダース解剖媒体(SM)をガラス(3または9)のうつ病の2つの連続したくぼみ(3または9)のくぼみガラスのスポットプレートに加えます。次の連続したうつ病に1倍のPBSを追加します。
- 鉗子のペアを使用して、3番目のインスター幼虫をさまようを選び、PBSで濡れた組織に置いてフライフード残渣をきれいにします。PBSでうつ病に幼虫を置き、その後、SMで連続うつ病に置きます.
- 細かい鉗子を使って幼虫の下半身の3/4分の1 を取り除きます。
- 1組の鉗子で幼虫の口のフックをそっとつかみ、もう一方の端にもう一方の鉗子を持たします。
- 口のフックを内側に押し込み、同時にもう一方の端の組織を剥がすことによって、幼虫の頭を裏返しにします。
- 取り付けられた想像力ディスクを持つ幼虫の脳を観察します。脳に付着した他の組織を取り除き、脳をSMで次の連続したうつ病に移す。
- 10 mM EdU ストック溶液を解凍します。この10mMストックをSMに希釈して、100μMの溶液を準備します。
- この100 μM EdU+SM溶液を、パイレックスプレートの別のくぼみに100 μL追加します。25°Cで2時間100μMの脳を100μLで5~10回解剖した脳を2時間培養します。
注: NBs は 2 時間に 1 回分かれるため、このプロトコルは 1 つの完全なセル周期を分析することを目的としています。それ以上のステップのために無傷の脳のみを使用してください。解剖中に損傷した脳を捨てる。
3. 固定と免疫染色
- 4%パラホルムアルデヒド(PFA)溶液をヒュームフードに準備します。
- パラホルムアルデヒド粉末4gを80mLの1x PBSに加え、磁気スターラーに置いたビーカーに加え、60°Cに加熱します。 PFAを溶解するには、1 N NaOHの数滴を加えます。pH を確認し、必要に応じて 1 M HCl の数滴で 7.0 に調整します。
- 1x PBSで音量を100 mLに調整します。2~6 °Cで最大1ヶ月間、PFA溶液をアリコートして保管します。幼虫脳などの大きな組織を効率的に固定するために、0.3%非イオン性洗剤( 材料表を参照)をPFA溶液に添加します。
- EdUを組み込んだ後、4%PFAを含む0.6 mLマイクロ遠心チューブに脳を移す。15分間、常温でヌテーターでインキュベートします。脳がチューブの下部に落ち着くように、実験室のベンチのチューブをタップします。
- PFAを取り出し、室温でPBS+ 0.3%非イオン性洗剤(PBST)で3回洗浄します。各洗浄が10分以上続くよう、ヌテタで確認します。最後の洗浄後、PBSTを取り除き、ブロッキング溶液(PBST + 5%ウシ血清アルブミン)を加え、室温で30分間インキュベートします。
- PBSTにおける希薄な抗ミランダ抗体(1:250)および抗pH3抗体(1:200)(同一のチューブ内の両方の抗体)。ブロッキングバッファーを取り外し、一次抗体溶液を添加します。2~6 °Cで一晩インキュベートします。
注:ミランダはCB NBに存在する膜タンパク質です。CB領域13内のこれらの大きな丸い細胞を同定する役割を果たす。 - 一次抗体溶液を取り出し、PBSTで3回洗浄します。各洗浄は、室温でヌテターで10分間持続することを確認します。
- PBSTに1:500希釈アレクサフルーオール488抗ウサギとアレクサフルオール568抗ラットを加えることによって二次抗体溶液を調製します。PBSTを取り出し、解剖した脳に二次抗体溶液を加える。暗闇の中で2〜6°Cで一晩インキュベートし、ヌテーターで、PBSTで3回洗浄します(ステップ3.5)。
4. EdU検出、DNA染色、取り付け
- EdU検出カクテルを準備するには、1.5 mLチューブにコンポーネント( 表2を参照)を混ぜます。
- 最後の洗浄(ステップ3.6)の後、PBSTを取り出し、解剖した脳にEdU検出カクテルを加えます。室温で暗闇の中で30分間、ヌテーターでインキュベートします。PBSTで2回、暗闇の中で10分間洗浄します。
- DNA染色の場合、PBSTでHoechst 33342(成分G)1:2,000を希釈し、5μg/mL溶液を調製します。
- 2回目の洗浄後にPBSTを取り除き(ステップ4.2)、解剖した脳に5μg/mLのHoechst溶液を500μL加えます。暗闇の中で10分間インキュベートし、Hoechstを取り除き、PBSTで10分間1回洗います。
- ラボベンチにチューブをタップし、脳が落ち着くようにします。PBSTをチューブから取り出しますが、残すのは50-100μLだけです。
- 200 μL マイクロピペットチップの端部を切り、きれいなガラススライドに慎重に脳を移します。濾紙ストリップでブロッティングして、スライドから余分なPBSTを除去します。フィルター用紙が脳に触れないように注意してください。
- 水溶性の非蛍光実装媒体を脳に一滴置き、腹側神経コードがスライドに向き、ローブが上向きになるように脳を向ける。脳を連続的に画像化しやすいように、脳を単一のファイルに配置します。
- 脳の上にカバースリップをそっと置きます。スライドを一晩2~6°Cに置きます。
注:取り付け媒体は、マニキュアでカバースリップを密封する必要がないように、一晩保管時に硬化します。
5. イメージング
注: このプロトコルで使用されるレーザー走査顕微鏡および油浸性の目的の詳細については 、材料表 を参照してください。
- 取得ソフトウェアから、63x 目標を選択します。
- 取り付けられた脳のすぐ上のカバースリップに浸漬油を一滴入れ、接眼を通して組織を見つけやすくします。
- DAPI/Hoechst 33342チャネルを使用して、接眼を通して脳を見つけ、ソフトウェアの 取得モード に切り替えます。
- 画像Hoechst 33342(DNA)、アレクサフルーター488(pH3)、アレクサフルオール568(ミランダ)、アレクサフルオール647(EdU)をイメージする4チャンネルを設定します。選択した 色素の 励起レーザーとエミッション フィルタを自動的に設定する、色素アシスタント ツールを使用します。
- 脳葉全体を包含するような視野を設定する。0.8 μm離れた場所に配置されたzスタックを取得して、脳ローブの全容を画像化します。イメージング セッションのすべてのイメージを *.lif ライブラリ 形式で保存します。
6. 画像解析
注: 次の手順では、取得した画像の解析と、セルを G0/G1 フェーズ、S 位相、S>G2/M (S から G2/M への進行)、および ImageJ ソフトウェアを使用した M 位相に分類する方法について説明します。
- フィジー (フィジーは ImageJ) を次の URL からダウンロード https://fiji.sc/ します。フィジーを開き、.lifファイルをフィジーにドラッグアンドドロップします。
注:フィジーは、いくつかのプラグイン14でプリインストールされているImageJのバージョンです。.lifファイルをフィジーに転送すると、.lifファイルを処理するために必要なバイオフォーマットプラグインが開きます。バイオフォーマットプラグインは、他のマイクロスコープブランド、例えばニコン顕微鏡から生成されたnd2ファイルから生成された画像ファイルを開くためにも必要です。このプラグインはフィジーとプリインストールされています。 - スタック表示タブから[データブラウザ]を選択し、バイオフォーマットプラグインのメモリ管理タブから仮想スタックを使用します。
注: 8- 10 の脳からの z スタックを持つ Lif ファイルは、多くの場合、300 ~ 400 メガバイトのサイズです。RAMが少ないコンピュータでは、そのようなファイルをいくつか開くと、ImageJで利用可能なRAMが急速に使い果たされ、それ以上の画像処理が妨げられます。仮想スタックは「読み取り専用」であり、処理に高い RAM を必要とせず、大きなデータセットをフィジーに読み込むには理想的なオプションです。 - ImageJ に表示されるマルチチャンネル画像を確認します。[イメージ] |のカラー チャネル ツール を使用して、メニュー バーから チャネルの色|変更します。CB領域の大きな丸い細胞としてミランダ標識されたNBを観察してください。
- NB を 2 回カウントしないように、 各 NB の楕円ツールを使用して関心領域 (ROI) を描画します。
- ImageJ メニュー バーから[分析]を選択|ツール|ROI マネージャー.現在の Z セクションのすべての NB をマークし、各セルをマークした後でtを押します。
- 現在の z セクション内のすべての NB がマークされたら、チャネルを pH3 および EdU に変更し、手動で EdU 陽性 NB、pH3 陽性 NB、EdU と pH3 の両方について正に染色される NB、および両方のマーカーに対して染色しない NB の数をカウントします。
- 後続の z セクションで NB を検索し、古い RO を削除し、新しい RO を追加して、別のスタック内の NB をカウントします。
- 次の列を使用してスプレッドシートを準備します: 1. EdU- pH3-: このセクションは、セル周期の G0/G1 フェーズにある二重陰性セルを表します。2. EdU+:このカテゴリの細胞は、EdUを組み込み、DNA複製(S相)を受けている。3. EdU+ pH3+: これらの二重陽性細胞は、S相を完了し、G2またはM相に進行している;4. pH3+: これらの NB は有糸分裂を受けている。
- 各ローブについて上記の4つのカテゴリすべてに存在するNBの割合を計算します。各カテゴリの MB の割合のプールされたデータを示すスプレッドシート ソフトウェアを使用して棒グラフを準備します。
結果
二葉性 ショウジョウバエ 第3次インスター幼虫脳は、基本的な細胞および発達過程9を研究するためのモデルシステムとして利用されてきた。現在の研究の焦点は、CB領域のEdU-およびpH3標識されたNBsにおける細胞周期進行の分析のためのプロトコルを提示することであった(図1)。CB NB はタイプ I とタイプ II にサブタイプ化され、特性非対称分割パターン9が表示されます。各タイプI NB部門は、自己更新が可能なNBと、分化9のために運命付けされた別のGMCを生成する。対照的に、II型NBは、自己更新し、2つの遺伝子組み換え9を生成するトランジット増幅、未熟な神経前駆細胞(INP)を生成します。異なるNB集団はOL領域に存在するが、この研究は、NB特異的マーカーで大きく容易に識別可能なCB NBに焦点を当てた。
この研究では、ミランダはCB NBを同定し、分析するために使用されました(図2)。ミランダはまた、OLで他の細胞集団を染色するが、CBのNBsは、その大きなサイズとCB位置13のためにミランダと識別することができる。他のより具体的なマーカーは、NB自己再生を調節する転写因子であるデッドパンなどのCB NBのラベルにも使用できます。しかし、pH3とEdUの両方がクロマチンをマークするように、膜マーカーミランダは、pH3とEdUでマークされたNBを視覚化し、分析することを容易にするために使用されました。EdUの組み込み、その後の検出、および免疫染色および画像解析によるさらなる特性評価は、複雑な手順である。最適な染色とイメージング条件を決定するには、各ステップを標準化することが重要です。一部の公開レポートでは、EdU/pH3 ラベリング戦略が提示されていますが、これらのレポートでは最適化と画像解析の手順について詳しく説明していません。 図 1 に示すワークフローは、画像解析までの EdU の組み込みから手順をまとめます。
我々は最近、正常な有糸分裂性進行11のためにNBsによって必要とされるMms19遺伝子を特徴付けた。実細胞イメージング分析を通じて、機能的なMms19を欠いているNBは、有糸分裂を終えるために野生型NBの2倍の時間がかかることを示した。これは、野生型のNBs(図3A)と比較して、M相にMms19P NBsの有意に高い割合を有することが判明したEdU/pH3分析に明確に反映された。Mms19の発現:::IGFP融合タンパク質のMms19Pバックグラウンドでは、表現型欠損11,15を救うために示されていた。これは、M相における細胞の割合がMms19:::eGFP発現のMms19 Pバックグラウンドで野生型レベルに救出された細胞周期進行分析の結果と良好に相関した(図3A、B)。

図1:EdU/pH3デュアルラベリングの簡略化されたワークフロー 第3のインスター幼虫脳を解剖し、100 μM EdUで2時間インキュベートした。続いて、脳組織をPFAで固定し、ミランダおよびpH3に対する抗体で免疫染色した。染色された脳の画像は共焦点顕微鏡で得られ、さらにImageJ/Fijiで処理され、細胞を異なる細胞周期相に割り当てた。略語: EdU = 5-エチニル-2'-デオキシウリジン;pH3 = ホスホヒストン H3;PFA = パラホルムアルデヒド;SM = シュナイダー解剖媒体;PBS = リン酸緩衝生理食塩分;PBST = PBS + 0.3% 非イオン性洗剤;BSA = ウシ血清アルブミン。 この図の大きなバージョンを表示するには、ここをクリックしてください。
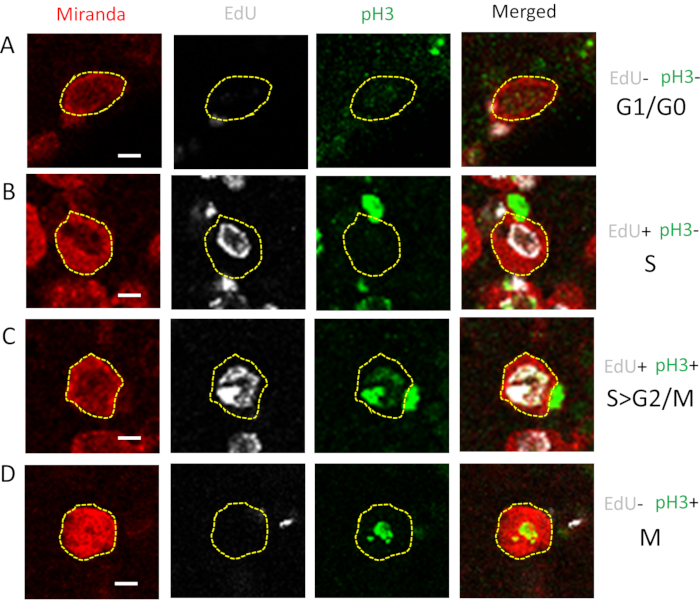
図2:G1/G0へのセルの割り当てS;S>G2/MおよびMのフェーズ。細胞はG1、S、G2、Mの各相を経て全細胞周期を完了します。第3インスター幼虫脳をさまようことからCB NBは、ミランダ(赤)、EdU(灰色)、pH3(緑)、およびDNAがHoechst 33342(青)で標識された。ラベル付きNBsはImageJで分析され、(A)EdUもpH3(G1/G0)も正に染色されていないかどうか、(B)EdU(S相)、(C)EdUとpH3(S>G2/M)の両方に対して正に染色されたかどうか、および(D)pH3(M相)のみに割り当てられた。野生型脳からのみ個々のNBの例を示します。スケールバー= 5 μm略語: CB = 中枢脳;NB = 神経芽細胞;EdU = 5-エチニル-2'-デオキシウリジン;pH3 = ホスホヒストン H3.この図の大きなバージョンを表示するには、ここをクリックしてください。
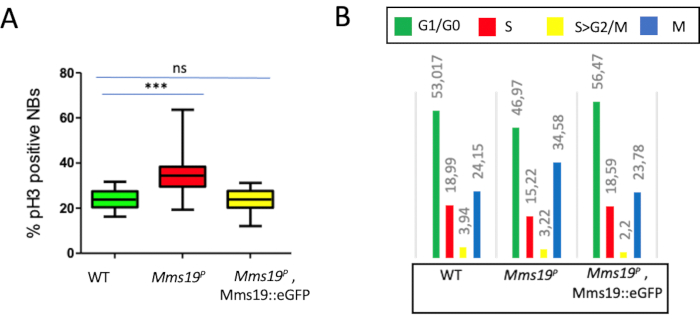
図3:NB細胞周期期分布に対するMms19Pの影響(A) 野生型(w;+;+)NBの分析を行った結果、〜25%のNBがM相であることが判明した。しかし、Mms19P NBでは、この割合はほぼ40%に増加しました。Mms19::ms19PバックグラウンドにおけるeGFP発現は、Mms19P表現型を救うために知られており、この背景のM相NBの割合は野生型に匹敵するものでした。(B) 細胞周期期G1/G0、S、S>G2/M、Mに対応する4つのカテゴリーにおけるNBの割合を野生タイプで比較した。Mms19P、および Mms19::eGFP、Mms19 P遺伝子型。M相相とG1/G0相の割合は、野生型のNBと比較して、Mms19P NBsで大きく異なります。対照的に、Mms19::eGFP、Mms19 P脳におけるNBの細胞周期分布は、野生型に見られるものと同等である。統計的有意性は、Kruskal-Wallis検定を使用して計算され、ダンの後検定を使用して比較された複数の列。(P<0.001)この図は11から変更されています。略語: NB = 神経芽細胞;eGFP = 強化された緑色蛍光タンパク質;WT = ワイルドタイプ。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 試薬 | 金額/ボリューム |
| EdU (コンポーネント A) | 5 mg |
| アレクサ・フルオール 647 – アジド (成分 B) | 1バイアル |
| ジメチルスルホキシド(DMSO、C成分) | 4 mL |
| クリック-iT EdU反応バッファー(成分D) | 4 mL (10x溶液) |
| 硫酸銅(CuSO4、成分E) | 100 mM;1バイアル |
| クリック-iT EdU バッファー添加剤 (コンポーネント F) | 400 mg |
| Hoechst 33342 (コンポーネント G) | 10 mg/mL 水中、35 μL |
表1:EdUキット部品 Click-iT EdU Alexa Fluor細胞増殖キットとそれぞれの量/体積に付属するコンポーネント。略語: EdU = 5-エチニル-2'-デオキシウリジンを有する。
| 反応成分 | ボリューム (mL) |
| 1x クリック-iT反応バッファー (ステップ 1.4 で準備) | 430 |
| CuSO4 (コンポーネント E) | 20 |
| アレクサフルオール647 – アジド (コンポーネントB, ステップ1.3で準備) | 1.2 |
| 反応緩衝添加剤(成分F、ステップ1.5で調製) | 50 |
| 総量 | ~500 |
表2:EdU検出カクテルの調製 EdU検出カクテルは、キットコンポーネントの示された量を混合して調製した(セクション2で用意)。略語: EdU = 5-エチニル-2'-デオキシウリジンを有する。
ディスカッション
EdU の組み込みとその続く細胞透過性アジドとの "クリック" 反応は、前の7で使用した BrdU メソッドよりもこの手法の実用的な利点を提示します。しかし、この反応はCu(I)イオンによって触媒され、いくつかの色素は、この銅触媒の存在下で不安定である可能性があり、Click-it EdUキットメーカーによって明確に助言される。EdU検出ステップを実行した後に免疫染色実験を行った場合、赤色チャネル色素、Alexa Fluor 568およびCy3では期待されるシグナル強度は認められなかった。しかし、このプロトコルは、EdU検出ステップの前に免疫染色反応が完了したときに機能した。このプロトコルでは、4つのチャンネルを使用して、Hoechst、pH3、ミランダ、およびEdUを可視化しました。
このプロトコルのもう一つの最適化されたステップは、幼虫にEdUスパイクフライフードを供給するのではなく、解剖された脳によるEdUの取り込みでした。完全な ショウジョウバエ NB細胞周期は約2-2.5 h16で持続するので、このプロトコルのように脳によるEdU取り込みは、脳の1つの完全な細胞周期の追跡を可能にする。第3のインスター幼虫の場合、これらの静止細胞は細胞周期のG1段階にある可能性が最も高い。しかし、後期胚から初期の第2段階のインスター段階まで、NBsは一時的に静止17になる。これらの初期の発達段階では、二重陰性染色はG0/静止期を表す可能性が最も高い。
DNA複製を行っているNBはEdUに対して積極的に染色する必要がありますが、S相(EdU)から後期G2またはM相に進行した細胞は、EdUとpH3の両方で積極的に染色する必要があります。しかし、初期のG2細胞はEdUまたはpH3に対して積極的に染色されないので、G2相の特徴付けはこのプロトコルでは困難であろう。しかし、EdUを組み込み、G2初期に進行した細胞も、EdUのために積極的に染色され、G2相の分析を複雑にする可能性があります。DNA複製を阻害するいくつかの薬物は、S相18、19、20において細胞周期停止を引き起こす。このプロトコルは、S相ブロック細胞がM相に進行せず、EdUの画分が低下したり、この場合には存在しないといった薬物治療の効果を分析し、同定するのに便利なツールとなり得る。
最近発表された研究では、NBs11における有糸分裂性進行に対するMms19遺伝子の効果を評価した。生細胞イメージングを通じて、M相進行におけるMms19P NBの劇的な遅延を実証しました。野生型のNBsはM相を10分程度で完了しますが、Mms19P NBはM相11を終えるのに約2倍の時間がかかりました。したがって、このEdU/pH3デュアルラベル付けプロトコルは、野生型脳と比較してMms19P脳のpH3に対して陽性染色するNBがほぼ1.5倍観察されたため、有糸分裂遅延を反映した。このEdUプロトコルからのデータは、したがって、直接のライブセルイメージング結果と同等である。このような直接の、ライブセルアプローチは時間がかかり、広範な最適化を必要とするため、このプロトコルは、特定の段階で欠陥を理解するために、このような細胞周期変異体の迅速な初期スクリーニングを行うために利用することができる。関心のあるフェーズが特定されると、これは直接細胞可視化アッセイによってフォローアップすることができます。
細胞周期期は、細胞タイプや発生段階によって大きく異なる場合があります。例えば、ショウジョウバエ胚の開発において、有糸分裂性キナーゼのダウンレギュレーションはS相の延長期間をもたらし、フェレット(ムスレ・プトリウス・フロー)のような分化のために肥脂した細胞では脳神経前駆細胞は、S相持続時間が著しく短い21,22である。EdUパルス標識時間は、このように与えられた細胞タイプのSおよびG相の長さに応じて最適化されるべきである。EdUパルスの持続時間も実験目的に依存し、例えば、短いパルスは現在S相中の細胞の分画を測定するのに十分であり、一方、より長いパルスはS相を通して細胞の進行の分析を可能にする。
EdUパルスの広範な最適化は、ペレイラと同僚23によってエレガントに実証されたように、S相の推定を可能にするかもしれません。これらの研究者は、HCT116細胞が増分期間EdUでパルス標識された新しいフローサイトメトリーベースの方法を実証した。著者らは、脈動時間がS相23の長さと一致する場合に、EdUの最大蛍光強度が得られることを実証した。さらに、EdU標識細胞の経時的な進行の分析は、G1およびG2/M相の定量化も可能にした。EdU/pH3デュアルラベリングの現在のプロトコルは、SおよびM位相欠陥の解析を可能にしますが、このプロトコルでは位相の正確な持続時間を測定することはできません。ペレイラと同僚が説明したプロトコルは、細胞周期の位相長さの決定を必要とするアッセイに適した代替手段となり得る。このプロトコルを追加のpH3標識と一緒に適応させることは、M相細胞の検出においてより高い感度をもたらす可能性もある。
EdU/pH3アプローチとは別に、fルオレシスuビキチンベース細胞周期指標(FUCCI)法は、ショウジョウバエ組織24,25と同様に哺乳動物細胞における細胞周期の進行を研究するためにも利用されている。このシステムは、APC/CおよびSKP2による特異的ユビキチン化およびプロテアソーム分解のモチーフを含む2つの蛍光タグタンパク質、ジェミニンおよびCdt1を利用する。APC/Cは、有糸分裂の終わりからG1およびSCFSkp2がSおよびG2相において活性であるのみであり、蛍光タグ付きゲミニンおよびCdt1の細胞周期段階特異的分解により、細胞周期相24の決定が可能となる。ショウジョウバエ組織に対するわずかに改変された「Fly-FUCCI」法は、代わりに、蛍光タグ付きCyclin BおよびE2F1に依存し、APC/C(有糸分裂中)およびCRL4Cdt2(S相発症時)によってそれぞれ25である。無数分解法に応答してショウジョウバエ幼虫NBの早期分化を特徴付ける以前の研究は、Fly-FUCCIおよびEdU/pH3の両方の方法によって細胞周期欠陥を分析した4。異数化は、NBの早期分化を誘発し、したがって、NBの高い分画が細胞周期を終了する。
これは、フライ・フッチとEdU/pH3データ4の両方に正確に反映されました。したがって、EdU/pH3法から得られたデータは、Fly-FUCCIのような他の細胞周期追跡方法と同様である。Fly-FUCCIは強力なツールであり、組織特異的プロモーターに融合したユビキタスに駆動される蛍光マーカーまたはマーカーを持つすべてのフライストックは、ストックセンターから入手可能です。しかし、これらの構築物を使用して、ヌル突然変異体またはsiRNAノックダウンで細胞周期欠陥を分析することは、FUCCI要素、組織特異的ドライバー、特定の突然変異、または関心のあるsiRNAを運ぶフライストックを作成するために遺伝子組み換えを伴うであろう。このプロセスは実際の実験を数週間遅らせる一方で、EdU/pH3法は遺伝的ヌルバックグラウンドを持つフライラインに容易に適用できる。あるいは、siRNAのノックダウンのために、ドライバストックとsiRNAストックの間のワンステップクロスをEdU/pH3分析に利用することができます。
このアプローチの欠点の1つは、イメージングと画像解析パイプラインであり、複数の脳サンプルから多数の細胞を手動で定量化します。近年、フローサイトメトリー手法は、細胞周期解析26のための従来の顕微鏡ベースのアッセイに代わるハイスループットの代替として提示されている。このアプローチで同時に数千個の細胞を迅速に分析すると、複数のマーカーを検出する機能が特定の細胞タイプの定量化を可能にします。培養細胞株では容易に使用できるが、このプロトコルはショウジョウバエ幼虫脳のような大きな組織サンプルに適用することは困難である。しかしながら、脳組織の解離と、フローサイトメトリー27,28による単離幼虫NBの分析を記述するいくつかのプロトコルが公開されている。この方向におけるさらなる革新的なアプローチは、ショウジョウバエ組織におけるハイスループット細胞周期解析のための新たな機会を提示するかもしれない。
開示事項
著者らは、競合する利益は存在しないと宣言している。
謝辞
この研究は、スイス国立科学財団(プロジェクト補助金31003A_173188;www.snf.ch)とベルン大学(www.unibe.ch)からBSへの資金提供によって支えられました。資金提供者は、研究デザイン、データ収集、分析、出版の決定、原稿の作成に何の役割も持っていませんでした。
資料
| Name | Company | Catalog Number | Comments |
| fly stocks | |||
| P{EPgy2}Mms19EY00797/TM3, Sb1 Ser1 (Mms19p) | Bloomington stock center | #15477 | P-element insertion in the third exon of Mms19 |
| +; Mms19::eGFP, Mms19p | Generated in house | eGFP-tagged Mms19 protein expressed in Mms19p background | |
| w1118 | Bloomington stock center | #3605 | wild-type stock (w;+;+) |
| Primary antibodies | Dilution | ||
| Rat anti-Miranda | Abcam | Ab197788 | 1/250 |
| Rabbit anti-pH3 | Cell Signaling | 9701 | 1/200 |
| Secondary antibodies | |||
| Goat anti-Rat Cy3 | Jackson Immuno | 112-165-167 | 1/150 |
| Goat anti-Rat Alexa Fluor 568 | Invitrogen | A11077 | 1/500 |
| Goat anti-Rabbit Alexa Fluor 488 | Invitrogen | A27034 | 1/500 |
| Reagent/Kit | |||
| Aqua Poly/Mount mounting medium | Polysciences Inc | 18606-20 | |
| Click-it EdU incorporation kit, Alexa Flour 647 | Thermo Fischer Scientific | C10340 | |
| Schneider’s Drosophila medium | Thermo Fischer Scientific | 21720-024 | |
| Bovine serum albumin (BSA) fraction V | Merck | 10735078001 | |
| Triton X-100 | Fischer Scientific | 9002-93-1 | non-ionic detergent |
| Software | |||
| Fiji (Imagej) | https://imagej.net/Fiji | ||
| Leica Application Suite (LAS X) | Leica microsystems | ||
| PRISM | Graph pad software | Version 5 | |
| Microsoft Excel | Microsoft office | 2016 | |
| Equipment | |||
| Leica TCS SP8 laser scanning confocal microscope with 63x oil-immersion, 1.4 NA Plan-apochromat objective | |||
| Materials | |||
| Aqua Poly/Mount mounting medium | water-soluble, non-fluorescing mounting medium | ||
| Pyrex 3 or 9 depression glass spot plate | |||
| Whatman filter paper |
参考文献
- Harashima, H., Dissmeyer, N., Schnittger, A. Cell cycle control across the eukaryotic kingdom. Trends in Cell Biology. 23 (7), 345-356 (2013).
- Vermeulen, K., Van Bockstaele, D. R., Berneman, Z. N. The cell cycle: a review of regulation, deregulation and therapeutic targets in cancer. Cell Proliferation. 36 (3), 131-149 (2003).
- Pardee, A. B. A restriction point for control of normal animal cell proliferation. Proceedings of the National Academy of the Sciences of the United States of America. 71 (4), 1286-1290 (1974).
- Gogendeau, D., et al. Aneuploidy causes premature differentiation of neural and intestinal stem cells. Nature Communications. 6, 8894 (2015).
- Barnum, K. J., O'Connell, M. J. Cell cycle regulation by checkpoints. Methods in Molecular Biology. 1170, 29-40 (2014).
- Gratzner, H. G. Monoclonal antibody to 5-bromo- and 5-iododeoxyuridine: A new reagent for detection of DNA replication. Science. 218 (4571), 474-475 (1982).
- Salic, A., Mitchison, T. J. A chemical method for fast and sensitive detection of DNA synthesis in vivo. Proceedings of the National Academy of the Sciences of the United States of America. 105 (7), 2415-2420 (2008).
- Kim, J. Y., et al. The value of phosphohistone H3 as a proliferation marker for evaluating invasive breast cancers: A comparative study with Ki67. Oncotarget. 8 (39), 65064-65076 (2017).
- Homem, C. C., Knoblich, J. A. Drosophila neuroblasts: a model for stem cell biology. Development. 139 (23), 4297-4310 (2012).
- Daul, A. L., Komori, H., Lee, C. Y. EdU (5-ethynyl-2'-deoxyuridine) labeling of Drosophila mitotic neuroblasts. Cold Spring Harbor Protocols. 2010 (7), 5461 (2010).
- Chippalkatti, R., Egger, B., Suter, B. Mms19 promotes spindle microtubule assembly in Drosophila neural stem cells. PLoS Genetics. 16, 1008913 (2020).
- Daul, A. L., Komori, H., Lee, C. Y. Immunofluorescent staining of Drosophila larval brain tissue. Cold Spring Harbor Protocols. (7), (2010).
- Mollinari, C., Lange, B., Gonzalez, C. Miranda, a protein involved in neuroblast asymmetric division, is associated with embryonic centrosomes of Drosophila melanogaster. Biology of the Cell. 94 (1), 1-13 (2002).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Nag, R. N., Niggli, S., Sousa-Guimaraes, S., Vazquez-Pianzola, P., Suter, B. Mms19 is a mitotic gene that permits Cdk7 to be fully active as a Cdk-activating kinase. Development. 145 (2), (2018).
- Cabernard, C., Doe, C. Q. Live imaging of neuroblast lineages within intact larval brains in Drosophila. Cold Spring Harbor Protocols. 2013 (10), (2013).
- Hartenstein, V., Spindler, S., Pereanu, W., Fung, S. The development of the Drosophila larval brain. Advances in Experimental Medicine and Biology. 628, 1-31 (2008).
- Hebar, A., Rutgen, B. C., Selzer, E. NVX-412, a new oncology drug candidate, induces S-phase arrest and DNA damage in cancer cells in a p53-independent manner. PLoS One. 7, 45015 (2012).
- Wyllie, F. S., et al. S phase cell-cycle arrest following DNA damage is independent of the p53/p21(WAF1) signalling pathway. Oncogene. 12 (5), 1077-1082 (1996).
- Xu, X., et al. Inhibition of DNA replication and induction of S phase cell cycle arrest by G-rich oligonucleotides. Journal of Biological Chemistry. 276 (46), 43221-43230 (2001).
- Duronio, R. J. Developing S-phase control. Genes & Development. 26 (8), 746-750 (2012).
- Turrero Garcia, M., Chang, Y., Arai, Y., Huttner, W. B. S-phase duration is the main target of cell cycle regulation in neural progenitors of developing ferret neocortex. Journal of Comparative Neurology. 524 (3), 456-470 (2016).
- Pereira, P. D., et al. Quantification of cell cycle kinetics by EdU (5-ethynyl-2'-deoxyuridine)-coupled-fluorescence-intensity analysis. Oncotarget. 8 (25), 40514-40532 (2017).
- Sakaue-Sawano, A., et al. Visualizing spatiotemporal dynamics of multicellular cell-cycle progression. Cell. 132 (3), 487-498 (2008).
- Zielke, N., et al. Fly-FUCCI: A versatile tool for studying cell proliferation in complex tissues. Cell Reports. 7 (2), 588-598 (2014).
- Shen, Y., Vignali, P., Wang, R. Rapid profiling cell cycle by flow cytometry using concurrent staining of DNA and mitotic markers. Bio-protocol. 7 (16), 2517 (2017).
- Berger, C., et al. FACS purification and transcriptome analysis of drosophila neural stem cells reveals a role for Klumpfuss in self-renewal. Cell Reports. 2 (2), 407-418 (2012).
- Harzer, H., Berger, C., Conder, R., Schmauss, G., Knoblich, J. A. FACS purification of Drosophila larval neuroblasts for next-generation sequencing. Nature Protocols. 8 (6), 1088-1099 (2013).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved