Method Article
マイクロ流体混合プラットフォームを用いた遺伝子導入のための脂質ナノ粒子の作製と特性化
要約
脂質ナノ粒子は、mRNAおよびDNAカプセル化のためのマイクロ流体混合プラットフォームアプローチを用いて開発される。
要約
脂質ベースの薬物キャリアは、サイズが小さく、生体適合性、高いカプセル化効率のために、臨床的および商業的に入手可能な送達システムに使用されてきました。核酸をカプセル化する脂質ナノ粒子(LnPs)の使用は、RNAまたはDNAを分解から保護するのに有利であり、細胞の取り込みを促進する。LNPは、多くの場合、イオン化可能な脂質、ヘルパー脂質、コレステロール、ポリエチレングリコール(PEG)結合脂質を含む複数の脂質成分を含みます。LNPは、イオン化可能な脂質存在に起因する核酸を容易に封入することができ、これは低pHでカチオンであり、負に荷電したRNAまたはDNAとの複合体化を可能にする。ここでLNPは、有機相中の脂質成分と核酸成分を水相で迅速に混合してメッセンジャーRNA(mRNA)またはプラスミドDNA(pDNA)を封入することによって形成される。この混合は精密なマイクロ流体混合プラットフォームを使用して行われ、層流を維持しながらナノ粒子自己集合を可能にする。流体力学のサイズと多分散は、ダイナミック光散乱(DLS)を使用して測定されます。LNP上の有効表面電荷はゼータ電位を測定することによって決定される。カプセル化効率は、蛍光色素を使用して、封じ込められた核酸を定量化することを特徴としている。代表的な結果は、この方法の再現性と、異なる製剤およびプロセスパラメータが開発されたLNPに及ぼす影響を示す。
概要
薬物キャリアは、低細胞毒性、バイオアベイラビリティの増加、および安定性の向上1、2、3を含む典型的な好ましい特性を有する治療を保護し、提供するために使用される。ポリマーナノ粒子、ミセル、および脂質ベースの粒子は、核酸カプセル化および送達4、5、6、7について以前に検討されてきた。脂質は、高い安定性8と生体適合性であるため、リポソーム、および脂質ナノ粒子を含む異なるタイプのナノキャリア系で使用されてきた。LNPは遺伝子送達用核酸を容易に封入できる9,10.それらは、全身循環11の間に血清プロテアーゼによる分解から核酸を保護し、特定の部位への送達を改善することができ、LNPの表面地形および物性がそれらの生物分布12に影響を及ぼす。LNPはまた、組織の浸透と細胞の取り込み9を改善します。これまでの研究では、2018年に米国食品医薬品局(FDA)および欧州医薬品庁によって承認された遺伝性経サイレチン媒介性アミロイドーシス14治療の治療用siRNA治療を含む最初の市販LNPを含むLNP13内でのsiRNAカプセル化の成功が実証されている。最近では、Lnpは、より大きな核酸部分、すなわちmRNAとDNA9の送達のために研究されている。2018年現在、臨床試験を受けている脂質ベースの核酸送達系は~22個あった。さらに、LNPを含むmRNAは現在有力な候補であり、COVID-19ワクチン15,16に採用されている。これらの非ウイルス性遺伝子治療の潜在的な成功は、核酸のカプセル化が高い小さな(〜100nm)、安定した均一な粒子を形成する必要があります。
LNP製剤中の主成分としてのイオン化可能脂質の使用は、複素化、カプセル化、及び送達のeffciciency14に対する利点を示している。イオン化可能な脂質は、典型的には酸解離定数(pKa)を有<7;例えば、ジリノールメチル-4-ジメチルアミノブチレート(D-Lin-MC3-DMA)は、FDA承認LNP製剤に用いられるイオン化可能な脂質を、6.4417のpKaを有する。低pHでは、イオン化可能な脂質上のアミン基がプロトン化され、正に荷電し、mRNAおよびDNA上に負に荷電したリン酸基を有する組立が可能になる。アミンの比率は、「N」、リン酸塩に対する基、「P」、基が組み立てを最適化するために使用される。N/P比は、使用される脂質および核酸に依存し、製剤18によって異なる。形成後、pHは中性または生理学的pHに調節して、治療的投与を可能にすることができる。これらのpH値では、電化可能な脂質も脱プロトン化され、中性表面電荷をLNPに付与する。
このイオン化脂質は、内経脱出19,20にも役立つ。LNPは細胞取り込み中にエンドサイトーシスを受け、細胞細胞質またはDNA貨物にmRNA貨物を核21に送達するためにエンドソームから放出されなければならない。内の内部は、通常、細胞外媒体よりも酸性の環境であり、イオン性脂質を正に22、23に充電する。正に荷電したイオン化可能な脂質は、内膜脂質膜上の負電荷と相互作用し、これが、LNPおよび核酸の放出を可能にする内因性の不安定化を引き起こす可能性がある。異なる電化脂質は、現在、両方のLNP分布の有効性を改善するために研究されている、 ならびに内経体脱出14。
LNPの他の典型的な成分は、ホスファチジルコリン(PC)またはホスホエタノールアミン(PE)脂質などのヘルパー脂質を含む。1,2-ジオレオイル-sn-グリセロ-3-ホスホエタノールアミン(DOPE)、1,2-ディステアロイル-sn-グリセロ-3-ホスホコリン(DSPC)、および1,2-ジオレオイル-snグリセロ-3-ホスホコリン(DOPC)が一般的に使用されているヘルパー脂質24,25。DOPEは、反転六角形II(HII)相を形成し、膜融合26によってトランスフェクションを増強することが示されているが、DSPCはその円筒形状27でLNPsを安定化させると考えられている。コレステロールはまた、膜剛性を高めるために製剤に組み込まれ、その後、LNPの安定性を助ける。最後に、脂質共役ポリエチレングリコール(PEG)が、粒子自己集合性27に助けるために必要な立体的障壁を提供するために製剤に含まれる。また、PEG は集約を防止することで LNP のストレージの安定性を向上させます。さらに、PEG はステルスコンポーネントとしてよく使用され、LNP の循環時間を長くすることができます。しかし、この属性はまた、アポリポタンパクE(ApoE)28によって駆動される内因性標的機構を介して肝細胞へのLNPの採用に対する課題を提起する可能性がある。従って、研究は、LNPからのPEGの拡散のためのアシル鎖長さを調査し、短い長さ(C8-14)がLNPから解離し、より長いアシル長28と比較してApoE採用に対してより適性であることを発見した。また、PEGが共役する脂質尾の飽和度合いは、LNPs29の組織分布に影響を与えることを示している。近年、Tween 20は、生物学的薬剤製品製剤に一般的に使用される界面活性剤であり、長い不飽和脂質尾を有するが、PEG-DSPEと比較してリンパ節の排出において高いトランスフェクションを有することが示されたが、これは注射部位29で筋肉を大部分トランスフェクトした。このパラメータは、望ましいLNPバイオディストリビューションを達成するために最適化することができます。
LNPsの形成の従来の方法は、薄膜水和法およびエタノール注入法27を含む。これらは容易に入手できる技術であるが、それらはまた、労働集約的であり、低いカプセル化効率をもたらし、そして27をスケールアップすることは困難である。混合技術の進歩は、より均一な粒子27を開発しながら、スケールアップに適した方法をもたらしました。これらの方法には、T-接合部混合、ずらしてヘリンボーン混合、及び微流体流体力学的集化27が含まれる。各方法は、固有の構造を有するが、全ては、脂質成分を含む有機相を有する核酸を含む水相を迅速に混合することを可能にし、結果として核酸27の高い封入を生じる。このプロトコルでは、マイクロ流体カートリッジを介した迅速かつ制御混合が利用され、ずらしたヘリンボーン混合設計を採用しています。このプロトコルは、LNPを含む核酸の調製、組立、および特性を概説する。
プロトコル
全体的なプロセスの概略を図 1に示します。
1. バッファの準備
注:バッファーの滅菌フィルタリングは、核酸およびLNP品質に影響を与える可能性のある微粒子を除去するために、ここで非常に推奨されています。
- リン酸緩衝生理食塩分 (PBS)
- 8 mM Na2HPO4、2mM KH2PO4、137 mM NaCl、およびヌクレアーゼフリー水で2.7 mM KClを使用して1x PBSを準備し、pHを7.4に調整します。
- 0.22 μmの細孔サイズフィルターを使用して真空濾過により滅菌します。
- クエン酸バッファ
- クエン酸ナトリウム5mM、クエン酸5mM、ヌクレアーゼフリー水中の塩化ナトリウム150mMを使用してクエン酸緩衝液を調製し、pH 4.5に調整します。
- 0.22 μmの細孔サイズフィルターを使用して真空濾過により滅菌します。
注: クエン酸バッファーは、mRNA が LNP にカプセル化される核酸である場合にのみ準備する必要があります。DNAがカプセル化される場合は、1.2をスキップし、1.3に進みます。
- リンゴ酸バッファー
- ヌクレアーゼフリー水中で20mMリンゴ酸と30mMの塩化ナトリウムを使用してリンゴ酸緩衝液を調製し、pH3.0に調整します。
- 0.22 μmの細孔サイズフィルターを使用して真空濾過により滅菌します。
注: リンゴ酸バッファーは、DNA が LNP にカプセル化される核酸である場合にのみ準備する必要があります。mRNAをカプセル化する場合は、1.3をスキップします。クエン酸緩衝液は、リンゴ酸緩衝液を有する3.0の低いpHとして、mRNAカプセル化に使用され、mRNA分解の可能性を高める可能性がある。プロトコルはここで一時停止することができます。
2. 脂質混合の調製
- ストック脂質が粉末状の場合は、純粋な200の証拠エタノールで可溶化する。
- 所望のモル比に基づいて、必要な脂質成分の混合を計算します。50:10:39:1のモル比(イオン化脂質:ヘルパー脂質:コレステロール:PEG)は、10 mMの総脂質濃度の例としてここで使用されます。 表1 は、これらの各成分に必要な濃度と体積を示しています。
注:マイクロ流体ミキサーのエタノール中の脂質混合濃度(EtOH)を達成するために必要な体積を計算する場合、総体積はEtOHの添加が脂質濃度に影響を与えないことを確実にするために考慮される。例えば、68.5μLのイオン化可能な脂質量は、エタノール中の5mM濃度に総脂質混合容積533μLを掛け、その後、38.9mMのストック脂質濃度で割ることによって計算されます。 - 各脂質ストック溶液の適切な量をガラスバイアルに加え、成分が断続的なボルテックスと混合できるようにします。533 μL の混合を合計する場合は、200 個の証拠エタノールを追加します。 表1の例では、これは254μLのエタノールです。
注:1回のランで1mLのLNPを生成するには、342.5 μLの脂質溶液が必要です。これは、サンプル採取前後の体積を持つ有機脂質溶液に対する水性核酸の3:1ミックスによるものです。533 μLの混合は超過として償うためになされる。
3. 核酸溶液の調製
注:核酸溶液の調製と取り扱いは、可能な限り無菌でRNaseフリーの環境で行われるようにします。核酸で可能な限りバイオセーフティキャビネットで作業してください。
- N/P比を計算します。N/P比は、負に荷電した核酸リン酸基(P)の総数に対するイオン化可能脂質アミン基(N)の総数である。N/P比は、多くの場合、LNP形成中に最適化することができるパラメータです。以下の手順に従います。
- 以下の数式を使用して、N 単位の数を計算します。
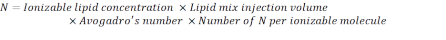
注:イオン化可能な脂質濃度(表1)は5 mMであり、これは5 x10-6 mol/mLに相当する。必要な脂質注入容積は0.3425 mLである。例えば、分子当たりのN単位数が1である場合、上記の式を用いて、脂質混合には1.03 x10 18N 単位がある。 - 目的の N/P 比の P 単位を計算します。ここでは、N/P = 36 が使用されます。
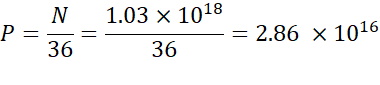
- 以下の数式を使用して、N 単位の数を計算します。
- 以下の式を使用して2.86 x 1016 P単位を得るために必要な核酸濃度を計算する。
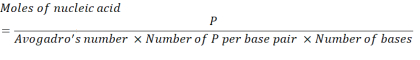
ここで、mRNAの塩基対当たりのP単位数は1、DNAは2である。1,200塩基のmRNAの場合、N/P = 36に必要なmRNAの量は3.96 x10-11 モルです。 - 以下の式を用いて、N/P=36に必要なmRNAの質量濃度を計算する。

リボヌクレオチド一リン酸単位の平均分子量は322g/mol30である。1,200基のmRNAを用いて、mRNAの分子量は386,400 g/molである。核酸溶液の必要な注入量は1.028 mLである。したがって、必要なmRNAの濃度は1.488x10-5 g/mLであり、これは14.88 μg/mLである。 - クエン酸バッファー内の mRNA の 14.88 μg/mL の 1.5 mL を構成します。
注:DNAが核酸をカプセル化する場合は、リンゴ酸バッファーを使用して核酸溶液を構成してください。
4. マイクロ流体チャネルのプライミング
メモ:このプロトコルは、機器メーカーのガイドラインに基付けされています。
- 適切なフィールドをクリックして、プライミングパラメータを計測器ソフトウェアに入力します(表2)。
注: 流量比は 3:1、流量率は 4~12 mL/minを推奨します。これは、ここで提示された研究だけでなく、メーカーによって最適であることが示されています。これは、アプリケーションに対して関心がある場合に変更できます。 - 器具の蓋を開け、マイクロ流体カートリッジを回転ブロックに挿入します。
- 1 mL シリンジに少なくとも0.5 mLのエタノールを引き込み、シリンジ先端に気泡やエアギャップがないことを確認します。この注射器をカートリッジの右入口に積み込みます。
- 3 mL のシリンジに水性バッファー (DNA の RNA 用クエン酸とリンゴ酸) を 1.5 mL 充填し、気泡や隙間がないことを確認します。この注射器をカートリッジの左入口に積み込みます。
- クリップホルダーに2本の15 mL円錐形チューブを挿入して、廃棄物容器として使用します。
- 計測器ソフトウェアで [実行 ]をクリックしてミキシングを開始し、パラメータが正しく入力されていることを確認します。
- 底の青色光が止んで示されるプライミングが停止したら、蓋を開け、円錐形のチューブとシリンジを適切に処分します。
5. LNPの形成
メモ:このプロトコルは、機器メーカーのガイドラインに基付けされています。
- 適切なフィールドをクリックして、定式化パラメータを使用してソフトウェアを更新します (表 2)。
- 1 mL シリンジに脂質混合液を充填します(ステップ2で作成)。シリンジチップのエアギャップや泡を取り外し、シリンジをカートリッジの右側に挿入します。
- 核酸溶液(ステップ3で作成)を3mLシリンジに引き込み、シリンジ先端に気泡やエアギャップがないことを確認します。カートリッジの左側の入口に注射器を挿入します。
注: 1 mL の LNP ソリューションを作成するためにボリュームが提供されています。この器械は10 mLまでのシリンジのサイズを組み込むことができる、そして容積は結果に影響を与えなしでそれに応じて拡大することができる。1 回の準備で準備できる LNP の最大ボリュームは 12 mL です。 - サンプル名を15 mL RNaseフリーの円錐形チューブにラベル付けし、左チューブクリップに挿入します。右チューブクリップに15 mLの廃棄物円錐を入れます。
- パラメータの入力が正しいことを確認したら、計器の蓋を閉じて[ 実行]をクリックします。
- 計測器の実行が終了したら、廃棄物容器とカートリッジを適切に廃棄します。円錐状のチューブを LNP サンプルで保持します。
- エタノールを<5%(v/v)に最小限に抑えるために、PBSでLNP 5xを希釈します。
注: 分解を防ぐためには、マイクロ流体混合後できるだけ早くPBSでLNPを希釈することが重要です。常にバイオセーフティキャビネットで希釈を行い、バッファ交換を通じてバイオセーフティキャビネットで作業を続けてください。
6. バッファ交換
メモ: 超遠心フィルターを使用するためのプロトコルが提供されています。この方法は、バッファーのより時間効率の良い交換をもたらすが、透析はここで置き換えることができます。
- 1000 x g で 5 分間遠心分離機を使用して、PBS 2 mL の超遠心分離フィルター (100 kDa の毛穴サイズ) をあらかじめ洗浄します。下のコンパートメントからPBSを空にします。
注:PBSは、生理学的に関連し、中性電荷を有するイオン化脂質をもたらす7.4±0.2にpHを増加させるために選択されます。 - 希釈したLNPを、洗浄済みの超遠心分離フィルターの上部コンパートメントに加え、遠心分離機を1000 x g で12分間追加します。
- 下部コンパートメントからフロースルーを破棄します。毎回5mLのPBSを超遠心分離フィルターに加えて、さらに2回のスメを行います。同じパラメータで遠心分離機。維持する必要がある最大ボリュームはありません。
注: スケールアップされた Lnrp のボリュームを準備した場合は、それに応じて、各洗浄の PBS の量を増やします。例えば、1回のランで2mLのLNPを調製した場合、1回の洗浄につき10mLPBSが推奨される。 - LNPの損失を最小限に抑えるために、超遠心分離フィルターの壁に対してLNP溶液をピペット数回。超遠心分離フィルターからLNP溶液を取り出し、ヌクレアーゼフリーバイアルに保管します。1 mLのLNP溶液の最終容積を達成するために必要な場合はPBSを加える。
- 必要に応じて、プリウェット0.2 μmシリンジフィルターを通してフィルターします。
注: プロトコルはここで一時停止することができます。
7. カプセル化効率の測定
- PBSで働く核酸溶液の2倍の連続希釈を行い、最高濃度500 ng/mLから始まり、少なくとも5つの希釈液を作ることで、標準曲線を調製します。PBS をブランクとして使用します。
- LNP サンプル希釈液を準備します。PBSでLNPサンプルを希釈し、標準曲線の中間点(例えば初期濃度から推定される核酸の250 ng/mL)の周囲にある概算理論的濃度を達成する。
- RNA定量試薬(mRNA測定用)の溶液をTritonX-100で調製し、LNPを破壊し、LNP内外の核酸の総量を測定します。この溶液には、0.5%(v/v)RNA試薬、0.4%(v/v)TritonX-100、および99.1%(v/v)PBSが含まれています。
- TritonX-100を使用せずに試薬の溶液を調製し、LNPにカプセル化されていない核酸の量を測定します。この溶液は0.5%(v/v)RNA試薬および99.5%(v/v)PBSを含んでいる。
注: LNP がプラスミド DNA などの二本鎖 DNA (dsDNA) をカプセル化する場合は、同じ手順に従って、代わりに 7.3 および 7.4 の dsDNA 試薬を使用してください。 - 96ウェル黒色蛍光可能プレートでは、7.1および7.2で調製されたLNPおよび核酸標準溶液のそれぞれに少なくとも4つの複製物をロードする。
- 標準およびサンプルの複製の半分に、TritonX-100を含む試薬の等しい量を加えます。これは、核酸の総量を定量化します。
- 標準およびサンプルの残りのウェルに、TritonX-100なしで試薬の等しい量を加える。これは、LNPの内部にカプセル化されていない核酸の量を定量化します。
- プレートを室温で5分間振って、添加された試薬との標準とサンプルを完全に混合し、光の露出を避けるための予防措置を講じます。
- マイクロプレートリーダーを用いて、励起波長480nm、発光波長520nmで蛍光を測定します。
- TritonX-100を使用しない試薬を添加した標準曲線を使用して、LNPの外の核酸濃度を計算します。7.2 で使用される希釈係数を掛けます。
- TritonX-100を含む試薬を添加した標準曲線を用いて、LNPの内側と外側の両方の核酸の濃度を計算します。7.2 で使用される希釈係数を掛けます。
- 内部と外側の両方の核酸の総濃度から外側の核酸濃度(ステップ7.10から計算)を差し引いて核酸の濃度を計算する(ステップ7.11から計算)
- LNP内部の核酸濃度(ステップ7.12から計算)と核酸の総濃度(ステップ7.11から計算)の比からカプセル化効率を定量化する。
注: プロトコルはここで一時停止することができます。
8. 濃度調整
- 必要に応じて、カプセル化効率の結果を用いて、LNP溶液内の核酸濃度を調整します。
- より少ない濃縮溶液が望ましい場合は、PBSで溶液を希釈して所望の濃度を達成する。
- より濃縮された溶液が望ましい場合は、超遠心分離フィルターを使用して追加の遠心分離を実行します。
注: プロトコルはここで一時停止することができます。
9. LNP流体力学サイズと多分散を測定する
- PBSで40倍のLNP溶液のアリコートを希釈し、1mLの最終体積を得た。
注: この希釈は必要に応じて変更される場合があります。この希釈値は、高品質の結果を提供しながら、少量のLNPストック溶液を使用するため推奨されます。 - セミマイクロキュベットを使用して、流体力学的直径と多分散指数を測定します。キュベットにLNP溶液を追加し、インストルメントに挿入します。計測器ソフトウェアで、測定タイプ、サンプルの詳細(材料、分散剤、温度、セルタイプ)、測定指示(実行回数)を含むように操作手順を設定します。測定の取得を開始する準備ができたら 、[開始 ] をクリックします。
10. LNPゼータ電位を測定する
- LNP溶液40xのアリコートをヌクレアーゼフリー水で希釈し、1mLの最終体積を得た。
注:ヌクレアーゼフリー水は、伝導度に対する高塩バッファーの影響を最小限に抑えるためにゼータ電位測定のための溶媒として使用されます。 - 折り畳まれた毛細管ゼータ細胞を使用して、ゼータ電位を測定する。
- 充填ラインまで、キュベットにLNP溶液を追加します。電極が機器と接触していることを確認するために、機器に挿入します。
- 計測器ソフトウェアで、測定タイプ、サンプルの詳細(材料、分散剤、温度、セルタイプ)、測定指示(実行回数)を含むように操作手順を設定します。測定の取得を開始する準備ができたら 、[開始 ] をクリックします。
結果
同じ脂質製剤と6のN/P比を有するLNPの複数のバッチを別々の日に開発し、この技術の再現性を実証した。バッチ1と2は、類似した多分散性を有する重なり合うサイズ分布をもたらした(図2A)2つの異なるバッチ間のサイズまたはカプセル化効率に有意な差は認められなかった(図2B)。カプセル化効率はバッチ毎に高く(>98.5%)、サイズは77 nm LNP直径と類似していた。粒子は、バッチ1の平均多分散指数(PDI)0.15、バッチ2の0.18で均一であった。
製剤パラメータの変化は、N/P比、使用されるイオン化可能脂質、および核酸をカプセル化することに関して、いくつかの小さく、まだ統計的に有意な差を示した。違いが議論されているが、生成されたすべてのLNPは、ほとんどの製剤が95%を超え、粒子サイズが110nm未満で80%を超えるカプセル化をもたらし、ここで開発されたすべての製剤が遺伝子導入に望ましいことに注意することが重要である。まず、イオン化可能な脂質Aを用いて、N/Pの10および36でLNPを開発した。N/P比を下げると、カプセル化効率が4%低下し、N/P = 36で98 nmから109 nmのN/P= 109 nmにLNPの流体力学的直径が増加しました(図3A)。NMPとイオン化可能脂質Aと異なるイオン化可能脂質Bを比較し、36のN/Pを維持すると、カプセル化効率が大きく変化し、イオン化可能な脂質Aを使用して形成されたLNPと81%のpDNAカプセル化がイオン化可能脂質Bを用いて形成されたLNPでカプセル化された(図3B)。イオン化可能な脂質B LnPSはまた、95nmの流体力学的直径を有するわずかに小さい粒子をもたらした。最後に、mRNAとpDNAの両方を有するイオン化可能脂質Aを用いてLNPsを形成した。pDNAをカプセル化するLNPsは、直径91nmのmRNA LnPsと比較して、直径119nmの大きな粒子をもたらした(図3C)。pDNAとmRNA LnPsの両方が、〜91〜94%で同様のカプセル化効率をもたらした。
最後に、流量プロセス パラメータの変更は、ここでテストした流量で開発された LNP に影響を与えませんでした。4 mL/min と 12 mL/min の両方で、LnP が開発され、pDNA の 96% をカプセル化し、直径 110 nm を有することが特徴付けられた (図 4)。プロセスパラメータまたは配合パラメータに関係なく、すべてのLNPは、電荷中性ゼータ電位測定をもたらしました。

図1:LNPの開発と特性評価のワークフローまず、脂質混合液と核酸溶液(1および2)が作られる。脂質ミックスは、イオン化可能な脂質、ヘルパー脂質、コレステロール、PEGをエタノールに含み、核酸溶液は緩衝液にmRNAまたはDNAを含む。溶液は、LNPs(4)を形成するマイクロ流体カートリッジ(3)を使用して混合される。次に、エタノールを除去し、溶液pHを中性(5)に増加させるためにバッファー交換が必要である。LNPの特性評価は、それぞれ(6及び7)の蛍光マイクロプレートアッセイおよびゼータサイザーを用いてカプセル化効率及び粒子径、多分散性、およびゼータ電位を決定するために行われる。この図の大きなバージョンを表示するには、ここをクリックしてください。
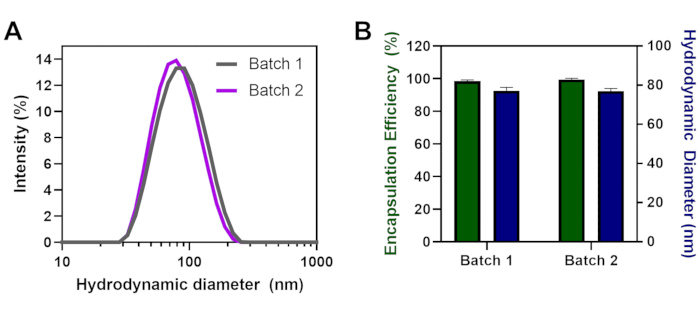
図2:別日に形成されたLNPのバッチ再現性を バッチ化するバッチ(A)バッチ1対バッチ2のサイズ分布(B)カプセル化効率(%)と流体力学的直径(nm)をmRNAとN/P=6の各バッチに対して行う。誤差範囲は標準偏差を示します。α = 0.05 の双方向 ANOVA を使用した統計分析は有意性を示さない。 この図の大きなバージョンを表示するには、ここをクリックしてください。

図3: 製剤パラメータのバリエーション: (A)N/P=10及び36で形成されたLNPsは、いずれもpDNAを有するイオン化可能脂質Aを用いた。(B)イオン化可能脂質Aとイオン化可能脂質Bと共にN/P=36で形成されたLNPsをpDNAで(C) N/P= 6でイオン化可能な脂質Cを用いて mRNA または pDNA のいずれかで形成された LNP。誤差範囲は標準偏差を示します。統計分析は、α = 0.05 の双方向分散分析を使用して実行されました。*p<0.05;**p<0.01;p<0.001;p<0.0001. この図の大きなバージョンを表示するには、ここをクリックしてください。

図4: プロセスパラメータのバリエーション N/P= 10でpDNAを有するイオン化可能脂質Aを用いて、4および12mL/minの流速で形成されるLNPs。誤差範囲は標準偏差を示します。α = 0.05 の双方向 ANOVA を使用した統計分析は有意性を示さない。 この図の大きなバージョンを表示するには、ここをクリックしてください。
| 脂質 | モル比 | ストック脂質濃度 (mM) | 脂質混合用エタノール中濃度(mM) | ボリューム(μL) |
| イオン化可能脂質 | 50 | 38.9 | 5 | 68.5 |
| ヘルパー脂質 | 10 | 10 | 1 | 53.3 |
| コレステロール | 39 | 20 | 3.9 | 103.9 |
| C-14ペグ | 1 | 1 | 0.1 | 53.3 |
| エトフ | 254 | |||
| トータル | 533 | |||
表1:脂質混合例を1mLのLNPを調製する。 提供されるエタノール中の脂質ストック濃度は、脂質がエタノール中で可溶化することを可能にすることが示されているが、他のストック濃度は利用され、脂質が可溶化されている限り結果に影響を及ぼさない。マイクロ流体混合のためのエタノール中の脂質濃度の例も提供される。これらの濃度は、モル比に基づいて、所望のLNP製剤に基づいて変化させることができる。
| プライミング | 定式 化 | |
| ボリューム (mL) | 2 | 1.37 |
| 流量比(水性:EtOH) | 3:1 | 3:1 |
| 合計流量(mL/分) | 12 | 4 |
| 左注射器サイズ (mL) | 3 | 3 |
| 右シリンジサイズ (mL) | 1 | 1 |
| 廃棄物量(mL)を開始 | 0.35 | 0.25 |
| エンド廃棄物量 (mL) | 0.05 | 0.05 |
表 2: マイクロ流体混合ベンチトップ機器ソフトウェアプライミングおよび LNP製剤のサンプルパラメータ
ディスカッション
再現性、速度、および低体積スクリーニングは、マイクロ流体混合を用いて、他の既存の方法(例えば、脂質フィルム水和およびエタノール注入)と比較してLNPを形成する重要な利点である。我々は、異なるLNPバッチで観察されるカプセル化効率または粒子サイズに影響を与えなく、この方法の再現性を実証した。これは、Lnpsを含むあらゆる治療が臨床的に利用可能になるための不可欠な基準です。
ここで説明する技術は、わずかな数分の時間スケールでLNP形成をもたらす、ずらしたヘリンボーン微小流体混合を採用しています。この混合は、制御と短縮時間27を混合するために有利である混沌とした対流を使用しています。このミキサーは水相と有機相が互いに効果的に27を包み込むのを可能にする。ずらしてヘリンボーン混合を用いて、以前の研究では、粒子が最小の熱力学的に安定なサイズ32で形成されることを示しており、これは、組成がLNPs27、32、33のサイズおよび多分散性に影響を与える傾向があることを意味する。これは、N/P比、使用したイオン化可能な脂質、および封入された核酸が、カプセル化効率および粒子サイズの変化に影響を与える要因であった代表的な結果で観察された。流量や混合比などの動作パラメータは、一定の閾値を超えるサイズにも影響を及ぼし、その後、粒子サイズは最小の安定サイズ27,33となる。4 mL/min対12mL/minの流量を用いた場合、カプセル化効率や粒径に変化は認められなかった。したがって、両方の流量が、LNP の結果に影響を与えるしきい値を超えている可能性があります。実験例としては、上述した結果と、脂質AおよびpDNAを用いた。異なるイオン化可能な脂質および核酸が、流量に関してLNP特性に対してより大きな影響を与える可能性がある。その他のタイプのマイクロ流体混合には、乱流流を使用するT-接合点と対流拡散混合27に基づく微小流体流体力学的集光法が含まれる。LNP開発のためのマイクロ流体混合技術のこれらの他のタイプと比較して、ずらしてヘリンボーン混合は3つの重要な基準の組み合わせを可能にする:急速混合、バッチ変動にバッチを最小化し、市販されている27。マイクロ流体混合法の3つすべてが、従来の脂質膜水和処理法27に比べてカプセル化効率と制御サイズを高くすることを可能にする。
最後に、研究開発段階で様々なLNP製剤の少量を製造する能力は、重要な利点です。LNPを開発する際の課題の1つは、必要な結果と有効性を達成するために製剤ごとにテストおよび最適化できる変数の数です。脂質および核酸は、多くの製剤パラメータ(例えば、モル比、N/P比、プロセスパラメータなど)をスクリーニング、トラブルシューティング、および変更して、特定の用途に最も適したLNPを見つけるためにコストを高くすることができます。少量は、大規模で最終製剤を製造するための制限である可能性がありますが、より大きなマイクロ流体混合機器で技術をスケールアップする能力は市販されています。
プロトコルの重要なステップは、メーカーの推奨で脂質ストックソリューションの適切なストレージから始まります。LNPは、さらに使用するまで2〜8 °Cで保管する必要があります。核酸調製物について、クエン酸緩衝液およびリンゴ酸緩衝液が高核酸カプセル化34,35でLNPを形成するのに有効であることを示す結果が示された。必要に応じて、他のバッファを代わりに使用することもできます。別の緩衝液が選択された場合、脂質がカチオンであり、核酸と複合体を保つことができることを確実にするために、イオン化可能な脂質のpKa以下のpHを維持することが重要である。マイクロ流体混合器具を使用する場合、LNP形成前にカートリッジをプライミングし、製造業者が推奨するカートリッジ使用量を超えないようにし、異なる配合組成物間でカートリッジを交換することが重要である。水性の形成のための最も一般的な流量比:有機溶液は3:1です。ただし、必要に応じて変更できます。流量も必要に応じて調整できます。最後に、mRNAを使用する場合は、プロセス全体を通してRNaseフリーの環境を確保することが重要です。目的のサイズまたはカプセル化効率が達成されない場合、トラブルシューティングを開始するいくつかの場所には、使用されるN/ P比または脂質モル率の変更が含まれます。ここで説明する計測器プロセスでは、最大体積制限が12 mLのベンチトップモデルを使用していますが、このプロセスは異なるマイクロ流体混合モデルを使用して大容量のボリュームに拡張できます。このプロセスは、様々な臨床適応症のためのLNPの開発に使用するための脂質混合物および核酸の変化に適応することができる。この柔軟性により、LNPを使用して将来の多くのアプリケーションを実現し、さまざまな必要な製剤を製造することができます。この技術は、リポソームやポリマーナノ粒子を含む他のタイプのナノ粒子の開発にも使用されています。いくつかのパラメータ変更を伴い、この方法は様々なナノ粒子製剤に使用することができる。
ここで詳述するプロトコルは、mRNAまたはDNA封入されたLnPsを達成するための再現可能な方法を説明する。プロセス パラメーターに加えて、追加の考慮事項が LNP の結果に影響を与える可能性があります。これまでの研究では、同様の方法を用いて、さまざまな核酸、イオン化可能脂質、N/P比、PEGリンカー長さなどでLnPを製造しています。これらのパラメータは、パーティクルのカプセル化の効率、サイズ、および電荷に影響を与えることができます。機器メーカーは、18、36を最適化することができるこれらのパラメータに応じて同様の変更を指摘しています。これらのパラメータは、核酸の生体分布および有効性にさらに影響を及ぼし得る。例えば、PEGに結合した炭化水素鎖長(C14、C16、およびC18)を調査した研究では、C14の短いアシル鎖は、より長いアシル鎖に比べて肝臓取り込みのレベルが高く、より長い期間28のために循環したままであることがわかりました。このプロトコルは、多様な組成を持つLNPの形成、最適化、およびテストを可能にし、これを多目的なプロセスにします。
開示事項
著者は全員サオブフィの従業員です。著者らは、利益相反や競合する金銭的利益はないと宣言している。
謝辞
アトゥル・サルヤ、ヤティン・ゴカーン、マリア・テレサ・ペラッキア、ウォルター・シュヴェンゲル、フィリップ・ザカスの指導とLNP開発への貢献に感謝します。
資料
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
参考文献
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved