Method Article
使用微流体混合平台为基因传递制订和定性脂质纳米粒子
摘要
脂质纳米粒子是使用微流体混合平台方法开发的,用于mRNA和DNA封装。
摘要
基于脂质的药物载体由于体积小、生物相容性和封装效率高,已用于临床和商业上可用的交付系统。使用脂质纳米粒子(LNPs)封装核酸有利于保护RNA或DNA免受降解,同时促进细胞吸收。LNPs 通常含有多种脂质成分,包括电离子脂、辅助脂质、胆固醇和聚乙烯乙二醇 (PEG) 结合脂质。LNPs 可以很容易地封装核酸,由于电离子脂质的存在,在低 pH 值是阴离子的,并允许与负电压 RNA 或 DNA 的复合。在这里,LNPs是通过封装信使RNA(mRNA)或质粒DNA(pDNA)形成的,使用有机相中的脂质成分和在声相中核酸成分的快速混合。这种混合使用精确的微流体混合平台进行,允许纳米粒子自组装,同时保持层流。水动力学大小和多散射是使用动态光散射 (DLS) 测量的。LNP 上的有效表面电荷通过测量 zeta 电位来确定。封装效率的特点是使用荧光染料来量化包裹的核酸。具有代表性的结果表明,该方法具有可重复性,并且不同的配方和工艺参数对已开发的 LNP 具有影响。
引言
药物携带者用于保护和提供具有典型有利特性的治疗,包括低细胞毒性,增加生物可用性,并改善稳定性1,2,3。聚合物纳米粒子、鼠类和脂质粒子以前曾被探索过核酸封装和输送4、5、6、7。脂质已用于不同类型的纳米载体系统,包括脂质体和脂质纳米粒子,因为它们与高稳定性8生物相容。LNPs可以很容易地封装核酸的基因传递9,10。它们保护核酸在系统循环过程中不受血清蛋白酶的降解,并可以改善对特定部位的输送,因为LNPs的表面地形和物理特性会影响其生物分布12。LNPs还改善组织渗透和细胞吸收9。先前的研究表明,在LNP13中,西RNA封装取得了成功,包括首个含有西RNA治疗遗传性转乙酰激素介质淀粉样体病的LNP治疗药物,该疗法于2018年获得美国食品和药物管理局(FDA)和欧洲药品管理局的批准。最近,正在研究LNPs的交付更大的核酸,即mRNA和DNA9。截至2018年,有+22个基于脂质的核酸输送系统正在进行临床试验14。此外,含有LNPs的mRNA目前是主要候选者,并已受雇于COVID-19疫苗15,16。这些非病毒基因疗法的潜在成功需要形成小(+100 nm),稳定和均匀的粒子与高核酸封装。
在LNP配方中使用电离子脂作为主要成分,在复合、封装和递送效率14方面显示出优势。离子脂质通常具有酸分离常数 (pKa) < 7:例如,二烯酰-4-二甲基丁基丁酸酯(D-Lin-MC3-DMA),在FDA批准的LNP配方中使用的电离子脂质,pKa为6.4417。在低pH值下,电离子脂质上的胺组变得质子化和正电荷,允许在mRNA和DNA上与负电荷磷酸盐组组装。胺、"N"、组与磷酸盐、"P"的比例,用于优化组件。N/P比率取决于使用的脂质和核酸,根据配方18而异。形成后,pH值可调整为中性或生理pH值,以便进行治疗管理。在这些 pH 值下,电离脂质也脱质,从而向 LNP 提供中性表面电荷。
电离子脂也有助于内分泌逃生19,20。LNPs在细胞吸收过程中接受内分泌,必须从内皮体中释放出来,以便将mRNA货物送入细胞质或DNA货物到细胞核21。内皮体内部通常比细胞外介质更酸性,使电离子脂质正电荷22,23。带正电荷的电离子脂质可与内分泌脂膜上的负电荷相互作用,从而导致内皮体不稳定,从而释放LNP和核酸。目前正在研究不同的电离子脂质,以提高LNP分布的功效,以及内分泌逃逸14。
LNP 的其他典型成分包括辅助脂质,如磷脂酰胆碱 (PC) 或磷乙醇胺 (PE) 脂质。1,2-二甲苯-sn-甘油-3-磷乙醇胺(多普),1,2-二乙酰-sn-甘油-3-磷 磷胆碱 (DSPC), 和 1,2 二醇 - sn-甘油-3 磷胆碱 (DOPC) 是常用的辅助脂质24,25.DOPE已被证明形成一个倒置的六边形II(HII)相,并通过膜融合26增强透射,而DSPC已被认为稳定LNPs与圆柱形几何27。胆固醇也被纳入配方,以增加膜刚度,随后有助于LNP的稳定。最后,脂质结合聚乙烯乙二醇(PEG)被纳入配方,以提供必要的石碑屏障,以帮助在粒子自组装27。PEG 还通过防止聚合来提高 LNP 的存储稳定性。此外,PEG 经常被用作隐形组件,可以增加 LNP 的循环时间。然而,这一属性也可能构成挑战,招募LNPs肝细胞通过内源性定位机制驱动的阿波利波蛋白E(ApoE)28。因此,研究已经调查了从LNP扩散PEG的乙酰链长度,发现短长度(C8-14)与LNP分离,更适合ApoE招募相比,更长的乙酰长度28。此外,PEG 与之结合的脂质尾巴饱和程度已证明会影响 LNPs29的组织分布。最近,Tween 20,这是生物药物制剂中常用的表面活性剂,具有长期不饱和脂质的尾巴,与PEG-DSPE相比,在排出淋巴结方面具有很高的转化性,PEG-DSPE主要在注射部位29处对肌肉进行透射。此参数可以优化,以实现所需的 LNP 生物分布。
传统的LNP形成方法包括薄膜水化法和乙醇注射法27。虽然这些是现成的技术,他们也是劳动密集型的,可能会导致低封装效率,并具有挑战性地扩大27。混合技术的进步使得方法更易放大,同时开发出更均匀的粒子27。这些方法包括T结混合,交错鱼骨混合,微流体流体动力学聚焦27。每种方法都有独特的结构,但都允许快速混合含有核酸的一个液态与含有脂质成分的有机相,从而产生高封装的核酸27。在此协议中,利用通过微流体墨盒进行快速和可控的混合,采用交错的鱼骨混合设计。本协议概述了含有 LNPs 的核酸的制备、组装和定性。
研究方案
图1提供了整个过程的示意图。
1. 准备缓冲器
注意:这里强烈建议对缓冲器进行无菌过滤,以去除可能影响核酸和 LNP 质量的任何颗粒物。
- 磷酸盐缓冲盐水 (PBS)
- 使用 8 mM Na2HPO 4、2 mM KH2PO4、137 mM NaCl 和 2.7 mM KCl 在核酸酶无水中准备 1x PBS,并将 pH 值调整为 7.4。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
- 柠檬酸盐缓冲器
- 使用 5 mM 柠檬酸钠、5 mM 柠檬酸和 150 mM 氯化钠在无核酸水中准备柠檬酸盐缓冲器,并调整到 pH 4.5。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
注:只有在 mRNA 是将封装在 LNP 中的核酸时,才需要准备柠檬酸盐缓冲器。如果DNA将被封装跳过1.2,并继续到1.3。
- 乳酸缓冲器
- 使用20mM乳酸和30mM氯化钠在无核酸水中准备乳酸缓冲器,并调整到pH3.0。
- 使用 0.22 μm 孔径过滤器进行真空过滤消毒。
注:只有当DNA是将封装在LNP中的核酸时,才需要准备乳酸缓冲器。如果要封装 mRNA,请跳过 1.3。柠檬酸盐缓冲用于 mRNA 封装,因为带乳酸缓冲器的 3.0 的低 pH 值可能导致 mRNA 降解的可能性增加。协议可以在此处暂停。
2. 脂质混合物的制备
- 如果库存脂质为粉末状,则以纯 200 证明乙醇溶液。
- 根据所需的摩尔比率计算所需的脂质成分组合。50:10:39:1(离子脂质:辅助脂质:胆固醇:PEG)的摩尔比将在这里用作总脂质浓度为10mM的示例。 表 1 显示每个组件所需的浓度和体积。
注:在计算微流体混合器乙醇 (EtOH) 中实现脂质混合浓度所需的体积时,会考虑总体积,以确保 EtOH 的添加不会影响脂质浓度。例如,通过将乙醇中的 5 mM 浓度乘以 533 μL 的总脂质混合体积,然后除以 38.9 mM 的库存脂质浓度来计算 68.5 μL 的电离子脂质体积。 - 将每个脂质库存溶液的适当数量添加到玻璃瓶中,使组件与间歇性涡流混合。加入200种证明乙醇,总混合物为533微升。例如,表 1,这是254微升乙醇。
注:要单次运行以生产 1 mL 的 LNPs,需要 342.5 μL 的脂质溶液。这是由于3:1混合了液态核酸到有机脂溶液,在样品收集前后丢弃了一些体积。混合 533 μL 以补偿超标。
3. 核酸溶液的制备
注:核酸溶液的准备和处理将在无菌和无砷的环境中尽可能进行。尽可能用核酸在生物安全柜中工作。
- 计算市盈率。N/P 比率是可电离子脂胺组 (N) 与负电压核酸磷酸盐组 (P) 的总数。N/P 比率通常是在 LNP 形成期间可以优化的参数。按照下面的步骤操作。
- 使用以下公式计算 N 单位的数量:
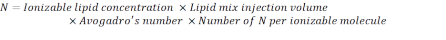
注:电离子脂质浓度(表1)为5mM,相当于5×10-6摩尔/mL。所需的脂质注射量为 0.3425 mL。例如,如果每个分子的 N 单位数为 1,则使用上述方程,脂质混合物中有 1.03 x10 18 N 单位。 - 计算所需 N/P 比率的 P 单位。例如,这里使用了 N/P = 36。
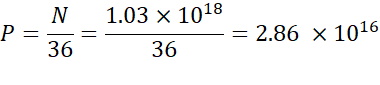
- 使用以下公式计算 N 单位的数量:
- 使用以下方程计算必要的核酸浓度,以获得 2.86 x10 16 P 单位。
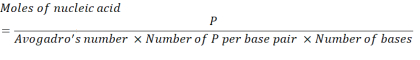
其中,mRNA 每碱基对的 P 单位数为 1,DNA 为 2。对于具有 1,200 个碱基的 mRNA,N/P = 36 所需的 mRNA 量为 3.96 x 10-11 摩尔。 - 使用以下方程计算 N/P = 36 所需的 mRNA 质量浓度。

核糖核苷酸单磷酸盐单位的平均分子量为322克/摩尔30。mRNA的分子量为1,200基mRNA,分子量为386,400克/摩尔。核酸溶液所需的注射量为 1.028 mL。因此,所需的 mRNA 浓度为 1.488x10-5 g/mL,即 14.88 μg/mL。 - 在柠檬酸盐缓冲区中,组成 1.5 mL 的 14.88 μg/mL 的 mRNA。
注:当DNA将核酸封装时,使用乳酸缓冲剂来组成核酸溶液。
4. 启动微流体通道
注:此协议根据仪器制造商的准则进行修改。
- 单击相应的字段(表 2)将启动参数输入到仪器软件中。
注:建议流量比为3:1,流量为4-12 mL/min。。。这已被证明是最好的研究在这里提出,以及制造商。如果对申请感兴趣,情况可能会有所不同。 - 打开仪表盖,将微流体墨盒放入旋转块中。
- 将至少 0.5 mL 的乙醇抽入 1 mL 注射器中,确保注射器尖端没有气泡或空气间隙。将此注射器加载到墨盒的右入口。
- 用1.5兆L的排液缓冲器填充3mL注射器(RNA的柠檬酸盐和DNA的乳酸),确保没有气泡或间隙。将此注射器加载到墨盒的左入口。
- 在夹子支架中插入两个 15 mL 圆锥形管,用作废容器。
- 单击" 运行" 仪器软件开始混合,确保参数输入正确。
- 当仪器停止启动时,由底部蓝光关闭指示,打开盖子并正确处理锥形管和注射器。
5. LNP 编队
注:此协议根据仪器制造商的准则进行修改。
- 点击相应的字段(表2),用配方参数更新软件。
- 将 1 mL 注射器与脂质混合物一起填充(在第 2 步中准备)。去除注射器尖端的任何气隙或气泡,并将注射器插入墨盒的右侧。
- 将核酸溶液(在第 3 步中准备)绘制到 3 mL 注射器中,确保注射器尖端没有气泡或气隙。将注射器插入墨盒的左入口。
注:提供卷,使LNPs的1ml解决方案。该仪器可以集成高达 10 mL 的注射器尺寸,并且体积可以相应地缩放,不会对结果造成影响。一次制备中可制备的 LNP 的最大容量为 12 mL。 - 将一个 15 mL 无 RNase 的锥形管标记为样本名称,并插入到左管夹中。将 15 mL 废圆锥体放在右管夹中。
- 在确认参数的正确输入后,关闭仪表盖并单击 "运行"。
- 仪器运行完后,正确丢弃废容器和墨盒。保留带有 LNP 样品的圆锥管。
- 用 PBS 稀释 LNP 5x,将乙醇降至 <5% (v/v)。
注:在微流体混合后,尽快稀释PBS中的LNPs,以防止降解,这一点很重要。始终在生物安全柜中执行稀释,并在整个缓冲交换期间继续在生物安全柜中工作。
6. 缓冲交换
注:提供使用超离心机过滤器的协议。虽然此方法可更及时高效地交换缓冲器,但透析可以在此处替代。
- 通过 1000 x g 的离心机离心,预洗 2 mL PBS 的超离心机过滤器(100 kDa 孔径大小),持续 5 分钟。从底部隔间清空 PBS。
注:选择PBS将pH值提高到7.4±0.2,这在生理上是相关的,将导致电离子脂具有中性电荷。 - 将稀释的 LNPs 添加到预洗超离心机滤清器的顶舱中,以 1000 x g 为离心机,持续 12 分钟。
- 丢弃从底部隔间流过的流量。每次在超离心机滤清器中加入 5 mL 的 PBS,再进行两次清洗。以相同的参数离心。没有需要保持的最大音量。
注:如果准备了放大的 LNP 体积,则相应地增加每次洗涤的 PBS 体积。例如,如果单次运行时准备了 2 mL 的 LNPs,则建议每次洗涤 10 mL PBS。 - 将 LNP 解决方案对超离心机滤光片的墙壁进行几次,以最大限度地减少 LNP 损失。从超离心机过滤器中取出 LNP 溶液并存放在无核素小瓶中。如果需要,添加 PBS 以实现 1 mL 的 LNP 解决方案的最终体积。
- 如有必要,通过预湿的 0.2 μm 注射器过滤器进行过滤。
注:协议可以在此处暂停。
7. 测量封装效率
- 通过在 PBS 中对工作核酸溶液进行 2 倍串序稀释,从最高浓度 500 ng/mL 开始,并至少进行 5 次稀释,从而准备标准曲线。将 PBS 用作空白。
- 准备 LNP 样品稀释。用 PBS 稀释 LNP 样品,以实现围绕标准曲线中点的大致理论浓度(例如,从初始浓度估计的 250 ng/mL 核酸)。
- 准备使用 TritonX-100 的 RNA 定量试剂(用于 mRNA 测量)的解决方案,以破坏 LNPs 并测量 LNP 内外的核酸总量。此解决方案包含 0.5% (v/v) RNA 试剂、0.4% (v/v) TritonX-100 和 99.1% (v/v) PBS。
- 准备一个没有 TritonX-100 的试剂溶液,以测量 LNPs 中未封装的核酸量。此解决方案包含 0.5% (v/v) RNA 试剂和 99.5% (v/v) PBS。
注:如果 LNPs 封装双搁浅 DNA (dsDNA),如质粒 DNA,则按照相同的程序在 7.3 和 7.4 中使用 dsDNA 试剂。 - 在 96 井黑色荧光板中,装载至少四个复制的 LNP 和核酸标准溶液,分别以 7.1 和 7.2 表示。
- 在标准和样品的复制品中,增加一个包含 TritonX-100 的试剂的等量。这将量化核酸的总量。
- 在剩余的标准和样品井中,添加具有 TritonX-100 的同等数量的试剂。这将量化LNP中未封装的核酸量。
- 在室温下摇动板5分钟,确保将标准和样品与添加的试剂彻底混合,采取预防措施避免光线照射。
- 使用微板读取器测量荧光,激发波长为 480 nm,发射波长为 520 nm。
- 使用添加没有 TritonX-100 的试剂所制定的标准曲线计算 LNP 以外的核酸浓度。乘以 7.2 中使用的稀释因子。
- 使用添加含有 TritonX-100 的试剂所制定的标准曲线计算 LNP 内外核酸的浓度。乘以 7.2 中使用的稀释因子。
- 通过从内外核酸的总浓度中减去核酸的浓度(从第7.10步计算),计算核酸内部的浓度(从第7.11步计算)
- 从LNP内核酸浓度(从第7.12步计算)和核酸总浓度(从第7.11步计算)中量化封装效率。
注:协议可以在此处暂停。
8. 浓度调整
- 如有必要,使用封装效率的结果调整 LNP 溶液中的核酸浓度。
- 如果需要不太集中的解决方案,则用 PBS 稀释溶液以实现所需的浓度。
- 如果需要更集中的解决方案,则使用超离心机过滤器进行额外的离心运行。
注:协议可以在此处暂停。
9. 测量LNP流体动力大小和多分散性
- 将 LNP 解决方案的引文稀释 40 倍,与 PBS 配合在一起,以获得 1 mL 的最终体积。
注意:如果需要,可能会更改此稀释。建议此稀释值,因为它使用少量的 LNP 库存解决方案,同时提供质量结果。 - 使用半微微晶圈,测量流体动力直径和多分散度指数。将 LNP 解决方案添加到库维特并插入仪器中。在仪器软件中设置操作程序,包括测量类型、样品详细信息(材料、分散剂、温度和细胞类型)和测量说明(运行次数)。当准备开始测量采集时,单击 "开始 "。
10. 衡量LNP泽塔潜力
- 用无核酸酶水稀释 LNP 溶液 40 倍的酸液,以获得 1 mL 的最终体积。
注:无核酸酶水用作zeta潜在测量的溶剂,以尽量减少高盐缓冲对电导率的影响。 - 使用折叠毛细细的泽塔细胞,测量泽塔的潜力。
- 将 LNP 解决方案添加到填充线的库维特中。插入仪器,确保电极与仪器接触。
- 在仪器软件中设置操作程序,包括测量类型、样品详细信息(材料、分散剂、温度和细胞类型)和测量说明(运行次数)。当准备开始测量采集时,单击 "开始 "。
结果
在不同的天开发了多批具有相同脂质配方和6的NPP,以证明该技术的可重复性。第1批和第2批导致大小分布重叠,具有类似的多散(图2A),在两个不同批次之间的大小或封装效率方面没有显著差异(图2B)。每批封装效率高(>98.5%),尺寸与77纳米LNP直径相似。颗粒均匀,第 1 批的平均多分散度指数 (PDI) 为 0.15,第 2 批的平均多分散指数 (PDI) 为 0.18。
配方参数的变化表明,在 N/P 比率、使用电离子脂质和封装核酸方面存在一些小而统计学上显著的差异。在讨论差异时,必须注意,所有形成的 LNP 的封装率均超过 80%,大多数配方大于 95%,颗粒大小小于 110 nm,因此此处开发的所有配方都适合基因传递。首先,电离子脂A用于在10和36的N/P下开发LNP。降低 N/P 比率导致封装效率降低 4%,LNP 的水动力直径从 N/P = 36 的 98 nm 增加到 N/P = 10 的 109 nm(图 3A)。将 LNP 与电离子脂质 A 与不同的电离子脂 B 进行比较,并保持 36 的 N/P,从而显著改变了封装效率,其中 100% 的 pDNA 与使用电离子脂 B 形成的 LNP 进行封装,81% 的 pDNA 与使用电电脂 B 形成的 LNP(图 3B)进行封装。电容脂质 B LNP 也产生略小的颗粒,流体动力直径为 95 nm。最后,利用具有 mRNA 和 pDNA 的电离子脂质 A 形成 LNP。封装 pDNA 的 LNPs 产生的颗粒直径为 119 nm,而 MRNA LNP 的直径为 91 nm(图 3C)。pDNA 和 mRNA LNP 的封装效率都相似,为 91-94%。
最后,流速过程参数的变化不会影响根据此处测试的流速率开发的 LNP。在4 mL/min和12 mL/min,LNPs被开发和特征为封装了96%的pDNA,直径为110纳米(图4)。所有 LNP,无论过程参数或配方参数如何,都会导致电荷中性 zeta 潜在测量。

图1: LNP 开发和定性工作流程。 首先,脂质混合物和核酸溶液(1 和 2)。脂质混合物中含有乙醇中的电离子脂、辅助脂质、胆固醇和PEG,而核酸溶液中含有mRNA或DNA。解决方案使用微流体墨盒(3)混合,形成 LNP(4)。接下来,需要缓冲交换来去除乙醇,并将溶液pH值提高到中性(5)。利用荧光微板检测和齐塔化器分别(6 和 7)对 LNPs 进行特征分析,以确定封装效率和颗粒大小、多分散性和 zeta 电位。 请单击此处查看此图的较大版本。
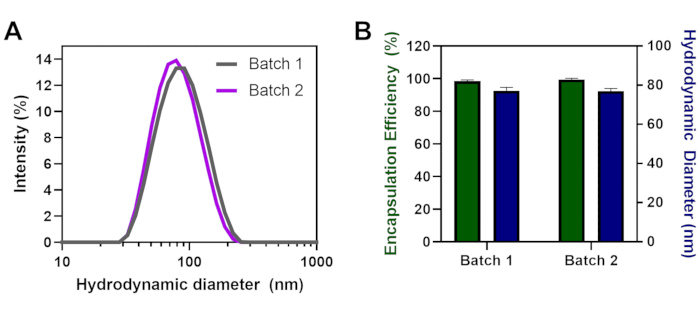
图2:在单独的日子内形成的LNP的批次可重复性。(A)第1批与第2批(B)封装效率(%)和水动力直径(nm)的大小分布,每批具有mRNA和N/P = 6。错误条注释标准偏差。使用具有α = 0.05 的双向 ANOVA 进行统计分析没有意义。请单击此处查看此图的较大版本。

图3:配方参数的变化。 (A) 在 N/P = 10 和 36 形成的 LNP 均使用带 pDNA 的电离子脂质 A。(B) LNP 与电离子脂 B 和电离子脂 B 形成, 均在 N/P = 36 与 pDNA。(C) 与 mRNA 或 pDNA 形成的 LNP 均使用 N/P = 6 的电电脂 C。错误条注释标准偏差。统计分析使用双向 ANOVA 进行,α = 0.05;*p<0.05;**p<0.01;p<0.001:p<0.0001。 请单击此处查看此图的较大版本。

图4: 过程参数的变化。 LNP 以 4 和 12 mL/min 的流速形成,使用电离子脂质 A 与 PDNA 在 N/P = 10。错误条注释标准偏差。使用具有α = 0.05 的双向 ANOVA 进行统计分析没有意义。 请单击此处查看此图的较大版本。
| 脂质 | 摩尔比率 | 库存脂浓度 (mM) | 脂质混合物乙醇浓度 (mM) | 卷 (μL) |
| 离子脂质 | 50 | 38.9 | 5 | 68.5 |
| 帮手脂质 | 10 | 10 | 1 | 53.3 |
| 胆固醇 | 39 | 20 | 3.9 | 103.9 |
| C-14 PEG | 1 | 1 | 0.1 | 53.3 |
| 埃托奥 | 254 | |||
| 总 | 533 | |||
表1:示例脂质混合,以准备1 mL的LNPS。 提供的乙醇中的脂质库存浓度已被证明允许脂质在乙醇中溶化,但可以使用其他库存浓度,并且不会影响结果,只要脂质溶于溶质。还提供了用于微流体混合的乙醇中脂质的示例浓度。这些浓度基于摩尔比率,可根据所需的 LNP 制备情况进行变化。
| 装雷管 | 配方 | |
| 体积 (mL) | 2 | 1.37 |
| 流速比(水:ETOH) | 3:1 | 3:1 |
| 总流量 (mL/分钟) | 12 | 4 |
| 左注射器尺寸 (mL) | 3 | 3 |
| 右注射器尺寸 (mL) | 1 | 1 |
| 开始废物量 (mL) | 0.35 | 0.25 |
| 末期废物量 (mL) | 0.05 | 0.05 |
表2:微流体混合台式仪器软件原始和LNP配方示例参数
讨论
与其他现有方法(如脂膜水化和乙醇注射)相比,可重复性、速度和低体积筛选是使用微流体混合形成 LNP 的重要优势。我们已经证明了这种方法的可重复性,对用不同的LNP批次观察到的封装效率或颗粒大小没有影响。这是任何治疗,包括LNPs,成为临床可用的基本标准。
这里描述的技术采用交错的鱼骨微流体混合,这导致LNP形成的时间尺度只有几分钟。这种混合使用混沌的偏言,这是有利于混合控制和缩短时间27。这种搅拌机使起因和有机相有效地包裹在一起27。利用交错的鱼骨混合,以前的研究表明,粒子形成最小的热动力学稳定大小32,这意味着组成往往影响大小和多散的LNPs27,32,33。这在具有代表性的结果中观察到,其中使用N/P比、离子脂质和核酸封装是影响封装效率和颗粒大小变化的因素。操作参数,如流速和混合比也可以影响超过一定阈值的大小,之后粒子大小是在其最小的稳定大小27,33。使用 4 mL/min 与 12 mL/min 的流量时,未观察到封装效率或颗粒大小的变化。因此,可能两个流量都高于将影响 LNP 结果的阈值。示例实验和上面描述的结果使用脂质 A 和 pDNA。不同的电离子脂质和核酸可能会对LNP的流速特征产生更大的影响。其他类型的微流体混合包括T-junction,它使用湍流和微流体流动力学聚焦方法,这是基于对流扩散混合27。与LNP开发的这些其他类型的微流体混合技术相比,交错的鱼骨混合实现了三个重要标准的组合:快速混合,最大限度地减少批次到批次的变异性,并可在27日上市。与传统的脂膜水化或乙醇注射方法相比,这三种微流体混合方法确实允许更高的封装效率和控制尺寸。
最后,在研发阶段生产低量各种LNP配方的能力是一个显著的优势。开发 LNP 的一个挑战是每个配方可以测试和优化的变量数量,以实现预期的结果和有效性。脂质和核酸在筛选、排除故障和修改许多配方参数(例如摩尔比、N/P 比率、工艺参数等)以找到最适合特定应用的 LNP 时可能成本高昂。虽然低体积可能是大规模生产最终配方的一个限制,但使用较大的微流体混合仪器扩展该技术的能力在商业上是可用的。
协议的关键步骤从根据制造商的建议妥善存储脂质库存解决方案开始。然后,LNPs 应存储在 2-8 °C 下,直至进一步使用。对于核酸制备,所展示的结果表明,柠檬酸盐缓冲液和麦酸缓冲剂能有效形成高核酸封装34、35的LNPs。如果需要,可以改用其他缓冲器。如果选择另一个缓冲区,则必须保持电离子脂质 pKa 以下的 pH 值,以确保脂质是酸性,并且可能与核酸相复合。在使用微流体混合仪器时,在 LNP 形成之前,请务必对墨盒进行制入,不要超过制造商建议的墨盒使用量,并在不同的配方成分之间更改墨盒。水体形成最常见的流动比:有机溶液为3:1:但是,如果需要,可以更改此情况。流量也可以根据需要进行调整。最后,在与 mRNA 合作时,确保整个过程中环境无 RNase 非常重要。如果没有达到所需的大小或封装效率,一些开始故障排除的地方包括更改使用的 N/P 比率或脂质摩尔百分比。此处描述的仪器过程使用最大体积限制为 12 mL 的台式机型,尽管此过程可使用不同的微流体混合模型可扩展为更大的体积。这个过程可以适应脂质混合物和核酸的变化,用于开发用于各种临床适应症的LNP。有了这种灵活性,许多未来的应用可以与LNPs实现,以产生不同的所需的配方。该技术还用于开发其他类型的纳米粒子,包括脂质体和聚合物纳米粒子。随着参数的改变,这种方法可用于各种纳米粒子配方。
此处详细介绍的协议描述了实现 mRNA 或 DNA 封装 LNP 的可重复方法。除了过程参数之外,其他考虑因素还会影响 LNP 结果。以往的工作也使用类似的方法生产各种核酸,离子脂质,N/P比率,PEG链接长度等LNP。这些参数会影响粒子的封装效率、大小和电荷。仪器制造商也注意到类似的变化,这取决于这些参数,可以优化18,36。这些参数可以进一步影响核酸的生物分布和功效。例如,研究已经调查了碳氢化合物链长度(C14,C16和C18)与PEG结合,发现C14的短乙酰链导致肝脏吸收水平高于较长的乙酰链,后者在28年更长时间内保持循环。此协议允许形成、优化和测试成分各异的 LNP,这使得这是一个多功能的过程。
披露声明
所有作者都是萨诺菲的员工。作者宣称他们没有利益冲突或相互竞争的经济利益。
致谢
感谢阿图尔·萨卢贾、亚廷·戈卡恩、玛丽亚-特雷莎·佩拉基亚、沃尔特·施文格和菲利普·扎卡斯对LNP发展的指导和贡献。
材料
| Name | Company | Catalog Number | Comments |
| 1,2-dimyristoyl-rac-glycero-3-methoxypolyethylene glycol-2000 (C-14 PEG) | Avanti Polar Lipids | 880151P | |
| 10 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1121-3810 | |
| 1000 µl Graduated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1111-2831 | |
| 20 µl Beveled Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-1810 | |
| 200 µl Graudated Filter Tips (RNase-,DNase-, DNA-free) | USA Scientific | 1120-8810 | |
| 3β-Hydroxy-5-cholestene, 5-Cholesten-3β-ol (Cholesterol) | Sigma-Aldrich | C8667 | |
| BD Slip Tip Sterile Syringes (1 ml syringe) | Thermo Fisher Scientific | 14-823-434 | |
| BD Slip Tip Sterile Syringes (3 ml syringe) | Thermo Fisher Scientific | 14-823-436 | |
| BD Vacutainer General Use Syringe Needles (BD Blunt Fill Needle 18G) | Thermo Fisher Scientific | 23-021-020 | |
| Benchtop Centrifuge | Beckman coulter | ||
| Black 96 well plates | Thermo Fisher Scientific | 14-245-177 | |
| BrandTech BRAND BIO-CERT RNase-, DNase-, DNA-free microcentrifuge tubes (1.5mL) | Thermo Fisher Scientific | 14-380-813 | |
| Citric Acid | Fisher Scientific | 02-002-611 | |
| Corning 500ml Vacuum Filter/Storage Bottle System, 0.22 um pore | Corning | 430769 | |
| Disposable folded capillary cells | Malvern | DTS1070 | |
| Ethyl Alcohol, Pure 200 proof | Sigma-Aldrich | 459844 | |
| Fisher Brand Semi-Micro Cuvette | Thermo Fisher Scientific | 14955127 | |
| Invitrogen Conical Tubes (15 mL) (DNase-RNase-free) | Thermo Fisher Scientific | AM12500 | |
| MilliporeSigma Amicon Ultra Centrifugal Filter Units | Thermo Fisher Scientific | UFC901024 | |
| NanoAssemblr Benchtop | Precision Nanyosystems | ||
| Nuclease-free water | Thermo Fisher Scientific | AM9930 | |
| Phosphate Buffered Saline (PBS) | Thermo Fisher Scientific | AM9624 | |
| Quant-iT PicoGreen dsDNA Assay Kit | Thermo Fisher Scientific | P7589 | |
| Quant-iT RiboGreen RNA Assay Kit | Thermo Fisher Scientific | R11490 | |
| Sodium Chloride | Fisher Scientific | 02-004-036 | |
| Sodium Citrate, Dihydrate, granular | Fisher Scientific | 02-004-056 | |
| SpectraMax i3x | Molecular Devices | ||
| Zetasizer Nano | Malvern |
参考文献
- Mitchell, M. J., Billingsley, M. M., Haley, R. M., Wechsler, M. E., Peppas, N. A., Langer, R., et al. Engineering precision nanoparticles for drug delivery. Nature Reviews Drug Discovery. , 1-24 (2020).
- Davis, M. E., Chen, Z., Shin, D. M. Nanoparticle therapeutics: an emerging treatment modality for cancer. Nanoscience and technology: A collection of reviews from nature journals. (239), 250 (2010).
- Patra, J. K., Das, G., Fraceto, L. F., et al. Nano based drug delivery systems: recent developments and future prospects. J Nanobiotechnol. 16 (71), (2018).
- Rai, R., Alwani, S., Badea, I. Polymeric nanoparticles in gene therapy: New avenues of design and optimization for delivery applications. Polymers. 11 (4), 745 (2019).
- Bailey, C. M., Nagarajan, R., Camesano, T. A. Designing polymer micelles of controlled size, stability, and functionality for siRNA delivery. ACS Symposium Series. 1271, 35-70 (2017).
- Yin, H., et al. Non-viral vectors for gene-based therapy. Nature Reviews Genetics. 15 (8), 541-555 (2014).
- Bailey-Hytholt, C. M., Nagarajan, R., Camesano, T. A. Förster resonance energy transfer probing of assembly and disassembly of short interfering RNA/Poly(ethylene glycol)-Poly-L-Lysine polyion complex micelles. Molecular Assemblies: Characterization and Applications. , 47-60 (2020).
- Puri, A., Loomis, K., Smith, B. Lipid-based nanoparticles as pharmaceutical drug carriers: from concepts to clinic. Crit Rev Ther Drug Carrier Syst. 26 (6), 523-580 (2009).
- Cullis, P. R., Hope, M. J. Lipid nanoparticle systems for enabling gene therapies. Molecular Therapy. 25 (7), 1467-1475 (2017).
- Munsell, E. V., Ross, N. L., Sullivan, M. O. Journey to the center of the cell: Current Nanocarrier design strategies targeting biopharmaceuticals to the cytoplasm an nucleus. Current Pharmaceutical Design. 22 (9), 1227-1244 (2016).
- Zhao, Y., Huang, L. Lipid nanoparticles for gene delivery. Advances in Genetics. 88, 13-36 (2014).
- Chen, S., et al. Influence of particle size on the in vivo potency of lipid nanoparticle formulations of siRNA. Journal of Controlled Release. 235, 236-244 (2016).
- Wan, C., Allen, T. M., Cullis, P. R. Lipid nanoparticle delivery systems for siRNA-based therapeutics. Drug Delivery and Translational Research. 4 (1), 74-83 (2014).
- Kulkarni, J. A., Cullis, P. R., Van Der Meel, R. Lipid nanoparticles enabling gene therapies: From concepts to clinical utility. Nucleic Acid Therapeutics. 28 (3), 146-157 (2018).
- Shin, M. D., et al. COVID-19 vaccine development and a potential nanomaterial path forward. Nature Nanotechnology. 15 (8), 646-655 (2020).
- Thanh Le, T., et al. The COVID-19 vaccine development landscape. Nature Reviews. Drug Discovery. 19 (5), 305-306 (2020).
- Tam, Y. Y. C., Chen, S., Cullis, P. R. Advances in lipid nanoparticles for siRNA delivery. Pharmaceutics. 5 (3), 498-507 (2013).
- Cayabyab, C., Brown, A., Tharmarajah, G., Thomas, A. mRNA lipid nanoparticles. Precision Nanosystems Application Note. , (2019).
- Gilleron, J., et al. Image-based analysis of lipid nanoparticle-mediated siRNA delivery, intracellular trafficking and endosomal escape. Nature Biotechnology. 31 (7), 638-646 (2013).
- Suzuki, Y., Ishihara, H. Structure, activity and uptake mechanism of siRNA-lipid nanoparticles with an asymmetric ionizable lipid. International Journal of Pharmaceutics. 510 (1), 350-358 (2016).
- Kowalski, P. S., Rudra, A., Miao, L., Anderson, D. G. Delivering the messenger: Advances in technologies for therapeutic mRNA delivery. Molecular Therapy. 27 (4), 710-728 (2019).
- Schmid, J. A. The acidic environment in endocytic compartments. Biochemical Journal. 303 (2), 679-680 (1994).
- Maugeri, M., et al. Linkage between endosomal escape of LNP-mRNA and loading into EVs for transport to other cells. Nature Communications. 10 (1), (2019).
- Kulkarni, J. A., Witzigmann, D., Leung, J., Tam, Y., Cullis, P. R. On the role of helper lipids in lipid nanoparticle formulations of siRNA. Nanoscale. (45), (2019).
- Hafez, I. M., Maurer, N., Cullis, P. R. On the mechanism whereby cationic lipids promote intracellular delivery of polynucleic acids. Gene Therapy. 8 (15), 1188-1196 (2001).
- Hafez, I. M., Culis, P. R. Roles of lipid polymorphism in intracellular delivery. Advanced Drug Delivery Reviews. 47 (2-3), 139-148 (2001).
- Evers, M. J. W., et al. State-of-the-art design and rapid-mixing production techniques of lipid nanoparticles for nucleic acid delivery. Small Methods. 2 (9), 1700375 (2018).
- Mui, B. L., et al. Influence of polyethylene glycol lipid desorption rates on pharmacokinetics and pharmacodynamics of siRNA lipid nanoparticles. Molecular Therapy - Nucleic Acids. 2 (139), (2013).
- Zukancic, D., et al. The importance of poly(Ethylene glycol) and lipid structure in targeted gene delivery to lymph nodes by lipid nanoparticles. Pharmaceutics. 12 (11), 1-16 (2020).
- NEBioCalculator. New England BioLabs Inc Available from: https://nebiocalculator.neb.com/#!/formulas (2020)
- Kastner, E., et al. High-throughput manufacturing of size-tuned liposomes by a new microfluidics method using enhanced statistical tools for characterization. International Journal of Pharmaceutics. 477 (1-2), 361-368 (2014).
- Zhigaltsev, I. V., et al. Bottom-up design and synthesis of limit size lipid nanoparticle systems with aqueous and triglyceride cores using millisecond microfluidic mixing. Langmuir. 28 (7), 3633-3640 (2012).
- Belliveau, N. M., et al. Microfluidic synthesis of highly potent limit-size lipid nanoparticles for in vivo delivery of siRNA. Molecular Therapy - Nucleic Acids. 1 (8), 37 (2012).
- Hassett, K. J., et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Molecular Therapy - Nucleic Acids. 15, 1-11 (2019).
- Tanaka, H., et al. The delivery of mRNA to colon inflammatory lesions by lipid-nano-particles containing environmentally-sensitive lipid-like materials with oleic acid scaffolds. Heliyon. 4 (12), 00959 (2018).
- Singh, J., et al. Nucleic acid lipid nanoparticles. Precision Nanosystems Application Note. , (2018).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。