Method Article
ヒト尿由来細胞から得られた直接再プログラムされた筋チューブでのエキソンスキップ
要約
本稿では、MYOD1変換尿由来細胞を用いてデュシェンヌ型筋の効率的なモデリングのための詳細なプロトコルを説明し、エキソンスキップ後のジストロフィンmRNAおよびタンパク質レベルの回復を評価する。
要約
進行性および致命的な筋肉疾患であるデュシェンヌ型筋ジストロフィー(DMD)は、ジストロフィンタンパク質の存在を引き起こすDMD遺伝子の突然変異によって引き起こされる。現在までに、エキソン53スキップしやすいモルフォリノオリゴヌクレオチドの全身注射に基づいて、国立神経学・精神医学センターで研究者が開始した最初のヒト研究を完了しました。DMDの効果的な治療のために、臨床試験を行う前に薬物をスクリーニングし、患者の適格性を評価するためにDMD患者由来の筋芽細胞を用いたインビトロ検査が不可欠であると考えられる。ごく最近、ヒストンメチルトランスファーザーゼ阻害剤(3-デアザンプラノシンA塩酸塩)で処理された新しいMYOD1変換尿由来細胞(UDC)をDMDの細胞モデルとして報告しました。新しい自家用UDCは、DMDの疾患特異的な遺伝子型のフェノノコピーを示し、様々な筋肉関連疾患における精密医療の応用につながる可能性がある。本稿では、MYOD1-変換UDCを用いたDMD筋細胞の効率的なモデリングと逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)、ウェスタンブロッティング、免疫細胞化学を用いて、エクストンスキップ後のジストロフィンmRNAおよびタンパク質レベルの回復を評価するための詳細なプロトコルについて述べた。
概要
デュシェンヌ型筋ジストロフィー(DMD)は、進行性で致命的な筋肉疾患であり、ジストロフィンタンパク質1の不在をもたらすDMD遺伝子のフレームシフト突然変異によって引き起こされる。アンチセンスオリゴヌクレオチドベースのエキソンスキップ療法は、DMDに有望であると考えられている。この療法は、DMD読み取りフレーム2を復元するためにmRNA前スプライシングを変更することにより、より穏やかなベッカー型筋ジストロフィー様表現型への重症性DMD表現型の変換に基づいている。我々は最近、DMDでエキソン53スキップを誘発することができるリンコオダミドモルフォリノオリゴマー(PMO)絨毛球の静脈内投与を繰り返すことに基づくヒト初の研究を完了し、優れた安全性プロファイル、有望な有効性、および許容可能な薬物動態学的パラメータ(UMINとして登録:000010964およびCLINICALTRIALS.GOV:NCT0286)3
しかし、この疾患に対する費用対効果の高い効率的な治療法を開発するためには、DMD患者から得られた原発性筋細胞を用いたインビトロ試験は、臨床試験を行う前に薬物スクリーニングおよび患者適格性の検証に不可欠であり、また、ヒト試験中のエキソンスキップ療法の有効性を反映したバイオマーカー4。ごく最近、患者特異的なMYOD1変換尿由来細胞(UDC)5,6を,6DMD7の5原発筋芽細胞として開発する新しい技術を報告した。従って、筋芽細胞を生成するために、患者からの尿の採取のみが必要であり、侵襲的処置は必要とされない。本稿では、3-デアザネプラノシンA塩酸塩で処理されたMYOD1変換UDCを用いてDMD筋肉を効率的にモデリングするための詳細なプロトコルを説明し、エキサキのスキップ後に復元されたジストロフィンmRNAおよびタンパク質を評価する。
プロトコル
国立神経精神医学センターの倫理委員会は、この研究を承認しました(承認ID:A2017-018、A2018-029)。すべての個人は尿を提供する前にインフォームド・コンセントを与えました。すべての実験は、関連するガイドラインと規制の下で行われました。
1. UDC の分離と主要な文化
注: UDC は、以前に公開されたプロトコル8、9,、10に従って分離されました。,
- 殺菌されたペットボトルの自然なミチュレーションの間に尿サンプルを集める。
注:外尿道オリフィスの殺菌は必要ありません。中流尿は、ウイルス汚染のリスクを低減することが望ましい。次の手順の前にストック時間が>1時間である場合、尿サンプルは細胞の生存率を維持するために4°Cに移す必要があります。しかし、不溶性沈殿物が現れるため、<4°Cの温度は避けるべきです。 - 尿サンプル全体を室温で10分間400xgで遠心分離する。 g
- 上清を吸引し、チューブに1mLを残す。
- 残りの1mLの尿中にペレットを個別に再懸濁し、それらを単一の50 mLチューブに集める。
- カルシウムとマグネシウムを含まない99mLのPBS、ペニシリン/ストレプトマイシン(P/S)1%、0.5 μg/mLアンホテリシンB、遠心分離機を200xgで室温で10分間加えます。 g
- 上清を吸引し、チューブに0.2mLを残す。
- ピルビン酸ナトリウムを含まない高グルコースダルベックの改変イーグル培地(DMEM)と組換えヒト表皮成長因子(EGF)を補ったハムのF-12栄養混合物の1:1混合物で構成される一次培地の4.5 mLで細胞ペレットを再懸濁し、 インスリン、 ヒドロコルチゾン、エピネフリン、T3、トランスフェリン、10%テトラサイクリンフリーウシ胎児血清(FBS)、1%P/S、および0.5 μg/mLアンホテリシンB。
- ゼラチンコーティング6ウェルプレート(各ウェルの総体積、1.5 mL)の3つのウェルに細胞を播種します。培養液は37°C、CO2を5%2で24時間加湿した。
- 次の3日間、1.5 mLのプライマリメディアを毎日追加します。
- 4日目に、組換えヒトEGFを添加した1.5mLの成長培地に交換し、 インスリン、ヒドロコルチゾン、エピネフリン、T3、トランスフェリン、15%テトラサイクリンフリーFBS、0.5%L-アラニン-L-グルタミン、0.5%非必須アミノ酸、および2.5 ng/mL線維芽細胞増殖因子-塩基(bFGF)、組換えヒトプレート誘導因子(PDGF)、EGF、および1/1%P/1%P/1%。
- 1日おきに成長培地を変更します。
注: UDC コロニーは 1 週間以内に出現します。 - UDC培養が80-90%コンフルエントになったら、培地を取り除き、PBSで細胞を洗浄し、0.25%トリプシンEDTAを使用してすべての細胞を分割し、3,000-5,000細胞/cm2で新しいゼラチンコーティングされた60mm皿に播種します(通路1)。
注: UDC は液体窒素で保管できます。UDCは通常、60 mm培養皿の60~70%の合流度で3つのストックチューブに分けられます。
2. レトロウイルスコンストラクト
- ポリメラーゼ連鎖反応(PCR)により、MYOD1(NM_002478.4)プラスミドのコード領域を増幅します。
注: MYOD1増幅とサーマルサイクラーの条件の混合物を表1と表 2にそれぞれ示します。 - 増幅PCR産物の1μLを用いて約1,000bpサイズのアガロースゲル電気泳動で1バンドを検出し、MYOD1配列が正常に増幅されたことを確認します。
- クリーンアップキットを使用してPCR製品を洗浄し、分光光度計で濃度を決定します。
- 一晩37°Cで表3に示すように混合物をインキュベートし、複数クローニング部位の制限酵素標的領域においてTet-on系およびピューロマイシン耐性遺伝子を用いてレトロウイルスベクターを消化する。
- 1つのバンドを0.7%のアガロースゲル電気泳動で検出し、1μLの消化物を使用して、レトロウイルスベクターが正常に消化されたことを確認します。
- クリーンアップキットを使用して消化された製品を洗浄し、分光光度計によってその濃度を決定します。
- 増幅されたMYOD1フラグメント(ステップ 2.1-2.3 で生成される)を、消化されたレトロウイルスベクター(ステップ 2.4-2.6 で生成)にクローン化するには、融合中クローニング反応を実行します。表4に示すように反応を設定し、50°Cで15分間反応をインキュベートし、氷の上に置きます。
- メーカーの指示に従って大腸菌のコンピテントセルを使用して変換を行います (資料表)。
- 10 g/L バクトトリプトン、5 g/L バクト酵母エキス、5 g/L NaCl、15 g/L バクト寒天、および 50 mg/L アンピシリンからなる LB 培養プレート上で培養することにより、形質転換されたコンピテント 細胞を選択します。
- 選択したコロニーと培養液を、一晩37°Cで200rpmでバクト寒天なしでLB培養培地でピックアップする。
- プラスミド精製キット(材料表)を使用してMYOD1挿入レトロウイルスベクターを精製し、分光光度計を使用して定量化します。
- 挿入されたMYOD1配列を横切って両側にそれぞれ標的とするフォワードおよびリバースプライマーによって増幅されたPCR産物の直接シーケンシングによって、MYOD1がレトロウイルスベクターに正しく挿入されることを確認する。
注: MYOD1シーケンスは、融合中のクローニングが成功した場合に、レトロウイルスベクター配列の間に挟まれた検出が可能です。 - レトロウイルス産生のために、10cmコラーゲンコーティングプレートの50,000細胞/cm2で包装細胞を播種し、DMEMで10%FBSを加湿して37°C、5%CO2で224時間培養します。
- 包装細胞が80%の合流に増殖する場合、30μgのMYOD1-挿入レトロウイルスベクター、30μgの包装ベクター、および細胞貫通ペプチド(材料表)を含むトランスフェクション試薬を渦で混合し、10分間インキュベートします。
- 37°Cおよび5%CO2で加湿した培養細胞および培養液にインキュベートした混合物を加える。
注:コラーゲンのコーティングが必要です。培養液は、培養プレートから細胞を分離しやすいため、播種後24時間以上で良い場合があります。 - 4時間または一晩後、培地を新たな成長培地に変更する。
- ウイルス上清を収集し、コトランスフェクション後24時間と48時間で新鮮な培地に置き換え、上清を組み合わせます。
- ウイルス上清を濃縮するには、濃縮試薬と混合し、一晩で37°Cでインキュベートし、4°Cで45分間1,500 x gで遠心分離機を行います。
- レトロウイルス上清を0.45μmの孔でPVDFフィルターでフィルターします。
- メーカーの指示に従って定量PCRキットとサーマルサイクラーシステムを使用して、レトロウイルスベクターの力乗をチェックしてください。
- ウイルス上清を小さなアリコートに分け、-80°Cでストックします。
3. UDCにおけるMYOD1-レトロウイルスベクターの感染
- ゼラチンコーティングされた60mm皿に3,000-5,000セル/cm2でUDCをシードします。
- 24時間の播種後、解凍したレトロウイルス(ステップ2.21)を、8μg/mLの濃度でヘキサジメトリン臭化物を加えることによって、200の感染の多重度に感染する。
- 37°Cおよび5%CO2で24時間の培養を加湿した後2、培養培地を1μg/mLピューロマイシンを含む新鮮な成長培地に置き換えて、MYOD1-トランスデューブ細胞を選択する。1 日おきにメディアを変更します。
注意:MYOD1陽性細胞を選択する場合、通常1μg/mLのピューロマイシンが選択に使用されます。適切な用量を決定する必要があります。.未感染細胞を含むプレートを使用し、3-5日にすべての細胞を殺す用量を選択してください。MYOD1-陽性細胞は、ピューロマイシンを添加してから7〜10日以内に選択する必要があります。MYOD1-トランスデュースされたUDCは液体窒素で貯えることができる。
4. 3-デアザネプラノシンA塩酸塩(DZNep)で処理されたMYOD1-トランスデュースUDCの筋形成分化
注:最近、ヒストンメチルトランスフェラーゼ阻害剤であるDZNepが、後期筋調節因子の1つであるMYOGENINの発現を有意に促進し、また、ミオチューブ分化7を導く可能性があると報告されている。
- プレートMYOD1- 3.5 x 104細胞/cm2の密度でコラーゲンコーティングウェル内の UDC を導入しました。培養は37°C及び5%CO2で2加湿した。
- 24時間後、L-アラニン-L-グルタミン、5%馬血清、ITSサプリメント、1 μg/mLドキシサイクリン、および5 μM DZNepを用いた高グルコースDMEMで構成される分化培地に成長培地を変更します。
注:10 mM DZNepソリューションは-80°Cで3ヶ月間保存できます。霜を取り除く冷凍庫を使用し、凍結融解サイクルを繰り返さないようにします。ドキシサイクリンとDZNepによって活性化されたMYOD1の両方が増殖を抑制し、UDCの心因性分化を促進する。したがって、ドキシサイクリンおよびDZNepは、筋形成分化の誘導後に添加することが推奨される。DZNepは、用量依存的な方法でMYOD1-UDCの筋原性分化を促進する。一方、高濃度で細胞毒性を示す。したがって、筋原性分化および細胞生物学的利用能への影響に応じて、1-10 μMの範囲のDZNepの適切な濃度を決定します。 - 3日後、DZNepを使用せずに新しい分化培地に分化培地を変更する。次に、3日ごとに培地を交換する。
注:UDCは互いに融合し、分化後1〜2週間以内にミオチューブを形成します。
5. MYOD1変換された UDC でのエキソンスキップ
注:ここでは、患者由来細胞におけるエキソンスキップを評価する3つのプロトコルが記載されています:1)ジストロフィンmRNAの逆転写酵素ポリメラーゼ連鎖反応(RT-PCR)。2)ウェスタンブロットによる回復ジストロフィンタンパク質シグナルの半定量化;3)免疫細胞化学による回復したジストロフィン蛍光シグナルの半定量化。すべての方法は、用量依存的な方法でエキソンスキップを検出することができます。
- RT-PCRによるエキソンスキップ効率の評価
- 7日目にDMD患者から得られたオリゴヌクレオチド(ASO)を、分化後7日目に得られたMYOD1変換UDCにトランスフェクトするには、ASO、トランスフェクション試薬(材料表)を混合し、最終濃度1〜10μMに分化培地を37°Cおよび5%CO2で加湿した培養液。2
- ASOで72時間のインキュベーションを行った後、ASOを使用せずに培地を新鮮な分化培地に変更する。
- ASOトランスフェクションの3~7日後から、分化培地を取り出し、PBSで1倍洗います。細胞のリシスバッファーを追加し、UDCを解凍し、RNA抽出キットを使用して全RNAを収穫します。
- 分光光度計でRNA濃度を測定します。
- 表 5に従って、PCR チューブに 1 ステップ RT-PCR 反応に必要な試薬を組み合わせます。
- PCR チューブを混合した温度サイクルに入れます。表 6に従ってサーモサイクラーを実行します。
- マイクロチップ電気泳動を行い、以下のようなモル濃度を用いてエキソンスキップ効率を算出する。
エクソンスキップ効率(%)=スキップバンド/(スキップバンド+非スキップバンド)x 100
注:PCR製品は、短期保存用に4°C、長期保存用に-20°Cの冷蔵庫に保管してください。
- ウェスタンブロッティングによるエキソンスキップ後のジストロフィンの検出
- ステップ5.1.1および 5.1.2 に従ってトランスフェクト ASO および培養 MYOD1 -UDC.
- 3日ごとにメディアを変更します。
- 分化の2週間後、プロテアーゼ阻害剤を含む放射性免疫沈降アッセイ(RIPA)緩衝液を用いて培養細胞から全タンパク質を抽出する。
- 氷上のライゼを、遠心分離機で14,000 x gで4°Cで15分間超音波処理します。
- 上清を収集し、BCAタンパク質アッセイキットを使用してタンパク質濃度を決定します。
- 0.5 mLチューブに全タンパク質15μgを加え、プロテアーゼ阻害剤を含むRIPAバッファーを総体積10μLに加えて希釈し、1レーン当たり15μgの全タンパク質を実行します。
- 表7に示すように、サンプルバッファー、還元剤、脱イオン水を加える。細胞ライセートを70°Cで10分間変性させる。
- 8.95 g/L トリシン、6.06 g/Lトリスベース、1.0 g/Lドデシル硫酸ナトリウム(SDS)を含むトリス酢酸ランニングバッファーを準備します。
- サンプル(20 μL)をトリス酢酸3-8%ゲルにセットし、150 Vで75分間電気泳動を行います。
- メタノールを使わずにブロッティングバッファーを準備します。
- PVDF膜を20 sメタノールに浸し、次にブロッティングバッファーに浸して使用するまで(少なくとも10分)PVDF膜をミニゲルで6 x 8 cm、ミディゲルで8 x 12 cmのサイズに切ります。
- ブロッティングペーパーをPVDF膜と同じサイズに切り、使用するまでブロッティングバッファに浸します。
- 電気泳動後、PVDF膜と同じ大きさのゲルを切り、蒸留水に浸します。
- ブロッティングペーパー、PVDF膜、およびゲルをセミドライ転写装置に配置する(図1)。4 mA/cm2で 30 分間転送します。
- 膜2xを蒸留水でリンスします。
- 抗ジストロフィン(1:500)および抗α-チューブリン(1:1,200)抗体を一次抗体として調製する。
- HRP結合抗マウス抗体(1:100)を二次抗体として調製する。
- 膜を一次抗体でインキュベートし、洗浄バッファーで洗浄し、室温で自動化された西洋処理装置(材料表)を使用して二次抗体と共にインキュベートします。
注:抗α-チューブリン抗体は、通常、負荷制御として使用されます。1:500抗ジストロフィンおよび1:1,200抗α-チューブリン抗体を含む混合一次抗体溶液は、抗体反応が同時に行われるとうまく機能します。 - 蒸留水で膜をすすい。
- 化学発光検出試薬と電荷結合デバイス(CCD)カメラベースのイメージャーを使用してタンパク質を検出します。
- 適切なソフトウェアを使用してデータを分析します。
- 免疫細胞化学によるエキソンスキップ後のジストロフィンの検出
- ステップ 4.1-4.3 に従って、UTUBE をコラーゲンコーティング 96 ウェルプレートで直接ミオチューブに再プログラムします。
- ステップ 5.1.2 および 5.1.3 に従って ASO および培養MYOD1-UDC をトランスフェクトします。
- 分化2週間後、PBSで細胞を洗浄し、4°Cで10分間、4%パラホルムアルデヒドに固定します。
- MYOD1-UDCを室温で10分間0.1%の非イオン性洗剤で透過し、37°Cで15分間ヤギ血清10%の液剤を遮断します。
- 一次抗体を4°Cで一晩インキュベートする。
- 細胞をPBSで洗浄し、二次抗体で室温で30分間インキュベートします。
注:ここでは、マウス抗ジストロフィン(1:30)が一次抗体として使用され、抗マウスIgGが二次抗体として使用され、そしてHoechst(1:10,000)が核染色に使用されます。 - 蛍光顕微鏡を使用してプレートを画像化し、アナライザーを使用して、同じ条件下のすべてのウェルで蛍光信号を自動的に半定量化します。
結果
私たちは、UDCを簡単かつ非侵襲的に収集することができました。UDCは、一次細胞培養を開始してから1週間以内にコロニーを形成し、顕著な増殖能を観察した。UDCの培養は簡単で、手順が正しく行われたときには細菌または真菌汚染はまれでした。
図2は、一次培養後の1週間のUDCコロニーの代表的な位相コントラスト画像を示す(図2A)とMYOD1-UPCが分化後の1週間(図2B)。図3は、RT-PCRによりDMD患者から得られたUDCにおけるエキソンスキップの正常な検出を示す。図3Aは、DMD遺伝子にエキソン45-54欠失を有する6歳の雄由来のDZNep処理されたMYOD1-UDCにおけるアンチセンスオリゴヌクレオチド処理後のジストロフィンのRT-PCR分析を示す。オープンリーディングフレームは、exon 44スキップによって復元されました。分化後の14日目に、用量依存的にエキソンスキップの誘導を確認した(図3B)。上のバンドはネイティブ製品を示し、下のバンドはオープンリーディングフレームを復元したexon 44スキップされた製品を示します。
図4は、用量依存的にウェスタンブロッティングによってDMD患者から得られたUDCでのエキソンスキップ後のジストロフィンの検出に成功したことを示す。また、免疫細胞化学を用いて復元されたジストロフィン発現を検出した(図5)。96ウェルプレート上のアンチセンスオリゴヌクレオチド(ASO)トランスフェクションの1週間後に蛍光顕微鏡でジストロフィンの強度を測定した(図5A)。対照ASOで処理されたMYOD1-UDCよりもASOで処理されたMYOD1-UDCでは、著しく高い蛍光シグナルが観察された(図5B)。 MYOD1
これらの結果は、我々の新しいアッセイがmRNAおよびタンパク質レベルでDMD患者から得られたMYOD1-UDCで効率的にエキソンスキップを評価できることを示唆している。
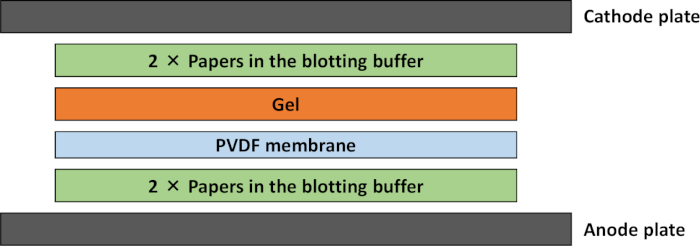
図1:セミドライウェスタンブロットの転写スタックの概略図。ブロッティングバッファーに浸した 2 つのペーパーを負の端子に置き、その上に 2 つのペーパーをバッファーに浸した。緩衝液に浸したゲルをPVDF膜の上にそっと敷いた。この図の大きなバージョンを表示するには、ここをクリックしてください。

図 2: UDC の代表的なイメージ。(A) 一次培養の1週間後のUDCの位相コントラスト画像。スケールバー = 200 μm. インセット: 白い長方形の領域の拡大画像。(B) 分化後1週間のMYOD1-UDCの位相コントラスト画像。スケールバー= 50 μmこの図は、滝沢ら7.7から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図3:DMD患者から得られた尿由来細胞(UDC)におけるエキソンスキップの評価に成功したRT-PCR。(A)3-デアザネプラノシンA塩酸塩(DZNep)処理したMYOD1-UDCをエキソン45-54欠失で、3-デアザネプラノシンA塩酸塩中のアンチセンスオリゴヌクレオチド処理後のジストロフィンのRT-PCR解析。DZNep処理されたMYOD1-UDCも、コントロール濃度1~10μMのコントロールアンチセンスでコントロールとして処理しました。上のバンドは、読み取りフレームから残ったスキップされていない製品(Ex 45-54削除)でした。下のバンドは、オープンリーディングフレームを復元したexon 44スキップされた製品(Ex 44-54削除とEx 44スキップ)でした。(B)スキップ効率(エキソン44スキップ転写モルリティ)/(ネイティブ+エキソン44スキップ転写モルリティ[矢印でマーク])x 100%マイクロチップ電気泳動システムを用いて計算した。一方向の ANOVA とそれに続くボンフェローニのポスト ホック テストは、スキップ効率を比較するために使用されました (n = 3 各グループの場合、****P < 0.0001)。データは平均±SEMとして表される。この図は、滝沢ら7.7から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図4:ウェスタンブロットによるDMD患者からの尿由来細胞(UDC)におけるエキソンスキップの評価に成功した。(A)DZNep処理されたMYOD1-UDCのジストロフィンの代表的なウェスタンブロットは、エキソン44スキップ後にエキソン45-54欠失を伴うDMD患者から。Aジストロフィン検出には、抗ジストロフィン(C末端に対して)が用いられた。(B)αチューブリン発現に正規化されたバンドの相対強度を、一方向ANOVAを行い、続いてボンフェローニのポストホック検査を行うことによって、アンチセンスオリゴヌクレオチド処理の有無にかかわらず患者由来細胞で比較した(n = 3各群、**P<0.01、***P;0.001、HI=健康個体数)。この図は、滝沢ら7.7から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。

図5:DZNep処理されたMYOD1-UDCにおけるアンチセンスオリゴヌクレオチド処理後のジストロフィンに対する免疫細胞化学のヒートマップ-45-54欠失を伴うDMD患者から得た。(A)exon 45-54の削除は、エクソン44のエキソンスキップに基づいてオープンリーディングフレームを復元した。A(B)シグナル強度を、96ウェルプレート上のアンチセンスオリゴヌクレオチドトランスフェクションの1週間後に蛍光顕微鏡を用いて定量した。一方向の ANOVA とそれに続くボンフェローニのポスト ホック テストが比較に使用されました (n = 各グループに対して 3-4、 ****P < 0.0001)。この図は、滝沢ら7.7から変更されました。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 試薬 | ボリューム | 最終濃度 |
| 2x PCR プレミックス | 12.5 μL | 1x |
| フォワードプライマー | 5 pmol | 0.2 μM |
| リバースプライマー | 5 pmol | 0.2 μM |
| テンプレート | 80 ng | |
| 殺菌された蒸留水 | 最大25 μL | |
| 反応ごとの総体積 | 25 μL |
表1:RT-PCRによるMYOD1増幅のための混合物。
| 98°C | 10 s | |
| 55°C | 10 s | } 35 サイクル |
| 72°C | 10 s |
表2:MYOD1増幅のためのサーマルサイクラーの条件。
| 試薬 | ボリューム |
| 10x K バッファ | 2 μL |
| レトロウイルスベクター(500 ng/μL) | 2 μL |
| 制限酵素1(2-15 U) | 1 μL |
| 制限酵素2(2-15 U) | 1 μL |
| 殺菌された蒸留水 | 14 μL |
| 総量 | 20 μL |
表3:レトロウイルスベクターを消化するチューブの混合物。
| 試薬 | ボリューム |
| 精製されたミオド1フラグメント | 100 ng |
| 消化されたレトロウイルスベクター | 100 ng |
| 5x酵素プレミックス | 4 μL |
| 殺菌された蒸留水 | 最大20 μL |
| 総量 | 20 μL |
表4:インフュージョンクローニング反応のための混合物。
| ソリューション | ボリューム/リアクション (μL) | 最終濃度 |
| RNaseフリーウォーター | 変数 | - |
| ワンステップ RT-PCR バッファー | 4 | 1x |
| dNTP ミックス (各 dNTP の 10 mM を含む) | 0.8 | 各 dNTP の 400 mM |
| フォワードプライマー(10mM) | 1.2 | 0.6 mM |
| リバースプライマー(10mM) | 1.2 | 0.6 mM |
| ワンステップ RT-PCR 酵素ミックス | 0.8 | - |
| RNase阻害剤(オプション) | 変数 | 5-10単位/反応 |
| テンプレート RNA | 50-400 ng | |
| 総量 | 20 |
表5:ワンステップRT-PCRの1回の反応に必要な化合物。
| 1サイクル | 逆転写 | 30分 | 50°C |
| 1サイクル | 初期 PCR 活性化ステップ | 15分 | 95°C |
| 1サイクル | 変性 | 1分 | 94°C |
| 焼鈍 | 1分 | 60°C | |
| 拡張子 | 1分 | 72°C | |
| 1サイクル | 最終拡張 | 7分 | 72°C |
| 保持 | ∞ | 4°C |
表6:ワンステップRT-PCRのサーマルサイクラー状態
| 試薬 | ボリューム |
| タンパク質(15μg) | 10 μL |
| サンプルバッファー (4x) | 5 μL |
| 還元剤(10倍) | 2 μL |
| 脱イオン水 | 3 μL |
| 総量 | 20 μL |
表7:ドデシル硫酸ポリアクリルアミドゲル電気泳動用サンプルの調製(SDS-PAGE)。
ディスカッション
ここでは、DMD患者から得られたMYOD1変換されたUDCにおけるエキソンスキップの詳細なプロトコルについて説明する。アッセイシステムを用いて、最適なアンチセンス配列を効率的にスクリーニングした。MYOD1変換されたUDCは、疾患の病態生理学の調査に有用であると仮定する。
臨床試験を実施する前に、新薬のスクリーニングや患者の適格性評価には、mRNAレベルで患者由来細胞を使用したエキソンスキップの評価が不可欠です。エキソンスキップ効率の計算は、mRNAレベルでのみ評価することができる。
ジストロフィンの修復はエキソンスキップの利点を予測する代理バイオマーカーとして重要であるため、タンパク質レベルでのエキソンスキップの評価も重要です。現在までに、ヒト横紋筋肉腫(RD)細胞を含む一次筋細胞株または不死化筋芽細胞株を用いてアンチセンスオリゴヌクレオチド配列のスクリーニングが行われることが多いが、このタンパク質を内因的に発現するため、筋細胞株やRD細胞株を用いたジストロフィンレベルの回復を測定することはできない。DMD患者由来MYOD1-UDCにおけるジストロフィンの回復を用量依存的に明確に検出することができる。今回の新しいアッセイでは、ウェスタンブロッティングによる復元タンパク質の評価が定量性に優れていると考えています。一方、96のウェルプレートを用いた免疫細胞化学による評価は、多くの候補化合物を同時にスクリーニングするのに理想的である。
本稿では、MYOD1-変換UDCを用いた効率的なDMD筋の詳細なモデル化プロトコルと、RT-PCR、ウェスタンブロッティング、免疫細胞化学を用いて、エキサクスキップ後のmRNAおよびタンパク質レベルで復元されたジストロフィンを評価する。UDCは非侵襲的かつ容易に収集することができる。したがって、新しいインビトロアッセイは、筋肉疾患の種類に関係なく、幅広い基礎的および翻訳的研究に適用できると仮定しています。
開示事項
国立神経精神医学センターは現在、日本新薬有限公司と共に、DMD用のエキソン53スキップ薬であるNS-065/NCNP-01を開発中です。
謝辞
This work was supported by the Japan Society for the Promotion of Science Grant-in-Aid for Scientific Research (C) [grant no. 18K07544 to Y.A.], Grants-in-Aid for Research on Nervous and Mental Disorders [grant no. 28-6 to Y.A.], and the Japan Agency for Medical Research and Development [grant nos. 18ek0109239h0002, 18lm0203066h0001, and 18lm0203069h0001 to Y.A.].
資料
| Name | Company | Catalog Number | Comments |
| 1% P/S Solution Stabilized | Thermo Fisher | 15070-063 | Cell culture |
| Amphotericin B | Sigma Aldrich | A2942 | |
| Anti-dystrophin | Abcam | ab15277 | Western blot (WB) |
| Anti-dystrophin | Leica | NCL-DYS1 | Immunocytochemistry(ICC) |
| Anti-mouse IgG, Dylight 488 | Vector Laboratories | DK-2488 | ICC |
| Anti-α-tubulin | Sigma | T6199 | Western bot and ICC |
| BZ-X800 | KEYENCE | BZ-800 | Fluorescent microscope |
| CELLBANKER | ZENOAQ | CB011 | Cell stock in liquid nitrogen |
| ChemiDoc MP Imaging System | Bio-Rad | 170-8280J1 | WB |
| CloneAmp HiFi PCR premix | Clontech | 639298 | Retroviral production |
| cOmplete Protease Inhibitor Cocktail | Roche | 4693116001 | Protein extraction for WB |
| E.coli DH5 α Competent Cells | TAKARA | 9057 | |
| ECL Prime Western Blotting Detection Reagent | GE healthcare | RPN2232 | WB |
| EGF | Peprotech | AF-100-15 | Cell culture |
| Endo-Porter | GeneTools | 2922498000 | ASO transfection |
| Extra Thick Blot Filter Paper | Bio-Rad | 1703965 | WB |
| EzFastBlot HMW | Atto | AE-1460 | WB |
| fibroblast growth factor-basic | Sigma-Aldrich | F0291 | Cell culture |
| Glutamax | Thermo Fisher Scientific | 35050-061 | Cell culture |
| GP2-293 packaging cells | Clontech | 631458 | Retroviral production |
| Ham's F-12 Nutrient Mix | Thermo Fisher Scientific | 11765-054 | Cell culture |
| High glucose DMEM with GlutaMAX-I | Thermo Fisher Scientific | 10569-010 | Cell culture |
| High glucose DMEM without sodium pyruvate | GE Healthcare | SH30022.01 | Cell culture |
| HiSpeed Plasmid Purification Kit | QIAGEN | 12643 | Retroviral production |
| Histofine Simple Stain MAX PO | NICHIREI BIOSCIENCE INC. | 424151 | WB |
| Hoechst 33342 | Thermo Fisher Scientific | H3570 | ICC |
| Human PDGF-AB | Peprotech | 100-00AB-10UG | Cell culture |
| iBind Flex Solution | Thermo Fisher Scientific | SLF2020 | WB |
| iBind Flex Western Device | Thermo Fisher Scientific | SLF2000 | WB (Automated mestern-processing device) |
| Immobilon-P Transfer Membrane (PVDF) | MERCK | IPVH304F0 | WB |
| In-Fusion HD cloning Kit | Clontech | 639648 | Retroviral production |
| ITS Liquid Media Supplement | Sigma-Aldrich | I3146 | Cell culture |
| MILTEX HV 0.45 μm filter | MERCK | SLHV033RS | Retroviral production |
| MultiNA | SHIMADZU | MCE-202 | Microchip electrophoresis |
| MYOD1 (GFP-tagged) | ORIGENE | RG209108 | Retroviral production |
| NanoDrop | Thermo Fisher | ND-ONE-W | Spectrophotometer |
| Nonessential amino acids | Thermo Fisher | 11140-050 | Cell culture |
| NucleoSpin Gel and PCR Clean-Up Kit | Clontech | 740986.20 | PCR clean up |
| NuPAGE 3-8% Tris-Acetate Protein Gels | Invitrogen | EA03785BOX | WB |
| NuPAGE Antioxidant | Invitrogen | NP0005 | WB |
| NuPAGE LDS Sample Buffer | Invitrogen | NP0007 | WB |
| NuPAGE Sample Reducing Agent | Invitrogen | NP0009 | WB |
| NuPAGE Tris-Acetate SDS Running Buffer | Invitrogen | LA0041 | WB |
| One Step TB Green PrimeScript RT-PCR Kit | TAKARA | RR066A | Titer check of retroviral vector |
| PBS | Thermo Fisher Scientific | 14190-250 | Cell culture |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23227 | WB |
| Polybrene Infection / Transfection Reagent | Sigma-Aldrich | TR-1003 | Retroviral infection |
| pRetroX-TetOne-Puro Vector | Clontech | 634307 | Retroviral vecor |
| Puromycin | Clontech | 631305 | Cell culture |
| QIAGEN OneStep RT-PCR Kit | Qiagen | 210212 | PCR |
| REGM Bullet Kit | Lonza | CC-3190 | Material for growth medium of UDCs |
| REGM SingleQuots | Lonza | CC-4127 | Material for primary medium of UDCs |
| Retrovirus Titer Set | TAKARA | 6166 | Titer check of retroviral vector |
| Retro-X Concentrator | Clontech | 631455 | Retroviral production |
| RIPA buffer | Thermo Fisher Scientific | 89901 | WB |
| RNeasy kit | Qiagen | 74104 | RNA extraction for PCR |
| Tetracycline-free foetal bovine serum | Clontech | 631106 | Cell culture |
| Triton-X | MP Biomedicals | 9002-93-1 | ICC |
| Trypsin-EDTA (0.05%) | Gibco | 25300054 | Cell culture |
| XCell SureLock Mini-Cell | Invitrogen | EI0001 | WB |
| Xfect transfection reagent | Clontech | 631317 | Transfection of plasmids into packaging cells |
参考文献
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51, 919-928 (1987).
- Cirak, S., et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. Lancet. 378, 595-605 (2011).
- Komaki, H., et al. Systemic administration of the antisense oligonucleotide NS-065/NCNP-01 for skipping of exon 53 in patients with Duchenne muscular dystrophy. Science Translational Medicine. 10 (437), (2018).
- Antoury, L., et al. Analysis of extracellular mRNA in human urine reveals splice variant biomarkers of muscular dystrophies. Nature Communications. 9, 3906 (2018).
- Rahmoune, H., et al. Glucose transporters in human renal proximal tubular cells isolated from the urine of patients with non-insulin-dependent diabetes. Diabetes. 54, 3427-3434 (2005).
- Zhang, Y., et al. Urine derived cells are a potential source for urological tissue reconstruction. The Journal of Urology. 180, 2226-2233 (2008).
- Takizawa, H., et al. Modelling Duchenne muscular dystrophy in MYOD1-converted urine-derived cells treated with 3-deazaneplanocin A hydrochloride. Scientific Reports. 9, 3807 (2019).
- Zhou, T., et al. Generation of human induced pluripotent stem cells from urine samples. Nature Protocols. 7, 2080-2089 (2012).
- Chen, W., et al. Skeletal myogenic differentiation of human urine-derived cells as a potential source for skeletal muscle regeneration. Journal of Tissue Engineering and Regenerative Medicine. 11, 334-341 (2017).
- Kim, E. Y., Page, P., Dellefave-Castillo, L. M., McNally, E. M., Wyatt, E. J. Direct reprogramming of urine-derived cells with inducible MyoD for modeling human muscle disease. Skeletal Muscle. 6, 32 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved