Method Article
マウス膵管腺癌の超音波誘導矯正着移植
要約
マウス由来膵管腺癌細胞株の超音波誘導移植のためのプロトコルを原在腫瘍部位に直接記載する。このアプローチは、注射の2〜4週間以内に超音波スキャンによって検出可能な膵臓腫瘍をもたらし、外科的整形トピック移植と比較して腹壁の腫瘍細胞播種の割合を有意に減少させた。
要約
黒色腫および肺腺癌における免疫チェックポイント遮断の最近の成功は、免疫腫瘍学の分野を亜鉛めっきにし、患者の大半が免疫療法に反応しないため、現在の治療の限界を明らかにした。新しい効果的な治療の組み合わせを迅速に特定するための正確な前臨床モデルの開発は、この満たされていない臨床ニーズに対処するために重要です。膵管腺癌(PDA)は、免疫療法に応答する患者のわずか2%の免疫チェックポイント遮断耐性腫瘍の正規の例である。遺伝子組み換えクラスG12D+/-;Trp53R172H+/-;PDAのPdx-1 Cre(KPC)マウスモデルはヒト疾患を再現し、前臨床環境における免疫療法耐性の治療法を評価するための貴重なツールですが、腫瘍発症までの時間は非常に可変的です。PDAの外科的オルソトピック腫瘍移植モデルは、KPC組織特異的腫瘍微小環境(TME)の免疫生物学的特徴を維持するが、時間集約的な手順を必要とし、異常な炎症を導入する。ここでは、超音波誘導矯正局所腫瘍移植モデル(UG-OTIM)を用いて、KPC由来PDA細胞株をマウス膵臓に直接非侵襲的に注入する。UG-OTIM腫瘍は内因性組織部位で増殖し、PDA TMEの組織学的特徴を忠実に再現し、腹壁に最小限の播種で注射後4週間までに前臨床研究のための登録サイズの腫瘍に到達する。ここで説明するUG-OTIMシステムは、マウスPDA TMEにおける新規な治療組み合わせの高スループット分析を可能にする迅速かつ再現性の高い腫瘍モデルである。
概要
膵管腺癌(PDA)は、現在の治療に難治性である悪名高い攻撃的な疾患であり、陰気な5年生存率は9%1である。PDAは最近、米国におけるがん関連死亡率の第3位の原因となる乳がんを上回り、2030年までに第2位の原因(肺癌の背後)になると予測されている。免疫学的に「コールド」PDA腫瘍微小環境(TME)の特徴の多くは、免疫抑制性骨髄細胞集団の高い浸潤を含む3、4、5、6、7、密な間質沈着8、10、11、およびT細胞5、12、13 -に寄与するPDA14における免疫療法の失敗。この目的のために、臨床的に関連する動物モデルの使用は、生体内の免疫学的に冷たい腫瘍に対する新規な薬物組み合わせの有効性を調査するために不可欠なツールである。
遺伝子組み換えクラスG12D+/-;Trp53R172H+/-;PDAのPdx-1 Cre(KPC)マウスモデルは、疾患および組織病理学的特徴の分子ドライバを含むヒトPDAの顕著な臨床的側面を忠実に再現する15。KPC腫瘍は、完全免疫能力マウスで自発的に発症し、臨床試験の設定でこれらの薬物を投与する前に、化学療法16、17、免疫療法18、19、20、およびストロマ標的療法9、11、22を含む治療アプローチの尋問を可能にする。PDAの前臨床モデルとしてのその多くの強みにもかかわらず、KPCマウスの使用は、腫瘍発症が4〜40週の範囲であり得る(したがって、大規模な繁殖コロニーの維持を必要とする)15として自発的腫瘍発達の非常に可変的な進行によって不利である。さらに、KPCマウスは、ポリクローナル原発腫瘍23の可能性を有し、疾患が進行するにつれて、動物の健康状態の急速な低下および共罹患率および共罹患率の増加がある。
自発的なKPCマウスモデルに代わる1つの選択肢は、PDA24のオルソトピック移植モデルを使用することです。天然組織部位への腫瘍細胞株の直接外科的移植は、PDAの組織特異的腫瘍微小環境(TME)を再現するより費用対効果が高く予測可能な方法である。腫瘍移植は、遺伝的に後ろに交差したマウス5にクローン腫瘍細胞株の注入を可能にし、KPCマウスモデルに繁殖するのに時間がかかる追加の遺伝子操作を有する宿主マウスを可能にする。しかしながら、膵腫瘍移植は、腹壁24、25、26の縫合部位に異常な炎症を導入する労働集約的な外科的処置を必要とし、多くの場合、長い術後回復27、28、29を含む。
げっ歯類特異的トランスデューサを用いた超音波イメージングの技術進歩により、高解像度の画像をリアルタイムで提供します。腹腔内の注射針運動の超音波イメージングによって導かれ、1つは特異的に外科的移植および関連する炎症の不在の直交トピック腫瘍注射の利点を利用して、膵臓に腫瘍細胞を移植することができる。このアプローチは、超音波誘導矯正局所腫瘍移植モデル(UG-OTIM)と呼ばれ、膵臓癌30の異種移植モデルおよびユーイング肉腫、神経芽細胞腫および膀胱癌31、32を含む他のいくつかの癌モデルにおいて既に確立されている。
ここでは、マウス膵臓に腫瘍細胞株の超音波誘導注射を行うための詳細なプロトコルを提供する。我々は、結果として得られた腫瘍がKPC TMEの組織学的および免疫学的特徴を再現することを示し、したがって、免疫療法を含む新しい治療の組み合わせを調査するために使用することができ、移動する最も有望な治療法を迅速に明らかにする臨床試験に進む。
プロトコル
動物プロトコルは、ペンシルベニア大学の動物ケアと使用委員会の機関によって審査され、承認されました.雌の5~6週齢のC57Bl/6マウスを購入し(材料表参照)、1〜3週間の休息後に使用した。大学の動物資源研究室は動物のケアを監督しました.
1. 注射のためのPDA腫瘍細胞株の調製
- 腫瘍細胞(TC)培地中でKPC由来PDA細胞株を増殖させる:ダルベッコの修飾イーグル培地(DMEM)を10%胎児ウシ血清(FBS)、2mM Lグルタミンおよび83μg/mLゲンタマイシンを添加した。
- 細胞が37°Cおよび5%CO2で維持されるフラスコで80-85%の合流性に成長することを可能にする。
- 細胞が理想的な結合に達したら、フラスコから媒体をデカントし、温かい(37°C)、無菌リン酸緩衝生理食塩分(PBS)で2回洗浄し、付着細胞の単層を覆うのに十分です。最終洗浄後の残りのPBSのピペット。
- 温かい(37°C)0.05%トリプシンEDTA溶液(ハンクスベースの酵素フリー細胞解離バッファーで1:10希釈した0.5%ストックトリプシンEDTA希釈)を加え、各フラスコのモノレイヤーをカバーし、3〜5分間、または細胞が側面をタップして切り離されるまでインキュベートします。フラスコ。
- 10-25mLのコールド(4°C)を各フラスコに添加し、トリプシン化反応を停止します。50mL円錐形に細胞懸濁液を注ぎ、冷たいTC媒体で50mLまで充填します。
- 4°Cで5分間300gで遠心分離機。低温、無菌DMEM(無血清)で上清を廃棄し、ペレットを再サスペンドします。複数の円錐管を使用して細胞を収集した場合、このステップですべてのペレットを単一の円錐形に組み合わせることができます。
- 4°で5分間300gで遠心分離機。
- 手順 1.6 ~ 1.7 を 2 回繰り返します。最後の洗浄では、カウントのための細胞のアリコートを取ります。生体内注射には≥90%の細胞生存率が推奨される。
- PDA腫瘍細胞の均一な懸濁液を所望の腫瘍細胞濃度で調製する。10-20 x 106セル/mL(250,000~500,000細胞/25μL)を適切な量の滅菌、低温DMEMまたはPBSで使用しましたが、各細胞株は生体内で滴定する必要があります。
- 細胞を冷たく、氷の上に置き、注射する準備ができるまで保ちます。
2. マウスの手術前の準備
注: この手順は、手順の 24 時間前に実行することをお勧めします。
- 実験用マウスを含むケージを37°Cに設定した暖かい場所に置きます。
- 新しい清潔なケージを入手し、37°Cに設定された第2の温暖化プラットフォームに配置します。
- 生物学的安全キャビネット、誘導室、超音波(米国)段階を滅菌剤で徹底的に洗浄します(材料表を参照)。
- 米国段階の温暖化機能を37°Cに変えます。
- 麻酔機をオンにする:チューブスプリッタのダイヤルを調整して、気流が誘導室のみに制限されるようにします。酸素タンクをオンにし、流量を1 L/分に設定します。
- 誘導室にマウスを1本置きます。もはや移動し、呼吸が遅くなるまでマウスを監視します。
- スプリッタのダイヤルを調整して、誘導チャンバとノーズコーンの両方にエアーフローが許可されるようにします。誘導室から素早くマウスを移動し、鼻コーンに銃口で暖かい米国のステージ上の腹の残り液に置きます。
- つま先のつまみに対する反射的な応答を観察して、誘導のレベルをテストします。何もない場合、マウスは脱毛の準備ができています。
- 組織の脱水を防ぐために、両眼に少量の眼潤滑剤(材料表参照)を置きます。マウスを回して、ステージ上の背の高い円切りに置くようにします。腹部の露出を最大化し、ステージにマウスを固定するために、紙テープでステージに上下の四肢を穏やかに付着します。
- 無菌綿先端アプリケーターを使用して、腹部の左上の象限に寛大な層脱毛クリームを塗布します。脱毛は脾臓の一般的な領域に適用され、中間線に向かって延びる必要があります。約1分間座って許可します。
- 綿の先端アプリケーターの反対側の端を使用して脱毛クリームを拭き取り、簡単に取り除いたら、ドライガーゼパッドで腹部をきれいに拭いて、脱毛の程度をテストします。その後、少量の温かい生理脱毛でガーゼのきれいな層を濡らし、もう一度領域を拭いて脱毛剤を完全に除去します。化学的な火傷の可能性を減らすために、マウスの皮膚に直接接触する2分を超えないでください。
- 髪が腹部から十分に取り除かれたら、暖かい新しい清潔なケージにマウスを戻します。
- 最初の動物が米国のステージで脱毛を受けている間、次の動物は誘導室に加えることができる。
- マウスの次のケージを麻酔する前に、アイソフルランをオフにし、誘導室を酸素で洗い流します。滅菌剤で誘導室と米国のステージ/ノーズコーンをきれいにします。すべてのケージとマウスが脱毛するまで、手順2.5-2.14を繰り返します。
注:移植前の一定期間の食物の一時的な撤退による動物の断食は、胃および腸内の未消化食物による腹部器官の視覚閉塞を最小限に抑えると考えることができる(12〜24時間)。水の制限はお勧めしません。動物が絶食されている場合は、脱水を防ぐために、1mL温かい(37°C)の注射で治療し、腫瘍注射後に無菌生理食塩分を治療することをお勧めします。
3. PDA細胞の超音波誘導移植
注:すべての超音波手順は、超音波イメージングマシンとソフトウェアを使用して行われます(材料表を参照)。トランスデューサの中心周波数は40MHz、帯域幅は22~55MHzです。
- プラットフォーム表面が床に平行で、研究者が動物の頭を右にして動物の左側を向くように超音波プラットフォームを調整します。横断腹部画像が得られるようにトランスデューサの位置を調整します(図1A)。
- ステップ2.1~2.8の説明に従って、注入するマウスを麻酔する。手順 2.9 の説明に従って、米国プラットフォームでマウスを安定させます。
- 腹部の無毛のセクションに暖かい(37°C)超音波ゲルの寛大な量を適用します。
- トランスデューサをそっと下げてマウスの腹部に接触します。膵臓がはっきりと見えるまで、必要に応じてトランスデューサを調整します。腹腔の正確な向きを提供するために、左の腎臓と脾臓を見つけます。
メモ:トランスデューサの位置が変更され、腹部の左側にアクセスできるようになったため、ステージコントロールのX軸とY軸が反転するようになりました。 - 29G x 1/2" インスリン注射器(25μLの腫瘍細胞懸濁液を含む物質表参照)をロードします。腹壁の腫瘍細胞の播種を最小限に抑えるために、注射の前に無菌アルコール準備パッドで針先を拭きます。
- 鈍いエッジ鉗子を使用して、皮膚および腹壁をつかみ、所望の注射部位の張力を高める。超音波プラットフォーム表面に約25°-45°の角度で注射器を保持し、ゆっくりと皮膚と腹壁を介して針を進めます。次のステップに進む前に、針が腹壁を穿刺したことを確認します。針が腹壁を突き刺すように小さなポップを感じる必要があります。
- 超音波可視化の下で、針を膵臓に直接導く(図1B-C)。注射器のバレルをゆっくりと上下に動かして、針が膵臓組織内にあるかどうかを確認します。配置が正しい場合、注射器バレルが動いている間、針の先端は膵臓組織内に残ります。
- 腫瘍細胞をゆっくりと注入し、膵臓内の流体ボーラスの形成によって細胞が所望の位置に移植されていることを確認する(超音波スクリーンに見える、図1D)。
注:いくつかの抵抗は、プランジャーを落ち込ませている間に感じるべきです。膵臓を複数回突き刺すので、腹腔への漏出の可能性が高くなるので注意してください。 - 懸濁液の全容積が注入され、膵臓に液体ボーラスが見えたら、針を数秒間非常に静かに保ちます。ゆっくりとマウスの腹部から針を引き込み、注射された細胞を邪魔しないように細心の注意を払う。
- 清潔で暖かいケージにマウスを置き、マウスが麻酔から完全に回復することを確認します。すべての動物に対してこのプロセスを繰り返します。
- 次のマウスを麻酔する前に、誘導室と米国のステージ/ノーズコーンを滅菌剤で洗浄してください。
- すべてのマウスが注射されるまで、手順3.2~3.11を繰り返します。
結果
この報告書の目的は、KPC由来PDA細胞株の超音波誘導移植を行うための詳細なプロトコルを提供することにあった。図2-4に示す代表的な実験では、UG-OTIM腫瘍が一貫した速度で、用量依存的に増殖することを確認した。さらに、UG-OTIM腫瘍がKPC TMEの顕著な免疫学的および組織学的特徴を再現することを示す。従って、UG-OTIMシステムは、生体内で新しい治療の組み合わせを迅速にスクリーニングするために高スループットの方法で使用することができる前臨床PDAマウスモデルである。
ここで概説したUG-OTIMプロトコルを用いて、マウスを移植用に調製し、加熱された超音波プラットフォームに固定し、プラットフォームとトランスデューサの両方の位置を、図1Aに示すようにこの手順に合わせて調整した。高解像度超音波イメージングは、腎臓または脾臓の穿極なしに標的とすることができるマウス膵臓内の注射部位を同定するために使用された(図1B)。超音波可視化の下で、針は腹膜壁を通して腹腔に慎重に導入され、マウス膵臓に導かれました(図1C)。針の正しい配置が確立された後、腫瘍細胞懸濁液を非常にゆっくりと膵臓に注入した。膵臓内の気泡の存在によって移植が成功したことが確認された(図1D)。初期の実験では、マウスを犠牲にし、膵臓の総体組織中の流体ボーラスを直接可視化して処置の有効性を検証した(図1E)。
腫瘍移植および増殖速度は、毎週の超音波イメージングによって監視された。移植に成功した腫瘍は、実験の時間を通して膵臓の境界内に含まれていた腫瘍を産生した(図2A)。超音波ソフトウェア(図2C)は、各時点で腫瘍領域と体積を決定するために使用される、ならびに生成される測定された腫瘍の3Dマッピングのために使用される(図2B)、および3D画像がマウスのネクロプシーの時点で確認された(図2C)。UG-OTIM処置中の不適切な細胞注射は、腹壁腫瘍の発症をもたらす可能性がある(図2Dに示されている代表的な画像)。腹腹腫瘍を有するマウスは、さらなる研究から除外することができる。
前臨床試験での使用に最適な細胞濃度を決定するために、C57Bl/6 KPC由来PDA細胞株(4662)9を6つの独立した実験にわたって素朴な野生型C57Bl/6マウスに注入した。この細胞株(インビトロで6回通過)は、完全に裏十字型KPC腫瘍軸受マウス(>10世代、SNP解析19により確認された)に由来し、分子細胞適合複合体不一致腫瘍拒絶抗原を防止した。腫瘍細胞を低いチッタ(1.25 x 106細胞/25μL)および高いチッター(5 x 106細胞/25μL)用量で注射した。高いタター腫瘍注射は、低いタイヤーコホートと比較して注射の3週間後に腫瘍を有する動物のより大きな割合をもたらした(図3A)。腫瘍発症の遅延にもかかわらず、全体的な腫瘍増殖速度は2回の用量間で有意に異なっていなかった(図3B)。同様に、2つのコホート間の生存率は有意に異なっていなかったが、低力子コホートにおける生存率がわずかに改善されるデータ傾向(図3C)。高い観度コホートはまた、低いチッターコホートよりも4週間の後注射によって前臨床研究に登録可能な腫瘍を有するマウスのより大きな割合を産生した(図3D)。高いおよび低いタイヤーコホートの両方からのマウスの大半は、25日目までに登録可能な腫瘍を提示し、腹水を含む末期疾患症状を発症した(データは示されていない)。転移は、このプロトコルからの細胞用量で4662を使用して起こらないが、異なる細胞株または用量33でモデル化され得る。
UG-OTIM法は、私たちの初期の実験で困難だった所望の注射部位を正確に局在させるために、細かい運動能力の習得を必要としました。このため、膵臓内で腫瘍を発症した動物の数(移植成功)を、超音波誘導腫瘍移植を受けた動物の総数と比較した表を含めた(表1)。動物は、腫瘍が望ましくない場所(すなわち、腎臓)で発達した場合、または示されているように、注射後6週間までに腫瘍の証拠がなかった場合、将来の分析から排除された。各実験からの登録可能な膵腫瘍(≥20mm3腫瘍容積)を有するマウスの割合の毎週の進行を表1に示す。
従来の外科的オルソトピックモデルではなくUG-OTIMアプローチを使用する利点があるかどうかを判断するために(技術に熟達した後の時間投資を超えて)、各処置後のマウスの腹壁におけるPDA腫瘍の播種を比較した。2/31マウス(6.5%)UG-OTIM注射後に意図しない腹壁腫瘍を発症し、外科的注射後に腹壁腫瘍を発症した7/15マウスと比較した(46.6%, p< 0.0029) (表1)。従って、腹腹隔における追加の腫瘍の播種速度は、外科的移植と比較してUG-OTIM法において大幅に減少する。
UG-OTIM腫瘍を有するマウスを犠牲にした結果、腫瘍の総解剖学は自発的なKPC腫瘍に類似していることがわかった(図4A)。組織学的解析は、両方のモデルで類似した異常な管構造のパターンを実証し、ヒト疾患の形態を再現した(図4B)。KPCおよびUG-OTIM腫瘍の両方における免疫浸潤を調べるために、代表的な組織学的サンプルをCD3(T細胞で表す)およびF4/80(マクロファージで表される)に染色した。どちらのモデルでも、染色パターンはT細胞に浸透しにくい腫瘍を明らかにした(図4C)がマクロファージによって高く浸潤した(図4D)。この知見は、ほとんどのヒトおよびKPC PDAサンプル5、7、12の免疫学的に冷たい表現型と一致する。
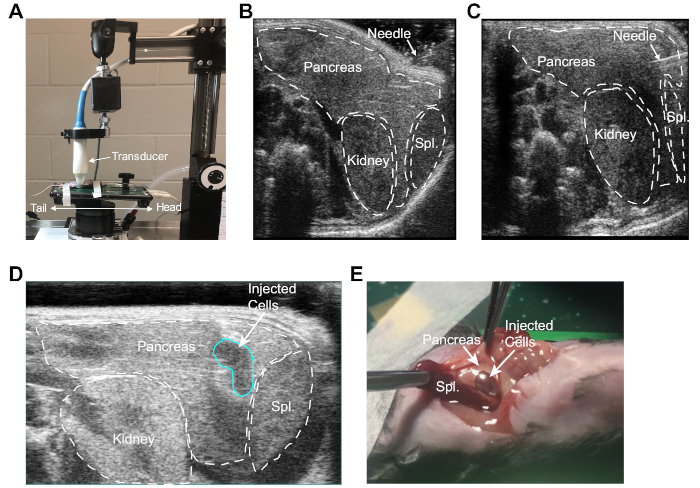
図1:マウス膵臓へのPDA細胞の超音波誘導移植(A)腹部器官の高解像度画像を得るために用いられるマウス、超音波段階、超音波プローブの向き。ステージとプラットフォームは、マウス腹部の左上の象限に簡単にアクセスできるように、標準方向から90°回転しています。(B)腎臓、脾臓および膵臓の同定を表す超音波画像。ここで注射針はマウス腹部に対して配置される。(C)マウス膵臓内の針を描いた超音波画像。(D)膵臓への腫瘍細胞の制御注射後の注射部位(青色で概説)における気泡を示す超音波画像。(E)超音波誘導注射後に膵臓にPDA細胞を含む流体ボーラスを明らかにする開腹術。この図の大きなバージョンを表示するには、ここをクリックしてください。
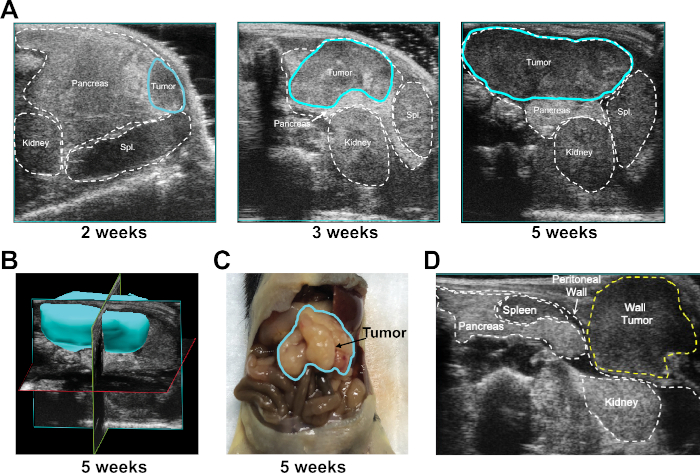
図2:UG-OTIM注射後の腫瘍増殖のモニタリング(A)示されているように、2、3、および5週間の注射後におけるUG-OTIM腫瘍(青色で概説)の代表的な超音波画像。(B)代表的な超音波ソフトウェアを用いて5週間後のUG-OTIM腫瘍の3D画像を再構築した。(C)UG-OTIM腫瘍の代表的な総解剖学は、マウス壊死時の5週間後注射後である。(D)7週間後の不適切な細胞注射後に皮下層に増殖する腹膜壁腫瘍の代表的な超音波画像。この図の大きなバージョンを表示するには、ここをクリックしてください。
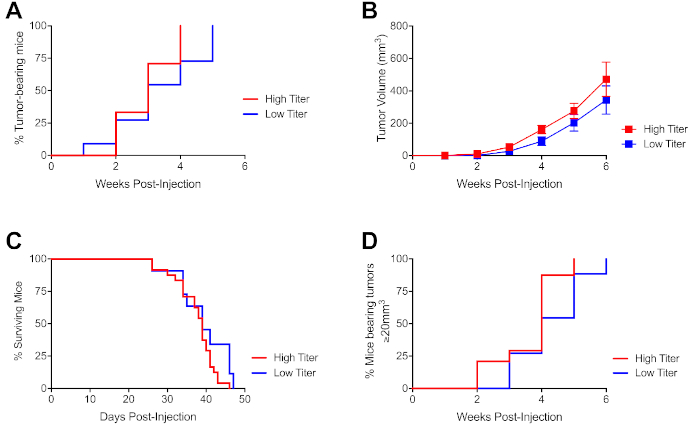
図3:PDA細胞の超音波誘導注射後の登録可能な腫瘍の用量依存性発症。(A)高いチッター(500,000細胞/25μL)または低チッター(125,000細胞/25μL)腫瘍細胞を有する図1に記載されているように、注射後に示された時点での腫瘍耐性マウスの割合は、示すように。(B)(A)からマウスの腫瘍増殖動態は、各記号がマウスの群を表し、誤差棒は、注射後に示された時点で生きている(A)から生きているマウスのSEM.(C)を示す。マウスは、腫瘍が>1000mm3であったり、腫瘍の併用のために身体の状態が悪かった場合に安楽死または検閲された。(D) (A) からマウスの腫瘍発症を登録する時間 。登録可能な腫瘍は体積で≥20mm3であると考えられている。n=8-20マウス/実験を用いた4つの独立した実験を代表するデータ。この図の大きなバージョンを表示するには、ここをクリックしてください。
| 実験 | 膵腫瘍軸受/総注射 | 第1週(登録可能) | 第2週(登録可能) | 第3週(登録可能) | 第4週(登録可能) | 播種腹腹腫瘍 |
| ハイ・ティター | 24/31 | Nd | 8/24 (3/24) | 15/24 (7/24) | 23/23 (20/23) | 2/20 |
| ロー・ティター | 11/17 | Nd | 3/11 (0/11) | 6/11 (3/11) | 9/11 (5/11) | 0/11 |
| 外科注射 | 15/17 | Nd | Nd | 15/15 (9/15) | 15/15 (14/15) | 7/15 |
表1:手術用移植と比較したUG-OTIM腫瘍の成功数高力または低力度当たりの2〜4個の独立した実験と、実験あたりn=5〜10マウスを組み合わせたデータ。「外科的注射」は、125,000個の腫瘍細胞の腹部腹腔鏡手術注射を受けたマウスを示す。「腫瘍軸受」は、膵腫瘍を有するマウスを示す。「登録可能」は、腫瘍体積>20mm3を有する各時点における腫瘍耐性マウスの割合を示す。「播種腹膜腫瘍」は、腫瘍細胞注射から腹膜壁に腫瘍の併用播種を有していた腫瘍を有する腫瘍を有するマウスの総割合を示す。膵臓以外の組織に誤って提示された腫瘍を有するマウス(すなわち、腎臓)は、「腫瘍を有する」集団から除外された(ただし、全注入マウスに含まれる)。NDは、決定されていない。高い層と低いタター群を比較する腹壁の播種の頻度は、外科的移植と比較し、p < 0.0029マンホイットニー後試験による2テールT試験を介して。

図4:UG-OTIM腫瘍はKPC腫瘍微小環境を再現する。代表的な画像が表示されます。一番上の行、KPC腫瘍。下段、5週間後のUG-OTIM腫瘍。(A)壊死時に発興奮した腫瘍の総解剖学。(B)H&E (10X, bar=100μm) (C) CD3 (茶色) (10X, bar=100μm) のための免疫ヒストケミストリー染色。(D)F4/80(赤)およびDAPI(青)の免疫蛍光染色(4X、bar=500μm)。この図の大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここでは、オートキトン組織部位へのマウスPDA細胞株の直接移植に対する高分解能超音波検査の使用は、KPCおよび外科的正形外科モデルシステムの両方に代わる信頼性の高い代替手段であることを示す。UG-OTIMは、腫瘍診断および信頼できる腫瘍増殖動態に短い時間枠でPDAの免疫病理学的特徴を保持する生物学的に関連する腫瘍を産生する。したがって、超音波誘導注射は、直交移植PDA腫瘍を有するマウスの迅速な産生のための有用なツールとして機能し、臨床的に関連するモデルにおける治療的組み合わせの調査を可能にする。
超音波誘導注入は前臨床調査の標準的なモデルの上に重要な改善を提供する。第一に、この手順は、完全にC57BL/6の逆交差PDA細胞をマウス膵臓に直接移植することにより、自発的腫瘍の発症のためのKPCマウスの時間集約的なモニタリングを排除する。第二に、従来の外科的オルソトピック注射と同様に、UG-OTIMアプローチは、モノクローナル腫瘍細胞株および/または細胞株のex vivo操作の選択を含む、注入された細胞株を制御し、腫瘍細胞移植を受ける宿主を制御することを可能にする。第三に、この低侵襲技術は、生存手術の困難な労働を回避し、動物のための複雑な術後回復期間だけでなく、外科的創傷治癒からの炎症性信号をバイパスします。最後に、UG-OTIM腫瘍は、外科的移植と同様に、低T細胞浸潤および高マクロファージ浸潤を含むKPCマウスで観察されたTMEを要約する。したがって、UG-OTIMモデルは、自発的なKPCモデルにおける治療的調査を遅滞させる追加の合併症なしにKPC腫瘍の主要な特徴を保持する。
プロトコルの重要なステップの数は、この技術を成功させるために重要なステップです。この手順にはマウス超音波イメージングの専門知識が不可欠ですが、膵臓に細胞を正常に埋め込むために必要な手間は、独立して開発しなければならないスキルセットです。12時間の明暗サイクルのマウスの場合、動物を一晩断食すると、胃と腸が超音波によって膵臓、腎臓および脾臓の視界を遮断する可能性のある未消化食品を取り除くことができた。さらに、オルソトピック注射に使用される各細胞株は、さらなる実験の前に滴定され、増殖動態を理解し、転移電位33を決定する必要がある。注射中に、注射部位で皮膚をつまむために鉗子を使用すると、皮膚と腹壁の両方を穏やかに穿刺するために必要な緊張を作成しました。手順の重要なステップは、組織を穿刺したり、脾臓や腎臓などのオフターゲット部位を穿刺することなく、針を慎重に膵臓に導くためであった。流体ボーラスの確認は、適切な組織における腫瘍細胞注射が成功した最良の指標であった。注射後、液体のボーラスを妨げないように針をゆっくりと引き抜くべきである。DMEMまたはトリパンブルーのいずれかを使用した一連の試験注射は、この注射に必要な細かい運動能力の習得に役立つことがわかりました。
この手順のトラブルシューティングでは、プロトコルの成功に影響を与えるさまざまな要因を特定しました。試験実験では、私たちの最も頻繁なエラーは、このスキルの定期的な運動が熟練度を向上させることを示唆する初期の実験でより頻繁に発生した移植中に腎臓を穿穿見していました。さらに、トラブルシューティング段階でネクロプシーでの超音波と直接可視化の両方を介して腫瘍細胞注射後の流体ボーラスの存在を確認することで、成功した注入技術が改善されたことがわかりました。注射中に超音波によって気泡の形成が確認されない場合、注射器を完全に押し下げる前に針の位置を調整して、腫瘍細胞の残りのボーラスを放出することができる。また、注射が早すぎると、膵臓の腹腔に腫瘍細胞がこぼれたり、液体ボーラスが崩壊したりする可能性があることも観察した。一般に、これらの動物は、腫瘍4週間後の注射の証拠を示さなかったn=7動物を除いて膵腫瘍を開発し続けた。この結果は、私たちの最初の試みでのみ報告されました(そして、6/7動物は腫瘍細胞の低いタイヤーで注入されました)。疑わしい腫瘍細胞注射を有するマウス、または針の再配置を必要とするマウスは、膵臓の外側の腫瘍の発症を注意深く監視する必要があります。
超音波誘導法の最も重要な制限は、必要な器具の入手可能性と腫瘍移植に関連する技術的なスキルです。マウスは超音波プラットフォーム上で非滅的に注入され、注射器と針の先端が超音波ゲルを通過するので、手順は完全に無菌ではありません。これらの研究を開始して以来、合計8回の独立した実験でn=148マウスに感染の証拠は見られなかったが、この過程で感染剤が注射針を通して膵臓に入る可能性がある。そのため、可能な限り多くのプロトコルの側面(手袋、超音波表面、アイスボックスを含む)は、病原体への潜在的な暴露を減らすために消毒剤または70%エタノールでスプレーする必要があります。現在のプロトコルの追加の制限は、現在の希釈で4662細胞株を使用した転移の欠如であった。UG-OTIMシステムで使用される各細胞株は、望ましい成長率および転移電位33のために滴定されるべきである。最後に、現在のプロトコルは、単一細胞懸濁液中に腫瘍細胞を注入するための技術を確立しました。しかし、細胞外マトリックス基質の添加は、潜在的に腫瘍の確立を増強し、腫瘍細胞の漏出を防ぐために添加することができる(外科的移植モデル27、30、31、32で使用される)。したがって、UG-OTIMの制限の多くは、オルソトピック注射で使用されている細胞株の適切な試験で克服することができる。
要約すると、UG-OTIMモデルは、マウス膵臓に腫瘍細胞を組織指向注射する正確な方法である。この低侵襲の注入技術は処置時間を減らし、外科後の合併症を最小にし、注射の正確さを改善することによって調査官および動物の両方に利益を与える。UG-OTIM注射から生じる腫瘍は、自発的なKPC腫瘍の特徴的な免疫生物学的特徴を保持し、腫瘍発症に対する信頼できる時間を有し、および再現性の腫瘍増殖動態を有する。したがって、UG-OTIMモデルは、前臨床環境で治療の組み合わせを問い合わせ、最大の満たされていない臨床ニーズを持つ患者のための新しい治療法を明らかにするために、比較的高スループットの方法で使用することができます。
開示事項
著者は何の開示もない。
謝辞
著者らは、ロバート・フォンダーハイデ博士とフォンダーハイデ研究所の全メンバー、膵臓がんマウス病院の全メンバー、ペンシルベニア大学膵臓がん研究センターのベン・スタンガー博士、デヴォラ・デルマンに感謝したいと考えています。役に立つディスカッション。この研究は、パーカーがん免疫療法フェロー賞(KTB)とペンシルベニア大学膵臓がん研究センター(CC)からの資金提供を受けています。
資料
| Name | Company | Catalog Number | Comments |
| 50 mL Conicals | Thomas Scientific | 2602A26 | |
| Blunt edged forceps | Fine Science Tools | 11000-12 | |
| Cell Dissociation Buffer | Thermo-Fisher | 13151014 | |
| Cotton Tipped swabs | Thermo-Fisher | 19062614 | |
| Covidien Monoject 3/10mL, 29G X 1/2" | Thermo-Fisher | 8881600145 | |
| Depilatory Agent | Amazon | Nair Body Lotion | |
| DMEM | Thermo-Fisher | 10-566-016 | |
| FBS | Gemini Bio-oroducts | 100-106 | |
| Flask | Sigma-Aldrich | CLS430825 | |
| Forceps (blunt edge) | Fine Science Tools | 11000-12 | |
| Gauze | Fisher | 13-761-52 | |
| Gentamicin | Thermo-Fisher | 15750060 | |
| Induction Chamber | VetEquip | 941444 | |
| Isofluorane | Penn Vet Supply | VED1350 | |
| Isofluorane Vaporizer | VetEquip | 911103 | |
| L-glutamine | Thermo-Fisher | 25030081 | |
| Optixcare | MidWest Veterinary Supply | 052.50310.3 | |
| Paper Tape | Medline | MMM1530Z5 | |
| PBS | Thermo-Fisher | 14-190-250 | |
| Slide warmer | C&A Scientific | XH-2001 | |
| Sterilant (Clidox-S) | Fisher Scientific | NC0332382 (activator) NC9189926 (base) | Needs to be combined according to manufacturer's instructions |
| Sterile Alcohol prep pad | Covidien | 6818 | |
| Trypsin | Thermo-Fisher | 15090046 | |
| Ultrasound gel | Thermo-Fisher | 03-34-1LT | |
| Visualsonics Ultrasound Vevo 2100 | Visual Sonics | Vevo 2100 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Research. 74 (11), 2913-2921 (2014).
- Chao, T., Furth, E. E., Vonderheide, R. H. CXCR2-Dependent Accumulation of Tumor-Associated Neutrophils Regulates T-cell Immunity in Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 4 (11), 968-982 (2016).
- Steele, C. W., et al. CXCR2 Inhibition Profoundly Suppresses Metastases and Augments Immunotherapy in Pancreatic Ductal Adenocarcinoma. Cancer Cell. 29 (6), 832-845 (2016).
- Li, J., et al. Tumor Cell-Intrinsic Factors Underlie Heterogeneity of Immune Cell Infiltration and Response to Immunotherapy. Immunity. 49 (1), 178-193 (2018).
- Beatty, G. L., et al. Exclusion of T Cells From Pancreatic Carcinomas in Mice Is Regulated by Ly6C(low) F4/80(+) Extratumoral Macrophages. Gastroenterology. 149 (1), 201-210 (2015).
- Bayne, L. J., et al. Tumor-derived granulocyte-macrophage colony-stimulating factor regulates myeloid inflammation and T cell immunity in pancreatic cancer. Cancer Cell. 21 (6), 822-835 (2012).
- Beatty, G. L., et al. CD40 agonists alter tumor stroma and show efficacy against pancreatic carcinoma in mice and humans. Science. 331 (6024), 1612-1616 (2011).
- Lo, A., et al. Tumor-Promoting Desmoplasia Is Disrupted by Depleting FAP-Expressing Stromal Cells. Cancer Research. 75 (14), 2800-2810 (2015).
- Rhim, A. D., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer Cell. 25 (6), 735-747 (2014).
- Ozdemir, B. C., et al. Depletion of Carcinoma-Associated Fibroblasts and Fibrosis Induces Immunosuppression and Accelerates Pancreas Cancer with Reduced Survival. Cancer Cell. 28 (6), 831-833 (2015).
- Clark, C. E., et al. Dynamics of the immune reaction to pancreatic cancer from inception to invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Stromnes, I. M., Hulbert, A., Pierce, R. H., Greenberg, P. D., Hingorani, S. R. T-cell Localization, Activation, and Clonal Expansion in Human Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 5 (11), 978-991 (2017).
- Morrison, A. H., Byrne, K. T., Vonderheide, R. H. Immunotherapy and Prevention of Pancreatic Cancer. Trends in Cancer. 4 (6), 418-428 (2018).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Yip-Schneider, M. T., et al. Dimethylaminoparthenolide and gemcitabine: a survival study using a genetically engineered mouse model of pancreatic cancer. BMC Cancer. 13, 194 (2013).
- Frese, K. K., et al. Nab-Paclitaxel potentiates gemcitabine activity by reducing cytidine deaminase levels in a mouse model of pancreatic cancer. Cancer Discovery. 2 (3), 260-269 (2012).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. 28 (5), 638-652 (2015).
- Byrne, K. T., Vonderheide, R. H. CD40 Stimulation Obviates Innate Sensors and Drives T Cell Immunity in Cancer. Cell Reports. 15 (12), 2719-2732 (2016).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Keenan, B. P., et al. A Listeria vaccine and depletion of T-regulatory cells activate immunity against early stage pancreatic intraepithelial neoplasms and prolong survival of mice. Gastroenterology. 146 (7), 1784-1794 (2014).
- Jiang, H., et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nature Medicine. 22 (8), 851-860 (2016).
- Maddipati, R., Stanger, B. Z. Pancreatic Cancer Metastases Harbor Evidence of Polyclonality. Cancer Discovery. 5 (10), 1086-1097 (2015).
- Foster, D. S., Jones, R. E., Ransom, R. C., Longaker, M. T., Norton, J. A. The evolving relationship of wound healing and tumor stroma. Journal of Clinical Investigation Insight. 3 (18), (2018).
- Kasper, M., et al. Wounding enhances epidermal tumorigenesis by recruiting hair follicle keratinocytes. Proceedings of the National Academy of Sciences. 108 (10), (2010).
- Stuelten, C. H., et al. Acute Wounds Accelerate Tumorigenesis by a T Cell-Dependent Mechanism. Cancer Research. 68 (18), (2008).
- Qiu, W., Su, G. H. Development of orthotopic pancreatic tumor mouse models. Methods of Molecular Biology. 980, 215-223 (2013).
- Moreno, J. A., Sanchez, A., Hoffman, R. M., Nur, S., Lambros, M. P. Fluorescent Orthotopic Mouse Model of Pancreatic Cancer. Journal of Visualized Experiments. (115), (2016).
- Erstad, D. J., et al. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Disease Models and Mechanisms. 11 (7), (2018).
- Huynh, A. S., et al. Development of an orthotopic human pancreatic cancer xenograft model using ultrasound-guided injection of cells. Public Library of Science One. 6 (5), e20330 (2011).
- Thomas, T. T., et al. Utilization of Ultrasound-guided Tissue-directed Cellular Implantation for the Establishment of Biologically Relevant Metastatic Tumor Xenografts. Journal of Visualized Experiments. (135), (2018).
- Jager, W., et al. Minimally invasive establishment of murine orthotopic bladder xenografts. Journal of Visualized Experiments. (84), e51123 (2014).
- Aiello, N. M., Rhim, A. D., Stanger, B. Z. . Orthotopic injection of pancreatic cancer cells. , (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved