Method Article
毛尿胰腺腺腺腺癌超声引导正射植入
摘要
我们描述了一种将鼠源胰腺腺腺腺腺腺癌细胞系直接植入原生肿瘤部位的超声引导植入方案。与手术正交植入相比,这种方法在注射后2-4周内通过超声波扫描检测胰腺肿瘤,显著降低了围肠壁上肿瘤细胞播种的比例。
摘要
最近,黑色素瘤和肺腺癌免疫检查点封锁的成功刺激了免疫肿瘤学领域,并揭示了当前治疗的局限性,因为大多数患者对免疫治疗没有反应。开发准确的临床前模型,以快速识别新颖有效的治疗组合,对于满足这一未满足的临床需求至关重要。胰腺导管腺癌(PDA)是免疫检查点阻断耐药肿瘤的规范例子,只有2%的患者对免疫治疗有反应。基因工程克拉斯G12D+/-;Trp53R172H+/-;PDA的Pdx-1 Cre(KPC)小鼠模型重述人类疾病,是评估临床前免疫治疗抗药性治疗的宝贵工具,但肿瘤发病时间变化很大。PDA的外科正交肿瘤植入模型保持KPC组织特异性肿瘤微环境(TME)的免疫生物学特征,但需要耗时的手术,并引入异常炎症。在这里,我们使用超声波引导的正交肿瘤植入模型(UG-OTIM)将非侵入性PdPc衍生的PDA细胞系直接注射到小鼠胰腺中。UG-OTIM肿瘤生长在内源性组织位点,忠实地重述PDA TME的组织特征,并在注射后四周内达到注册大小的肿瘤进行临床前研究,并在围肠壁上进行最少的播种。此处描述的 UG-OTIM 系统是一种快速且可重复的肿瘤模型,可用于对小鼠 PDA TME 中的新型治疗组合进行高通量分析。
引言
胰腺导管腺癌(PDA)是一种众所周知的侵略性疾病,对目前的治疗是难治的,5年生存率为9%。PDA最近超过乳腺癌,成为美国癌症相关死亡的第三大原因,预计到2030年将成为第二大病因(仅次于肺癌)。免疫学"冷"PDA肿瘤微环境(TME)的一些特征-包括免疫抑制骨髓细胞群的高渗透3,4,5,6,7,致密基质沉积8,9,10,11,以及缺乏T细胞5,12,13-贡献PDA14免疫疗法的失败。为此,使用临床相关动物模型是研究新药组合对体内免疫性感冒肿瘤疗效的重要工具。
基因工程克拉斯G12D+/-;Trp53R172H+/-;PDA的Pdx-1 Cre(KPC)小鼠模型忠实地概括了人类PDA的显著临床方面,包括疾病的分子驱动因素和组织病理学特征15。KPC肿瘤在完全免疫能力小鼠中自发发展,允许接受化疗方法,包括化疗16、17、免疫疗法18、19、20、21和在临床试验中给药前的频闪靶向治疗9、11、22。尽管KPC小鼠作为PDA的临床前模型有许多优势,但自然肿瘤发育的变数变化很大,因此其使用处于不利地位,因为肿瘤发病范围为4至40周(因此需要维持一个大型繁殖群)15。此外,KPC小鼠有多克隆原发性肿瘤23的潜力,并且动物健康迅速下降,随着疾病进展15,包括隐匿症和腹水在内的共病性增加。
自发KPC小鼠模型的一个替代方案是使用PDA24的正射体植入模型。将肿瘤细胞系直接手术植入原生组织部位是一种更具成本效益和可预测的方法,用于重述PDA的组织特异性肿瘤微环境(TME)。肿瘤植入允许向基因背交鼠5的克隆肿瘤细胞系注射,允许宿主小鼠进行额外的基因操作,这将非常耗时地繁殖到KPC小鼠模型。然而,胰腺肿瘤植入需要一个劳动密集型的外科手术,在腹壁24、25、26的缝合部位引入异常炎症,并且通常包括长时间的术后恢复27、28、29。
使用啮齿动物特异性传感器进行超声成像的技术进步可实时提供高分辨率图像。在围肠腔注射针运动的超声成像指导下,可以专门将肿瘤细胞植入胰腺,在无手术植入和相关炎症的情况下利用正交肿瘤注射的好处。这种方法,称为超声引导正交肿瘤植入模型(UG-OTIM)以前已经建立了在胰腺癌30的异种移植模型,以及其他几个癌症模型,包括尤因的肉瘤,神经母细胞瘤和膀胱癌31,32。
在这里,我们提供了一个详细的协议,用于在鼠胰腺中执行肿瘤细胞系的超声波引导注射。我们展示由此产生的肿瘤,重述KPC TME的组织学和免疫学特征,因此可用于研究新的治疗组合,包括免疫疗法,以迅速揭示最有前途的治疗方法移动推进临床试验。
研究方案
动物协议由宾夕法尼亚大学动物护理和使用委员会审查和批准。雌性5至6周大的C57Bl/6小鼠被购买(见材料表),并在1-3周休息后使用。大学实验室动物资源监督动物护理。
1. 注射用PDA肿瘤细胞系的制备
- 在肿瘤细胞(TC)培养基培养KPC衍生的PDA细胞系:Dulbeco的改性鹰培养基(DMEM)辅以10%胎儿牛血清(FBS)、2mML-谷氨酰胺和83μg/mL甘霉素。
- 使细胞在37°C和5%CO2的烧瓶中生长到80-85%的汇合。
- 一旦细胞达到理想的汇合,从烧瓶中去掉介质,用热(37°C)、无菌磷酸盐缓冲盐水(PBS)洗涤两次,足以覆盖粘附细胞的单层。最后洗涤后剩余的PBS的移液器。
- 加入温暖 (37°C) 0.05% 胰蛋白酶-EDTA 溶液(0.5% 库存胰蛋白酶-EDTA 稀释 1:10 在汉克斯的无酶细胞解离缓冲液中),以覆盖每个烧瓶中的单层,并在 37°C 孵育 3-5 分钟,或直到细胞分离,在汉克斯的无酶细胞分离缓冲液的两侧瓶。
- 在每个烧瓶中加入10-25mL的冷(4°C),无菌TC培养基,以阻止胰蛋白酶化反应。将细胞悬浮液倒入50mL锥形(s),用冷TC介质填充至50mL。
- 在300g下在4°C下离心5分钟。在冷、无菌的DMEM(无血清)中丢弃上清液并重新悬浮颗粒。如果使用多个锥形管来收集细胞,则在此步骤中,所有颗粒都可以组合成单个锥形。
- 在300g下离心5分钟,4°。
- 重复步骤 1.6-1.7 两次。在最后洗涤中,取一个等分的细胞进行计数。建议在体内注射时细胞活力为±90%。
- 在肿瘤细胞所需的浓度下,制备PDA肿瘤细胞的统一悬浮液。我们使用10-20 x 106细胞/mL(250,000至500,000细胞/25μL)在适量的无菌,冷DMEM或PBS,但每个细胞系应在体内打中。
- 保持细胞冷,在冰上,直到准备注射。
2. 小鼠手术前制备
注: 建议在手术前 24 小时执行此步骤。
- 将装有实验鼠的笼子放在温度高达37°C的暖上。
- 获得新的、干净的笼子,并放置在设置为 37°C 的第二个加热平台上。
- 用消毒剂彻底清洁生物安全柜、感应室和超声波(美国)阶段(参见材料表)。
- 将美国阶段的加热功能调至 37°C。
- 打开麻醉机:调整分管分离器上的表盘,使气流仅限于感应室。打开氧气罐,将流量设置为 1 L/min。将非羟基蒸发器打开至 2-3%。
- 将一只鼠标放入感应室。监测鼠标,直到不再移动,呼吸减慢。
- 调整分路器上的刻度盘,以便允许气流同时进入感应室和鼻锥。快速将鼠标从感应室移出,并将其放在温暖的美国舞台上的腹腔中,其枪口位于鼻锥中。
- 通过观察对脚趾捏合的任何反射反应来测试感应水平。如果没有,鼠标已准备好脱毛。
- 在双眼上放置少量眼睛润滑剂(见材料表),以防止组织脱水。转动鼠标,使其在舞台上的背对质。用纸带轻轻将上肢和下肢粘附在舞台上,以最大限度地暴露腹部,并将鼠标固定到舞台上。
- 使用无菌棉尖施用器在腹部左上象限上涂抹一层宽厚的脱皮霜。脱毛应应用于脾脏的一般区域,并延伸到中线。允许坐约一分钟。
- 测试脱毛程度,使用棉尖施用器的另一端轻轻擦去脱毛霜,一旦它容易去除,用干纱布垫擦拭腹部清洁。然后用少量的暖盐水湿一层干净的纱布,再次擦拭区域,以完全去除脱毛剂。在小鼠皮肤上直接接触时间不要超过 2 分钟,以减少化学烧伤的机会。
- 一旦头发从腹部完全去除,将鼠标返回到温暖器上新的干净笼子。
- 当第一只动物在美国舞台上进行脱毛时,下一只动物可以添加到感应室。
- 在麻醉下一个笼子的老鼠之前,关闭胶合物,用氧气冲洗感应室。用消毒剂清洁感应室和美国舞台/鼻锥。重复步骤 2.5-2.14,直到所有笼子和小鼠都脱毛。
注:在植入前一段时间,通过暂时戒取食物来禁食动物可考虑尽量减少胃和肠道中未消化的食物造成的腹部器官视觉阻塞(12-24 小时)。不建议限水。如果动物禁食,建议在肿瘤注射后注射1mL暖(37°C),无菌盐水,以防止脱水。
3. PDA细胞的超声引导植入
注:所有超声程序均使用超声成像机和软件进行(见材料表)。传感器的中心频率为40 MHz,带宽为22-55 MHz。
- 调整超声波平台,使平台表面与地面平行,调查员面向动物的左侧,动物的头部向右。调整传感器位置,以便获得横向腹部图像(图1A)。
- 如步骤 2.1-2.8 中所述,对要注射的鼠标进行麻醉。如步骤 2.9 所述,稳定美国平台上的鼠标。
- 在腹部无毛部分涂抹大量热(37°C)超声凝胶。
- 轻轻降低传感器以接触小鼠腹部。根据需要调整传感器,直到胰腺清晰可见。找到左肾和脾脏,以便提供腹腔的精确方向。
注: 由于传感器位置已更改,允许进入腹部左侧,因此舞台控制装置上的 X 轴和 Y 轴现已反转。 - 加载29G x 1/2"胰岛素注射器(见材料表),肿瘤细胞悬浮液为25μL。注射前用无菌酒精准备垫擦拭针头,以尽量减少腹壁的肿瘤细胞播种。
- 使用钝边钳,抓住皮肤和围眼壁,以增加所需注射部位的张力。将注射器以大约 25°-45° 角与超声波平台表面保持,缓慢地将针头穿过皮肤和围层壁。确认针头已刺穿围网壁,然后再继续执行下一步。当针刺穿围网壁时,应该感觉到一个小的爆裂声。
- 在超声波可视化下,将针头直接引导到胰腺中(图1B-C)。通过轻轻地上下移动注射器筒,确认针头在胰腺组织内。如果放置正确,当注射器筒移动时,针头将留在胰腺组织内。
- 缓慢地注入肿瘤细胞,并通过在胰腺内形成液体团体来确认细胞被植入所需位置(在超声波屏幕上可见,图1D)。
注:在打压柱塞时,应感觉到一些阻力。小心不要多次刺穿胰腺,因为这增加了渗入腹腔的可能性。 - 一旦注射了全部的悬浮液,在胰腺中可以看到液体的bolus,保持针头静止几秒钟。慢慢从小鼠腹部缩回针头,注意不要干扰注射的细胞。
- 将鼠标放在干净、温暖的笼子里,确保小鼠从麻醉中完全恢复。对所有动物重复此过程。
- 在麻醉下一只小鼠之前,用消毒剂清洁感应室和美国舞台/鼻锥。
- 重复步骤 3.2-3.11,直到所有小鼠都注射过。
结果
本报告的目的是为KPC衍生的PDA细胞系进行超声波引导植入提供详细的方案。在图2-4所示的代表性实验中,我们确认UG-OTIM肿瘤以一致的速度和剂量依赖性的方式生长。此外,我们还表明UG-OTIM肿瘤概括了KPC TME的显著免疫学和组织学特征。因此,UG-OTIM系统是一种临床前PDA小鼠模型,可以以高通量的方式用于快速筛选体内新的治疗组合。
使用此处概述的 UG-OTIM 协议,小鼠为植入做好了准备,固定在加热的超声波平台上,并针对此程序调整了平台和传感器的位置,如图1A所示。高分辨率超声成像用于识别小鼠胰腺内的注射部位,该部位可以在不穿孔肾脏或脾脏的情况下瞄准(图1B)。在超声可视化下,针头通过腹壁小心地引入腹腔,并引导进入小鼠胰腺(图1C)。确定正确放置针头后,将肿瘤细胞悬浮液注射到胰腺中非常缓慢。胰腺内存在气泡,从而证实了成功植入(图1D)。在早期实验中,小鼠被牺牲,通过直接可视化整个胰腺组织中的液体博鲁斯来验证手术的功效(图1E)。
肿瘤植入和生长速度通过每周超声成像监测。成功的植入产生了肿瘤,在整个实验期间,肿瘤包含在胰腺的边界内(图2A)。超声波软件(见材料表)用于确定肿瘤区域和体积,每个时间点以及要生成的测量肿瘤的三维映射(图2B),并在小鼠尸体解剖时确认3D图像(图2C)。在UG-OTIM过程中,细胞注射不当可能导致围肠壁肿瘤的发展(图2D显示了其代表性图像)。存在围肠肿瘤的小鼠可以从进一步研究中排除。
为了确定临床前研究的最佳细胞浓度,在六个独立实验中将C57Bl/6 KPC衍生的PDA细胞系(4662)9注射到天真的野生型C57Bl/6小鼠体内。该细胞系(在体外通过六次)来自完全背交的KPC肿瘤携带小鼠(>10代,由SNP分析19确认),以防止分子组织相容性复合不匹配肿瘤排斥抗原。以低定位(1.25 x 106细胞/25μL)和高定位(5 x 106细胞/25μL)剂量注射肿瘤细胞。高针头肿瘤注射导致携带肿瘤的动物在注射三周后比低产头激素组(图3A)的比例更大。尽管肿瘤发病延迟,但两个剂量之间的肿瘤总生长率没有显著差异(图3B)。同样,虽然两个队列之间的存活率没有显著差异,但低度子组存活率略有改善的数据趋势(图3C)。高针组在注射后四周内,在临床前研究中(指定为±20mm3肿瘤体积)的有肿瘤的小鼠比例也高于低度定位组(图3D)。大多数来自高度和低度分组小鼠在第25天出现可登记肿瘤,并出现包括腹水在内的终末期疾病症状(未显示数据)。转移,不发生使用4662在细胞剂量从该协议,可以模拟不同的细胞系或剂量33。
UG-OTIM 方法需要掌握精细的运动技能,以准确定位所需的注射部位,这在我们最早的实验中具有挑战性。因此,我们包括一张表格,描绘了胰腺内出现肿瘤的动物数量(成功植入),与接受超声波引导肿瘤植入的动物总数相比(表1)。如果肿瘤在不需要的位置(即肾脏)发展,或者注射后六周内没有肿瘤的证据,则动物从未来的分析中被排除,如所示。表1所示,每个实验中携带可登记胰腺肿瘤(±20mm3肿瘤体积)的小鼠比例的每周进展。
为了确定使用UG-OTIM方法是否有益于传统的外科正交模型(在熟练掌握该技术后超过时间投资),我们比较了每次手术后小鼠围网中PDA肿瘤的播种情况。我们发现只有2/31的老鼠(6.5%)UG-OTIM注射后出现意外的围肠壁肿瘤,与手术注射后出现围肠壁肿瘤的7/15小鼠相比(46.6%,p<0.0029)(表1)。因此,与手术植入相比,UG-OTIM方法在围膜中植入其他肿瘤的速率大大降低。
在牺牲患有UG-OTIM肿瘤的小鼠时,我们发现肿瘤的总解剖结构类似于自发的KPC肿瘤(图4A)。组织学分析显示,两种模型都相似,并概括了人类疾病的形态(图4B)。为了调查KPC和UG-OTIM肿瘤中的免疫渗透,对CD3(由T细胞表示)和F4/80(由巨噬细胞表示)进行了有代表性组织学样本的染色。在这两种模型中,染色模式揭示了被T细胞严重渗透的肿瘤(图4C),但被巨噬细胞高度渗透(图4D)。这一发现与大多数人类和KPC PDA样本5、7、12的免疫性感冒表型一致。
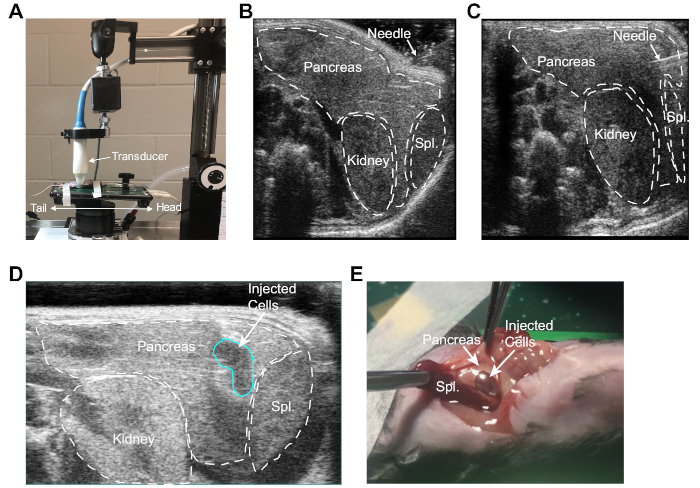
图1:PDA细胞超声引导植入鼠胰腺。(A) 用于获取腹部器官高分辨率图像的小鼠定向、超声阶段和超声波探针。请注意,舞台和平台从标准方向旋转 90°,以便轻松访问小鼠腹部的左上象限。(B) 超声图像,描绘肾脏、脾脏和胰腺的识别。在这里,注射针位于小鼠腹部。(C) 描绘小鼠胰腺内针的超声图像。(D) 在将肿瘤细胞控制注射到胰腺后,描绘注射部位气泡的超声图像(以蓝色表示)。(E) 在超声波引导注射后,腹腔切除术揭示胰腺中含有PDA细胞的液体博鲁斯。请点击此处查看此图的较大版本。
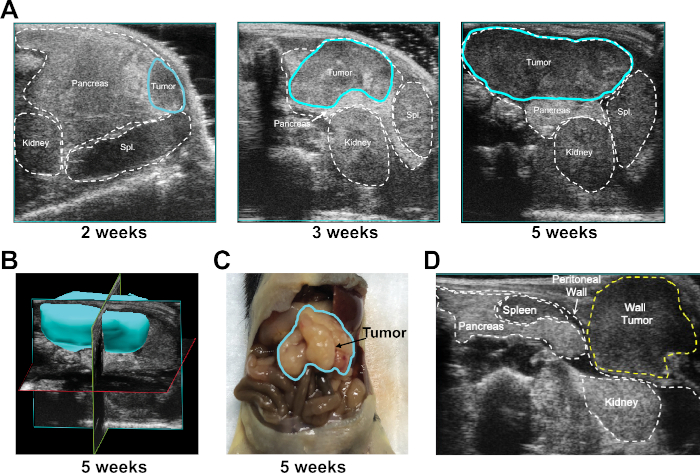
图2:监测UG-OTIM注射后的肿瘤生长。(A) 如所示,UG-OTIM 肿瘤的代表性超声像(以蓝色表示)在注射后 2、3 和 5 周。(B) 使用超声波软件在注射后5周内重建UG-OTIM肿瘤的3D图像。(C) UG-OTIM肿瘤的代表性总解剖在小鼠尸体解剖后5周注射。(D) 注射后7周细胞注射不当后,在皮下层生长的围肠壁肿瘤的代表性超声图像。请点击此处查看此图的较大版本。
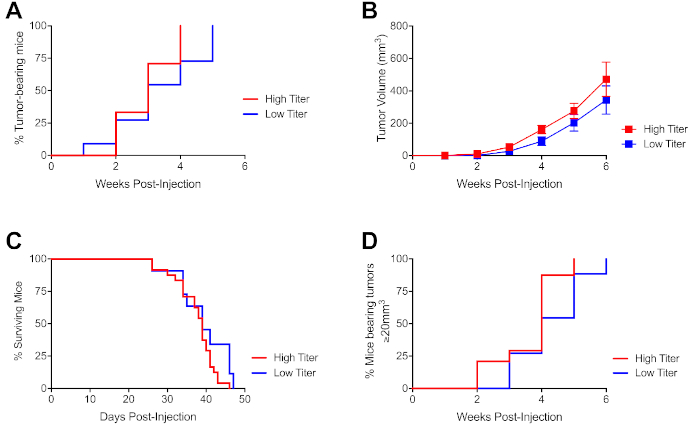
图3:PDA细胞超声引导注射后可登记肿瘤的剂量依赖性发病。(A) 如图1所示,在注射后指示时间点具有高定度(500,000细胞/25μL)或低定度(125,000细胞/25μL)肿瘤细胞的肿瘤小鼠的比例,如图所示。(B) 来自 (A) 的小鼠的肿瘤生长动力学,每个符号代表一组小鼠,误差条表示 SEM.(C) 注射后在指示时间点存活的小鼠比例。如果肿瘤为>1000mm3或由于肿瘤合并症而身体状况不佳,则对小鼠进行安乐死或审查。(D) 从 (A. ) 小鼠可登记肿瘤发病的时间可登记肿瘤的体积为±20mm3。n=8-20小鼠/实验的4个独立实验的数据代表。请点击此处查看此图的较大版本。
| 实验 | 胰腺肿瘤轴承/总注射 | 第 1 周(可注册) | 第 2 周(可注册) | 第3周(可注册) | 第4周(可注册) | 种子围肠肿瘤 |
| 高蒂特 | 24/31 | ND | 8/24 (3/24) | 15/24 (7/24) | 23/23 (20/23) | 2/20 |
| 低蒂特 | 11/17 | ND | 3/11 (0/11) | 6/11 (3/11) | 9/11 (5/11) | 0/11 |
| 手术注射 | 15/17 | ND | ND | 15/15 (9/15) | 15/15 (14/15) | 7/15 |
表1:与手术植入相比,UG-OTIM肿瘤成功数量。数据组合从2-4独立实验每个高或低点子条件与n=5-10小鼠每个实验。"手术注射"表示接受腹部腹腔镜手术注射的小鼠12.5万个肿瘤细胞。"肿瘤携带"表示患有胰腺肿瘤的小鼠。"可登记"表示每个时间点有肿瘤体积 >20mm3的肿瘤小鼠的比例。"种子性围肠肿瘤"表示肿瘤细胞注射后,在围肠壁上同时播种肿瘤的肿瘤小鼠的总比例。在胰腺(即肾脏)以外的组织中出现肿瘤的小鼠被排除在"肿瘤携带"群体(但包括在总注射小鼠中)。ND,未确定。通过2尾T测试与曼-惠特尼后测试,将高和低皮托组与手术植入进行比较的围网墙播种频率。p < 0.0029。

图4:UG-OTIM肿瘤重述KPC肿瘤微环境。将显示具有代表性的图像。顶行,KPC 肿瘤。下排,UG-OTIM肿瘤在植入后5周。(A) 尸体解剖时切除肿瘤的总解剖结构.(B) H&E (10X, bar=100μm) (C) CD3 (棕色) (10X, bar=100μm) 的免疫组织化学染色。(D) F4/80 (红色) 和 DAPI (蓝色) (4X, bar=500μm) 的免疫荧光染色。请点击此处查看此图的较大版本。
讨论
我们在这里表明,使用高分辨率超声造影将鼠PDA细胞系直接植入自体组织部位是KPC和外科正交模型系统的可靠替代方案。UG-OTIM产生与生物相关的肿瘤,保留PDA的免疫病理特征,缩短肿瘤诊断和可靠的肿瘤生长动力学的时间框架。因此,超声波引导注射可以作为快速生产携带正位植入PDA肿瘤的小鼠的有用工具,允许在临床相关模型中研究治疗组合。
超声引导植入比临床前调查的标准模型有重要的改进。首先,通过直接将完全C57BL/6背交的PDA细胞植入小鼠胰腺中,消除了对KPC小鼠发育自发肿瘤的长时间监测。其次,与传统外科正交注射类似,UG-OTIM方法允许控制注射的细胞系,包括选择单克隆肿瘤细胞系和/或细胞系的体外操作,以及控制接收肿瘤细胞植入的宿主。第三,这种微创技术避免了生存手术的繁琐劳动,绕过了动物复杂的术后恢复期以及手术伤口愈合产生的炎症信号。最后,UG-OTIM肿瘤-类似于手术植入-重述在KPC小鼠中观察到的TME,包括低T细胞渗透和高巨噬细胞渗透。因此,UG-OTIM 模型保留了 KPC 肿瘤的关键特征,没有额外的并发症,从而延缓自发 KPC 模型中的治疗研究。
协议中的一些关键步骤是掌握该技术成功的关键。鼠超声成像方面的专业知识对于此过程至关重要,但成功将细胞植入胰腺所需的手动灵巧性是必须独立开发的一套技能。对于12小时光明/黑暗周期的小鼠,在动物身上禁食一夜,确保胃和肠被清除任何未消化的食物,这些食物可以通过超声波阻断胰腺、肾脏和脾脏的观察。此外,用于正交注射的每个细胞系应在进一步实验之前进行定子,以了解生长动力学并确定转移电位33。在注射过程中,使用钳子在注射部位捏合皮肤,造成皮肤和围肠壁轻轻穿刺所需的张力。手术的一个关键步骤是小心地引导针头进入胰腺,而不穿孔组织或刺穿离目标部位,如脾脏或肾脏。确认液体血球是正确组织中肿瘤细胞注射成功的最佳指标。注射后,针头应慢慢拔出,以免干扰液体。我们发现,使用DMEM或Trypan Blue的一系列试验性注射有助于掌握这种注射所需的精细运动技能。
在此过程的故障排除过程中,我们确定了影响协议成功的许多因素。在试验实验中,我们最常见的错误是在植入过程中穿孔肾脏,这在早期实验中更为频繁,表明经常练习这种技能可以提高熟练程度。此外,我们发现,通过超声和直接可视化在故障排除阶段在诊断阶段确认肿瘤细胞注射后存在液体血性血球,改进了成功的注射技术。如果在注射过程中没有超声波确认气泡的形成,可以在完全压压注射器以释放肿瘤细胞的剩余栓塞之前调整针头的位置。我们还观察到,注入过快的悬浮量导致肿瘤细胞溢出到围室或胰腺中液体胸腔崩溃。一般来说,这些动物继续发展胰腺肿瘤,除了n+7动物,没有显示肿瘤的证据4周后注射。这一结果仅在我们第一次尝试时报告(6/7只动物被注射了低酸量的肿瘤细胞)。有可疑的肿瘤细胞注射,或需要重新定位针头的小鼠,应密切监测胰腺外肿瘤的发展。
超声引导方法的首要限制是所需仪器的可用性以及与肿瘤植入相关的技术技能。该过程并非完全无菌,因为小鼠在超声波平台上不无菌地被注射,注射器和针头通过超声波凝胶。尽管自发起这些研究以来,在总共8个独立实验中,我们没有看到任何148只小鼠感染的证据,但在这个过程中,传染性病原体有可能通过注射针进入胰腺。因此,协议的许多方面(包括手套、超声波表面、冰盒)应喷洒消毒剂或70%乙醇,以减少对病原体的潜在接触。当前协议的一个附加限制是,在当前稀释时,使用4662细胞系缺乏转移。UG-OTIM系统中使用的每个细胞系都应针对所需的生长速率以及转移电位33进行定子。最后,我们目前的协议建立了在单细胞悬浮液中注射肿瘤细胞的技术。然而,可以添加细胞外基质基质,以潜在地加强肿瘤建立和防止肿瘤细胞泄漏(因为它用于手术植入模型27,30,31,32)。因此,UG-OTIM的许多局限性可以通过对正交注射中使用的细胞系进行适当测试来克服。
总之,UG-OTIM模型是将肿瘤细胞组织定向注射到鼠胰腺的精确方法。这种微创植入技术通过缩短手术时间、最大限度地减少手术后并发症和提高注射精度,对研究者和动物都有好处。UG-OTIM注射引起的肿瘤保留了自发性KPC肿瘤的免疫生物学特性,对肿瘤发病有可靠的时间,并且可重复肿瘤生长动力学。因此,UG-OTIM 模型可以以相对较高的通量方式用于在临床前环境中询问治疗组合,以揭示针对临床需求最大未满足的患者的新疗法。
披露声明
作者没有披露。
致谢
作者要感谢罗伯特·冯德海德博士和冯德海德实验室的所有成员,胰腺癌小鼠医院的所有成员,宾夕法尼亚大学胰腺癌研究中心的本·斯坦格博士和德沃拉·德尔曼有益的讨论。这项工作得到了帕克癌症免疫治疗研究员奖(KTB)和宾夕法尼亚大学胰腺癌研究中心(CC)的资助。
材料
| Name | Company | Catalog Number | Comments |
| 50 mL Conicals | Thomas Scientific | 2602A26 | |
| Blunt edged forceps | Fine Science Tools | 11000-12 | |
| Cell Dissociation Buffer | Thermo-Fisher | 13151014 | |
| Cotton Tipped swabs | Thermo-Fisher | 19062614 | |
| Covidien Monoject 3/10mL, 29G X 1/2" | Thermo-Fisher | 8881600145 | |
| Depilatory Agent | Amazon | Nair Body Lotion | |
| DMEM | Thermo-Fisher | 10-566-016 | |
| FBS | Gemini Bio-oroducts | 100-106 | |
| Flask | Sigma-Aldrich | CLS430825 | |
| Forceps (blunt edge) | Fine Science Tools | 11000-12 | |
| Gauze | Fisher | 13-761-52 | |
| Gentamicin | Thermo-Fisher | 15750060 | |
| Induction Chamber | VetEquip | 941444 | |
| Isofluorane | Penn Vet Supply | VED1350 | |
| Isofluorane Vaporizer | VetEquip | 911103 | |
| L-glutamine | Thermo-Fisher | 25030081 | |
| Optixcare | MidWest Veterinary Supply | 052.50310.3 | |
| Paper Tape | Medline | MMM1530Z5 | |
| PBS | Thermo-Fisher | 14-190-250 | |
| Slide warmer | C&A Scientific | XH-2001 | |
| Sterilant (Clidox-S) | Fisher Scientific | NC0332382 (activator) NC9189926 (base) | Needs to be combined according to manufacturer's instructions |
| Sterile Alcohol prep pad | Covidien | 6818 | |
| Trypsin | Thermo-Fisher | 15090046 | |
| Ultrasound gel | Thermo-Fisher | 03-34-1LT | |
| Visualsonics Ultrasound Vevo 2100 | Visual Sonics | Vevo 2100 |
参考文献
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Research. 74 (11), 2913-2921 (2014).
- Chao, T., Furth, E. E., Vonderheide, R. H. CXCR2-Dependent Accumulation of Tumor-Associated Neutrophils Regulates T-cell Immunity in Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 4 (11), 968-982 (2016).
- Steele, C. W., et al. CXCR2 Inhibition Profoundly Suppresses Metastases and Augments Immunotherapy in Pancreatic Ductal Adenocarcinoma. Cancer Cell. 29 (6), 832-845 (2016).
- Li, J., et al. Tumor Cell-Intrinsic Factors Underlie Heterogeneity of Immune Cell Infiltration and Response to Immunotherapy. Immunity. 49 (1), 178-193 (2018).
- Beatty, G. L., et al. Exclusion of T Cells From Pancreatic Carcinomas in Mice Is Regulated by Ly6C(low) F4/80(+) Extratumoral Macrophages. Gastroenterology. 149 (1), 201-210 (2015).
- Bayne, L. J., et al. Tumor-derived granulocyte-macrophage colony-stimulating factor regulates myeloid inflammation and T cell immunity in pancreatic cancer. Cancer Cell. 21 (6), 822-835 (2012).
- Beatty, G. L., et al. CD40 agonists alter tumor stroma and show efficacy against pancreatic carcinoma in mice and humans. Science. 331 (6024), 1612-1616 (2011).
- Lo, A., et al. Tumor-Promoting Desmoplasia Is Disrupted by Depleting FAP-Expressing Stromal Cells. Cancer Research. 75 (14), 2800-2810 (2015).
- Rhim, A. D., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer Cell. 25 (6), 735-747 (2014).
- Ozdemir, B. C., et al. Depletion of Carcinoma-Associated Fibroblasts and Fibrosis Induces Immunosuppression and Accelerates Pancreas Cancer with Reduced Survival. Cancer Cell. 28 (6), 831-833 (2015).
- Clark, C. E., et al. Dynamics of the immune reaction to pancreatic cancer from inception to invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Stromnes, I. M., Hulbert, A., Pierce, R. H., Greenberg, P. D., Hingorani, S. R. T-cell Localization, Activation, and Clonal Expansion in Human Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 5 (11), 978-991 (2017).
- Morrison, A. H., Byrne, K. T., Vonderheide, R. H. Immunotherapy and Prevention of Pancreatic Cancer. Trends in Cancer. 4 (6), 418-428 (2018).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Yip-Schneider, M. T., et al. Dimethylaminoparthenolide and gemcitabine: a survival study using a genetically engineered mouse model of pancreatic cancer. BMC Cancer. 13, 194 (2013).
- Frese, K. K., et al. Nab-Paclitaxel potentiates gemcitabine activity by reducing cytidine deaminase levels in a mouse model of pancreatic cancer. Cancer Discovery. 2 (3), 260-269 (2012).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. 28 (5), 638-652 (2015).
- Byrne, K. T., Vonderheide, R. H. CD40 Stimulation Obviates Innate Sensors and Drives T Cell Immunity in Cancer. Cell Reports. 15 (12), 2719-2732 (2016).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Keenan, B. P., et al. A Listeria vaccine and depletion of T-regulatory cells activate immunity against early stage pancreatic intraepithelial neoplasms and prolong survival of mice. Gastroenterology. 146 (7), 1784-1794 (2014).
- Jiang, H., et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nature Medicine. 22 (8), 851-860 (2016).
- Maddipati, R., Stanger, B. Z. Pancreatic Cancer Metastases Harbor Evidence of Polyclonality. Cancer Discovery. 5 (10), 1086-1097 (2015).
- Foster, D. S., Jones, R. E., Ransom, R. C., Longaker, M. T., Norton, J. A. The evolving relationship of wound healing and tumor stroma. Journal of Clinical Investigation Insight. 3 (18), (2018).
- Kasper, M., et al. Wounding enhances epidermal tumorigenesis by recruiting hair follicle keratinocytes. Proceedings of the National Academy of Sciences. 108 (10), (2010).
- Stuelten, C. H., et al. Acute Wounds Accelerate Tumorigenesis by a T Cell-Dependent Mechanism. Cancer Research. 68 (18), (2008).
- Qiu, W., Su, G. H. Development of orthotopic pancreatic tumor mouse models. Methods of Molecular Biology. 980, 215-223 (2013).
- Moreno, J. A., Sanchez, A., Hoffman, R. M., Nur, S., Lambros, M. P. Fluorescent Orthotopic Mouse Model of Pancreatic Cancer. Journal of Visualized Experiments. (115), (2016).
- Erstad, D. J., et al. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Disease Models and Mechanisms. 11 (7), (2018).
- Huynh, A. S., et al. Development of an orthotopic human pancreatic cancer xenograft model using ultrasound-guided injection of cells. Public Library of Science One. 6 (5), e20330 (2011).
- Thomas, T. T., et al. Utilization of Ultrasound-guided Tissue-directed Cellular Implantation for the Establishment of Biologically Relevant Metastatic Tumor Xenografts. Journal of Visualized Experiments. (135), (2018).
- Jager, W., et al. Minimally invasive establishment of murine orthotopic bladder xenografts. Journal of Visualized Experiments. (84), e51123 (2014).
- Aiello, N. M., Rhim, A. D., Stanger, B. Z. . Orthotopic injection of pancreatic cancer cells. , (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。