Method Article
Impianto ortotopico a ultrasuoni dell'adenocarcinoma dugalese Murine
In questo articolo
Riepilogo
Descriviamo un protocollo per l'impianto guidato ad ultrasuoni di linee cellulari adenocarcinoma pancreatiche derivate da murini direttamente nel sito tumorale nativo. Questo approccio ha portato a tumori pancreatici rilevabili dalla scansione a ultrasuoni entro 2-4 settimane dall'iniezione, e ha ridotto significativamente la proporzione di semina delle cellule tumorali sulla parete peritoneale rispetto all'impianto ortotopico chirurgico.
Abstract
Il recente successo del blocco del checkpoint immunitario nel melanoma e nell'adenocarcinoma polmonare ha galvanizzato il campo dell'immuno-oncologia e ha rivelato i limiti dei trattamenti attuali, poiché la maggior parte dei pazienti non risponde all'immunoterapia. Lo sviluppo di modelli preclinici accurati per identificare rapidamente nuove ed efficaci combinazioni terapeutiche sono fondamentali per rispondere a questa esigenza clinica non soddisfatta. L'adenocarcinoma duttale pancreatico (PDA) è un esempio canonico di un tumore resistente al blocco del checkpoint immunitario con solo il 2% dei pazienti che rispondono all'immunoterapia. Il KrasG12D Trp53R172H--; Il modello murino Pdx-1 Cre (KPC) della malattia umana del PDA riassume la malattia umana ed è uno strumento prezioso per valutare le terapie per la resistenza all'immunoterapia in ambiente preclinico, ma il tempo per l'insorgenza del tumore è altamente variabile. I modelli chirurgici di impianto del tumore ortotopico del PDA mantengono i segni immunobiologici del microambiente tumorale specifico del tessuto KPC (TME), ma richiedono una procedura che richiede molto tempo e introducono un'infiammazione aberrante. Qui, usiamo un modello di impianto del tumore ortotopico a ultrasuoni (UG-OTIM) per iniettare linee cellulari PDA derivate da KPC direttamente nel pancreas del topo. I tumori UG-OTIM crescono nel sito del tessuto endogeno, ricapitolando fedelmente le caratteristiche istologiche del PDA TME, e raggiungono i tumori di dimensioni identistive per studi preclinici di quattro settimane dopo l'iniezione con semina minima sulla parete peritoneale. Il sistema UG-OTIM qui descritto è un modello tumorale rapido e riproducibile che può consentire l'analisi ad alta produttività di nuove combinazioni terapeutiche nel murno PDA TME.
Introduzione
L'adenocarcinoma duttale pancreatico (PDA) è una malattia notoriamente aggressiva che è refrattaria rispetto ai trattamenti attuali, con un tasso di sopravvivenza a 5 anni triste del 9%1. PDA ha recentemente superato il cancro al seno per diventare la terza causa di mortalità legata al cancro negli Stati Uniti e si prevede che diventerà la seconda causa leader (dietro solo il cancro ai polmoni) entro il 20302. Una serie di caratteristiche caratteristiche del microambiente tumorale PDA (TME) immunologicamente 'freddo' - tra cui alta infiltrazione di popolazioni di cellule mieloidi immunosoppressive3,4,5,6,7, densa deposizione stronosa8,9,10,11, e una carenza di cellule T5,12,13- contribuire a l'incapacità delle immunoterapie nel PDA14. A tal fine, l'uso di un modello animale clinicamente rilevante è uno strumento essenziale per studiare l'efficacia di nuove combinazioni di farmaci per tumori immunologicamente freddi in vivo.
Il KrasG12D Trp53R172H--; Il modello murino Pdx-1 Cre (KPC) del PDA riassume fedelmente aspetti clinici salienti del PDA umano, compresi i fattori molecolari della malattia e le caratteristiche istopatologiche15. I tumori KPC si sviluppano spontaneamente in topi completamente competenti, consentendo l'interrogatorio di approcci terapeutici tra cui la chemioterapia16,17, immunoterapia18,19,20,20,e la terapia stroma-targeting9,11,22invivo prima della somministrazione di questi farmaci nell'ambiente di sperimentazione clinica. Nonostante i suoi molti punti di forza come modello preclinico di PDA, l'uso di topi KPC è svantaggiato dalla progressione altamente variabile dello sviluppo tumorale spontaneo come insorgenza del tumore può variare da 4 a 40 settimane (richiedendo quindi il mantenimento di una grande colonia riproduttiva)15. Inoltre, i topi KPC hanno il potenziale per i tumori primari policlonali23, e c'è un rapido declino nella salute animale e un aumento delle co-morbidità tra cui cachessia e ascite mentre la malattia progredisce15.
Un'alternativa al modello di mouse spontaneo KPC è quella di utilizzare un modello di impianto ortotopico di PDA24. L'impianto chirurgico diretto delle linee cellulari tumorali nel sito tissutale nativo è un metodo più economico e prevedibile per ricapitolare il microambiente tumorale specifico del tessuto (TME) del PDA. L'impianto tumorale consente l'iniezione di linee cellulari tumorali clonali a topi geneticamente arrancati5,consentendo ai topi ospiti con ulteriori manipolazioni genetiche che richiederebbero molto tempo per riprodursi nel modello murino KPC. Tuttavia, l'impianto del tumore pancreatico richiede una procedura chirurgica ad alta intensità di lavoro che introduce un'infiammazione aberrante nel sito di sutura nella parete addominale24,25,26, e spesso include un lungo recupero post-operatorio27,28,29.
I progressi tecnologici nell'imaging a ultrasuoni utilizzando trasduttori specifici del roditore forniscono immagini ad alta risoluzione in tempo reale. Guidati dall'imaging ad ultrasuoni del movimento dell'ago ad iniezione nella cavità peritoneale, si può specificamente impiantare le cellule tumorali nel pancreas, sfruttando i benefici delle iniezioni di tumore ortotopico in assenza di impianto chirurgico e infiammazione associata. Questo approccio, definito modello di impianto del tumore ortotopico a ultrasuoni (UG-OTIM) è stato precedentemente stabilito in un xenotrapianto modelli di cancro al pancreas30 così come in diversi altri modelli di cancro tra cui sarcoma di Ewing, neuroblastoma e cancro della vescica31,32.
Qui, forniamo un protocollo dettagliato per eseguire iniezioni guidate da ultrasuoni di linee cellulari tumorali al pancreas murino. Mostriamo che i tumori risultanti riassumono le caratteristiche istologiche e immunologiche del KPC TME e possono quindi essere utilizzati per studiare nuove combinazioni terapeutiche, comprese le immunoterapie, per rivelare rapidamente i trattamenti più promettenti per in avanti agli studi clinici.
Protocollo
I protocolli sugli animali sono stati esaminati e approvati dal Comitato istituzionale di cura e uso degli animali presso l'Università della Pennsylvania. Sono stati acquistati topi C57Bl/6 di dimensioni femminili di 5-6 settimane (cfr. Tabella dei materiali)e utilizzati dopo 1-3 settimane di riposo. Il Laboratorio universitario Risorse Animali ha supervisionato la cura degli animali.
1. Preparazione delle linee cellulari tumorali del PDA per l'iniezione
- Crescere nella linea cellulare PDA derivata da KPC nei supporti delle cellule tumorali (TC): Dulbecco's Modified Eagle Medium (DMEM) integrata con 10% di siero bovino fetale (FBS), 2mM L-glutamine e 83g di gentamicin.
- Consentire alle cellule di crescere fino all'80-85% di confluenza nei flaconi mantenuti a 37 e 5% di CO2.
- Una volta che le cellule raggiungono la confluenza ideale, decantare il supporto dai flaconi e lavarsi due volte con una salina calda (37oC), sterile salina tampone fosfato (PBS), sufficiente a coprire il monostrato di cellule aderenti. Pipette di PBS rimanente dopo il lavaggio finale.
- Aggiungere la soluzione calda (37oC) 0,05% trypsin-EDTA (0,5% stock trypsin-EDTA diluito 1:10 nel buffer di dissociazione cellulare senza enzimi di Hanks) per coprire il monostrato in ogni fiaschezza e incubare a 37 gradi centigradi per 3-5 minuti o fino a quando le cellule non si staccano con toccare i lati del pallone e incubare a 37 gradi per 3-5 minuti o fino a quando le cellule non si staccano toccando sui lati del pallone e incubare a 37 gradi per 3-5 minuti o fino a quando le cellule non si staccano con toccare sui lati del pallone e incubare a 37 gradi per 3-5 minuti o fino a quando le cellule non si staccano toccando sui lati del pallone e incubare a 37 o fino a quando le cellule non si staccano con toccare sui lati del pallone e incubare a 37 gradi centigradi per 3-5 minuti o fino a quando le cellule non si staccano toccando sui lati del pallone e incubare a 37 o fino a Flask.
- Aggiungere 10-25 mL di freddo (4oC), supporti TC sterili in ogni pallone per fermare la reazione di prova. Versare la sospensione cellulare in uno o più conici 50mL, riempire fino a 50mL con supporti TC freddi.
- Centrifuga a 300g per 5 minuti a 4 oC. Scartare supernatante e risospendere il pellet in freddo, sterile DMEM (senza siero). Se sono stati utilizzati più tubi conici per raccogliere le cellule, tutti i pellet possono essere combinati in un unico conico in questa fase.
- Centrifuga a 300g per 5 minuti a 4 gradi.
- Ripetere i passaggi da 1.6 a 1.7 due volte. Nel lavaggio finale, prendere una aliquota di cellule per il conteggio. La redditività cellulare del 90% è raccomandata per le iniezioni in vivo.
- Preparare una sospensione uniforme delle cellule tumorali del PDA alla concentrazione desiderata delle cellule tumorali. Abbiamo usato 10-20 x 106 cellule/mL (da 250.000 a 500.000 cellule/25 -L) nella quantità appropriata di DMEM sterile, freddo o PBS, ma ogni linea cellulare deve essere titonata in vivo.
- Mantenere le cellule fredde, sul ghiaccio, fino a quando non sono pronte per l'iniezione.
2. Preparazione pre-chirurgica dei topi
NOTA: questo passaggio è consigliabile eseguire 24 ore prima della procedura.
- Posizionare le gabbie contenenti topi sperimentali su un set più caldo a 37oC.
- Ottenere nuove gabbie pulite e posizionarle su una seconda piattaforma di riscaldamento impostata su 37 gradi centigradi.
- Pulire accuratamente l'armadio di sicurezza biologica, la camera di induzione e lo stadio ad ultrasuoni (US) con sterile (vedi Tabella dei materiali).
- Ruotare la funzione di riscaldamento dello stadio USA a 37 gradi centigradi.
- Accendere la macchina per l'anestesia: regolare i quadranti sul divisore del tubo in modo che il flusso d'aria sia limitato solo alla camera di induzione. Accendere il serbatoio di ossigeno e impostare la portata a 1 L/min. Accendi il vaporizzatore isoflurane al 2-3%.
- Posizionare un singolo mouse nella camera di induzione. Monitorare il mouse fino a quando non è più mobile e la respirazione è rallentata.
- Regolare i quadranti sullo splitter in modo che il flusso d'aria sia alla camera di induzione che al cono del naso. Sposta rapidamente il topo dalla camera di induzione e posalo in recumbency ventrale sul caldo stadio americano con il muso nel cono naso.
- Testare il livello di induzione osservando qualsiasi risposta riflessiva alla pizzicatura dei dipidati. Se non c'è nessuno, il mouse è pronto per la depilazione.
- Posizionare una piccola quantità di lubrificante per gli occhi (vedi Tabella dei materiali)su entrambi gli occhi per prevenire la disidratazione dei tessuti. Girare il mouse in modo che si trova in recumbency dorsale sul palco. Aderire delicatamente le estremità superiori e inferiori allo stage con nastro di carta al fine di massimizzare l'esposizione dell'addome e fissare il mouse allo stage.
- Utilizzare un applicatore sterile a punta di cotone per applicare una crema depilatoria a livello generoso al quadrante superiore sinistro dell'addome. Il depilatorio deve essere applicato nella zona generale della milza e si estende verso la linea mediana. Lasciare stare a sedersi per circa un minuto.
- Testare il grado di depilazione utilizzando delicatamente l'estremità opposta dell'applicatore di punta di cotone per pulire la crema depilatoria, una volta che si rimuove facilmente, pulire l'addome pulito con un tampone di garza secca. Quindi sbondare uno strato pulito di garza con una piccola quantità di salina calda e pulire l'area ancora una volta per rimuovere completamente l'agente depilatorio. Non superare 2 minuti completi di contatto diretto sulla pelle del topo al fine di ridurre la possibilità di ustioni chimiche.
- Una volta che i capelli sono stati sufficientemente rimossi dall'addome, riportare il topo in una nuova gabbia pulita sul più caldo.
- Mentre il primo animale è in fase di depilazione sullo stadio degli Stati Uniti, il prossimo animale può essere aggiunto alla camera di induzione.
- Prima di anestesizzare la prossima gabbia di topi, spegnere l'isoflurane e lavare la camera di induzione con ossigeno. Pulire la camera di induzione e il cono di stadio/naso degli Stati Uniti con sterile. Ripetere i passaggi da 2,5 a 2,14 fino a quando tutte le gabbie e i topi non sono stati sottoposti a depilazione.
NOTA: Fissare gli animali mediante ritiro temporaneo del cibo per un periodo prima dell'impianto può essere considerato per ridurre al minimo l'ostruzione visiva degli organi addominali a causa di cibo non digerito nello stomaco e nell'intestino (12-24 ore). La restrizione dell'acqua non è raccomandata. Se gli animali sono digiunati, si raccomanda che siano trattati con un'iniezione di 1mL caldo (37oC), sterile salina dopo iniezione tumorale al fine di prevenire la disidratazione.
3. Impianto a ultrasuoni delle cellule PDA
NOTA: Tutte le procedure ecografiche vengono eseguite utilizzando la macchina e il software di imaging a ultrasuoni (vedere Tabella dei materiali). Il trasduttore ha una frequenza centrale di 40 MHz e una larghezza di banda di 22-55 MHz.
- Regolare la piattaforma ad ultrasuoni in modo che la superficie della piattaforma sia parallela al pavimento e l'investigatore si trovi di fronte al lato sinistro dell'animale, con la testa dell'animale a destra. Regolare la posizione del trasduttore in modo da ottenere un'immagine addominale trasversale (Figura 1A).
- Anestesizzare il mouse da iniettare come descritto nei passaggi 2.1-2.8. Stabilizzare il mouse sulla piattaforma statunitense come descritto al punto 2.9.
- Applicare una generosa quantità di gel ad ultrasuoni caldo (37 gradi centigradi) sulla sezione senza peli dell'addome.
- Abbassare delicatamente il trasduttore per contattare l'addome del topo. Regolare il trasduttore in base alle esigenze fino a quando il pancreas non è chiaramente visibile. Individuare il rene sinistro e la milza per fornire un orientamento accurato della cavità addominale.
NOTA: poiché la posizione del trasduttore è stata modificata per consentire l'accesso al lato sinistro dell'addome, l'asse X e Y sui controlli dello stage sono ora invertiti. - Caricare una siringa insulinico 29G x 1/2" (vedi Tabella dei materiali)con 25 -L di sospensione delle cellule tumorali. Pulire la punta dell'ago con il cuscinetto sterile di preparazione dell'alcool prima dell'iniezione al fine di ridurre al minimo la semina delle cellule tumorali nella parete addominale.
- Utilizzando pinze smussate, afferrare la pelle e la parete peritoneale per aumentare la tensione nel sito di iniezione desiderato. Tenendo la siringa ad un angolo di circa 25-45 gradi rispetto alla superficie della piattaforma ad ultrasuoni, far avanzare lentamente l'ago attraverso la pelle e la parete peritoneale. Verificare che l'ago abbia forato attraverso la parete peritoneale prima di procedere al passaggio successivo. Un piccolo pop dovrebbe essere sentito come l'ago trafigge la parete peritoneale.
- Sotto la visualizzazione ecografica, guidare l'ago direttamente nel pancreas(Figura 1B-C). Confermare che l'ago si trova all'interno del tessuto del pancreas muovendo delicatamente il barile della siringa su e giù. Se il posizionamento è corretto, la punta dell'ago rimarrà all'interno del tessuto del pancreas mentre la canna della siringa si muove.
- Iniettare lentamente le cellule tumorali e confermare che le cellule vengono impiantate nella posizione desiderata dalla formazione di un bolo fluido all'interno del pancreas (visibile sullo schermo ad ultrasuoni, Figura 1D).
NOTA: Una certa resistenza dovrebbe essere sentito durante lo stantuffo deprimente. Fare attenzione a non perforare il pancreas più volte in quanto questo aumenta la probabilità di perdite nella cavità addominale. - Una volta che l'intero volume di sospensione è stato iniettato e un bolo fluido può essere visto nel pancreas, tenere ago molto immobile per diversi secondi. Lentamente ritrarre l'ago dall'addome del topo, facendo molta attenzione a non disturbare le cellule iniettate.
- Posizionare il mouse in una gabbia pulita e calda e assicurarsi che il mouse si riprenda completamente dall'anestesia. Ripetere questo processo per tutti gli animali.
- Prima di anestesizzare il topo successivo, pulire la camera di induzione e il cono stadio/naso degli Stati Uniti con sterile.
- Ripetere i passaggi da 3.2 a 3.11 fino a quando tutti i topi non sono stati iniettati.
Risultati
L'obiettivo di questa relazione era quello di fornire un protocollo dettagliato per l'impianto a ultrasuoni di linee cellulari PDA derivate da KPC. Negli esperimenti rappresentativi illustrati nella Figura 2-4,confermiamo che i tumori UG-OTIM crescono ad un ritmo costante e in modo dipendente dalla dose. Inoltre, dimostriamo che i tumori UG-OTIM riassumono le caratteristiche immunologiche e istologiche salienti del KPC TME. Così, il sistema UG-OTIM è un modello di mouse PDA preclinico che può essere utilizzato in modo ad alta produttività per proiettare rapidamente nuove combinazioni di trattamento in vivo.
Utilizzando il protocollo UG-OTIM qui descritto, i topi sono stati preparati per l'impianto, fissati alla piattaforma a ultrasuoni riscaldata e le posizioni sia della piattaforma che del trasduttore sono state regolate per questa procedura, come mostrato nella Figura 1A. L'imaging ad ultrasuoni ad alta risoluzione è stato utilizzato per identificare un sito di iniezione all'interno del pancreas del topo che potrebbe essere preso di mira senza perforazione del rene o della milza (Figura 1B). Sotto la visualizzazione ultrasonografica, l'ago è stato accuratamente introdotto alla cavità addominale attraverso la parete peritoneale e guidato nel pancreas del topo (Figura 1C). Dopo il corretto posizionamento dell'ago è stato stabilito, la sospensione delle cellule tumorali è stata iniettata molto lentamente nel pancreas. Un impianto riuscito è stato confermato dalla presenza di una bolla all'interno del pancreas(Figura 1D). Nei primi esperimenti, il topo è stato sacrificato, e l'efficacia della procedura è stata verificata visualizzando direttamente un bolo fluido nel tessuto pancreas lordo (Figura 1E).
L'impianto tumorale e il tasso di crescita sono stati monitorati dall'imaging a ultrasuoni settimanale. Gli impianti di successo hanno prodotto tumori che erano contenuti all'interno dei confini del pancreas per tutto il tempo dell'esperimento (Figura 2A). Il software a ultrasuoni (vedi Tabella dei materiali) utilizzato ha permesso di determinare l'area e il volume del tumore per ogni punto temporale, nonché per la mappatura 3D dei tumori misurati da generare ( Figura2B) e le immagini 3D sono state confermate al momento della necropsia del topo (Figura 2C). Un'iniezione di cellule impropria durante la procedura UG-OTIM può provocare lo sviluppo di un tumore alla parete peritoneale (una seguente immagine rappresentativa è mostrata nella Figura 2D). I topi che presentano tumori peritoneali possono essere esclusi da ulteriori studi.
Per determinare la concentrazione ottimale di cellule per l'uso in studi preclinici, una linea cellulare PDA derivata da C57Bl/6 derivata da KPC (4662)9 è stata iniettata in ingenui, wild-type C57Bl/6 topi in sei esperimenti indipendenti. Questa linea cellulare (passata in vitro sei volte) è stata derivata da un topo portatore di tumore KPC completamente incrociato (>10 generazioni, confermato da SNP-analisi19) per prevenire l'istocompatibilità molecolare complesso antigeni del rigetto del tumore. Le cellule tumorali sono state iniettate a un titro basso (1,25 x 106 cellule/25 -L) e ad un alto titra (5 x 106 cellule/25 -L) dose. Le iniezioni di tumore ad alto titro hanno provocato una maggiore percentuale di animali portatori di tumore tre settimane dopo le iniezioni rispetto alla coorte di tibattio basso (Figura 3A). Nonostante il ritardo nell'insorgenza del tumore, il tasso di crescita del tumore complessivo non era significativamente diverso tra le due dosi (Figura 3B). Allo stesso modo, mentre il tasso di sopravvivenza tra le due coorti non era significativamente diverso, la tendenza dei dati verso una sopravvivenza leggermente migliorata nella coorte a basso tibore (Figura 3C). La coorte ad alto titro ha anche prodotto una percentuale maggiore di topi con tumori che sono stati iscritti in studi preclinici (designati al volume tumorale di 20mm3) di quattro settimane dopo l'iniezione rispetto alla coorte a basso titro (Figura 3D). La maggior parte dei topi provenienti da coorti di tifo sia alto che basso presentava tumori iscritti entro il giorno 25 e sviluppava sintomi di malattia allo stadio finale, tra cui asciti (dati non mostrati). Le metastasi, che non si verificano utilizzando 4662 alle dosi cellulari da questo protocollo, possono essere modellate con diverse linee cellulari o dosi33.
Il metodo UG-OTIM ha richiesto una padronanza delle capacità motorie per localizzare con precisione il sito di iniezione desiderato, che è stato impegnativo nei nostri primi esperimenti. Per questo motivo, abbiamo incluso una tabella che raffigura il numero di animali che hanno sviluppato tumori all'interno del pancreas (impianti riusciti) rispetto al numero totale di animali sottoposti a impianto di tumore a guida ecografica (Tabella 1). Gli animali sono stati eliminati da analisi future se i tumori si sono sviluppati in una posizione indesiderata (cioè rene) o se non c'erano prove di tumore da sei settimane dopo l'iniezione, come indicato. La progressione settimanale della percentuale di topi che portano tumori pancreatici iscrivibili (volume tumorale di 20 mm3) da ogni esperimento è mostrata anche nella Tabella 1.
Per determinare se c'era un vantaggio nell'utilizzare l'approccio UG-OTIM piuttosto che il tradizionale modello ortotopico chirurgico (oltre l'investimento chirurgico dopo aver ottenuto competenze alla tecnica), abbiamo confrontato la seeding dei tumori PDA nella parete peritoneale dei topi dopo ogni procedura. Abbiamo scoperto che solo 2/31 topi (6,5%) ha sviluppato tumori delle pareti peritoneali non intenzionali dopo le iniezioni di UG-OTIM, rispetto ai topi 7/15 che hanno sviluppato tumori della parete peritoneale dopo l'iniezione chirurgica (46,6%, p < 0.0029) (tabella 1). Così, il tasso di seeding di tumori aggiuntivi nel peritoneo è notevolmente ridotto nel metodo UG-OTIM rispetto all'impianto chirurgico.
Al sacrificio di topi che portano tumori UG-OTIM, abbiamo scoperto che l'anatomia grossolana dei tumori era simile ai tumori spontanei del KPC (Figura 4A). L'analisi istologica ha dimostrato un modello di strutture duttali anormali che era simile in entrambi i modelli e che ricapitolava la morfologia della malattia umana (Figura 4B). Per studiare l'infiltrato immunitario all'interno dei tumori kPC e UG-OTIM, i campioni istologici rappresentativi sono stati macchiati per CD3 (espressi dalle cellule T) e F4/80 (espressi dai macrofagi). In entrambi i modelli, i modelli di colorazione hanno rivelato tumori che erano scarsamente infiltrati dalle cellule T(Figura 4C),ma fortemente infiltrati dai macrofagi (Figura 4D). Questa scoperta è coerente con il fenotipo immunologicamente freddo della maggior parte dei campioni di PDA umano e KPC5,7,12.
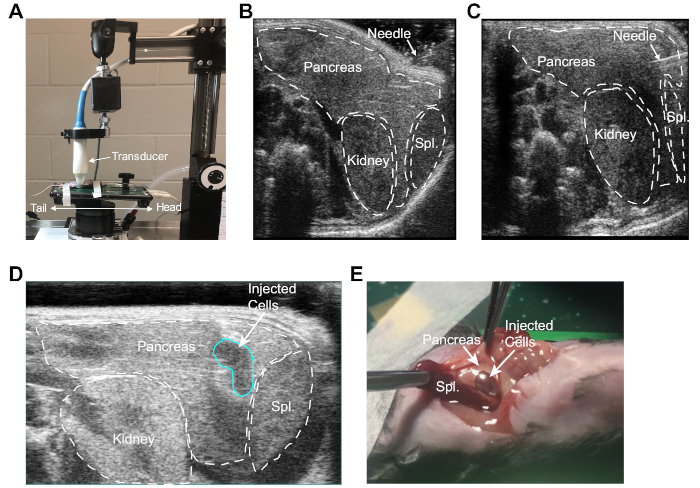
Figura 1: Impianto a ultrasuoni delle cellule del PDA nel pancreas murino. (A) Orientamento del topo, stadio ad ultrasuoni e sonda ad ultrasuoni utilizzati per ottenere un'immagine ad alta risoluzione degli organi addominali. Si noti che lo stadio e la piattaforma sono stati ruotati di 90 gradi rispetto all'orientamento standard per consentire un facile accesso al quadrante superiore sinistro dell'addome del mouse. (B) Immagine ultrasonografica raffigurante l'identificazione di rene, milza e pancreas. Qui l'ago di iniezione è posizionato contro l'addome del topo. (C) Immagine ultrasonografica raffigurante l'ago all'interno del pancreas del topo. (D) Immagine ultrasonografica raffigurante la bolla nel sito di iniezione (delineato in blu) a seguito di iniezione controllata di cellule tumorali nel pancreas. (E) Laparotomia rivelando il bolus liquido contenente cellule PDA nel pancreas dopo l'iniezione guidata ad ultrasuoni. Fare clic qui per visualizzare una versione più grande di questa figura.
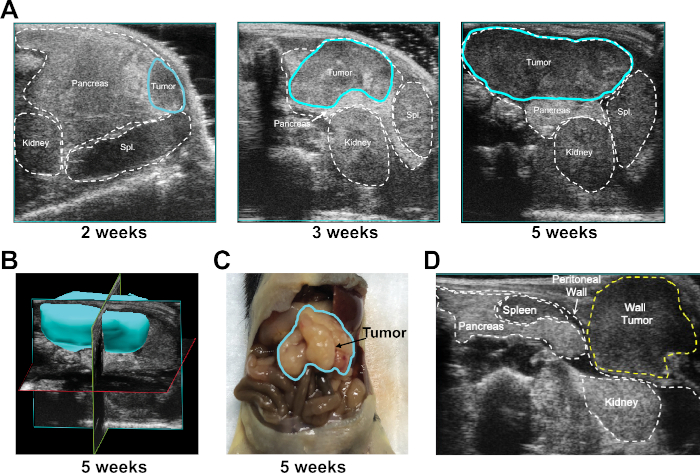
Figura 2: Monitoraggio della crescita del tumore dopo l'iniezione UG-OTIM. (A) Immagine ultrasonografica rappresentativa del tumore UG-OTIM (delineato in blu) a 2, 3 e 5 settimane dopo l'iniezione, come indicato. (B) Rappresentante ricostruito immagine 3D del tumore UG-OTIM 5 settimane dopo l'iniezione utilizzando il software a ultrasuoni. (C) Anatomia lorda rappresentativa del tumore UG-OTIM 5 settimane dopo l'iniezione sulla necroscopia dei topi. (D) Immagine ultrasonografica rappresentativa di un tumore alla parete peritoneale che cresce nello strato sottocutaneo dopo un'iniezione cellulare impropria a 7 settimane dopo l'iniezione. Fare clic qui per visualizzare una versione più grande di questa figura.
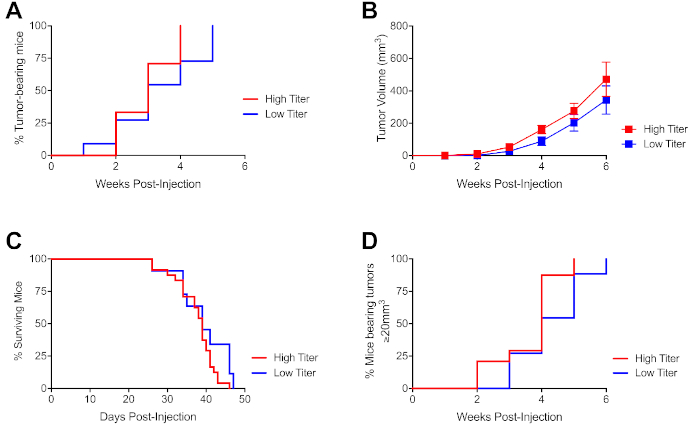
Figura 3: insorgenza dipendente dalla dose di tumori iscrivibili dopo l'iniezione guidata ad ultrasuoni delle cellule PDA. (A) Proporzione di topi portatori di tumore ai punti temporali indicati dopo l'iniezione, come descritto nella Figura 1 con titolo elevato (500.000 cellule/25 -L) o da un titro basso (125.000 cellule/25L), come indicato. (B) Cinetica di crescita tumorale di topi da (A), ogni simbolo rappresenta un gruppo di topi, le barre di errore indicano SEM. (C) Proporzione di topi da (A) vivo nei punti indicati dopo l'iniezione. I topi sono stati eutanasia o censurati se i tumori erano >1000mm3 o la condizione del corpo era scarsa a causa di comorbidità tumorali. (D) Tempo di insorgenza tumorale iscrivibile per topi da (A). I tumori iscrivibili sono considerati 20mm3 di volume. Dati rappresentativi di 4 esperimenti indipendenti con mouse/esperimenti n. 8-20. Fare clic qui per visualizzare una versione più grande di questa figura.
| rsperimento | Cuscinetto/iniezioni totali del tumore al pancreas | Settimana 1 (iscrivibile) | Settimana 2 (iscrivibile) | Settimana 3 (iscrivibile) | Settimana 4 (iscrivibile) | Tumori Peritoneiali di semi |
| Alto titro | 24/31 | Nd | 8/24 (3/24) | 15/24 (7/24) | 23/23 (20/23) | 2/20 |
| Titro basso | 11/17 | Nd | 3/11 (0/11) | 6/11 (3/11) | 9/11 (5/11) | 0/11 |
| Iniezione chirurgica | 15/17 | Nd | Nd | 15/15 (9/15) | 15/15 (14/15) | 7/15 |
Tabella 1: Numero di tumori UG-OTIM di successo rispetto all'impianto chirurgico. Dati combinati da 2-4 esperimenti indipendenti per condizione di titolo alto o basso con mouse di 5-10 dollari per esperimento. "Iniezione chirurgica" indica topi che hanno ricevuto l'iniezione chirurgica laparoscopica addominale di 125.000 cellule tumorali. "Portatore di tumore" indica topi con un tumore al pancreas. "Iscrivibile" indica la proporzione di topi portatori di tumore in ogni punto con un volume tumorale >20mm3. "Semi peritoneal Tumori" indica la proporzione totale di topi portatori di tumore che avevano semi concomitanti di tumori sulla parete peritoneale dall'iniezione di cellule tumorali. I topi con tumori che si presentano in modo errato in tessuti diversi dal pancreas (cioè rene) sono stati esclusi dalle popolazioni "portanti" (ma inclusi nei topi iniettati totali). ND, non determinato. Frequenza di seeding a parete peritoneale confrontando gruppi di titolo alti e bassi combinati con l'impianto chirurgico, p < 0,0029 tramite test T a due code con il post-test Mann-Whitney.

Figura 4: I tumori UG-OTIM riassumono il microambiente tumorale del KPC. Vengono visualizzate le immagini rappresentative. In alto, tumori del KPC. Riga inferiore, tumori UG-OTIM a 5 settimane dopo l'impianto. (A) Anatomia lorda dei tumori asformati sulla necroscopia. (B) H&E (10X, bar-100 m) (C) Colorazione immunoistochimica per CD3 (marrone) (10X, bar-100 m). (D) Colorazione immunofluorescente di F4/80 (rosso) e DAPI (blu) (4X, bar-500 m). Fare clic qui per visualizzare una versione più grande di questa figura.
Discussione
Dimostriamo qui che l'uso dell'ultrasonografia ad alta risoluzione per l'impianto diretto di linee cellulari murine PDA al sito tissutale autoctono è un'alternativa affidabile sia al KPC che ai sistemi chirurgici del modello ortotopico. UG-OTIM produce tumori biologicamente rilevanti che mantengono le caratteristiche immunopatologiche del PDA con un lasso di tempo ridotto alla diagnosi-tumorale e una cinetica di crescita del tumore affidabile. L'iniezione guidata ad ultrasuoni può quindi servire come strumento utile per la produzione rapida di topi che portano tumori del PDA impiantati ortotopicamente, consentendo lo studio delle combinazioni terapeutiche in un modello clinicamente rilevante.
L'impianto a ultrasuoni offre importanti miglioramenti rispetto ai modelli standard di indagine preclinica. In primo luogo, questa procedura elimina il monitoraggio intensivo del tempo dei topi KPC per lo sviluppo di tumori spontanei impiantando direttamente completamente C57BL/6 cellule di PDA con cross nel pancreas murino. In secondo luogo, simile alle iniezioni ortotopiche chirurgiche tradizionali, l'approccio UG-OTIM consente il controllo sulla linea cellulare iniettata, compresa la selezione di una linea cellulare tumorale monoclonale e/o la manipolazione ex vivo della linea cellulare, così come il controllo sull'ospite che riceve l'impianto della cellula tumorale. In terzo luogo, questa tecnica minimamente invasiva evita il difficile lavoro della chirurgia di sopravvivenza e bypassa il complicato periodo di recupero post-operatorio per gli animali, nonché i segnali infiammatori dalla guarigione chirurgica della ferita. Infine, i tumori UG-OTIM - simili all'impianto chirurgico - ricapitolano il TME osservato nei topi KPC, tra cui l'infiltrazione di cellule T a bassa Etta e l'elevata infiltrazione dei macrofagi. Così, il modello UG-OTIM mantiene le caratteristiche chiave dei tumori KPC senza le ulteriori complicazioni che ritardano le indagini terapeutiche nel modello spontaneo KPC.
Una serie di passaggi critici nel protocollo sono fondamentali per padroneggiare il successo della tecnica. La competenza nell'imaging a ultrasuoni murino è essenziale per questa procedura, ma la manualità necessaria per impiantare con successo le cellule nel pancreas è un insieme di competenze che deve essere sviluppato in modo indipendente. Per i topi in un ciclo di 12 ore di luce /scuro, il digiuno degli animali durante la notte ha assicurato che lo stomaco e l'intestino fossero stati eliminati da qualsiasi alimento non digerito che potesse bloccare la vista del pancreas, del rene e della milza mediante ultrasuoni. Inoltre, ogni linea cellulare utilizzata per l'iniezione ortotopica deve essere titonata prima di ulteriori esperimenti per comprendere la cinetica della crescita e determinare il potenziale metastatico33. Durante l'iniezione, l'uso di pinze per pizzicare la pelle nel sito di iniezione ha creato la tensione necessaria per forare delicatamente sia attraverso la pelle che la parete peritoneale. Un passo chiave nella procedura è stato quello di guidare con attenzione l'ago nel pancreas senza perforare il tessuto o forare un sito off-target come la milza o il rene. La conferma di un bolo liquido è stato il miglior indicatore di successo dell'iniezione di cellule tumorali nel tessuto corretto. Dopo l'iniezione, l'ago deve essere ritirato lentamente in modo da non disturbare il bolo liquido. Abbiamo scoperto che una serie di iniezioni di prova utilizzando dMEM o Trypan Blue ha contribuito a sviluppare una padronanza delle capacità motorie fini necessarie per questa iniezione.
Durante la risoluzione dei problemi di questa procedura, è stata identificata una serie di fattori che hanno influito sul successo del protocollo. Negli esperimenti di prova, il nostro errore più frequente è stato la perforazione del rene durante l'impianto, che si è verificato più frequentemente nei nostri primi esperimenti suggerendo che l'esercizio regolare di questa abilità migliora la competenza. Inoltre, abbiamo scoperto che confermare la presenza di un bolo liquido dopo l'iniezione di cellule tumorali tramite ecografia e visualizzazione diretta alla necropsia durante la fase di risoluzione dei problemi ha migliorato la tecnica di iniezione di successo. Se la formazione di una bolla non è confermata dagli ultrasuoni durante l'iniezione, la posizione dell'ago può essere regolata prima di deprimere completamente la siringa per rilasciare il bolo rimanente delle cellule tumorali. Abbiamo anche osservato che i volumi delle sospensioni iniettati troppo rapidamente hanno provocato la fuoriuscita di cellule tumorali nella cavità peritoneale o collasso del bolo liquido nel pancreas. In generale, questi animali hanno continuato a sviluppare tumori pancreatici con l'eccezione di animali n. 7 che non hanno mostrato alcuna prova di tumore 4 settimane dopo l'iniezione. Questo risultato è stato riportato solo nei nostri primi tentativi (e 6/7 animali sono stati iniettati con un basso tè di cellule tumorali). I topi che hanno iniezioni di cellule tumorali discutibili, o che richiedono il riposizionamento dell'ago, devono essere attentamente monitorati per lo sviluppo di tumori al di fuori del pancreas.
I principali limiti del metodo a ultrasuoni sono la disponibilità degli strumenti necessari e l'abilità tecnica associata all'impianto tumorale. La procedura non è completamente sterile, in quanto il mouse viene iniettato in modo non sterile sulla piattaforma ad ultrasuoni, con la siringa e la punta dell'ago che passano attraverso il gel ad ultrasuoni. Anche se non abbiamo visto alcuna prova di infezione in n- 148 topi attraverso un totale di 8 esperimenti indipendenti da quando ha avvistato questi studi, è possibile che un agente infettivo potrebbe entrare nel pancreas attraverso l'ago di iniezione durante questo processo. Come tale, il maggior numero possibile di aspetti del protocollo (compresi guanti, superfici ad ultrasuoni, scatole di ghiaccio) deve essere spruzzato con disinfettante o 70% di etanolo per ridurre la potenziale esposizione agli agenti patogeni. Un'ulteriore limitazione del protocollo attuale era la mancanza di metastasi utilizzando la linea cellulare 4662 alle diluizioni attuali. Ogni linea cellulare utilizzata nel sistema UG-OTIM deve essere titolata per i tassi di crescita desiderati e per il potenziale metastatico33. Infine, il nostro protocollo attuale ha stabilito tecniche per l'iniezione di cellule tumorali in una sospensione a singola cellula. Tuttavia, l'aggiunta di un substrato di matrice extracellulare potrebbe essere aggiunto per migliorare potenzialmente lo stabilimento tumorale e prevenire la perdita di cellule tumorali (come viene utilizzato nei modelli di impianto chirurgico27,30,31,32). Così, molte delle limitazioni di UG-OTIM possono essere superate con un test appropriato delle linee cellulari utilizzate nelle iniezioni ortotopiche.
In sintesi, il modello UG-OTIM è un metodo preciso di iniezione di cellule tumorali dirette al pancreas murino. Questa tecnica di impianto minimamente invasiva avvantaggia sia lo sperimentatore che gli animali riducendo i tempi di procedura, riducendo al minimo le complicazioni post-chirurgiche e migliorando la precisione dell'iniezione. I tumori derivanti da iniezioni UG-OTIM mantengono le caratteristiche immunobiologiche dei tumori spontanei del KPC, hanno tempo affidabile per l'insorgenza del tumore e la cinetica di crescita del tumore riproducibile. Così il modello UG-OTIM può essere utilizzato in modo relativamente ad alta produttività per interrogare combinazioni terapeutiche in un ambiente preclinico per rivelare nuovi trattamenti per i pazienti con il più grande bisogno clinico non soddisfatto.
Divulgazioni
Gli autori non hanno divulgazioni.
Riconoscimenti
Gli autori desiderano ringraziare il Dr. Robert Vonderheide e tutti i membri del laboratorio Vonderheide, tutti i membri del Pancreatic Cancer Mouse Hospital, il Dr. Ben Stanger, il Centro di Ricerca sul Cancro Pancreatico presso l'Università della Pennsylvania, e Devora Delman per discussioni utili. Questo lavoro è supportato dal finanziamento del Parker Institute for Cancer Immunotherapy Fellow Award (KTB) e del Pancreatic Cancer Research Center presso l'Università della Pennsylvania (CC).
Materiali
| Name | Company | Catalog Number | Comments |
| 50 mL Conicals | Thomas Scientific | 2602A26 | |
| Blunt edged forceps | Fine Science Tools | 11000-12 | |
| Cell Dissociation Buffer | Thermo-Fisher | 13151014 | |
| Cotton Tipped swabs | Thermo-Fisher | 19062614 | |
| Covidien Monoject 3/10mL, 29G X 1/2" | Thermo-Fisher | 8881600145 | |
| Depilatory Agent | Amazon | Nair Body Lotion | |
| DMEM | Thermo-Fisher | 10-566-016 | |
| FBS | Gemini Bio-oroducts | 100-106 | |
| Flask | Sigma-Aldrich | CLS430825 | |
| Forceps (blunt edge) | Fine Science Tools | 11000-12 | |
| Gauze | Fisher | 13-761-52 | |
| Gentamicin | Thermo-Fisher | 15750060 | |
| Induction Chamber | VetEquip | 941444 | |
| Isofluorane | Penn Vet Supply | VED1350 | |
| Isofluorane Vaporizer | VetEquip | 911103 | |
| L-glutamine | Thermo-Fisher | 25030081 | |
| Optixcare | MidWest Veterinary Supply | 052.50310.3 | |
| Paper Tape | Medline | MMM1530Z5 | |
| PBS | Thermo-Fisher | 14-190-250 | |
| Slide warmer | C&A Scientific | XH-2001 | |
| Sterilant (Clidox-S) | Fisher Scientific | NC0332382 (activator) NC9189926 (base) | Needs to be combined according to manufacturer's instructions |
| Sterile Alcohol prep pad | Covidien | 6818 | |
| Trypsin | Thermo-Fisher | 15090046 | |
| Ultrasound gel | Thermo-Fisher | 03-34-1LT | |
| Visualsonics Ultrasound Vevo 2100 | Visual Sonics | Vevo 2100 |
Riferimenti
- Siegel, R. L., Miller, K. D., Jemal, A. Cancer statistics, 2019. CA Cancer Journal for Clinicians. 69 (1), 7-34 (2019).
- Rahib, L., et al. Projecting cancer incidence and deaths to 2030: the unexpected burden of thyroid, liver, and pancreas cancers in the United States. Cancer Research. 74 (11), 2913-2921 (2014).
- Chao, T., Furth, E. E., Vonderheide, R. H. CXCR2-Dependent Accumulation of Tumor-Associated Neutrophils Regulates T-cell Immunity in Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 4 (11), 968-982 (2016).
- Steele, C. W., et al. CXCR2 Inhibition Profoundly Suppresses Metastases and Augments Immunotherapy in Pancreatic Ductal Adenocarcinoma. Cancer Cell. 29 (6), 832-845 (2016).
- Li, J., et al. Tumor Cell-Intrinsic Factors Underlie Heterogeneity of Immune Cell Infiltration and Response to Immunotherapy. Immunity. 49 (1), 178-193 (2018).
- Beatty, G. L., et al. Exclusion of T Cells From Pancreatic Carcinomas in Mice Is Regulated by Ly6C(low) F4/80(+) Extratumoral Macrophages. Gastroenterology. 149 (1), 201-210 (2015).
- Bayne, L. J., et al. Tumor-derived granulocyte-macrophage colony-stimulating factor regulates myeloid inflammation and T cell immunity in pancreatic cancer. Cancer Cell. 21 (6), 822-835 (2012).
- Beatty, G. L., et al. CD40 agonists alter tumor stroma and show efficacy against pancreatic carcinoma in mice and humans. Science. 331 (6024), 1612-1616 (2011).
- Lo, A., et al. Tumor-Promoting Desmoplasia Is Disrupted by Depleting FAP-Expressing Stromal Cells. Cancer Research. 75 (14), 2800-2810 (2015).
- Rhim, A. D., et al. Stromal elements act to restrain, rather than support, pancreatic ductal adenocarcinoma. Cancer Cell. 25 (6), 735-747 (2014).
- Ozdemir, B. C., et al. Depletion of Carcinoma-Associated Fibroblasts and Fibrosis Induces Immunosuppression and Accelerates Pancreas Cancer with Reduced Survival. Cancer Cell. 28 (6), 831-833 (2015).
- Clark, C. E., et al. Dynamics of the immune reaction to pancreatic cancer from inception to invasion. Cancer Research. 67 (19), 9518-9527 (2007).
- Stromnes, I. M., Hulbert, A., Pierce, R. H., Greenberg, P. D., Hingorani, S. R. T-cell Localization, Activation, and Clonal Expansion in Human Pancreatic Ductal Adenocarcinoma. Cancer Immunology Research. 5 (11), 978-991 (2017).
- Morrison, A. H., Byrne, K. T., Vonderheide, R. H. Immunotherapy and Prevention of Pancreatic Cancer. Trends in Cancer. 4 (6), 418-428 (2018).
- Hingorani, S. R., et al. Trp53R172H and KrasG12D cooperate to promote chromosomal instability and widely metastatic pancreatic ductal adenocarcinoma in mice. Cancer Cell. 7 (5), 469-483 (2005).
- Yip-Schneider, M. T., et al. Dimethylaminoparthenolide and gemcitabine: a survival study using a genetically engineered mouse model of pancreatic cancer. BMC Cancer. 13, 194 (2013).
- Frese, K. K., et al. Nab-Paclitaxel potentiates gemcitabine activity by reducing cytidine deaminase levels in a mouse model of pancreatic cancer. Cancer Discovery. 2 (3), 260-269 (2012).
- Stromnes, I. M., et al. T Cells Engineered against a Native Antigen Can Surmount Immunologic and Physical Barriers to Treat Pancreatic Ductal Adenocarcinoma. Cancer Cell. 28 (5), 638-652 (2015).
- Byrne, K. T., Vonderheide, R. H. CD40 Stimulation Obviates Innate Sensors and Drives T Cell Immunity in Cancer. Cell Reports. 15 (12), 2719-2732 (2016).
- Winograd, R., et al. Induction of T-cell Immunity Overcomes Complete Resistance to PD-1 and CTLA-4 Blockade and Improves Survival in Pancreatic Carcinoma. Cancer Immunology Research. 3 (4), 399-411 (2015).
- Keenan, B. P., et al. A Listeria vaccine and depletion of T-regulatory cells activate immunity against early stage pancreatic intraepithelial neoplasms and prolong survival of mice. Gastroenterology. 146 (7), 1784-1794 (2014).
- Jiang, H., et al. Targeting focal adhesion kinase renders pancreatic cancers responsive to checkpoint immunotherapy. Nature Medicine. 22 (8), 851-860 (2016).
- Maddipati, R., Stanger, B. Z. Pancreatic Cancer Metastases Harbor Evidence of Polyclonality. Cancer Discovery. 5 (10), 1086-1097 (2015).
- Foster, D. S., Jones, R. E., Ransom, R. C., Longaker, M. T., Norton, J. A. The evolving relationship of wound healing and tumor stroma. Journal of Clinical Investigation Insight. 3 (18), (2018).
- Kasper, M., et al. Wounding enhances epidermal tumorigenesis by recruiting hair follicle keratinocytes. Proceedings of the National Academy of Sciences. 108 (10), (2010).
- Stuelten, C. H., et al. Acute Wounds Accelerate Tumorigenesis by a T Cell-Dependent Mechanism. Cancer Research. 68 (18), (2008).
- Qiu, W., Su, G. H. Development of orthotopic pancreatic tumor mouse models. Methods of Molecular Biology. 980, 215-223 (2013).
- Moreno, J. A., Sanchez, A., Hoffman, R. M., Nur, S., Lambros, M. P. Fluorescent Orthotopic Mouse Model of Pancreatic Cancer. Journal of Visualized Experiments. (115), (2016).
- Erstad, D. J., et al. Orthotopic and heterotopic murine models of pancreatic cancer and their different responses to FOLFIRINOX chemotherapy. Disease Models and Mechanisms. 11 (7), (2018).
- Huynh, A. S., et al. Development of an orthotopic human pancreatic cancer xenograft model using ultrasound-guided injection of cells. Public Library of Science One. 6 (5), e20330 (2011).
- Thomas, T. T., et al. Utilization of Ultrasound-guided Tissue-directed Cellular Implantation for the Establishment of Biologically Relevant Metastatic Tumor Xenografts. Journal of Visualized Experiments. (135), (2018).
- Jager, W., et al. Minimally invasive establishment of murine orthotopic bladder xenografts. Journal of Visualized Experiments. (84), e51123 (2014).
- Aiello, N. M., Rhim, A. D., Stanger, B. Z. . Orthotopic injection of pancreatic cancer cells. , (2016).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon