Method Article
管状構造の組織工学のためのコア/シェル印刷足場
要約
ここに提示される、血管および他の管状構造のティッシュ工学のために適した中空足場の1ステップの製造のための簡単な使用、コア/シェル、三次元バイオプリンティングの組み立てである。
要約
コア/シェルフィラメントの3次元(3D)印刷により、液体コアとの界面で架橋された安定したシェルを持つチャネル構造を直接製作できます。後者は、中空チューブの後に残って、ポスト印刷を削除されます。添加物製造技術(ここで説明したような、天然細胞外マトリックス[ECM]を構造的かつ生化学的に模倣するテーラーメイド[bio]インクと同様に)を統合することは、高度な組織工学に向けた重要なステップです。ただし、明確に定義された構造の正確な製造には、使用中の材料用に最適化されたカスタマイズされた製造戦略が必要です。したがって、カスタマイズ可能で使いやすく、幅広い材料やアプリケーションと互換性のあるセットアップから始めるのが賢明です。この仕事は、明確に定義された、アルギネートベースの足場材料製剤でテストされた木質杭構造のコア/シェル印刷を探索するために、ルアー互換性を持つ製造しやすいコア/シェルノズルを提示します。
概要
間違いなく、組織工学(TE)の究極の目的は、人体1、2、3の傷ついた部分を再生または置換するために使用することができるインビトロで機能組織または器官を産生することである。組織工学(TE)の現在の研究は、分野の個々の側面(足場材料、製造手順、細胞源など)に焦点を当てています。4、5、ならびに生体内の基本的な側面を模倣する組織および器官の単純なインビトロモデルを開発する。このようなモデルは、薬物スクリーニングや毒性研究などの多くの用途に既に有用であり、特に従来の2D細胞培養が天然組織の動的応答を模倣できない場合には6、7、 8,9.インビトロモデルの三次元モデルは、通常、細胞10、物理化学的手がかり11、および生体活性分子12、13を組み合わせて構築される。脱細胞組織または生物学的または生体適合性材料14、15、16、17、18からデノボを構築。
足場は、生体内組織19を代表する設計組織の機能性を可能にするために、複雑な3Dマイクロアーキテクチャとネイティブ組織の階層構造を要約することが重要である。TE の著しい技術進歩にもかかわらず、生理学的に関連する人工組織構造の開発は依然として課題です。厚い組織(>200 μmの厚さ)は、酸素および栄養拡散20などの制限のために特に問題がある。より大きな組織構造に向けた進歩がなされた。しかし、酸素や栄養素を輸送し、廃棄物除去を促進するためには、血管に細胞の高い近接性が必要です。組織の血管化(または組織構造内の相互接続された3D血管ネットワークの製造)は、細胞の生存率を維持し、体外的に設計された組織の機能を促進する上で重要な役割を果たします。長期実験におけるモデル21,22.さらに、必要な分解能、構造的完全性、および同時生体適合性は、まだ23を達成していない。
いくつかのTEアプローチは、血管のような構造を構築し、インビトロでの血管化を容易にする試みで提案されている。いくつかの例は、微小血管ネットワーク24を生成するために自己集めする内皮細胞(また、線維芽細胞などの他の細胞と共培養)、血管前駆細胞および内皮細胞を促進するペリサイトの使用を含む成長21,25,血管形成を誘発する血管新生成長因子の送達 20,26, 血管層20の制御を可能にする細胞シート技術を用いて、血管新生を促進する非常に多孔質の足場構造27.前述のアプローチは血管新生誘導に焦点を当てており、一般的にかなりの量の追加成長因子(例えば、VEGF)と形成する時間を必要とする。しかし、最大の欠点は、血管パターンに対する再現性が限られ、空間的に制限された空間制御であり、通常、必ずしも灌流を容易にしないとは限らない組織構造内のランダムな血管系分布をもたらす。
添加剤製造(AM、3Dバイオプリンティングなど)は、TEに適した足場を作るために、生物学的または生体適合性の材料を使用した3D構造の製造にますます関与しています。いくつかのAMアプローチが並行して使用され、開発されている(例えば、インクジェットおよびマイクロエクスションベースの方法、異なるタイプのリソグラフィ技術)。.個々の技術は、特定の長所と短所28を示し、様々な修飾(例えば、マイクロパターニング、誘発血管新生など)が、大きく、複雑で安定した血管の程度を増加させる理由であるネットワークは22、29、30を製造することができる。
これらの中で、押出バイオプリンティングは、特に互換性のある材料の広い範囲(一般的に細胞に優しいプロセス28、31、32)だけでなく、例外的な汎用性のために、最も一般的に使用される方法ですアプリケーションの用語(例えば、埋め込みおよび犠牲印刷23、33、中空構造34、35等の製造)。現在の研究に取り組む主な課題は、2Dから3D構造への移動、高い空間分解能を持つ中空管の密集したネットワークの形成、細胞培養における流体流れの間の全体的な機械的完全性と形状忠実性などです。条件30.
説得可能な組織への最も簡単なアプローチは、コンストラクト内のチャネルの相互接続されたネットワークの製造です。組織足場内にこのようなパーフューズ可能なチャネルを作ることは、廃棄物を除去しながらすぐに栄養と酸素の拡散を可能にするので、前述の問題の多くを解決することが期待されます。したがって、構築物内の壊死領域の潜在的な形成は回避される36.このようなチャネルは、さらに内皮細胞(IC)で播種され、3D組織モデル37における人工血管として機能してもよい。最も基本的な意味では、容器は中空チャネル、ICの柔らかい層、および堅い貝で構成することができる。最近では、押出のための共軸針を利用したコア/シェル方形の2つの異なる材料の3D押出は、38、39、40、41の製作を可能にするように、多くの関心を得ています。中空の管。
従来のマイクロエクスルーション3D印刷と同様に、コア/シェル印刷は、同軸ノズル(例えば、同じ軸上に異なる直径を持つ2本の針を同じ軸に位置合わせし、より広い針が狭い針を囲む)で行われます。したがって、2つの材料は、中央フィラメントまたは「内側」コアとして、第2は「外側」シェル41として、同時に押し出すことができる。現在までに、共軸バイオプリンティングは、固体42、コア/シェル43、および中空ストランド40、44を有する構造を製造するために利用されてきた。しかし、使用される材料は、印刷された構造体の最適な細胞の生存率と機械的な堅牢性の両方のために最適化されていません。前述のように、この技術は、より硬いものが柔らかいものをサポートする異なる機械的特性を持つバイオマテリアルを組み合わせる可能性を提供します。さらに重要なのは、足場材料(例えば、アルギン酸塩、カルボキシメチルセルロース)がシェルとして押し出され、架橋剤で構成されるコア(例えば、塩化カルシウム)が内側の毛細管から分配され、その後、印刷後にすすり出される場合、単一のステップ45で連続的な中空管を作製することができる。
このことを念頭に置いて、血管構造および他の管状組織の工学のための明確で、説得可能な足場を造るために、簡単で反復可能なワンステップ法が開発された。費用対効果の高い技術を開発するには、製造は理想的には単一ステップのプロセスでなければなりません。したがって、コア/シェルのセットアップを3Dバイオプリンタに適応し、統合しました。基本的な設計は、より大きな直径の第2のノズルが置かれる注入の間に変形を避けるために金属から成っている中央ノズルから成っている。このような共軸ノズルのセットアップは、押し出されたヒドロゲルチャネルの2つの流れの共押出および即時架橋を可能にする。これにより、多層中空フィラメントの直接製造が可能となり、その後の塩化カルシウム(CaCl2)濃度の高いクロスリンクにより、外部からのより永続的な安定化が保証されます。
したがって、この方法は、中空ヒドロゲルフィラメントが3D構造の機械的完全性をサポートする足場として機能し、同時に提供する内蔵マイクロチャネルとして機能する足場とマイクロチャネルの同時印刷を可能にします。細胞増殖のための栄養素。このプロトコルは、内蔵チャネルを持つヒドロゲル3D構造が中空フィラメントを生成するために架橋を制御することによって製造されるカスタムメイドのコ軸ノズルの使用に基づいて、コア/シェル3Dバイオプリンティング戦略の詳細な手順を提供し、細胞培養中に説得可能なままである。
この作品で使用される3D印刷セットアップは、バノヴィッチとVihar46によって前述したように構成され、3つの主要なコンポーネントに分けることができます:A)X、Y、およびZ方向で50 μmの位置決め精度を持つ3軸CNC機械セットアップ。B)2つの押出機、使い捨て、1.2 μLボクセル分解能の5 mLルアーロックシリンジに適合。とC)エレクトロニクスとソフトウェアを制御します。
コア/シェル印刷を容易にするために、押出機(一次押出機、コアを印刷)の1つに取り付けることができ、G27鈍い端針と互換性のある適切なノズルが開発されました。また、2番目の押出機(シェルを印刷)に接続するためのluerロック互換性を持っています。最初のプロトタイプは、鈍い端のG27針(内径= 210 μm、外径= 410 μm)をG21針(内径=510μm、外径=820μm)またはG20円錐先端(内径=600μm)に挿入して製作し、次に二次nを挿入した。シェル材料を供給するために横にeedle。しかし、針シャフトのわずかな曲げのために、内側と外側の針の同心円位置を有するノズル先端を作り出すことはできない。
この問題を解決するために、次の基準を満たす新しいノズル設計が考案されました:1)3軸CNCミルを使用して製造することができ、2)様々な材料(PEEKや金属などの高性能プラスチック)から作ることができる、3)ルアロック互換性を有しています。シェル材料を適用するための4)は、G27鈍い端針に互換性があり、先端を中心軸に位置合わせするために2つの位置に保持します。ノズルプロトタイプの回路図を図 1 に示します。
プロトコル
1. ヒドロゲルおよび架橋ソリューションの準備
- 簡単に言えば、激しく混合することにより、ALGおよびCMC粉末を超純水に溶解し、合計3重量%ALGおよび3wt%CMC溶液を得る。
注:この作品では、5 mLの注射器が印刷に使用されます。したがって、材料の最終的な量は、そのボリュームに調整されます。ただし、他の押出カートリッジおよび印刷されたサンプルサイズの場合は、それに応じて調製された材料の量をスケーリングする必要があります。 - ALG-CMC混合物に1.5重量%セルロースナノファイバーを添加し、印刷に適した所望の粘度に達するために追加の機械的補強を行います。
- オーバーヘッドミキサーを使用して均質になるまでヒドロゲル懸濁液を攪拌する。
注:ヒドロゲルに繊維や気泡が存在してはなりません。 - 印刷用の一次架橋溶液として使用される超純水中に100mM塩化カルシウム(CaCl2)溶液の10mLを調製する。
- 足場の後処理における二次架橋溶液として使用される超純水中の5重量.%CaCl2溶液の10 mLを調製する。
注:一般的に、即時の化学的架橋に適したすべてのヒドロゲル製剤は、中空チューブのワンステップ製造を可能にし、このタイプのコア/シェルセットアップで使用することができます。印刷および架橋メカニズムは、それに応じて最適化する必要があります。ヒドロゲルの粘度は、所望の組成物によって異なります。しかしながら、ポリマー濃度および増粘剤(例えば、ナノファイバー)の添加により調整することができる。安定した構造の3D印刷のための理想的な粘度は押し出されたフィラメントがその形を保持し、足場が架橋する前に自身の重量を保持するのに十分高い。
2. パーフューズ可能な足場のコア/シェル印刷
- 印刷前に、70%のエタノールを十分に噴霧してバイオプリンターを殺菌し、1時間UV光にさらすことを行います。
- バイオプリンタの電源を入れ、3Dプリンターにバンドルされている制御ソフトウェアを実行します。
- ホームアイコンを押して、ホーミング手順を実行します。
- ツールバー コマンド ファイルの使用|G コードをインポートし、生成されたスキャフォールド g コードをインポートします。
- ヒドロゲルを無菌5mLシリンジに移し、3Dプリンターの押出機台紙の1つに入れます。ルアーロックと短いチューブを介して、コア/シェルノズルのサイドルナー入力に接続します。
- 架橋液(100 mM CaCl2)を、付属のG27鈍い端針で別の無菌5 mLシリンジに移し、コア/シェルノズルの上部針ホルダーに挿入します。内側の針は、外側のコア/シェルノズルからわずかに突出する必要があります(~1 mm)。配置を手動で調整します。押し出し台に 2 番目のシリンジを挿入します。
- シリンジをマウントに正しく挿入するには(図 2に示すセットアップ)、A とB と上下矢印をクリックして、両方の押し出し台紙を手動で制御します。
- 印刷を開始する前に、ヒドロゲルと架橋液を別々に押し出して、コア/シェルノズル内のすべての余分な気泡をクリアし、連続的なヒドロゲルの流れを確保します。
- Z矢印と上下矢印を使用して、ノズルと印刷基板の間の距離を手動で調整します。接着性の高い平らなガラス印刷基板を使用することをお勧めします。押出ノズルは、ヒドロゲルの中断のない流れを可能にするために基板と接触してはならない。ノズルと基板(層高さ)の最適な距離は、通常、外側のノズル直径の幅と同じですが、使用される材料と個々の印刷パラメータに調整されます。個々のニーズに応じて、印刷の開始高さを調整します。
- [再生]ボタンを押して印刷プロセスを開始します。
注:実際の足場の印刷が開始される前に均質な中空フィラメントの敷設を確実にするために、足場を囲むスカート(図3)の印刷を含めるのが推奨されます。最適な足場を印刷する意図で最適なヒドロゲル流を達成するために、製剤組成物、架橋液組成、および印刷パラメータ(すなわち、印刷速度、押出圧力、印刷温度、間の距離)基板や押出ノズルなど)。 - 印刷後、印刷された足場で基板を慎重に取り外し、スキャフォールド全体に二次架橋溶液(5 wt.% CaCl2)を注ぎ、足場全体に架橋を確実に行います。室温(RT)で1分間インキュベートします。
注: スキャフォールド全体が架橋ソリューションに沈んでいることを確認します。このステップは、足場の所望の強度特性を達成するために重要ですが、使用される材料と架橋方法によって異なります。 - メスを使用して手動で余分なスカート材料をカットします。
- 紫外線で足場を30分間殺菌し、慎重に足場をひっくり返し、殺菌プロセスを繰り返します。
- 足場を慎重に取り外し、足場をゆっくりと横に引っ張ります。足場が基板に強く付着している場合は、その間に鋭いエッジを挿入して分離します。
- 足場を無色細胞培養培養培養剤(DMEMを5重量%FBS、100 U/mLペニシリンおよび1mg/mLストレプトマイシンで補充)に移し、少なくとも24時間5重量%CO2を含む雰囲気で37°Cでインキュベートする。
3. 内皮細胞の調製と生死アッセイ溶液
- 細胞培養のために、フェノール赤を加えた高度なDMEM細胞培養培地を調製し、5重量%FBSおよび2 mM L-グルタミンでそれを補う。100 U/mL ペニシリンと 1 mg/mL ストレプトマイシンを追加します。
- ヒト臍静脈内皮細胞(HUVEC)ラインを開始し、記載された47に従ってHUVEC培養プロトコルに従ってそれらを通過する。
注:以下に説明するように、白い半透明の足場に細胞を注入する際に簡単な視覚化のためにフェノール赤を加えた細胞培養培養培地で細胞を培養することをお勧めします。 - 細胞計数の場合、細胞培養培養培養中に懸濁した細胞のピペット100μLを0.1重量.%トリパン青色溶液の900 μLで染色する。
- 自動セルカウンターまたは手動ヘモサイトメーターを使用して、懸濁液中の推定数をカウントして取得します。
- 生きた/死んだアッセイのために、無菌PBSで4 mMカルセイン-AMと2 mMプロピジウムヨウ化物の溶液を調製する。
注:生きた/死んだ解決策は、アッセイを行う前に直接準備する必要があります。
4. 足場への細胞の移動
- 細胞培養培養物から足場を取り出し、十分に大きなガラスペトリ皿に移します。
- 足場に細胞を注入する直前に、0.25 wt.%トリプシンによる処理を使用してフラスコからHUVECを解離する。
- 簡単に言えば、細胞培養培養培養を処分し、0.25重量%トリプシン(〜2 mL)で細胞を37°Cで5分間インキュベートする。
- インキュベーション後、トリプシン化細胞に約3mLの細胞培養培養培養培養を加え、すべての剥離細胞を遠心管に移す。
- 細胞を200xgで5分間遠心分離し、上清を処分する。
- 新鮮な細胞培養培養培養培養中の細胞を再中断する。
- 前述のようにセルをカウントします。個々のニーズに応じて総細胞濃度を調整します。本研究では、340,000細胞/mLの開始濃度を用いられる。
- 取り付けられた鈍いG27針で無菌注射器の細胞を再懸濁させる。
- エントリ ポイントを検索し、慎重に足場にセルを注入開始します。半透明の足場を通る細胞懸濁液の流れは目に見えるはずである。足場全体がセルサスペンションで満たされていることを確認します。
- 細胞培養培地に足場を沈め、5重量%CO2を含む雰囲気で37°Cで10日間インキュベートします。
- 実験ニーズに応じて細胞培養培養培養培養剤を補充する。
5. 生きた/死んだアッセイと細胞イメージング
- インキュベーション後、PBSで足場をすすいで下ろします。
- 鈍い端の針を使って、以前に調製したライブ/デッド溶液(PBSで4mM calcein-AMおよび2 mMプロピジウムヨウ化物)を慎重に足場に注入し、37°Cで30分間PBSでインキュベートします。ソリューションがスキャフォールド全体の長さを通って流れていることを確認します。
- PBS で足場をすすいで下ろします。
- 足場をガラススライドに慎重に移します。
- 蛍光顕微鏡下で足場に直接染色した細胞を観察します。
注:生存細胞は緑色蛍光を生成し、死んだ細胞は赤色蛍光灯を放出する。
結果
この研究の目的は、木質杭構造のコア/シェル印刷用のルアー互換性を持つ、製造しやすいコア/シェルノズルを開発することです。さらに、簡単で反復可能なワンステップ印刷プロトコルが説明され、幅広い材料と異なる化学架橋機構を簡単に変更でき、明確に定義され、説得力のある足場を構築します。血管および他の管状組織構造の工学。
コア/シェルノズル
ノズルは、G27の鈍い端針(内側の軸フィラメントを印刷するための)とノズル本体で構成され、針を所定の位置に保持し、材料入力用の接続ポートを備えたシェルフィラメントの外側ノズルを作成します。図 1 に回路図を示します。個々の押出機に置かれ、コアおよび貝材料を提供する2つの5 mLの注射器。チューブはノズル本体をシリンジと接続し、シェル材料を提供します。
コア/シェルノズルとシリンジのセットアップの完全なアセンブリを図 2 に示します。ノズル本体の最初の機能プロトタイプは、ポリオキシメチレン(POM)のブロックを粉砕するCNCによって製造された。要素間の互換性とシールは、G27針とチューブをVitaprintに取り付けることによって試験した。ノズル、ルアーロックコネクタ、または本体と針の間にシェル材料の漏れは認められませんでした。ノズル本体は針ハブ(luerコネクタ)としっかりとフィットし、ノズル全体の動きを押出機と同期させます。
足場の建物
足場を作製する最も簡単なアプローチは、印刷方向が連続する層ごとに変更される層によって材料層を堆積させ、通常は90°の角度で配置することです。ヒドロゲルの粘弾性および吸湿特性のために、印刷された構造の形状の忠実度を保持することは挑戦的なままである。このプロトコルセクションの主な目的は、2つのポリマーを使用したパーフューズブルコア/シェル足場の3Dプリンティングであり、以前に増加したセルロースナノファイバー(NFC)を添加した足場の建物(ALGおよびCMC)に有望な結果を示しました。機械的安定性。ALGおよびCMCはいずれも負に帯電し、水溶性線形共重合体48と共重であり、いずれもカルボキシル基を含有し、これは二体陽イオンの添加と架橋することができる。Ca2+粒子は、2つの官能基を同時に有するイオン結合を形成し、ポリマー鎖間の接続を形成し、ゲル剛性を高める。
パーフューズ可能な足場の印刷
このプロセスの目的は、複数の層にまたがるシンプルな木の杭足場構造を3Dプリントし、完全に架橋されるまでその形状の忠実性と説得力を維持することです。これには、クロスオーバーやリトラクションの動きのないコアとシェルの共押しも必要で、フローを中断する可能性があります。したがって、一般的な CAD モデリングおよびスライス方法はあまり適していません。この研究では、手動で設計されたgコードを使用し、高速gコード準備のためにPythonベースのgコードジェネレータを開発しました。
足場は木の木の格子形で構成され、平らなガラス表面の上に造られた。製作は層ごとに行い、後続層の交差線を前のものに対して90°の角度で堆積した。さらに、後続層はX方向とY方向で2%狭く、先行層による連続フィラメント支持を確保した。フィラメント間の距離(マクロポアサイズ)は、押し出されたフィラメントの外径(0.8mm)とグリッド線間の距離(3mm)を考慮してgコードで正確に設計することができます。
足場は、さらなる検討のための主要な包含基準を満たすために必要とされました。第一に、高さが少なくとも4層の足場は、印刷中に構造的完全性と形状(例えば、マクロポアサイズ)を保持し、さらなる開発の対象となる必要がありました。第二に、足場は37°Cで細胞培養培養剤で7日間インキュベートされた後も、耐噴性(安定なマイクロチャネル)を維持する必要がありました。適切な時間間隔(1、2、5、および7日)で、足場を培養培養物から取り出し、それらがまだ説得可能であるかどうかを調べた。図4Aでは、新たに印刷および後処理された足場の断面は、フィラメント内部に明確に見える中空チャネルを表示する。図4Bでは、37°Cの細胞培養培養培養物中72時間インキュベーション後も、フィラメントが足場全体の長さを通して中空構造を保持していることは明らかである。
いくつかの製剤は、印刷可能であり、構造的に安定したまま、印刷された幾何学を維持し、説得可能なままでした。しかし、さらなる試験(すなわち、3重量%ALG + 3 wt.% CMC + 1.5 wt.% NFC)のために単一の1つが選択され、最大10層のパーフューズ可能な足場の印刷が可能でした。カスタム ノズルを使用した印刷プロセスを図 5Aに示します。コア/シェル印刷は、より少ない粘性製剤で可能でした。しかし、より高い濃度のゲルはノズルを通る連続的な流れを可能にしなかった。一次架橋(コア材料、印刷中に送達される)については、100mMCaCl2が利用され、ノズル内のゲル固化を引き起こすことなく、中空フィラメントの連続形成を十分に安定化させた。ポスト印刷後、足場を5重量%CaCl2溶液に浸し、ヒドロゲルを完全に架け、長期的な形状忠実性を求めた。完成した足場のサンプルを図 5Bに示します。最適化の間、人工色素の製剤のプロセスは、コア溶液に使用され、視覚的な評価を可能にし、押し出されたフィラメントの品質を調べるようにした。染料は、細胞の播種および栽培のために調製された最終足場の製造に使用されなかった。
ライブ/デッドアッセイ
インキュベーション後、生きた/死んだアッセイを使用して、ICを可視化し、インキュベートされた足場内の生きている(緑色)細胞と死んだ(赤)細胞を区別しました。これは、2つの主な目的を果たした:A)足場が細胞に有害な影響を示さずに成長と接着を促進する生体適合性環境を提供するかどうかを決定し、B)管状構造およびその構造の構造的完全性を可視化する。内部チャネル システムの詳細を説明します。
生きた/死んだアッセイの結果を図6に示します。細胞内エステラーゼの存在下で、血漿膜透過性カルセイン-AMはカルセインに変換され、生細胞中の緑色蛍光光を放出する。一方、アポトーシス細胞は、膜不透過性プロピジウムヨウ化物によって可視化され、DNA二重らせんにインターカレーゼーションすると赤色で蛍石が生えます。生きている/死んだイメージおよび足場の明るい分野の写真は中空チャネルの中の細胞を視覚化するのを助けるために結合された。染色液を注入し、48時間足場細胞インキュベーション後に3Dプリント足場で直接行ったアッセイを行った。
この研究は、パーフューズ可能な足場のコア/シェル印刷の概念実証としてのみ役立つため、比較的小さなシード密度のIC(340,000セル/mL)が使用されたことに留意すべきである。生きた/死んだアッセイの最も重要な結論は、48時間後でさえ死んだ細胞(赤色)が観察されず、足場材料自体もその分解産物も毒性効果を示さなかったことを証明した。さらに、ICは実際に付着し、足場の中に付着したままで、チャネル内で成長すると均一に分散凝集体を形成するように見えました。これは、記載された製造方法および足場製剤が、生体内での構築に適したフレームワークを提供することを示唆している。複雑な組織工学は、3つの空間的な次元すべてで細胞とECMの相互作用とタイトな細胞間関を模倣することに加えて、その生存率を維持するために新鮮な培地への一定の細胞暴露を必要とします。これは、連続灌流の下で密なチャネルネットワークによって達成することができ、これは将来の仕事でさらなる調査を保証し、血管系の長期的な組織工学を容易にするために材料および成長変数を最適化する必要がある。

図1:コア/シェルノズルプロトタイプ。(A)ノズル本体プロトタイプの全体的な設計と主なコンポーネントを示します。ノズルは上部を通して鈍い端のG27の針を挿入することによって完了する。上部および下部の針のホルダーは、針を固定し、ノズル軸と再調整し、先端がノズルから中心まで伸びていることを保証する。 ノズルを二次注射器から押し出された「シェル」材料で接続するには、luerロックコネクタを備えたチューブを横入力に取り付けます。ここから、材料は狭いチャネルを通してノズルに転送される。上記のチャネルの製造には、製造後にキャップする必要がある穴を2つの位置で掘削する必要があります)。(B)図示は、挿入されたG27針を持つノズルのクローズアップであり、ノズルから伸びる。この図のより大きなバージョンを表示するには、ここをクリックしてください。
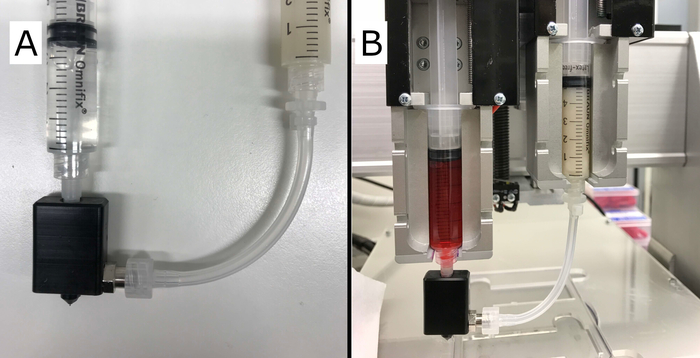
図 2: 最終的なコア/シェルのセットアップ。(A)示すのは、ヒドロゲル(右)を含む正しく取り付けられたシリンジを備えた完成したコア/シェルノズルで、「シェル」と架橋液(左)を「コア」として押し出したものです。(B) 2つの押出機を備えたVitaprintシステムに取り付けられたコア/シェルのセットアップを示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
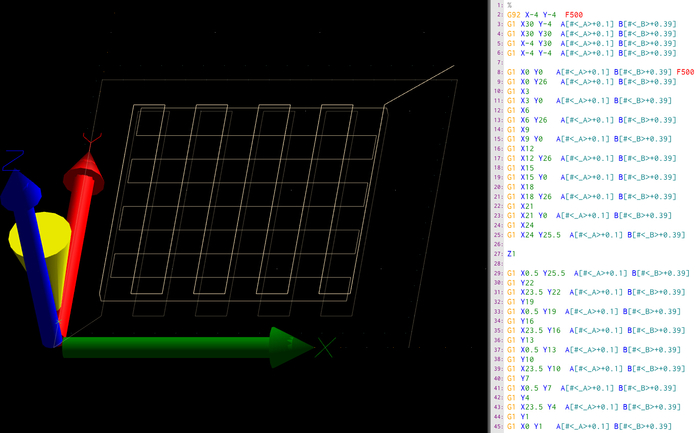
図3:管状足場のGコード。ここでは、プリンタソフトウェアのスクリーンショット、具体的にはパスプレビュー(A)と第1層の生のgコード(B)が表示されます。g コードは、絶対空間方向 (X、Y、Z) のターゲット座標と、相対方向の押し出し (A,B) を持つ一連の命令です。G コマンドは命令のタイプを決定しますが、G1 はターゲット座標に向かって線形移動を表し、G92 は最初の開始位置を決定します。また、以下のコマンドの送り速度は、指示Fをmm/minで決定します。

図4:中空の内部を持つ足場鎖の断面。(A)表示されているのは、新しく印刷され、後処理された足場の断面スライスです。(B)図示は、72時間の細胞培養培養培養培養物でインキュベートされた後の足場の断面スライスである。ノズル形状は、円形の断面を持つチューブの押し出しを定義しますが、フィラメントは堆積時に幾分平坦化されているように見えます。しかし、内部チャネルはそのまま残り、インキュベーション中にその形態を保持します。この図のより大きなバージョンを表示するには、ここをクリックしてください。
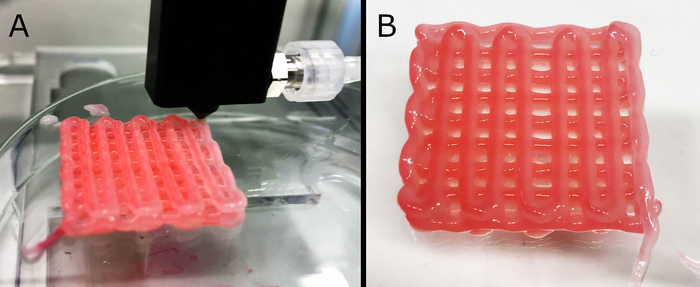
図 5: 足場のコア/シェル印刷。ここで、3層中空管足場及びその最終形態(B)の製造(A)を示す。改善された可視化のために、コア内の架橋溶液を赤色染料で染色した。製剤は足場の安定性を保持するのに十分な機械的安定性を示し、たとえより厚い構造(最大10層、図示されていないデータ)が製造された場合であっても。最終構造の外形寸法は約27mm×27mm×3.5mm。

図6:足場で直接行われる生きた/死んだアッセイ。HUVECの懸濁液を内側の足場チャネルに注入し、48時間インキュベートし、生/死色素で処理した。生存可能なHUVECは、画像の明るいスポットで表される緑色蛍光灯を放出する。死細胞は緑色蛍光灯を発する。ただし、観測された足場には何も表示されません。細胞の分布はまた、チャネルの形状および保持灌流能力を意味する。わずかな程度に、生きている/死んだアッセイ溶液はまた足場材料を染色し、顕微鏡下で光蛍光を作り出した。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ノズル設計
開発されたコア/シェルノズルを使用して、2押出機Vitaprintシステムに統合され、中空、管状足場は、単一ステッププロセスで製造されました。準備された足場のほとんどを通して管壁の均等な厚さを達成するために、針は外側の押出リングの軸の上に中央に置かれる必要がある。標準的なゲージの針は、多くの場合、軸からわずかな、まだ有意な偏心を示します。したがって、ノズル本体は、針を2箇所に保持するように設計され、一番上(ハブを固定)、最終コア/シェルチャンバーの前に1回(カニューレ自体を固定する)、軸方向の位置合わせを補正します。軸線形の精度は、固定点間の距離に伴って増加します。しかし、針の長さと利用可能なノズルチャンバーの容積との間のトレードオフがあります。セットアップの機能をさらに改善するために、ノズルの特定の変更を実装することができます:A)安定性を向上させたノズルマウント、B)針の互換性の広い範囲のための追加のノズル、C)針のための正確な調整機構ノズルの位置決め、およびD)は、その場の材料準備のための追加の入力およびマイクロ流体装置を統合する。
ヒドロゲル最適化
最適な ALG:CMC 比を決定するために、いくつかの材料反復を評価しました。一般に、両方の成分の3重量.%を超える濃度を有するコア/シェル印刷は、連続的なヒドロゲル流を可能にしなかったり、ノズルの詰まりをもたらしたため、不可能とレンダリングされた。具体的には、3重量%を超えるALG濃度が過度に粘度を増加させ、ノズル詰まりをもたらし、ALG濃度の低下とCMC(>3 wt.%)濃度の上昇により、架橋時間が遅くなり、十分な供給ができなかった。足場の構造サポート。コア/シェル印刷は、より少ない粘性製剤で可能でした。しかし、押し出されたゲル粘度は、長期的な形状忠実性を維持するのに十分でなければなりません。最終的に、1:1 ALG:CMC比は、Maver etal.49による以前の研究を確認する最も適した選択であることが証明された。NFCの追加により、コア/シェルプリント足場の印刷性と構造剛性が大幅に向上しましたが、材料の架橋特性に大きな影響を与えはありませんでした。
特定の細胞タイプと実験的なセットアップに最適化されたカスタムアプリケーションは、組成と架橋機構が異なる適切に調整された足場材料を必要とします。本研究で説明する方法は、Ca2+イオンを使用してイオン上でイオン化されたアルギン酸セルロース混合ポリマー溶液に基づいている。アルギネート自体は、(1,4)連結β-d-マンロネート(M)およびα-l-グルロン酸(G)残基のブロックの線形ポリマーであり、Ca2+およびSr2+、Br2+、Mgなどの他の解元陽イオン結合によって可逆的にイオン的に架橋することができる2+.それにもかかわらず、アルギン酸塩の架橋のために最も広く使用されているイオンは、CaCl 2の形でCa2+のままである。Ca2+は、CaSO4または CaCO3の形式でも使用できます。しかし、CaCl2に対するCaSO4の低溶解度は、ゲル化が遅くなることを意味する。 CaCO3は弱く、一貫性のない機械的特性をもたらす可能性があるさらに遅いゲル化時間を生み出します。
通常、ゲル化時間が長いほど均質な構成が生成されますが、コア/シェル印刷などの特定のアプリケーションでは、高速ゲル化率50が必要です。Mg2+イオンもゲル化を誘発します。しかし、その架橋効率はCa2+と比較して約5x-10x低く、2-3 hの架橋時間を持つ。さらに、マグネシウムイオンはグルロン単位に対してより選択的であり、したがって架橋はALG51の化学組成により依存する。この場合、中空構造が崩壊する前に連続的な中空チャネル形成を確保するためには、高速ゲル化速度が不可欠です。CaCl2は中空フィラメントの直接堆積のために重要である最も速いゲル化率を生み出す。100mMCaCl2を利用し、ノズル内のゲル固化を引き起こさずに中空フィラメントの連続形成を十分に安定化させた。
足場の印刷と後処理
1)3Dバイオプリンターを含むすべての溶液および材料が印刷前に適切に殺菌されることを含め、プロセスのこの部分で次の手順を考慮する必要があります。2)ヒドロゲルを調製する場合、連続印刷には材料の均質性が重要です。不純物や気泡の導入は、ノズルを詰まらせたり、押し出しを妨害したりする可能性があるため、避ける必要があります。3)シリンジは、ルアーロック機構を介してコア/シェルノズルに正しく接続し、図2A、Bに見られるように押出機マウントに正しく挿入する必要があります。4)複雑な構造を印刷する前に、コア/シェルノズル内の余分な気泡をクリアし、連続的なヒドロゲルの流れを確保するために、ゲルと架橋液の小さな部分を事前に押し出すことをお勧めします。これは、再現性を向上させるためにgコードに直接組み込むことができます。5)足場自体の印刷が開始される前に均質な中空フィラメントの敷設を確保するために足場を囲むスカートを追加することが有用です。
さらに、6)印刷フィラメントと基板との接着性を向上させるために、良好な接着性を持つ平らな表面(すなわち、ガラススライドまたはペトリ皿)を使用することをお勧めします。7)押出ノズルは、ヒドロゲルの中断のない流れを可能にするために基板と直接接触してはなりません。初期距離は印刷の品質に大きな影響を与えますが、押し出されたフィラメントの厚さは初期設定の近似性が高くなります。8)gコードの開始印刷の高さは、個々のニーズに応じて調整する必要があります。印刷パラメータを最適化した後、スキャフォールド g コードを Planet CNC ソフトウェアにインポートし、プロトコルで説明されているように印刷プロセスを開始する必要があります。9)最適な足場を印刷する意図でヒドロゲルの流れを制御し、最適化するために、製剤組成物と印刷パラメータの両方を変更する必要があります(すなわち、印刷速度、押出圧、印刷温度、基板間の距離と押し出しノズル、層の高さ、足場のサイズなど)。
一般に、より高い粘度を持つ製剤を印刷するには、より高い流量が必要です。前述のように、即時の化学的架橋に適したすべてのヒドロゲル製剤は、中空チューブのワンステップ製造を可能にし、記載されたコア/シェルセットアップで使用してもよい。印刷および架橋メカニズムは、それに応じて最適化する必要があります。印刷後、すべての足場は5 wt.%CaCl2溶液との二次架橋によって後処理され、ALG-CMC成分の完全な架橋を保証し、少なくとも30分間UV光の下で両側から殺菌した。足場を架橋液で完全に巻き込み、架橋プロセスを完了するのに十分な長さのためにインキュベートする必要があります。後処理は、あらかじめ考慮する必要がある材料と架橋機構によって異なります。後処理後、足場を基板から慎重に除去し、細胞培養培地に移し、細胞播種前に少なくとも24時間制御された雰囲気でインキュベートする必要があります。無色の媒体を使用すると、足場への注入中の細胞懸濁液の可視性を向上させます。
ライブ/デッドアッセイ
生きた/死んだ溶液は、漂白しやすい蛍光色素が含まれているため、アッセイを行う前に直接準備し、アッセイを行う前に暗闇の中に保管する必要があります。所望のインキュベーション時間の後、細胞培養培養培養培養物は足場を取り囲んで慎重に廃棄し、PBSですすいでください。理想的には、同じエントリポイントを細胞の播種に使用し、その後に生/死済みアッセイを足場に注入する必要があります。
結果の重要性
ALGとCMCの両方は、既にインビトロで血管新生を促進するために使用されています。ECM模倣機能、物理的な架橋、および生体適合性に基づいて、ALGは一般的に血管新生成長因子(例えば、bFGF、HGF、VEGF164、およびAng-1*)52の送達および制御放出のためのコンポーネントとして採用されている。、53、54。さらに、ゼラチンと組み合わせて、CMCは、生理学的条件下での急速な架橋能力に起因する血管内皮細胞の封入にも用いられている55。NFCは、足場の機械的安定性と形状忠実度をさらに高めるために添加されました。目的は、血管を強化することではなく、コア/シェルの方法で印刷された、機能可能な中空のALG-CMC足場を生産する可能性を実証することではなく、添付性と増殖を促進することを強調する必要があります。ヒューヴェックALG-CMC混合物を使用する選択は、中空チャネルのコア/シェル印刷を可能にする一般的に使用され、簡単にアクセス可能で、生体適合性の基材の所見に基づいていました。他の多くの材料は、血管新生を高めるためのより実行可能なオプションである可能性があります。しかし、一部は、このアプローチで重要である迅速なゲル化/架橋を容易にしないため、コア/シェル印刷には適していません。
開示事項
著者らは、彼らが競合する金銭的利益を持っていないと宣言します。
謝辞
著者らは、スロベニア研究機関(助成番号:P3-0036、I0-0029)と科学教育スポーツ省(助成番号:5442-1/2018/59)から受け取ったこのプロジェクトの財政的支援を認めたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Alginic acid sodium salt | Sigma-Aldrich (Germany) | 180947 | powder; Mw ~80,000 |
| ATTC HUV-EC-C [HUVEC] | LGC Standards (UK) | ATCC-CRL-1730 | Endothelial Cell Growth Supplement (ECGS) and unidentified factors from bovine pituitary, hypothalamus or whole brain extracts are mitogenic for this line; the cells have a life expectancy of 50 to 60 population doublings. |
| Axiovert 40 inverted optical microscope | Carl Zeiss Microscopy GmbH (Germany) | three contrastingtechniques in one objective – e.g. brightfield,phase contrast and PlasDIC | |
| Calcium chloride | Sigma-Aldrich (Germany) | C1016 | anhydrou; granular; ≤7.0 mm; ≥93.0% |
| Cellulose nanofibrils suspension (NFC, 3% (w/v)) | The Process Development Center, University of Maine (Maine, USA) | nominal fiber width of 50 nm; lengths of up to several hundred microns | |
| ELGA Purelab water purification system | Veolia Water Technologies (UK) | ||
| EVOS FL Cell Imaging System | ThermoFisher Scientific Inc. (Germany) | AMF4300 | a fully integrated, digital, inverted imaging system for four-color fluorescence and transmitted-light applications |
| Gibco Advanced Dulbecco’s modified Eagle’s medium (Advance DMEM) | ThermoFisher Scientific Inc. (Germany) | 12491015 | high glucose; no glutamine; phenol red |
| Gibco Dulbecco’s modified Eagle’s medium (DMEM) | ThermoFisher Scientific Inc. (Germany) | 21063029 | high glucose; L-glutamine; HEPES; no phenol red |
| Gibco Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific Inc. (Germany) | 10270106 | FBS origin: Brazil; 5 % (w/v) FBS |
| Hypodermic Sterican needle | B. Braun Melsungen AG (Germany) | 9180117 | 0.40 x 25mm, 27G x 1'' |
| L-glutamine | Sigma-Aldrich (Germany) | G3126 | ReagentPlus®, ≥99% (HPLC) |
| Live/Dead Cell Double Staining Kit | Sigma-Aldrich (Germany) | 4511 | contains calcein-AM and propidium iodide (PI) solutions; suitable for fluorescence |
| Nunc EasYFlask cell culture flasks | ThermoFisher Scientific Inc. (Germany) | 156367 | Nunclon Delta certified for monolayer formation, cloning efficiency, non-cytotoxic, non-pyrogenic, and sterility; filter caps; culture area of 25 cm2 |
| Omnifix syringe | B. Braun Melsungen AG (Germany) | 4617053V | 5 mL Luer Lock |
| Penicillin G sodium salt | Sigma-Aldrich (Germany) | P3032 | powder; BioReagent; suitable for cell culture |
| Phosphate buffered saline | Sigma-Aldrich (Germany) | P4417 | tablet; one tablet dissolved in 200 mL of deionized water yields 0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4, at 25 °C |
| Sodium carboxymethyl cellulose | Sigma-Aldrich (Germany) | 419338 | powder; average Mw ~700,000 |
| Streptomycin sulfate salt | Sigma-Aldrich (Germany) | S9137 | powder; BioReagent; suitable for cell culture |
| Ultra-pure water | Veolia Water Technologies (UK) | 18.2 mΩ cm at 25⁰C | |
| VitaPrint 3D bio-printer | IRNAS (Slovenia) |
参考文献
- Langer, R., Vacanti, J. Advances in tissue engineering. Journal of pediatric surgery. 51 (1), 8-12 (2016).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), (2012).
- Khademhosseini, A., Vacanti, J. P., Langer, R. Progress in tissue engineering. Scientific American. 300 (5), 64-71 (2009).
- Wobma, H., Vunjak-Novakovic, G. Tissue Engineering and Regenerative Medicine 2015: A Year in Review. Tissue Engineering Part B: Reviews. 22 (2), 101-113 (2016).
- Park, K. M., Shin, Y. M., Kim, K., Shin, H. Tissue Engineering and Regenerative Medicine 2017: A Year in Review. Tissue Engineering Part B: Reviews. 24 (5), 327-344 (2018).
- Mattei, G., Giusti, S., Ahluwalia, A. Design criteria for generating physiologically relevant in vitro models in bioreactors. Processes. 2 (3), 548-569 (2014).
- Elliott, N. T., Yuan, F. A review of three‐dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2011).
- Breslin, S., O’Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5-6), 240-249 (2013).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews Drug Discovery. 15 (11), 751-769 (2016).
- Di Nardo, P., Minieri, M., Ahluwalia, A. . Stem Cell Engineering. , 41-59 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments. Journal of the Royal Society Interface. 8 (55), 153-170 (2011).
- Tayalia, P., Mooney, D. J. Controlled growth factor delivery for tissue engineering. Advanced Materials. 21 (3233), 3269-3285 (2009).
- Caddeo, S., Boffito, M., Sartori, S. Tissue Engineering Approaches in the Design of Healthy and Pathological In Vitro Tissue Models. Frontiers in Bioengineering and Biotechnology. 5, 40 (2017).
- Chang, H. -. I., Wang, Y. . Regenerative medicine and tissue engineering-cells and biomaterials. , (2011).
- Rice, J. J., et al. Engineering the regenerative microenvironment with biomaterials. Advanced Healthcare Materials. 2 (1), 57-71 (2013).
- Khademhosseini, A., Langer, R. A decade of progress in tissue engineering. Nature Protocols. 11 (10), 1775-1781 (2016).
- Yu, Y., Alkhawaji, A., Ding, Y., Mei, J. Decellularized scaffolds in regenerative medicine. Oncotarget. 7 (36), 58671-58683 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and bioengineering. 103 (4), 655-663 (2009).
- Lovett, M., Lee, K., Edwards, A., Kaplan, D. L. Vascularization strategies for tissue engineering. Tissue Engineering Part B: Reviews. 15 (3), 353-370 (2009).
- Rouwkema, J., Rivron, N. C., van Blitterswijk, C. A. Vascularization in tissue engineering. Trends in Biotechnology. 26 (8), 434-441 (2008).
- Bae, H., et al. Building vascular networks. Sci Transl Med. 4 (160), (2012).
- Štumberger, G., Vihar, B. Freeform Perfusable Microfluidics Embedded in Hydrogel Matrices. Materials. 11 (12), 2529 (2018).
- Ibrahim, M., Richardson, M. K. Beyond organoids: In vitro vasculogenesis and angiogenesis using cells from mammals and zebrafish. Reproductive Toxicology. 73, 292-311 (2017).
- Sorrell, J. M., Baber, M. A., Caplan, A. I. Influence of adult mesenchymal stem cells on in vitro vascular formation. Tissue Engineering Part A. 15 (7), 1751-1761 (2009).
- Davies, N. H., Schmidt, C., Bezuidenhout, D., Zilla, P. Sustaining neovascularization of a scaffold through staged release of vascular endothelial growth factor-A and platelet-derived growth factor-BB. Tissue Engineering Part A. 18 (1-2), 26-34 (2012).
- Li, X., He, J., Zhang, W., Jiang, N., Li, D. Additive manufacturing of biomedical constructs with biomimetic structural organizations. Materials. 9 (11), 909 (2016).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773 (2014).
- Hasan, A., et al. Microfluidic techniques for development of 3D vascularized tissue. Biomaterials. 35 (26), 7308-7325 (2014).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Advanced Materials. 26 (19), 3124-3130 (2014).
- Huang, Y., Zhang, X. F., Gao, G., Yonezawa, T., Cui, X. 3D bioprinting and the current applications in tissue engineering. Biotechnology Journal. , (2017).
- Wang, X., et al. 3D bioprinting technologies for hard tissue and organ engineering. Materials. 9 (10), 802 (2016).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Rocca, M., Fragasso, A., Liu, W., Heinrich, M. A., Zhang, Y. S. Embedded Multimaterial Extrusion Bioprinting. SLAS Technology. 23 (2), 154-163 (2018).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Huang, S., Yang, Y., Yang, Q., Zhao, Q., Ye, X. Engineered circulatory scaffolds for building cardiac tissue. Journal of Thoracic Disease. 10 (Suppl 20), S2312-S2328 (2018).
- Hoch, E., Tovar, G. E., Borchers, K. Bioprinting of artificial blood vessels: current approaches towards a demanding goal. European Journal of Cardiothoracic Surgery. 46 (5), 767-778 (2014).
- Yeo, M., Lee, J. S., Chun, W., Kim, G. H. An Innovative Collagen-Based Cell-Printing Method for Obtaining Human Adipose Stem Cell-Laden Structures Consisting of Core-Sheath Structures for Tissue Engineering. Biomacromolecules. 17 (4), 1365-1375 (2016).
- Liu, W., et al. Coaxial extrusion bioprinting of 3D microfibrous constructs with cell-favorable gelatin methacryloyl microenvironments. Biofabrication. 10 (2), 024102 (2018).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Akkineni, A. R., Ahlfeld, T., Lode, A., Gelinsky, M. A versatile method for combining different biopolymers in a core/shell fashion by 3D plotting to achieve mechanically robust constructs. Biofabrication. 8 (4), 045001 (2016).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Advanced Materials. 28 (4), 677-684 (2016).
- Kim, G., Ahn, S., Kim, Y., Cho, Y., Chun, W. Coaxial structured collagen–alginate scaffolds: fabrication, physical properties, and biomedical application for skin tissue regeneration. Journal of Materials Chemistry. 21 (17), 6165-6172 (2011).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Mistry, P., et al. Bioprinting Using Mechanically Robust Core-Shell Cell-Laden Hydrogel Strands. Macromolecular Bioscience. 17 (6), (2017).
- Banović, L., Vihar, B. Development of an extruder for open source 3D bioprinting. Journal of Open Hardware. 2 (1), (2018).
- Habib, A., Sathish, V., Mallik, S., Khoda, B. 3D printability of alginate-carboxymethyl cellulose hydrogel. Materials. 11 (3), 454 (2018).
- Maver, T., et al. Combining 3D printing and electrospinning for preparation of pain-relieving wound-dressing materials. Journal of Sol-Gel Science and Technology. , 1-16 (2018).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: Part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Topuz, F., Henke, A., Richtering, W., Groll, J. Magnesium ions and alginate do form hydrogels: a rheological study. Soft Matter. 8 (18), 4877-4881 (2012).
- Perets, A., et al. Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres. Journal of Biomedical Materials Research Part A. 65 (4), 489-497 (2003).
- Ruvinov, E., Leor, J., Cohen, S. The effects of controlled HGF delivery from an affinity-binding alginate biomaterial on angiogenesis and blood perfusion in a hindlimb ischemia model. Biomaterials. 31 (16), 4573-4582 (2010).
- Peirce, S. M., Price, R. J., Skalak, T. C. Spatial and temporal control of angiogenesis and arterialization using focal applications of VEGF164 and Ang-1. American Journal of Physiology-Heart and Circulatory Physiology. 286 (3), H918-H925 (2004).
- Kageyama, T., et al. In situ cross-linkable gelatin-CMC hydrogels designed for rapid engineering of perfusable vasculatures. ACS Biomaterials Science & Engineering. 2 (6), 1059-1066 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved