Method Article
Core/Shell DruckGerüste für Tissue Engineering von Röhrenstrukturen
In diesem Artikel
Zusammenfassung
Präsentiert wird hier ein einfach zu bedienender, Kern-/Schalen-, dreidimensionaler Bioprinting-Aufbau für die einstufige Fertigung von Hohlgerüsten, geeignet für die Gewebetechnik von Gefäß- und anderen Röhrenstrukturen.
Zusammenfassung
Der dreidimensionale (3D) Druck von Kern-/Schalenfilamenten ermöglicht die direkte Herstellung von Kanalstrukturen mit einer stabilen Schale, die an der Schnittstelle mit einem flüssigen Kern vernetzt ist. Letzteres wird nach dem Druck entfernt und hinterlässt ein Hohlrohr. Die Integration einer additiven Fertigungstechnik (wie hier beschrieben mit maßgeschneiderten [Bio]Tinten, die die native extrazelluläre Matrix [ECM] strukturell und biochemisch imitieren) ist ein wichtiger Schritt in Richtung fortschrittlicher Tissue Engineering. Die präzise Fertigung klar definierter Strukturen erfordert jedoch maßgeschneiderte Fertigungsstrategien, die für das verwendete Material optimiert sind. Daher ist es sinnvoll, mit einer Einrichtung zu beginnen, die anpassbar, einfach zu bedienen und mit einem breiten Spektrum von Materialien und Anwendungen kompatibel ist. Diese Arbeit präsentiert eine einfach zu fertigende Kern-/Schalendüse mit Luer-Kompatibilität, um den Kern-/Schalendruck von Holzstapelstrukturen zu erforschen, die mit einer klar definierten, auf Alginat basierenden Gerüstmaterialformulierung getestet wurden.
Einleitung
Das Endziel der Tissue Engineering (TE) ist es wohl, funktionelle Gewebe oder Organe in vitro zu produzieren, die verwendet werden können, um verletzte oder kranke Teile des menschlichen Körpers zu regenerieren oder zu ersetzen1,2,3. Die aktuelle Forschung in tissue engineering (TE) konzentriert sich auf einzelne Aspekte des Feldes (Gerüstmaterialien, Herstellungsverfahren, Zellquellen usw.) 4,5, sowie die Entwicklung einfacher In-vitro-Modelle von Geweben und Organen, die grundlegende Aspekte ihrer In-vivo-Pendants imitieren. Solche Modelle sind bereits für viele Anwendungen nützlich, wie z. B. Arzneimittelscreening und Toxizitätsstudien, insbesondere in Fällen, in denen herkömmliche 2D-Zellkulturen die dynamischen Reaktionen der nativen Gewebe nicht imitieren6,7, 8,9. Dreidimensionale In-vitro-Modelle werden in der Regel durch die Kombination von Zellen10, physikalisch-chemischen Cues11und biologisch aktiven Molekülen12,13 auf Gerüsten, die aus Gerüsten gewonnen werden, dezellularisierte Gewebe oder konstruiert de novo aus biologischen oder biokompatiblen Materialien14,15,16,17,18.
Es ist entscheidend, dass Gerüste die komplexe 3D-Mikroarchitektur und hierarchische Struktur der nativen Gewebe rekapitulieren, um die Funktionalität der technischen Gewebe zu ermöglichen, die für In-vivo-Gewebe19repräsentativ sind. Trotz des bedeutenden technologischen Fortschritts bei TE bleibt die Entwicklung physiologisch relevanter künstlicher Gewebekonstrukte eine Herausforderung. Dicke samt Dicke ( >200 m Dicke) sind aufgrund von Einschränkungen wie Sauerstoff- und Nährstoffdiffusion20besonders problematisch. Fortschritte in Richtung größerer Gewebekonstrukte wurden erzielt; Die erforderliche hohe Nähe der Zellen zu den Blutgefäßen, um Sauerstoff und Nährstoffe zu transportieren und die Abfallentsorgung zu fördern, muss jedoch rekapituliert werden. Die Vaskularisation von Geweben (oder alternativ die Herstellung von miteinander verbundenen 3D-Gefäßnetzwerken innerhalb von Gewebekonstrukten) spielt eine entscheidende Rolle bei der Aufrechterhaltung der Zelllebensfähigkeit und der Förderung von Funktionen von in vitro entwickelten Geweben, was für Modelle in verlängerten Experimenten21,22. Darüber hinaus müssen die erforderliche Auflösung, strukturelle Integrität und gleichzeitige Biokompatibilität noch erreicht werden23.
Mehrere TE-Ansätze wurden vorgeschlagen, um blutgefäßähnliche Strukturen zu konstruieren und die Vaskularisation in vitro zu erleichtern. Einige Beispiele sind die Aussaat von Endothelzellen (auch mit anderen Zelltypen wie Fibroblasten kokultiviert), die sich selbst zusammensetzen, um mikrovaskuläre Netzwerke zu erzeugen24, Verwendung von vaskulären Vorläuferzellen und Pericyten, die Endothelzellen fördern Wachstum21,25, die Abgabe von angiogenen Wachstumsfaktoren, die Vaskularisation induzieren20,26, mit Zellblatt-Technologie, die die Kontrolle über vaskuläre Schichtung ermöglicht20, und hochporöse Gerüststrukturen, die Angiogenese fördern27. Die genannten Ansätze konzentrieren sich auf die Angiogenese-Induktion, die in der Regel erhebliche Mengen an zusätzlichen Wachstumsfaktoren (z. B. VEGF) und Zeit zur Bildung erfordert. Die größten Nachteile sind jedoch ihre begrenzte Reproduzierbarkeit und eingeschränkte räumliche Kontrolle über vaskuläre Musterung, was in der Regel zu einer zufälligen Vaskulaturverteilung innerhalb des Gewebekonstrukts führt, die nicht unbedingt die Durchblutung erleichtert.
Die additive Fertigung (AM, z. B. 3D-Bioprinting) ist zunehmend an der Herstellung von 3D-Konstrukten mit biologischen oder biokompatiblen Materialien beteiligt, um für TE geeignete Gerüste zu erstellen. Mehrere AM-Ansätze werden parallel verwendet und entwickelt (z. B. Ink-Jet- und Mikroextrusions-basierte Methoden, verschiedene Arten von lithographischen Techniken), um Gerüste herzustellen, die natives Gewebe in ihrer Architektur, Biochemie und Funktionalität imitieren. . Die einzelnen Techniken weisen gewisse Vor- und Nachteile auf28, weshalb verschiedene Modifikationen untersucht werden (z.B. Mikromusterung, induzierte Angiogenese usw.), um das Ausmaß zu erhöhen, in dem große, komplexe und stabile Gefäße Netzwerke können hergestellt werden22,29,30.
Unter diesen ist Extrusion Bioprinting die am häufigsten verwendete Methode, vor allem aufgrund der breiten Palette von kompatiblen Materialien (ein allgemein zellfreundliches Verfahren28,31,32) sowie außergewöhnliche Vielseitigkeit in (z.B. Embedded- und Opferdruck23,33, Herstellung von Hohlkonstruktionen34,35, etc.). Die wichtigsten Herausforderungen, die die gegenwärtigen Studien beschäftigen, sind die Übertragung von 2D- auf 3D-Strukturen, die Bildung eines dichten Netzes von Hohlrohren mit hoher räumlicher Auflösung sowie die allgemeine mechanische Integrität und Formtreue während des Flüssigkeitsflusses in der Zellkultur. Bedingungen30.
Der einfachste Ansatz für perfusable Gewebe ist die Herstellung eines miteinander verbundenen Kanalnetzes innerhalb des Konstrukts. Die Schaffung solcher durchlässigen Kanäle innerhalb eines Gewebegerüsts wird viele der oben genannten Probleme lösen, da es sofort eine Nährstoff- und Sauerstoffdiffusion ermöglicht, während Abfallprodukte entfernt werden. Daher wird die potentielle Bildung nekrotischer Regionen innerhalb des Konstrukts vermieden36. Solche Kanäle können zusätzlich mit Endothelzellen (ECs) gesät werden und als künstliche Blutgefäße in 3D-Gewebemodellen37dienen. Im elementarsten Sinne kann ein Gefäß aus einem hohlen Kanal, einer weichen Schicht von ECs und einer steifen Schale bestehen. Kürzlich hat die 3D-Extrusion von zwei verschiedenen Materialien in Kern-/Schalenmode unter Verwendung von koaxialen Nadeln für die Extrusion viel Interesse gewonnen38,39,40,41, da es die Herstellung von Hohlrohre.
Ähnlich wie beim herkömmlichen Mikroextrusions-3D-Druck erfolgt der Kern-/Schalendruck mit einer koaxialen Düse (z.B. zwei Nadeln mit unterschiedlichen Durchmessern, die auf derselben Achse ausgerichtet sind, so dass die breitere Nadel die schmalere umschließt). So können zwei Materialien gleichzeitig extrudiert werden, wobei eines als zentrales Filament oder "innerer" Kern und ein zweites als "äußere" Schale41. Bis heute wurde der koaxiale Bioprinting zur Herstellung von Strukturen mit festen42,Kern/Schale43und Hohlsträngen40,44verwendet; Die verwendeten Materialien wurden jedoch nicht sowohl für die optimale Zelllebensfähigkeit als auch für die mechanische Robustheit der gedruckten Konstrukte optimiert. Wie bereits erwähnt, bietet die Technik die Möglichkeit, Biomaterialien mit unterschiedlichen mechanischen Eigenschaften zu kombinieren, bei denen die steifere die weichere unterstützt. Noch wichtiger ist, wenn das Gerüstmaterial (z. B. Alginat, Carboxymethylcellulose) als Schale extrudiert wird, während der Auslaufstoff aus dem Vernetzungsmittel (z. B. Calciumchlorid) aus der inneren Kapillare abgegeben und dann nach dem Druck ausgespült wird, möglich, ein kontinuierliches Hohlrohr in einem einzigen Schritt zu fertigen45.
Vor diesem Hintergrund wurde eine einfache und wiederholbare Ein-Schritt-Methode entwickelt, um klar definierte und durchlässige Gerüste für die Konstruktion von Gefäßstrukturen und anderen Röhrengeweben zu bauen. Um eine kostengünstige Technologie zu entwickeln, sollte die Fertigung idealerweise ein einstufiger Prozess sein. Daher wurde ein Kern-/Schalenaufbau angepasst und in den 3D-Bioprinter integriert. Die Grundkonstruktion besteht aus einer zentralen Düse aus Metall, um Verformungen während der Injektion zu vermeiden, um die eine zweite Düse mit größerem Durchmesser platziert wird. Ein solcher koaxialer Düsenaufbau ermöglicht die Koextrusion der beiden Strömungen und die sofortige Vernetzung des extrudierten Hydrogelkanals. Dies ermöglicht die direkte Herstellung von mehrschichtigen Hohlfilamenten, während die anschließende Vernetzung mit höheren Calciumchloridkonzentrationen (CaCl2) eine dauerhaftere Stabilisierung von außen gewährleistet.
Als solches ermöglicht dieses Verfahren den gleichzeitigen Druck von Gerüsten und Mikrokanälen, bei denen die hohlen Hydrogelfilamente als Gerüst dienen, um die mechanische Integrität von 3D-Konstrukten zu unterstützen und gleichzeitig als eingebaute Mikrokanäle zu fungieren, um Nährstoffe für das Zellwachstum. Dieses Protokoll bietet ein detailliertes Verfahren der Core/Shell 3D-Bioprinting-Strategie auf der Grundlage einer maßgeschneiderten koaxialen Düse, in der Hydrogel-3D-Strukturen mit eingebauten Kanälen durch Steuerung der Vernetzung zur Herstellung von Hohlfilamenten hergestellt werden. die während der Zellkultur durchfauchbar bleiben.
Der in dieser Arbeit verwendete 3D-Druckaufbau ist wie zuvor von Banovic und Vihar46 beschrieben konfiguriert und kann in drei Hauptkomponenten unterteilt werden: A) eine dreiachsige CNC-Mechanik mit 50 m Positioniergenauigkeit in X-, Y- und Z-Richtung; B) zwei Extruder, angepasst für Einweg-, 5 ml Luer-Lock-Spritzen, mit 1,2 l Voxel-Auflösung; und C) Steuerung von Elektronik und Software.
Um den Kern-/Schalendruck zu erleichtern, wurde eine geeignete Düse entwickelt, die auf einem der Extruder (Primärextruder, Druck des Kerns) montiert werden kann und mit G27-Stumpfendnadeln kompatibel ist. Es hat auch Luer-Lock-Kompatibilität mit dem zweiten Extruder verbinden (Druck der Schale). Die ersten Prototypen wurden entweder durch Einsetzen einer stumpfen G27-Nadel (Innendurchmesser = 210 m, Außendurchmesser = 410 m) in eine G21-Nadel (Innendurchmesser = 510 m, Außendurchmesser = 820 m) oder G20-Konusspitze (Innendurchmesser = 600 m) hergestellt und anschließend eine sekundäre n seitlich das Schalenmaterial zu liefern. Aufgrund einer leichten Biegung der Nadelwelle ist es jedoch nicht möglich, eine Düsenspitze mit konzentrischer Ausrichtung der Innen- und Außennadeln herzustellen.
Um dieses Problem zu lösen, wurde ein neues Düsendesign entwickelt, das die folgenden Kriterien erfüllt: 1) es kann mit einer 3-Achsen-CNC-Fräse hergestellt werden, 2) es kann aus verschiedenen Materialien (Hochleistungskunststoffe, wie PEEK oder Metalle) hergestellt werden, 3) es hat Luer-Lock-Kompatibilität zum Auftragen von Schalenmaterial und 4) ist für eine G27-Stumpf-Endnadel kompatibel und hält sie an zwei Positionen an Ort und Stelle, um die Spitze an der Mittelachse auszurichten. Ein Schaltplan des Düsenprototyps ist in Abbildung 1dargestellt.
Protokoll
1. Herstellung von Hydrogelen und Vernetzungslösungen
- Kurz gesagt, durch kräftiges Mischen, lösen Sie ALG- und CMC-Pulver in reinem Wasser auf, um eine Gesamtlösung von 3 Gew.- und CMC-Lösungen zu erhalten.
ANMERKUNG: Bei dieser Arbeit werden 5 ml Spritzen für den Druck verwendet; somit wird die endgültige Materialmenge an dieses Volumen angepasst. Bei anderen Extrusionspatronen und gedruckten Probengrößen sollte jedoch die Menge des vorbereiteten Materials entsprechend skaliert werden. - Fügen Sie 1,5 Gew. Cellulose-Nanofasern in das ALG-CMC-Gemisch für zusätzliche mechanische Verstärkung hinzu, um die gewünschte Viskosität zu erreichen, die für den Druck geeignet ist.
- Rühren Sie die Hydrogelsuspension bis zur Homogenisierung mit einem Oberleitungsmischer.
HINWEIS: Im Hydrogel sollten keine Fasern oder Blasen vorhanden sein. - Bereiten Sie 10 ml 100 ml Calciumchlorid (CaCl2) Lösung in reinem reinem Wasser vor, die als primäre Vernetzungslösung für den Druck verwendet wird.
- Bereiten Sie 10 ml 5 Gew.% CaCl2 Lösung in reinem Wasser, die als sekundäre Vernetzungslösung in der Nachbearbeitung von Gerüsten verwendet wird.
HINWEIS: Im Allgemeinen ermöglichen alle Hydrogelformulierungen, die für die sofortige chemische Vernetzung geeignet sind, eine einstufige Herstellung von Hohlrohren und können mit dieser Art von Kern-/Schalenaufbau verwendet werden. Die Druck- und Vernetzungsmechanismen müssen entsprechend optimiert werden. Die Viskosität des Hydrogels variiert je nach gewünschter Zusammensetzung; Es kann jedoch mit Polymerkonzentrationen und der Zugabe von Verdickungsmitteln (z.B. Nanofasern) eingestellt werden. Die ideale Viskosität für den 3D-Druck stabiler Strukturen ist hoch genug, damit das extrudierte Filament seine Form behält und das Gerüst vor der Vernetzung sein eigenes Gewicht behält.
2. Kern-/Schalendruck von perfusablegerüsten
- Sterilisieren Sie den Bioprinter vor dem Druck, indem Sie 70% Ethanol gründlich sprühen und 1 H UV-Licht aussetzen.
- Schalten Sie den Bioprinter ein und führen Sie die Steuerungssoftware aus, die in einem Bundle mit dem 3D-Drucker geliefert wird.
- Führen Sie das Homing-Verfahren aus, indem Sie das Home-Symbol drücken.
- Verwenden des Symbolleistenbefehls Datei | Importieren Sie G-Code, importieren Sie den generierten Gerüst-G-Code.
- Übertragen Sie das Hydrogel in eine sterile 5 ml Spritze und legen Sie es in eine der Extruderhalterungen des 3D-Druckers. Über das Luer-Lock und ein kurzes Rohr, verbinden Sie es mit seitlichen Luer-Eingang der Kern/Schalendüse.
- Die Vernetzungslösung (100 mM CaCl2) mit einer angeschlossenen G27-Stumpfendnadel auf eine andere sterile 5 ml Spritze übertragen und in den oberen Nadelhalter der Kern-/Schalendüse einlegen. Die Innennadel sollte leicht aus der äußeren Kern-/Schalendüse herausragen. Passen Sie die Ausrichtung manuell an. Setzen Sie die zweite Spritze in die Extrusionshalterung ein.
- Um die Spritzen korrekt in die Halterungen einzufügen (Einrichtung in Abbildung 2),steuern Sie beide Extrusionshalterungen manuell, indem Sie auf die Pfeile A und B sowie Nach oben und unten klicken.
- Vor Beginn des Druckvorgangs das Hydrogel und die Vernetzungslösung separat extrudieren, um alle überschüssigen Luftblasen in der Kern-/Schalendüse zu löschen und einen kontinuierlichen Hydrogelfluss zu gewährleisten.
- Passen Sie mit den Pfeilen Z und Oben und Nach unten den Abstand zwischen Düse und Drucksubstrat manuell an. Es wird empfohlen, ein flaches, glasbedrucktes Substrat zu verwenden, das eine gute Haftung hat. Die Extrusionsdüse sollte nicht mit dem Substrat in Berührung gebracht werden, um einen unterbrechungsfreien Fluss des Hydrogels zu ermöglichen. Der optimale Abstand zwischen Düse und Substrat (Schichthöhe) ist in der Regel der gleiche wie die Breite des außendüsedurchmessers, wird aber an das verwendete Material und die einzelnen Druckparameter angepasst. Passen Sie die Anfangsdruckhöhe an die individuellen Bedürfnisse an.
- Drücken Sie die Play-Taste, um den Druckvorgang zu starten.
HINWEIS: Es wird empfohlen, den Druck eines Rocks (Abbildung 3) um das Gerüst zu beschränken, um sicherzustellen, dass ein homogenes Hohlfilament verlegt wird, bevor der Druck des eigentlichen Gerüsts beginnt. Um einen optimalen Hydrogelfluss mit der Absicht zu erreichen, optimale Gerüste zu drucken, variieren Sie die Formulierungszusammensetzung, die Vernetzung der Lösungszusammensetzung und Druckparameter (z. B. Druckgeschwindigkeit, Extrusionsdruck, Drucktemperatur, Abstand zwischen Substrat und Extrusionsdüse usw.). - Nach dem Drucken das Substrat mit dem bedruckten Gerüst vorsichtig entfernen und die sekundäre Vernetzungslösung (5 Gew.% CaCl2) über das gesamte Gerüst gießen, um die Vernetzung über das gesamte Gerüst zu gewährleisten. 1 min bei Raumtemperatur (RT) inkubieren.
HINWEIS: Stellen Sie sicher, dass das gesamte Gerüst in der Vernetzungslösung untergetaucht ist. Dieser Schritt ist entscheidend für die Erreichung der gewünschten Festigkeitseigenschaften des Gerüstes, variiert jedoch je nach Material und Vernetzungsmethode. - Mit einem Skalpell manuell schneiden Sie das überschüssige Rockmaterial.
- Sterilisieren Sie die Gerüste unter einem UV-Licht für 30 min. Vorsichtig kippen Sie das Gerüst und wiederholen Sie den Sterilisationsprozess.
- Lösen Sie das Gerüst vorsichtig vom Substrat, indem Sie es vorsichtig seitlich ziehen. Wenn das Gerüst stark am Substrat haftet, trennen Sie es, indem Sie eine scharfe Kante zwischen sie einfügen.
- Übertragen Sie das Gerüst in ein farbloses Zellkulturmedium (DMEM ergänzt mit 5 Gew.% FBS, 100 U/ml Penicillin und 1 mg/ml Streptomycin), und inkubieren Sie es bei 37 °C in einer Atmosphäre mit 5 Gew.%CO2 für mindestens 24 h.
3. Herstellung von Endothelzellen und Lebend/toter Assaylösung
- Für die Zellkultivierung bereiten Sie das fortschrittliche DMEM-Zellkulturmedium mit Zusatz von Phenolrot vor und ergänzen es mit 5 Gew.% FBS und 2 mM L-Glutamin. 100 U/ml Penicillin und 1 mg/ml Streptomycin hinzufügen.
- Initiieren Sie die menschliche Nabelvenen-Endothel-Zell (HUVEC) Linie und durchführen Sie sie in Übereinstimmung mit HUVEC-Kultivierungsprotokollen wiebeschrieben 47.
HINWEIS: Es wird empfohlen, die Zellen in Zellkulturmedien mit zusatz phenolrot für eine einfache Visualisierung während der Injektion der Zellen in weiße transluzente Gerüste zu kultitoren, wie unten beschrieben. - Zur Zellzählung wird die Pipette 100 l der Zellen, die in Zellkulturmedien suspendiert sind, mit einer 900-L-Lösung mit 0,1 Gew.-% Trypan-Blau-Lösung gefärbt.
- Verwenden Sie einen automatisierten Zellzähler oder ein manuelles Hämozytometer, um die geschätzte Anzahl der Zellen in suspension zu zählen und zu erhalten.
- Für den Leben/Toten-Assay eine Lösung von 4 mM Calcein-AM und 2 mM Propidiumjodid in sterilem PBS vorbereiten.
HINWEIS: Die Live/Dead-Lösung sollte direkt vor der Durchführung des Testes vorbereitet werden.
4. Übertragen von Zellen in Gerüste
- Entfernen Sie die Gerüste von den Zellkulturmedien und übertragen Sie sie in eine ausreichend große Glas-Petrischale.
- Unmittelbar vor der Injektion der Zellen in die Gerüste, trennen Sie die HUVECs von den Kolben mit der Behandlung von 0,25 Gew.% Trypsin.
- Kurz gesagt, entsorgen Sie Zellkulturmedien und inkubieren Sie die Zellen mit 0,25 Gew.% Trypsin (ca. 2 ml) für 5 min bei 37 °C.
- Fügen Sie nach der Inkubation den trypsinisierten Zellen 3 ml Zellkulturmedien hinzu und übertragen Sie alle getrennten Zellen in ein Zentrifugenrohr.
- Zentrifugieren Sie die Zellen bei 200 x g für 5 min und entsorgen Sie den Überstand.
- Unterbrechen Sie die Zellen in Denfresh Cell Culture Medien.
- Zählen Sie die Zellen wie zuvor beschrieben. Passen Sie die Gesamtzellenkonzentration an die individuellen Bedürfnisse an. In dieser Arbeit wird eine Anfangskonzentration von 340.000 Zellen/ml verwendet.
- Setzen Sie die Zellen in einer sterilen Spritze mit einer befestigten stumpfen G27-Nadel aus.
- Finden Sie einen Einstiegspunkt und beginnen Sie sorgfältig, Zellen in die Gerüste zu injizieren. Der Zellsuspensionsfluss durch ein lichtdurchlässiges Gerüst sollte sichtbar sein. Stellen Sie sicher, dass sich das gesamte Gerüst mit zelleligem Aufhängung füllt.
- Die Gerüste in Zellkulturmedien untertauchen und bei 37 °C in einer Atmosphäre mit 5 Gew.%CO2 für bis zu 10 Tage bebrüten.
- Füllen Sie die Zellkulturmedien nach experimentellen Bedürfnissen auf.
5. Live/Dead Assay und Zellbildung
- Nach der Inkubation die Gerüste mit PBS abspülen.
- Mit einer stumpfen Endenadel die zuvor vorbereitete Leben/Tot-Lösung (4 mM Calcein-AM und 2 mM Propidiumjodid in PBS) vorsichtig in die Gerüste injizieren und in PBS für 30 min bei 37 °C inkubieren. Stellen Sie sicher, dass die Lösung durch die Länge des gesamten Gerüstes fließt.
- Spülen Sie die Gerüste mit PBS.
- Übertragen Sie die Gerüste vorsichtig auf eine Glasrutsche.
- Beobachten Sie die gefärbten Zellen direkt in den Gerüsten unter einem Fluoreszenzmikroskop.
HINWEIS: Lebensfähige Zellen erzeugen grüne Fluoreszenz und abgestorbene Zellen emittieren rotes Fluoreszenzlicht.
Ergebnisse
Ziel dieser Arbeit war es, eine einfach herzustellende Kern-/Schalendüse mit Luerkompatibilität für den Kern-/Schalendruck von Holzstapelstrukturen zu entwickeln. Darüber hinaus wurde ein einfaches und wiederholbares einstufiges Druckprotokoll beschrieben, das einfach zu modifizieren ist und eine breite Palette von Materialien und verschiedene chemische Vernetzungsmechanismen für den Bau klar definierter und durchsetzbarer Gerüste für Entwicklung von vaskulären und anderen röhrenförmigen Gewebestrukturen.
Kern-/Schalendüse
Die Düse besteht aus einer G27-Stumpfendnadel (zum Bedrucken des inneren Axialfilaments) und dem Düsenkörper, der die Nadel an Ort und Stelle hält und eine Außendüse für das Schalenfilament mit einem Anschlussanschluss für materialinput erzeugt. Ein Schaltplan ist in Abbildung 1dargestellt. Zwei 5 ml Spritzen, die in die einzelnen Extruder gelegt werden und die Kern- und Schalenmaterialien liefern. Schläuche verbinden den Düsenkörper mit der Spritze und liefern das Schalenmaterial.
Die komplette Montage der Kern-/Schalendüse und des Spritzenaufbaus ist in Abbildung 2dargestellt. Der erste funktionale Prototyp des Düsenkörpers wurde durch CNC-Fräsen eines Polyoxymethylenblocks (POM) hergestellt. Die Kompatibilität und Abdichtung zwischen dem Element, einer G27-Nadel und einem Schlauch wurde durch Deninbau in Vitaprint getestet. Es wurde kein Leck des Schalenmaterials in der Düse, im Luer-Lock-Stecker oder zwischen Körper und Nadel beobachtet. Der Düsenkörper passt eng mit der Nadelnabe (Luer-Stecker) und sorgt so für eine synchronisierte Bewegung der gesamten Düse mit dem Extruder.
Gerüstbau
Der einfachste Ansatz bei der Herstellung von Gerüsten besteht darin, Materialien Schicht für Schicht abzulagern, bei dem die Druckrichtung auf jeder aufeinanderfolgenden Schicht geändert wird, in der Regel in einem Winkel von 90°. Aufgrund der viskoelastischen und hygroskopischen Eigenschaften der Hydrogele bleibt die Beibehaltung der Formtreue der bedruckten Strukturen eine Herausforderung. Der Hauptzweck dieses Protokollabschnitts ist der 3D-Druck von perfusablen Kern-/Schalengerüsten mit zwei Polymeren, die zuvor vielversprechende Ergebnisse für gerüstbauliche (ALG und CMC) mit der Zugabe von Cellulose-Nanofasern (NFC) zur mechanische Stabilität. Sowohl ALG als auch CMC sind negativ geladene, wasserlösliche lineare Copolymere48 und enthalten beide Carboxylgruppen, die mit dem Zusatz von divalenten Kationen vernetzt werden können. Ca2+-Partikel bilden ionische Bindungen mit zwei funktionellen Gruppen gleichzeitig, bilden Verbindungen zwischen Polymerketten, wodurch die Gelsteifigkeit erhöht wird.
Drucken von perfusablegerüsten
Ziel dieses Prozesses ist es, einfache Holzstapelgerüststrukturen, die sich über mehrere Schichten erstrecken und ihre Formtreue sowie Durchlässigkeit bis zur Vernetzung behalten, in 3D-Druck zu bedrucken. Dies erfordert sogar eine Koextrusion von Kern und Schale ohne Crossover- oder Rückzugsbewegungen, die den Durchfluss unterbrechen können. Daher sind typische CAD-Modellierungs- und Schneidverfahren weniger geeignet. In dieser Arbeit wird ein manuell entworfener g-Code verwendet und ein pythonbasierter g-Code-Generator für eine schnelle g-Code-Vorbereitung entwickelt.
Die Gerüste wurden in holzgitterweiseform aufgebaut und auf einer flachen Glasoberfläche aufgebaut. Die Fertigung erfolgte Schicht für Schicht und legte die Kreuzungslinien jeder nachfolgenden Schicht in einem Winkel von 90° zur vorherigen Schicht ab. Darüber hinaus war jede nachfolgende Schicht in X- und Y-Richtung um 2 % schmaler, was eine kontinuierliche Filamentunterstützung durch vorhergehende Schichten gewährleistete. Der Abstand zwischen Filamenten (Makroporengröße) kann im g-Code unter Berücksichtigung des Außendurchmessers des extrudierten Filaments (0,8 mm) und des Abstands zwischen Gitternetzlinien (3 mm) exakt ausgelegt werden.
Gerüste mussten wichtige Aufnahmekriterien erfüllen, um sie weiter zu prüfen. Zunächst waren Gerüste mit mindestens 4 Höhenschichten erforderlich, um ihre strukturelle Integrität und Geometrie (z. B. Makroporengröße) während des Drucks beizubehalten, um für die Weiterentwicklung in Frage zu kommen. Zweitens mussten Gerüste auch nach 7 Tagen Inkubation in Zellkulturmedien bei 37 °C durchfauchbar bleiben (stabile Mikrokanäle). In entsprechenden Zeitabständen (1, 2, 5 und 7 Tage) wurden Gerüste aus den Kulturmedien genommen und getestet, ob sie noch durchlässig waren. In Abbildung 4Azeigt der Querschnitt eines frisch bedruckten und nachbearbeiteten Gerüstes einen deutlich sichtbaren Hohlkanal im Inneren des Filaments. In Abbildung 4Bwird deutlich, dass das Filament auch nach 72 h Inkubation in Zellkulturmedien bei 37 °C die Hohlstruktur über die gesamte Gerüstlänge behält.
Mehrere Formulierungen waren druckbar, blieben strukturell stabil, bewahrten die gedruckte Geometrie und blieben durchsetzbar; für weitere Tests wurde jedoch eine einzige ausgewählt (d. h. 3 Gew.% ALG + 3 Gew.% CMC + 1,5 Gew.% NFC), die das Drucken von persiusablen Gerüsten mit bis zu 10 Schichten ermöglichte. Der Druckprozess mit der benutzerdefinierten Düse ist in Abbildung 5Adargestellt. Kern-/Schalendruck war mit weniger viskosen Formulierungen möglich; Gele mit höheren Konzentrationen ließen jedoch keinen kontinuierlichen Fluss durch die Düse zu. Für die primäre Vernetzung (Kernmaterial, während des Drucks geliefert) wurde 100 mM CaCl2 eingesetzt, wodurch die kontinuierliche Bildung eines Hohlfilaments ausreichend stabilisiert wurde, ohne gelverfestigung innerhalb der Düse zu verursachen. Nach dem Druck wurden die Gerüste in einer 5-Gew.% CaCl2-Lösung eingeweicht, um das Hydrogel für eine langfristige Formtreue vollständig zu vernetzen. Eine fertige Gerüstprobe ist in Abbildung 5Babgebildet. Während der Optimierung wurde ein künstlicher Farbstoff in der Kernlösung verwendet, um eine visuelle Auswertung und Untersuchung der Qualität des extrudierten Filaments zu ermöglichen. Der Farbstoff wurde nicht für die Herstellung der letzten Gerüste verwendet, die für die Zellsaatierung und Kultivierung vorbereitet wurden.
Live/dead assay
Nach der Inkubation wurde ein Leben/Toter-Test verwendet, um die ECs zu visualisieren und zwischen den lebenden (grünen) und den toten (roten) Zellen innerhalb des bebrütenden Gerüstes zu unterscheiden. Dies diente zwei Hauptzwecken: A) zu bestimmen, ob die Gerüste eine biokompatible Umgebung bieten, um Wachstum und Haftung zu fördern, ohne schädliche Auswirkungen auf die Zelle zu zeigen, und B) die strukturelle Integrität von Rohrstrukturen und deren internes Kanalsystem im Detail.
Die Ergebnisse des Live/Dead-Assays sind in Abbildung 6dargestellt. In Gegenwart von intrazellulären Esterasen wird die plasmamembrandurchlässige Calcein-AM in Calcein umgewandelt, die grünes Fluoreszenzlicht in lebenden Zellen aussendet. Auf der anderen Seite werden apoptotische Zellen durch membranundurchlässiges Propidiumjodid visualisiert, das rot fluoresziert, wenn es in der DNA-Doppelhelix interkaliert wird. Live/Dead-Bilder und Hellfeldbilder von Gerüsten wurden kombiniert, um die Zellen in den hohlen Kanälen zu visualisieren. Die Färbelösung wurde injiziert und der Assay direkt in den 3D-gedruckten Gerüsten nach Gerüst-Zell-Inkubation für 48 h durchgeführt.
Es sei darauf hingewiesen, dass eine relativ geringe Saatdichte von ECs verwendet wurde (340.000 Zellen/ml), da diese Studie nur als Proof-of-Concept für den Kern-/Schalendruck von perfusablegerüsten diente. Die bedeutendste Schlussfolgerung des Lebens-/Toten-Tests ist, dass auch nach 48 h keine abgestorbenen Zellen (rot) beobachtet wurden, was beweist, dass weder das Gerüstmaterial selbst noch seine Abbauprodukte toxische Wirkungen zeigten. Darüber hinaus hielten und blieben die ECs tatsächlich innerhalb der Gerüste und schienen gleichmäßig verteilte Agglomerate zu bilden, wenn sie innerhalb der Kanäle angebaut wurden. Dies deutet darauf hin, dass die beschriebene Herstellungsmethode und Gerüstformulierung einen geeigneten Rahmen für den Aufbau in vivo, relevanter, röhrenförmiger Gewebemorphologien bieten. Neben der Nachahmung von Zell-ECM-Interaktionen und einer engen Zell-Zell-Kommunikation in allen drei räumlichen Dimensionen erfordert komplexe Gewebetechnik auch eine konstante Zellexposition gegenüber frischem Medium, um ihre Lebensfähigkeit aufrechtzuerhalten. Dies wiederum kann durch ein dichtes Kanalnetz unter kontinuierlicher Perfusion erreicht werden, was eine weitere Untersuchung in zukünftigen Arbeiten rechtfertigt und eine Optimierung der Material- und Wachstumsparameter erfordert, um die langfristige Gewebeentwicklung der Vaskulatur zu erleichtern.

Abbildung 1: Core/Shell-Düse-Prototyp. (A) Das Gesamtdesign und die Hauptkomponenten des Düsenkörperprototyps werden dargestellt. Die Düse wird durch einsetzeneine stumpfe G27-Nadel durch die Oberseite vervollständigt. Die oberen und unteren Nadelhalter immobilisieren und richten die Nadel mit der Düsenachse neu aus, um sicherzustellen, dass sich die Spitze von der Düse durch die Mitte erstreckt. Um die Düse mit "Schalenmaterial" zu verbinden, das aus der Sekundärspritze extrudiert wird, werden Schläuche mit einem Luer-Lock-Stecker am seitlichen Eingang befestigt. Von hier aus wird das Material durch einen schmalen Kanal an die Düse weitergeleitet. Die Herstellung des genannten Kanals erfordert Bohrungen in zwei Positionen, wodurch Löcher entstehen, die nach der Herstellung gedeckelt werden müssen). (B) Gezeigt wird eine Nahaufnahme der Düse mit einer eingesetzten G27-Nadel, die sich aus der Düse ausdehnt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
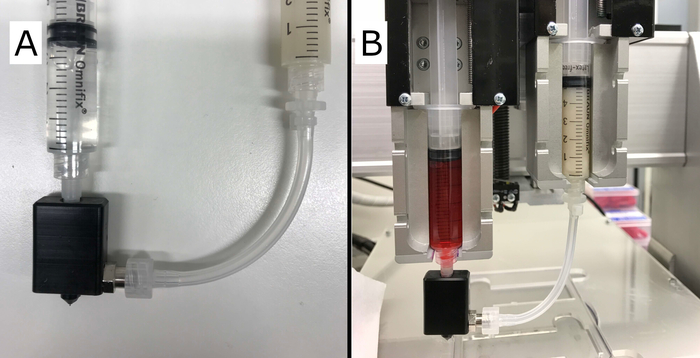
Abbildung 2: Endgültige Kern-/Schaleneinrichtung. (A) Gezeigt wird die fertige Kern-/Schalendüse mit korrekt befestigten Spritzen, die das Hydrogel (rechts) enthalten und die "Schale" und die Vernetzungslösung (links) als "Kern" extrudiert. (B) Gezeigt wird der Kern-/Schalenaufbau, der mit zwei Extrudern in das Vitaprint-System eingebaut ist. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
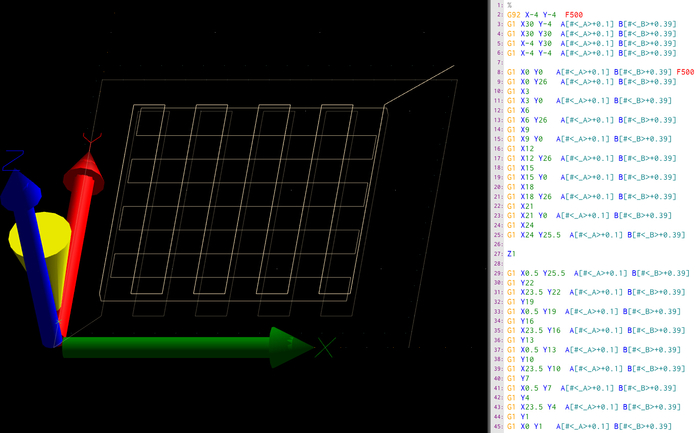
Abbildung 3: G-Code des Rohrgerüsts. Hier wird ein Screenshot der Druckersoftware gezeigt, insbesondere die Pfadvorschau (A) und der rohe g-Code der ersten Ebene (B). Der g-Code ist ein Satz von Anweisungen mit Zielkoordinaten in absoluten räumlichen Richtungen (X, Y, Z) sowie Extrusion (A,B) in relativen Richtungen. Der Befehl G bestimmt den Befehlstyp der Anweisung, während G1 die lineare Bewegung in Richtung der Zielkoordinaten und G92 die Anfangsausgangsposition bestimmt. Darüber hinaus wird die Einspeiserate der folgenden Befehle mit der Anweisung F in mm/min bestimmt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Querschnitt eines Gerüststrangs mit hohlem Innenraum. (A) Gezeigt wird die Querschnittsscheibe des frisch bedruckten und nachbearbeiteten Gerüstes. (B) Gezeigt wird die Querschnittsscheibe des Gerüstes, nachdem sie 72 h lang in Zellkulturmedien inkubiert wurde. Während die Düsenform die Extrusion eines Rohres mit einem runden Querschnitt definiert, scheint das Filament bei der Ablagerung etwas abgeflacht zu sein. Der interne Kanal bleibt jedoch intakt und behält seine Form während der Inkubation. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
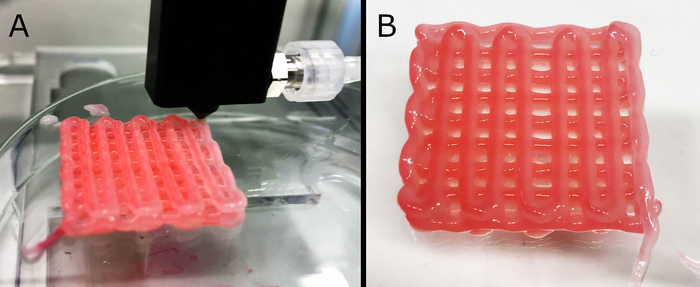
Abbildung 5: Kern-/Schalendruck von Gerüsten. Hier wird die Herstellung (A) eines dreilagigen Hohlrohrgerüsts und seiner endgültigen Form (B) gezeigt. Zur verbesserten Visualisierung wurde die Vernetzungslösung im Kern mit einem roten Farbstoff befleckt. Die Formulierung weist eine ausreichende mechanische Stabilität auf, um die Gerüststabilität zu erhalten, auch wenn dickere Strukturen (bis zu 10 Schichten, nicht dargestellte Daten) hergestellt werden. Die Außenmaße der Endkonstruktion waren ca. 27 mm x 27 mm x 3,5 mm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 6: Live/Dead Assay direkt in den Gerüsten durchgeführt. Eine Suspension von HUVECs wurde in den inneren Gerüstkanal injiziert, für 48 h inkubiert und mit Leben/Totfarbstoff behandelt. Lebensfähige HUVECs emittieren grünes Fluoreszenzlicht, das in den hellen Flecken des Bildes dargestellt wird. Abgestorbene Zellen emittieren grünes Fluoreszenzlicht; jedoch sind keine im beobachteten Gerüst sichtbar. Die Verteilung der Zellen bedeutet auch die Form und die beibehaltenen Perfusionsfähigkeiten der Kanäle. Die Lebende/Tote-Assay-Lösung färbte auch das Gerüstmaterial und erzeugte Lichtfluoreszenz unter dem Mikroskop. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Düsendesign
Mit der entwickelten Kern-/Schalendüse, die in ein Vitaprint-System mit zwei Extrudern integriert ist, wurden hohle, röhrenförmige Gerüste in einem einstufigen Prozess gefertigt. Um eine gleichmäßige Dicke der Rohrwand durch die meisten der vorbereiteten Gerüste zu erreichen, muss die Nadel zentral auf der Achse des äußeren Extrusionsrings positioniert werden. Standardmessnadeln weisen oft eine leichte, aber signifikante Exzentrizität außerhalb der Achse auf. So wurde der Düsenkörper so konzipiert, dass er die Nadel an zwei Stellen hält, einmal an der Spitze (Befestigung der Nabe) und einmal vor der endgültigen Kern-/Schalenkammer (Befestigung der Kanüle selbst), wodurch seine axiale Ausrichtung korrigiert wird. Die Genauigkeit der axialen Ausrichtung erhöht sich mit dem Abstand zwischen dem Fixierungspunkt. Es gibt jedoch einen Kompromiss zwischen Nadellänge und verfügbarm Düsenkammervolumen. Um die Funktionalität des Aufbaus weiter zu verbessern, können bestimmte Modifikationen der Düse implementiert werden: A) eine Düsenhalterung mit verbesserter Stabilität, B) zusätzliche Düsen für eine breitere Palette von Nadelkompatibilität, C) ein präziser Einstellmechanismus für Nadel- Düsenpositionierung und D) integrationen zusätzliche Eingänge und mikrofluidische Geräte für die spontane Materialaufbereitung.
Hydrogel-Optimierung
Um das optimale ALG:CMC-Verhältnis zu bestimmen, wurden mehrere Materialiterationen ausgewertet. Im Allgemeinen wurde der Kern-/Schalendruck mit Konzentrationen über 3 Gew.% beider Komponenten unmöglich gemacht, da er keinen kontinuierlichen Hydrogelfluss zuließ oder zu einer Verstopfung der Düse führte. Insbesondere die ALG-Konzentration über 3 Gew.% erhöhte die Viskosität übermäßig und führte zu einer Verstopfung der Düsen, während niedrigere ALG-Konzentrationen und höhere CMC-Konzentrationen (>3 Gew.%) die Vernetzungszeiten verlangsamten und somit nicht genügend tragwerksütze des Gerüstes. Kern-/Schalendruck war mit weniger viskosen Formulierungen möglich; Extrudierte Gelviskosität muss jedoch ausreichen, um die langfristige Formtreue aufrechtzuerhalten. Am Ende erwies sich ein 1:1 ALG:CMC-Verhältnis als die am besten geeignete Wahl, was eine vorherige Studie von Maver et al.49bestätigt. Die Zugabe von NFC verbesserte die Bedruckbarkeit und strukturelle Steifigkeit von Kern-/Schalengerüsten deutlich, hatte aber keinen signifikanten Einfluss auf die Vernetzungseigenschaften des Materials.
Kundenspezifische Anwendungen, die für bestimmte Zelltypen und experimentelle Aufgelegungoptimiert sind, erfordern gut zugeschnittene Gerüstmaterialien, die in der Zusammensetzung und den Vernetzungsmechanismen variieren. Das in dieser Arbeit beschriebene Verfahren basiert auf einer Alginat-Zellulose-Mischpolymerlösung, die ionisch mit Ca2+-Ionen vernetzt ist. Alginat selbst ist ein lineares Polymer aus Blöcken von (1,4)-verbundenen (M) und -l-Guluronat (G)-Rückständen, die durch Anwendung von Ca2+ und anderen divalenten Kationen wie Sr2+,Br2+reversibel ionisch vernetzt werden können, 2+. Dennoch bleibt das am weitesten verbreitete Ion zur Vernetzung von Alginat Ca2+ in Form von CaCl2. Ca2+ kann auch in Form von CaSO4 oder CaCO3verwendet werden; die geringe Löslichkeit von CaSO4 im Vergleich zu CaCl2 bedeutet jedoch eine langsamere Gelation. CaCO3 liefert noch langsamere Gelationszeiten, die zu schwachen und inkonsistenten mechanischen Eigenschaften führen können.
Längere Gelationszeiten erzeugen in der Regel ein homogeneres Konstrukt, jedoch erfordern bestimmte Anwendungen, wie z. B. Kern-/Schalendruck, schnelle Gelationsraten50. Mg2+ Ionen induzieren auch Gelation; Ihre Vernetzungseffizienz ist jedoch etwa 5x-10x niedriger, im Vergleich zu Ca2+, mit Vernetzungszeiten von 2-3 h. Darüber hinaus sind Magnesiumionen selektiver gegenüber guluronischen Einheiten, daher hängt die Vernetzung mehr von der chemischen Zusammensetzung des ALG51ab. In diesem Fall ist eine schnelle Gelationsrate unerlässlich, um eine kontinuierliche Hohlkanalbildung zu gewährleisten, bevor die Hohlstruktur zusammenbrechen kann. CaCl2 liefert die schnellste Gelationsrate, die für die direkte Abscheidung von Hohlfilamenten entscheidend ist. 100 mM CaCl2 wurde eingesetzt, was die kontinuierliche Bildung eines Hohlfilaments ausreichend stabilisierte, ohne gelverfestigung innerhalb der Düse zu verursachen.
Druck und Nachbearbeitung von Gerüsten
Die folgenden Schritte sollten während dieses Teils des Prozesses berücksichtigt werden, einschließlich 1) um sicherzustellen, dass alle Lösungen und Materialien, einschließlich des 3D-Biodruckers, vor dem Drucken ordnungsgemäß sterilisiert werden. 2) Bei der Herstellung des Hydrogels ist die Homogenität des Materials entscheidend für den kontinuierlichen Druck. Das Einbringen von Verunreinigungen oder Luftblasen sollte vermieden werden, da sie die Düse verstopfen und/oder die Extrusion stören können. 3) Die Spritzen sollten über den Luer-Lock-Mechanismus ordnungsgemäß an die Kern-/Schalendüse angeschlossen und korrekt in die Extruderhalterungen eingesetzt werden, wie in Abbildung 2A,Bzu sehen ist. 4) Vor dem Drucken einer komplexen Struktur wird empfohlen, einen kleinen Teil des Gels und die Vernetzungslösung vorzuextrudieren, um die überschüssigen Luftblasen in der Kern-/Schalendüse zu löschen und einen kontinuierlichen Hydrogelfluss zu gewährleisten. Dies kann direkt in den g-Code integriert werden, um die Wiederholbarkeit zu verbessern. 5) Es ist hilfreich, einen Rock um das Gerüst herum hinzuzufügen, um die Verlegung eines homogenen Hohlfilaments zu gewährleisten, bevor der Druck des Gerüstes selbst beginnt.
Zusätzlich, 6) zur Verbesserung der Haftung zwischen Druckfilament und Substrat, wird empfohlen, eine flache Oberfläche mit guter Haftung (d. h. eine Glasrutsche oder Petrischale) zu verwenden. 7) Die Extrusionsdüse sollte nicht in direktem Kontakt mit dem Substrat stehen, um einen unterbrechungsfreien Fluss des Hydrogels zu ermöglichen. Der anfangse Abstand wirkt sich stark auf die Qualität des Drucks aus, aber die Dicke des extrudierten Filaments ist eine gute Annäherung an die Anfangseinstellung. 8) Die Anfangsdruckhöhe im g-Code sollte an die individuellen Bedürfnisse angepasst werden. Nachdem die Druckparameter optimiert wurden, sollte der Gerüst-G-Code in die Planet CNC-Software importiert und der Druckprozess wie im Protokoll beschrieben gestartet werden. 9) Um den Hydrogelfluss mit der Absicht zu steuern und zu optimieren, um optimale Gerüste zu drucken, sollten sowohl die Formulierungszusammensetzung als auch die Druckparameter variiert werden (d. h. Druckgeschwindigkeit, Extrusionsdruck, Drucktemperatur, Abstand zwischen Substrat und Extrusionsdüse, Schichthöhe, Gerüstgröße usw.).
Im Allgemeinen sind höhere Durchflussraten erforderlich, um Formulierungen mit höherer Viskosität zu drucken. Wie bereits erwähnt, ermöglichen alle Hydrogelformulierungen, die für die sofortige chemische Vernetzung geeignet sind, eine einstufige Fertigung von Hohlrohren und können mit dem beschriebenen Kern-/Schalenaufbau verwendet werden. Die Druck- und Vernetzungsmechanismen müssen entsprechend optimiert werden. Nach dem Druck wurden alle Gerüste durch sekundäre Vernetzung mit 5 Gew.% CaCl2-Lösung nachbearbeitet, die eine vollständige Vernetzung der ALG-CMC-Komponente gewährleistete und von beiden Seiten unter uv-licht für mindestens 30 min sterilisiert wurde. Es sollte sichergestellt werden, dass das Gerüst mit der Vernetzungslösung vollständig verschlungen und lange genug inkubiert wird, um den Vernetzungsprozess abzuschließen. Die Nachbearbeitung unterscheidet sich je nach verwendetem Material und Vernetzungsmechanismus, der vorher in Betracht gezogen werden sollte. Nach der Nachbearbeitung sollten Gerüste sorgfältig vom Substrat entfernt, auf Zellkulturmedien übertragen und in einer kontrollierten Atmosphäre mindestens 24 h vor der Zellaussaat inkubiert werden. Die Verwendung eines farblosen Mediums verbessert die Sichtbarkeit der Zellsuspension während der Injektion in das Gerüst.
Live/dead assay
Die Lebende/Tote Lösung sollte direkt vor der Durchführung des Assays vorbereitet und im Dunkeln gehalten werden, bevor der Test durchgeführt wird, da er Fluoreszenzfarbstoffe enthält, die anfällig für Bleichen sind. Nach der gewünschten Inkubationszeit sollten die Zellkulturmedien sorgfältig um die Gerüste herum entsorgt und mit PBS abspült werden. Idealerweise sollte derselbe Einstiegspunkt für die Zellaussaat verwendet werden, gefolgt von dem Leben/Toten-Assay, der in die Gerüste injiziert wird.
Bedeutung der Ergebnisse
Sowohl ALG als auch CMC wurden bereits verwendet, um Angiogenese in vitro zu fördern. Basierend auf seinen ECM-mimetischen Eigenschaften, physikalischen Vernetzungen und Biokompatibilität wurde ALG häufig als Komponente für die Lieferung und kontrollierte Freisetzung von angiogenen Wachstumsfaktoren (z. B. bFGF, HGF, VEGF164 und Ang-1*) eingesetzt52 ,53,54. Darüber hinaus wurde CMC in Kombination mit Gelatine aufgrund seiner schnellen Vernetzungsfähigkeiten unter physiologischen Bedingungen auch zur Verkapselung von vaskulären Endothelzellen eingesetzt55. NFC wurde hinzugefügt, um die mechanische Stabilität und Formtreue von Gerüsten weiter zu erhöhen. Es sollte betont werden, dass das Ziel nicht darin bestand, die Vaskularisation zu verbessern, sondern die Möglichkeit der Herstellung von durchsetzbaren, hohlen ALG-CMC-Gerüsten zu demonstrieren, die in Kern-/Schalenform gedruckt werden, was auch die Befestigung und Proliferation von HUVECs. Die Wahl der Verwendung eines ALG-CMC-Gemischs basierte auf Erkenntnissen aus häufig verwendeten, leicht zugänglichen und biokompatiblen Grundmaterialien, die den Kern-/Schalendruck von Hohlkanälen ermöglichen könnten. Viele andere Materialien können praktikablere Optionen zur Verbesserung der Angiogenese sein; Einige sind jedoch nicht für den Kern-/Schalendruck geeignet, da sie keine schnelle Gelation/Vernetzung ermöglichen, was bei diesem Ansatz von entscheidender Bedeutung ist.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Die Autoren möchten die finanzielle Unterstützung für dieses Projekt würdigen, die von der slowenischen Forschungsagentur (Fördernummern: P3-0036 und I0-0029) und dem Ministerium für Wissenschaft, Bildung und Sport (Zuschussnummer: 5442-1/2018/59) erhalten wurde.
Materialien
| Name | Company | Catalog Number | Comments |
| Alginic acid sodium salt | Sigma-Aldrich (Germany) | 180947 | powder; Mw ~80,000 |
| ATTC HUV-EC-C [HUVEC] | LGC Standards (UK) | ATCC-CRL-1730 | Endothelial Cell Growth Supplement (ECGS) and unidentified factors from bovine pituitary, hypothalamus or whole brain extracts are mitogenic for this line; the cells have a life expectancy of 50 to 60 population doublings. |
| Axiovert 40 inverted optical microscope | Carl Zeiss Microscopy GmbH (Germany) | three contrastingtechniques in one objective – e.g. brightfield,phase contrast and PlasDIC | |
| Calcium chloride | Sigma-Aldrich (Germany) | C1016 | anhydrou; granular; ≤7.0 mm; ≥93.0% |
| Cellulose nanofibrils suspension (NFC, 3% (w/v)) | The Process Development Center, University of Maine (Maine, USA) | nominal fiber width of 50 nm; lengths of up to several hundred microns | |
| ELGA Purelab water purification system | Veolia Water Technologies (UK) | ||
| EVOS FL Cell Imaging System | ThermoFisher Scientific Inc. (Germany) | AMF4300 | a fully integrated, digital, inverted imaging system for four-color fluorescence and transmitted-light applications |
| Gibco Advanced Dulbecco’s modified Eagle’s medium (Advance DMEM) | ThermoFisher Scientific Inc. (Germany) | 12491015 | high glucose; no glutamine; phenol red |
| Gibco Dulbecco’s modified Eagle’s medium (DMEM) | ThermoFisher Scientific Inc. (Germany) | 21063029 | high glucose; L-glutamine; HEPES; no phenol red |
| Gibco Fetal Bovine Serum (FBS), qualified | ThermoFisher Scientific Inc. (Germany) | 10270106 | FBS origin: Brazil; 5 % (w/v) FBS |
| Hypodermic Sterican needle | B. Braun Melsungen AG (Germany) | 9180117 | 0.40 x 25mm, 27G x 1'' |
| L-glutamine | Sigma-Aldrich (Germany) | G3126 | ReagentPlus®, ≥99% (HPLC) |
| Live/Dead Cell Double Staining Kit | Sigma-Aldrich (Germany) | 4511 | contains calcein-AM and propidium iodide (PI) solutions; suitable for fluorescence |
| Nunc EasYFlask cell culture flasks | ThermoFisher Scientific Inc. (Germany) | 156367 | Nunclon Delta certified for monolayer formation, cloning efficiency, non-cytotoxic, non-pyrogenic, and sterility; filter caps; culture area of 25 cm2 |
| Omnifix syringe | B. Braun Melsungen AG (Germany) | 4617053V | 5 mL Luer Lock |
| Penicillin G sodium salt | Sigma-Aldrich (Germany) | P3032 | powder; BioReagent; suitable for cell culture |
| Phosphate buffered saline | Sigma-Aldrich (Germany) | P4417 | tablet; one tablet dissolved in 200 mL of deionized water yields 0.01 M phosphate buffer, 0.0027 M potassium chloride and 0.137 M sodium chloride, pH 7.4, at 25 °C |
| Sodium carboxymethyl cellulose | Sigma-Aldrich (Germany) | 419338 | powder; average Mw ~700,000 |
| Streptomycin sulfate salt | Sigma-Aldrich (Germany) | S9137 | powder; BioReagent; suitable for cell culture |
| Ultra-pure water | Veolia Water Technologies (UK) | 18.2 mΩ cm at 25⁰C | |
| VitaPrint 3D bio-printer | IRNAS (Slovenia) |
Referenzen
- Langer, R., Vacanti, J. Advances in tissue engineering. Journal of pediatric surgery. 51 (1), 8-12 (2016).
- Atala, A., Kasper, F. K., Mikos, A. G. Engineering complex tissues. Science Translational Medicine. 4 (160), (2012).
- Khademhosseini, A., Vacanti, J. P., Langer, R. Progress in tissue engineering. Scientific American. 300 (5), 64-71 (2009).
- Wobma, H., Vunjak-Novakovic, G. Tissue Engineering and Regenerative Medicine 2015: A Year in Review. Tissue Engineering Part B: Reviews. 22 (2), 101-113 (2016).
- Park, K. M., Shin, Y. M., Kim, K., Shin, H. Tissue Engineering and Regenerative Medicine 2017: A Year in Review. Tissue Engineering Part B: Reviews. 24 (5), 327-344 (2018).
- Mattei, G., Giusti, S., Ahluwalia, A. Design criteria for generating physiologically relevant in vitro models in bioreactors. Processes. 2 (3), 548-569 (2014).
- Elliott, N. T., Yuan, F. A review of three‐dimensional in vitro tissue models for drug discovery and transport studies. Journal of Pharmaceutical Sciences. 100 (1), 59-74 (2011).
- Breslin, S., O’Driscoll, L. Three-dimensional cell culture: the missing link in drug discovery. Drug Discovery Today. 18 (5-6), 240-249 (2013).
- Edmondson, R., Broglie, J. J., Adcock, A. F., Yang, L. Three-dimensional cell culture systems and their applications in drug discovery and cell-based biosensors. Assay and Drug Development Technologies. 12 (4), 207-218 (2014).
- Horvath, P., et al. Screening out irrelevant cell-based models of disease. Nature Reviews Drug Discovery. 15 (11), 751-769 (2016).
- Di Nardo, P., Minieri, M., Ahluwalia, A. . Stem Cell Engineering. , 41-59 (2011).
- Lee, K., Silva, E. A., Mooney, D. J. Growth factor delivery-based tissue engineering: general approaches and a review of recent developments. Journal of the Royal Society Interface. 8 (55), 153-170 (2011).
- Tayalia, P., Mooney, D. J. Controlled growth factor delivery for tissue engineering. Advanced Materials. 21 (3233), 3269-3285 (2009).
- Caddeo, S., Boffito, M., Sartori, S. Tissue Engineering Approaches in the Design of Healthy and Pathological In Vitro Tissue Models. Frontiers in Bioengineering and Biotechnology. 5, 40 (2017).
- Chang, H. -. I., Wang, Y. . Regenerative medicine and tissue engineering-cells and biomaterials. , (2011).
- Rice, J. J., et al. Engineering the regenerative microenvironment with biomaterials. Advanced Healthcare Materials. 2 (1), 57-71 (2013).
- Khademhosseini, A., Langer, R. A decade of progress in tissue engineering. Nature Protocols. 11 (10), 1775-1781 (2016).
- Yu, Y., Alkhawaji, A., Ding, Y., Mei, J. Decellularized scaffolds in regenerative medicine. Oncotarget. 7 (36), 58671-58683 (2016).
- Tibbitt, M. W., Anseth, K. S. Hydrogels as extracellular matrix mimics for 3D cell culture. Biotechnology and bioengineering. 103 (4), 655-663 (2009).
- Lovett, M., Lee, K., Edwards, A., Kaplan, D. L. Vascularization strategies for tissue engineering. Tissue Engineering Part B: Reviews. 15 (3), 353-370 (2009).
- Rouwkema, J., Rivron, N. C., van Blitterswijk, C. A. Vascularization in tissue engineering. Trends in Biotechnology. 26 (8), 434-441 (2008).
- Bae, H., et al. Building vascular networks. Sci Transl Med. 4 (160), (2012).
- Štumberger, G., Vihar, B. Freeform Perfusable Microfluidics Embedded in Hydrogel Matrices. Materials. 11 (12), 2529 (2018).
- Ibrahim, M., Richardson, M. K. Beyond organoids: In vitro vasculogenesis and angiogenesis using cells from mammals and zebrafish. Reproductive Toxicology. 73, 292-311 (2017).
- Sorrell, J. M., Baber, M. A., Caplan, A. I. Influence of adult mesenchymal stem cells on in vitro vascular formation. Tissue Engineering Part A. 15 (7), 1751-1761 (2009).
- Davies, N. H., Schmidt, C., Bezuidenhout, D., Zilla, P. Sustaining neovascularization of a scaffold through staged release of vascular endothelial growth factor-A and platelet-derived growth factor-BB. Tissue Engineering Part A. 18 (1-2), 26-34 (2012).
- Li, X., He, J., Zhang, W., Jiang, N., Li, D. Additive manufacturing of biomedical constructs with biomimetic structural organizations. Materials. 9 (11), 909 (2016).
- Murphy, S. V., Atala, A. 3D bioprinting of tissues and organs. Nature Biotechnology. 32 (8), 773 (2014).
- Hasan, A., et al. Microfluidic techniques for development of 3D vascularized tissue. Biomaterials. 35 (26), 7308-7325 (2014).
- Kolesky, D. B., et al. 3D bioprinting of vascularized, heterogeneous cell-laden tissue constructs. Advanced Materials. 26 (19), 3124-3130 (2014).
- Huang, Y., Zhang, X. F., Gao, G., Yonezawa, T., Cui, X. 3D bioprinting and the current applications in tissue engineering. Biotechnology Journal. , (2017).
- Wang, X., et al. 3D bioprinting technologies for hard tissue and organ engineering. Materials. 9 (10), 802 (2016).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Rocca, M., Fragasso, A., Liu, W., Heinrich, M. A., Zhang, Y. S. Embedded Multimaterial Extrusion Bioprinting. SLAS Technology. 23 (2), 154-163 (2018).
- Hinton, T. J., et al. Three-dimensional printing of complex biological structures by freeform reversible embedding of suspended hydrogels. Science Advances. 1 (9), e1500758 (2015).
- Huang, S., Yang, Y., Yang, Q., Zhao, Q., Ye, X. Engineered circulatory scaffolds for building cardiac tissue. Journal of Thoracic Disease. 10 (Suppl 20), S2312-S2328 (2018).
- Hoch, E., Tovar, G. E., Borchers, K. Bioprinting of artificial blood vessels: current approaches towards a demanding goal. European Journal of Cardiothoracic Surgery. 46 (5), 767-778 (2014).
- Yeo, M., Lee, J. S., Chun, W., Kim, G. H. An Innovative Collagen-Based Cell-Printing Method for Obtaining Human Adipose Stem Cell-Laden Structures Consisting of Core-Sheath Structures for Tissue Engineering. Biomacromolecules. 17 (4), 1365-1375 (2016).
- Liu, W., et al. Coaxial extrusion bioprinting of 3D microfibrous constructs with cell-favorable gelatin methacryloyl microenvironments. Biofabrication. 10 (2), 024102 (2018).
- Gao, Q., He, Y., Fu, J. Z., Liu, A., Ma, L. Coaxial nozzle-assisted 3D bioprinting with built-in microchannels for nutrients delivery. Biomaterials. 61, 203-215 (2015).
- Akkineni, A. R., Ahlfeld, T., Lode, A., Gelinsky, M. A versatile method for combining different biopolymers in a core/shell fashion by 3D plotting to achieve mechanically robust constructs. Biofabrication. 8 (4), 045001 (2016).
- Colosi, C., et al. Microfluidic Bioprinting of Heterogeneous 3D Tissue Constructs Using Low-Viscosity Bioink. Advanced Materials. 28 (4), 677-684 (2016).
- Kim, G., Ahn, S., Kim, Y., Cho, Y., Chun, W. Coaxial structured collagen–alginate scaffolds: fabrication, physical properties, and biomedical application for skin tissue regeneration. Journal of Materials Chemistry. 21 (17), 6165-6172 (2011).
- Luo, Y., Lode, A., Gelinsky, M. Direct plotting of three-dimensional hollow fiber scaffolds based on concentrated alginate pastes for tissue engineering. Advanced Healthcare Materials. 2 (6), 777-783 (2013).
- Mistry, P., et al. Bioprinting Using Mechanically Robust Core-Shell Cell-Laden Hydrogel Strands. Macromolecular Bioscience. 17 (6), (2017).
- Banović, L., Vihar, B. Development of an extruder for open source 3D bioprinting. Journal of Open Hardware. 2 (1), (2018).
- Habib, A., Sathish, V., Mallik, S., Khoda, B. 3D printability of alginate-carboxymethyl cellulose hydrogel. Materials. 11 (3), 454 (2018).
- Maver, T., et al. Combining 3D printing and electrospinning for preparation of pain-relieving wound-dressing materials. Journal of Sol-Gel Science and Technology. , 1-16 (2018).
- Kuo, C. K., Ma, P. X. Ionically crosslinked alginate hydrogels as scaffolds for tissue engineering: Part 1. Structure, gelation rate and mechanical properties. Biomaterials. 22 (6), 511-521 (2001).
- Topuz, F., Henke, A., Richtering, W., Groll, J. Magnesium ions and alginate do form hydrogels: a rheological study. Soft Matter. 8 (18), 4877-4881 (2012).
- Perets, A., et al. Enhancing the vascularization of three-dimensional porous alginate scaffolds by incorporating controlled release basic fibroblast growth factor microspheres. Journal of Biomedical Materials Research Part A. 65 (4), 489-497 (2003).
- Ruvinov, E., Leor, J., Cohen, S. The effects of controlled HGF delivery from an affinity-binding alginate biomaterial on angiogenesis and blood perfusion in a hindlimb ischemia model. Biomaterials. 31 (16), 4573-4582 (2010).
- Peirce, S. M., Price, R. J., Skalak, T. C. Spatial and temporal control of angiogenesis and arterialization using focal applications of VEGF164 and Ang-1. American Journal of Physiology-Heart and Circulatory Physiology. 286 (3), H918-H925 (2004).
- Kageyama, T., et al. In situ cross-linkable gelatin-CMC hydrogels designed for rapid engineering of perfusable vasculatures. ACS Biomaterials Science & Engineering. 2 (6), 1059-1066 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten