Method Article
ウイルス感染のライブイメージングと定量化のためのルシフェラーゼ蛍光レポーターインフルエンザウイルス
要約
インフルエンザA型ウイルス(IAV)は、毎年の流行や時折のパンデミックを引き起こす伝染性呼吸器病原体です。ここでは、新規組換えルシフェラーゼおよび蛍光発現バイレポーターIAV(BIRFLU)を用いて生体内のウイルス感染を追跡するプロトコルについて説明する。このアプローチは、研究者に生体内でIAVを研究するための優れたツールを提供します。
要約
インフルエンザA型ウイルス(IAV)は、健康と経済的に重大な影響を伴うヒト呼吸器疾患を引き起こす。他のウイルスと同様に、IAVを研究するには、感染細胞および/または感染の動物モデルにおけるウイルスの存在を検出するために、面倒な二次的アプローチを使用する必要があります。この制限は、容易に追跡可能な蛍光または生物発光(ルシフェラーゼ)レポータータンパク質を発現する組換えIAVの生成によって最近回避されている。しかし、研究者は、外来配列を含むIAVゲノムの制限容量のために蛍光またはルシフェラーゼレポーター遺伝子を選択することを余儀なくされています。この制限を克服するために、我々は、インビトロおよびインビボでのIAV感染を容易に追跡するために、蛍光およびルシフェラーゼレポーター遺伝子の両方を安定的に発現する組換え複製有能なバイレポーターIAV(BIRFLU)を生成した。この目的のために、インフルエンザA/プエルトリコ/8/34 H1N1(PR8)のウイルス非構造(NS)およびヘマグルチニン(HA)ウイルスセグメントを、蛍光金星および生物発光ナノルシフェラーゼタンパク質をそれぞれコードするように修飾した。ここでは、IAV感染のマウスモデルにおけるBIRFLUの使用と、インビボイメージングシステムを用いて両レポーター遺伝子の検出について説明する。特に、レポーターとウイルス複製の両方の表現との間に良好な相関関係が見られた。分子生物学、動物研究、イメージング技術の最先端技術の組み合わせは、ウイルス宿主の相互作用とダイナミクスの研究を含むインフルエンザ研究のためにこのツールを使用するユニークな機会を研究者に提供します。ウイルス感染。重要なことは、異なるウイルスセグメントから2つの外来遺伝子を発現させるためにウイルスゲノムを遺伝的に改変する可能性は、(i)新規IAVワクチンの開発、(ii)組換えIAVの生成にこのアプローチを使用する機会を開きます。他のヒト病原体感染症の治療のためのワクチンベクターとして使用することができる。
概要
インフルエンザA型ウイルス(IAV)は、オルソミキソビリダ科1、2、3の封入された一本鎖陰性陰性セグメントRNAウイルスである。世界保健機関(WHO)は、年間3~500万人のインフルエンザ患者と、世界で25万人以上のインフルエンザによる死亡者数を推定しています 4,5,6.特にインフルエンザに対して脆弱なグループには、高齢者、免疫不全者、および小児7、8、9、10、11が含まれる。ワクチンは利用可能であり、ウイルス感染に対する最も一般的かつ効果的な介入を表すが、IAVは急速に進化し、既存の免疫3、12、13を脱出することができる。14歳,15.2009年のパンデミックH1N1株の再出現と病原性IAVの出現は、世界中の人間の公衆衛生に対する絶え間ない脅威を繰り返し述べています 4,16.
流行やパンデミックの間に、新たに単離されたウイルスの病原性と透過性を迅速に決定することが重要です。ウイルスを検出するための現在利用可能な技術は時間がかかり、時にはこれらの分析の完了を遅らせることができる面倒なアプローチの使用を必要とします17,18,19,20.さらに、現在のウイルスアッセイはスケールアップが困難であり、発生時に必要になる可能性があります。最後に、マウス、モルモット、フェレットなどの感染の検証済み動物モデルの使用は日常的に使用され、インフルエンザ感染、免疫応答、および新しいワクチンおよび/または抗ウイルス薬の有効性を研究する上で不可欠です。しかし、これらのモデルは、リアルタイムでウイルスのダイナミクスを観察することができないため、制限されています。これは、ウイルス感染の静的イメージングに研究を制限します21,22,23,24,25.これらのアッセイで使用される動物はまた、ウイルス負荷を決定するために安楽死させ、したがって、これらの研究を完了するために必要な動物の数を増加させる26。これらすべての制限を回避するために、多くの研究者は、組換え複製能力のあるレポーター発現IAVの使用に依存しており、ウイルス学的アッセイを加速し、リアルタイムで生体内のウイルス負荷と普及を検出することができます26 ,27,28,29,30,31,32,33,34,35 ,36,37,38,39,40,41.重要なことに、これらのレポーター発現IAVは、細胞培養および感染33、42の動物モデルにおいて野生型(WT)IAVと同様に複製することができる。
蛍光タンパク質と生物発光タンパク質は、その感度、安定性、使いやすさのために研究者が一般的に使用する2つのレポーターシステムです。また、蛍光および生物発光タンパク質検出技術43、44、45、46、47、48に多大な支持と進歩があります。.蛍光タンパク質とルシフェラーゼは、それらが発光することを可能にする異なる特性を有し、特に励起状態が生成される方法と発光が検出される方法が異なり、43、44、45、 46、47、48。蛍光タンパク質は、まずエネルギーを吸収することによって励起され、その後、分子が低エネルギー状態に減少するにつれて、異なる波長で光として放出される43。一方、生物発光は、光45を生成するために基板、酸素、および時にはATPを含む化学的興奮反応に由来する。これら2種類のレポータータンパク質の特性が異なるため、目的の研究に応じて他方よりも有利な可能性があります。蛍光タンパク質は細胞の局在化28、41を観察するために広く使用されているが、生体内シグナルは強度が不十分であり、生組織49における自己蛍光によってしばしば隠されている。したがって、研究者は、生体中のウイルスダイナミクスを評価するためにルシフェラーゼに依存しているが、蛍光タンパク質は、ex vivo研究50、51、52、53に好ましい。蛍光タンパク質とは異なり、ルシフェラーゼは生体内研究に適しており、非侵襲的アプローチ26、27、28、29、30でより適用可能です。,31歳,32歳,33歳,34歳,35歳,36歳,37歳,38歳,39歳,40歳,41歳,54.最終的には、研究の種類に基づいて、研究者は、蛍光またはルシフェラーゼレポータータンパク質を読み出しとして使用するか、機能性と感度のトレードオフに彼らの研究を対象とし、厳しく選択する必要があります。組換えレポーターウイルスの有用性を制限します。また、蛍光またはルシフェラーゼ系を用いた異なるレポーター遺伝子の発現とウイルス複製または普及との相関関係に関する懸念があり、得られたデータの解釈を危険にさらす可能性がある。レポーター表現IAV。
我々は、同じウイルスゲノム55内の蛍光およびルシフェラーゼタンパク質の両方にコードする組換え複製有能なバイレポーターIAV(BIRFLU)を生成することによって、この制限を克服した(図1)。ここでは、小さくて明るい生物発光タンパク質であるNanoLucルシフェラーゼ(Nluc)は、インフルエンザA/プエルトリコ/08/1934 H1N1(PR8)24、33、インフルエンザA/プエルトリコのウイルスHAセグメントにヘマグルチニン(HA)配列の上流に挿入された。 40、55、56、57.加えて、頻繁に使用される単光蛍光タンパク質である金星は、非構造(NS)ウイルスセグメント32、33、36、41、55に挿入した。BIRFLUは蛍光およびルシフェラーゼレポーター遺伝子の両方にコードするので、レポータータンパク質シグナルのいずれかを読み出しとして使用して、インビトロまたはインビボ55におけるウイルス複製および普及を決定することができる。BIRFLUの生成とインビトロまたはインビボ特性に関する追加情報は、最近の出版物55で見つけることができます。BIRFLUは、新規蛍光および生物発光系微小中和アッセイ55を介して抗ウイルス薬または中和抗体の有効性を試験するために使用することができる。さらに、BIRFLUは、感染55のマウスモデルにおけるウイルスダイナミクスを評価するためにも使用することができる。本原稿では、VIVFLU55をインビトロで特徴付ける手順と、生体内またはヴィーナスex vivoにおけるNlucの検出のための生体内発光イメージングシステムを用いたマウスにおけるBIRFLU感染の研究方法について述べた。
分子生物学、動物研究、イメージング技術の最先端の技術の組み合わせは、ウイルス宿主相互作用、ウイルス感染のダイナミクスの研究を含むIAV研究のためにBIRFLUを使用するユニークな機会をもたらします。IAV感染症の治療治療または他の病原体感染症の治療のためのワクチンベクターとしてのIAVの潜在的な使用のための新しいワクチンアプローチの開発。
プロトコル
マウスを含むすべてのプロトコルは、ロチェスター大学医学部の機関動物ケアおよび使用委員会(IACUC)および機関バイオセーフティ委員会(IBC)によって承認されています。動物で行われるすべての実験は、国立研究評議会58の実験動物のケアと使用のためのガイドの勧告に従います。ロチェスター大学医学部のビバリウムと実験動物医学施設部門は、ラボアニマルケア(AALAC)インターナショナルの評価と認定のための協会によって認定され、連邦法および州法および国立衛生研究所(NIH)の方針に準拠しています。マウスを使用する場合は、適切なパーソナルプロテクション機器(PPE)が必要です。同様の方針と要件は、各機関でこの原稿の中で概説された実験を行う際に実施されるべきである。
1. 小さな脊椎動物の使用
- 5~7週齢の雌BALB/cマウスを購入し、特定の病原体のない条件下で動物ケア施設でそれらを維持します。決定された施設にマウスが到着すると、動物が新しい環境に順応できるように、4~5日間の休息期間を許可する。
- IACUC プロトコルに従って、ケージごとに最大 5 匹のマウスを配置します。
注:実験の結論では、動物が死んでいることを確実にするために、マウスは2番目の方法が物理的な方法でなければならないことを考慮して、2つの承認された手順を使用して安楽死させた。本研究では、BIRFLUおよびインビボイメージングにおけるマウス感染後、動物は2,2,2-トリブロモエタノール(TBE)の致死用量で安楽死させ、かつ前述したように物理的な二次的方法として肝静脈を切断することによって23を示した。
2. バイオセーフティ
注:この原稿では、BIRFLUは、一般的なマウス適応実験室IAV株23、32、33、56であるインフルエンザA/プエルトリコ/08/34 H1N1(PR8)のバックボーンで生成された。このウイルスは、前述のプラスミドベースの逆遺伝学アプローチと生成の完全な説明を用いて生成され、およびBIRFLUのインビトロおよびインビボ特性解析は、我々の最近の出版物55で見出すことができる。IAV感染(インビトロまたはインビボ)を含むすべての手順は、生物安全レベル(BSL)-2条件下で生物学的安全キャビネットで行われた。
注意:適切なバイオセーフティレベルは、バイオセーフティリスク評価に従って決定する必要があります。バイオセーフティリスク評価の実施と効果的なバイオセーフティ封じ込めの確立に関する追加情報は、実験を行う機関に相談する必要があります。
- すべての実験手順を実行する前後に70%のエタノールまたは二酸化塩素消毒剤でバイオセーフティキャビネットをきれいにします。マウスの作業の場合は、使用前後にすべての解剖材料(はさみ、鉗子の解剖など)とDounceホモジナイザーを殺菌します。
- 適切なIBCおよびIACUCガイドラインの下で手順中に生成されたすべての生物学的材料を廃棄します。
3. BIRFLUのインビトロキャラクタライゼーション(図2)
注:すべてのバッファーおよびメディア構成については、表 1を参照してください。
- 蛍光によるタンパク質発現の解析(図2A)と間接免疫蛍光(図2B)
- 感染の1日前に、マディン・ダービー・イヌ・キネ腎臓(MDCK)上皮細胞(1 x 105細胞/ウェル、トリプリケート)を用いた種子24ウェルプレートを組織培養培地中に、5%CO2を有する37°Cインキュベーターでプレートを維持する。模擬感染細胞とBIRFLU感染細胞の両方で選択されたすべての抗体を評価するのに十分なウェルを準備します。
注:ウイルス感染を開始する前に単層を確認するために、光顕微鏡下で細胞を視覚化することをお勧めします。感染時までにMDCK細胞の90%の合流単層が推奨される。 - 感染媒体中のWTまたはBIRFLU IAVの希釈を調製し、感染媒体の最終容積0.25 mL/ウェルで細胞当たり0.1プラーク形成単位(PFU)の多重性(MOI)で播種MDCK細胞に感染する。
- ステップ3.1.1から組織培養培地を取り出し、1xリン酸緩衝生理食べ物(PBS)でMDCK細胞を2回洗浄する。3.1.2からMDCK細胞にウイルス希釈を加え、室温で1時間のロッキングプラットフォームにプレートを置き、ウイルス吸着を可能にします。
注:模擬感染細胞は、ウイルスが存在しない場合にのみ感染媒体でインキュベートされる。 - ウイルス吸着後(ステップ3.1.3)、吸引によってウイルス接種を除去し、TPCK処理トリプシンの1 μg/mLを含む感染後培地の1 mLを各ウェルに追加する。33°Cで5%CO2加湿インキュベーターで18時間細胞をインキュベートします。
- 感染の18時間後、24ウェルプレート(3.1.4)から組織培養上清を除去する。0.25 mL/ウェルの固定/透過性溶液で細胞を固定し、室温で20分間透過させます。
注:ホルムフードに固定/透過性溶液を準備し、ホルムアルデヒドの暴露を防ぎます。 - ステップ3.1.5から固定/透過性溶液を取り出し、1x PBSで細胞を2回洗浄し、室温で1時間のブロッキング溶液の0.25 mL/ウェルで細胞をインキュベートします。
注:次の工程に進むか、一晩4°Cでブロッキング溶液中の細胞を保存する。 - ブロッキング溶液(ステップ3.1.6)を除去し、IAV核タンパク質、NP(HB-65)またはウサギポリクローナル抗体(pAb)の1:1,000希釈に対してマウスモノクローナル抗体(MAb)の0.25 mL/ウェル(1 μg/mL)をNLucに対して追加します(表参照)。いずれも抗体希釈液(1x PBS、2.5%BSA)で希釈し、37°Cで1時間細胞をインキュベートする。
- ステップ3.1.7から一次抗体を取り出し、1x PBSで細胞を3回洗浄し、テキサス赤結合抗マウスまたは抗ウサギ二次抗体の0.25 mL/ウェルでインキュベートする(材料の表を参照)抗体で1:200希釈希釈液。
注:細胞核は、同じ二次抗体溶液に0.5 μg/mLの4',6'-ジアミディノ-2-フェニリンドール(DAPI)を添加することによって同時に染色することができる。暗闇の中で37°Cで1時間細胞をインキュベートする。他の蛍煙素と共役した他の二次抗体を用いることができる。 - ステップ3.1.8から二次抗体とDAPIを取り出し、1x PBSで細胞を3回洗浄する。洗浄後、細胞を0.25mL/ウェルの1x PBSのままにしておきます。
- 蛍光顕微鏡のステージにプレートを置き、適切な蛍光フィルターを使用して感染細胞から金星とNlucレポーターの発現を検出します。蛍光顕微鏡(20倍倍)を用いて画像をキャプチャし、画像編集ソフトウェア(図2A、B)を使用してマージします。
- 感染の1日前に、マディン・ダービー・イヌ・キネ腎臓(MDCK)上皮細胞(1 x 105細胞/ウェル、トリプリケート)を用いた種子24ウェルプレートを組織培養培地中に、5%CO2を有する37°Cインキュベーターでプレートを維持する。模擬感染細胞とBIRFLU感染細胞の両方で選択されたすべての抗体を評価するのに十分なウェルを準備します。
- Nluc活性(図2C)とウイルス複製(図2D)を分析します。
- 感染の1日前に、5%CO2を含む37°Cインキュベーターで組織培養培養培養培養培養物を用いたMDCK細胞を用いた種子12ウェルプレート(2 x 105細胞/ウェル、トリプリケート)を用いて、感染時までに約90%の合流性に達する。
注:感染前に、顕微鏡下の細胞を調べて、MDCK細胞の単層を確認してください。 - 感染の日は、感染媒体中のWTおよびBIRFLUウイルスの希釈を準備し、0.5 mL/ウェルで0.001 PFUのMOIで三つ編みのMDCK細胞(ステップ3.2.1.)に感染する。組織培養培地を取り出し、1x PBSでMDCK細胞を2回洗浄する。
- MDCK単層にウイルス希釈を追加し、ロッキングプラットフォーム上で1時間室温でウイルス吸着を可能にします。ウイルス吸着後、ウイルス接種を取り除き、TPCK処理トリプシンの1 μg/mLを含む感染後培地の1.5mLを各ウェルに加える。感染した細胞を33°Cで5%CO2加湿インキュベーターでインキュベートし、ステップ3.2.4に示された時点で上清を集める。
- 24、48、72、および96 hポスト感染(p.i.)で、各井戸から150μLの組織培養上清を収集し、サンプルを-80°Cのマイクロ遠心管に保存し、Nlucアッセイおよびウイルス滴定を行う。
- Nluc活性アッセイを実行するには、製造元の指示に従ってください。まず、氷上で-80°C(ステップ3.2.4)に保存した組織培養上清を解凍します。
注:製造元からの推奨事項を参照し、必要に応じてアッセイを最適化します。 - 希釈酵素溶液(材料の表を参照)を希釈バッファーでNluc置レート1:50を希釈して調記する。ルシフェラーゼアッセイ用の白いフラットボトム96ウェルマイクロプレートで、集めた組織培養上清サンプルの10~25μLで25μLのルシフェラーゼアッセイ溶液を混合します。ルミノメーター(図2C)を使用して発光度を測定する前に、2~3分間混合物をインキュベートします。
注:組織培養上清における感染性ウイルス粒子の存在は、前述の23,32、前述のように蛍光免疫焦点アッセイ(Venus)または間接免疫蛍光(ウイルス抗原染色)によって決定される。 33、56. - ウイルス滴定の前日、組織培養培地を用いた96ウェルプレート(2 x 104細胞/ウェル、トリプリケート)にMDCK細胞を種子化し、細胞が5%CO2で37°Cに設定されたインキュベーターで感染時までに90%の合流に達することを可能にする。
- 氷上で解凍した組織培養上清サンプルを使用します(ステップ3.2.4.)。新しい96ウェルプレートの各ウェルに90μLの感染培地を加え、解凍した組織培養上清(ステップ3.2.4)の10μLを第1ウェル(行A)に加えます。マルチチャンネルピペを使用して、行Aから行Bに10 μLを混合して転送します。
注:この手順は、最後の行 (H) まで繰り返す必要があります。ウイルス滴定の正確な測定のために三量体でウイルス滴定を行うことをお勧めします。 - 96ウェルプレート(ステップ3.2.7)のMDCK細胞から組織培養培地を取り出し、1x PBSで2回洗浄します。ウイルス希釈を含むレプリカ96ウェルプレートの上清希釈(ステップ3.2.8)をMDCK細胞を含む96ウェルプレートの各ウェルに50 μLを追加します。
- 室温で1時間のロッキングプラットフォーム上の96ウェルプレートをインキュベートし、ウイルス吸着を可能にします。ウイルス吸着後、接種を取り除き、TPCK処理トリプシンの1 μg/mLを含む感染後培地の100 μL/ウェルを追加します。感染細胞を33°Cインキュベーターで12時間インキュベートし、CO2を5%入れた。
- BIRFLUは金星を発現するので、感染細胞の数は蛍光顕微鏡を用いて直接数えることができる。あるいは、ウイルス力中剤は、ウイルスタンパク質23、56、57、59に対する抗体を用いて前述したように間接的な免疫蛍光によって決定することができる。後者については、セクション4.4に記載されている抗NP mAb HB-65を用いて細胞および染色を修正/透過化する。
- 式を用いて蛍光形成単位(FFU)/mLの数を数えることによってウイルス性チタンを決定する:((FFUの数)x 20 x 1/希釈(図2D)。
- 感染の1日前に、5%CO2を含む37°Cインキュベーターで組織培養培養培養培養培養物を用いたMDCK細胞を用いた種子12ウェルプレート(2 x 105細胞/ウェル、トリプリケート)を用いて、感染時までに約90%の合流性に達する。
4. BIRFLUの生体内特性図(図3および図4)
- マウス感染
注:マウスの鼻腔内感染は、前述の23として行った。感染のマウスモデルを使用して生体内のIAV感染のより詳細なプロトコルについては、前の出版物23に関連付けられたビデオを見ることをお勧めします。このセクションでは、BIRFLU を使用したマウス感染に必要な手順のみを要約します。- マウスを検査して、健康状態と全体的な身体的外観を評価します。1x PBSでBIRFLUの希釈を調べ、30 μL/マウスの総体積でBIRFLUの1 x 106 PFUを用いてマウスを接種する。マウスの接種まで氷の上にウイルスを維持します。
注:イメージングの内部制御として、模擬感染(1x PBS)マウスが必要となる。模擬感染マウスをBIRFLU感染動物とは異なるケージに入れよう。 - 5~7週齢の雌BALB/cマウスを240〜250mg/kgのトリブロモエタノール(TBE)で腹腔内に麻酔する。その後、ケージにマウスを戻し、約5分間待ちます。
注:注射鎮静剤は、生体内のインフルエンザ感染に対する吸入鎮静剤よりも推奨され、後者は気道上皮によるウイルスの挙動および取り込み方を修正することができる。さらに、それらはまた、肺の局所免疫応答に影響を与え、感染したマウスの生体内イメージングを妨げる可能性がある。最後に、吸入鎮静剤は効果の持続時間を減少させており、感染した動物の生体内イメージングの問題となるであろう。 - 調製したBIRFLU希釈の30μLでマウスを接種する。ケージに戻す前に、マウスが適切に呼吸していることを確認します。
- マウスを検査して、健康状態と全体的な身体的外観を評価します。1x PBSでBIRFLUの希釈を調べ、30 μL/マウスの総体積でBIRFLUの1 x 106 PFUを用いてマウスを接種する。マウスの接種まで氷の上にウイルスを維持します。
- BIRFLUに感染したマウスの生物発光モニタリング(図4A)
注:この原稿レポーターのNlucまたはVenusの発現およびBIRFLUに感染したマウスの肺におけるウイルス複製は、感染後3日で決定される。しかし、生物発光イメージングの性質上、実験時間ごとに安楽死させる必要なしに、個々のBIRFLU感染動物におけるNluc発現の繰り返しモニタリングを可能にする。イソファラン麻酔マニホールドを持つ生体内イメージングシステムは、記載された実験手順を実行するために必要とされる。画像集録およびデータ解析に使用されるイメージング機器および画像ソフトウェアの詳細については、材料の表を参照してください。- 生物発光シグナルを改善するためにマウスの胸を剃る。イメージング ソフトウェアを開き、を押します。次に、イメージングモードを生物発光、自動保存、自動への露出時間、オープンフィルタなどに設定するなど、使用するパラメータを設定します。
- 機械が完全に初期化されたら、イソファラン麻酔システムをオンにする。麻酔室に動物を置きます。マウスは、酸素ガスの混合物と同時に軽く麻酔され、1-2%のイソファルランを気化させる。
- マウスが麻酔されると、22G針を用いた注射器を用いてレトロ軌道ルートを介して1x PBS(最終容積100μL/マウス)で1:10希釈したNluc基板(材料の表を参照)を投与する。
- Nluc試薬投与直後に、動物を胸を上にしてマニホールドコーンの中に入れ、イメージング中に動物の麻酔を保つ。イメージャードアを閉じた直後に、ソフトウェアプログラムで取得をクリックします(図4A、上)。
- イメージングの後、マウスをケージに戻して完全に回復し、イソファル気化器をオフにします。次に、マウス肺のex vivoイメージングを進め、金星レポーター遺伝子発現を評価する(セクション4.3)。
- イメージングソフトウェアツールを使用して、取得した生物発光データを分析します。特定の信号を指定し、対象領域(通常は胸部の周り)でフラックス測定を行うツールROI(対象領域)を利用します(図4A、下)。ROI形状は無関係ですが、一般に、信号拡散領域全体を捕捉するために、より大きなROIが好ましい。
- [測定]をクリックします。光子の生物発光度は、異なるパラメータやイメージング機器によって提供される出力測定値に匹敵する絶対光子放出測定を提供するため、評価します。
- BIRFLUに感染したマウスにおける蛍光分析(図3および図4B)
- 前述の23に記載されているように、生体内イメージング後にマウス肺を収集する。
- 簡単に言えば、TBE(500 mg/kg)の致死量でマウスを安楽死させる。70%エタノールで切開部位を消毒する。メスで、胸骨から腹部の基部に切開し、切開の底からはさみで側面に切り取ります。次に、肝静脈(第2の物理的安楽死法)を切断し、動物を出血させる。
注:イメージング中に高いバックグラウンド信号を避けるためには、肺内の血液量を最小限に抑えることが重要です(下記参照)。
- 簡単に言えば、TBE(500 mg/kg)の致死量でマウスを安楽死させる。70%エタノールで切開部位を消毒する。メスで、胸骨から腹部の基部に切開し、切開の底からはさみで側面に切り取ります。次に、肝静脈(第2の物理的安楽死法)を切断し、動物を出血させる。
- 後部の回復にマウスを置き、胸膜をカットし、肋骨ケージを開くためにはさみを使用します。その後、鉗子で肺を静かに保持しながら、はさみで気管の端を切り取ることによって肺を取り除く。
- 1x PBSの2 mLの6ウェルプレートに肺を置き、1x PBSで肺を3回洗浄します。
注:サンプル間の汚染を避けるために、各動物間の解剖用具をきれいにし、消毒する。
- 1x PBSの2 mLの6ウェルプレートに肺を置き、1x PBSで肺を3回洗浄します。
- 画像集録ソフトウェアをクリックして初期化し、イメージングモードを蛍光に設定する、自動保存、自動への露光時間、励起(500 nm)、発光(540 nm)フィルタを設定します。
- マシンが初期化されると、肺を黒い背景トレイに入れ、組織が互いに分離していることを確認し、イメージャーにトレイを導入し、イメージャードアを閉じた後にイメージングシステムプログラムをクリックします(図4B、上)。
- イメージング後、すぐに組織を取り出し、サンプルが同じ日に処理される場合は氷(4°C)に保存します。またはチューブとドライアイスで、サンプルが後で別の日に処理される場合は、-80 °Cでそれらを保存する前に、迅速にそれらを凍結します。
- 画像処理では、ROIツールを選択し、個々の肺の周りにROIを描画します。[測定]をクリックします。次に、得られた平均放射効率測定を用いて、模擬感染マウスから値を減算する(図4B、下)。
注:BIRFLUでは、Nlucと金星発現のレベルと信号分布の良好な相関があります。したがって、同じ動物からNluc(マウス全体)と金星(駆除肺)発現を分析し、同じ向きを維持することが重要です。
- 前述の23に記載されているように、生体内イメージング後にマウス肺を収集する。
- マウス肺におけるBIRFLU複製の評価(図3及び図4C)
- 前述の23としてプラークアッセイによるウイルス滴定のためのマウス肺の均質化。
- 1 mLの冷媒感染媒体を含むダウンスホモジナイザーに肺を置く。完全に崩壊するまで、室温で1分間害虫で肺を均質化し、4°Cで無菌チューブにサンプルを保存します。
- 10分間300 x gでサンプルを遠心分離し、無菌チューブで上清を収集します。同じ日に使用する場合は氷の上にサンプルを保存するか、後でウイルス力を評価するために-80 °Cでそれらを凍結します。
注:新しいDounceホモジナイザーは、各肺サンプルに使用する必要があります。 - プラークアッセイを行うために、ウイルス滴定を行う前日に、組織培養培養培養培養培養におけるMDCK細胞(5 x 105細胞/ウェル)を有する種子6ウェルプレートを播種する。5%CO2で一晩37°Cで細胞をインキュベートし、翌日90%の合流に達する。感染前に、細胞が光顕微鏡下で単層を形成することを確認してください。
- 感染媒体で均質化されたサンプル(ステップ4.4.1)から上清の1:10の連続希釈を準備します。感染媒体の540 μLでマイクロ遠心管を準備し、均質化された肺サンプルから最初のチューブに60 μLを追加し、上下にピペッティングして混合し、新しい先端を使用して、60 μLを次のチューブに移します。最後の希釈まで、このシリアル希釈プロセスを繰り返します。
注:我々の経験では7希釈は、感染したマウスの肺からのプラークアッセイによってウイルスの電離剤を決定するのに十分である。 - MDCK細胞(ステップ4.4.3)を1x PBSで2回洗浄し、シリアル希釈されたサンプルの500 μLを6ウェルプレートの各ウェルに移します。プレートをロッキングプラットフォームに置き、室温で1時間ウイルス吸収を行います。
- ウイルス吸収の1時間後、ウイルス接種を除去し、TPCK処理トリプシンの1 μg/mLを含むオーバーレイ培地の2 mL/ウェルを加え、次いで3日間5%CO2以下で細胞をインキュベートする。
- 感染した細胞(ステップ4.4.6)を室温で1x PBSで希釈した4%ホルムアルデヒドの1mL/ウェルを2時間固定し、オーバーレイ培地を慎重に除去し、各ウェルに1x PBSの1mLを加えます。金星の可視化のために、蛍光の検出のためのイメージングシステムを用いて6ウェルプレートを画像化する。
注:ウイルスプラークは、画像編集ソフトウェアを使用して着色することができます(材料の表を参照)。 - Nluc発現を評価するには、抗Nluc pAbを用いて免疫染色によりウイルスプラークを可視化する。このために、1x PBSを取り出し、室温で15分間透過性溶液の0.5mL/ウェルを用いて細胞を透過化する。
- 透過性溶液を取り出し、1x PBSで細胞を3回洗浄し、室温で1時間のブロッキング溶液を0.5mL/ウェルでブロックします。
- ステップ4.4.9からブロッキング溶液を除去し、pAb抗Nluc希釈1:1,000のpAb抗Nlucの0.5 mL/ウェルで細胞をインキュベートし、37°Cで1時間希釈溶液を用いる。
- Nluc発現プラークの可視化のためのメーカーの勧告に従って、ABCアルカリホスファターゼキットとDABペルオキシダーゼ基板キットを使用してください。
- 簡単に言えば、4.4.10から細胞を1x PBSで3回洗浄し、37°Cで1時間のバイオチン化抗ウサギ二次抗体の0.5 mL/ウェルでそれらをインキュベートします。
- 二次抗体を取り出し、1x PBSで細胞を3回洗浄し、37°Cで1時間ABC溶液でインキュベートする。1x PBSで細胞を3回洗浄し、DAB HRP基板キットでウイルスプラークを可視化します。従来のスキャナを使用して免疫染色プラークをスキャンします。
注:免疫染色のための他の同様のキットを使用することができます。
- 室温で1時間の結晶紫色溶液でウイルスプラークを汚します。結晶バイオレットを捨て、水でプレートを3回洗い、プレートを乾燥させ、再びプレートをスキャンします。
- ウイルスの定数を決定するには、結晶紫色染色後に明らかにされたプラークを数えます。従来のスキャナを使用してプラークをスキャンします。ウイルスチターをmL当たりのプラーク形成単位(PFU)として計算します(PFU/mL)。
- 生体内のBIRFLUの安定性を評価するには、結晶紫色染色プラークの数(感染性ウイルスの数、ステップ4.4.12)を数えることによってレポーター発現ウイルスの割合を計算し、金星およびNluc発現プラークの数と比較します(ステップ 4.4.7 とステップ 4.4.11)。
- 10分間300 x gでサンプルを遠心分離し、無菌チューブで上清を収集します。同じ日に使用する場合は氷の上にサンプルを保存するか、後でウイルス力を評価するために-80 °Cでそれらを凍結します。
結果
インビトロでのBIRFLUの生成と特性化(図1、図2)
2つの異なるレポーター遺伝子(BIRFLU)を発現する組換え複製可能なIAVは、最先端の分子生物学とプラスミドベースの逆遺伝学技術を用いて構築された(図1)。ここでは、その小さなサイズ、ATP独立性、より大きな強度、および最適化された基板48、60を含む他のルシフェラーゼに対するいくつかの利点のためにNlucを使用することを選択しました。Nlucは、IAV PR8のHAセグメントにクローニングされ、続いてHAの開いた読み取りフレーム(ORF)の前にブタテショウイルス(PTV)2A切断部位(2A)が続いた(図1)。HAのORFは、元のパッキング信号を除去し、可能な組み換えを避けるためにサイレント変異を含み込んだ。完全なHA包装信号をNlucの前に加え、同じウイルスRNAセグメントからのvirionおよびNlucおよびHA発現への改変HAセグメントの適切な組み込みを可能にした(図1)。さらに、蛍光タンパク質金星は、単一の転写物32、36、41、54から2つのウイルスタンパク質NS1およびNEPをコードする修飾IAV PR8 NSセグメントにクローニングされた。 57.そのために、金星はNS1のC端子に融合され、NEP ORF全体がNS1-ヴィーナスとNEP配列の間に置かれたPTV 2A切断部位の下流にクローン化された(図1)。最終的に、これら2つの改変HAおよびNSウイルスプラスミド構造体は、BIRFLU(図1)を生成するためにIAV PR8逆遺伝学プラスミドの残りの部分と組み合わせて使用された。BIRFLUのインビトロおよびインビボ特性化は、前述の55.
図2では、蛍光および間接免疫蛍光アプローチを用いて金星、Nluc、およびNP発現レベルを決定することにより、ビトロBIRFLUで特徴付けた(図2A,B)。MDCK細胞のコンフルエント単層は、WTまたはBIRFLU PR8ウイルスで模擬感染または感染(MOI 0.1)を有し、感染後18時間で、金星発現を蛍光顕微鏡を用いて直接評価した(図2A,B)。Nluc(図2A)およびNP(図2B)発現は、各タンパク質に特異的な抗体を用いて間接免疫蛍光により可視化した。予想通り、金星およびNluc発現はBIRFLUに感染した細胞でのみ検出され、WT PR8ウイルスに感染した細胞では検出されなかった。さらに、間接免疫蛍光顕微鏡は、WTおよびBIRFLU PR8感染細胞の両方におけるNP発現を明らかにした。模擬感染細胞では、金星、Nluc、NPの発現は検出されなかった(図A,B)。
インビトロでNluc発現レベルを評価するために、MDCK細胞をWTまたはBIRFLU PR8ウイルスおよびNluc活性を組織培養上清で感染させた(MOI 0.001)、感染後24、48、72および96hで評価した(図2C)。BIRFLUに感染したMDCK細胞の組織培養上清においてNluc活性のみが検出された(図2C)。組織培養上清におけるNluc活性は、感染後96時間でより高い発現レベルを有する24時間後感染の早い時期に検出された、おそらくウイルス感染中に誘発された細胞障害効果(CPE)が保持されたNlucタンパク質を放出するためである。セルに。培養細胞におけるBIRFLUの適合性を評価するために、WTおよびBIRFLU PR8ウイルスの増殖運動学も評価し(図2D)、組織培養上清における感染性ウイルスの存在を免疫焦点アッセイ(図2D)で決定した(図2D)).特に、BIRFLU複製動態はWT PR8ウイルスの複製に匹敵するが、BIRFLU複製はわずかに遅れ、WT PR8と同じウイルス性チターに到達しなかった。しかし、BIRFLUは5 x 107 PFU/mL(図2D)の有数に達することができ、ウイルスゲノム中の2つのレポーター遺伝子の発現がMDCK細胞におけるBIRFLU複製を有意に妨げなまないことを示した。
マウスにおけるBIRFLU感染の追跡(図3および図4)
図3は、IAV感染のマウスモデルにおけるBIRFLUダイナミクスの評価のための概略的なフローチャートである。5~7週齢の雌BALB/Cマウスは、1x PBSで模擬感染したか、またはBIRFLUの1 x 106 PFUに感染した。感染後3日目に、マウスをイゾフランで麻酔し、次いでNluc基板をレトロ軌道に注入した。全てのマウスを直ちにIVIS器具に入れ、NlucシグナルをIVISを用いて生体内で評価した。次に、マウスを安楽死させ、肺を採取した。次いで、取り出した肺をインビボイメージャーを用いてexvivoを分析し、金星発現を介して蛍光強度を決定した。最後に、マウスの肺を均質化し、ウイルス力と安定性をプラークアッセイによって決定した。プラークは、金星の直接蛍光によって、Nlucに特異的な抗体を用いた免疫染色および結晶紫色染色によって評価された。
前述の複製有能なレポーター発現IAVは、ウイルス感染および複製の代理として、蛍光または生物発光タンパク質のいずれかの単一のレポーター遺伝子を発現する。しかしながら、BIRFLUは、ウイルス感染時に両方のタイプのレポーター遺伝子を発現することができる。BIRFLU感染後の生物発光(インビボイメージング)と蛍光(エクスビボイメージング)の相関関係を評価するために、5~7週齢の雌BALB/cマウスを1x PBSで模擬感染させたり、BIRFLU(106 PFU)を眼内に接種した。.Nluc活性(図4A)は、生体内イメージング器具を用いて感染後3日間にレトロ軌道に注入したNluc基板の投与により評価した。以前の研究では、PR8を含むIAV複製が感染後24日目から4日目の間にピークを迎えることが示されたため、3日目に生物発光を評価することを選択しました。生物発光をモニターし(図4A、上)、平均総フラックス(フラックス(log10 p/s))を算出するために使用した(図4A、下)。予測通り、BIRFLUに接種したマウスは高い生物発光活性を示したが、模擬感染マウスではシグナルは検出されなかった。その後、感染したマウスの肺を採取し、ex vivoイメージングを用いて金星発現を評価した(図4B、上)。また、蛍光平均放射効率を算出した(図4B、底部)。駆除されたマウス肺も同質化し、生体内におけるBIRFLUのウイルス性電質および遺伝的安定性を決定した(図4C,D)。BIRFLUの遺伝的安定性は、マウスの肺および蛍光顕微鏡(Venus,top)、免疫染色(Nluc、中央)および結晶紫染色(底)から単離されたウイルスを用いてプラークアッセイを用いて分析した。マウス肺から回収されたBIRFLUは、プラークを形成し、両方のレポーター遺伝子を安定的に発現することができた(図4C)。特に、バイオルミネッセンスと蛍光シグナルとウイルス複製との良好な相関関係を観察した。
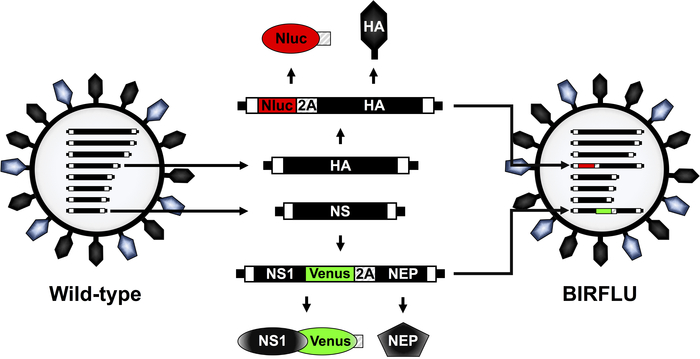
図1:IAV PR8 WTおよびBIRFLUビリオン構造およびゲノムセグメントの概略表現。IAVは、ヘマグルチニン(HA;黒)およびノイラミニダーゼ(NA;青色)の2つの主要なウイルス糖タンパク質を含む脂質二層層に囲まれている。IAV には、8 つの一本鎖、負感、RNA セグメント(PB2、PB1、PA、HA、NP、NA、M、および NS)が含まれています。各ウイルスセグメントには、3'および5'の端(ブラックボックス)に非符号化領域(NCR)が含まれています。また、ウイルス(v)RNAの3'および5'末端には、vRNAを新生ビリオン(白い箱)に効率的に封入するパッケージング信号が含まれています。IAV PR8 HA および NS ウイルスセグメントおよび製品は黒で示されています。Nluc、金星、およびPTV 2Aの配列は、それぞれ赤、緑、縞模様のボックスで示されています。BIRFLUでは、Nlucと金星をそれぞれ表す改変されたHAセグメントとNSセグメントの概略図も示されている。この図は、ノガレスら55から適応されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図2:BIRFLUのインビトロキャラクタライゼーション。(A, B)直接蛍光と免疫蛍光によるタンパク質発現の解析MDCK細胞は、PR8 WTまたはBIRFLUウイルスを用いた模擬感染または感染(MOI 0.1)であった。感染細胞を18時間後に固定し、直接蛍光顕微鏡で金星発現を直接可視化し、特定の抗体と間接免疫蛍光を用いてNluc(A)およびウイルスNP(B)発現を可視化した。核はDAPIで染色した。代表的な画像(20倍倍)を示す。スケールバー = 100 μm。(C, D)PR8 WTおよびBIRFLUの成長運動学。WTおよびBIRFLUPR8ウイルスに感染したMDCK細胞(MOI 0.001)からの組織培養上清におけるNluc活性(C)およびウイルスチター(D)は、感染後の示された時間で評価した。データは三点三度の平均±SDを表す。ウイルス力体は、免疫焦点アッセイ(FFU/mL)によって決定した。点線は検出限界(200 FFU/ml)を示します。この図は、ノガレスら55から適応されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:マウスにおけるBIRFLUの研究のための概略表現。NlucおよびVenusレポーター遺伝子の発現は、生体内またはex vivoイメージングを用いてBIRFLUの1 x 106 PFUに感染したマウスで評価した。簡単に言えば、1日目に、5〜7週齢の雌BALB/cマウスを模擬感染(1x PBS)または1x 106 PFUで接種した。感染後3日目に、マウスをイゾフランを用いて軽度に麻酔し、Nluc基板をレトロ軌道に注入した。Nlucシグナルは、生体内イメージングを用いて直接評価した。イメージング直後、マウスを安楽死させ、全開き肺における金星の発現をex vivoイメージングを用いて分析した。回収したマウス肺を均質化し、プラークアッセイによるウイルス複製および安定性を評価した。矢印は、蛍光(金星)、免疫染色(Nluc)および結晶紫色染色との相関を示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。
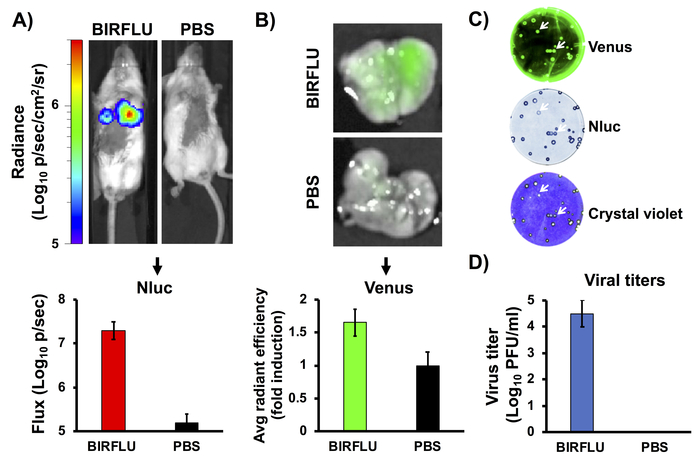
図4:生体内生物発光および蛍光発現中。雌の5~7週齢のBALB/cマウスは、模擬感染(1x PBS)またはBIRFLUの1 x 106 PFUを眼内接種した。感染後3日目に、マウス全体におけるNluc活性(A)が決定された。輝度スケールを示す単一のマウスの代表的な画像(p/秒/cm2/sr)。生物発光輝度値を定量し、平均総フラックスを示した(Flux(Log10 p/s)。Nlucイメージング後、肺は、外生画像(B)のために採取した。肺全体からの代表的な写真が示されている。金星発現を定量するために、対象領域(ROI)の平均値を模擬感染マウスから肺自動蛍光に正規化し、折り畳み変化を算出した。生体内におけるBIRFLUの遺伝的安定性を解析するために、マウス肺から回収したウイルスを、蛍光顕微鏡(Venus,上)、免疫染色(Nluc、中央)および結晶紫色染色(下)を用いてプラークアッセイにより分析した( C)。1匹のマウスの代表的な画像が表示されます。ウイルス複製を評価するために、全肺はイメージング後に均質化され、MDCK細胞に感染し、プラークアッセイ(PFU/mL)(D)によってウイルス力中電圧を決定するために使用された。矢印は、蛍光(金星)、免疫染色(Nluc)、および結晶紫色染色との相関を示す。バーは、肺ウイルス量高の平均±SDを表す。この図は、Logales et al.55から適応されています。この図のより大きなバージョンを表示するには、ここをクリックしてください。
| 組織培養培養培養培養剤とソリューション | 組成 | ストレージ | 使用 |
| 組織培養培地:ダルベッコの改変イーグル培地(DMEM)、10%胎児ウシ血清(FBS)、1%ペニシリン連鎖筋菌-L-グルタミン(PSG)(DMEM10%FBS 1%PSG)。 | 445 ml DMEM、FBSの50ミリリットル、100倍PSGの5mL。 | 4 °C | MDCK細胞の維持 |
| 感染後メディア: DMEM 0.3% 牛アルブイン (BA), 1% PSG(DMEM 0.3% BA 1%PSG). | 491 ml DMEM, 4.2 ml の 35 % BA と 100x PSG の 5 ml | 4 °C | ウイルス感染後のMDCK細胞の維持 |
| 10xリン酸緩衝生理食べ物(PBS) | NaClの80g、KClの2g、Na2 HPO4.7H2Oの11.5g、KH2 PO4の2g。ddH2O を最大 1 L に追加する pH を 7.3 に調整する | 室温 | 1x PBS を準備するには |
| 1x PBS | ddH2O で 10x PBS を希釈する | 室温 | 細胞を洗う |
| 感染媒体: 1x PBS, 0.3% BA, 1% ペニシリン連鎖マイシン (PS) (PBS/BA/PS) | 487 mL 1x PBS滅菌、4.2 mLの35%BAおよび5 mlの100x 1%PS(100 U/mL) | 4 °C | ウイルス感染 |
| 固定/透過性溶液:4%ホルムアルデヒド、0.5%トリトンX-100を1x PBSで希釈。 | 400 mL 中性緩衝ホルマリン 10%、トリトンX-100の5mlおよび1x PBSの595 mL | 室温 | MDCK細胞の固定および透過性。 |
| ブロッキング溶液:1x PBSで2.5%ウシ血清アルブミン(BSA)。 | 1x PBSの97.5 mLのBSAの2.5 g | 4 °C | 免疫蛍光およびプラークアッセイのブロッキング溶液。 |
| 抗体希釈液(1x PBSで1%BSA) | 1x PBSの99 mLのBSAの1 g | 4 °C | 一次抗体および二次抗体の希釈 |
| 0.1% 結晶バイオレット溶液 | メタノールの400mLで結晶バイオレットの1g。ddH2O の 600 ml を追加します。 | 室温 | プラークアッセイにおけるMDCK細胞の染色 |
| トシルスルホニルフェニルアラニルクロロメチルケトン(TPCK)処理トリプシン | ddH2O で 1 mg/mL で 1,000x ストック溶液を準備する | -20 °C | ウイルス感染のため。 |
表1:組織培養培地および溶液
ディスカッション
研究者は、ウイルス複製と病因の現在の理解を理解し、拡大するための重要な分子ツールとして組換えレポーター発現ウイルスに依存しています26,27,28,29歳,30歳,31歳,32歳,33歳,34歳,35歳,36歳,37歳,38歳,39歳,40歳,41歳,54.最も一般的に好まれるレポーター遺伝子は、ルシフェラーゼと蛍光タンパク質であり、主に同定の技術進歩、改良された変異体の開発、およびイメージング技術による検出43,44歳,45歳,46歳,47歳,48.組換えレポーターウイルスは、ウイルス学的アッセイを加速し、インビトロおよびインビボでウイルスのダイナミクスを研究し、現在承認されているまたは新しいワクチンおよび治療アプローチの有効性をテストするためにしばしば使用される26, 27,28,29,30,31,32,33,34,35, 36,37,38,39,40,41,54.残念ながら、IAVの場合、過去の研究は単一のレポーター遺伝子の発現に限定され、26、27、28、29を行うことができる研究のタイプを妨げる,30歳,31歳,32歳,33歳,34歳,35歳,36歳,37歳,38歳,39歳,40歳,41歳,54.この制限を回避するために、Nlucルシフェラーゼと金星蛍光タンパク質(BIRFLU)を発現する複製有能なバイレポーターIAVを生成しました。
本報告では、BIRFLUのインビトロ特性と、IAV感染のマウスモデルを用いて生体内のウイルス感染を追跡するためにBIRFLUを用いた実験的アプローチについて述べた。BIRFLU Nlucと金星発現はウイルスのチターと相関した。さらに、BIRFLUは安定したままで、感染したマウスの肺から回収された後も両方のレポーター遺伝子を発現し続けた。このアプローチは、IAV感染症の治療のための新しい治療選択肢の同定と開発を含む、培養細胞および動物モデルにおけるIAVを研究する絶好の機会を研究者に提供する。
BIRFLUはPR8のバックボーンを用いて生成されたが、異なるタイプ、サブタイプまたはウイルス株のバックボーンを使用して他の組換えIAVを同じ実験的アプローチを使用して生成することができる。同様に、本報告では、IAVのマウスモデルにおけるBIRFLUの使用に関する実験手順について説明した。しかし、BIRFLUは他の動物モデルにおけるIAV感染を評価する貴重な技術である可能性がある。
開示事項
著者は何も開示していない。
謝辞
LM-S研究所におけるインフルエンザウイルスに関する研究は、ニューヨークインフルエンザセンター(NYICE)(NIH 272201400005C)によって部分的に資金提供され、NIAIDインフルエンザ研究・サーベイランスセンター(CEIRS)契約No.HHSN27201400005C (NYICE) と国防総省 (DoD) ピアレビュー医療研究プログラム (PRMRP) 助成金 W81XWH-18-1-0460.
資料
| Name | Company | Catalog Number | Comments |
| 12-well Cell Culture Plate | Greiner Bio-one | 665102 | |
| 24-well Cell Culture Plate | Greiner Bio-one | 662160 | |
| 6-well Cell Culture Plate | Greiner Bio-one | 657160 | |
| 96-well Cell Culture Plate | Greiner Bio-one | 655-180 | |
| Adobe Photoshop CS4 | Adobe | This software is used in 3.1.10 and 4.4.7 | |
| Bovin Albumin solution (BA) | Sigma-Aldrich | A7409 | Store at 4 ° C |
| Bovin Serum Albumin (BSA) | Sigma-Aldrich | A9647 | Store at 4 °C |
| Cell Culture dishes 100mm | Greiner Bio-one | 664-160 | |
| ChemiDoc MP Imaging System | BioRad | This instrument is used in 4.4.7 | |
| Crystal Violet | Thermo Fisher Scientific | C581-100 | Store at Room temperature |
| Dounce Tissue Grinders | Thomas Scientific | 7722-7 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Corning Cellgro | 15-013-CV | Store at 4 °C |
| Fetal Bovine Serum (FBS) | Seradigm | 1500-050 | Store at -20 °C |
| 5 to 7 week-old female BALB/c mice | National Cancer Institute (NCI) | 555 | |
| Isoflurane | Baxter | 1001936040 | Store at Room temperature |
| IVIS Spectrum | PerkinElmer | 124262 | This instrument is used for in vivo imaging (4.2 and 4.3) |
| IX81 Motorized Inverted Microscope | Olympus | Olympus IX81 | |
| Living Image 4.7.2 software | PerkinElmer | This instrument is used for in vivo imaging (4.2 and 4.3) | |
| Lumicount | Packard | This instrument is used for quantifying luciferase activity (3.2.6) | |
| Madin-Darby Canine Kidney (MDCK) epithelial cells | ATCC | CCL-34 | |
| Monoclonal Antibody anti-NP Influenza A Virus HB-65 | ATCC | H16-L10-4R5 | Store at -20 °C |
| Nano-Glo Luciferase Assay Reagent | Promega | N1110 | This reagent is used to measure Nluc activity. Store at -20 °C |
| Neutral Buffered Formalin 10% | EMD | 65346-85 | Store at RT |
| Nunc MicroWell 96-Well Microplates | Thermo Fisher Scientific | 269620 | |
| Penicillin/Streptomycin (PS) 100x | Corning | 30-00-CI | Store at -20 °C |
| Penicillin/Streptomycin/L-Glutamine (PSG) 100x | Corning | 30-009-CI | Store at -20 °C |
| Retiga 20000R Fast1394 Camera | Qimaging | Retiga 2000R | |
| Scanner | HP | ||
| Texas Red-conjugated anti-mouse -rabbit secondary antibodies | Jackson | 715-075-150 | Store at -20 °C |
| Tosylsulfonyl phenylalanyl chloromethyl ketone (TPCK)-treated trypsin | Sigma-Aldrich | T8802 | Store at -20 °C |
| Triton X-100 | J.T.Baker | X198-07 | Store at RT |
| Vmax Kinetic plate reader | Molecular Devices |
参考文献
- Palese, P., Shaw, M. L., Knipe, D. M., Howley, P. M., Griffin, D. E., Lamb, R. A., Martin, M. A. Orthomyxoviridae: The Viruses and Their Replication. Fields Virology. , (2007).
- Martinez-Sobrido, L., Peersen, O., Nogales, A. Temperature Sensitive Mutations in Influenza A Viral Ribonucleoprotein Complex Responsible for the Attenuation of the Live Attenuated Influenza Vaccine. Viruses. 10 (10), (2018).
- Nogales, A., Martinez-Sobrido, L. Reverse Genetics Approaches for the Development of Influenza Vaccines. International Journal of Molecular Sciences. 18 (1), (2016).
- Neumann, G., Noda, T., Kawaoka, Y. Emergence and pandemic potential of swine-origin H1N1 influenza virus. Nature. 459 (7249), 931-939 (2009).
- Louie, J. K., et al. A review of adult mortality due to 2009 pandemic (H1N1) influenza A in California. PLoS One. 6 (4), e18221 (2011).
- Barr, I. G., et al. Epidemiological, antigenic and genetic characteristics of seasonal influenza A(H1N1), A(H3N2) and B influenza viruses: basis for the WHO recommendation on the composition of influenza vaccines for use in the 2009-2010 Northern Hemisphere season. Vaccine. 28 (5), 1156-1167 (2010).
- Simonsen, L., et al. Impact of influenza vaccination on seasonal mortality in the US elderly population. A.M.A. archives of internal medicine. 165 (3), 265-272 (2005).
- McLean, H. Q., Peterson, S. H., King, J. P., Meece, J. K., Belongia, E. A. School absenteeism among school-aged children with medically attended acute viral respiratory illness during three influenza seasons, 2012-2013 through 2014-2015. Influenza and Other Respiratory Viruses. 11 (3), 220-229 (2017).
- Principi, N., Esposito, S. Protection of children against influenza: Emerging problems. Human Vaccines and Immunotherapeutics. , 1-8 (2017).
- Falsey, A. R., Treanor, J. J., Tornieporth, N., Capellan, J., Randomized Gorse, G. J. double-blind controlled phase 3 trial comparing the immunogenicity of high-dose and standard-dose influenza vaccine in adults 65 years of age and older. Journal of Infectious Diseases. 200 (2), 172-180 (2009).
- Fuller, J. D., et al. Influenza vaccination of human immunodeficiency virus (HIV)-infected adults: impact on plasma levels of HIV type 1 RNA and determinants of antibody response. Clinical Infectious Diseases. 28 (3), 541-547 (1999).
- Carrat, F., Flahault, A. Influenza vaccine: the challenge of antigenic drift. Vaccine. 25 (39-40), 6852-6862 (2007).
- Doherty, P. C., Kelso, A. Toward a broadly protective influenza vaccine. Journal of Clinical Investigation. 118 (10), 3273-3275 (2008).
- Fiore, A. E., et al. Prevention and control of influenza with vaccines: recommendations of the Advisory Committee on Immunization Practices (ACIP), 2010. MMWR Recommendations and Reports. 59 (RR-8), 1-62 (2010).
- Pica, N., Palese, P. Toward a universal influenza virus vaccine: prospects and challenges. Annual Review of Medicine. 64, 189-202 (2013).
- To, K. K., Chan, J. F., Chen, H., Li, L., Yuen, K. Y. The emergence of influenza A H7N9 in human beings 16 years after influenza A H5N1: a tale of two cities. Lancet Infectious Diseases. 13 (9), 809-821 (2013).
- Baker, S. F., Nogales, A., Santiago, F. W., Topham, D. J., Martinez-Sobrido, L. Competitive detection of influenza neutralizing antibodies using a novel bivalent fluorescence-based microneutralization assay (BiFMA). Vaccine. 33 (30), 3562-3570 (2015).
- He, W., Mullarkey, C. E., Miller, M. S. Measuring the neutralization potency of influenza A virus hemagglutinin stalk/stem-binding antibodies in polyclonal preparations by microneutralization assay. Methods. , (2015).
- Kayali, G., et al. Testing human sera for antibodies against avian influenza viruses: horse RBC hemagglutination inhibition vs. microneutralization assays. Journal of Clinical Virology. 43 (1), 73-78 (2008).
- Stephenson, I., et al. Reproducibility of serologic assays for influenza virus A (H5N1). Emerging Infectious Diseases. 15 (8), 1252-1259 (2009).
- Maher, J. A., DeStefano, J. The ferret: an animal model to study influenza virus. Lab Animal (NY). 33 (9), 50-53 (2004).
- Webster, R. G., Cox, N., Stoehr, K. . WHO/CDS/CSR/NCS/2002.5 Rev. 1. , (2002).
- Rodriguez, L., Nogales, A., Martínez-Sobrido, L. Influenza A Virus Studies in a Mouse Model of Infection. Journal of Visualized Experiments. (127), (2017).
- Cox, A., Baker, S. F., Nogales, A., Martínez-Sobrido, L., Dewhurst, S. Development of a mouse-adapted live attenuated influenza virus that permits in vivo analysis of enhancements to the safety of live attenuated influenza virus vaccine. Journal of Virology. 89 (6), 3421-3426 (2015).
- Steel, J., Lowen, A. C., Mubareka, S., Palese, P. Transmission of influenza virus in a mammalian host is increased by PB2 amino acids 627K or 627E/701N. PLoS Pathogens. 5 (1), e1000252 (2009).
- Tran, V., Moser, L. A., Poole, D. S., Mehle, A. Highly sensitive real-time in vivo imaging of an influenza reporter virus reveals dynamics of replication and spread. Journal of Virology. 87 (24), 13321-13329 (2013).
- Fukuyama, S., et al. Multi-spectral fluorescent reporter influenza viruses (Color-flu) as powerful tools for in vivo studies. Nature Communications. 6, 6600 (2015).
- Manicassamy, B., et al. Analysis of in vivo dynamics of influenza virus infection in mice using a GFP reporter virus. Proceedings of the National Academy of Sciences U S A. 107 (25), 11531-11536 (2010).
- Perez, J. T., Garcia-Sastre, A., Manicassamy, B. Insertion of a GFP reporter gene in influenza virus. Current Protocols in Microbiology. , (2013).
- Reuther, P., et al. Generation of a variety of stable Influenza A reporter viruses by genetic engineering of the NS gene segment. Scientific Reports. 5, 11346 (2015).
- Tran, V., et al. Multi-Modal Imaging with a Toolbox of Influenza A Reporter Viruses. Viruses. 7 (10), 5319-5327 (2015).
- Breen, M., Nogales, A., Baker, S. F., Perez, D. R., Martinez-Sobrido, L. Replication-Competent Influenza A and B Viruses Expressing a Fluorescent Dynamic Timer Protein for In Vitro and In Vivo Studies. PLoS One. 11 (1), e0147723 (2016).
- Nogales, A., Baker, S. F., Martinez-Sobrido, L. Replication-competent influenza A viruses expressing a red fluorescent protein. Virology. , 206-216 (2014).
- Nogales, A., et al. Replication-competent fluorescent-expressing influenza B virus. Virus Research. 213, 69-81 (2015).
- Avilov, S. V., et al. Replication-competent influenza A virus that encodes a split-green fluorescent protein-tagged PB2 polymerase subunit allows live-cell imaging of the virus life cycle. Journal of Virology. 86 (3), 1433-1448 (2012).
- Breen, M., Nogales, A., Baker, S. F., Martínez-Sobrido, L. Replication-Competent Influenza A Viruses Expressing Reporter Genes. Viruses. 8 (7), (2016).
- Eckert, N., et al. Influenza A virus encoding secreted Gaussia luciferase as useful tool to analyze viral replication and its inhibition by antiviral compounds and cellular proteins. PLoS One. 9 (5), e97695 (2014).
- Karlsson, E. A., et al. Visualizing real-time influenza virus infection, transmission and protection in ferrets. Nature Communications. 6, 6378 (2015).
- Czako, R., et al. In Vivo Imaging of Influenza Virus Infection in Immunized Mice. MBio. 8 (3), (2017).
- Harding, A. T., Heaton, B. E., Dumm, R. E., Heaton, N. S. Rationally Designed Influenza Virus Vaccines That Are Antigenically Stable during Growth in Eggs. MBio. 8 (3), (2017).
- DiPiazza, A., et al. Pandemic 2009 H1N1 Influenza Venus reporter virus reveals broad diversity of MHC class II-positive antigen-bearing cells following infection in vivo. Scientific Reports. 7 (1), 10857 (2017).
- Yan, D., et al. Replication-Competent Influenza Virus and Respiratory Syncytial Virus Luciferase Reporter Strains Engineered for Co-Infections Identify Antiviral Compounds in Combination Screens. Biochemistry. 54 (36), 5589-5604 (2015).
- Shaner, N. C., Patterson, G. H., Davidson, M. W. Advances in fluorescent protein technology. Journal of Cell Science. 120 (Pt 24), 4247-4260 (2007).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nature Methods. 2 (12), 905-909 (2005).
- Kelkar, M., De, A. Bioluminescence based in vivo screening technologies. Current Opinion in Pharmacology. 12 (5), 592-600 (2012).
- Welsh, D. K., Noguchi, T. Cellular bioluminescence imaging. Cold Spring Harbor Protocols. 2012 (8), (2012).
- Zhao, H., et al. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. Journal of Biomedical Optics. 10 (4), 41210 (2005).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Molecular Imaging. 12 (7), 1-13 (2013).
- Vintersten, K., et al. Mouse in red: red fluorescent protein expression in mouse ES cells, embryos, and adult animals. Genesis. 40 (4), 241-246 (2004).
- Stacer, A. C., et al. NanoLuc reporter for dual luciferase imaging in living animals. Mol Imaging. 12 (7), 1-13 (2013).
- Schoggins, J. W., et al. Dengue reporter viruses reveal viral dynamics in interferon receptor-deficient mice and sensitivity to interferon effectors in vitro. Proc Natl Acad Sci U S A. 109 (36), 14610-14615 (2012).
- Pan, W., et al. Visualizing influenza virus infection in living mice. Nat Commun. 4, 2369 (2013).
- Heaton, N. S., et al. In vivo bioluminescent imaging of influenza a virus infection and characterization of novel cross-protective monoclonal antibodies. J Virol. 87 (15), 8272-8281 (2013).
- Nogales, A., Baker, S. F., Martínez-Sobrido, L. Replication-competent influenza A viruses expressing a red fluorescent protein. Virology. 476, 206-216 (2015).
- Nogales, A., et al. A novel fluorescent and bioluminescent Bi-Reporter influenza A virus (BIRFLU) to evaluate viral infections. Journal of Virology. , (2019).
- Nogales, A., et al. Influenza A Virus Attenuation by Codon Deoptimization of the NS Gene for Vaccine Development. Journal of Virology. 88 (18), 10525-10540 (2014).
- Nogales, A., DeDiego, M. L., Topham, D. J., Martinez-Sobrido, L. Rearrangement of Influenza Virus Spliced Segments for the Development of Live-Attenuated Vaccines. Journal of Virology. 90 (14), 6291-6302 (2016).
- National Research Council (U.S.). Committee for the Update of the Guide for the Care and Use of Laboratory Animals., Institute for Laboratory Animal Research (U.S.) & National Academies Press (U.S.). . Guide for the care and use of laboratory animals. , (2011).
- Nogales, A., Martinez-Sobrido, L., Chiem, K., Topham, D. J., DeDiego, M. L. Functional Evolution of the 2009 Pandemic H1N1 Influenza Virus NS1 and PA in Humans. Journal of Virology. 92 (19), (2018).
- Hall, M. P., et al. Engineered luciferase reporter from a deep sea shrimp utilizing a novel imidazopyrazinone substrate. ACS Chemical Biology. 7 (11), 1848-1857 (2012).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved