Method Article
腎糸球体と腎糸球体細胞表面タンパク質の標識体内の分離
要約
ここでマウスの体内でビオチンと腎糸球体細胞表面タンパク質のラベリングのためのプロトコルを提案する.このプロトコルは、マウス腎臓の灌流、腎糸球体に分離および興味の蛋白質の内因性の免疫沈降を実行する方法について説明します。
要約
蛋白尿は糸球体のフィルター窓内皮細胞、糸球体基底膜とスリットにダイアフラムの足で構成されているの中断に起因します。デリケートな糸球体のフィルター、特にスリット ダイヤフラムの構造は、さまざまな細胞表面蛋白質の相互作用に依存しています。これらの細胞の表面蛋白質を勉強ところの in vitro研究や組織学的分析にとどまってきた。標識法は、生理学的および病態生理学的条件下での腎糸球体細胞表面タンパク質の研究を可能にするマウス体内の講演を紹介します。このプロトコルは、マウス腎臓の灌流、腎糸球体に分離および興味の蛋白質の内因性の免疫沈降を実行する方法について説明します。腎糸球体細胞表面豊かな半定量はこの手法とビオチン血流にアクセス可能なすべての蛋白質ですぐに利用できる、免疫沈降法を学ぶことができます。さらに、ビオチン化の有無は糸球体を分離できますさらに主糸球体細胞培養 (つまり、プライマリ ポドサイト細胞培養) と同様、糸球体の RNA とタンパク質の解析であります。
概要
蛋白尿は糸球体傷害の特徴で、通常糸球体のフィルター1の破壊を伴います。糸球体のフィルターは、穴あきの内皮細胞、糸球体基底膜と足細胞で構成されます。デリケートな糸球体のフィルターの分子構造は非常に動的かつセル表面蛋白質両方健康と病気の腎臓2,3,4,5,6 で人身売買の対象.セル表面蛋白質のエンドサイトーシスは、足7の生存のために不可欠であると示されています。ネフリンとポドカリキシン足細胞に発現する膜貫通タンパク質であります。ネフリンはスリット糸球体ダイヤフラムのバックボーン ポドカリキシンはコーティング足8,9,10の二次足プロセス シアロ糖タンパク質。エンドサイトーシスの人身売買は、ネフリンとポドカリキシン3,11,12,13,14以前示されています。
我々 の知る限り、セル表面蛋白質のエンドサイトーシスまだ記載されていない文献で糸球体の内皮細胞。ところが、血管内皮細胞は、一般にエンドサイトーシス (すなわち、クラスリン依存、いかだ依存エンドサイトーシス)15,16のさまざまな種類のすべての必要な蛋白質を表現します。したがって、血管内皮 (VE) を使用してこのメソッドを学ぶことができる血管内皮細胞表面の人身売買-カドヘリンおよび細胞の細胞接着分子 (ICAM-2)17糸球体内皮細胞のマーカー蛋白質の表面.
残念ながら、繊細な糸球体 3 層のフィルター表面蛋白質の売買を検討する、セルの正確な体外モデルはありません。このメソッドの目的は、人身売買生体腎糸球体蛋白を勉強します。さらに、このプロトコルには、糸球体、さらに糸球体の RNA、蛋白質、または細胞の解析を有効にするを分離する方法に関する情報が含まれています。18,19のテクニックは別によって記述されていると同様の糸球体分離グループの。
以前は、私たちと他の人の使用している前のヴィヴォビオチン化2,3,4,20,21腎糸球体細胞表面蛋白質の分類します。ただし、この前のヴィヴォメソッドで孤立した糸球体は、エンドサイトーシス人身売買に影響を与える可能性があります機械的ストレスにさらされました。また、腎糸球体細胞表面タンパク質の蛍光標識は広範囲で使用されて文学2,20,22。この方法では、しかし、少数の蛋白質だけを 1 つのスライド内で分析できる、蛍光画像の定量は困難です。
この新しい体内法腎糸球体細胞表面蛋白質豊かさと人身売買で正確に健康と病気、腎臓を勉強する信頼性の高いツールを提供しています、蛍光抗体テストへの追加として使用できます。
プロトコル
マウスは、ローカル動物のケア施設やフランスでジャンビエ ラボから社内品種として得られました。ケアと実験動物の使用 (米国国家機関の健康出版 85-23 号、1996 の改正のため、ガイドに記載されているガイドラインに従って、調査を行った。関連機関の承認に従ってすべての動物実験を行った (州政府 LANUV 参照番号 AZ:84-02.04。2016.A435)。
1. 商品、ソリューション、および装置の準備
- (MgCl2) 塩化マグネシウム 1 mM と 0.1 mM 塩化カルシウム (CaCl2) 添加リン酸緩衝生理食塩水 1 L を準備 (PBSCM) および滅菌フィルターをフィルター処理します。
- 灌流のマウスごと滅菌 PBSCM 5 mL を準備し、氷の上に置きます。
- 各マウスの 0.5 mg/mL ビオチンを添加した滅菌 PBSCM 5 mL を準備します。
- 各マウス滅菌 PBSCM 5 mL を準備し、108磁気ビーズ × 0.8 を追加 (e.g。、200 μ l 前処理なし、4 × 10 の8ビーズ/mL の溶液の) 糸球体の塞栓術の。オリジナル チューブ滅菌の磁気ビーズを保つためにセル文化ベンチの下このソリューションを準備します。氷の上には、このソリューションを配置します。
- 100 mM グリシンを PBSCM (マウスあたり 5 mL) に追加することによって焼入ソリューションを準備し、氷の上にそれを維持します。
- コラゲナーゼの解決 (0.378 U/mL 中のコラゲナーゼ A 滅菌 PBSCM) を確認します。マウスあたり 2 mL チューブにコラゲナーゼ溶液 1 mL をピペット、氷の上に置きます。
- 洗浄、滅菌 PBSCM を準備 (手順 1.1 参照) 50 mL のチューブし、氷の上に置きます。
- 灌流、2.0 mL/min の流量とシリンジ ポンプを使用します。
- 21 G 針、10 mL シリンジを準備します。針の先端が、20-30 cm の長いカテーテル (内径、ID = 0.58 mm)。カテーテルを接続 (ID 0.58 mm) 10 cm 短いカテーテル (0.28 mm ID) と小さいカテーテルの先端をマウス大動脈に簡単挿入するため斜めカットします。
- 手術中に手順の合字、マウスごとに 3 つの 5-7 cm シルク スレッド (6 - 0 4-0) をカットします。
- 手術のため 3 用クランプ、2 外科はさみ、ピンセット 2、2 高級ピンセット、1 高級シザー、綿棒を準備します。(例えば、腹腔内麻酔のケタミン 100 mg/kg 体重とキシラジン 5 mg/kg 体重) 麻酔を準備します。
- 2 つの腎臓の糸球体の分離、100 μ m の細胞ストレーナー、2 つの 50 ml チューブ、マグネット キャッチャーを使用します。
- チャップスの換散バッファーの準備: 20 mM 3 [(3-cholamidopropyl) dimethylammonio]-1-propanesulfonate (チャップス);20 mM トリス (ヒドロキシメチル)-aminomethan (トリス) pH 7.5;50 mM sodiumchorlide (NaCl);50 mM sodiumfluoride (NaF);15 mM Na4P2O7;0.1 mM エチレンジアミン四酸 (EDTA) pH 8.0;2 mM の sodiumorthovanadate。2 mM adenosinetriphosphat (ATP)。
- クールなの遠心分離機 4 ° C
2. 顕微鏡下での手術
- マウスの麻酔 (例えばケタミン ・ キシラジンと腹腔内、手順 1.11 参照)。適切な麻酔を確認するつま先ピンチ テストを実行します。
- 70% イソプロピル アルコール液をマウスの腹部の側面を消毒します。
- 胸骨に骨盤から皮膚を通してメディアン カットを実行し、ピンセットを使用して腹部の筋膜から皮膚を削除します。腹部の真ん中、両側手術ハサミで皮膚をカットします。
- 手術器具を変更します。剣から腹部の筋肉層を通して膀胱にメディアン カットを適用、ピンセット、手術用のはさみを使用して 4 つの象限に分けてください。上の 2 つの脇のマウスの首の方向に 2 つ用クランプとクランプ付します。
注: 腹部が今開かれます。 - 滅菌綿棒で取って内臓を入れて、高級ハサミ肝横隔膜靭帯をカットします。
- 2 つの高級ピンセットで副腎の高さに腎動脈の近位大動脈の周り (6 - 0 絹糸 4-0) で結紮を準備します。ピンセットで血流を廃止する近位大動脈結紮を締めます。
- 無料の筋膜、脂肪、および他の組織から遠位の大動脈、微細手術用ピンセットを用いた腎動脈の頭蓋の肝/上腸間膜動脈周囲の結紮を準備します。
- 腎動脈の遠位腹部大動脈周囲 (6 - 0 絹糸 4-0) で結紮を準備し、クランプ下大静脈と大動脈分岐部の高さで。
- 小さな穴にカット大動脈遠位腎動脈大動脈の直径の半分穴があるので。大動脈にカテーテルを入れ、合字の準備でそれを修正します。
注意: は、空気塞栓を防ぐために灌流システムの泡を避けるため。 - 灌流を 2 mL/min の流速で冷えた PBSCM に始まります。
- 微細手術用はさみで腎動脈のレベルで腎静脈に穴をカットし、肝および腸間膜動脈を結紮を締めます。
注: 腎臓は灌流を開始した後淡いに向ける必要があります。
3生体内でビオチン化。
- 変更バブル無料の冷たい PBSCM を注射器は、ラベリング、表面のビオチンは 0.5 mg/mL を添加した、2 mL/min の流量で 5 mL と腎臓の灌流します。
注: ミックス (例えば、 50 mL のチューブを回して) PBSCM ソリューション ソリューション内の泡の形成を避けるために優しく。シリンジ内溶液の吸引後、シリンジから空気や泡を避難します。カテーテル システムに接続されているカニューレのスペースを埋めるための注射器で余分なカニューレ (21 G) を使用します。最後に、泡なしカテーテル、カニューレに注射器を付けなさい。 - 無気泡シリンジを糸球体を消すし、2 mL/min の流量で 5 ml を灌流する 100 mM グリシンを添加した氷の PBSCM に変更します。
- 変更バブル無料の冷たい PBSCM をシリンジ 200 μ L 磁気ビーズ/mL を添加した、2 mL/分で腎臓の灌流します。
注: 腎臓表面に茶色の磁気ビーズと糸球体の塞栓術、表示されます。
4. 糸球体 2 つの腎臓からの分離
- 門で腎臓、カプセルを取り外します。10 cm の細胞培養皿の PBSCM の 15 mL の氷に腎臓を配置します。腎臓を収穫後麻酔下頚部転位とマウスを安楽死させます。手術および灌流の手順の最後約 20-22 分。
- 粉々 にカット腎臓、最小可能な新しいダブル エッジ刃を持つ。コラゲナーゼ A の 1 ml 2 mL チューブに組織を移動 (ステップ 1.6 参照) と 37 ° C, 30 分のダイジェスト。前に、消化後に、軽く 1000 μ L ピペットをカット ミックスします。
- 冷たい PBSCM を使用して 100 μ m 携帯こし器を通って消化組織をすすいでください。優しく細胞スクレーパーを使用して、残り組織トラフ セル ストレーナーをミンチし、50 mL の容量にその後冷えた PBSCM でそれをすすいでください。
- 4 ° C 500 x グラムの懸濁液を遠心分離機 5 分、上清を除去し、ボルテックス ペレット中の冷たい PBSCM 1.5 mL 弱でペレットを再懸濁します。その後、糸球体の懸濁液を新しい 2 mL チューブに入れます。
5. 洗浄
- マグネット キャッチャーを使用して、1 つの側面に糸球体を抽出します。糸球体の磁石に向かって移動している前に 1 分間待ちます。
- マグネット キャッチャーに 2 mL 管したまま 1000 μ L ピペットで上澄みを削除します。最初と 2 番目の洗濯中にステップは糸球体の損失を避けるために管のままに清の 250 μ L を (ステップ 5.3 を参照)。この手順では、すぐにチューブの底に沈む管状構造をさせることを避けるため。
注: 洗濯手順長く持続するそれ以外の場合。 - マグネット キャッチャーから 2 mL チューブを外し、PBSCM、(非常に重要)、その後上下のピペット 1 mL を加える渦。
- マグネット キャッチャーにチューブを戻すし、5.2 でやり直します。
- 糸球体の純度が 90% に達するまでは、洗浄のステップを繰り返します。これは、顕微鏡 (40 〜 100 倍) で清の代表的な因数を調べてください。
注: 糸球体は、茶色の磁気ビーズを含むラウンド構造として表示されます。細長い構造は鋼管のフラグメントあり無料磁気ビーズは、茶色の丸い点として表示されます。かさばる構造体として細胞の残骸があります。 - 純度に達した場合は、1 ml PBSCM の球体を溶解することにより糸球体の数を見積もります。混合した後、10 μ L の因数を取り出して顕微鏡下で糸球体をカウントします。次の式により糸球体の数を計算する: 最終的な糸球体数 = 10 μ L 分注 x 100 で糸球体の数。
- 糸球体の分離を成功させるは、10,000-40,000 の球体の範囲に します。
6 蛋白質の抽出と免役沈降法 (IP)
- 6800 x g で 5 分間で 4 ° C で遠心分離によって収集糸球体マグネット キャッチャーを使用しながら上澄みを除去し、冷たい換散バッファーでペレットを再懸濁します (e.g、300 μ l; 30,000 糸球体。チャップスを 1.11 の手順を参照)。30 の最高速度で組織ホモジナイザーを用いたサンプルを均質化 s させ、30 分間氷の上にそれらを分離します。
- 4 ° C で 30 分間 15,000 × g で遠心分離によっての不溶性物質を削除します。ピペットの上清を新しい 1.5 mL チューブに lysate のセルが含まれます。ペレットを破棄します。
- ビシンコニン (BCA) を使用して、上清のタンパク質濃度の測定-製造元の指示に従って手法します。700-1,000 μ g/mL の糸球体蛋白量に 30,000 糸球体の成功溶解をもたらします。換散バッファーと同じ蛋白質量を調整します。
- 糸球体の総体積の 10% の因数を取るライセート、95 ° C で塩化物イオン + 5 分間インキュベーションする前に dithiothreithol (DTT) x 2 を追加
- IP、頭上式シェーカーで 4 ° C で一晩ストレプトアビジン アガロース ビーズ ライセートの残りの部分を孵化させなさい。
- アガロース ビーズ 4 ° C で 3 分間 1000 × g で遠心、上清を削除し、非特異的タンパク質結合のビーズを洗浄する換散バッファーの 800 μ L を追加します。
- 3 回、洗浄を繰り返し、上清を完全に削除します。
- 塩化物イオン + DTT × 2 の 30 μ L を追加し、95 ° C、5 分で孵化させなさい。
- ライセートを読み込むと IP プローブ 10 %sds のゲルし 70 V、30 分間で 20 で SDS のゲルを実行 1.5 h. のためのゲルあたり mA はその後、200 で 2 h のためのゲルをしみニトロセルロース膜に mA。
- 洗浄液に一晩 5% ウシ血清アルブミン (BSA) で 4 ° C で硝酸セルロースの膜をブロックします。
- 4 ° C で一晩興味の抗体を持つ膜をインキュベートします。シェーカー上で 5 分間 3 回バッファーを洗浄洗浄し、室温で 1 h の HRP 標識二次抗体と膜を孵化させなさい。洗浄手順を繰り返します。
- ライセートを視覚化し、CCD カメラで超解像化学発光剤を用いて、膜プローブを免疫沈降.
結果
糸球体を正確に分離するには、最初 PBSCM とマウスの腎臓を灌流する必要は。PBSCM による血液灌流腎淡 (図 1A) になります。磁気ビーズと糸球体の塞栓術、腎臓の表面 (図 1B) に茶色のドットとして表示されます。マグネット キャッチャーで糸球体の分離は、(図 1C) 腎隣接で汚染を表示ことがあります。糸球体における前に、腎糸球体の純度 > 95% は、糸球体をより徹底的に洗浄することにより成し遂げられる必要が (図 1D)。
生体内でビオチン化はビオチンと表面蛋白質をセルにラベルを付ける機能に依存しています。これを調査するには、マウスの腎臓は PBSCM または細胞膜非透過性ビオチンと灌流します。図 2に示すように、ビオチンが、ビオチン潅流ではなく、コントロール マウス腎臓の毛細血管ループにラベルを付けます。生体内でビオチン灌流によってラベル付けされた糸球体の細胞表層タンパク質を調べるためには、糸球体の抽出物のビオチンの端数の免疫沈降が実行されます。図 3糸球体の膜貫通タンパク質ネフリンとポドカリキシン ビオチン分数内沈澱がAに示します。ただし、コントロール マウス、ネフリンまたはポドカリキシンは検出されませんビオチン化タンパク質の沈澱率。ネガティブ コントロールとして細胞内タンパク質の細胞外シグナル調節キナーゼ p42 と p44 (ERK) コントロールとビオチン潅流マウス腎臓の両方のビオチン化タンパク質の免疫沈降した分数で発見されていません。このメソッドによってセル表面蛋白質ネフリンがビオチン化実際にであることを確認するには、コントロールとビオチン潅流マウス腎臓からネフリンを沈殿します。ビオチンを視覚化するには、沈澱分数はストレプトアビジンと汚れます。図 3Bビオチン潅流にビオチン化ネフリンを示していますが、動物を制御できません。ライセート コントロールは、コントロールとビオチン潅動物蛋白質の同量を示します。内皮細胞タンパク質血管内皮 (VE)-図 3Cに示すように、カドヘリンはビオチン分数内沈澱。コントロール マウスの VE カドヘリンは沈殿なし、VE カドヘリンはコントロールとビオチン潅動物の lysates 存在が。ビオチン潅動物から細胞接着分子 2 (ICAM-2) を沈殿、対照動物の ICAM-2 が見つからない場合。コントロールやビオチン潅動物の Lysates は同量の ICAM-2 (図 3C) を示します。アクチンはローディング コントロールとして提供しています。
このメソッドは、腎症 (腎毒性腎炎、NTNなど) のモデルにおける腎糸球体細胞表面タンパク質の量を定量化する使用することができます。NTN [NTN 血清注射後日 1 (1 d)] の初期の段階で、蛋白尿は急増しています。NTN [日 18 (18 d)] の後の段階で蛋白尿が大幅に低下します。図 4は、初期 NTN (1 d) でネフリン豊富な細胞表面を示しています。体内のビオチン化試金 (図 4A) は、コントロールに比べて NTN 動物で細胞表面ネフリンの削減を示しています。デンシトメトリーの分析は、NTN 動物コントロール (図 4C) と比較してのビオチン標識ネフリン (57%) の大幅な削減を示しています。アクチンに合計ネフリンの定量的解析はコントロールと NTN マウス (図 4B) 重要な違いを明らかにします。P57 ポドサイト セル特定染色を使用して、ポドサイト数値は、NTN とコントロールの動物 (図 4および4 e) の等しい量を表示します。図 5は、後半 NTN (18 d) のネフリン セル表面豊かな結果を表示します。図 5A制御およびセル表面ネフリンの回復を示す NTN マウスの生体内でビオチン化アッセイを示しています。デンシトメトリー分析は、コントロールおよび NTN マウス (図 5B) のセル表面ネフリンの重要な違いを表示しません。合計ネフリン NTN マウス (図 5C) で 25% 減少しました。ポドサイト番号は NTN マウス約 19% (図 5 5 e) によってコントロールと比較して減少しました。

図 1: 腎臓の灌流、腎糸球体の分離します。PBSCM と灌流後マウスの内臓に顕微鏡を通して (、) のビュー。大動脈にカテーテルは、矢印で示されます。PBSCM による血液灌流は、青ざめさせて腎臓をリードします。(B) 塞栓磁気ビーズの糸球体は腎臓表面に茶色のドットとして表示されます。(C) 表示が私を示す顕微鏡) 糸球体 (構造ラウンド ブラウン); の汚染ii) と隣接 (光細長い構造);および iii) 細胞の残骸。糸球体の純度は約 50% です。無料磁気ビーズは、ブラウン ドット (倍率 100 倍) として表示されます。(D) 顕微鏡 (倍率 100 倍) の腎糸球体の 95% の純度を示すを表示します。スケール バー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。

図 2:ビオチン糸球体毛細血管ループを検出しました。PBSCM (コントロール) とビオチン (ビオチン) 潅流マウス糸球体 (C57BL/6) の代表的な蛍光イメージ。ビオチン (緑) はストレプトアビジン ビオチン潅流マウスだけで糸球体毛細血管ループで可視化しました。コントロール マウスでは、糸球体のビオチンの染色は表示されません。両方のマウスを球体の核では、WT1 (赤) が検出されました。この図は、以前の文書20から変更されています。この図の拡大版を表示するのにはここをクリックしてください。

図 3: In vivo 腎糸球体細胞表面タンパク質のビオチン ラベルします。(A) 西部のしみの沈澱 (IP) ビオチン化細胞表面タンパク質の解析 (IP: ストレプトアビジン アガロース ビーズ) と溶解液 (溶解液) PBSCM 潅流 (コントロール) とビオチン潅流 (ビオチン) マウスからの腎臓。ネフリンの膜貫通蛋白質とポドカリキシンはビオチン潅流マウス腎臓の沈澱サンプルでのみ検出します。コントロール マウス、ネフリンとポドカリキシンないコントロール マウス腎臓の沈澱プローブで検出されます。コントロールやビオチン潅動物の lysates で合計ネフリンとポドカリキシンが、両方のグループで同様に表現されます。細胞内タンパク質の細胞外シグナル調節キナーゼ p42 と p44 (ERK) コントロールとビオチン潅流マウス腎臓の沈澱プローブで検出されません。両方のマウスのグループの lysates ERK は、等しい量で検出されます。ローディング コントロールとしてアクチンは黒ずんでいます。(B) 西部のしみの沈澱ネフリンの解析 (IP: α ネフリン) PBSCM 潅流 (コントロール) およびビオチン潅流 (ビオチン) マウスの。ビオチン灌流腎制御マウス ネフリンの検出が見つからない中、ネフリンはストレプトアビジン染色、可視化します。ネフリンの沈澱分数 (IP: α-ネフリン、WB: ネフリン) ライセートの一部だけでなく、(ライセート、WB: ネフリン) ネフリンのネフリンを同量のステンド グラスします。アクチンは、ローディング コントロールとして使用されます。(C) 沈澱ビオチン標識細胞表面タンパク質のウェスタンブロッティング (IP: ストレプトアビジン アガロース ビーズ) と PBSCM 潅流 (コントロール) とビオチン潅流 (ビオチン) マウスからの腎臓の lysates (溶解)。貫通型のマーカー蛋白質血管内皮 (VE)-カドヘリン、細胞接着分子 2 (ICAM-2) は沈澱量ビオチン潅動物でのみ検出します。コントロール マウスで VE カドヘリンや ICAM-2 は検出されません。アクチンは、ローディング コントロールとして機能します。この図は、以前の文書20から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
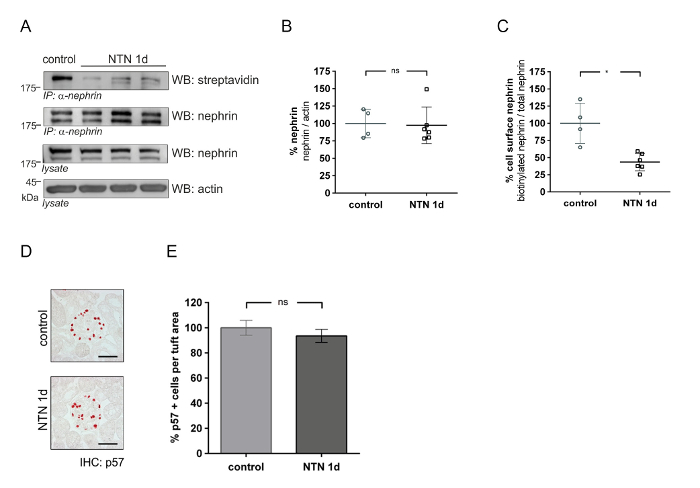
図 4: 初期腎毒性腎炎腎症 (NTN) における糸球体蛋白ネフリン豊富。(A) 西部のしみの表面ネフリンの解析 (IP: α-ネフリン、WB: ストレプトアビジン) と合計ネフリン (IP: α ネフリンまたはライセート、WB: ネフリン) コントロールと抗血清投与マウス (NTN 1 d) で。アクチンは、ローディング コントロールとして機能します。NTN のコントロールと比較して扱われたマウス表示セル表面ネフリンを削減 (IP: α ネフリン、WB ストレプトアビジン) コントロールと比較して。(B) コントロールおよび NTN 1 d マウスの合計ネフリン/アクチンの定量的解析 [n を制御 = 4、NTN n = 6、非有意差 (ns)]。コントロールおよび NTN マウスの細胞表面ネフリン (ビオチン ネフリン/総ネフリン) の (C) Densitometric 分析 (* p < 0.01 制御 n = 4、NTN n = 6)。(D) p57 免疫制御と NTN 1 d マウスの足を示します。(E) p57 房面積 (μ2) 肯定的な細胞の数量化解析。(マウスの定量化、ns あたり 40 糸球体)。西部のしみのデータは意味 ± SD. ポドサイト カウントは意味 ± SEM. Unpaired tを表示-ウェルチの補正でテストします。スケールバー = 50 μ m。この図は、以前の文書20から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
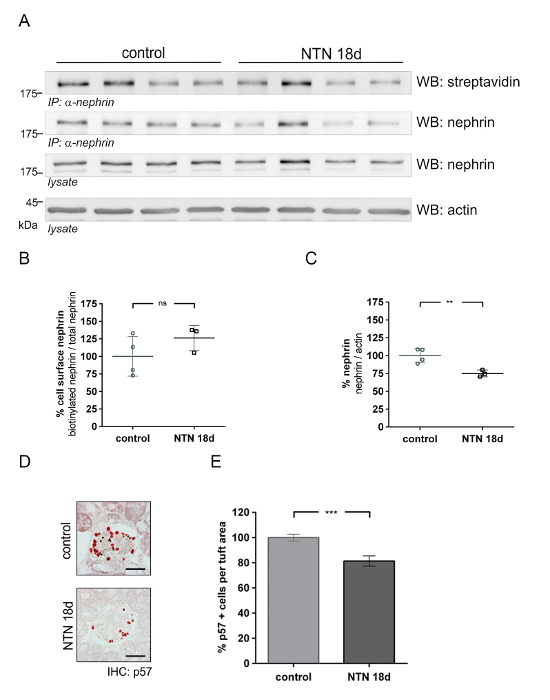
図 5: 後半の腎毒性腎炎腎症 (NTN) における糸球体蛋白ネフリン豊富。(A) 西部のしみの表面ネフリンの解析 (IP: α-ネフリン、WB: ストレプトアビジン) と合計ネフリン (IP: α ネフリンまたはライセート、WB: ネフリン) コントロールと抗血清の投与マウス (NTN 18 d)。コントロールと比較して NTN 18 d マウス表示セル表面ネフリンの同量 (IP: α-ネフリン、WB: ストレプトアビジン)。NTN 投与 18 日表示にマウス以下の合計ネフリンとアクチンをローディング コントロールとして提供しています。(B) デンシトメトリー分析表示コントロールと NTN 18 d マウス間細胞表面ネフリンに有意差 (n を制御 = 4、NTN n = 3)。(C) Densitometric アクチンに合計ネフリンの分析。18 日に NTN マウス、コントロールに比べてネフリンのより少ない表現がある (n を制御 = 4、NTN n = 3、* * p < 0.001)。(D) p57 免疫制御と NTN 18 d マウスの足を示します。(赤) NTN 18 d マウス コントロールと比較して少ない p57 陽性細胞が集まっています。磁気ビーズは、黒いドットとして表示されます。(E) 糸球体房面積 (μ2) p57 陽性細胞の定量的解析 (* * * p < 0.0001 制御 n = 2、NTN n = 2、定量化マウスあたり 40 糸球体)。西部のしみのデータは意味 ± SD. ポドサイト カウントは意味 ± SEM. 統計解析を表示: 対になっていないt-ウェルチの補正でテストします。スケールバー = 50 μ m。この図は、以前の文書20から変更されています。この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
提案手法により糸球体糸球体 RNA か蛋白質を調査するための分離を成功させる。さらに、プライマリの腎糸球体細胞文化は分離の腎糸球体から実行できます。ビオチンは、糸球体の分離の前に適用されます、腎糸球体細胞表面蛋白質の分類が実行できます。この方法では、体内の腎糸球体細胞表面タンパク質輸送を学ぶことができると蛋白質量の半定量が可能です。腎糸球体細胞の表面の蛋白質の量を正しくテストするための最も重要な手順は、1) マウス外科特に大動脈カニュレーションの手動専門知識の開発、2) 無気泡注射器の接続の空気塞栓を避けるために、腎糸球体に、3) PBSCM による血液灌流が開始したら冷たい条件の下で働きます。
この手法は、マウス外科マニュアル専門知識が不可欠です。大動脈カニュレーションは、容器の郭清は腎臓の灌流を防ぐために特に重要です。大動脈のカットは十分な大きさにする必要があります (血管径の約 50%) カテーテルを導入する十分なスペースを作成します。カテーテルは斜めにカットされて、大動脈にカテーテルの導入が容易になります。郭清に加え導入カテーテル置かれるべき大動脈内高い腎動脈を妨げないために。腎動脈はそれ以外の場合ビオチンと磁気ビーズ潅ないです。
ビオチンは、ストレプトアビジン蛋白質に高い親和性と結合する小さなビタミンです。そのサイズが小さいため (244 Da)、ビオチンは共役蛋白質の機能は変更されず、糸球体で濾過されるが。ストレプトアビジンと孵化、ビオチン化タンパク質がアガロース ビーズやその他の方法で区切るありますタグなしタンパク質簡単に。ビオチンの N hydroxysuccimide (NHS) エステルはアミンにバインド (-NH2)、例えばリジン残基の側鎖の豊富な蛋白質のグループ。スルホ NHS LC ビオチンは、水溶性とセルは不浸透性、細胞膜が変更されていない場合です。スルホ NHS LC ビオチンは、セル表面蛋白質23のラベルに示されています。ビオチン NHS エステル アミン グループのバインドが pH (7-9) とアミン無料バッファー (すなわちPBSCM) の使用によって異なります。7.4 の pH と PBSCM は、それは最適な溶解度とビオチンの機能で最適な生理学的な特性を組み合わせたしたがってビオチンとマウス腎臓を灌流して使用されました。ラベル付け後タンパク質をクエンチするには、グリシンのアミン グループにバインドするために無料のビオチンを許可するグリシンによる PBSCM の血液灌流が実行されます。動物の死の後の細胞プロセスを防ぐため、冷えたソリューションによる血液灌流を行い、氷で作業を続けることが重要です。
Ex vivoビオチン化メソッドと同様に、生体内でビオチン化中の糸球体の処理への機械的応力プロトコル 5 月も影響エンドサイトーシス、急速なイベント、および RNA の整合性をシグナリングします。したがって、細胞の酵素活性のリスクを軽減する氷の上すべての処理ステップが実行されることが不可欠です。
深刻な抗血清腎炎 (NTN) 損傷マウス腎臓のような漏出の動物モデル。特に、NTN は病気 (42 日間)24の高度な段階で腎線維症につながる尿細管病変、糸球体硬化症、メサンギウム拡大で起因します。疾患モデルにおける来たした腎糸球体の障害の灌流は、蛋白質量の偏りのある結果をもたらすかもしれません。硬化糸球体ない磁気ビーズの潅可能性が高いが、こうして、この方法で分離になる可能性がありますありません。激しい糸球体硬化症につながる病気モデルで異なるふるい手順を介して糸球体を分離する技術を使用してこのプロトコル25で使用される磁気ビーズ法に代わる可能性があります。ただし、糸球体が厳しくありなら、ビオチンとも血流が損なわれます。さらに、抽出された糸球体が浴びる前のヴィヴォビオチン ソリューション21では、講演の前のヴィヴォおそらくされませんこれらのモデルで有利であります。また、それは糸球体の血流に依存しないよう、深刻な病気の糸球体におけるタンパク質豊富なは、有利になることを検出する蛍光の使用します。
この手法を使用して蛋白質の量の半定量は、密度測定を使用して、うまく動作します。しかし、密度測定の検出限界の結果として蛋白質量のわずかな違いを逃すことができます。
記載した技術は興味の構造、分離の手法でアクセスするか、または興味の表面の蛋白質は 1 つのセル型または器官の構造に固有灌流は、他の動物の臓器に転送できます。にもかかわらずすべての表面蛋白質この手法によりビオチン化は、特異抗体を用いた免疫沈降法と、(図 3Bではネフリンの示すように) に特定の蛋白質の細胞表面タンパク質発現量に します。
開示事項
著者が明らかに何もありません。
謝辞
著者は、彼女の卓越したテクニカル サポートにブランカ Duvnjak をありがとうございます。この作品は、ドイツ研究振興協会 (www.dfg.de) WO1811/2-1 m. w. に、QU280/3-1 星に想いを支えられました。出資者には、研究デザイン、データ収集、データ分析、意思決定、公開する、原稿の準備の役割はなかった。
資料
| Name | Company | Catalog Number | Comments |
| Motic SMZ168 BL | Motic | SMZ168BL | microscope for mouse surgery |
| KL1500LCD | Pulch and Lorenz microscopy | 150500 | light for mouse surgery |
| Rompun (Xylazin) 2% | Bayer | PZN:01320422 | anesthesia |
| Microfederschere | Braun, Aesculap | FD100R | fine scissors, for cut into the aorta |
| Durotip Feine Scheren | Braun, Aesculap | BC210R | for abdominal cut |
| Anatomische Pinzette | Braun, Aesculap | BD215R | for surgery until the abdomen is opened |
| Präparierklemme | Aesculap | BJ008R | for surgery |
| Seraflex | Serag Wiessner | IC108000 | silk thread |
| Ketamine 10% | Medistar | anesthesia | |
| Rompun (Xylazin) 2% | Bayer | anesthesia | |
| Fine Bore Polythene Tubing ID 0.28mm OD 0.61mm | Portex | 800/100/100 | Catheter |
| Fine Bore Polythene Tubing ID 0.58mm OD 0.96mm | Portex | 800/100/200 | Catheter |
| Harvard apparatus 11 Plus | Harvard Apparatus | 70-2209 | syringe pump |
| EZ-link Sulfo-NHC-LC-Biotin | Thermo Scientific | 21335 | biotin |
| Dynabeads Untouched Mouse T-cells | Invitrogen | 11413D | to embolize glomeruli |
| Collagenase A | Roche | 10103578001 | to digest kidney tissue |
| DynaMag-2 | Invitrogen | 123.21D | Magnet catcher |
| 100µm cell stainer | Greiner-bio | 542000 | for glomerular isolation |
| Axiovert 40 CFL | Zeiss | non available | to confirm glomerular purity |
| TissueRuptor | Quiagen | 9002755 | Tissue homogenizer |
| CHAPS | Sigma-Aldrich | C3023 | for lysis buffer |
| Tris-HCL | Sigma-Aldrich | T5941 | for lysis buffer |
| NaCl | VWR chemicals | 27810295 | for lysis buffer |
| NaF | Sigma-Aldrich | 201154 | for lysis buffer |
| EDTA | Sigma-Aldrich | E5134 | for lysis buffer |
| ATP | Sigma-Aldrich | 34369-07-8 | for lysis buffer |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | Follow the manufacturer's instructions |
| nephrin antibody | Progen | GP-N2 | for westernblot |
| Polyclonal goat anti-podocalyxin antibody | R&D Systems | AF15556-SP | for westernblot |
| Streptavidin Agarose Resin | Thermo Scientific | 20347 | for immunoprecipitation |
| Protein A sepharose CL-4B | GE Healthcare | 17096303 | for immunoprecipitation |
| polyclonal rabbit anti-p57 antibody | SCBT | sc-8298 | for Immunohistochemistry |
| mouse monoclonal anti-beta actin antibody, clone AC-74 | Sigma-Aldrich | A2228 | Western blot loading control |
| rabbit anti-p44/42 | cell signalling | 4695 | for westernblot |
| Pierce High sensitivity streptavidin-HRP | Thermo Scientific | 21130 | for westernblot |
| polyclonal mouse ICAM-2 antibody | R&D Systems | AF774 | for westernblot |
| polyclonal mouse anti-VE-cadherin | R&D Systems | AF1002 | for westernblot |
参考文献
- Jefferson, J. A., Alpers, C. E., Shankland, S. J. Podocyte biology for the bedside. American Journal of Kidney Disease. 58 (5), 835-845 (2011).
- Konigshausen, E., et al. Angiotensin II increases glomerular permeability by beta-arrestin mediated nephrin endocytosis. Scientific Reports. 6, 39513(2016).
- Quack, I., et al. beta-Arrestin2 mediates nephrin endocytosis and impairs slit diaphragm integrity. Proceedings of the National Academy of Science of the United States of America. 103 (38), 14110-14115 (2006).
- Quack, I., et al. PKC alpha mediates beta-arrestin2-dependent nephrin endocytosis in hyperglycemia. Journal of Biological Chemitry. 286 (15), 12959-12970 (2011).
- Swiatecka-Urban, A. Endocytic Trafficking at the Mature Podocyte Slit Diaphragm. Frontiers in Pediatrics. 5, 32(2017).
- Swiatecka-Urban, A. Membrane trafficking in podocyte health and disease. Pediatric Nephrology. 28 (9), 1723-1737 (2013).
- Soda, K., et al. Role of dynamin, synaptojanin, and endophilin in podocyte foot processes. The Journal of Clinical Investigation. 122 (12), 4401-4411 (2012).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein--nephrin--is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Martin, C. E., Jones, N. Nephrin Signaling in the Podocyte: An Updated View of Signal Regulation at the Slit Diaphragm and Beyond. Frontiers in Endocrinology (Lausanne). 9, 302(2018).
- Nielsen, J. S., McNagny, K. M. The role of podocalyxin in health and disease. Journal of the American Society of Nephrology. 20 (8), 1669-1676 (2009).
- Yasuda, T., Saegusa, C., Kamakura, S., Sumimoto, H., Fukuda, M. Rab27 effector Slp2-a transports the apical signaling molecule podocalyxin to the apical surface of MDCK II cells and regulates claudin-2 expression. Molecular Biology of the Cell. 23 (16), 3229-3239 (2012).
- Tossidou, I., et al. Podocytic PKC-alpha is regulated in murine and human diabetes and mediates nephrin endocytosis. Public Library of Science One. 5 (4), 10185(2010).
- Qin, X. S., et al. Phosphorylation of nephrin triggers its internalization by raft-mediated endocytosis. Journal of the American Society of Nephrology. 20 (12), 2534-2545 (2009).
- Waters, A. M., et al. Notch promotes dynamin-dependent endocytosis of nephrin. Journal of the American Society of Nephrology. 23 (1), 27-35 (2012).
- Zhang, X., Simons, M. Receptor tyrosine kinases endocytosis in endothelium: biology and signaling. Arteriosclerosis Thrombosis and Vascular Biology. 34 (9), 1831-1837 (2014).
- Maes, H., Olmeda, D., Soengas, M. S., Agostinis, P. Vesicular trafficking mechanisms in endothelial cells as modulators of the tumor vasculature and targets of antiangiogenic therapies. Federation of European Biochemical Societies Journal. 283 (1), 25-38 (2016).
- Satchell, S. C., et al. Conditionally immortalized human glomerular endothelial cells expressing fenestrations in response to VEGF. Kidney International. 69 (9), 1633-1640 (2006).
- Takemoto, M., et al. A new method for large scale isolation of kidney glomeruli from mice. American Journal of Pathology. 161 (3), 799-805 (2002).
- Liu, X., et al. Isolating glomeruli from mice: A practical approach for beginners. Experimental and Therapeutic Medicine. 5 (5), 1322-1326 (2013).
- Haase, R., et al. A novel in vivo method to quantify slit diaphragm protein abundance in murine proteinuric kidney disease. Public Library of Science One. 12 (6), 0179217(2017).
- Satoh, D., et al. aPKClambda maintains the integrity of the glomerular slit diaphragm through trafficking of nephrin to the cell surface. Journal of Biochemistry. 156 (2), 115-128 (2014).
- Tomas, N. M., et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy. New England Journal of Medicine. 371 (24), 2277-2287 (2014).
- Daniels, G. M., Amara, S. G. Selective labeling of neurotransmitter transporters at the cell surface. Methods in Enzymology. 296, 307-318 (1998).
- Ougaard, M. K. E., et al. Murine Nephrotoxic Nephritis as a Model of Chronic Kidney Disease. International Journal of Nephrology. 2018, 8424502(2018).
- Salant, D. J., Darby, C., Couser, W. G. Experimental membranous glomerulonephritis in rats. Quantitative studies of glomerular immune deposit formation in isolated glomeruli and whole animals. Journal of Clinical Investigation. 66 (1), 71-81 (1980).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved