Method Article
Aislamiento de glomérulos y en Vivo de etiquetado de proteínas de la superficie celular Glomerular
En este artículo
Resumen
Aquí presentamos un protocolo para murino en vivo etiquetado de proteínas de la superficie celular glomerular con biotina. Este protocolo contiene información sobre la perfusión de los riñones de ratón, aislar glomérulos y realizar endógena inmunoprecipitación de la proteína de interés.
Resumen
Proteinuria resulta de la alteración del filtro glomerular que está conformada por el endotelio fenestrado, la membrana basal glomerular y podocytes con sus diafragmas de abertura. La delicada estructura del filtro glomerular, especialmente el diafragma de la raja, se basa en la interacción de proteínas de superficie de diversas células. Estudio de estas proteínas de superficie celular hasta el momento se ha limitado a estudios en vitro o análisis histologic. Aquí, presentamos un murino en vivo Biotinilación etiquetado método, que permite el estudio de las proteínas de superficie celular glomerular bajo condiciones fisiológicas y fisiopatológicas. Este protocolo contiene información sobre la perfusión de los riñones de ratón, aislar glomérulos y realizar endógena inmunoprecipitación de la proteína de interés. Semi-cuantificación de la abundancia de superficie celular glomerular está disponible con este nuevo método y todas las proteínas accesibles a perfusión de biotina e inmunoprecipitación puede estudiarse. Además, aislamiento de glomérulos con o sin Biotinilación permite más análisis de RNA glomerular y proteínas así como glomerular primaria de la célula cultura (es decir, Podocito primario de la célula).
Introducción
Proteinuria es un sello de lesión glomerular y generalmente acompaña alteración del filtro glomerular1. El filtro glomerular está compuesto por el endotelio fenestrado, la membrana basal glomerular y podocytes. La delicada estructura molecular del filtro glomerular es altamente dinámico y sujeto a la proteína de la superficie de la célula trata de ambos riñones sano y enfermo2,3,4,5,6 . Endocitosis de proteínas de la superficie de la célula se ha demostrado para ser esencial para la supervivencia de los podocytes7. Nefrina y podocalyxin son proteínas transmembranales expresadas en podocytes. Nephrin está la espina dorsal de la membrana glomerular raja, podocalyxin es una Sialoglicoproteína capa los procesos secundario pies de podocitos8,9,10. Trata endocíticas se ha demostrado previamente para nefrina y podocalyxin3,11,12,13,14.
Al mejor de nuestro conocimiento, endocitosis de proteínas de la superficie de la célula todavía no se ha descrito en las células endoteliales glomerulares en la literatura. Sin embargo, las células endoteliales expresan en general todas las proteínas necesarias para los diferentes tipos de endocitosis (es decir, endocytosis clathrin-dependiente, dependiente de la balsa)15,16. Por lo tanto, trata de superficie de célula endotelial puede ser estudiada con este método, por ejemplo, vascular endotelial (VE)-cadherin y molécula de adhesión intracelular (ICAM-2) como una célula superficie marcador proteico de las células endoteliales glomerulares17 .
Desafortunadamente, existe un modelo exacto en vitro para el filtro glomerular tres capas delicado en que la célula trata de la proteína de la superficie puede ser estudiada. El objetivo de este método es por lo tanto para el estudio de proteína glomerular tráfico en vivo. Además, este protocolo contiene información acerca de cómo aislar los glomérulos, lo que permite más análisis de RNA, proteínas o células glomerulares. Aislamiento glomerular similar técnicas han sido descritas por diferentes grupos de18,19.
Previamente, nosotros y otros hemos usado ex vivo de etiquetado de proteínas de la superficie celular glomerular Biotinilación2,3,4,20,21. Sin embargo, en este método ex vivo , glomérulos aislados fueron expuestos a esfuerzos mecánicos que pueden influir en tráfico endocítico. Por otra parte, inmunofluorescencia etiquetado de proteínas de la superficie celular glomerular ha ampliamente utilizado en la literatura2,20,22. Con este método, sin embargo, sólo un pequeño número de proteínas puede ser analizado dentro de una diapositiva, y cuantificación de imágenes de inmunofluorescencia es a menudo difícil.
Este método de novela en vivo ofrece una herramienta confiable para el estudio celular glomerular proteína superficial abundancia y trata exactamente en sanos y enfermos riñones, y puede ser utilizado como una adición a las pruebas de inmunofluorescencia.
Protocolo
Se obtuvieron ratones como una raza propia de las instalaciones de cuidado de los animales locales o de los laboratorios de Janvier en Francia. Las investigaciones se llevaron a cabo según las directrices descritas en la guía para el cuidado y uso de animales de laboratorio (US nacional institutos de salud publicación no. 85-23, revisada en 1996). Todos los experimentos con animales se realizaron conforme a las pertinentes aprobaciones institucionales (Gobierno del estado LANUV referencia número AZ:84-02.04. 2016.A435).
1. preparación de equipos, instrumentos y soluciones
- Preparar 1 L de solución salina amortiguada de fosfatos con 1 mM cloruro de magnesio (MgCl2) y 0,1 mM cloruro de calcio (CaCl2) (PBSCM) y filtrar con un filtro estéril.
- Preparar 5 mL de PBSCM estéril por ratón para perfusión y coloque en hielo.
- Para cada ratón, preparar 5 mL de PBSCM estéril suplementada con biotina 0,5 mg/mL.
- Para cada ratón, preparar 5 mL de PBSCM estéril y añadir 0,8 x 108 granos magnéticos (ej., 200 μL de una solución de 4 x 108 granos/mL, sin tratamiento previo) para la embolización de los glomérulos. Preparar esta solución debajo del Banco de la cultura de célula para mantener las bolas magnéticas en el tubo original estéril. Colocar esta solución en el hielo.
- Preparar una solución de enfriamiento mediante la adición de glicina 100 mM para PBSCM (5 mL por ratón) y mantenerlo en hielo.
- Hacer una solución de colagenasa (0.378 U/mL colagenasa A en PBSCM estéril). Por ratón, Pipetear 1 mL de la solución de colagenasa en un tubo de 2 mL y coloque en hielo.
- Para lavarse, preparar PBSCM estéril (ver paso 1.1) en 50 mL del tubo y coloque en hielo.
- De perfusión, utilice una bomba con un caudal de 2,0 mL/min.
- Prepare jeringa de 10 mL con una aguja de 21G. Coloque la punta de la aguja de un catéter largo de 20-30 cm (diámetro interior, ID = 0,58 mm). Conectar el catéter (ID 0,58 mm) con un catéter corto de 10 cm (ID 0,28 mm) y cortar la punta del catéter más pequeño oblicuo para una fácil inserción en la aorta de ratón.
- Para los procedimientos de ligadura durante la cirugía, cortar tres hilos de seda 5-7 cm (4-0 6-0) a por el ratón.
- Para la cirugía, prepare 3 pinzas quirúrgicas, 2 tijeras quirúrgicas, 2 pinzas, 2 Pinzas finas, 1 tijera fina y esponjas. Preparar la anestesia (por ejemplo, intraperitoneal anestesia ketamina 100 mg/kg peso corporal y peso corporal de 5 mg/kg de xilacina).
- Para el aislamiento de los glomérulos de los dos riñones, use un colador de celda de 100 μm, dos tubos de 50 ml y una atracción de imán.
- Preparación de grietas del tampón de lisis: 20 m m 3 [(3-cholamidopropyl) dimetilamonio] -1-propanesulfonate (caps); 20 mM Tris (hidroximetil)-aminomethan (Tris) pH 7,5; sodiumchorlide 50 m m (NaCl); sodiumfluoride 50 mM (NaF); 15 mM Na4P2O7; pH de 0,1 mM etilendiaminotetracético (EDTA) el ácido 8.0; sodiumorthovanadate de 2 mM; y 2 mM adenosinetriphosphat (ATP).
- Centrífugas de frío a 4 ° C.
2. cirugía bajo el microscopio
- Anestesiar el ratón (por ejemplo, con ketamina/xilacina por vía intraperitoneal, vea paso 1.11). Realice la prueba del pellizco del dedo del pie para confirmar la anestesia adecuada.
- Desinfectar el lado ventral del ratón con isopropanol al 70%.
- Realizar una incisión mediana a través de la piel de la pelvis al esternón y quitar la piel de la fascia abdominal con unas pinzas. Cortar la piel a ambos lados en el medio del abdomen con tijeras quirúrgicas.
- Cambiar las herramientas quirúrgicas. Aplicar un corte mediano de xifoides a la vejiga a través de la capa del músculo abdominal y dividir en cuatro cuadrantes utilizando pinzas y tijeras quirúrgicas. Coloque las dos superior a un lado con las pinzas hacia el cuello del ratón con dos pinzas quirúrgicas.
Nota: Ahora se abre el abdomen. - Poner los órganos viscerales a un lado con un hisopo estéril y cortar el ligamento hepático-frénico con tijeras finas.
- Preparar una ligadura (con un hilo de seda 4-0 6-0) alrededor de la aorta proximal de las arterias renales en la altura de la glándula suprarrenal con dos pinzas finas. Apriete la ligadura aórtica proximal para abolir el flujo sanguíneo con pinzas.
- Libres de la aorta distal de la fascia, grasa y otros tejidos y preparar una ligadura alrededor de la arteria hepática/mesentéricos craneal de las arterias renales con finas pinzas quirúrgicas.
- Preparar una ligadura (con un hilo de seda 4-0 6-0) alrededor de la aorta distal de las arterias renales y la abrazadera de la vena cava y aorta a la altura de la bifurcación.
- Corte un pequeño agujero en la aorta distal a las arterias renales por lo que el agujero es mitad del diámetro de la aorta. Colocó el catéter en la aorta y fijar con la ligadura preparada.
PRECAUCIÓN: Evitar burbujas en el sistema de perfusión para evitar embolias gaseosas. - Iniciar la perfusión con la PBSCM helada con un caudal de 2 mL/min.
- Cortar un agujero en la vena renal a nivel de las arterias renales con finas tijeras quirúrgicas y apriete la ligadura alrededor de las arterias hepáticas y mesentéricas.
Nota: Los riñones deben resultar claros después de comenzar la perfusión.
3. en Vivo Biotinilación
- Cambio la jeringa libre de burbuja para helados PBSCM complementado con biotina 0,5 mg/mL para la superficie de etiquetado y perfusión de los riñones con 5 mL a un flujo de 2 mL/min.
Nota: Las soluciones PBSCM (p. ej., girando los tubos de 50 mL) se mezclan suavemente para evitar formación de burbujas dentro de la solución. Después de la aspiración de la solución en la jeringa, evacuar el aire ni burbujas de la jeringa. Use una cánula adicional (21G) en la jeringa para llenar el espacio en la cánula que está conectada al sistema de catéter. Por último, pegar la jeringa en la cánula con la sonda sin burbujas. - Cambiar la jeringa sin burbujas PBSCM helada suplementado con glicina 100 mM para saciar los glomérulos y perfusión con 5 mL a un flujo de 2 mL/min.
- Cambio la jeringa libre de burbuja para helados PBSCM complementado con 200 μL magnético granos/mL y perfusión de los riñones de 2 mL/min.
Nota: En la superficie del riñón, embolización de glomérulos con granos magnéticos marrón será visible.
4. aislamiento de glomérulos de los dos riñones
- Retirar los riñones en el hilum y retirar la cápsula. Poner los riñones en hielo en 15 mL de PBSCM en una placa de cultivo celular de 10 cm. Eutanasia el ratón con la dislocación cervical bajo anestesia después de la cosecha de los riñones. Los procedimientos de cirugía y de la perfusión duran aproximadamente 20-22 minutos.
- Corte los riñones en trozos más pequeños posibles con una nueva hoja de doble filo. Mover el tejido en un tubo de 2 mL con 1 mL de colagenasa A (ver paso 1.6) y digest a 37 ° C durante 30 minutos. Antes y después de la digestión, mezclar suavemente con un μL 1000 corte pipeta.
- Enjuague el tejido digerido por un colador de celda de 100 μm usando PBSCM helada. Utilice suavemente el raspador de célula para picar el la coladera de la célula a través de tejido restante y enjuague con helada PBSCM luego a un volumen total de 50 mL.
- Centrifugar la suspensión a 4 ° C 500 x g por 5 minutos quite el sobrenadante y resuspender el precipitado con un poco menos de 1,5 mL de PBSCM helada mientras Vortex la pelotilla. Luego, poner la suspensión glomerular en un nuevo tubo de 2 mL.
5. lavado
- Utilice el colector de imán para tirar los glomérulos a un lado. Espere 1 minuto antes de los glomérulos se han trasladado hacia el imán.
- Quite el sobrenadante con una pipeta de 1000 μL mientras el tubo de 2 mL en el colector de imán. Durante el primer y segundo lavado los pasos (ver paso 5.3), 250 μL de sobrenadante permanece en el tubo para evitar la pérdida de glomérulos. Realizar este procedimiento rápidamente para evitar que las estructuras tubulares del fregadero a la parte inferior del tubo.
Nota: El procedimiento de lavado durará más tiempo de lo contrario. - Quite el tubo de 2 mL de colector de imán y añadir 1 mL de PBSCM, pipeta arriba y abajo (muy importante), entonces vortex.
- Vuelva a colocar el tubo en el colector de imán y comenzar de nuevo con el paso 5.2.
- Repita los pasos de lavado hasta que la pureza de glomérulos ha alcanzado el 90%. Para ello, examinar una alícuota representativa del sobrenadante con un microscopio (40-100 X).
Nota: Glomérulos aparecerá como estructuras redondas que contienen granos magnéticos marrón. Estructuras alargadas son fragmentos tubulares y granos magnéticos libres aparecen como puntos redondos marrones. Restos celulares pueden aparecer como estructuras voluminosas. - Si se alcanza la pureza, estimar el número de glomérulos disolviendo los glomérulos en 1 mL de PBSCM. Después de mezclar, tomar una alícuota de 10 μL y contar los glomérulos en el microscopio. Calcular el número de glomérulos con la siguiente ecuación: número final de glomérulos = número de glomérulos en x 100 alícuota de 10 μL.
- Aislamiento exitoso de glomérulos conduce a un rango de 10.000-40.000 glomérulos.
6. proteína extracción e inmunoprecipitación (IP)
- Glomérulos recogemos por centrifugación a 4 ° C a 6800 x g por 5 min Quite el sobrenadante durante el uso de una atracción de imán y resuspender el precipitado en tampón de lisis helada (e.g., 30.000 glomérulos de 300 μL; GRIETAS, ver paso 1.11). Homogeneizar las muestras con un homogeneizador de tejidos a la máxima velocidad de 30 s y lyse en hielo durante 30 minutos.
- Eliminar el material insoluble por centrifugación a 15.000 x g por 30 min para 4 ° C. Pipeta el sobrenadante que incluye la celda lisada en un nuevo tubo de 1,5 mL. Deseche los pellets.
- Medir la concentración de proteínas del sobrenadante usando una bicinchoninic (BCA)-basado en método siguiendo las instrucciones del fabricante. Una lisis exitosa de 30.000 glomérulos cede a una cantidad de proteína glomerular de 700-1.000 μg/mL. Ajustar cantidades de proteína igual con tampón de lisis.
- Tomar una alícuota del 10% del volumen total de glomerular lisado y añadir 2 x Laemmli + dithiothreithol (DTT) antes de la incubación durante 5 min a 95 ° C.
- Para IP, incubar el resto del lisado con estreptavidina agarose granos durante la noche a 4 ° C en un agitador de arriba.
- Centrifugar perlas de agarosa a 1000 x g durante 3 min a 4 ° C, eliminar el sobrenadante y añadir 800 μL de tampón de lisis para lavar los granos para la Unión a proteínas inespecíficas.
- Repita el lavado 3 veces y retire completamente el sobrenadante.
- Añadir 30 μL de 2 x Laemmli + TDT e incubar a 95 ° C durante 5 minutos.
- Carga el lisado y sondas IP en un SDS 10% gel y correr el gel de la SDS a 70 V por 30 min, luego a 20 mA por gel de 1,5 h. posteriormente, secar el gel por 2 h a 200 mA en una membrana de nitrocelulosa.
- Bloquear la membrana de nitrocelulosa durante la noche a 4 ° C con 5% de albúmina sérica bovina (BSA) en tampón de lavado.
- Incubar la membrana con el anticuerpo de interés durante la noche a 4 ° C. Lavar con buffer 3 veces durante 5 min en un agitador se lava e incubar la membrana con el anticuerpo secundario etiquetado HRP por 1 h a temperatura ambiente. Repetir el lavado.
- Visualizar el lisado y sondas de inmunoprecipitación en la membrana mediante el uso de un agente quimioluminiscente de súper-resolución con una cámara CCD.
Resultados
Para aislar glomérulos con precisión, es necesario inundar murinos riñones con PBSCM primero. Perfusión con PBSCM activa riñones pálidos (figura 1A). Embolización de glomérulos con bolas magnéticas serán visible como puntos marrones en la superficie del riñón (figura 1B). Aislamiento de glomérulos con el colector de imán puede mostrar contaminación con tubuli renal (figura 1C). Antes de análisis de glomérulos, una pureza de > 95% de glomérulos debe conseguirse lavando más a fondo los glomérulos (figura 1D).
En vivo Biotinilación se basa en la capacidad para etiquetar la célula proteínas superficiales con biotina. Para estudiar esto, riñones murinos son perfundidos con PBSCM o célula-membrana permeable biotina. Como se muestra en la figura 2, biotina etiquetas los lazos capilares en perfusión de biotina pero no en los riñones de ratón de control. Para investigar proteínas de la superficie celular de los glomérulos por la perfusión en vivo biotina, inmunoprecipitación de la fracción de biotina de extractos glomerulares se realiza. Figura 3 A demuestra que nephrin glomerular proteínas transmembrana y podocalyxin immunoprecipitated dentro de la fracción de biotina. Sin embargo, en los ratones de control, no nephrin podocalyxin se detecta o en la fracción immunoprecipitated de proteínas biotiniladas. Como control negativo, la señal extracelular de proteína intracelular regula kinasas p42 y p44 (ERK) no se encuentran en la fracción immunoprecipitated de proteínas biotiniladas de control y riñones perfundidos biotina ratón. Para confirmar que la nefrina de proteína de la superficie celular es realmente biotinilado por este método, nephrin se precipita de control y los riñones perfundidos biotina ratón. Para visualizar la biotina, se tiñe la fracción immunoprecipitated con estreptavidina. Figura 3 B muestra nephrin biotinilado en perfusión de biotina pero no controlar animales. Controles de lisado indican cantidades iguales de proteínas en el control y perfusión de biotina animales. Proteína endotelial vascular endotelial (VE)-cadherin es immunoprecipitated dentro de la fracción de biotina como se muestra en la figura 3C. En los ratones de control, no VE-cadherina se precipita, mientras que VE-cadherina está presente en lisados de control y animales inundada de biotina. Molécula de adhesión intracelular (ICAM-2) de 2 se precipita de animales inundada de biotina y no ICAM-2 se encuentra en los animales control. Lisados de control y de perfusión de biotina animales muestran cantidades iguales de ICAM-2 (figura 3C). Actinia sirve como control de carga.
Este método puede utilizarse para cuantificar cantidades de proteínas de la superficie celular glomerular en modelos de nefropatía (p. ej., nefritis nefrotóxica, NTN). En la fase temprana de NTN [día 1 (1 d) después de la inyección de suero NTN], proteinuria aumenta rápidamente. En la fase tardía de NTN [día 18 (18 d)], la proteinuria disminuye significativamente. La figura 4 muestra abundancia superficial de la célula de nefrina en NTN temprano (d 1). En vivo Biotinilación ensayo (figura 4A) muestra una reducción de nefrina superficie celular en animales NTN comparados a los controles. El análisis densitométrico muestra una reducción significativa de la nefrina biotinilado (57%) en animales NTN comparados a los controles (figura 4C). Análisis cuantitativo de la nefrina total a actina no revela ninguna diferencia significativa entre los controles y NTN ratones (figura 4B). Usando un p57 Podocito células específicas de tinción, Podocito números mostrarán cantidades iguales en los animales control y NTN (figuras 4 y 4E). Figura 5 muestra los resultados de abundancia superficial de la célula de nefrina en NTN finales (18 d). Figura 5 A muestra el ensayo de Biotinilación en vivo en NTN ratones indicando una recuperación de la nefrina superficial de la célula y control. Análisis densitométricos no muestran ninguna diferencia significativa de nefrina superficie celular en control y NTN ratones (figura 5B). Nephrin total se redujo en un 25% en los ratones NTN (figura 5C). Podocito números disminuyeron en ratones NTN comparados a los controles por aproximadamente el 19% (figuras 5 y 5E).

Figura 1 : La perfusión renal y el aislamiento de glomérulos. (A) vista a través del microscopio en el situs murino después perfusión con PBSCM. El catéter en la aorta se indica con una flecha. Perfusión con PBSCM lleva a los riñones a pálido. (B) embolización de glomérulos con granos magnéticos aparecen como puntos marrones en la superficie del riñón. (C) aunque Ve el microscopio mostrando) contaminación de glomérulos (marrón alrededor de las estructuras); II) con tubuli (estructuras alargadas ligeras); y iii) desechos de la célula. Pureza de los glomérulos es aproximadamente 50%. Granos magnéticos libres aparecen como puntos marrones (aumento 100 X). (D) vista a través del microscopio mostrando una pureza de 95% de los glomérulos (aumento 100 X). Barras de escala = 100 μm. haga clic aquí para ver una versión más grande de esta figura.

Figura 2: biotina detectada en el circuito del capilar glomerular. Imagen representativa de la inmunofluorescencia de glomérulos de ratón (C57BL/6) perfundida con PBSCM (control) y biotina (biotin). Biotina (verde) es visualizada por estreptavidina en el lazo capilar glomerular sólo en ratones inundada de biotina. Ratones de control no muestran coloración biotina glomerular. WT1 (rojo) se detecta en los núcleos de podocitos en ambos ratones. Esta figura ha sido modificada de una anterior publicación20. Haga clic aquí para ver una versión más grande de esta figura.

Figura 3: en vivo biotina etiquetado de proteínas de la superficie celular glomerular. (A) Western blot análisis de proteínas de superficie de célula immunoprecipitated (IP) biotinilado (IP: perlas de agarosa estreptavidina) y lisados (lisado) de riñones de perfusión PBSCM (control) y perfusión de la biotina (biotin) ratones. Las proteínas transmembrana nefrina y podocalyxin solo se detectó en muestras immunoprecipitated de riñones perfundidos biotina ratón. Nefrina y podocalyxin en ratones de control, no se detectan en sondas immunoprecipitated de riñones de ratón de control. En lisados de control y animales inundada de biotina, podocalyxin y total nephrin se expresan igualmente en ambos grupos. La señal extracelular de proteína intracelular regula kinasas p42 y p44 (ERK) no se detectan en immunoprecipitated sondas de control y riñones perfundidos biotina ratón. En los lisados de ambos grupos de ratón, ERK se detecta en cantidades iguales. Actina se tiñe como un control de carga. (B) Western blot análisis de immunoprecipitated nefrina (IP: α-nefrina) en perfusión PBSCM (control) y perfusión de la biotina (biotin) ratones. En riñones perfundidos de biotina, nephrin se visualiza con estreptavidina la coloración, mientras que la no detección de nefrina se encuentra en los ratones control. La fracción immunoprecipitated de nefrina (IP: α-nefrina, WB: nephrin) así como la fracción lisada (lisado, WB: nephrin) teñido de nefrina Mostrar cantidades iguales de nefrina. Actina se utiliza como un control de carga. Análisis de (C) Western blot de proteína superficial de la célula de immunoprecipitated biotinilado (IP: perlas de agarosa estreptavidina) y lisados (lisado) de los riñones de las PBSCM inundada (control) y perfusión de la biotina (biotin) ratones. La proteína transmembrana marcador endotelial vascular (VE)-cadherin y molécula de adhesión intracelular (ICAM-2) de 2 sólo se detectan en la fracción immunoprecipitated de animales inundada de biotina. En los ratones de control, no se detectan VE-cadherina o ICAM-2. Actinia sirve como un control de carga. Esta figura ha sido modificada de una anterior publicación20. Haga clic aquí para ver una versión más grande de esta figura.
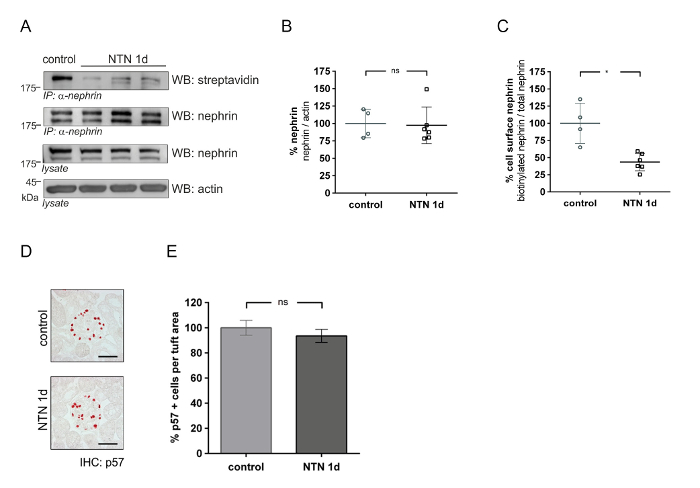
Figura 4 : Abundancia de nefrina proteína glomerular en la nefropatía de nefritis nefrotóxica temprano (NTN). (A) Western blot análisis de superficie nefrina (IP: α-nefrina, WB: estreptavidina) y nephrin total (IP: α-nefrina o lisado, WB: nephrin) en ratones tratados con suero control y nefrotóxicos (NTN 1 d). Actinia sirve como un control de carga. En comparación con controles, NTN ratones tratados muestran reducido nephrin superficie celular (IP: α-nefrina, WB estreptavidina) comparados a los controles. (B) análisis cuantitativo de la nefrina total/actina en ratones días 1 NTN y control [control de n = 4, NTN n = 6, diferencias no significativas (ns)]. (C) Densitometric análisis de célula superficial nephrin (biotinilado nephrin total nephrin) en ratones NTN y control (* p < 0.01, control n = 4, NTN n = 6). (D) Immunohistochemistry de p57 con podocitos en control y ratones días 1 NTN. (E) análisis cuantitativo de las células positivas p57 por área de penacho (μm2). (40 glomérulos por ratón cuantificado, ns). Datos de inmunoblot, Feria medio ± SD. Podocito cuentas medios ± SEM. Unpaired t-test con corrección de Welch. Barra de escala = 50 μm. Esta figura ha sido modificada de una anterior publicación20. Haga clic aquí para ver una versión más grande de esta figura.
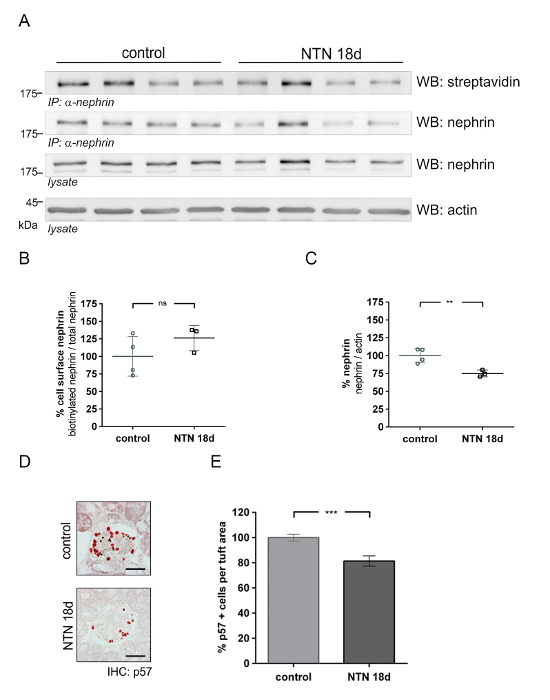
Figura 5 : Abundancia de nefrina proteína glomerular en la nefropatía de nefritis nefrotóxica finales (NTN). (A) Western blot análisis de superficie nefrina (IP: α-nefrina, WB: estreptavidina) y nephrin total (IP: α-nefrina o lisado, WB: nephrin) en control y nefrotóxicos del suero tratado ratones (NTN 18 d). En comparación con controles, NTN 18 días ratones muestran cantidades iguales de nefrina superficie celular (IP: α-nefrina, WB: estreptavidina). NTN tratados ratones en pantalla día 18 menos nephrin total, y la actinia sirve como un control de carga. (B) densitométrica análisis no muestra ninguna diferencia significativa en nephrin superficie celular entre los controles y NTN 18 ratones días (control n = 4, NTN n = 3). (C) Densitometric análisis de nefrina total a actina. En ratones NTN en día 18, hay menor expresión de la nefrina en comparación con los controles (control n = 4, NTN n = 3, ** p < 0.001). (D) Immunohistochemistry de p57 con podocitos en control y NTN 18 días ratones. Hay menos células positivas p57 (rojo) en ratones días NTN 18 comparados con controles. Granos magnéticos aparecen como puntos negros. (E) análisis cuantitativo de las células positivas p57 por área de penacho glomerular (μm2) (*** p < 0.0001, control n = 2, NTN n = 2, 40 glomérulos por ratón cuantificado). Datos de inmunoblot, Feria medio ± SD. Podocito cuentas medios ± SEM. estadístico análisis: desapareado t-test con corrección de Welch. Barra de escala = 50 μm. Esta figura ha sido modificada de una anterior publicación20. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
El método presentado permite aislamiento exitoso de glomérulos investigar glomerular ARN o proteína. Además, pueden realizarse cultivos de células glomerulares primarios de los glomérulos aislados. Si la biotina se aplica antes de aislamiento glomerular, etiquetado de proteínas de la superficie celular glomerular se puede realizar. Con este método, se puede estudiar en vivo células glomerulares trata de proteína de la superficie, y semi-cuantificación de la abundancia de la proteína es posible. Los pasos más críticos para la prueba con éxito abundancia de proteína de la superficie de células glomerulares son 1) desarrollando experiencia manual en ratón cirugía especialmente la canulación de la aorta, 2) sin burbujas conexión de jeringuillas para evitar la embolización de aire de la glomérulos y 3) trabajan en condiciones heladas una vez que ha comenzado a perfusión con PBSCM.
Esta técnica manual experiencia en cirugía de ratón es esencial. Canulación de la aorta es especialmente crítica, ya que la disección del vaso impedirá la perfusión de los riñones. El corte en la aorta debe ser lo suficientemente grande (aproximadamente 50% del diámetro del vaso) para crear espacio suficiente para introducir el catéter. Si el catéter está cortado diagonalmente, la introducción del catéter en la aorta será más fácil. Además de la disección, el catéter introducido debe colocarse alto dentro de la aorta con el fin de no obstruir las arterias renales. Las arterias renales de lo contrario no se perfunde con biotina y las bolas magnéticas.
La biotina es una vitamina pequeña que se une con alta afinidad a las proteínas de la estreptavidina. Debido a su pequeño tamaño (Da 244), biotina no altera la función de conjugados de proteínas y se filtrará a través de los glomérulos. Por incubación con estreptavidina, proteínas biotiniladas pueden fácilmente separar de proteínas sin etiquetar por perlas de agarosa u otros métodos. Ésteres de N-hydroxysuccimide (NHS) de biotina se unen a amina (-NH2) grupos de proteínas, que son abundantes en las cadenas laterales de residuos de lisina, por ejemplo. Sulfo-NHS-LC-biotina es agua soluble y célula-impermeable, si las membranas están intactas. Sulfo-NHS-LC-biotina ha demostrado etiqueta célula proteínas superficiales23. Unión de ésteres de NHS de biotina a grupos amino es dependiente de pH (7-9) y el uso de búferes de Amina-libre (es decir, PBSCM). PBSCM con un pH de 7.4 por lo tanto se utilizó para la perfusión de los riñones de ratón con biotina, ya que combina propiedades fisiológicas ideales con solubilidad óptima y la función de la biotina. Para calmar las proteínas después de etiquetar, se realiza la perfusión de PBSCM con glicina, permitiendo biotina libre ser ligadas a grupos amino de la glicina. Para evitar procesos celulares después de la muerte del animal, es importante realizar la perfusión con una solución fría y seguir trabajando en el hielo.
Similar a los métodos ex vivo biotinylation, la tensión mecánica de procesamiento glomérulos durante en vivo Biotinilación protocolos mayo también endocitosis de impacto, rápida señalización de eventos y la integridad del RNA. Por lo tanto es esencial que todos los pasos de procesamiento se realizan en el hielo para reducir el riesgo de la actividad enzimática celular.
Modelos animales proteinuria como nefrotóxicos del suero nefritis (NTN) daño del ratón los riñones severamente. En particular, NTN resulta en la expansión mesangial y esclerosis glomerular las lesiones tubulares, lleva a la fibrosis renal en estadios avanzados de la enfermedad (42 días)24. La perfusión deteriorada de glomérulos esclerosados en modelos de la enfermedad puede conducir a resultados sesgados de la abundancia de la proteína. Glomérulos esclerosados no es probable que se perfunde con bolas magnéticas y así no pueden ser aislados en este método. En modelos de la enfermedad conduce a la esclerosis glomerular grave, usando técnicas para aislar los glomérulos a través de distintas etapas de tamizado puede ser una alternativa al método de granos magnéticos utilizado en este protocolo25. Sin embargo, si los glomérulos son fuertemente esclerosados, perfusión incluso con biotina puede reducirse. Además, ex vivo biotinylation, glomérulos extraídos son bañados ex vivo en biotina soluciones21, probablemente no será beneficioso en estos modelos. Como alternativa, uso de inmunofluorescencia para detectar abundancia de proteína en glomérulos gravemente enfermos puede ser ventajosa, ya que no depende de la perfusión de glomérulos.
Semi-cuantificación de la abundancia de la proteína usando esta técnica funciona bien mediante el uso de la densitometría. Sin embargo, pequeñas diferencias en la abundancia de proteína pueden perderse como resultado del límite de detección de densitometría.
La técnica descrita puede transferirse a otros órganos animales que son perfundidos, siempre que las estructuras de interés son accesibles mediante técnicas de aislamiento o la proteína de la superficie de interés es específica a la estructura de una célula tipo u órgano. A pesar de todas las proteínas de superficie biotinilado por esta técnica, utilizando un anticuerpo específico para la inmunoprecipitación dará lugar a la fracción de la expresión de proteína de la superficie celular de la proteína específica (como muestra de la nefrina en la figura 3B).
Divulgaciones
Los autores no tienen nada que revelar.
Agradecimientos
Los autores agradecen a Blanka Duvnjak para su asistencia técnica excepcional. Este trabajo fue financiado por la Deutsche Forschungsgemeinschaft (www.dfg.de) WO1811/2-1 a M.W. y QU280/3-1 al coeficiente intelectual La donante no tenía ningún papel en el diseño del estudio, recopilación de datos, análisis de datos, publicación y preparación del manuscrito.
Materiales
| Name | Company | Catalog Number | Comments |
| Motic SMZ168 BL | Motic | SMZ168BL | microscope for mouse surgery |
| KL1500LCD | Pulch and Lorenz microscopy | 150500 | light for mouse surgery |
| Rompun (Xylazin) 2% | Bayer | PZN:01320422 | anesthesia |
| Microfederschere | Braun, Aesculap | FD100R | fine scissors, for cut into the aorta |
| Durotip Feine Scheren | Braun, Aesculap | BC210R | for abdominal cut |
| Anatomische Pinzette | Braun, Aesculap | BD215R | for surgery until the abdomen is opened |
| Präparierklemme | Aesculap | BJ008R | for surgery |
| Seraflex | Serag Wiessner | IC108000 | silk thread |
| Ketamine 10% | Medistar | anesthesia | |
| Rompun (Xylazin) 2% | Bayer | anesthesia | |
| Fine Bore Polythene Tubing ID 0.28mm OD 0.61mm | Portex | 800/100/100 | Catheter |
| Fine Bore Polythene Tubing ID 0.58mm OD 0.96mm | Portex | 800/100/200 | Catheter |
| Harvard apparatus 11 Plus | Harvard Apparatus | 70-2209 | syringe pump |
| EZ-link Sulfo-NHC-LC-Biotin | Thermo Scientific | 21335 | biotin |
| Dynabeads Untouched Mouse T-cells | Invitrogen | 11413D | to embolize glomeruli |
| Collagenase A | Roche | 10103578001 | to digest kidney tissue |
| DynaMag-2 | Invitrogen | 123.21D | Magnet catcher |
| 100µm cell stainer | Greiner-bio | 542000 | for glomerular isolation |
| Axiovert 40 CFL | Zeiss | non available | to confirm glomerular purity |
| TissueRuptor | Quiagen | 9002755 | Tissue homogenizer |
| CHAPS | Sigma-Aldrich | C3023 | for lysis buffer |
| Tris-HCL | Sigma-Aldrich | T5941 | for lysis buffer |
| NaCl | VWR chemicals | 27810295 | for lysis buffer |
| NaF | Sigma-Aldrich | 201154 | for lysis buffer |
| EDTA | Sigma-Aldrich | E5134 | for lysis buffer |
| ATP | Sigma-Aldrich | 34369-07-8 | for lysis buffer |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | Follow the manufacturer's instructions |
| nephrin antibody | Progen | GP-N2 | for westernblot |
| Polyclonal goat anti-podocalyxin antibody | R&D Systems | AF15556-SP | for westernblot |
| Streptavidin Agarose Resin | Thermo Scientific | 20347 | for immunoprecipitation |
| Protein A sepharose CL-4B | GE Healthcare | 17096303 | for immunoprecipitation |
| polyclonal rabbit anti-p57 antibody | SCBT | sc-8298 | for Immunohistochemistry |
| mouse monoclonal anti-beta actin antibody, clone AC-74 | Sigma-Aldrich | A2228 | Western blot loading control |
| rabbit anti-p44/42 | cell signalling | 4695 | for westernblot |
| Pierce High sensitivity streptavidin-HRP | Thermo Scientific | 21130 | for westernblot |
| polyclonal mouse ICAM-2 antibody | R&D Systems | AF774 | for westernblot |
| polyclonal mouse anti-VE-cadherin | R&D Systems | AF1002 | for westernblot |
Referencias
- Jefferson, J. A., Alpers, C. E., Shankland, S. J. Podocyte biology for the bedside. American Journal of Kidney Disease. 58 (5), 835-845 (2011).
- Konigshausen, E., et al. Angiotensin II increases glomerular permeability by beta-arrestin mediated nephrin endocytosis. Scientific Reports. 6, 39513(2016).
- Quack, I., et al. beta-Arrestin2 mediates nephrin endocytosis and impairs slit diaphragm integrity. Proceedings of the National Academy of Science of the United States of America. 103 (38), 14110-14115 (2006).
- Quack, I., et al. PKC alpha mediates beta-arrestin2-dependent nephrin endocytosis in hyperglycemia. Journal of Biological Chemitry. 286 (15), 12959-12970 (2011).
- Swiatecka-Urban, A. Endocytic Trafficking at the Mature Podocyte Slit Diaphragm. Frontiers in Pediatrics. 5, 32(2017).
- Swiatecka-Urban, A. Membrane trafficking in podocyte health and disease. Pediatric Nephrology. 28 (9), 1723-1737 (2013).
- Soda, K., et al. Role of dynamin, synaptojanin, and endophilin in podocyte foot processes. The Journal of Clinical Investigation. 122 (12), 4401-4411 (2012).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein--nephrin--is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Martin, C. E., Jones, N. Nephrin Signaling in the Podocyte: An Updated View of Signal Regulation at the Slit Diaphragm and Beyond. Frontiers in Endocrinology (Lausanne). 9, 302(2018).
- Nielsen, J. S., McNagny, K. M. The role of podocalyxin in health and disease. Journal of the American Society of Nephrology. 20 (8), 1669-1676 (2009).
- Yasuda, T., Saegusa, C., Kamakura, S., Sumimoto, H., Fukuda, M. Rab27 effector Slp2-a transports the apical signaling molecule podocalyxin to the apical surface of MDCK II cells and regulates claudin-2 expression. Molecular Biology of the Cell. 23 (16), 3229-3239 (2012).
- Tossidou, I., et al. Podocytic PKC-alpha is regulated in murine and human diabetes and mediates nephrin endocytosis. Public Library of Science One. 5 (4), 10185(2010).
- Qin, X. S., et al. Phosphorylation of nephrin triggers its internalization by raft-mediated endocytosis. Journal of the American Society of Nephrology. 20 (12), 2534-2545 (2009).
- Waters, A. M., et al. Notch promotes dynamin-dependent endocytosis of nephrin. Journal of the American Society of Nephrology. 23 (1), 27-35 (2012).
- Zhang, X., Simons, M. Receptor tyrosine kinases endocytosis in endothelium: biology and signaling. Arteriosclerosis Thrombosis and Vascular Biology. 34 (9), 1831-1837 (2014).
- Maes, H., Olmeda, D., Soengas, M. S., Agostinis, P. Vesicular trafficking mechanisms in endothelial cells as modulators of the tumor vasculature and targets of antiangiogenic therapies. Federation of European Biochemical Societies Journal. 283 (1), 25-38 (2016).
- Satchell, S. C., et al. Conditionally immortalized human glomerular endothelial cells expressing fenestrations in response to VEGF. Kidney International. 69 (9), 1633-1640 (2006).
- Takemoto, M., et al. A new method for large scale isolation of kidney glomeruli from mice. American Journal of Pathology. 161 (3), 799-805 (2002).
- Liu, X., et al. Isolating glomeruli from mice: A practical approach for beginners. Experimental and Therapeutic Medicine. 5 (5), 1322-1326 (2013).
- Haase, R., et al. A novel in vivo method to quantify slit diaphragm protein abundance in murine proteinuric kidney disease. Public Library of Science One. 12 (6), 0179217(2017).
- Satoh, D., et al. aPKClambda maintains the integrity of the glomerular slit diaphragm through trafficking of nephrin to the cell surface. Journal of Biochemistry. 156 (2), 115-128 (2014).
- Tomas, N. M., et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy. New England Journal of Medicine. 371 (24), 2277-2287 (2014).
- Daniels, G. M., Amara, S. G. Selective labeling of neurotransmitter transporters at the cell surface. Methods in Enzymology. 296, 307-318 (1998).
- Ougaard, M. K. E., et al. Murine Nephrotoxic Nephritis as a Model of Chronic Kidney Disease. International Journal of Nephrology. 2018, 8424502(2018).
- Salant, D. J., Darby, C., Couser, W. G. Experimental membranous glomerulonephritis in rats. Quantitative studies of glomerular immune deposit formation in isolated glomeruli and whole animals. Journal of Clinical Investigation. 66 (1), 71-81 (1980).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados