Method Article
Isolamento dei Glomeruli e In Vivo di etichettatura delle proteine di superficie delle cellule glomerulari
In questo articolo
Riepilogo
Qui presentiamo un protocollo per l'etichettatura dei Murina in vivo delle proteine di superficie delle cellule glomerulari con biotina. Questo protocollo contiene informazioni su come irrorare i reni del mouse, isolare i glomeruli ed eseguire immunoprecipitazione endogena della proteina di interesse.
Abstract
Proteinuria deriva dalla distruzione del filtro glomerulare che è composto dall'endotelio fenestrato e la membrana basale glomerulare podociti con loro fessura diaframmi. La delicata struttura del filtro glomerulare, soprattutto il diaframma a fessura, si basa sull'interazione di proteine della superficie cellulare diversificata. Lo studio di queste proteine di superficie delle cellule è stato finora limitato a studi in vitro o l'analisi istologica. Qui, presentiamo un biotinylation murino in vivo etichettatura metodo, che consente lo studio delle proteine di superficie delle cellule glomerulari in condizioni fisiologiche e patofisiologiche. Questo protocollo contiene informazioni su come irrorare i reni del mouse, isolare i glomeruli ed eseguire endogeno immunoprecipitazione di una proteina di interesse. Semi-quantificazione dell'abbondanza di superficie delle cellule glomerulari è prontamente disponibile con questo metodo novello e tutte le proteine accessibile alla perfusione di biotina e immunoprecipitazione può essere studiato. Isolamento dei glomeruli con o senza biotinylation consente inoltre ulteriori analisi di glomerulare RNA e proteina così come primario delle cellule glomerulari (culturacioè, Podocita primario delle cellule).
Introduzione
Proteinuria è un segno distintivo della lesione glomerulare e solitamente accompagna la rottura del filtro glomerulare1. Il filtro glomerulare è composto dell'endotelio fenestrato e la membrana basale glomerulare podociti. La delicata struttura molecolare del filtro glomerulare è altamente dinamico e soggetto a proteina di superficie delle cellule traffico in entrambi i reni sani e malati2,3,4,5,6 . Endocitosi di proteine di superficie delle cellule ha dimostrato di essere essenziale per la sopravvivenza di podociti7. Nefrina e Podocalixina sono proteine transmembrana espresse su podociti. Nefrina è la spina dorsale del diaframma fessura glomerulare, mentre Podocalixina è un sialoglycoprotein rivestimento i processi secondari piede di podociti8,9,10. Endocitico traffico precedentemente è stato indicato per Nefrina e Podocalixina3,11,12,13,14.
Al meglio della nostra conoscenza, endocitosi delle proteine della superficie cellulare ancora non sono stata descritta in cellule endoteliali glomerulari nella letteratura. Tuttavia, le cellule endoteliali esprimono in generale tutte le proteine necessarie per i diversi tipi di endocitosi (cioè, endocitosi clatrina-dipendente, zattera-dipendente)15,16. Pertanto, traffico di superficie delle cellule endoteliali può essere studiato con questo metodo, utilizzando, ad esempio, vascolare endoteliale (VE)-caderina e molecola intracellulare di adesione (ICAM-2) come una cella di superficie proteina marker per cellule endoteliali glomerulari17 .
Purtroppo, non c'è nessun modello preciso in vitro per il filtro glomerulare a tre strati delicato in quale cella può essere studiato il traffico della proteina di superficie. L'obiettivo di questo metodo è così di studiare glomerulare proteine traffico in vivo. Inoltre, questo protocollo contiene informazioni su come isolare i glomeruli, consentendo l'ulteriore analisi di RNA, proteine o cellule glomerulari. Isolamento glomerulare simile tecniche sono state descritte da diversi gruppi di18,19.
In precedenza, noi ed altri abbiamo usato ex vivo etichettatura delle proteine di superficie delle cellule glomerulari di biotinilazione2,3,4,20,21. Tuttavia, in questo metodo ex vivo , glomeruli isolati sono stati esposti a sollecitazioni meccaniche, che possono influenzare il traffico endocitico. In alternativa, immunofluorescenza etichettatura delle proteine di superficie delle cellule glomerulari è stato utilizzato estesamente nella letteratura2,20,22. Con questo metodo, tuttavia, solo un piccolo numero di proteine possa essere analizzato all'interno di una diapositiva, e quantificazione delle immagini di immunofluorescenza è spesso difficile.
Questo metodo di romanzo in vivo offre uno strumento affidabile per lo studio delle cellule glomerulari proteina di superficie abbondanza e traffico accurato in sani e malati reni, e può essere utilizzato in aggiunta al test di immunofluorescenza.
Protocollo
Topi sono stati ottenuti come un in-House di razza provenienti dall'impianto di cura degli animali locali o da Janvier Labs in Francia. Le indagini sono state condotte secondo le linee guida descritte nella Guida per la cura e l'uso di animali da laboratorio (US National istituti di salute pubblicazione n. 85-23, rivisto 1996). Tutti gli esperimenti sugli animali sono stati eseguiti in conformità con le pertinenti approvazioni istituzionale (dichiari il governo LANUV AZ:84 numero di riferimento-02.04. 2016.A435).
1. preparazione di strumenti, soluzioni e attrezzature
- Preparare 1 L di soluzione fisiologica tamponata con fosfato completato con 1 mM di cloruro di magnesio (MgCl2) e 0,1 mM di cloruro di calcio (CaCl2) (PBSCM) e filtrare attraverso un filtro sterile.
- Preparare 5 mL di PBSCM sterile per topo per aspersione e posizionarlo sul ghiaccio.
- Per ogni mouse, preparare 5 mL di sterile PBSCM completati con biotina di 0,5 mg/mL.
- Per ogni mouse, preparare 5 mL di PBSCM sterile e aggiungere 0,8 x 108 biglie magnetiche (ad es., 200 µ l di una soluzione di8 perline/mL 4 x 10, senza pretrattamento) per il embolization dei glomeruli. Preparare questa soluzione sotto la panca di coltura cellulare per mantenere i branelli magnetici nel tubo originale sterile. Posto questa soluzione sul ghiaccio.
- Preparare una soluzione tempra aggiungendo glicina di 100 mM per PBSCM (5 mL per topo) e tenerlo sul ghiaccio.
- Preparare una soluzione di collagenasi (0.378 U/mL collagenosi A in PBSCM sterile). Per topo, Pipettare 1 mL della soluzione della collagenosi in una provetta da 2 mL e posizionarlo sul ghiaccio.
- Per il lavaggio, preparare PBSCM sterile (Vedi punto 1.1) in 50 mL di un tubo e collocarlo sul ghiaccio.
- Per aspersione, è possibile utilizzare una pompa a siringa con un flusso di 2,0 mL/min.
- Preparare una siringa da 10 mL con ago 21G. Posizionare la punta dell'ago in un catetere lungo 20-30 cm (diametro interno, ID = 0,58 mm). Collegare il catetere (ID 0,58 mm) con un catetere corto di 10 cm (ID 0,28 mm) e tagliare la punta del catetere più piccolo obliquo per un facile inserimento in aorta del mouse.
- Per le procedure di legatura durante l'intervento chirurgico, tagliare tre fili di seta 5-7 cm (4-0 6-0) del mouse.
- Per la chirurgia, preparare 3 clamp chirurgiche, 2 forbici chirurgiche, 2 pinzette, 2 pinzette bene, 1 forbice fine e tamponi. Preparare l'anestesia (ad es., anestesia intraperitoneale ketamina 100 mg/kg di peso corporeo e xilazina 5 mg/kg di peso corporeo).
- Per l'isolamento dei glomeruli dei due reni, utilizzare un colino di cella di 100 µm, due provette da 50 ml e un catcher di magnete.
- Preparare CHAPS buffer di lisi: 20 mM 3-[(3-cholamidopropyl) dimethylammonio] -1-propanesulfonate (CHAPS); 20 mM Tris (idrossimetil)-aminomethan (Tris) pH 7.5; sodiumchorlide 50 mM (NaCl); sodiumfluoride 50 mM (NaF); 15 mM Na4P2O7; 0,1 mM etilendiamminotetraacetico (EDTA) l'acido a pH 8.0; sodiumorthovanadate di 2 mM; e 2 mM adenosinetriphosphat (ATP).
- Centrifughe raffreddare a 4 ° C.
2. chirurgia sotto il microscopio
- Anestetizzare il mouse (per esempio, con chetamina/xilazina intraperitonealmente, vedi punto 1.11). Eseguire il test toe-pizzico per confermare l'anestesia adeguata.
- Disinfettare il lato ventrale del mouse con 70% di isopropanolo.
- Eseguire un taglio mediano attraverso la pelle dal bacino allo sterno e togliere la pelle dalla fascia addominale con una pinzetta. Tagliare la pelle su entrambi i lati al centro dell'addome con forbici chirurgiche.
- Cambiare strumenti chirurgici. Applica un taglio mediano da xifoideo alla vescica attraverso lo strato del muscolo addominale e dividerli in quattro quadranti utilizzando pinzette e forbici chirurgiche. Fissare la parte superiore due con morsetti verso il collo del mouse con due pinze chirurgiche.
Nota: L'addome è ora aperto. - Mettere da parte con un tampone sterile negli organi viscerali e tagliare il legamento epatico-frenico con forbice.
- Preparare una legatura (con un filo di seta 4-0 6-0) intorno all'aorta prossimale delle arterie renali all'altezza della ghiandola surrenale con due pinzette bene. Stringere la legatura aortica prossimale per abolire il flusso sanguigno con una pinzetta.
- Gratis l'aorta distale da gronda, grasso e altri tessuti e preparare una legatura intorno all'arteria epatica/mesenterica craniale delle arterie renali con pinzette chirurgiche bene.
- Preparare una legatura (con un filo di seta 4-0 6-0) intorno all'aorta distale delle arterie renali e bloccare la vena cava e aorta all'altezza della biforcazione.
- Tagliare un piccolo foro nell'aorta distale per le arterie renali affinché il foro è metà del diametro dell'aorta. Mettere il catetere in aorta e fissarlo con la legatura preparata.
Attenzione: Evitare le bolle nel sistema di perfusione per prevenire emboli d'aria. - Iniziare la perfusione con la gelida PBSCM ad una portata di 2 mL/min.
- Praticare un foro nella vena renale a livello delle arterie renali con forbici chirurgiche bene e stringere la legatura intorno le arterie epatiche e mesenteriche.
Nota: Dopo aver avviato la perfusione reni devono impallidire.
3. in Vivo biotinilazione
- Cambiamento della siringa priva di bolle per PBSCM ghiacciata integrati con biotina di 0,5 mg/mL per l'etichettatura di superficie e irrorare i reni con 5 mL ad una portata di 2 mL/min.
Nota: Mescolare le soluzioni PBSCM (ad es., ruotando le provette da 50 mL) delicatamente per evitare la formazione di bollicine all'interno della soluzione. Dopo l'aspirazione della soluzione all'interno della siringa, evacuare eventuali bolle o l'aria dalla siringa. Utilizzare una cannula supplementare (21G) sulla siringa per riempire lo spazio nella cannula che è collegato al sistema di catetere. Infine, attaccare la siringa nella cannula con il catetere senza bolle. - Modificare la siringa priva di bolle ghiacciate PBSCM completati con glicina 100mm per placare i glomeruli e irrorare con 5 mL a un flusso di 2 mL/min.
- Cambiamento della siringa priva di bolle per PBSCM ghiacciata completati con 200 μL magnetico perline/mL e irrorare i reni a 2 mL/min.
Nota: Sulla superficie del rene, il embolization dei glomeruli con biglie magnetiche marrone sarà visibile.
4. isolamento dei Glomeruli da due reni
- Rimuovere i reni all'ILO e la capsula. Mettere i reni sul ghiaccio in 15 mL di PBSCM in una piastra di coltura delle cellule di 10 cm. Eutanasia il mouse con dislocazione cervicale in anestesia dopo la raccolta i reni. Le procedure di chirurgia e perfusione durano circa 20-22 min.
- Tagliare i reni in pezzi più piccoli possibile con una nuova lama a doppio taglio. Spostare il tessuto in una provetta da 2 mL con 1 mL di collagenasi A (Vedi punto 1.6) e digest a 37 ° C per 30 min. Prima e dopo la digestione, mescolare delicatamente con un 1000 μL tagliare pipetta.
- Sciacquare il tessuto digerito attraverso un colino di cella μm 100 utilizzando PBSCM ghiacciata. Utilizzare delicatamente il cella-raschietto per tritare il trogolo di tessuto restante del filtro cella e sciacquarlo con gelida PBSCM in seguito ad un volume totale di 50 mL.
- Centrifugare la sospensione a 4 ° C 500 x g per 5 min. eliminare il surnatante e risospendere il sedimento con poco meno di 1,5 mL di PBSCM ghiacciata mentre nel Vortex il pellet. In seguito, mettere la sospensione glomerulare in una nuova provetta da 2 mL.
5. lavaggio
- Utilizzare il catcher di magnete per tirare i glomeruli di lato. Attendere 1 minuto prima glomeruli sono spostati verso il magnete.
- Rimuovere il surnatante con una pipetta di 1000 μL mentre il tubo 2ml rimane nel catcher di magnete. Durante il lavaggio primo e la secondo procedura (Vedi punto 5.3), 250 μL del surnatante rimane nel tubo per evitare la perdita dei glomeruli. Eseguire questa procedura rapidamente per evitare le infiltrazioni di strutture tubolari sul fondo del tubo.
Nota: La procedura di lavaggio durerà più a lungo in caso contrario. - Rimuovere la provetta da 2 mL da catcher magnete e aggiungere 1 mL di PBSCM, pipetta su e giù (molto importante), poi vortice.
- Rimettere il tubo il catcher di magnete e ricominciare dal punto 5.2.
- Ripetere i passaggi di lavaggio finché la purezza dei glomeruli ha raggiunto il 90%. Per questo, è necessario esaminare un'aliquota rappresentativa del surnatante sotto un microscopio (40-100 X).
Nota: Glomeruli apparirà come rotonde strutture contenenti marrone biglie magnetiche. Strutture allungate sono frammenti tubolare e gratuiti biglie magnetiche vengono visualizzati come punti rotondi marrone. Detriti cellulari potrebbero apparire come strutture ingombranti. - Se viene raggiunta la purezza, stimare il numero dei glomeruli sciogliendo i glomeruli in 1 mL di PBSCM. Dopo la miscelazione, prendere un'aliquota di 10 μL e contare i glomeruli sotto il microscopio. Calcolare il numero di glomeruli con la seguente equazione: numero finale dei glomeruli = numero dei glomeruli in 10 μL aliquota x 100.
- Successo isolamento dei glomeruli conduce ad una gamma di 10.000-40.000 glomeruli.
6. proteina estrazione e immunoprecipitazione (IP)
- Glomeruli Raccogli mediante centrifugazione a 4 ° C a 6800 x g per 5 min. eliminare il surnatante mentre usando un catcher di magnete e risospendere il pellet in tampone di lisi ghiacciata (ad es., 30.000 glomeruli in 300 μL; SCREPOLATURE, vedi punto 1.11). I campioni di omogeneizzare con un omogeneizzatore del tessuto alla massima velocità per 30 s e li lisare in ghiaccio per 30 min.
- Rimuovere il materiale insolubile mediante centrifugazione a 15.000 x g per 30 min a 4 ° C. Dispensare il surnatante che include la cella lysata in una nuova provetta da 1,5 mL. Scartare il pellet.
- Misurare la concentrazione di proteina del surnatante utilizzando un bicinconinico (BCA)-basato su metodo seguendo le istruzioni del produttore. Una riuscita lisi dei 30.000 glomeruli produce una quantità di proteine glomerulare di 700-1.000 µ g/mL. Adattarsi alla quantità di proteina uguale con tampone di lisi.
- Prendere un'aliquota del 10% del volume totale per glomerulare lisato e aggiungere 2 x Laemmli + dithiothreithol (DTT) prima dell'incubazione per 5 min a 95 ° C.
- Per IP, incubare il resto del lisato con streptavidina agarosio perle durante la notte a 4 ° C su agitatore overhead.
- Centrifuga dell'agarosi branelli a 1000 x g per 3 min a 4 ° C, eliminare il surnatante e aggiungere 800 μL di tampone di lisi per lavare le perle per legame con le proteine aspecifiche.
- Ripetere il lavaggio 3 volte e rimuovere il surnatante completamente.
- Aggiungere 30 μL di 2x Laemmli + DTT e incubare a 95 ° C per 5 min.
- Caricare il lisato e sonde IP su un 10% SDS del gel ed eseguire il gel di SDS a 70 V per 30 min, poi al 20 mA al gel per 1,5 h. in seguito, asciugare il gel per 2 h a 200 mA su una membrana di nitrocellulosa.
- Bloccare la membrana di nitrocellulosa durante la notte a 4 ° C con 5% albumina di siero bovino (BSA) in tampone di lavaggio.
- Incubare la membrana con l'anticorpo di interesse durante la notte a 4 ° C. Lavare con buffer 3 volte per 5 minuti su un agitatore di lavaggio e incubare la membrana con l'anticorpo secondario HRP-etichetta per 1 h a temperatura ambiente. Ripetere la fase di lavaggio.
- Visualizzare il lisato e immunoprecipitazione sonde sulla membrana utilizzando un agente chemiluminescente di Super-risoluzione con una camera CCD.
Risultati
Per isolare i glomeruli con precisione, è necessario irrorare murini reni con PBSCM prima. Aspersione con PBSCM trasforma reni pallidi (Figura 1A). Il embolization di glomeruli con biglie magnetiche saranno visibile come puntini marroni sulla superficie del rene (Figura 1B). Isolamento dei glomeruli con il catcher magnete può mostrare la contaminazione con tubuli renali (Figura 1C). Prima di un'ulteriore analisi dei glomeruli, purezza > 95% dei glomeruli deve essere ottenuta mediante lavaggio glomeruli più accuratamente (Figura 1D).
Biotinilazione in vivo si basa sulla capacità di etichetta delle cellule proteine di superficie con biotina. Per studiare questo, reni murini sono perfusi con PBSCM o biotina permeabile della membrana cellulare. Come illustrato nella Figura 2, biotina etichette i cicli capillari in biotina-irrorato ma non in reni di controllo del mouse. Per studiare le proteine di superficie delle cellule del glomerulo etichettati da in vivo l'aspersione di biotina, immunoprecipitazione della frazione biotina di estratti glomerulare viene eseguita. Figura 3 A dimostra che glomerulare proteine transmembrana Nefrina e Podocalixina sono immunoprecipitated all'interno della frazione di biotina. Tuttavia, nei topi di controllo, nessun Nefrina o Podocalixina viene rilevato nella frazione immunoprecipitati delle proteine biotinilate. Come controllo negativo, il proteina intracellulare extracellulare-segnale regolato chinasi p42 e p44 (ERK) non si trovano nella frazione immunoprecipitati delle proteine biotinilate di controllo e di reni perfusi con biotina del mouse. Per confermare che la Nefrina proteina della superficie delle cellule è in realtà biotinilati da questo metodo, Nefrina è precipitato da controllo e reni perfusi con biotina del mouse. Per visualizzare la biotina, la frazione di immunoprecipitato è macchiata con streptavidina. Figura 3 B Mostra biotinilati Nefrina in biotina-irrorato ma non controllare gli animali. Controlli di lisato indicare uguali quantità di proteina in controllo e animali perfusi con biotina. Proteina endoteliale vascolare endoteliale (VE)-caderina è immunoprecipitato all'interno della frazione di biotina, come illustrato nella Figura 3C. Nei topi di controllo, non VE-caderina è precipitato, mentre VE-caderina è presente nei lisati di controllo e animali perfusi con biotina. Molecola di adesione intracellulare 2 (ICAM-2) è precipitata da animali perfusi con biotina e nessun ICAM-2 è trovato negli animali di controllo. Lisati di controllo e biotina-irrorato animali mostrano gli importi uguali di ICAM-2 (Figura 3C). Actina servito come il controllo di carico.
Questo metodo può essere utilizzato per quantificare la quantità di proteine di superficie delle cellule glomerulari in modelli di nefropatia (ad es., nefrite, nefrotossici, NTN). Nella fase in anticipo di NTN [giorno 1 (1D) dopo l'iniezione del siero NTN], proteinuria aumenta rapidamente. Nella successiva fase di NTN [giorno 18 (18d)], la proteinuria diminuisce in modo significativo. La figura 4 Mostra l'abbondanza di superficie cellulare Nefrina in anticipo NTN (1D). In vivo biotinylation test (Figura 4A) Mostra una riduzione di Nefrina superficiale delle cellule in animali NTN rispetto ai controlli. L'analisi densitometrica Mostra una significativa riduzione di biotinylated Nefrina (57%) negli animali NTN rispetto ai controlli (Figura 4C). Analisi quantitativa di Nefrina totale all'actina non rivela nessuna differenza significativa tra i controlli e topi NTN (Figura 4B). Utilizzando un p57 Podocita cella specifica colorazione, Podocita numeri visualizzare gli importi uguali in animali NTN e controllo (figure 4 e 4E). Figura 5 vengono visualizzati i risultati dell'abbondanza di superficie cellulare Nefrina nel tardo NTN (18d). Figura 5 A Mostra il dosaggio di biotinilazione in vivo nei topi NTN che indica un recupero di cellule superficiali Nefrina e controllo. L'analisi densitometrica non visualizza nessuna differenza significativa di cellule superficiali Nefrina nei topi NTN (Figura 5B) e di controllo. Nefrina totale è stato ridotto del 25% nei topi di NTN (Figura 5C). Podocita numeri sono stati diminuiti nei topi NTN rispetto ai controlli di circa il 19% (figure 5 e 5E).

Figura 1 : Isolamento dei glomeruli e perfusione reni. (A) vista attraverso il microscopio nel situs murino dopo aspersione con PBSCM. Il catetere nell'aorta è indicato con una freccia. Aspersione con PBSCM porta i reni per impallidire. (B) il embolization dei glomeruli con biglie magnetiche appaiono come puntini marroni sulla superficie del rene. (C) vista però il microscopio che mostra i) contaminazione dei glomeruli (marroni tondo strutture); II) con tubuli (luce strutture allungate); e iii) delle cellule di detriti. La purezza dei glomeruli è circa il 50%. Gratuito biglie magnetiche appaiono come puntini marroni (ingrandimento 100 X). (D) vista attraverso il microscopio che mostra una purezza di 95% dei glomeruli (ingrandimento 100 X). Scala bar = 100 µm. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 2: biotina rilevata nel ciclo capillare glomerulare. Immagine di immunofluorescenza rappresentativo dei glomeruli del mouse (C57BL/6) irrorato con PBSCM (controllo) e biotina (biotina). Biotina (verde) è visualizzata da streptavidina nel ciclo capillare glomerulare solo nei topi biotina-irrorato. Topi di controllo non mostrare la macchiatura glomerulare biotina. WT1 (rosso) viene rilevato nei nuclei dei podociti in entrambi i topi. Questa figura è stata modificata da una precedente pubblicazione20. Clicca qui per visualizzare una versione più grande di questa figura.

Figura 3: In vivo biotina etichettatura delle proteine di superficie delle cellule glomerulari. (A) Western blot analisi delle proteine della superficie cellulare immunoprecipitati (IP) biotinilato (IP: streptavidina agarosio perline) e lisati (lisato) dei reni da PBSCM-irrorato (controllo) e perfusi con biotina (biotina) topi. Le proteine transmembrana Nefrina e Podocalixina vengono rilevati solo nei campioni immunoprecipitati dei reni perfusi con biotina del mouse. Nei topi di controllo, Nefrina e Podocalixina non vengono rilevati in immunoprecipitati sonde dei reni di controllo del mouse. Nei lisati di controllo e animali perfusi con biotina, Podocalixina e totale Nefrina sono espressi ugualmente in entrambi i gruppi. Il proteina intracellulare extracellulare-segnale regolato chinasi p42 e p44 (ERK) non vengono rilevati in immunoprecipitati sonde di controllo e reni perfusi con biotina del mouse. Nei lisati di entrambi i gruppi del mouse, ERK viene rilevata in quantità uguali. L'actina è macchiato come un controllo di carico. (B) Western blot analisi di immunoprecipitato Nefrina (IP: α-Nefrina) in PBSCM-irrorato (controllo) e perfusi con biotina (biotina) topi. Nei reni perfusi con biotina, Nefrina è visualizzato con streptavidina macchiatura, mentre nessun rilevamento per Nefrina è trovato nei topi di controllo. La frazione di immunoprecipitati di Nefrina (IP: α-Nefrina, WB: Nefrina) così come la frazione lisata (lisato, WB: Nefrina) macchiato per Nefrina Visualizza gli importi uguali di Nefrina. L'actina è usato come un controllo di carico. Analisi della macchia (C) Western di proteina di superficie delle cellule immunoprecipitati biotinilato (IP: streptavidina agarosio perline) e lisati (lisato) dei reni da PBSCM irrorati (controllo) e perfusi con biotina (biotina) topi. La proteina del transmembrane marker vascolare endoteliale (VE)-caderina e molecola di adesione intracellulare 2 (ICAM-2) vengono rilevati solo nella frazione immunoprecipitati degli animali perfusi con biotina. Nei topi di controllo, non VE-caderina o ICAM-2 vengono rilevati. Actina funge da un controllo di carico. Questa figura è stata modificata da una precedente pubblicazione20. Clicca qui per visualizzare una versione più grande di questa figura.
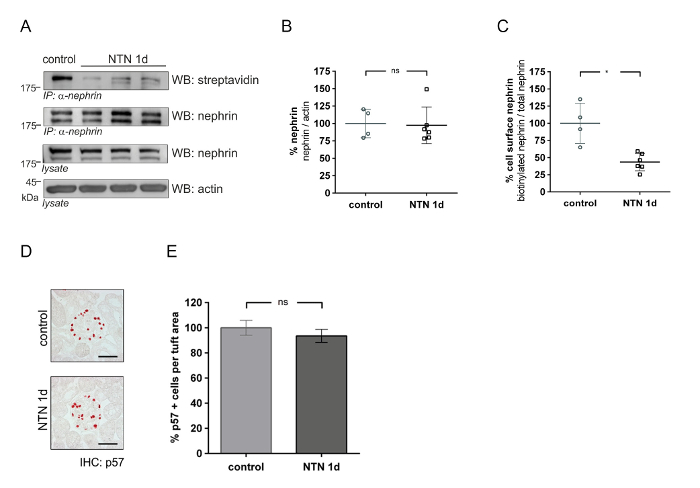
Figura 4 : Glomerulare proteina Nefrina abbondanza nella nefropatia iniziale di nefrite nefrotossici (NTN). (A) Western blot analisi di superficie Nefrina (IP: α-Nefrina, WB: streptavidina) e totale Nefrina (IP: α-Nefrina o lisato, WB: Nefrina) nei topi trattati con siero controllo e nefrotossici (NTN 1D). Actina funge da un controllo di carico. Rispetto ai controlli, NTN topi trattati mostrano ridotta delle cellule superficiali Nefrina (IP: α-Nefrina, WB streptavidina) rispetto ai controlli. (B) analisi quantitativa di totale Nefrina/actina in controllo e topi d NTN 1 [controllo n = 4, NTN n = 6, differenze non significative (ns)]. (C) Densitometric analisi di cellule superficiali Nefrina (biotinylated Nefrina/totale Nefrina) nei topi NTN e controllo (* p < 0.01, controllo n = 4, NTN n = 6). (D) Immunohistochemistry di p57 mostrando podociti in controllo e topi d NTN 1. (E) analisi quantitativa di p57 cellule positive per area di ciuffo (μm2). (40 glomeruli per topo quantificati, ns). Macchia occidentale dati mostrano mezzi ± SD. Podocita mostrano conta mezzo ± SEM. Unpaired t-test con correzione di Welch. Barra della scala = 50 µm. Questa figura è stata modificata da una precedente pubblicazione20. Clicca qui per visualizzare una versione più grande di questa figura.
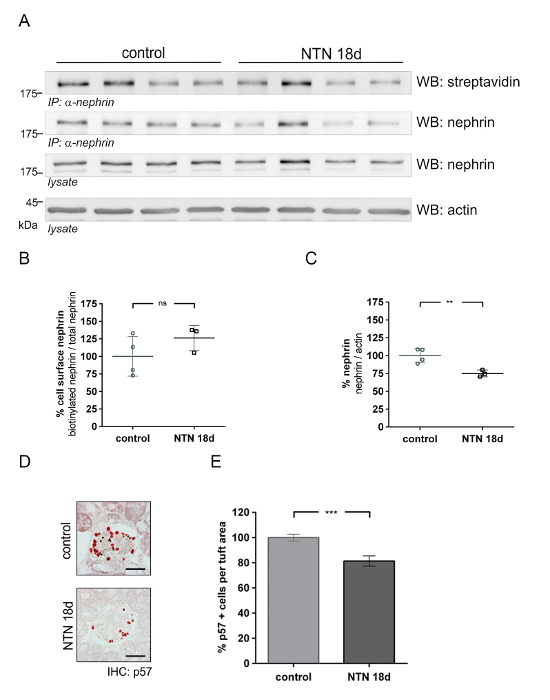
Figura 5 : Glomerulare proteina Nefrina abbondanza nella nefropatia di tardo nefrotossici nefrite (NTN). (A) Western blot analisi di superficie Nefrina (IP: α-Nefrina, WB: streptavidina) e totale Nefrina (IP: α-Nefrina o lisato, WB: Nefrina) nel siero di controllo e nefrotossici trattati topi (NTN 18D). Rispetto ai comandi, NTN 18 d topi mostrano uguali quantità di cellule superficiali Nefrina (IP: α-Nefrina, WB: streptavidina). NTN topi sul display giorno 18 trattati meno totale Nefrina e actina funge da un controllo di carico. (B) densitometrica analisi non visualizza nessuna differenza significativa in cellule superficiali Nefrina tra controlli e topi d 18 NTN (controllo n = 4, NTN n = 3). (C) Densitometric analisi di Nefrina totale all'actina. Nei topi NTN a giorno 18, c'è meno espressione di Nefrina rispetto ai controlli (controllo n = 4, NTN n = 3, * * p < 0,001). (D) Immunohistochemistry di p57 risultati podociti nei topi d 18 NTN e controllo. Ci sono meno cellule positive p57 (rosso) in topi d 18 NTN rispetto ai controlli. Biglie magnetiche appaiono come puntini neri. (E) analisi quantitativa di p57 cellule positive per zona glomerulare ciuffo (μm2) (* * * p < 0,0001, controllo n = 2, NTN n = 2, 40 glomeruli per topo quantificato). Macchia occidentale dati mostrano mezzi ± SD. Podocita mostrano conta mezzo ± SEM. Statistical analysis: spaiati t-test con correzione di Welch. Barra della scala = 50 µm. Questa figura è stata modificata da una precedente pubblicazione20. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Il metodo proposto permette di successo isolamento dei glomeruli di indagare glomerulare RNA o proteine. Inoltre, colture primarie di cellule glomerulari possono essere eseguite da glomeruli isolati. Se biotina viene applicata prima di isolamento glomerulare, etichettatura delle proteine di superficie delle cellule glomerulari può essere eseguita. Con questo metodo, in vivo delle cellule glomerulari traffico della proteina di superficie possa essere studiato e semi-quantificazione dell'abbondanza di proteine è possibile. Le fasi più critiche per il test con successo abbondanza della proteina della superficie delle cellule glomerulari sono 1) sviluppare la perizia manuale in chirurgia del mouse soprattutto incannulazione dell'aorta, 2) privo di bolle connessione delle siringhe per evitare aria embolization della glomeruli e 3) lavorando in condizioni ghiacciate, una volta avviato l'aspersione con PBSCM.
Per questa tecnica, perizia manuale in chirurgia del mouse è essenziale. Inserimento di una canula dell'aorta è particolarmente critica, come la dissezione del vaso impedirà la perfusione dei reni. Il taglio nell'aorta dovrebbe essere abbastanza grande (circa il 50% del diametro del vaso) per creare spazio sufficiente per introdurre il catetere. Se il catetere è tagliato diagonalmente, introduzione del catetere in aorta sarà più facile. Oltre a dissezione, il catetere introdotto deve essere posizionato in alto all'interno dell'aorta al fine di non ostacolare le arterie renali. Le arterie renali in caso contrario verranno non essere irrorate con biotina e le sfere magnetiche.
Biotina è una vitamina piccola che si lega con alta affinità alle proteine streptavidina. A causa delle sue piccole dimensioni (Da 244), biotina non altera la funzione delle proteine coniugate e sarà filtrata attraverso il glomerulo. Tramite incubazione con streptavidina, proteine biotinilate possono essere separati facilmente dalle proteine senza tag di agarosio perline o altri metodi. N-hydroxysuccimide (NHS) esteri di biotina legano ad ammina (-NH2) gruppi di proteine, che sono abbondanti sulle catene laterali dei residui di lisina, ad esempio. Sulfo-NHS-LC-biotina è acqua solubile e cella-impermeabile, se le membrane cellulari sono intatte. Sulfo-NHS-LC-biotina è stata indicata per etichetta di proteine della superficie cellulare23. Associazione di esteri di NHS di biotina ai gruppi amminici dipende dal pH (7-9) e l'uso di buffer di ammina-free (cioè, PBSCM). PBSCM con un pH di 7,4 fu pertanto utilizzato per irrorare i reni del mouse con biotina, come unisce proprietà fisiologiche ideali con solubilità ottimale e la funzione di biotina. Per placare la proteine dopo l'etichettatura, aspersione di PBSCM con la glicina è effettuato, permettendo la biotina libera di diventare associato ai gruppi amminici di glicina. Per evitare processi cellulari dopo la morte dell'animale, è importante eseguire perfusione con una soluzione ghiacciata e continuare a lavorare sul ghiaccio.
Simili ai metodi di biotinilazione ex vivo , lo stress meccanico dei glomeruli di elaborazione durante in vivo biotinylation protocolli maggio anche endocitosi di impatto, rapida segnalazione eventi e l'integrità del RNA. Pertanto è essenziale che tutte le fasi di lavorazione vengono eseguite sul ghiaccio per ridurre il rischio di attività enzimatica cellulare.
Proteinuric modelli animali come gravemente i reni con mouse nefrotossici siero danno nefrite (NTN). In particolare, NTN risultati in espansione mesangiale, sclerosi glomerulare e tubolare lesioni, che conduce alla fibrosi renale nelle fasi avanzate della malattia (42 giorni)24. Aspersione alterata dei glomeruli sclerosed nei modelli di malattia può portare a risultati parziale dell'abbondanza di proteine. Glomeruli sclerosed probabilmente verranno non essere irrorati con biglie magnetiche e così non possono diventare isolati in questo metodo. Nei modelli di malattia che conduce alla sclerosi glomerulare severa, utilizzando tecniche per isolare i glomeruli attraverso diverse fasi di setacciatura può essere un'alternativa al metodo branelli magnetici utilizzato in questo protocollo25. Tuttavia, se glomeruli sono gravemente sclerosed, anche aspersione con biotina può essere alterata. Inoltre, ex vivo biotinylation, in cui estratti glomeruli sono bagnata ex vivo in biotina soluzioni21, probabilmente non sarà vantaggiosa in questi modelli. In alternativa, utilizzare dell'immunofluorescenza per rilevare abbondanza di proteina in glomeruli gravemente malati può essere vantaggioso, come esso non si basa su aspersione dei glomeruli.
Semi-quantificazione dell'abbondanza di proteine utilizzando questa tecnica funziona bene utilizzando densitometria. Tuttavia, piccole differenze in abbondanza di proteine possono perdere come risultato il limite di rilevamento di densitometria.
La tecnica descritta può essere trasferita ad altri organi degli animali che sono perfusi, condizione che le strutture di interesse sono accessibili tramite tecniche di isolamento o la proteina di superficie di interesse è specifica di struttura di tipo o organo di una cella. Anche se tutte le proteine di superficie sono biotinilati di questa tecnica, utilizzando un anticorpo specifico per immunoprecipitazione porterà alla frazione di espressione della proteina della superficie delle cellule della proteina specifica (come indicato per Nefrina Figura 3B).
Divulgazioni
Gli autori non hanno nulla a rivelare.
Riconoscimenti
Gli autori ringraziano Blanka Duvnjak per la sua assistenza tecnica eccezionale. Questo lavoro è stato supportato dalla Deutsche Forschungsgemeinschaft (www.dfg.de) WO1811/2-1 a M.W. e QU280/3-1 a I.Q. Il finanziatore non aveva alcun ruolo nel disegno di studio, raccolta dati, analisi dei dati, decisione di pubblicare e preparazione del manoscritto.
Materiali
| Name | Company | Catalog Number | Comments |
| Motic SMZ168 BL | Motic | SMZ168BL | microscope for mouse surgery |
| KL1500LCD | Pulch and Lorenz microscopy | 150500 | light for mouse surgery |
| Rompun (Xylazin) 2% | Bayer | PZN:01320422 | anesthesia |
| Microfederschere | Braun, Aesculap | FD100R | fine scissors, for cut into the aorta |
| Durotip Feine Scheren | Braun, Aesculap | BC210R | for abdominal cut |
| Anatomische Pinzette | Braun, Aesculap | BD215R | for surgery until the abdomen is opened |
| Präparierklemme | Aesculap | BJ008R | for surgery |
| Seraflex | Serag Wiessner | IC108000 | silk thread |
| Ketamine 10% | Medistar | anesthesia | |
| Rompun (Xylazin) 2% | Bayer | anesthesia | |
| Fine Bore Polythene Tubing ID 0.28mm OD 0.61mm | Portex | 800/100/100 | Catheter |
| Fine Bore Polythene Tubing ID 0.58mm OD 0.96mm | Portex | 800/100/200 | Catheter |
| Harvard apparatus 11 Plus | Harvard Apparatus | 70-2209 | syringe pump |
| EZ-link Sulfo-NHC-LC-Biotin | Thermo Scientific | 21335 | biotin |
| Dynabeads Untouched Mouse T-cells | Invitrogen | 11413D | to embolize glomeruli |
| Collagenase A | Roche | 10103578001 | to digest kidney tissue |
| DynaMag-2 | Invitrogen | 123.21D | Magnet catcher |
| 100µm cell stainer | Greiner-bio | 542000 | for glomerular isolation |
| Axiovert 40 CFL | Zeiss | non available | to confirm glomerular purity |
| TissueRuptor | Quiagen | 9002755 | Tissue homogenizer |
| CHAPS | Sigma-Aldrich | C3023 | for lysis buffer |
| Tris-HCL | Sigma-Aldrich | T5941 | for lysis buffer |
| NaCl | VWR chemicals | 27810295 | for lysis buffer |
| NaF | Sigma-Aldrich | 201154 | for lysis buffer |
| EDTA | Sigma-Aldrich | E5134 | for lysis buffer |
| ATP | Sigma-Aldrich | 34369-07-8 | for lysis buffer |
| Pierce BCA Protein Assay Kit | Thermo Scientific | 23225 | Follow the manufacturer's instructions |
| nephrin antibody | Progen | GP-N2 | for westernblot |
| Polyclonal goat anti-podocalyxin antibody | R&D Systems | AF15556-SP | for westernblot |
| Streptavidin Agarose Resin | Thermo Scientific | 20347 | for immunoprecipitation |
| Protein A sepharose CL-4B | GE Healthcare | 17096303 | for immunoprecipitation |
| polyclonal rabbit anti-p57 antibody | SCBT | sc-8298 | for Immunohistochemistry |
| mouse monoclonal anti-beta actin antibody, clone AC-74 | Sigma-Aldrich | A2228 | Western blot loading control |
| rabbit anti-p44/42 | cell signalling | 4695 | for westernblot |
| Pierce High sensitivity streptavidin-HRP | Thermo Scientific | 21130 | for westernblot |
| polyclonal mouse ICAM-2 antibody | R&D Systems | AF774 | for westernblot |
| polyclonal mouse anti-VE-cadherin | R&D Systems | AF1002 | for westernblot |
Riferimenti
- Jefferson, J. A., Alpers, C. E., Shankland, S. J. Podocyte biology for the bedside. American Journal of Kidney Disease. 58 (5), 835-845 (2011).
- Konigshausen, E., et al. Angiotensin II increases glomerular permeability by beta-arrestin mediated nephrin endocytosis. Scientific Reports. 6, 39513(2016).
- Quack, I., et al. beta-Arrestin2 mediates nephrin endocytosis and impairs slit diaphragm integrity. Proceedings of the National Academy of Science of the United States of America. 103 (38), 14110-14115 (2006).
- Quack, I., et al. PKC alpha mediates beta-arrestin2-dependent nephrin endocytosis in hyperglycemia. Journal of Biological Chemitry. 286 (15), 12959-12970 (2011).
- Swiatecka-Urban, A. Endocytic Trafficking at the Mature Podocyte Slit Diaphragm. Frontiers in Pediatrics. 5, 32(2017).
- Swiatecka-Urban, A. Membrane trafficking in podocyte health and disease. Pediatric Nephrology. 28 (9), 1723-1737 (2013).
- Soda, K., et al. Role of dynamin, synaptojanin, and endophilin in podocyte foot processes. The Journal of Clinical Investigation. 122 (12), 4401-4411 (2012).
- Kestila, M., et al. Positionally cloned gene for a novel glomerular protein--nephrin--is mutated in congenital nephrotic syndrome. Molecular Cell. 1 (4), 575-582 (1998).
- Martin, C. E., Jones, N. Nephrin Signaling in the Podocyte: An Updated View of Signal Regulation at the Slit Diaphragm and Beyond. Frontiers in Endocrinology (Lausanne). 9, 302(2018).
- Nielsen, J. S., McNagny, K. M. The role of podocalyxin in health and disease. Journal of the American Society of Nephrology. 20 (8), 1669-1676 (2009).
- Yasuda, T., Saegusa, C., Kamakura, S., Sumimoto, H., Fukuda, M. Rab27 effector Slp2-a transports the apical signaling molecule podocalyxin to the apical surface of MDCK II cells and regulates claudin-2 expression. Molecular Biology of the Cell. 23 (16), 3229-3239 (2012).
- Tossidou, I., et al. Podocytic PKC-alpha is regulated in murine and human diabetes and mediates nephrin endocytosis. Public Library of Science One. 5 (4), 10185(2010).
- Qin, X. S., et al. Phosphorylation of nephrin triggers its internalization by raft-mediated endocytosis. Journal of the American Society of Nephrology. 20 (12), 2534-2545 (2009).
- Waters, A. M., et al. Notch promotes dynamin-dependent endocytosis of nephrin. Journal of the American Society of Nephrology. 23 (1), 27-35 (2012).
- Zhang, X., Simons, M. Receptor tyrosine kinases endocytosis in endothelium: biology and signaling. Arteriosclerosis Thrombosis and Vascular Biology. 34 (9), 1831-1837 (2014).
- Maes, H., Olmeda, D., Soengas, M. S., Agostinis, P. Vesicular trafficking mechanisms in endothelial cells as modulators of the tumor vasculature and targets of antiangiogenic therapies. Federation of European Biochemical Societies Journal. 283 (1), 25-38 (2016).
- Satchell, S. C., et al. Conditionally immortalized human glomerular endothelial cells expressing fenestrations in response to VEGF. Kidney International. 69 (9), 1633-1640 (2006).
- Takemoto, M., et al. A new method for large scale isolation of kidney glomeruli from mice. American Journal of Pathology. 161 (3), 799-805 (2002).
- Liu, X., et al. Isolating glomeruli from mice: A practical approach for beginners. Experimental and Therapeutic Medicine. 5 (5), 1322-1326 (2013).
- Haase, R., et al. A novel in vivo method to quantify slit diaphragm protein abundance in murine proteinuric kidney disease. Public Library of Science One. 12 (6), 0179217(2017).
- Satoh, D., et al. aPKClambda maintains the integrity of the glomerular slit diaphragm through trafficking of nephrin to the cell surface. Journal of Biochemistry. 156 (2), 115-128 (2014).
- Tomas, N. M., et al. Thrombospondin type-1 domain-containing 7A in idiopathic membranous nephropathy. New England Journal of Medicine. 371 (24), 2277-2287 (2014).
- Daniels, G. M., Amara, S. G. Selective labeling of neurotransmitter transporters at the cell surface. Methods in Enzymology. 296, 307-318 (1998).
- Ougaard, M. K. E., et al. Murine Nephrotoxic Nephritis as a Model of Chronic Kidney Disease. International Journal of Nephrology. 2018, 8424502(2018).
- Salant, D. J., Darby, C., Couser, W. G. Experimental membranous glomerulonephritis in rats. Quantitative studies of glomerular immune deposit formation in isolated glomeruli and whole animals. Journal of Clinical Investigation. 66 (1), 71-81 (1980).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon