Method Article
リアルタイム イメージングと二相循環フロー システムを用いた菌バイオ フィルム開発の定量
要約
アセンブリ操作について述べる、流下しながらリアルタイムで画像菌バイオ フィルム形成に設計フロー装置のクリーニングします。我々 はまた、提供し、取得した画像に使用する定量的アルゴリズムを話し合います。
要約
口腔咽頭カンジダ症は、カンジダ属のメンバーする必要がありますに付着し、唾液の影響下で口腔粘膜表面上に成長します。流れ下で成長のためのモデルを開発しているが、これらのシステムの多くは高価で、またはセルが流下しながら画像を許可しません。成長とカンジダ細胞の流れの下で、リアルタイムでの発展をイメージすることができます新しい装置を開発しました。ここでは、アセンブリと、この装置の使用だけでなく、生成されるデータの定量化のプロトコルを詳しく説明します。セルにアタッチとデタッチ スライドからも時間をかけてスライド上のバイオマスの測定を確認するに料金を定量化することが。このシステムは経済的で汎用性の高い、安価な卓上顕微鏡を含む光の顕微鏡の多くの種類を扱う、他フロー システムに比べて倍のイメージングができる拡張します。全体的にみて、流動場下における真菌種のバイオ フィルムの成長に非常に詳細なリアルタイムの情報を提供することができます低スループット システムです。
概要
カンジダ ・ アルビカンス(C. albicans) は、口腔粘膜の表面、口腔咽頭カンジダ症の原因、影響を受けた個人1生命の低品質の結果など、多くの組織タイプに感染する人間の日和見病原菌です。C. アルビカンスの病因の重要な特徴であり、形成とC. albicansバイオ フィルム2,3,4の機能に関する多くの研究が行われているバイオ フィルム形成 5、体外静的 (ない流れ) を使用して多くを行ったモデル。ただし、 C. albicans必要がある、口腔内の唾液の存在下で成長します。多数のフロー システムは、生細胞イメージング6,7,8,9,10を許可するように開発されています。これらの異なった流れシステムは異なる目的のために設計されている、従って各システムに異なる長所と短所。C. albicansの適切なシステムの流れの多くは高価でした、必要な複雑な加工、または流れの中のイメージを作成およびできなかった画像の前に停止しなければならなかったことがわかった。そこで、流れ11下C. albicansのバイオ フィルム形成を研究する新しいフロー装置。私たちフロー装置の設計時にこれらの主要な考慮事項に従いました。まず、バイオ フィルムの成長と開発の複数の側面を定量化することができるしたい (ように私たち研究変異株と変更されていない臨床分離株簡単に) 蛍光セルの使用を必要とすることがなく、リアルタイム。第二に、すべてのパーツを少し変更なしで市販したい (すなわち。、ないカスタム作製)、他よりは簡単に私たちのシステムを再作成できるように、簡単な修理を可能にします。拡張のための許可したいもの第三に、合理的に高流量時の画像します。最後に、たい、流れ、下基板に取り付けるセルの期間に続く新しい細胞を導入することがなく長期間バイオ フィルムの成長を監視することができます。
これらの考慮事項は、図 1に示す 2 フラスコ循環フロー システムを開発する私たちを率いてください。2 つのフラスコでは、2 つのフェーズ、添付ファイルのセル シード フラスコから描画する添付ファイル相、新しいセルを追加することがなくバイオ フィルムの成長を継続する無細胞系メディアを使用する成長期に実験を分割させてください。このシステムは、スライドとチューブ (5 に 2図 1) が、孵化器の中に置かれていることの前の顕微鏡用培養室で動作するように設計されています、外大セカンダリ コンテナーに配置するその他のコンポーネントはすべて、顕微鏡。また、接続された温度プローブとホット プレート攪拌 37 ° C で添付ファイル フラスコの真菌細胞を維持するために使用されます。それは再循環、このシステム フロー (36 h 以上の条件に応じてすることができます)、中に連続的なイメージングが可能です、直立または反転卓上顕微鏡を含む最も標準的な顕微鏡に使用できます。ここでは、アセンブリの操作、しフロー装置のクリーニング同様としては実験後、ビデオを分析するいくつかの基本的な ImageJ 定量的アルゴリズムを提供.
プロトコル
1. フロー装置を組み立てる
- 後述の考慮事項と図 1の回路図によると材料表に掲げる部品を構成します。
注意: 便宜上、装置は 2 つの側面、(上流のすべてメディア フラスコにスライド)、緑の側とオレンジ色に分かれて流れ側 (下流のすべてメディア フラスコにスライド)。- フロー装置のすべてがメディア フラスコ (図 1, 1) の唯一の例外で、リークを防ぐために気密であることを確認します。これを達成するためにテープ配管に適用パルセーションダンパ (PD) と 2 μ m フィルター ボトル (FB) を除いて組み立てる前に男性にスレッド処理により、ゴム製のガスケットはそれらの気密を保つテープ配管を必要としません。
- 通常の操作中には肯定的な圧力の下で、すべての有刺鉄線継手で耳クランプを適用 (すなわちポンプの下流)。
- 使用色分けラボ テープ ラベル A または G とバルブの場所を (添付ファイルおよび成長のそれぞれ)、ポンプ場所、スライドの接続場所、0.2 μ m フィルター接続。
- 使用するチューブの長さは流れシステムと顕微鏡、すべてのフロー装置を下流フラスコ (オレンジ側の大半) にポンプの二次封じ込めにする必要があります覚えておいて間の距離に基づいて決定します。約 1 m の余分なチューブを追加上流のスライド (できればバブル トラップ) これにより、スライドに達するすべてのメディアが適切な温度でこと、顕微鏡インキュベーション室内に配置します。
- バブル トラップできれば実験中に培養チャンバー内のスライドに合理的に可能な限り近い場所 (管壁に沿って多くの場合フォームの泡);ただし、する必要があります覚えておいて動作する真空に接続されています。
- FB と 0.2 μ m 使い捨てフィルターは約 0.5 m 長い間チューブを確認します。
- 追加する各メディアのフラスコに約 2 cm 電磁攪拌棒。
- (止血剤を使用することができます) 遮断弁として機能する管のクランプのいくつかのフォームを取得します。
- 使いやすさ、オートクレーブ バスケットでフロー装置を保ちます。それは、グリーン サイドとオレンジ サイドを容易に分離できるように大きな 1 つの 2 番目の小さなバスケットを持っていることができます。
- 4 mm のドリルビットを使用して添付ファイル フラスコ サーマル プローブ (世話を別の穴を通過する) に対応するゴム栓に余分な穴をドリルします。ポートを介して、チューブを取得するには、プッシュ チューブを通じてのピンセット。一度、場所、し、ピンセットがバックアウト プルでそれを保持するためにチューブをクランプします。
注: 余分な穴をゴム栓に追加できない場合は、4 ポートのスクリュー キャップの広口ネジ瓶がフラスコとゴムのストッパーの代わりに動作場合があります。
- 一度フロー システムは完全に組み立てされて、成長する両方緑とオレンジ色の側のフラスコのバルブを閉じます。添付ファイル フラスコ管、メスシリンダーと水を使用すると、製造元の指示に従って蠕動性ポンプを調整します。
2. 実験を実行します。
- 実験前日予熱の 37 ° c、顕微鏡インキュベーション室を開始し、菌の菌株の一晩かけて培養の準備 (蛍光は必要ありません)。
- 単一部品、ポンプを収集し、滅菌バイオ セーフティにキャビネットを配置します。
- バブル トラップを削除して安全キャビネットでこれらを配置温度プローブ フロー装置から。
- Detangle し、必要に応じて、チューブを整理します。
- オートクレーブ不妊; ように 30 分間の攪拌バーを含むフロー装置終了すると、バイオ セーフティ キャビネットに転送されます。
- 図 1に描かれている、バブル トラップ、温度プローブ、および (スライド) を除くすべての単一の使用のコンポーネントを接続します。
- 0.2 μ m フィルター (図 1, 11) では、「アダプター」としてそれを作るに 1 mL の注射器のプランジャーを取り外します。この端に FB からチューブを強制的、成長フラスコにつながるチューブに 0.2 μ m フィルターを取り付けます。
- システムへの空気漏れを防ぐとは、シリコン真空グリス スライド アダプター (内部のグリースを得るように注意してください) のトゲの周り、それを接続する前に適用されます。
- 100 mL の 2% (w/v) グルコース (YPD)、2% (w/v) ペプトン、酵母エキス 1% (w/v) で添付ファイル フラスコを埋める YPD の 200 mL の成長フラスコを記入してください。各フラスコにメディアを緑の側管に達することを確認します。
- すべてのバルブが開いていることを確認します。バブル トラップを付ける、真空、緑の側のチューブとポンプを接続バブル トラップの下流。
- 完全に緑の側面を埋める、調剤し、死んだ細胞やランダムなゴミ ミリリットルの最初のカップルが多いので、メディアの約 1-2 mL を破棄する 3.3 mL/min の流速で流体をポンプします。チューブの緑の側は満ちているメディア、そして、進む前にバブル トラップの下流の泡がないことを確認します。
- YPD、世話を気泡を導入することでチャネル スライドと貯水池を埋めます。
- オレンジ側約 0.5 m のバッファーを作成するより多くの流体フロー装置とポンプにスライドを接続します。これは、誤って逆流が発生した場合のスライドでの空気を防ぐためです。
- 顕微鏡に送信フロー装置の準備: 入口と出口のバブル トラップ、緑とオレンジ サイド添付ファイル フラスコ バルブを閉じられたクランプ クランプを閉じる。PD と FB のスクリュー キャップがタイトなオートクレーブに入れることの中に含まれていることを確認します。
- 輸送を容易にするためのチューブからポンプを外します。顕微鏡に近い二次容器にホット プレート攪拌を含むすべてのコンポーネントを移動します。
- イメージング用フロー装置を準備します。
- 温度プローブを付けるホット プレート攪拌し 37 ° C に添付ファイル、フラスコを加熱開始300 rpm でメディアをかき混ぜるし、全体の実験、この維持します。
- 顕微鏡のスライドをマウントし、テープを使用して、しっかりとそれを確保するため必要な場合。
- バブル トラップを付ける真空 (元に戻さないとクランプまだ)。
- 図 1に示される位置にフロー装置にポンプを接続します。
- 3.3 mL/min の流速でポンプを開始、約 5-10 秒の実行を許可し、バブル トラップ入口/出口クランプを削除します。
- ポンプ添付ファイル フラスコがヒートアップ中の実行を続行するを許可します。メディアがフロー システムの中で流通し、通常の操作をチェックします。
- チェック漏れ空気用継手ポンプ (いくつかのバブル形成は正常)、または下流漏れ流体の上流。
- 成長メディア フラスコ、PD、FB が (存在する場合は、フィルターの目詰まりやきつく耳クランプ可能性) 入口管から滴下メディアをすべてをあることを確認します。
- 顕微鏡をチャネル スライドに添付または圧延の細胞があるかどうかを確認します。細胞の数が多すぎる可能性があります設定時に汚染またはバブルのポリテトラフルオロ エチレン (PTFE) 膜がトラップ交換が必要があります。
- 添付ファイルのフラスコとインキュベーション室 37 ° C で 2 人とも、一度 1 × 106セル/mL に到達する添付ファイル フラスコに真菌細胞の十分な一晩文化を追加します。
注: μ L で追加するボリュームは、この数式を使用して計算できます。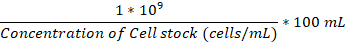
- セルに適応するように 15 分を待機します。
- セルのフローを開始する両方の成長フラスコのバルブを閉じながら両方の緑とオレンジ色の側の添付ファイル フラスコ バルブを開きます。
- セル スライドに到達するように約 5 分待ってから、(この時間は緑側チューブの長さに応じて調整する必要があります) 顕微鏡の初期フォーカスを可能にします。この時間の間に、前の実験で使用される同じ撮像パラメーターを顕微鏡を調整します。これは、最初の実行は、以下の手順を実行します。
- 低倍率空気目的に切り替えます。
- 見つけるし、接続されたセルまたは小さな出芽細胞に焦点を当てます。
- ケーラー照明用コンデンサーを構成し、暗視野に切り替えます。
- 露出時間を 300 ミリ秒に設定します。
- 小細胞は (新進娘細胞の約 7-8 のバック グラウンド強度比への信号は妥当な値) 背景にはっきりと見えるまだ薄暗いまで、照明の強度を調整します。今後の実験の照明の強さをメモ/マーク。
- 2 分ごとに 2 時間以上のイメージを取得するソフトウェアを構成します。
- 添付ファイル段階での画像の取り込みを開始します。約 5 の後に戻って確認してください、そのフォーカスを確保する 10 分が維持されています。そうでない場合は、次の画像を取得した後にすぐに焦点を調整しよう。
- 添付ファイル フェーズが終了した直後に、ファイルを保存し、両方添付ファイル フラスコ バルブを閉じながら両方緑とオレンジ色の側の成長のフラスコ バルブを開きます。培養チャンバー内バルブの場合、ステージをぶつけない世話をします。
- ホット プレート攪拌から体温計プローブを抜きます。
- ホット プレート攪拌から添付ファイル フラスコを取り出し、その場所で成長フラスコを置きます。
- 22 時間以上 15 分毎のイメージを取得し、成長期の画像集録を開始するソフトウェアを構成します。再焦点は必要はありませんする必要がありますが、数時間後フロー装置をチェックする勧めします。
- チェック漏れ空気用継手ポンプ (再びいくつかのバブル形成は正常)、または下流漏れ流体の上流
- 成長メディア フラスコ、PD と FB がすべてであるチェックは、(存在する場合は、フィルターの目詰まり、きつく耳クランプ、または場合は使用されている細胞を凝集、有刺鉄線のフィッティングで詰まらせる可能性) にメディアを滴下します。
- FB の流体のレベルをチェックします。メディアは、ボトル (フィルターの上の上の 1.5 cm 以上) の上部を近づいている場合 (緩めないで、このフラスコは圧力の下で) 両方 screwcaps を締めます。さらに締め、場合継続実験 (ただし、これはリークの可能性があります)、次の洗浄後 PD と FB にゴム製のガスケットに置き換えると。
- 成長段階の取得が完了したら、ファイルを保存し、オレンジ側に圧力をリリースとして、ノイズをすることができる緑とオレンジ色の側の添付ファイル フラスコ バルブを開き。彼らがメディア上に少なくとも数センチメートルまで両方のメディアのフラスコから来る緑側チューブを引き上げます。(約 100 mL/分またはポンプの早送りボタンを押したまま) 高速で、お手入れがより簡単にチューブからすべてのメディアを削除するポンプを実行します。空に、フロー装置をポンプから外し、この顕微鏡から削除します。
3. クリーン フロー装置
- (単一部品、バブル トラップ、および温度プローブ) 非オートクレーブ コンポーネントをすべて削除してバブル トラップを脇オートクレーブ 30 分廃棄フロー装置部品、70% エタノールできれいなプローブを使用します。
- オートクレーブ滅菌が終了した後、メディアを破棄しリンスしてメディア フラスコをおきます。バブル トラップを再接続します、(再利用可能) でのクリーニングに使用する ibidi チャネル スライドとフロー システムを図 1で示す位置にポンプに接続します。
- クランプは、オレンジ側成長フラスコ バルブを閉じられます。
- 漂白剤の原液の約 200 mL をビーカーに配置します。漂白剤、ゴム栓に配置し、(を除くすべてのフィルター) フロー装置全体漂白剤を循環する高速でポンプを開始します。一度漂白剤でいっぱい、高速でのポンプを残して着用でき、チューブを破るためにポンプを停止します。
- 15 分の漂白後、ビーカーの上ゴム栓を保持し、フロー装置から漂白剤を削除するもう一度ポンプを開始します。
- 手順 3.4 と 3.5 フロー システムを洗浄する漂白剤の代わりに過剰な水で 2 回繰り返します。この時間の間には、他の洗浄剤は腐食するか、フィルターを詰まらせるため水だけでフィルターを掃除します。
- ステップ 3.6 からのゴム製ス トッパーとビーカーの水に 0.2 μ m メディア フィルター (2 μ m FB から来る) に通常接続するというチューブを配置します。
- 引き離すことが通常できる耳クランプにもかかわらず簡単に 20 μ m のインライン フィルターの入口に接続されているチューブを外します。
- 真空フィルター フラスコと予備 3 穴ストッパーを介してチューブの長いセクションを使用して、フロー装置に接続することができます真空システムを作成します。
- この真空システムを 20 μ m フィルター入口の入口に接続し、真空; を開始これは死んだ細胞を削除、逆方向のフィルターを通して水を引くでしょう。
- プル、少なくとも 200 mL の水、フィルター、水フィルター行を空にする水からチューブを削除。
- 20 μ m フィルターから真空システムを外し、通常のチューブにフィルターを接続し直します。
4. 動画の定量化
注: すべてのファイルは、動作するようにタグ イメージ ファイル (TIF) 形式に変換する必要があります。さらに、実験を比較が重要ですすべての画像が同じ顕微鏡と画像処理パラメーター、撮影は前述の通り。
- ダウンロードしてインストールされていない場合は、ImageJ をインストールします。
- 補足のマクロ ファイルをダウンロードし、ImageJ\macros フォルダーに配置します。
- 指定されたマクロを調整します。
- ImageJ、以前実験から画像のスタックを開き、細胞存在の時間ポイントを選択します。
- 経由でメニューから選択"画像 |種類 |「8 ビット。
- 経由でメニューから選択"画像 |調整 |しきい値"。「暗い背景」チェック ボックスをオンにします。右側にあるドロップ ダウン メニューを赤に設定します。
- (大丈夫で、マクロが処理されるいくつかの非細胞の斑点) 余分なノイズを最小限の赤で覆われているすべてのセルまで、小さい方の値を調整します。この下限値のメモしておきます。
- 閾値ウィンドウおよび開いているイメージを閉じます。
- 経由でメニューから選択」のプラグイン |マクロ |[編集]。ファイルを開くように求めとき:「上の 1 つのフォルダー レベルに移動」、その後、マクロ フォルダーを選択し、流れバイオ フィルム数量マクロ ファイルを開きます。
- 4.3.4 の手順で決められた値に「さらに (15, 255);」のすべてのインスタンスで 15 の値を変更します。ファイルを保存してこのウィンドウを閉じます。
- 経由でメニューから選択」のプラグイン |マクロ |」をインストールし、流れバイオ フィルム定量化ファイルを選択します。
- 今、下で、 "のプラグイン |マクロ"メニュー、様々 なビデオ数量の六つの新しいオプションが表示されます。完全な分析を実行し、集録したデータのすべての利用可能な解析を実行し、出力ファイルを自動的に生成するメッセージが表示されたらの付着・増殖のビデオ ファイルを選択します。
結果
通常の代表的な画像がコマ撮り実験を一晩野生型c. アルビカンスを使用してその 37 ° C でセルを図 2Aおよび補足のビデオ 1で見ることができます。画像は見やすくするために造影されています。元のデータの定量化を行ったと代表的なグラフが図 2Bで見ることができます。(すなわち、イメージング エリア合計で割った値)、イメージングの領域に、これらのグラフを生成するデータが正規化された最初と剥離がさらに、バイオマス正常化した前述のよう。また、着脱は流れバイオ フィルム数量マクロによって生成された個々 のフレーム値ではなく時間、累積値を表示します。グラフは、この段階に達している、一度、回帰分析から統計上の比較を実行できます。

図 1: 二相循環フロー装置の概略図。接続の黒線はチューブを示し、矢印が通常の操作中にフローの方向を示します。(A) A フロー システムの一般的な概要を示します。便宜上、フロー システムは、緑の側に分かれています (スライドの上流) とオレンジ サイド (スライドの下流)。太字の数字は、材料の表に掲げる部品に対応します。バルブのラベル単管クランプまたは止血剤を実験中に配置するための場所をマークします。フィルターの順序は次のように: 8-20 μ m インライン フィルター、9-10 μ m インライン フィルター、10-2 μ m フィルター ボトル (FB) および 11-0.22 μ m 単回使用の使い捨てフィルターです。回路図ではないスケール。(B) A ポートを通過する 4 つのコンポーネントを示す添付フラスコにゴム栓のクローズ アップ ビュー: メディア コンセント、ガス交換を可能にする、0.2 μ m フィルター、温度プローブは (余分な穴を掘削が必要) とメディアを返します。(C) A の脈動ダンパー (PD)、FB と各ポートに使用するアセンブリとスクリュー キャップをクローズ アップ。これらのボトルは気密機能する必要があります。PD のアウトレット チューブよりも適切に機能するためのインレット チューブ ボトルに深く到達してください。FB でのグレーの四角形は、鋼のフィルターを表します。この図の拡大版を表示するのにはここをクリックしてください。

図 2:カンジダ 37 流栽培野生型細胞 ° C(A) 代表暗視野顕微鏡画像のフローで示された時点で 37 ° C の下で形成される microcolonies。スケールバー = 100 μ m (B) 代表的な画像の定量化データ。イメージングの領域 (デンシトメトリーの分析によって決まります)、細胞接着の累積率と % バイオマス剥離 (剥離率バイオマスに正規化) 内にある生物量の各菌株の時間の経過が表示されます。データ的に n ≥ 3 の実験は。この図の拡大版を表示するのにはここをクリックしてください。
補足ビデオ 1.カンジダ ・ アルビカンス37 流栽培野生型細胞 ° CWT の添付ファイルのセル基板 (左上隅に示されている時刻; 画像 2 分ごと)、添付ファイルの段階でこのコマ撮りの暗視野顕微鏡のビデオ番組がその後の成長と開発の間に続いて、成長期 (2 h で始まる; 画像 15 分毎)。セル シード メディア (1 x 106) は、携帯無料メディアを成長フェーズ中に使用した、添付ファイル段階で使用されました。流れは右から左へ。スケールバー = 50 μ m.してくださいここをクリックしてこのビデオを表示します。(右クリックしてダウンロード)
ディスカッション
上記できますフロー システムを使用して菌のバイオ フィルムの成長と発展の定量的な時間経過のビデオを生成。実験間の比較を可能にするイメージングのパラメーターが同じに保たれることを確保するため非常に重要です。これは (多くのガイドは、利用可能なオンラインこのプロセス) 各実験用ケーラー照明が顕微鏡に設定されていることを確認含まれています。パラメーターをイメージング、別フロー装置を操作するときに留意すべきいくつかの重要なステップがあります。まず、確実にそう失敗はバブル トラップを介して引っ張られる空気につながると流体の流れの中に真空下でバブル トラップを維持することが重要です。同様に、バブル トラップではない (すなわち、フロー装置を運搬するとき)、真空下で入口と出口の両方する必要がありますまま固定シャット ダウン;それ以外の場合空気には PTFE 膜のリークが発生します。このクランプは、バブル トラップが真空下でもう一度配置されるまで削除する必要はありません。最後に、非常に潜在的な下駄やリーク、フロー装置を監視することが重要です。システムの下駄をチェックする最も効率的な方法は、FB、PD、添付ファイル、または成長のフラスコの口から滴り落ちるメディアがあることを確認することです。すべてがスムーズに動作している場合、これらのメディアは比較的同じような料金で滴るべきであります。チューブとして場所を判断できます一般に詰まりがある場合だけ上流の詰まりはより厳格になります。
データを取得すると、我々 はビデオを量的に多数の ImageJ マクロを提供します。これらのマクロは、バイオ フィルムの成長と開発、バイオマス、およびセルにアタッチし、デタッチの表面またはバイオ フィルムから速度の測定を含む複数のパラメーターを決定します。指定されたマクロの説明を以下に示します。
完全な分析は、以下すべての解析を実行して自動的にデータを出力します。他のすべては開いているビデオを必要としながら、画像を開くファイルがない場合このマクロを実行できます。実行すると、添付ファイル スタック成長スタックのファイルし、ファイルを開くユーザーが要求されます。これに続いて、それ自動的に画像を分析し、添付画像ファイルと同じフォルダーに、以下のようにすべてのデータ テーブルを含むデータ フォルダーを出力します。添付ファイル カウンターマクロが添付ファイルでのみ実行されます。他のすべての解析は、付着・増殖のファイルの連結されたスタックで実行されます。出力データ生成されたファイルは、テキスト ファイルにインポートする必要がありますは、使いやすさに優れています。
合計強度解析は、アクティブなウィンドウの各フレームを分析します。4.3.7 以降の手順で示されるしきい値を下げる上にある各ピクセルのすべてのグレー値を追加して、フレームあたり 1 つの累積的な値を出力します。生成された値は、バイオマスが発生する任意のカメラの飽和状態まで、フレーム内に存在する比例します。イメージング領域の領域に、データを正規化し、必要があります。これは、マクロでは実行されません。
エリア分析は割合 (上記の下限のしきい値) 細胞によって覆われているフレームの領域のアクティブなウィンドウの各フレームを分析します。
添付ファイルのカウンターは各フレーム間を接続するすべてのセルの合計強度を決定するのにフレーム減算を使用します。したがって、最初のデータ ポイントは、フレーム 1 と 2 の間を接続するセルのバイオマス2 番目のデータ ポイントは、バイオマス等フレーム 2 と 3 の間付着細胞の。これらのデータは、画像領域に正規化する必要があります。簡単に読みやすくするため、グラフ化する前にこの値を統合する便利ですも。
剥離カウンター 添付ファイル カウンターと同じを動作しますが、各フレーム間をデタッチのセルの合計強度を決定するようにフレーム減算を反転させます。これらのデータはまたイメージング領域に正規化し、グラフ化する前に統合します。統合前にこれらのデータが合計強度解析における計算前のフレームの合計強度へさらに正規化できます。この新しい値は多くの場合、その時間の時点でバイオ フィルムからデタッチ細胞の比率を表す貴重なデータ、切り離しのバイオマス細胞は以来増加増加バイオ フィルム バイオマス。
ここで紹介の流れシステムが構築し、他のフロー システムより動作は複雑が、いくつかの利点を提供しています。これらの利点の多くは市販チャンネル スライドの私達の使用から生じる。これらのスライドで使用可能な組織培養治療はカンジダ細胞表面に付着するように十分です。さらに、さまざまな顕微鏡システム、正立顕微鏡の低倍率での透過光を使用してを含むで容易に使用することができます伝統的なスライドに似ているこのチャネル スライドのプロファイル。このタイプの顕微鏡を使用してデータ楽 (退色と低毒性はありませんでした)、特に蛍光顕微鏡と比較しての定量化を作った暗視野顕微鏡を使用することができました。(光) ごとに区分化せず伝統的な顕微鏡は、焦点細胞から意味貢献フォーカスと同様サイズ12のセルのようにイメージする光子の似たような数字、保守的な力です。つまり、高い地域は焦点から外れているにもかかわらず、画像の 1 つの平面にもかかわらずフル 3 D の成長しているバイオ フィルムはまだ定量化する実験中。この単面イメージング細胞への毒性被害を大幅に削減の利点がありますが、バイオ フィルムの 3 D アーキテクチャに関する情報を提供しません。しかし、このフロー システムは、この情報13を取得する蛍光細胞と共焦点顕微鏡を使っても使用できます。
ユニークな 2 フラスコも私たち流装置のセットアップを再循環させる多くの利点があります。まず、フロー システムの多くは、スライドする細胞と歯根を求め、しかし独立したセル シード添付ファイル フラスコの私達の使用はイメージを作成し、流れの下で、スライドに準拠するいると思ってセルを定量化する私たちにこれをことができます、何が発生するより似て 生体内で。さらに、我々 は以前に発生した高速の画像処理と画像接着イベントの我々 の顕微鏡を調整することがされているリアルタイム事実11の後それらの定量化とは対照的。第二に、再循環、携帯無料 24 h 以上の流動下でのバイオ フィルムの成長を理解することができた拡張期間にわたって維持することができます無料のセル成長フラスコ、非循環システムと通常達成することはできません期間を持つ.フロー システムが達成できるかの時間上限はまだ決めていないが、我々 は 36 h 実験を完了しましたしかし、長くの実験では、フィルターの目詰まりや漏れの可能性が高く。多数の要因はセル, どのように接着している、および菌糸形成、実験の期間の上限を定義する困難度の成長率など、実験の潜在的な期間に影響を与えます。ただし、提示フロー装置を達成することができますよりもはるかに長い期間が必要な場合、フィルターは、前述8をされているラインに紫外線 (UV) 殺菌ボックスで置き換えできます。この殺菌ボックスも許可イメージ細菌に使用するこのフロー装置画像菌株に私たちの以前の試みは、0.2 μ m フィルターの急速な目詰まりの結果。最終的には、我々 は、ボックスはカスタム作製とこの結果死んだ細胞を循環に UV 殺菌を採用する選んだ。
この流れシステムの別の利点は、それを顕微鏡を購入する必要がある場合は特に商業システムと比較して合理的に高価なはないです。私たちの研究室で基本的な透過光卓上顕微鏡を購入し、大規模な標準的な対流インキュベーター内全体の顕微鏡を置くことができました。唯一の主要な要件は、顕微鏡微速度顕微鏡観察を行うために (機械または電気) シャッター機能を必要です。
このシステムは汎用性が、多くの利点を提供していますが、低いスループット方法です。私たちフロー装置は他の使用できるフロー システムとは異なり、並列で複数の系統を成長することができます。広範な準備と清掃時間のためのみ週 2 つの実験を行うこととしております。ただし、他の多くの流れのシステムは幾分高価、カンジダ菌体は菌糸の条件の下で育てられたときに詰まらせることがあります。
さらに、このフロー システムは、他と比較して非常に複雑と操作を維持することは困難することができます。多くの実験の後フィルターを詰まらせる開始し、チューブが薄い、身に始まる、部品を開始、錆または緩む;このように交換するこれらのコンポーネントを必要とします。フィルターの使用によりこのシステム; いくつかの真菌の系統の成長条件と互換性がありません。特に、凝集を誘導することが急速に 20 μ m のライン フィルターを詰まらせます。しかし、十分な経験でフロー システムを使用して、失敗した実験で発生する前に潜在的な問題を検出しやすくなります。フロー装置の日常の操作を少し簡単にすることができる 1 つの事と機械工 (アルミ、ステンレス鋼など) オートクレーブ材料から住宅、泡オートクレーブすることができますバブル トラップのレプリカを作成していますバブル トラップの PTFE 膜とアダプター コンポーネントはオートクレーブ、フロー装置の残りの部分をトラップします。
結論としては、ここに示す二相循環フロー装置はイメージを作成し、バイオ フィルム形成菌流とリアルタイムで体外を定量化するユニークなモデルを表します。システムに限界がある、適応性の高い、ほとんど顕微鏡で十分に働きます。
開示事項
著者が明らかに何もありません。
謝辞
著者は、フロー装置の設計の貴重な入力を提供するため博士ウェイド Sigurdson を認めたいと思います。
資料
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 micron in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 micron in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 micron inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
参考文献
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved