Method Article
Echtzeit-Bildgebung und Quantifizierung der Pilz Biofilm-Entwicklung mit einem Zweiphasensystem rezirkulierenden Flow
In diesem Artikel
Zusammenfassung
Beschreiben wir die Montage, Betrieb, und Reinigung von einem Fluss Apparat Bild Pilz Biofilmbildung in Echtzeit unter fließen sollen. Wir bieten und diskutieren quantitative Algorithmen auf die aufgenommenen Bilder verwendet werden.
Zusammenfassung
Im oropharyngealen Candidose müssen Mitglieder der Gattung Candida halten und wachsen auf der mündlichen Schleimhautoberfläche während unter dem Einfluss von Speichel fließen. Während Modelle für das Wachstum unter Strömung entwickelt wurden, viele dieser Systeme sind teuer oder nicht zulassen, imaging, während die Zellen unter Strom stehen. Wir haben ein neuartiges Gerät entwickelt, das uns erlaubt, das Wachstum und die Entwicklung von Candida Albicans Zellen durch fließen und in Echtzeit-Bild. Hier zeigen wir das Protokoll für die Montage und Nutzung von dieser Strömung Apparat sowie die Quantifizierung der Daten, die generiert werden. Wir sind in der Lage, die Preise zu quantifizieren, die die Zellen zum Anfügen und trennen von Folie, sowie ein Maß für die Biomasse auf der Folie im Laufe der Zeit zu bestimmen. Dieses System ist wirtschaftlich und vielseitig, mit vielen Arten von Lichtmikroskopen, einschließlich preiswerte Benchtop Mikroskopen arbeiten und ist in der Lage, erweitert imaging Zeiten im Vergleich zu anderen wasserführenden Systemen. Insgesamt ist dies ein niedriger Durchsatz-System, die sehr detaillierte Echtzeit-Informationen auf das Wachstum von Biofilm Pilzarten unter Strom liefern kann.
Einleitung
Candida albicans (C. Albicans) ist eine opportunistische pilzliche Erreger von Menschen, die viele Gewebetypen, einschließlich mündliche Schleimhaut-Oberflächen, wodurch oropharyngealen Candidose und daraus resultierende in eine geringere Lebensqualität für die betroffenen Personen1infizieren können. Biofilmbildung ist ein wichtiges Merkmal für die Pathogenese von C. Albicans, und zahlreiche Studien haben auf die Bildung und Funktion von C. Albicans Biofilme2,3,4getan wurde, 5, viele davon wurden durchgeführt mit statisch (keine Strömung) in-vitro- Modelle. Allerdings müssen C. Albicans halten und wachsen in Gegenwart von Speichel fließen in die Mundhöhle. Zahlreiche Flow-Systeme wurden entwickelt, um für live Cell imaging6,7,8,9,10ermöglichen. Diese verschiedenen Flow-Anlagen sind für verschiedene Zwecke konzipiert und daher jedes System hat unterschiedliche Stärken und Schwächen. Wir fanden, dass viele der Strömung, die Systeme für C. Albicans angemessen waren kostspielig, erforderliche Anlage fabriziert Teile, oder könnte nicht abgebildet im Fluss und vor Bildgebung gestoppt werden musste. Daher entwickelten wir eine neuartige Strömung Apparat um C. Albicans Biofilmbildung unter Fluss11zu studieren. Bei der Konzeption unserer Flow-Apparate folgten wir dieser wichtigen Überlegungen. Erstens wollten wir mehrere Aspekte der Biofilm Wachstum und Entwicklung in quantifizieren zu können ohne die Verwendung von fluoreszierenden Zellen (so dass uns Studie mutierte Stämme und unveränderten klinischen Isolaten leicht) in Echtzeit. Zweitens wollten wir alle Teile mit wenig bis keine Änderungen im Handel erhältlich sein (zB., keine eigene Fertigung), andere mehr einfach unser System neu und für einfache Reparaturen. Drittens: Wir wollten auch ermöglichen längere Zeiten bei relativ hohen Flussraten imaging. Schließlich wollten wir, nach einer Phase der Zellen, die Befestigung auf dem Untergrund durch fließen, der Biofilm-Wachstum über einen längeren Zeitraum ohne Einführung neue Zellen überwachen zu können.
Diese Überlegungen führten uns zu zwei Kolben rezirkulierenden Flow-System in Abbildung 1dargestellt. Die zwei Kolben ermöglichen es uns, das Experiment in zwei Phasen, eine Anlage-Phase, die aus der Zelle ausgesät Anlage Flasche zieht und eine Wachstumsphase, die zellfreien Medien nutzt, um den Biofilm wachsen ohne den Zusatz von neuen Zellen aufgeteilt. Dieses System dient zur Arbeit mit einer Inkubation Kammer für das Mikroskop mit der Folie und der Schlauch davor (2 bis 5, Abbildung 1) in die brutmaschine gelegt und alle anderen Komponenten in einem großen sekundären Behälter außerhalb der Mikroskop. Darüber hinaus eine Herdplatte Rührer mit einem angeschlossenen Temperaturfühler verwendet wird, um Pilzzellen in der Anlage Kolben bei 37 ° c zu halten Wie es Rezirkulation ist, dieses System ist in der Lage, kontinuierliche Bildgebung während Flow (kann über 36 h je nach Bedingungen), und auf die gängigen Mikroskope, einschließlich aufrecht oder invertierte Benchtop Mikroskopen verwendet werden kann. Hier diskutieren wir die Montage, Betrieb, und Reinigung des Apparates fließen, sowie als bieten einige grundlegende ImageJ quantitativen Algorithmen, die Videos nach einem Experiment zu analysieren.
Protokoll
1. Montieren Sie den Flow-Apparat
- Konfigurieren Sie die Teile mit den unten beschriebenen Überlegungen in die Tabelle der Materialien gemäß dem Schaltplan in Abbildung 1 aufgeführt.
Hinweis: der Einfachheit halber der Fluss Apparat gliedert sich in zwei Seiten, die grüne Seite (alles oberhalb der Folie in die Medien-Fläschchen) und die Orange Seite (alles unterhalb der Folie in die Medien-Fläschchen).- Sicherstellen Sie, dass alle Fluss-Apparat ist luftdicht, Lecks, mit Ausnahme der Medien-Fläschchen (Abbildung 1, 1) zu verhindern. Um dies zu erreichen, gelten Sie Klempner Band für alle männlichen Gewinde vor dem Zusammenbau mit Ausnahme der Pulsation Dämpfer (PD) und 2 µm-Filter-Flasche (FB), die keinen Klempner Band benötigen, wie die Gummidichtungen sie luftdicht halten.
- Ohr Klemmen an jeden Stacheldraht Armatur, die unter Überdruck während des normalen Betriebs gelten (d.h., hinter der Pumpe).
- Verwendung farbcodierte Lab Bänder kennzeichnen die Ventil-Standorte mit einem A oder G (für die Befestigung und Wachstum, bzw.), den Standort der Pumpe, die Folie Verbindung Standorte und 0,2 µm-Filter-Verbindung.
- Bestimmen Sie die Länge der Schläuche verwendet werden basierend auf dem Abstand zwischen dem Flow-System und Mikroskop, unter Berücksichtigung, die den Fluss Apparat flussabwärts der Pumpe auf den Kolben (Großteil der orange Seite) der Auffangeinrichtungen sein sollten. Fügen Sie ca. 1 m zusätzliche Schlauch oberhalb der Folie (und vorzugsweise die Blase Falle), innerhalb der Mikroskop Inkubation Kammer zu platzieren, wie dies gewährleistet, dass alle Medien erreichen die Folie bei der korrekten Temperatur werden.
- Ort der Blase Falle so nah wie möglich auf die Folie, vorzugsweise in der Inkubation Kammer während eines Experiments (Luftblasen oft Form entlang der Schlauch Wand); Denken Sie jedoch daran, dass es sein muss angeschlossen, ein Vakuum zu bedienen.
- Sicherstellen Sie, dass der Schlauch zwischen der FB und 0,2 µm Einweg-Filter ca. 0,5 m lang ist.
- Fügen Sie einen ca. 2 cm magnetische rühren Bar in jeder Medien-Kolben.
- Erhalten Sie irgendeine Form von Schläuche Schellen als Absperrventile fungieren (futterzange können verwendet werden).
- Halten Sie für Benutzerfreundlichkeit den Fluss-Apparat in einer Korb autoklavierbar. Es kann hilfreich sein, einen zweiten kleineren Korb in einer großen erlauben einfache Trennung von der grün und orange Seite sein.
- Bohren Sie für die Anlage-Kolben, mit einem 4 mm Bohrer ein zusätzliches Loch in den Gummistopfen, Temperaturfühler (Vorsicht nicht zu gehen durch ein weiteres Loch) unterzubringen. Um den Schlauch über die Ports zu erhalten, schieben Sie den Schlauch durch mit einer Pinzette; Spannen Sie einmal durch, den Schlauch um Platz, und dann ziehen Sie die Pinzette wieder heraus zu halten.
Hinweis: Wenn es nicht möglich, die extra-Loch den Gummistopfen hinzuzufügen ist, funktionieren eine breit-Mund Schraube Flasche mit einem 4-Port-Schraubverschluss anstelle der Kolben und Rubber Stopper.
- Sobald die Flow-System komplett montiert wurden, schließen Sie die Ventile der beiden grün und orange Seite Wachstum Fläschchen. Verwenden Sie Wasser mit der Anlage Kolben Schlauch und ein Messzylinder die Peristaltische Pumpe entsprechend den Anweisungen des Herstellers zu kalibrieren.
2. führen Sie ein Experiment
- Am Vortag das Experiment beginnen, die Mikroskop Inkubation Kammer auf 37 ° C vorheizen und bereiten eine Übernachtung Kultur eine pilzartige Sorte (Fluoreszenz ist nicht erforderlich).
- Sammeln Sie Einweg-Komponenten und Pumpe zu, und in eine sterile Biosafety Kabinett.
- Entfernen Sie die Blase-Falle und die Temperatur Sonde aus dem Fluss Gerät und legen Sie diese in das Biosafety-Kabinett.
- Entwirren Sie und organisieren Sie die Schläuche zu, wenn nötig.
- Autoklaven der Fluss Apparat, darunter rühren Bars, für 30 min um Sterilität zu gewährleisten; Wenn Sie fertig sind, übertragen Sie auf die Biosicherheit Kabinett.
- Legen Sie die Blase Falle, Temperaturfühler und alle Einweg-Komponenten (außer der Folie), wie in Abbildung 1dargestellt.
- Entfernen Sie für den 0,2 µm-Filter (Abbildung 1, 11) den Kolben von 1 mL Spritze zu machen, als einen "Adapter". Erzwingen Sie die Schläuche aus der FB in diesem Zweck, und befestigen Sie die 0,2 µm-Filter auf das Rohr in den Kolben Wachstum führt.
- Fetten Sie Silikon Vakuum um die Widerhaken an den Diahalter (Vorsicht nicht zu Fett auf der Innenseite ein) vor dem Anschluss, da dieser verhindert Undichtigkeiten in das System.
- Füllen Sie die Anlage-Flasche mit 100 mL 1 % (w/V) Hefeextrakt, 2 % (w/V) Pepton und 2 % (w/V) Glukose (YPD), und füllen Sie die Wachstums-Flasche mit 200 mL YPD. Stellen Sie sicher, dass die grüne Seite-Schläuche des Mediums in jedem Kolben erreicht.
- Stellen Sie sicher, dass alle Ventile geöffnet sind. Ein Vakuum die Blase Falle beimessen, und die Pumpe an der grünen Seite Schlauch anschließen stromabwärts der Blase Überfüllung.
- Pumpen Sie die Flüssigkeit mit einer Durchflussrate von 3,3 mL/min vollständig füllen die grüne Seite, dann zu verzichten und etwa 1 – 2 mL des Mediums zu verwerfen, da die ersten paar Milliliter oft abgestorbene Zellen oder zufällige Verunreinigungen enthalten. Stellen Sie sicher, dass die grüne Seite des Rohrs mit Medien gefüllt ist und keine Luftblasen unterhalb der Blase Überfüllung, bevor Sie fortfahren hat.
- YPD, kümmert sich nicht um Luftblasen einzuführen füllen Sie die Kanal-Folie und der Behälter ein.
- Verbinden Sie der Folie mit der Strömung Apparat und die Pumpe mehr Flüssigkeit um einen Puffer von ca. 0,5 m auf der orange Seite zu erstellen. Dies soll versehentlich Trapping Luft in der Folie bei Rückfluss zu verhindern.
- Bereiten Sie den Fluss-Apparat für den Transport an das Mikroskop: Klemme geschlossen den Einlass und Auslass der Blase Falle und Klemme das Grün und Orange Seite Anlage Kolben Ventile geschlossen. Sicherstellen Sie, dass die Schraubverschlüsse für die PD und FB dicht sind, wie sie beim Autoklavieren lockern können.
- Trennen Sie die Pumpe vom Schlauch zum Transport zu erleichtern. Verschieben Sie dann alle Komponenten, einschließlich des Kochplatte Rührers in einen sekundären Behälter in der Nähe des Mikroskops.
- Bereiten Sie den Fluss-Apparat für die Bildgebung.
- Legen Sie den Temperaturfühler auf der Herdplatte Rührer und beginnen Sie, Heizung der Anlage Küvette auf 37 ° C. Rühren Sie die Medien bei 300 u/min und halten Sie dies für das ganze Experiment.
- Montieren Sie die Folie auf das Mikroskop, und verwenden Sie Band bei Bedarf fest zu sichern.
- Befestigen Sie die Blase Falle ein Vakuum (nicht rückgängig gemacht werden die Klammer noch).
- Verbinden Sie die Pumpe auf den Fluss-Apparat an der Stelle, die auf Abbildung 1angegeben.
- Starten Sie die Pumpe mit einer Durchflussrate von 3,3 mL/min, für ca. 5 – 10 s laufen lassen Sie, und entfernen Sie dann die Blase Falle Einlass/Auslass-Klemme.
- Lassen Sie die Pumpe weiter laufen, während die Anlage Flasche sich erwärmt. Nach Medien im gesamten System der Strömung in Umlauf gebracht hat, für den normalen Betrieb zu überprüfen.
- Überprüfen Sie Armaturen für Luft, die der Pumpe (einige Blasenbildung ist normal) oder Flüssigkeit austreten flussabwärts flussaufwärts.
- Prüfen Sie, ob das Wachstum Medien Kolben, PD und FB alle Tropfen Medien aus dem Schlauch sind (wenn nicht, dies ein verstopfter Filter oder eine überdreht Ohr Klemme hindeuten könnte).
- Überprüfen Sie das Mikroskop für angehängte oder rollenden Zellen auf der Kanal-Folie. Eine übermäßige Anzahl von Zellen möglicherweise Kontamination während des Setups, oder müsste ausgetauscht werden, dass die Polytetrafluorethylen (PTFE) Membran der Blase fangen.
- Sobald die Anlage Kolben und Inkubation Kammer sind beide bei 37 ° C, fügen Sie genug über Nacht Kultur von der Pilzzellen in den Anlage-Kolben, 1 x 106 Zellen/mL zu erreichen.
Hinweis: Die Lautstärke in µL hinzufügen kann mit dieser Formel berechnet werden: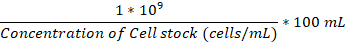
- Warten Sie 15 min um die Zellen zu akklimatisieren können.
- Öffnen Sie beide grün und orange Seite Anlage Kolben Ventile beim Schließen beide Wachstum Kolben Ventile um den Fluss der Zellen zu starten.
- Warten Sie etwa 5 min damit Zellen die Folie zu erreichen, und für die anfängliche Fokussierung des Mikroskops (diesmal müssen angepasst werden, abhängig von der Länge des Schlauches grüne Seite) zu ermöglichen. Während dieser Zeit stellen Sie das Mikroskop auf die gleichen bildgebenden Parameter, die in bisherigen Experimenten verwendet. Wenn dies der erste Lauf ist, gehen Sie folgendermaßen vor:
- Wechseln Sie zu einer niedrigen Vergrößerung Luft Objektiv.
- Finden Sie und konzentrieren Sie sich auf eine angehängte oder kleine angehende Zellen.
- Kondensator für Köhler Beleuchtung zu konfigurieren und dann zu Dunkelfeld wechseln.
- Legen Sie die Belichtungszeit auf 300 ms.
- Die leuchtenden Intensität, bis eine kleine Zelle ist noch deutlich sichtbar vom Hintergrund (ein Signal an Hintergrund-Verhältnis von ca. 7 – 8 für eine angehende tochterzelle ist ein brauchbarer Wert) dimmen. Endnotenzeichen Sie Fuß-/die leuchtende Intensität für zukünftige Experimente.
- Konfigurieren Sie die Software, um ein Bild alle 2 min über 2 h zu erwerben.
- Beginnen Sie Bilderfassung für die Anlage-Phase. Überprüfen Sie zurück nach ca. 5 und 10 min um sicherzustellen, dass Fokus wurde beibehalten. Wenn dies nicht der Fall ist, versuchen, passen die Fokussierung sofort, nachdem das nächste Bild abgerufen wurde.
- Unmittelbar nach die Anlage-Phase beendet ist, speichern Sie die Datei, und öffnen Sie dann beide grün und orange Seite Wachstum Kolben Ventile beim Schließen beide Anlage Kolben Ventile. Achten Sie darauf, nicht die Bühne stoßen, wenn alle Ventile in der Inkubation Kammer sind.
- Trennen Sie die Thermometer-Sonde von der Herdplatte Rührer.
- Entfernen des Anlage Kolbens von der Herdplatte Rührer und Wachstum Kolben an seinem Platz.
- Konfigurieren Sie die Software erwerben ein Bild alle 15 min über 22 h und Bilderfassung für die Wachstumsphase zu beginnen. Scharfstellens sollte nicht notwendig sein, aber es wird dringend empfohlen, den Fluss Apparat nach ein paar Stunden zu überprüfen.
- Überprüfen Sie Armaturen für Luft, die der Pumpe (wieder einige Blasenbildung ist normal) oder Flüssigkeit austreten flussabwärts flussaufwärts
- Überprüfen Sie, ob das Wachstum Medien Kolben, PD und FB alle sind tropft Medien (wenn nicht, dies könnte eine verstopfte Filter, eine überdreht Ohr Klemme oder eine Verstopfung an einem Stacheldraht passend, wenn die Zellen verklumpen).
- Überprüfen Sie den Flüssigkeitsstand in der FB. Wenn die Medien den oberen Teil der Flasche (mehr als 1,5 cm über die Oberkante des Filters) nähert, ziehen Sie beide Schraubverschluss (nicht, lösen da dieser Flasche unter Druck steht). Wenn sie nicht weiter anziehen werden, weiter das Experiment (obwohl dies zu einer Leckage führen kann), und ersetzen Sie die Gummidichtungen an der PD und FB nach der nächsten Reinigung.
- Wenn die Wachstums-Phase-Übernahme abgeschlossen ist, speichern Sie die Datei, und öffnen Sie dann die grüne und orange Seite Anlage Kolben Ventile, die Lärm machen können, wie der Druck auf die orange Seite veröffentlicht. Ziehen Sie die grüne Seite Schläuche kommen aus beiden Medien-Kolben, bis sie mindestens ein paar Zentimeter über die Medien sind. Führen Sie die Pumpe mit hoher Geschwindigkeit (ca. 100 mL/min oder Halt der schnellgangtaste an der Pumpe) um alle Medien aus den Schlauch zu entfernen, die macht die Reinigung einfacher. Wenn geleert, trennen Sie den Fluss Apparat von der Pumpe und entfernen Sie es vom Mikroskop.
3. Reinigen Sie den Flow-Apparat
- Entfernen Sie alle nicht autoklavierbar Komponenten (Einzelnutzung Komponenten, Bubble Trap und Temperaturfühler) und Autoklaven der Fluss Apparat für 30 min. Ablagestapel verwendet Einweg-Komponenten, saubere Sonde mit 70 % Ethanol und Blase Falle beiseite stellen.
- Nach dem Autoklavieren beendet ist, Medien, zu verwerfen und spülen und Medien Fläschchen beiseite. Dann schließen Sie die Blase Falle, verbinden Sie eine Ibidi-Kanal-Folie verwendet werden, für die Reinigung (wiederverwendbar), und verbinden Sie die Flow-System an der Pumpe an der Stelle, die in Abbildung 1dargestellt.
- Klemme geschlossen die orange Seite Wachstum Kolben Ventil.
- Legen Sie etwa 200 mL unverdünntes Bleichmittel in einen Becher füllen. Legen Sie die Gummistopfen in das Bleichmittel, und starten Sie die Pumpe mit hoher Geschwindigkeit Bleichmittel in den Fluss-Apparat (außer alle Filter) in Umlauf. Sobald mit Bleichmittel gefüllt, stoppen Sie die Pumpe verlassen, weil die Pumpe auf mit hoher Geschwindigkeit kann tragen und den Schlauch zu brechen.
- Nach dem Bleichen für 15 min halten Sie die Gummistopper über den Becher und starten Sie die Pumpe wieder um das Bleichmittel aus dem Fluss-Gerät zu entfernen.
- Wiederholen Sie die Schritte 3.4 und 3.5 zweimal mit zuviel Wasser anstelle von Bleichmittel, die Flow-System zu spülen. Während dieser Zeit reinigen Sie die Filter nur mit Wasser, weil andere Reinigungsmittel werden korrodieren oder die Filter verstopfen.
- Legen Sie die Schläuche, die normalerweise mit den 0,2 µm Medienfilter (aus 2 µm FB) in das Becherglas Wasser mit dem Gummistopfen aus Schritt 3.6 verbinden würde.
- Trennen Sie den Schlauch angebracht um den Einlass von 20 µm Inline-Filter, der in der Regel mit Leichtigkeit trotz der Ohr-Klemme auseinander gezogen werden kann.
- Verwenden Sie ein Vakuumfilter Fläschchen und einen langen Abschnitt der Schlauch durch eine freie 3-Loch stopfen ein Vakuum-Systems zu erstellen, das an dem Fluss-Gerät eine Verbindung herstellen können.
- Verbinden Sie dieses Vakuum-System zu, um den Einlass von 20 µm Filter Einlauf, und starten Sie das Vakuum; Dies wird Wasser durch den Filter in umgekehrter Richtung, entfernen abgestorbene Zellen ziehen.
- Ziehen Sie mindestens 200 mL Wasser durch den Filter, dann entfernen Sie den Schlauch aus dem Wasser, die Filter-Linien von Wasser zu entleeren.
- Trennen Sie Vakuum-System von 20 µm Filter und schließen Sie den Filter, um ihre normale Schläuche.
(4) Quantifizierung der Videos
Hinweis: Alle Dateien müssen in den Tag (TIF) Bilddateiformat Arbeit umgewandelt werden. Zusätzlich, um zwischen Experimente zu vergleichen, ist es wichtig, dass alle Bilder mit dem gleichen Mikroskop und bildgebenden Parameter getroffen werden, wie oben beschrieben.
- Downloaden Sie und installieren Sie ImageJ, falls nicht bereits installiert.
- Herunterladen Sie die zusätzliche Makrodatei, und legen Sie sie im Ordner "ImageJ\macros".
- Passen Sie die zur Verfügung gestellten Makro:
- Öffnen Sie ein Bildstapel aus einem früheren Experiment in ImageJ, und wählen Sie einen Zeitpunkt mit Zellen vorhanden.
- Wählen Sie aus dem Menü über "Bild | Typ | 8-Bit".
- Wählen Sie aus dem Menü über "Bild | Anpassen | Schwelle". Das Kontrollkästchen Sie "Dark Background" . Setzen Sie das Dropdown-Menü rechts auf rot.
- Passen Sie den niedrigeren beizulegenden Wert, bis alle Zellen in rot mit minimalen übermäßig laut bedeckt sind (einige nicht-Zelle Sprenkeln ist okay und verarbeitet werden durch das Makro). Notieren Sie sich diesen niedrigeren Wert.
- Schließen Sie den Schwellenwert-Fenster und das geöffnete Bild.
- Wählen Sie aus dem Menü über "Plugins | Makros | Bearbeiten". Wenn Sie aufgefordert werden, eine Datei zu öffnen: "move up eine Ordnerebene", dann wählen Sie den Ordner Makros und der Flow Biofilm Quantifizierung Makro-Datei zu öffnen.
- Ändern Sie die 15 Wert in allen Instanzen des "SetThreshold (15, 255);" auf 4.3.4 Schritt ermittelte Wert. Speichern Sie die Datei und schließen Sie dieses Fenster.
- Wählen Sie aus dem Menü über "Plugins | Makros | Installieren"und wählen Sie die Flow-Biofilm-Quantifizierung-Datei.
- Nun, unter dem "Plugins | Makros" Menü, sechs neue Optionen für verschiedene video Quantifizierungen angezeigt. Führen Sie die vollständige Analyse aus und wählen Sie die Anlage und das Wachstum Videodateien wenn aufgefordert, alle verfügbaren Analysen auf die erfassten Daten und Output-Dateien automatisch zu generieren.
Ergebnisse
Repräsentative Bilder eines normalen Übernachtung Zeitraffer Experiment mit Wildtyp C. Albicans Zellen bei 37 ° C in Abbildung 2A und ergänzenden Video 1gesehen werden. Die Bilder wurden Kontrast verbessert, um die Sichtbarkeit zu verbessern. Quantifizierung der Originaldaten wurde durchgeführt und repräsentative Grafiken sehen in Abbildung 2B. Um diese Diagramme zu erzeugen, wurden die Daten zuerst auf die imaging-Bereich (d.h., dividiert durch die gesamte imaging-Bereich) normalisiert, und die Ablösung wurde auf die Biomasse weiter normalisiert, wie oben beschrieben. Darüber hinaus zeigen die Anlage und das Ablösen der kumulierten Werte über Zeit, anstatt die einzelnen Frame-Werte durch den Fluss Biofilm Quantifizierung Makro erzeugt. Sobald die Grafiken dieses Stadium erreicht haben, können statistische Vergleiche durch Regressionsanalysen durchgeführt werden.

Abbildung 1 : Schaltplan des zweiphasigen rezirkulierenden Fluss Apparates. Schwarzen Verbindungslinien zeigen Schläuche und Pfeilspitzen geben die Richtung der Strömung während des normalen Betriebs. (A) A allgemeine schematische Übersicht über die Flow-System dargestellt. Der Einfachheit halber die Flow-System gliedert sich in eine grüne Seite (vor der Folie) und eine orange Seite (hinter der Folie). Fett formatierten Zahlen entsprechen in der Tabelle Materialien aufgeführten Teile. Etiketten für Ventile markieren Sie einfach für Schläuche Schellen oder futterzange während der Experimente platziert werden. Filterreihenfolge lautet wie folgt: 8 – 20 µm Inline-Filter, 9 – 10 µm Inline-Filter, 10 – 2 µm-Filter-Flasche (FB) und 11 – 0,22 µm Einweg Einweg-Filter. Schaltplan ist nicht maßstabsgetreu. (B) eine Nahaufnahme von den Gummistopfen für die Anlage-Kolben, illustrieren die vier Komponenten, die die Ports durchlaufen: Medieneinrichtung, die 0,2 µm-Luftfilter, der Gasaustausch ermöglicht es, den Temperaturfühler (erfordert ein zusätzliches Loch bohren), und die Medien zurück. (C) eine Nahaufnahme der Pulsation Dämpfer (PD) sowie die FB und die Schraubkappe Versammlung für jeden Port verwendet. Diese Flaschen müssen luftdicht zu funktionieren. Der Auslass-Schlauch für die PD sollte erreichen tiefer in die Flasche als der Zulauf Schlauch für reibungslose Funktionieren. Das graue Rechteck in der FB stellt die Stahl Filter dar. Bitte klicken Sie hier für eine größere Version dieser Figur.

Abbildung 2: Candida Albicans Wildtyp Zellen gewachsen unter Durchfluss bei 37 ° c (A) Vertreter Dunkelfeld Mikroskopie Bilder mikrokolonien, die unter Durchfluss bei 37 ° C zu den angegebenen Zeitpunkten zu bilden. Maßstabsleiste = 100 µm. (B) repräsentative Quantifizierung Bilddaten. Die Gesamtbiomasse innerhalb der bildgebenden Region (bestimmt durch Densitometrie Analyse), die kumulative Rate der Zellhaftung und Prozent Biomasse Loslösung (Ablösung Rate normiert auf die Biomasse) im Laufe der Zeit sind für jede Belastung gezeigt. Daten sind Mittel von n ≥ 3 Experimente. Bitte klicken Sie hier für eine größere Version dieser Figur.
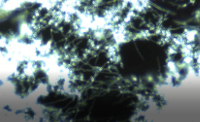
Ergänzende Video 1. Candida albicans Wildtyp Zellen gewachsen unter Durchfluss bei 37 ° c Dieses Zeitraffer Dunkelfeld Mikroskopie video zeigt die Befestigung der WT Zellen auf das Substrat in der Anlage-Phase (Zeitangabe in der oberen linken Ecke, Bilder erwarb alle 2 min), gefolgt von der anschließende Wachstum und Entwicklung während der Wachstumsphase (ab 2 h; Bilder erwarb alle 15 min). Zelle ausgesät Medien (1 x 106) dienten in der Phase der Anlage während zellfreien Medien während der Wachstumsphase verwendet wurden. Flow ist von rechts nach links. Maßstabsleiste = 50 µm. Bitte klicken Sie hier um dieses Video anzuzeigen. (Rechtsklick zum download)
Diskussion
Mit Hilfe der Flow-System ermöglicht wie oben beschrieben für die Generation der quantitativen Zeitraffer-Videos von Pilz Biofilm Wachstum und Entwicklung. Um Vergleiche zwischen Experimente zu ermöglichen ist es von entscheidender Bedeutung, um sicherzustellen, dass die bildgebenden Parameter gleich gehalten werden. Dazu gehört, dass das Mikroskop für Köhler Beleuchtung für jedes Experiment eingerichtet ist, (viele Guides sind online verfügbar für diesen Prozess). Abgesehen von imaging-Parameter, gibt es einige wichtige Schritte im Auge zu behalten, beim Arbeiten mit dem Gerät fließen. Erstens ist es wichtig sicherzustellen, dass die Blase Falle unter Vakuum während Flüssigkeitsströmung, beibehalten wird, denn Nichtbeachtung führt zu Luft durch die Blase Falle gezogen wird. Ebenso, wenn die Blase Falle nicht unter Vakuum (d. h., beim Transport der Flow-Apparat) müssen den Einlass und Auslass eingespannten geschlossen bleiben; Ansonsten wird Luft durch die PTFE-Membran eindringen. Diese Klemme muss nicht entfernt werden, bis die Blase Falle wieder unter Vakuum gesetzt wird. Zu guter Letzt ist es sehr wichtig, Ihren Fluss Apparat für potenzielle Clogs oder undichte Stellen zu überwachen. Der effizienteste Weg für Clogs in Ihrem System zu überprüfen ist zu überprüfen, dass es tropft von den Einlässen der Anlage oder Wachstum Kolben, die PD und die FB Medien. Die Medien daraus sollte relativ ähnlichen Preisen tropft sein, wenn alles reibungslos funktioniert. Wenn eine Verstopfung vorliegt, können Sie in der Regel bestimmen Sie den Speicherort als den Schlauch nur vorgeschaltet die Verstopfung wird härter werden.
Sobald die Daten erhalten haben, bieten wir zahlreiche ImageJ-Makros, die die Videos quantitate. Diese Makros bestimmen mehrere Parameter des Biofilm Wachstum und Entwicklung, einschließlich ein Maß für die Biomasse und die Rate, die Zellen anfügen und trennen von der Oberfläche oder Biofilm. Nachfolgend finden Sie Beschreibungen der bereitgestellten Makros.
Vollständige Analyse führt alle unten aufgeführten Analysen und gibt automatisch die Daten. Dieses Makro kann ohne eine offene Bilddatei ausgeführt werden, während alle anderen eine offenen Video erfordern. Bei der Ausführung, fordert es den Benutzer einen Stapel Anlagendatei, dann ein Wachstum-Stapel-Datei zu öffnen. Im Anschluss daran wird es automatisch die Bilder analysieren und Ausgang einen Datenordner, die Datentabellen enthalten, wie unten beschrieben in den gleichen Ordner wie die Anlage-Image-Datei. Die Anlage Zähler -Makro wird nur für die Anlagendatei durchgeführt; andere Analysen werden in einem verketteten Stack mit der Anlage und des Wachstums Dateien durchgeführt. Die Ausgabedaten erzeugte Dateien sind Textdateien, sollte jedoch importiert excel für Benutzerfreundlichkeit.
Die Summe Intensität Analyse analysiert jedes Bild des aktiven Fensters. Es summiert sich alle grauen Werte für jedes Pixel, die über den unteren Schwellenwert in Schritt 4.3.7 bezeichnet ist, und gibt einen kumulativen Wert pro Frame. Generierten Werte sind proportional zu der Biomasse in den Rahmen, bis jede Kamera Sättigung, das auftritt. Die Daten sollten dann auf den Bereich der bildgebenden Region normalisiert werden; Dies wird durch das Makro nicht ausgeführt.
Die Versorgungsgebiet Analyse analysiert jedes Bild des aktiven Fensters für den Bereich des Rahmens, die als Prozentsatz von Zellen (über dem unteren Grenzwert) abgedeckt ist.
Die Anlage Zähler wird Rahmen Subtraktion verwenden, um die Intensität der Summe aller Zellen zu bestimmen, die zwischen den Einzelbildern zu befestigen. So ist der erste Datenpunkt der Biomasse der Zellen, die zwischen den Bildern 1 und 2 legen; der zweiten Datenpunkt ist die Biomasse der verbundenen Zellen zwischen den Bildern 2 und 3, usw.. Diese Daten sollten im Bereich der bildgebenden Region normalisiert werden. Lesbarkeit ist es auch hilfreich sein, diesen Wert vor grafische Darstellung zu integrieren.
Die Ablösung Zähler funktioniert genauso wie die Anlage Zähler, sondern kehrt die Frame-Subtraktion, so dass es bestimmt die Intensität der Summe der Zellen, die zwischen den Einzelbildern zu lösen. Diese Daten sollten auch auf dem Gebiet der bildgebenden Region normalisiert und vor Grafik integriert. Vor der Integration können diese Daten auf die Gesamtsumme Intensität des vorhergehenden Frames berechnet in der Summe Intensität Analyse weiter normalisiert werden. Dieser neue Wert entspricht den Anteil der Zellen, die von den Biofilm zu diesem Zeitpunkt zu lösen, die oft mehr wertvolle Daten, da die Biomasse der lösen werden Zellen mit wachsenden Biofilm Biomasse zu erhöhen.
Während die Flow-System hier vorgestellten komplizierter ist zu bauen und zu betreiben als andere Fluss-Systeme, bietet sie einige Vorteile. Viele dieser Vorteile ergeben sich aus unserer Verwendung einer handelsüblichen Kanal-Folie. Die Gewebekultur Behandlungsmöglichkeiten für diese Folien genügt damit Candida Zellen an der Oberfläche zu halten. Darüber hinaus ermöglicht das Profil dieser Kanal-Folie wird ähnlich wie eine herkömmliche Folie problemlos auf eine Vielzahl von Mikroskopsysteme, einschließlich aufrechte Mikroskope mit Durchlicht bei geringer Vergrößerung verwendet werden. Mit dieser Art von Mikroskop erlaubte uns, Dunkelfeld-Mikroskopie, die Quantifizierung der Daten viel einfacher, vor allem im Vergleich zu Fluoreszenz-Mikroskopie (da gab es keine Immunofluoreszenz und niedrigen Phototoxizität) gemacht. Traditionelle Mikroskopie (ohne optische-Schnitt), ist konservativ, Bedeutung aus Fokus Zellen tragen ähnliche Zahlen von Photonen zu einem Bild im Fokus Zellen ähnlicher Größe12. Dies bedeutet, dass trotz unserer Ebene der Bildgebung, die 3D wachsende Biofilm noch während das Experiment quantifiziert wird ist, obwohl die höheren Regionen unscharf sind. Diese Single-Flugzeug-Bildgebung hat den Vorteil der Phototoxizität Schäden an den Zellen drastisch zu senken, aber keine Informationen über die 3D Architektur des Biofilms. Diese Flow-System kann jedoch auch mit fluoreszierenden Zellen und konfokale Mikroskope zu dieser Information13verwendet werden.
Die einzigartige zwei Kolben Umlaufkörper Einrichtung von unserem Fluss Apparat auch hat viele Vorteile. Erstens viele Fluss-Systeme erfordern, dass die Folien bereits mit Zellen ausgesät werden, aber unser Einsatz einer separaten Zelle ausgesät Anlage Flasche ermöglicht es uns, image und Zellen zu quantifizieren, da die Folie während unter Strömung werden eingehalten, und wir das Gefühl, dass dies ähnelt eher was geschieht < C0 > in-vivo. Darüber hinaus haben wir bisher unser Mikroskop für High-Speed-Bildgebung und Bild Adhäsion Veranstaltungen anpassen, wie sie in Echtzeit, im Gegensatz zu nach der Tatsache11zu quantifizieren. Zweitens, die einem zellfreien Wachstum-Kolben, der Heilmagnetismus und zellfreie über einen längeren Zeitraum erlaubt uns zu verstehen, wie Biofilme wachsen unter Strom für mehr als 24 Std. beibehalten werden kann, eine Dauer, die in der Regel mit nicht-Rezirkulation Systeme erreicht werden kann . Wir haben noch nicht bestimmt die Obergrenze der mal was mit unserer Flow-System erreicht werden kann, aber wir haben 36 h Experimente erfolgreich abgeschlossen; aber je länger das Experiment, desto größer ist die Wahrscheinlichkeit eines Lecks oder verstopfte Filter. Zahlreiche Faktoren beeinflussen die mögliche Dauer des Experiments, einschließlich die Wachstumsrate der Zellen, wie Kleber sind und der Grad der Hyphen Bildung, macht es schwierig, eine Obergrenze für die Dauer eines Experiments definieren. Jedoch können viel längere Laufzeiten gewünscht werden, als mit dem Flow-Gerät erreicht werden kann, wie dargestellt, der Filter mit einer Inline-Ultraviolett (UV) Sterilisation Box ersetzt werden wie zuvor beschrieben8wurde. Diese Sterilisation-Box kann auch dieser Fluss Apparat Bild Bakterien genutzt werden; Unsere bisherigen Versuche, Bild Bakterienstämme führte zu schnelle Verstopfung des Filters 0,2 µm. Letztendlich entschieden wir uns nicht um UV-Sterilisation zu übernehmen, da Feld Benutzerdefinierte ist hergestellt, und dies dazu führen würde, Rezirkulation von abgestorbenen Zellen.
Ein weiterer Vorteil dieser Fluss-Systems ist, dass es relativ günstig im Vergleich zu kommerziellen Systemen, vor allem, wenn Sie ein Mikroskop mit ihm kaufen müssen. In unserem Labor konnten wir eine grundlegende übertragene Licht Benchtop-Mikroskop zu kaufen und das gesamte Mikroskop in einer großen standard Konvektion brutmaschine zu platzieren. Die einzige wesentliche Voraussetzung ist, dass das Mikroskop eine Shutter-Funktion (mechanisch oder elektrisch) haben sollte, um Zeitraffer-Mikroskopie durchzuführen.
Während dieses System vielseitig ist und viele Vorteile bietet, ist es eine niedrige Durchsatz-Methode. Unser Flow-Apparat ist nicht in der Lage, mehrere Stämme im Gegensatz zu anderen verfügbaren Flow-Systeme parallel zu wachsen. Aufgrund der umfangreichen Vorbereitungen und Reinigungszeit können wir nur zwei Versuche pro Woche durchzuführen. Jedoch viele andere Flow-Anlagen sind ziemlich teuer und können verstopfen, wenn Candida -Zellen unter Hyphen bilden Bedingungen angebaut werden.
Darüber hinaus dieses Flow-System ist recht komplex, im Vergleich zu anderen, und kann schwierig sein, in Betrieb zu halten. Nach vielen Experimenten Filter zu verstopfen beginnen, Schlauch beginnt zu tragen dünn und Teile beginnen zu rosten oder locker werden; Daher erfordert diese Komponenten ersetzt werden. Die Verwendung von Filtern macht dieses System mit Wachstumsbedingungen von einigen pilzstämmen unvereinbar; vor allem wird alles, was Flockung induziert schnell 20 µm Inline-Filter verstopfen. Jedoch mit ausreichend Erfahrung im Umgang mit dem Flow-System, wird es einfacher, mögliche Probleme zu erkennen, bevor sie in ein misslungenes Experiment führen. Eine Sache, die getan werden, um den täglichen Betrieb des Geräts Strömung ein wenig einfacher zu bilden ist eine Nachbildung der Blase Überfüllung Gehäuse aus einem autoklavierbar Material (z.B. Aluminium oder Edelstahl), sodass Sie Autoklaven der Blase machen Maschinist haben fangen Sie mit dem Rest des Apparates fließen, da die PTFE-Membran und Adapter Komponenten der Blase Überfüllung autoklavierbar sind.
Abschließend stellt der zweiphasigen rezirkulierenden Fluss Apparat präsentiert hier ein einzigartiges Modell zu Bild und in-vitro- Biofilmbildung von Pilzen durch fließen und in Echtzeit zu quantifizieren. Während das System seine Grenzen hat, es ist sehr anpassungsfähig und funktioniert gut mit den meisten Mikroskopen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Die Autoren möchten Dr. Wade Sigurdson bestätigen für die Bereitstellung von wertvollen Beitrag bei der Gestaltung des Apparates fließen.
Materialien
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 micron in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 micron in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 micron inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
Referenzen
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten