Method Article
用两相循环流系统实时成像和定量真菌生物膜的研究
摘要
介绍了一种在水流下实时成像真菌生物膜形成的流动装置的组装、操作和清洗。我们还提供并讨论了用于获取图像的定量算法。
摘要
在口咽念珠菌病中,念珠菌属的成员必须坚持和生长在口腔粘膜表面, 而在唾液流动的影响下。虽然在流的增长模型已经开发, 许多这些系统是昂贵的, 或不允许成像, 而细胞在流动。我们开发了一种新的仪器, 使我们能够想象在流动和实时的白色念珠菌细胞的生长和发展。在这里, 我们详细介绍了该流程设备的组装和使用的协议, 以及所生成数据的量化。我们能够量化单元格附加到和从幻灯片中分离的速率, 以及确定随时间推移的幻灯片上生物量的测量值。该系统既经济又多功能, 与许多类型的光学显微镜, 包括廉价的台式显微镜, 并能延长成像时间相比, 其他流系统。总的来说, 这是一个低吞吐量的系统, 可以提供非常详细的实时信息的生物膜生长的真菌物种在流动。
引言
白色念珠菌(C. 白念珠菌) 是人类的一种机会性真菌病原体, 可感染多种组织类型, 包括口腔粘膜表面, 导致口咽念珠菌病, 并导致受影响的个人的生活质量降低1。生物膜的形成是影响白念珠菌发病的重要特征, 对白念珠菌生物膜的形成和功能进行了大量的研究2,3,4, 5, 其中许多已使用静态 (无流)体外模型进行。然而, 白念珠菌必须坚持和生长在唾液流在口腔中存在。许多流动系统已经开发, 以允许活细胞成像6,7,8,9,10。这些不同的流系统是为不同的目的而设计的, 因此每个系统都有不同的优点和缺点。我们发现, 许多适合C. 白念珠菌的流动系统成本高昂, 需要复杂的制造部件, 或者在流动过程中无法成像, 必须在成像之前停止。因此, 我们开发了一种新的流动装置来研究11流动下的白念珠菌生物膜形成。在我们的流量仪设计过程中, 我们遵循了这些主要考虑因素。首先, 我们希望能够实时量化生物膜生长和发展的多个方面, 而无需使用荧光细胞 (允许我们轻松研究突变菌株和未修改的临床分离株)。其次, 我们希望所有部件都能在商业上提供, 几乎没有任何修改 (i. e., 没有定制制造), 允许其他人更容易地重新创建我们的系统, 并允许轻松维修。第三, 我们还希望允许在相当高的流速率下延长成像时间。最后 , 我们希望 , 经过一段时间的细胞附着到基质动 , 能够监测生物膜生长在较长的时间 , 而不引入新的细胞。
这些考虑促使我们开发了图 1所示的双瓶循环流系统。两个烧瓶允许我们将实验分为两个阶段, 一个附着阶段, 从细胞种子附着烧瓶中吸取, 以及使用无细胞培养基继续生物膜生长的生长阶段, 而无需添加新细胞。该系统设计用于显微镜的孵育室, 其前面的滑块和油管 (2 到 5,图 1) 放置在孵化器内, 而所有其他组件放置在一个大型辅助容器外显微镜。此外, 带有附加温度探针的电炉搅拌器用于保持附着烧瓶中的真菌细胞37摄氏度。由于它是循环的, 这个系统能够连续成像在流动期间 (可以超过36小时取决于条件), 并可用于大多数标准显微镜, 包括直立或倒置台式显微镜。在这里, 我们讨论了流量设备的组装、操作和清洗, 并提供了一些基本的 ImageJ 定量算法来分析实验后的视频。
研究方案
1. 组装流量设备
- 根据图 1中的示意图配置材料表中列出的部件, 并考虑下面讨论的注意事项。
注意: 为方便起见, 流量设备分为两个侧面, 绿色侧 (所有的幻灯片的上游到培养基烧瓶), 橙色的一面 (所有的东西在幻灯片的下游到培养基烧瓶)。- 确保所有的流量设备都是气密的, 以防止泄漏, 除了介质烧瓶 (图 1, 1)。为了实现这一点, 除了脉动阻尼器 (PD) 和2µm 滤瓶 (FB) 外, 在组装前将水管胶带应用到任何螺纹上, 不需要水管胶带作为橡胶垫片使其密封。
- 在正常运行 (即泵的下游) 正压下的每一个带刺的接头上应用耳钳。
- 使用颜色编码的实验室磁带, 用 A 或 G (分别为附件和增长)、泵位置、滑动连接位置和0.2 µm 过滤器连接对阀门位置进行标注。
- 根据流量系统和显微镜之间的距离确定要使用的油管长度, 请记住, 泵到烧瓶下游的所有流量设备 (大部分为橙色侧) 应在二次密封中。增加大约1米的额外油管上游的幻灯片 (最好是气泡陷阱) 放置在显微镜孵育室, 因为这确保所有介质到达幻灯片将在正确的温度。
- 将气泡疏水阀尽可能靠近滑块, 最好是在实验期间的孵育室内 (气泡通常沿油管壁形成);然而, 请记住, 它必须连接到真空运行。
- 确保 FB 与0.2 µm 一次性过滤器之间的油管长度约为0.5 米。
- 将大约2厘米的磁力搅拌棒添加到每个介质瓶中。
- 获得某种形式的油管钳作为截止阀 (绑扎可以使用)。
- 为便于使用, 请将流量设备放在可高压灭菌的篮子中。它可以有帮助, 有一个更小的篮子在一个较大的, 使绿色的一面和橙色的一面容易分离。
- 对于附件烧瓶, 使用 4 mm 钻头, 在橡皮塞中钻一个额外的孔以容纳热探针 (注意不要穿过另一个孔)。要使油管穿过端口, 用镊子推油管;一旦通过, 夹紧油管保持到位, 然后拉镊子回来。
注: 如果无法将额外的孔添加到橡皮塞, 则使用四口螺钉盖的宽口螺钉瓶可以代替烧瓶和橡皮塞。
- 一旦流量系统完全组装好, 关闭绿色和橙色侧生长瓶的阀门。根据制造商的说明, 使用带有附件烧瓶管和分级气缸的水来校准蠕动泵。
2. 执行实验
- 实验前一天, 开始预加热显微镜孵育室至37摄氏度, 并准备一夜真菌菌株的培养 (不需要荧光)。
- 收集单一使用组件和泵, 并放置在一个无菌的生物安全柜。
- 从流动装置中取出气泡疏水阀和温度探头, 并将其放置在生物安全柜中。
- 如有必要, 梳理并组织油管。
- 高压釜的流动装置, 包括搅拌棒, 30 分钟确保无菌;完成后, 转移到生物安全柜。
- 如图 1所示, 连接气泡疏水阀、温度探头和所有单一使用组件 (幻灯片除外)。
- 对于0.2 µm 过滤器 (图 1、11), 从1毫升注射器中取出柱塞, 使其成为 "适配器"。强制从 FB 的管道到这一端, 并将0.2 µm 过滤器连接到通向生长瓶的油管上。
- 将硅胶真空润滑脂涂在滑动适配器的倒钩上 (注意不要在连接之前得到任何油脂), 因为这有助于防止空气泄漏到系统中。
- 用100毫升 1% (w/v) 酵母萃取物、2% (YPD) 蛋白胨和 2% (w/v) 葡萄糖 (YPD) 填充附着烧瓶, 并用200毫升, 填充生长烧瓶。确保绿色侧管到达每个烧瓶中的介质。
- 确保所有阀门均已打开。将气泡疏水阀附着到真空中, 然后将泵连接到气泡疏水阀下游的绿色侧管上。
- 以3.3 毫升/分钟的流速泵送液体, 以完全填充绿色侧, 然后分配和丢弃约为毫升的培养基, 因为前几毫升通常含有死细胞或随机碎屑。确保管道的绿色侧充满介质, 并在继续之前没有气泡陷井下游。
- 用 YPD 填充通道滑块和储层, 注意不要引入气泡。
- 将滑块连接到流设备, 然后泵出更多流体, 以创建橙色一侧约0.5 米的缓冲液。这是为了防止在发生回流时意外捕获幻灯片中的空气。
- 准备输送到显微镜的流动装置: 夹紧关闭气泡疏水阀的入口和出口, 并夹紧绿色和橙色侧附件烧瓶阀关闭。确保 PD 和 FB 的螺帽紧固, 因为它们可以在高压灭菌过程中松动。
- 断开泵与油管的连接, 使运输更容易。然后将所有组件 (包括加热炉搅拌器) 移动到显微镜附近的辅助容器中。
- 准备用于成像的流动装置。
- 将温度探头连接到电炉搅拌器, 并开始将附件烧瓶加热至37摄氏度。将介质搅拌 300 rpm, 并在整个实验中保持此。
- 将幻灯片安装在显微镜上, 必要时使用胶带将其紧紧固定。
- 将气泡疏水阀连接到真空 (不要撤消钳位)。
- 将泵连接到图 1所示位置的流量设备。
- 以3.3 毫升/分钟的流速启动泵, 允许它运行大约 5–10 s, 然后取下气泡疏水阀入口/出口钳。
- 当附件烧瓶升温时, 允许泵继续运行。一旦媒体在整个流程系统中循环, 检查正常操作。
- 检查泵上游空气泄漏的接头 (某些气泡形成正常), 或下游流体泄漏。
- 检查生长介质烧瓶、PD 和 FB 是否都是从入口管滴水的介质 (如果没有, 这可能表示过滤器堵塞, 或 overtightened 耳钳)。
- 使用显微镜检查通道滑块上的连接或滚动单元格。过量的细胞可能表示在设置过程中的污染, 或者气泡疏水阀的聚四氟乙烯 (PTFE) 膜需要更换。
- 一旦附着烧瓶和孵育室都在37摄氏度, 添加足够的夜间培养的真菌细胞到附着烧瓶达到 1 x 106细胞/毫升。
注意: 可以使用以下公式计算µL 中添加的卷: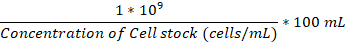
- 等待15分钟, 让细胞适应。
- 打开绿色和橙色侧附件烧瓶阀, 同时关闭两个生长瓶阀以启动细胞流动。
- 等待大约5分钟, 以允许细胞到达幻灯片, 并允许显微镜的初始对焦 (这一次可能需要根据绿色侧管的长度调整)。在此期间, 将显微镜调整为以前实验中使用的相同成像参数。如果这是第一次运行, 请按照下列步骤操作:
- 切换到低放大空气物镜。
- 查找并专注于附着的细胞或小的发芽细胞。
- 为科勒照明配置冷凝器, 然后切换到暗场。
- 将曝光时间设置为 300 ms。
- 调整照明强度, 直到一个小细胞暗淡, 但在背景清晰可见 (一个信号到背景比的7–8的一个萌芽的子细胞是一个合理的值)。注意/标记未来实验的照明强度。
- 将软件配置为每隔2小时2分钟获取一张图像。
- 开始连接阶段的图像采集。大约5和10分钟后再检查, 以确保保持焦点。如果没有, 则尝试在获取下一个图像后立即调整焦点。
- 在附着阶段完成后, 保存文件, 然后打开绿色和橙色侧生长瓶阀, 同时关闭两个附件烧瓶阀。如果在孵化室内有任何阀门, 请注意不要撞击舞台。
- 从电炉搅拌器拔下温度计探针。
- 从电炉搅拌器中取下附件烧瓶, 将生长瓶放在原位。
- 将软件配置为每隔15分钟采集一张图像22小时, 并开始对生长阶段进行图像采集。不需要重新对焦, 但强烈建议在几个小时后检查流量设备。
- 检查泵上游空气泄漏的接头 (再次出现气泡形成正常), 或下游流体泄漏
- 检查生长介质烧瓶、PD 和 FB 是否都是滴水介质 (如果没有的话, 这可能表明过滤器堵塞, overtightened 耳钳, 或在带刺的管件上堵塞, 如果使用的细胞絮凝)。
- 检查 FB 中的液位。如果媒体接近瓶子顶部 (超过1.5 厘米以上的过滤器顶部), 拧紧两个螺旋盖 (不要松开它们, 因为这个烧瓶是在压力下)。如果他们不会进一步收紧, 继续试验 (虽然这可能导致泄漏), 并更换在 PD 和 FB 的橡胶垫片下一次清洁后。
- 当生长阶段采集完成后, 保存文件, 然后打开绿色和橙色侧附件烧瓶阀, 可能会发出噪音作为在橙色一侧的压力释放。从两个培养基瓶中拉出绿色侧管, 直到它们至少在介质上方有几厘米。以高速运行泵 (约100毫升/分钟, 或按住泵上的快进按钮), 从油管中取出所有介质, 使清洗变得容易得多。清空时, 断开泵的流量装置, 并将其从显微镜中取出。
3. 清洁流动装置
- 卸下所有非高压灭菌组件 (单次使用组件、气泡疏水阀和温度探头), 并使用高压灭菌器30分钟. 弃用一次性组件, 用70% 乙醇清洁探针, 并预留气泡疏水阀。
- 高压灭菌完成后, 丢弃介质, 冲洗并放置培养基烧瓶。然后重新连接气泡疏水阀, 连接信息处理通道滑块用于清洁 (可重复使用), 并将流量系统连接到泵的位置, 如图 1所示。
- 夹紧关闭橙色侧生长瓶阀。
- 将约200毫升未稀释漂白剂放入烧杯中。将橡胶瓶塞放到漂白剂中, 然后以高速启动泵, 在整个流动装置中循环漂白 (除所有过滤器外)。一旦填充漂白剂, 停止泵, 因为离开泵在高速可以磨损和打破油管。
- 漂白15分钟后, 握住烧杯上方的橡胶瓶塞, 再次启动泵, 从流动装置中取出漂白剂。
- 重复步骤3.4 和3.5 两次用过量的水, 而不是漂白剂冲洗流系统。在此期间, 只有用水清洁过滤器, 因为其他清洁剂会腐蚀或堵塞过滤器。
- 将通常连接到0.2 µm 介质过滤器 (来自2µm FB) 到烧杯水中的油管与步骤3.6 中的橡胶瓶塞相连。
- 断开连接到20µm 直插式过滤器入口的油管, 尽管耳钳可以轻松地拆下。
- 通过一个备用的3孔塞子使用真空滤瓶和长段油管, 创建一个可连接到流量装置的真空系统。
- 将此真空系统连接到20µm 过滤器入口的入口, 然后开始真空;这将水通过过滤器在相反的方向, 去除死细胞。
- 通过过滤器拉出至少200毫升的水, 然后从水中取出油管, 清空滤水线。
- 断开真空系统与20µm 过滤器的连接, 然后将过滤器重新连接至正常油管。
4. 量化视频
注意: 所有文件都需要转换为标记图像文件 (TIF) 格式才能正常工作。此外, 为了比较实验, 重要的是所有的图像都采用相同的显微镜和成像参数, 如上文所述。
- 下载并安装 ImageJ 如果尚未安装。
- 下载补充宏文件, 并将其放在 ImageJ \ 宏文件夹中。
- 调整提供的宏:
- 从 ImageJ 中的上一个实验打开图像堆栈, 然后选择包含单元格的时间点。
- 从菜单中选择"图片 |类型 |8位 "。
- 从菜单中选择"图片 |调整 |阈值 "。检查"深色背景"框。将右侧下拉菜单设置为红色。
- 调整较低的值, 直到所有单元格都以红色覆盖, 且多余的噪声最小 (某些非单元格斑点是正常的, 将由宏处理)。记下此较低值。
- 关闭阈值窗口和打开的图像。
- 从菜单中选择"插件 |宏 |编辑 "。提示打开文件时: "上移一个文件夹级别", 然后选择 "宏" 文件夹并打开流生物膜量化宏文件。
- 将"setThreshold (15, 255) " 的所有实例中的15值更改为步骤4.3.4 中确定的值。保存文件并关闭此窗口。
- 从菜单中选择 "插件 |宏 |安装 "并选择流生物膜定量文件。
- 现在, 在"插件 |宏 "菜单, 六新选项的各种视频量化出现。运行完整的分析并选择附件和增长视频文件, 当系统提示您对获取的数据执行所有可用分析并自动生成输出文件时。
结果
在图 2a和补充视频 1中, 使用野生型白色白细胞在37摄氏度下进行正常过夜延时实验的代表性图像。图像经过对比增强, 可提高可见性。对原始数据进行量化, 在图 2B中可以看出代表性图。为了生成这些图, 数据首先归一化到成像区域 (即除以总成像面积), 分离进一步归一化为生物量, 如上所述。此外, 附件和剥离显示累积值随着时间的推移, 而不是由流生物膜量化宏生成的单个帧值。一旦图表达到这个阶段, 统计比较可以通过回归分析进行。

图 1: 两相循环流装置示意图.连接黑线表示油管, 箭头指示正常运行过程中的流向。(a) 说明了流动系统的一般示意图。为方便起见, 流系统分为绿色边 (滑块的上游) 和橙色边 (滑块的下游)。粗体数字对应于材料表中列出的零件。阀门标签只需标记在实验中放置油管夹或绑扎的位置。过滤器顺序如下: 8–20个µm 内联过滤器、9–10µm 内联过滤器、10–2µm 过滤瓶 (FB) 和11–0.22 µm 单使用一次性过滤器。原理图不是缩放。(B) 附件烧瓶的橡皮塞的特写视图, 说明通过端口的四个组件: 介质插座、允许气体交换的0.2 µm 空气滤清器、温度探头 (需要钻孔一个额外的孔) 和媒体返回。(C) 对脉动阻尼器 (PD) 和 FB 的特写视图, 以及每个端口使用的螺钉盖总成。这些瓶子需要气密才能起作用。PD 的出口油管应比进气管更深入到瓶子中, 以便正常工作。FB 中的灰色矩形表示钢过滤器。请点击这里查看这个数字的更大版本.

图 2: 在37摄氏度下生长的白色念珠菌野生型细胞.(A) 在所指明的时间点在37摄氏度下形成的独立王国的代表性暗场显微图像。比例尺 = 100 µm (B) 具有代表性的图像量化数据。在成像区域内的总生物量 (由密度测定法确定)、细胞附着的累积速率和生物量的百分比 (对生物量正常化的剥离率) 随时间而显示。数据是 n ≥3个实验的手段。请点击这里查看这个数字的更大版本.
补充视频 1.白色念珠菌野生型细胞生长在37摄氏度的流动下.这段延时暗场显微镜视频显示了在附着阶段 (在左上角显示的时间) 的 WT 细胞附着在基底上; 每2分钟采集的图像), 随后的生长和发展在生长阶段 (2 小时开始; 每15分钟采集的图像)。细胞种子培养基 (1 x 106) 在附着阶段使用, 而无细胞培养基在生长阶段使用。流是从右向左。缩放栏 = 50 µm.请点击这里查看视频。(右键单击可下载.
讨论
使用上述流程系统, 可以生成真菌生物膜生长和发育的定量延时视频。为了使实验进行比较, 必须确保成像参数保持不变, 这一点至关重要。这包括确保为每个实验设置科勒照明的显微镜 (许多参考线可在线进行此过程)。除了成像参数, 在使用流设备时还要牢记一些重要步骤。首先, 确保气泡疏水阀在流体流动过程中保持真空, 这一点很重要, 因为如果不这样做, 将导致空气通过气泡疏水阀被拉入。同样, 当气泡疏水阀不处于真空状态时 (即, 当输送流动装置时), 进气口和出水口必须保持箝位关闭;否则, 空气将通过 PTFE 膜泄漏。在气泡疏水阀再次放置在真空下之前, 不需要取下此夹钳。最后, 监控您的流量设备是否有潜在堵塞或泄漏非常重要。检查系统堵塞的最有效方法是检查附件或生长瓶、PD 和 FB 的入口是否有介质滴落。如果一切运作顺利, 这些媒体应该以相对相似的价格滴水。如果堵塞是存在的, 你通常可以确定的位置, 因为管道刚上游的堵塞将更加僵硬。
获得数据后, 我们提供大量 ImageJ 宏来定量视频。这些宏决定了生物膜生长和发育的多个参数, 包括生物量的测量, 以及细胞附着到表面或生物膜的速率。提供的宏的说明如下所示。
完整分析执行下面列出的所有分析, 并自动输出数据。此宏可以在没有打开的图像文件的情况下执行, 而其他所有要求打开的视频。执行时, 它将提示用户打开一个附件堆栈文件, 然后是一个增长堆栈文件。在此之后, 它将自动分析图像并将包含所有数据表的数据文件夹输出到与附件图像文件相同的文件夹中。附件计数器宏仅在附件文件上执行;所有其他分析都在附件和增长文件的串联堆栈上执行。生成的输出数据文件是文本文件, 但应导入 excel 以便于使用。
总和强度分析将分析活动窗口的每个帧。它将每个像素的所有灰色值添加到步骤4.3.7 中指定的较低阈值之上, 并输出每个帧的一个累计值。生成的值与框架内的生物量成正比, 直到发生任何摄像机饱和度为止。然后将数据规范化到成像区域的区域;这不是由宏执行的。
覆盖区域分析将分析活动窗口的每个帧, 以百分比表示单元格覆盖的帧区域 (高于下限阈值)。
附件计数器将使用帧减法来确定每个帧之间附加的所有单元格的总和强度。因此, 第一个数据点是在1和2帧之间附加的细胞的生物量;第二个数据点是2和3帧之间的附着细胞的生物量, 等等。这些数据应规范化为成像区域的区域。为了便于可读性, 在绘制图形之前集成此值也很有帮助。
脱离计数器的工作原理与附件计数器相同, 但会反转帧减法, 这样就可以确定每个帧之间分离的单元格的总和强度。这些数据还应规范化为成像区域的区域, 并在绘制之前集成。在集成之前, 这些数据可以进一步规范化为总和强度分析中计算的前一个帧的总总和强度。这个新值表示在该时间点与生物膜分离的细胞比例, 这通常是更有价值的数据, 因为分离细胞的生物量会随着生物膜生物量的增加而增大。
虽然这里提供的流量系统比其他流系统更复杂, 但它确实提供了几个优点。许多这些优点是由于我们使用了商业上可用的通道幻灯片。可用于这些幻灯片的组织培养处理足以使念珠菌细胞附着在表面上。此外, 该通道幻灯片的轮廓类似于传统的幻灯片, 使其易于用于各种显微镜系统, 包括在低放大倍率下使用透射光的直立显微镜。使用这种显微镜, 我们可以使用暗场显微镜, 这使得数据的量化变得容易得多, 特别是与荧光显微镜相比 (因为没有光漂白和低光毒性)。传统显微术 (没有光学切片), 是权力保守的, 意味着从焦点细胞贡献类似数量的光子到图像, 像在类似大小12的焦点单元格。这意味着, 尽管我们的单平面成像, 全3D 生长生物膜仍在整个实验中量化, 即使更高的区域是不集中的。这种单平面成像具有显著降低细胞光毒性损伤的优势, 但不提供生物膜3D 结构的任何信息。然而, 这种流动系统也可与荧光细胞和共聚焦显微镜一起使用, 以获得此信息13。
独特的两瓶循环装置, 我们的流量设备也有许多优点。首先, 许多流系统要求将幻灯片预播种的细胞, 但我们使用一个单独的细胞种子附着烧瓶允许我们图像和量化细胞, 因为他们坚持在幻灯片, 而在流动, 我们觉得这是更类似于发生了什么c0>in 体内。此外, 我们以前已经能够调整我们的显微镜的高速成像和图像粘附事件, 因为他们实时发生, 而不是量化他们后, 事实11。其次, 有一个无细胞生长瓶, 再循环和可以保持无细胞在延长的持续时间, 使我们能够了解生物膜如何在流动下生长超过24小时, 通常不能用非循环系统完成的持续时间.我们还没有确定我们的流量系统能达到的上限, 但我们已经成功地完成了36小时的实验;然而, 实验时间越长, 泄漏或过滤器堵塞的几率就越大。许多因素会影响实验的潜在持续时间, 包括细胞的生长速率、胶粘剂的粘度以及菌丝形成的程度, 这使得在实验的持续时间上很难定义一个上限。但是, 如果所需的持续时间比所示的流量设备要长得多, 则过滤器可以用在线紫外线 (UV) 灭菌盒代替, 如前面所描述的8。此灭菌盒还可允许此流动装置用于图像细菌;我们以前的图像细菌菌株的尝试导致0.2 µm 过滤器的快速堵塞。最终, 我们选择不采用 UV 杀菌, 因为这个盒子是定制制造的, 这将导致死细胞循环。
这个流程系统的另一个优点是, 相对于商业系统来说, 它是相当便宜的, 特别是如果你需要购买一个显微镜。在我们的实验室, 我们能够购买一个基本的透射光台式显微镜, 并将整个显微镜放在一个大型标准对流孵化器内。唯一的主要要求是, 显微镜应该有一个快门功能 (机械或电气), 以执行延时显微镜。
该系统通用性强, 具有许多优点, 是一种低吞吐量的方法。与其他可用的流量系统不同, 我们的流量设备无法并行增长多个菌株。由于广泛的准备和清洁时间, 我们只能够执行两个实验一个星期。然而, 许多其他流动系统是相当昂贵的, 并且可能堵塞当念珠菌细胞生长在菌丝形成条件下。
此外, 这个流动系统是相当复杂的相比, 其他人, 可能很难保持在运行中。经过多次实验, 过滤器开始堵塞, 油管开始磨损薄, 部件开始生锈或松动;因此需要更换这些元件。过滤器的使用使该系统与某些真菌菌株的生长条件不相容;特别是, 任何诱导絮凝的东西都会迅速堵塞20µm 的在线过滤器。但是, 在使用流系统的经验充足的时候, 在它们导致实验失败之前, 更容易检测潜在的问题。可以做的一件事, 使日常运行的流量器具更简单的是有一个机械师制造的泡沫陷阱外壳的一个可高压灭菌材料 (如铝或不锈钢) 的复制品, 让你热压罐的气泡疏水阀与其余的流动装置, 由于 PTFE 膜和适配器组件的气泡疏水阀是可高压灭菌。
最后, 本文提出的两相循环流仪是一种独特的模型, 用于在流动和实时的情况下对真菌进行体外生物膜形成的图像和定量。虽然系统有其局限性, 但它具有很强的适应性, 适用于大多数显微镜。
披露声明
作者没有什么可透露的。
致谢
作者想承认韦德博士 Sigurdson 在设计流动装置方面提供了宝贵的投入。
材料
| Name | Company | Catalog Number | Comments |
| Pump | Cole Parmer | 07522-20 | 6 |
| Pump head | Cole Parmer | 77200-60 | 6 |
| Tubing | Cole Parmer | 96410-14 | N/A |
| Bubble trap adapter | Cole Parmer | 30704-84 | 3 |
| Bubble trap vacuum adapter for 1/4” ID vacuum line | Cole Parmer | 31500-55 | 3 |
| In-line filter adapter (4 needed) | Cole Parmer | 31209-40 | 8,9 |
| Orange-side Y | Cole Parmer | 31209-55 | 7 |
| Green-side Y | ibidi | 10827 | 2 |
| * Slides | ibidi | 80196 | 4 |
| * Slide luers | ibidi | 10802 | 4 |
| Vacuum assisted Bubble trap | Elveflow/Darwin microfluidics | KBTLarge - Microfluidic Bubble Trap Kit | 3 |
| Media flasks | Corning | 4980-500 | 1 |
| 0.2 µm air filter | Corning | 431229 | 1 |
| Threaded glass bottle for PD and filter flask (2 needed) | Corning | 1395-100 | 5,10 |
| Ported Screw cap for PD and filter flask (2 needed) | Wheaton | 1129750 | 5,10 |
| Screwcap tubing connector | Wheaton | 1129814 | 5,10 |
| Tubing connector beveled washer | Danco | 88579 | 5,10 |
| Tubing connector flat washer | Danco | 88569 | 5,10 |
| Clamps for in-line filters and downstream Y (7 needed) | Oetiker/MSC Industrial Supply Company | 15100002-100 | 7,8,9 |
| Clamp tool | Oetiker/MSC Industrial Supply Company | 14100386 | N/A |
| 20 micron in-line media filter | Analytical Scientific Instruments | 850-1331 | 8 |
| 10 micron in-line media filter | Analytical Scientific Instruments | 850-1333 | 9 |
| 2 micron inlet media filter | Supelco/Sigma-Aldrich | 58267 | 10 |
| * 0.22 µm media filter | Millipore | SVGV010RS | 11 |
| * 0.22 µm media filter “adapter” | BD Biosciences | 329654 | 11 |
| Rubber stopper | Fisher Scientific | 14-131E | 1 |
| Hotplate stirrer with external probe port | ThermoFisher Scientific | 88880006 | N/A |
| Temperature probe | ThermoFisher Scientific | 88880147 | N/A |
参考文献
- Pankhurst, C. L. Candidiasis (oropharyngeal). BMJ clinical evidence. 2012, 1304 (2012).
- Ramage, G., Vandewalle, K., Wickes, B. L., López-Ribot, J. L. Characteristics of biofilm formation by Candida albicans. Revista iberoamericana de micología. 18 (4), 163-170 (2001).
- Nobile, C. J., Mitchell, A. P. Regulation of cell-surface genes and biofilm formation by the C. albicans transcription factor Bcr1p. Current biology: CB. 15 (12), 1150-1155 (2005).
- Blankenship, J. R., Mitchell, A. P. How to build a biofilm: a fungal perspective. Current opinion in microbiology. 9 (6), 588-594 (2006).
- Araújo, D., Henriques, M., Silva, S. Portrait of Candida Species Biofilm Regulatory Network Genes. Trends in microbiology. 25 (1), 62-75 (2017).
- Lane, W. O., et al. Parallel-plate flow chamber and continuous flow circuit to evaluate endothelial progenitor cells under laminar flow shear stress. Journal of visualized experiments. (59), e3349 (2012).
- Bakker, D. P., van der Plaats, A., Verkerke, G. J., Busscher, H. J., van der Mei, H. C. Comparison of velocity profiles for different flow chamber designs used in studies of microbial adhesion to surfaces. Applied and environmental microbiology. 69 (10), 6280-6287 (2003).
- Zhang, W., Sileika, T. S., Chen, C., Liu, Y., Lee, J., Packman, A. I. A novel planar flow cell for studies of biofilm heterogeneity and flow-biofilm interactions. Biotechnology and bioengineering. 108 (11), 2571-2582 (2011).
- Uppuluri, P., Lopez-Ribot, J. L. An easy and economical in vitro method for the formation of Candida albicans biofilms under continuous conditions of flow. Virulence. 1 (6), 483-487 (2010).
- Diaz, P. I., et al. Synergistic interaction between Candida albicans and commensal oral streptococci in a novel in vitro mucosal model. Infection and immunity. 80 (2), 620-632 (2012).
- McCall, A., Edgerton, M. Real-Time Approach to Flow Cell Imaging of Candida albicans Biofilm Development. Journal of fungi. 3 (1), 13 (2017).
- Zhang, B., Zerubia, J., Olivo-Marin, J. -. C. Gaussian approximations of fluorescence microscope point-spread function models. Applied optics. 46 (10), 1819-1829 (2007).
- Tati, S., et al. Candida glabrata Binding to Candida albicans Hyphae Enables Its Development in Oropharyngeal Candidiasis. PLoS pathogens. 12 (3), 1005522 (2016).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。