Method Article
マウスにおける気腫の評価に対する一定圧力下での肺固定
要約
ここに提示される肺固定のための有用なプロトコルは、肺気腫のマウスモデルからの肺標本の組織学的評価のための安定した状態を作成する。このモデルの主な利点は肺の崩壊またはデフレなしで同じ一定した圧力の多くの肺を固定できることである。
要約
気腫は、慢性閉塞性肺疾患(COPD)の重要な特徴である。気腫マウスモデルを含む研究は、肺の信頼性の高い組織学的標本を生成するために最適な肺固定を必要とします。空気と組織の大部分からなる肺の構造組成物の性質上、固定プロセス中に崩壊または脱脂するリスクがあります。様々な肺固定法が存在し、それぞれが独自の長所と短所を有する。ここで提示される肺固定法は、一定の圧力を利用して、気腫マウス肺モデルを用いた研究に最適な組織評価を可能にする。主な利点は、一度に同じ条件で多くの肺を修正できることです。肺標本は、慢性タバコの煙にさらされたマウスから得られる。肺の固定は一定した圧力の生産を可能にする専門装置を使用して行われる。この一定の圧力は、合理的に膨張した状態で肺を維持します。したがって、この方法は、タバコの煙誘発性軽度の気腫を評価するのに適した肺の組織学的標本を生成する。
概要
COPDは、世界的に有数の死因の1つです。タバコの煙はCOPDの最も重要な原因であるが、病因のメカニズムは不完全に定義されたままである。COPDは、気流の進行性の制限および肺の異常な炎症反応を含む2つの主要な特徴を示す。気腫性障害はCOPD患者2の肺で頻繁に起こる。気腫の病理学的所見は、肺胞壁破壊3によって特徴付けされる。いくつかの動物種は、生体内でCOPDモデルを生成するために使用されている(すなわち、イヌ、モルモット、サル、およびげっ歯類)4.しかし、マウスはCOPDモデルの構築で最も一般的に使用されるようになった。これは、その低コスト、遺伝的に改変される能力、広範なゲノム情報の可用性、抗体の可用性、および様々なマウス株を使用する能力を含む多くの利点を有する5。現在、人間のCOPDの完全な機能を模倣できるマウスモデルはありません。したがって、個々の研究者は、特定のCOPD研究6に最も適したモデルを選択する必要があります。気腫マウスモデルは、現在利用可能な多くのCOPDマウスモデルの一つです。その他のモデルには、悪化マウス モデル、全身共罹性モデル、および COPD 感受性モデル7が含まれます。
気腫マウスモデルは、化学薬品およびタバコの煙暴露4を含むいくつかのタイプの外因性薬剤によって生成されうる。化学暴露(例えば、エラスターゼに)は重度の肺気腫を生み出し、タバコの煙は軽度の気腫8、9をもたらす。タバコの煙はCOPDの病因の主な原因であると考えられています。したがって、COPDマウスモデルを作成する手段としてのタバコの煙の選択は合理的です10.多くの研究は、マウスの気腫を作成するためにタバコの煙を使用しています。例えば、Nikulaらは、7または13ヶ月間11分間タバコの煙にさらすことによって、B6C3F1雌マウスから気腫マウスモデルを作成することに成功した。我々はまた、老化マーカータンパク質/SMP-30 KOマウス12を介して気腫マウスモデルを確立した。タバコの煙暴露によってこの軽度の気腫モデルを適切に視覚化できる肺固定法を実行することが重要です。
肺固定のための様々な方法が確立されている13.しかしながら、肺気腫14を評価するための肺組織固定のゴールドスタンダード方法はない。この研究室からのいくつかの研究は、ここで提示された固定システムは、気腫12、15、16、17、18を評価するための安定した状態を作成することによって有用であることを示しています。現在のシステムの主な利点は、肺の崩壊やデフレなしに一度に同じ状態で多くの肺を修正できることです。現在の肺固定システムは所定の期間のための適切な一定の圧力で肺の標本を膨らませることを可能にするいくつかの特別な装置を使用する。この特別な装置は、下部容器、上部容器、ポンプを含む3つの部分で構成されています。肺試料は、加圧固定剤に接続された下部容器に配置され、その結果、上下容器19との間の薬剤のレベルに25cmH2O圧力差をもたらす。
プロトコル
順天堂大学医学部動物管理利用委員会により、以下の方法が承認されています。2006年6月1日、日本学術振興会「動物実験の適正行動指針」に従った。この方法には、1)マウス解剖、2)肺駆除、3)専門装置による肺組織の固定の3つの主要なステップがあります。典型的には、肺検体は、固定12、15、16、17、18の48時間後に埋め込みに処理される。
1. マウス解剖
- マウスの体重を測定し、投与するペントバルビタールの量を決定する。
- 体重70mg/kgの投与量でペントバルビタールを経体内に注入し、つま先ピンチに対する反応がない場合に麻酔を確認する。
- 皮膚と筋肉に浸透するまで、針を45°の角度で注入します。プランジャーを引き、空気真空を確認し、ペントバルビタールを注入します。
- 反射運動がない場合は麻酔を確認する。
注:完全な肺排泄には、安楽死マウスとは対照的に麻酔マウスを使用することをお勧めします。 - マウスの皮膚と腹筋を中間線で切り、頭筋領域を目指します。
- より広い作業スペースを提供するために横に切る。
2. 肺の排泄
- ダイヤフラム層を露出させ、鉗子で穿刺します。
- 胸部のスペースを開き、胸骨の領域を切り取り、肺と心臓をはっきりと見ることができるようにする。
- 心臓を左心房と右心室で切る。
- 図 1に示すように、カニューレ (24 G) を右心室領域に挿入し、肺動脈に到達するまで頭蓋領域に向ける。
- ポンプをオンにし、すべての肺組織が白い色に変わるまで、1xリン酸緩衝生理食べ物(PBS)が循環(約200 mL/h)を可能にします。
3. 肺組織の固定
- 気管、肺、心臓を取り除きます。
- 周囲の結合組織を切断することにより、3つの臓器をすべて解放します。
- 右の主気管支を縫合糸で結び、右肺のすべての葉を切ります。
- (オプション):右肺の葉は4つの部分から成っている。右の主気管支からこれらの部品をカットし、凍結組織サンプルとして処理するための部品を分割します。
- 10 mL注射器の中に位置する固定剤に左肺の心臓と葉を挿入します。
注意: 固定剤は危険です。適切な保護具(例えば、長いゴム手袋)を着用し、換気の良い部屋で作業してください。 - 図 2 に示すように、10 mL 注射器を使用して肺を膨らませる真空状態を作成します。
- 気管にカニューレ(20G)を挿入し、結び目を結ぶ。
- 1 mLの注射器を使用して漏出を確認するために固定剤で肺を膨らませる。
- 図3に示すように、肺固定圧装置への転送。
- 期間を固定した後、結び目で気管を結ぶ肺サンプルを取り除きます。
結果
前述したように、拡張一定圧力を発生する特殊装置は、3つの部分に分けることができる(図3A)。下部は肺試料を挿入する点です(図4A)。肺はカニューレ(20G)を介して3ウェイストップコックを使用してホルマリン流の先端に接続される(図4B)。圧力は、下部および上部の容器間の固定剤の異なる表面レベルから生成される(図5)。圧力差は25 cmH2O;しかし、高さ調整ノブを使用して、圧力は25-30 cmH2O(図5)の範囲内で調整することができる。ポンプは、チューブ(図3A)を介して下部と上部の容器を接続し、固定剤表面の高さに25cmの差を維持します。エージェントフローの方向を図3Bに記載しています。
次に提示されるのは、48時間の固定に続く肺における組織学的所見の代表的な結果である。生後6ヶ月の雄SMP30-KOマウスは、8週間タバコの煙または新鮮な空気(コントロールとして)にさらされた。両方の組織標本をヘマトキシリンおよびエオシンで染色した。図 6Aは、顕著な空域拡大を示さなかった空気暴露マウスからの組織学的所見を示す。対照的に、図6Bは、慢性タバコの煙にさらされたマウスにおける著しい空域拡大および肺胞壁破壊を明らかにする。
平均線形迎撃(MLI)は、Thurlbeckらによって記述された方法に従って決定された。20は、空域サイズにアクセスします。破壊指数(DI)は、Saettaらによって説明された方法に従って肺胞壁の破壊を評価するために決定された。21.肺標本のこれらの形態測定検査は、DIおよびMLIが空気暴露マウスよりも煙曝露SMP30-KOマウスにおいて有意に大きいことを明らかにした(図6C,D)。
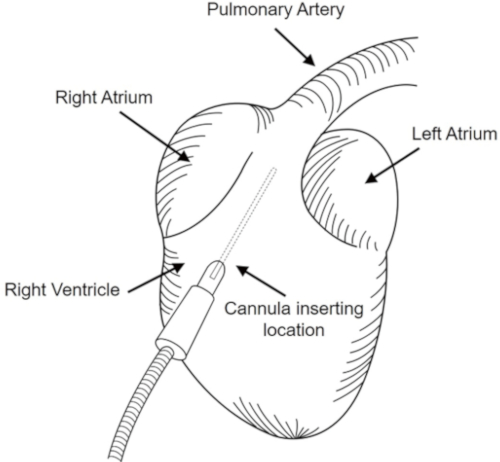
図1:肺の排泄。カニューレは右心室の位置に挿入され、肺動脈に向けられた。この図のより大きなバージョンを表示するには、ここをクリックしてください。
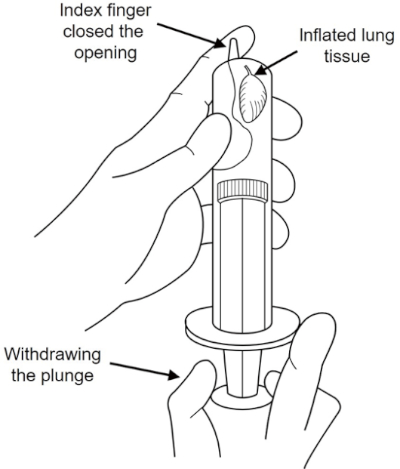
図2:真空注射器肺インフレーション。肺を膨らませる固定剤を含む10mL注射器内部の真空状態。この図のより大きなバージョンを表示するには、ここをクリックしてください。
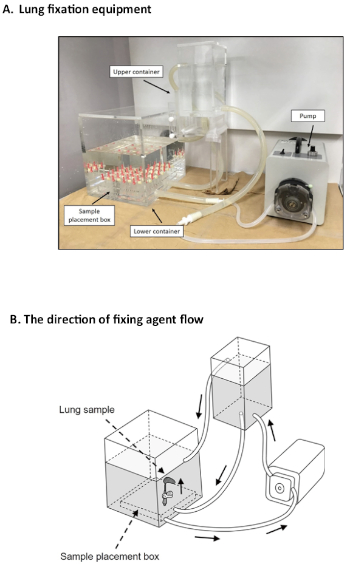
図3:肺固定装置。(A)アクリル装置は、ポンプ機を利用して、肺を48時間連続的に膨張させる25cmH2O圧力差を可能にした。(B)固定剤の流れの方向は矢印で示す。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図 4: 下のコンテナー。(A)マウス肺検体を下容器内の固定剤の中に配置した。(B)下部容器内には、ホルマリンが三方ストップコックとカニューレを通って流れるサンプル配置ボックスがあります。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図5:上部コンテナと高さ調整ノブ。上部容器は25cmH2Oの圧力を発生した。上部の容器の高さを調節するために使用することができる高さの調節のノブの2つのペアがある。その結果、生成される圧力は25〜30 cmH2Oの範囲内に設定することができ、この図のより大きなバージョンを表示するにはここをクリックしてください。
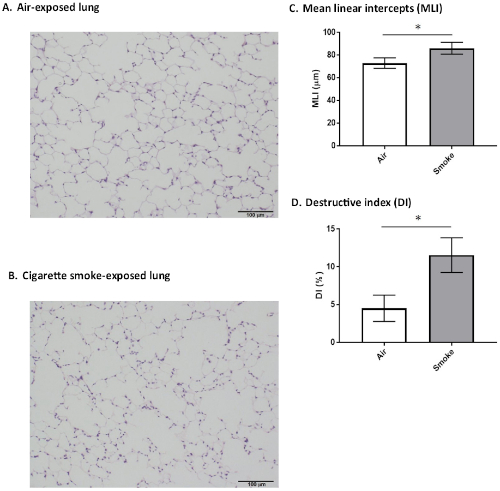
図6:マウス肺の体学的および形態学的所見8週間のタバコの煙にさらされたまたは空気暴露されたSMP30-KOマウス(6ヶ月、男性)からの肺切片の代表的なヒスチカル画像は、ヘマトキシリン-エオシンで染色された。スケールバー = 100 μm。(A)被曝群は有意な拡大またはその他の所見を示さなかった。(B)タバコの煙暴露群は、顕著な空域拡大および肺胞壁破壊を示した。(C)平均線形迎撃(MLI)。タバコの煙暴露マウスの肺では、MLIは空気暴露マウス(*p<0.001)よりも有意に大きかった。(D)破壊指数(DI)。タバコの煙暴露マウスの肺では、DIは空気暴露マウスの肺と比較して有意に増加した(*p< 0.001)。値は平均±SD(各群に対してn =6)として提示される。この図のより大きなバージョンを表示するには、ここをクリックしてください。
ディスカッション
ここで提示されたげっ歯類の肺の固定手順は新しいものではありません。ただし、このシステムにはいくつかの利点があります。まず、同じ状態で一度に多くの肺(最大20)を修正することができます。毒性病理学会は、重力の吸入圧力が22〜25 cmH2O22から変化すると述べています。特に、いくつかの研究は、25 cmH2O13、19、23、24、25、26、27の圧力で肺固定を行っています。、現在のシステム12、15、16、17、18を使用して私たちの研究室で採用されています。
第二に、それは時間の様々な期間のための一定の圧力で肺組織を固定することができる。私たちの研究室では、肺サンプルは通常48時間固定されています。多くの研究者は、比較的短い期間(例えば、5-20分)13、28、29、30、31、32を使用し、膨張した肺を結び、浸漬する必要に応じて長期間ホルマリン。肺固定の持続期間のゴールドスタンダードを示すデータや研究はありません。しかし、米国胸部学会(ATS)/欧州呼吸器学会(ERS)の声明は、気道のインフレ圧力を少なくとも24時間14時間維持しなければならない「銀基準」を記述している。日本病理学会はまた、一貫した免疫組織化学スライドを生成するために、1週間以内の固定時間を推奨しました。しかし、彼らの推薦は、人間の標本33を使用した分析に基づいている。各サンプルは下の容器に個別に配置されることになっているため、比較的短い固定期間は現在のシステムには適用できない場合があります。これは現在のシステムの制限です。結論として、マウス肺固定のための適切な時間の長さは不明のままである。
この方法の重要なステップは、ホルマリン固定プロセス中の肺ホルマリン漏出のリスクに関連しています。肺ホルマリン漏出は、肺サイズの収縮を引き起こす可能性があります。このリスクは 2 つの部分に分けることができます。最初の部分は、犠牲のステップ中に発生します。胸腔ケージを開いている間、肺表面に損傷を与えないことは重要である。予防の鍵は、横隔膜からこれをアプローチし、肺が頭頂胸膜から切り離された後に胸部肋骨ケージを切断し続ける。この方法は外科装置によって引き起こされる肺損傷を避ける。右の主要な気管支を結ぶとき別の重要なステップが発生します。マウスの右葉を特定することが重要です。後ろから見える位置に肺を置くことで、肺の位置を容易に識別できます。
第二の部分は専門の装置を使用して肺の固定プロセスの間である。下部容器のホルマリンポートに肺標本を挿入する間に重大なステップが起こる。一定の加圧プロセス中にホルマリンポートから肺標本が剥離するのを防ぐために、挿入がしっかりと確保されることを確認する必要があります。強調するもう一つの側面は、特殊な機器(下部コンテナ、上部コンテナ、およびポンプ)の3つの部分間のチューブ接続です。すべてのチューブ接続をしっかりと接続する必要があります。漏れが発生すると、上部容器内のホルマリン体積が減少し、一定の圧力が低下します。
毒物病理学会からの勧告によると、ホルマリンの気管内刺激は、その欠点22に勝つげっ歯類肺モデルのための利点を有する。彼らは、肺胞肺モルホメトリーの定量的研究を行う際に、気管内ホルマリン固定法の使用を示唆している。気道および肺胞壁の保存および肺アレンキマ22の可視化を含む2つの利点がある気管内肺の点質。Braberらによる1つの研究は、真空インフレーションおよび全身灌流法13と比較した場合、肺構造を維持する点で気管内ホルマリン注入法が優れていることを明らかにした。現在の方法は、マウスモデルにおける気管内刺激を利用して、肺胞領域の可視化を最適化する。
固定剤に関しては、ホルムアルデヒドを含む10%ホルマリンが従来用されている。ホルムアルデヒドは、タンパク質免疫原性を完全に破壊しないため、免疫病理学的調査の固定剤として広く使用されています。しかしながら、ATS/ERSステートメントは、組織構造14を適切に安定化しないため、ホルマリン固定を推奨しない。グルタルアルデヒドは、代わりに気道の含入に推奨されます。しかし、タンパク質免疫原性を破壊する対象となり、免疫組織化学に不適当な固定剤が生じます。いくつかの証拠は、現在の固定システム12を使用してホルマリン固定に続く形態測定評価(例えば、平均線形インターセプト、内部表面積、および破壊指数)のために固定肺が提供される可能性があることを報告している。,15歳,16歳,17歳,18.確かに,グルタルアルデヒドは現行のシステムに採用できる。従って、研究者は実験的な必要性に従って現在のシステムの両方の薬剤を選ぶことができる。
開示事項
著者は、宣言する競合する利益を持っていません。
謝辞
本研究は、JSPS KAKENHI助成金番号26461199(佐藤哲三)と順天堂大学大学院医学系研究科環境・ジェンダー特異医学研究所、助成番号E2920(佐藤哲三)の一部で支援されました。資金提供者は、現在の方法の設計と原稿の書き込みには何の役割も持っていなかった。
資料
| Name | Company | Catalog Number | Comments |
| 10% formalin (formalin neutral buffer solution) | Wako | 060-01667 | |
| Bent forceps | Hammacher | HSC187-11 | |
| Cannula, size 20G | Terumo | SR-FS2032 | |
| Cannula, size 22G | Terumo | SR-OT2225C | Cannula to exsanguinate lung |
| Forceps | Hammacher | HSC184-10 | |
| Kimtowel | Nippon Paper Crecia (Kimberly Clark) | 61000 | |
| Kimwipe | Nippon Paper Crecia (Kimberly Clark) | 62011 | |
| Lower container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
| Roller pump | Nissin Scientific Corp | NRP-75 | Pump machine to exsanguinate lung |
| Roller pump RP-2000 | Eyela (Tokyo Rikakikai Co. Ltd) | 160200 | Pressure equipment pump |
| Silicone tube Ø 9 mm | Sansyo | 94-0479 | Pressure equipment component |
| Somnopentyl (64.8 mg/mL) | Kyoritsu Seiyaku | SOM02-YA1312 | Pentobarbital Sodium |
| Surgical scissor | Hammacher | HSB014-11 | |
| Suture thread, size 0 | Nescosuture | GA01SW | |
| Syringe, 1 mL | Terumo | SS-01T | |
| Syringe, 1 ml with needle | Terumo | SS-01T2613S | |
| Syringe, 10 mL | Terumo | SS-10ESZ | |
| Three-way stopcock | Terumo | TS-TR1K01 | |
| Upper container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
参考文献
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD Executive Summary. American Journal of Respiratory and Critical Care Medicine. 195 (5), 557-582 (2017).
- Pauwels, R. A., Rabe, K. F. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet. 364 (9434), 613-620 (2004).
- Spurzem, J. R., Rennard, S. I. Pathogenesis of COPD. Seminars in Respiratory and Critical Care Medicine. 26 (2), 142-153 (2005).
- Vlahos, R., Bozinovski, S., Gualano, R. C., Ernst, M., Anderson, G. P. Modelling COPD in mice. Pulmonary Pharmacology and Therapeutics. 19 (1), 12-17 (2006).
- Vlahos, R., Bozinovski, S. Recent advances in pre-clinical mouse models of COPD. Clinical Science (Lond). 126 (4), 253-265 (2014).
- Stevenson, C. S., Belvisi, M. G. Preclinical animal models of asthma and chronic obstructive pulmonary disease. Expert Review of Respiratory Medicine. 2 (5), 631-643 (2008).
- Stevenson, C. S., Birrell, M. A. Moving towards a new generation of animal models for asthma and COPD with improved clinical relevance. Pharmacology and Therapeutics. 130 (2), 93-105 (2011).
- Vandivier, R. W., Ghosh, M. Understanding the Relevance of the Mouse Cigarette Smoke Model of COPD: Peering through the Smoke. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 3-4 (2017).
- Wright, J. L., Cosio, M., Churg, A. Animal models of chronic obstructive pulmonary disease. American Journal of Physiology Lung Cellular and Molecular Physiology. 295 (1), L1-L15 (2008).
- Rennard, S. I., Togo, S., Holz, O. Cigarette smoke inhibits alveolar repair: a mechanism for the development of emphysema. Proceedings of the American Thoracic Society. 3 (8), 703-708 (2006).
- Nikula, K. J., et al. A mouse model of cigarette smoke-induced emphysema. Chest. 117, 246S-247S (2000).
- Sato, T., et al. Senescence marker protein-30 protects mice lungs from oxidative stress, aging, and smoking. American Journal of Respiratory and Critical Care Medicine. 174 (5), 530-537 (2006).
- Braber, S., Verheijden, K. A., Henricks, P. A., Kraneveld, A. D., Folkerts, G. A comparison of fixation methods on lung morphology in a murine model of emphysema. American Journal of Physiology Lung Cellular and Molecular Physiology. 299 (6), L843-L851 (2010).
- Hsia, C. C., et al. An official research policy statement of the American Thoracic Society/European Respiratory Society: standards for quantitative assessment of lung structure. American Journal of Respiratory and Critical Care Medicine. 181 (4), 394-418 (2010).
- Kasagi, S., et al. Tomato juice prevents senescence-accelerated mouse P1 strain from developing emphysema induced by chronic exposure to tobacco smoke. American Journal of Physiology Lung Cellular and Molecular Physiology. 290 (2), L396-L404 (2006).
- Koike, K., et al. Complete lack of vitamin C intake generates pulmonary emphysema in senescence marker protein-30 knockout mice. American Journal of Physiology Lung Cellular and Molecular Physiology. 298 (6), L784-L792 (2010).
- Koike, K., et al. Vitamin C prevents cigarette smoke-induced pulmonary emphysema in mice and provides pulmonary restoration. American Journal of Respiratory Cell and Molecular Biology. 50 (2), 347-357 (2014).
- Suzuki, Y., et al. Hydrogen-rich pure water prevents cigarette smoke-induced pulmonary emphysema in SMP30 knockout mice. Biochemical and Biophysical Research Communications. 492 (1), 74-81 (2017).
- Saad, M., Ruwanpura, S. M. Tissue Processing for Stereological Analyses of Lung Structure in Chronic Obstructive Pulmonary Disease. Methods in Molecular Biology. 1725, 155-162 (2018).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. The American Review of Respiratory Disease. 95 (5), 765-773 (1967).
- Saetta, M., et al. Destructive index: a measurement of lung parenchymal destruction in smokers. The American Review of Respiratory Disease. 131 (5), 764-769 (1985).
- Renne, R., et al. Recommendation of optimal method for formalin fixation of rodent lungs in routine toxicology studies. Toxicologic Pathology. 29 (5), 587-589 (2001).
- Schneider, J. P., Ochs, M. Alterations of mouse lung tissue dimensions during processing for morphometry: a comparison of methods. American Journal of Physiology Lung Cellular and Molecular Physiology. 306 (4), L341-L350 (2014).
- Wright, J. L. Relationship of pulmonary arterial pressure and airflow obstruction to emphysema. Journal of Applied Physiology. 74 (3), 1320-1324 (1993).
- Wright, J. L., Churg, A. Cigarette smoke causes physiologic and morphologic changes of emphysema in the guinea pig. The American Review of Respiratory Disease. 142 (6 Pt 1), 1422-1428 (1990).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Wright, J. L., et al. Airway remodeling in the smoke exposed guinea pig model. Inhalation Toxicology. 19 (11), 915-923 (2007).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and Fixation Methods Useful in Mouse Lung Cancer Research. Journal of Visualized Experiments. (102), e52964 (2015).
- Roos, A. B., Berg, T., Ahlgren, K. M., Grunewald, J., Nord, M. A method for generating pulmonary neutrophilia using aerosolized lipopolysaccharide. Journal of Visualized Experiments. (94), (2014).
- Laucho-Contreras, M. E., Taylor, K. L., Mahadeva, R., Boukedes, S. S., Owen, C. A. Automated measurement of pulmonary emphysema and small airway remodeling in cigarette smoke-exposed mice. Journal of Visualized Experiments. (95), 52236 (2015).
- Nakanishi, Y., et al. Clarithromycin prevents smoke-induced emphysema in mice. American Journal of Respiratory and Critical Care Medicine. 179 (4), 271-278 (2009).
- Maeno, T., et al. CD8+ T Cells are required for inflammation and destruction in cigarette smoke-induced emphysema in mice. Journal of Immunology. 178 (12), 8090-8096 (2007).
- Sato, M., et al. Optimal fixation for total preanalytic phase evaluation in pathology laboratories: a comprehensive study including immunohistochemistry, DNA, and mRNA assays. Pathology International. 64 (5), 209-216 (2014).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved