Method Article
小鼠肺气肿评价持续压力下的肺固定
摘要
这里介绍的是肺固定的有用方案,为肺气肿小鼠模型肺标本的组织学评估创造了一个稳定的条件。该模型的主要优点是,它可以修复许多肺具有相同的恒定压力,没有肺崩溃或通缩。
摘要
肺气肿是慢性阻塞性肺病(COPD)的一个重要特征。涉及肺气肿小鼠模型的研究需要最佳的肺固定,以产生可靠的肺组织学标本。由于肺的结构组成的性质,主要由空气和组织组成,在固定过程中有它崩溃或放气的风险。各种肺固定方法存在,每种方法各有其优缺点。这里介绍的肺固定方法利用恒定压力,利用肺气肿小鼠肺模型为研究提供最佳的组织评估。主要优点是,它可以修复许多肺与相同的条件在同一时间。肺标本是从慢性香烟烟雾暴露小鼠获得的。肺固定使用专用设备进行,能够产生恒定的压力。这种恒定的压力使肺保持在合理的膨胀状态。因此,该方法产生一个肺组织标本,适合评估香烟烟雾引起的轻度肺气肿。
引言
慢性阻塞性肺病是全球主要死亡原因之一。香烟烟雾是COPD最重要的病因,但发病机制仍不完全确定。COPD表现出两个主要特征,包括气流的逐渐限制和肺的异常炎症反应。肺气肿紊乱经常发生在慢性阻塞性肺病患者2的肺部。肺气肿的病理发现以肺泡壁破坏为特征3。一些动物物种已经被用来生成在体内的COPD模型(即狗,豚鼠,猴子和啮齿动物)4。然而,鼠标已成为在COPD模型构造中最常用的。这有许多优点,包括成本低,具有转基因能力,广泛的基因组信息可用性,抗体的可用性,以及使用各种小鼠菌株的能力5。目前,没有小鼠模型可以模仿人类COPD的全部特征;因此,个别研究人员必须选择哪种模型最适合特定的慢性阻塞性肺病研究6。肺气小鼠模型是目前可用的众多 COPD 小鼠模型之一。其他模型包括加重小鼠模型、系统性共病模型和COPD易感性模型7。
肺气鼠模型可以由几种外源性物质产生,包括化学剂和香烟烟雾暴露4。化学品接触(例如,对乳化酶)会产生一种严重的肺气肿,而香烟烟雾则导致轻度肺气肿8,9。香烟烟雾被认为是COPD发病的主要原因;因此,选择香烟烟雾作为创建COPD小鼠模型的手段是合理的10。许多研究都利用香烟烟雾在老鼠体内制造肺气肿。例如,Nikula等人成功地从B6C3F1雌性小鼠身上培育出一种肺气肿小鼠模型,将它们暴露在香烟烟雾中7个月或13个月。我们还建立了肺气肿小鼠模型,通过衰老标记蛋白/SMP-30 KO小鼠12。执行肺固定方法至关重要,该方法可以通过香烟烟雾暴露来正确可视化这种温和的肺气肿模型。
各种肺固定方法已经建立13。然而,没有金标准肺组织固定方法用于评估肺气肿14。该实验室的几项研究表明,这里介绍的固定系统是有用的,为评估肺气肿12,15,16,17,18创建一个稳定的条件。目前系统的主要优点是,它可以修复许多肺与相同的条件在同一时间没有肺崩溃或通缩。目前的肺固定系统使用一些特殊设备,允许肺标本在给定时期内以适当的恒定压力膨胀。这种特殊设备由三个部分组成,包括下部容器、上部容器和泵。肺试样被放置在与加压固定剂相连的下容器中,导致上容器和下容器之间的代理水平存在25 cmH2O的压力差异19。
研究方案
以下方法已获得君登多大学医学院动物护理和使用委员会的批准。2006年6月1日,日本科学委员会遵循了《动物实验正确进行指南》。这种方法有三个主要步骤:1)小鼠解剖,2)肺外泄,和3)在专用设备辅助的肺组织的固定。通常,肺标本在48小时后被加工嵌入12,15,16,17,18。
1. 鼠标解剖
- 测量小鼠的体量,然后确定要施用的五巴比妥的量。
- 以70mg/kg的体重剂量注射五巴比妥内腹,并通过对脚趾捏没有反应来确认麻醉。
- 以 45° 角注射针头,直到其穿透皮肤和肌肉。绘制柱塞并确认空气真空,然后注射五巴比妥。
- 通过没有反射运动确认麻醉。
注意:建议使用麻醉小鼠而不是安乐死小鼠进行完全肺外泄。 - 在中线切割小鼠皮肤和腹部肌肉,瞄准头部区域。
- 横向切割,以提供更宽的工作空间。
2. 肺外泄
- 露出隔膜层,用钳子刺穿它。
- 打开胸腔空间,切开胸腔,让肺部和心脏清晰可见。
- 在左心房和右心室切心脏。
- 将导管(24 G)插入右心室区域,并将其直接插入头室区域,直到到达肺动脉,如图1所示。
- 打开泵,让 1x 磷酸盐缓冲盐水 (PBS) 循环(约 200 mL/h),直到所有肺组织变为白色。
3. 肺组织固定
- 取出气管、肺和心脏。
- 通过切割周围的结缔组织释放所有三个器官。
- 用缝合线绑住右主支气管,并切下右肺的所有叶。
- (可选):右肺的叶由四部分组成。从右侧主支气管中切割这些部分,并将零件分割为冷冻组织样本进行加工。
- 将心脏和左肺叶插入固定剂中,位于 10 mL 注射器内。
注意:固定剂是危险的。穿戴适当的防护设备(如长橡胶手套),并在通风良好的房间工作。 - 使用10 mL注射器制造真空条件,使肺部膨胀,如图2所示。
- 将套管 (20 G) 插入气管并打结。
- 使用1 mL注射器用固定剂充气肺部以检查有无泄漏。
- 转移到肺固定压力设备,如图3所示。
- 固定期后,取出用结绑气管的肺样本。
结果
如前所述,产生扩展恒定压力的专用设备可分为三部分(图3A)。下部是插入肺样本的点(图4A)。肺通过导管(20 G)连接到形式素流动的尖端使用三向停止公鸡(图4B)。压力由下部和上容器之间的固定剂的不同表面水平产生(图5)。压力差为25 cmH2O;但是,使用高度调节旋钮,压力可以在 25-30 cmH2O 的范围内调节(图 5)。泵通过管子连接下部和上部容器(图3A),在固定剂表面高度上保持25厘米的差异。代理流的方向如图3B所示。
接下来是肺组织学发现的代表性结果,在48小时的固定后。六个月大的雄性SMP30-KO小鼠暴露在香烟烟雾或新鲜空气(作为对照)8周。两个组织标本都沾有血氧素和欧辛。图 6A显示了空气暴露小鼠的组织学发现,这些小鼠没有显示出明显的空域扩大。相比之下,图6B揭示了暴露于慢性香烟烟雾的小鼠的空域扩大和白杨壁破坏。
均线性截距(MLI)是根据瑟尔贝克等人描述的方法确定的。20进入空域大小。根据Saetta等人描述的方法,确定破坏性指数(DI)对白道壁的破坏程度进行评估。21.这些肺标本的形态检查表明,在冒烟的SMP30-KO小鼠中,DI和MLI明显大于在空气暴露小鼠中(图6C,D)。
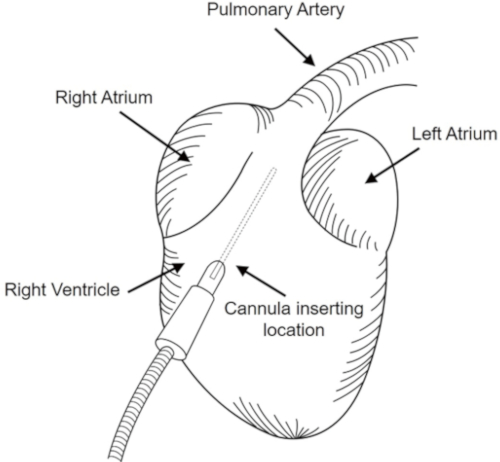
图1:肺外泄。在右心室的位置插入一根导管,并定向到肺动脉。请点击此处查看此图的较大版本。
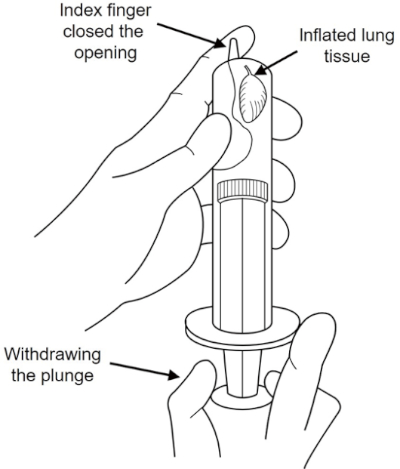
图2:真空注射器肺膨胀。含有固定剂的10 mL注射器内的真空状况,以膨胀肺部。请点击此处查看此图的较大版本。
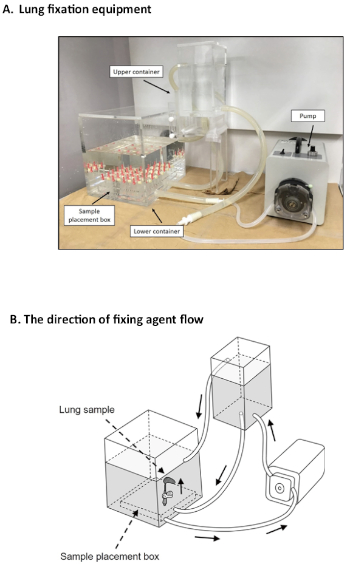
图3:肺固定设备。(A)丙烯酸设备允许25 cmH2O压力差,利用泵机连续膨胀肺48小时。(B)固定剂流的方向用箭头指示。请点击此处查看此图的较大版本。

图 4:下部容器。(A)小鼠肺标本位于下容器的固定剂内。(B)在下部容器内,有一个样品放置箱,顶部有一个形式素流经三向止流器和管状。请点击此处查看此图的较大版本。

图5:上部容器和高度调节旋钮。上部容器产生25 cmH2O的压力。有两对高度调节旋钮,可用于调节上容器的高度;因此,产生的压力可以设定在25~30 cmH2O的范围内。请点击此处查看此图的较大版本。
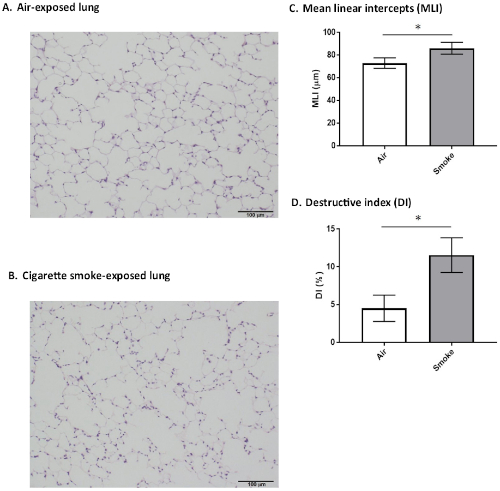
图6:小鼠肺和形态学发现。8周香烟烟雾暴露或空气暴露的SMP30-KO小鼠(6个月大,雄性)的肺部分代表性组织学图像,沾染了血氧林-欧素。刻度条 = 100 μm。(A)空气暴露组没有显着扩大或其他发现。(B)香烟烟雾暴露组出现明显的空域扩大和白杨壁破坏。(C)平均线性截距 (MLI)。在香烟烟雾暴露小鼠的肺部,MLI明显大于空气暴露小鼠([p < 0.001])。(D)破坏性指数。在香烟烟雾暴露小鼠的肺部,与空气暴露小鼠的肺部相比,DI显著增加(#p < 0.001)。值以平均值 = SD(n = 6 表示)。每个组。请点击此处查看此图的较大版本。
讨论
这里介绍的啮齿动物肺的固定程序并不新颖;然而,该系统有几个优点。首先,它可以修复许多肺(最多20个)与相同的条件在同一时间。毒理学病理学学会指出,重力灌输的压力从22-25 cmH2O22不等。值得注意的是,一些研究在25 cmH2O13,19,23,24,25,26,27的压力下进行了肺固定,我们的实验室已采用现行系统12、15、16、17、18。
其次,它可以在不同时期以恒定的压力固定肺组织。在我们的实验室中,肺样本通常固定为48小时。许多调查人员使用相对较短的时间(例如,5~20分钟)13,28,29,30,31,32,然后绑住膨胀的肺,浸入正式长时间,如需要。没有数据或研究表明肺固定持续时间的黄金标准。然而,美国胸腔学会(ATS)/欧洲呼吸学会(ERS)的声明描述了"银标准",即气道通胀压力必须至少维持24小时14小时。日本病理学会还建议固定时间不超过1周,以产生一致的免疫组织化学幻灯片;虽然,他们的建议是基于分析使用人类标本33。相对较短的固定时间段可能不适用于当前系统,因为每个样本应单独放置在较低的容器中。这是当前系统的限制。总之,小鼠肺固定的适当时间长度仍不得而知。
该方法的关键步骤与在正式固定过程中肺形式内渗漏的风险有关。肺形式泄漏可导致肺径收缩。这种风险可以分为两部分。第一部分发生在牺牲步骤中。打开胸腔时,重要的是不要对肺表面造成伤害。预防的关键是从隔膜接近这一点,并在肺从胸膜分离后继续切割胸肋笼。这种方法避免了手术设备造成的肺部损伤。绑住正确的主支气管时,会出现另一个关键步骤。识别哪些是小鼠的右叶非常重要。将肺置于从背观中可以看到的位置上,可以更容易地识别肺部的位置。
第二部分是在肺固定过程中使用专用设备。将肺试样插入下部集装箱的正口时,会出现关键步骤。应确认插入紧密牢固,以防止肺标本在持续加压过程中脱离正式端口。需要强调的另一个方面是专用设备(下部容器、上部容器和泵)三个部分之间的管道连接。所有管连接都应紧密连接。如果发生泄漏,上容器中的形式体积将减少,从而降低恒定压力。
根据毒理学病理学协会的建议,在宫内灌输正式宁具有优势的啮齿动物肺模型,这战胜了其缺点22。他们建议在进行肺泡肺活量定量研究时,使用耳内形式固定方法。内切肺灌输有两个优点,包括保护气道和肺泡壁,以及肺腹肌22的可视化。Braber等人的一项研究表明,与真空膨胀法和全身灌注法相比,在保持肺结构方面,内切内形式授液方法优于13。目前的方法利用小鼠模型中的气管内灌输来优化海底区域的可视化。
关于固定剂,10%甲醛,含有甲醛,是常规使用。甲醛被广泛用作免疫病理学调查的固定剂,因为它不能完全破坏蛋白质的免疫原性。然而,ATS/ERS声明不建议正式固定,因为它不能充分稳定组织结构14。建议用于气道内气的灌输;然而,它受到蛋白质免疫原性的破坏,导致免疫细胞化学的固定剂不合适。若干证据表明,固定肺可用于使用当前固定系统进行正式固定后进行形态测量(例如,平均线性截取、内部表面积和破坏性指数),15,16,17,18.当然,谷醛可用于目前的系统;因此,研究人员可以根据实验需要选择当前系统中的两种制剂。
披露声明
作者没有相互竞争的利益可申报。
致谢
这项工作部分得到了JSPS KAKENHI赠款号26461199(佐藤)和Juntendo大学医学院环境与性别特定医学研究所的支持,助学金编号为E2920(佐藤)。在设计现有方法和撰写手稿方面,受发人没有作用。
材料
| Name | Company | Catalog Number | Comments |
| 10% formalin (formalin neutral buffer solution) | Wako | 060-01667 | |
| Bent forceps | Hammacher | HSC187-11 | |
| Cannula, size 20G | Terumo | SR-FS2032 | |
| Cannula, size 22G | Terumo | SR-OT2225C | Cannula to exsanguinate lung |
| Forceps | Hammacher | HSC184-10 | |
| Kimtowel | Nippon Paper Crecia (Kimberly Clark) | 61000 | |
| Kimwipe | Nippon Paper Crecia (Kimberly Clark) | 62011 | |
| Lower container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
| Roller pump | Nissin Scientific Corp | NRP-75 | Pump machine to exsanguinate lung |
| Roller pump RP-2000 | Eyela (Tokyo Rikakikai Co. Ltd) | 160200 | Pressure equipment pump |
| Silicone tube Ø 9 mm | Sansyo | 94-0479 | Pressure equipment component |
| Somnopentyl (64.8 mg/mL) | Kyoritsu Seiyaku | SOM02-YA1312 | Pentobarbital Sodium |
| Surgical scissor | Hammacher | HSB014-11 | |
| Suture thread, size 0 | Nescosuture | GA01SW | |
| Syringe, 1 mL | Terumo | SS-01T | |
| Syringe, 1 ml with needle | Terumo | SS-01T2613S | |
| Syringe, 10 mL | Terumo | SS-10ESZ | |
| Three-way stopcock | Terumo | TS-TR1K01 | |
| Upper container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
参考文献
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD Executive Summary. American Journal of Respiratory and Critical Care Medicine. 195 (5), 557-582 (2017).
- Pauwels, R. A., Rabe, K. F. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet. 364 (9434), 613-620 (2004).
- Spurzem, J. R., Rennard, S. I. Pathogenesis of COPD. Seminars in Respiratory and Critical Care Medicine. 26 (2), 142-153 (2005).
- Vlahos, R., Bozinovski, S., Gualano, R. C., Ernst, M., Anderson, G. P. Modelling COPD in mice. Pulmonary Pharmacology and Therapeutics. 19 (1), 12-17 (2006).
- Vlahos, R., Bozinovski, S. Recent advances in pre-clinical mouse models of COPD. Clinical Science (Lond). 126 (4), 253-265 (2014).
- Stevenson, C. S., Belvisi, M. G. Preclinical animal models of asthma and chronic obstructive pulmonary disease. Expert Review of Respiratory Medicine. 2 (5), 631-643 (2008).
- Stevenson, C. S., Birrell, M. A. Moving towards a new generation of animal models for asthma and COPD with improved clinical relevance. Pharmacology and Therapeutics. 130 (2), 93-105 (2011).
- Vandivier, R. W., Ghosh, M. Understanding the Relevance of the Mouse Cigarette Smoke Model of COPD: Peering through the Smoke. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 3-4 (2017).
- Wright, J. L., Cosio, M., Churg, A. Animal models of chronic obstructive pulmonary disease. American Journal of Physiology Lung Cellular and Molecular Physiology. 295 (1), L1-L15 (2008).
- Rennard, S. I., Togo, S., Holz, O. Cigarette smoke inhibits alveolar repair: a mechanism for the development of emphysema. Proceedings of the American Thoracic Society. 3 (8), 703-708 (2006).
- Nikula, K. J., et al. A mouse model of cigarette smoke-induced emphysema. Chest. 117, 246S-247S (2000).
- Sato, T., et al. Senescence marker protein-30 protects mice lungs from oxidative stress, aging, and smoking. American Journal of Respiratory and Critical Care Medicine. 174 (5), 530-537 (2006).
- Braber, S., Verheijden, K. A., Henricks, P. A., Kraneveld, A. D., Folkerts, G. A comparison of fixation methods on lung morphology in a murine model of emphysema. American Journal of Physiology Lung Cellular and Molecular Physiology. 299 (6), L843-L851 (2010).
- Hsia, C. C., et al. An official research policy statement of the American Thoracic Society/European Respiratory Society: standards for quantitative assessment of lung structure. American Journal of Respiratory and Critical Care Medicine. 181 (4), 394-418 (2010).
- Kasagi, S., et al. Tomato juice prevents senescence-accelerated mouse P1 strain from developing emphysema induced by chronic exposure to tobacco smoke. American Journal of Physiology Lung Cellular and Molecular Physiology. 290 (2), L396-L404 (2006).
- Koike, K., et al. Complete lack of vitamin C intake generates pulmonary emphysema in senescence marker protein-30 knockout mice. American Journal of Physiology Lung Cellular and Molecular Physiology. 298 (6), L784-L792 (2010).
- Koike, K., et al. Vitamin C prevents cigarette smoke-induced pulmonary emphysema in mice and provides pulmonary restoration. American Journal of Respiratory Cell and Molecular Biology. 50 (2), 347-357 (2014).
- Suzuki, Y., et al. Hydrogen-rich pure water prevents cigarette smoke-induced pulmonary emphysema in SMP30 knockout mice. Biochemical and Biophysical Research Communications. 492 (1), 74-81 (2017).
- Saad, M., Ruwanpura, S. M. Tissue Processing for Stereological Analyses of Lung Structure in Chronic Obstructive Pulmonary Disease. Methods in Molecular Biology. 1725, 155-162 (2018).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. The American Review of Respiratory Disease. 95 (5), 765-773 (1967).
- Saetta, M., et al. Destructive index: a measurement of lung parenchymal destruction in smokers. The American Review of Respiratory Disease. 131 (5), 764-769 (1985).
- Renne, R., et al. Recommendation of optimal method for formalin fixation of rodent lungs in routine toxicology studies. Toxicologic Pathology. 29 (5), 587-589 (2001).
- Schneider, J. P., Ochs, M. Alterations of mouse lung tissue dimensions during processing for morphometry: a comparison of methods. American Journal of Physiology Lung Cellular and Molecular Physiology. 306 (4), L341-L350 (2014).
- Wright, J. L. Relationship of pulmonary arterial pressure and airflow obstruction to emphysema. Journal of Applied Physiology. 74 (3), 1320-1324 (1993).
- Wright, J. L., Churg, A. Cigarette smoke causes physiologic and morphologic changes of emphysema in the guinea pig. The American Review of Respiratory Disease. 142 (6 Pt 1), 1422-1428 (1990).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Wright, J. L., et al. Airway remodeling in the smoke exposed guinea pig model. Inhalation Toxicology. 19 (11), 915-923 (2007).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and Fixation Methods Useful in Mouse Lung Cancer Research. Journal of Visualized Experiments. (102), e52964(2015).
- Roos, A. B., Berg, T., Ahlgren, K. M., Grunewald, J., Nord, M. A method for generating pulmonary neutrophilia using aerosolized lipopolysaccharide. Journal of Visualized Experiments. (94), (2014).
- Laucho-Contreras, M. E., Taylor, K. L., Mahadeva, R., Boukedes, S. S., Owen, C. A. Automated measurement of pulmonary emphysema and small airway remodeling in cigarette smoke-exposed mice. Journal of Visualized Experiments. (95), 52236(2015).
- Nakanishi, Y., et al. Clarithromycin prevents smoke-induced emphysema in mice. American Journal of Respiratory and Critical Care Medicine. 179 (4), 271-278 (2009).
- Maeno, T., et al. CD8+ T Cells are required for inflammation and destruction in cigarette smoke-induced emphysema in mice. Journal of Immunology. 178 (12), 8090-8096 (2007).
- Sato, M., et al. Optimal fixation for total preanalytic phase evaluation in pathology laboratories: a comprehensive study including immunohistochemistry, DNA, and mRNA assays. Pathology International. 64 (5), 209-216 (2014).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。