Method Article
Lungenfixierung unter konstantem Druck zur Beurteilung von Emphysem bei Mäusen
In diesem Artikel
Zusammenfassung
Hier wird ein nützliches Protokoll zur Lungenfixierung vorgestellt, das einen stabilen Zustand für die histologische Auswertung von Lungenproben aus einem Mausmodell von Emphysem schafft. Der Hauptvorteil dieses Modells ist, dass es viele Lungen mit dem gleichen konstanten Druck ohne Lungenkollaps oder Deflation reparieren kann.
Zusammenfassung
Emphysem ist ein signifikantes Merkmal der chronisch obstruktiven Lungenerkrankung (COPD). Studien mit einem emphysematous Mausmodell erfordern eine optimale Lungenfixierung, um zuverlässige histologische Proben der Lunge zu produzieren. Aufgrund der Art der strukturellen Zusammensetzung der Lunge, die größtenteils aus Luft und Gewebe besteht, besteht die Gefahr, dass sie während des Fixierungsprozesses zusammenbricht oder entleert wird. Es gibt verschiedene Lungenfixierungsmethoden, von denen jede ihre eigenen Vor- und Nachteile hat. Die hier vorgestellte Lungenfixierungsmethode nutzt konstanten Druck, um eine optimale Gewebeauswertung für Studien mit einem emphysematous Maus-Lungenmodell zu ermöglichen. Der Hauptvorteil ist, dass es viele Lungen mit dem gleichen Zustand auf einmal beheben kann. Lungenproben werden von chronischen Zigarettenrauch exponierten Mäusen gewonnen. Die Lungenfixierung erfolgt mit speziellen Geräten, die die Produktion von konstantem Druck ermöglichen. Dieser konstante Druck hält die Lunge in einem einigermaßen überhöhten Zustand. So erzeugt diese Methode eine histologische Probe der Lunge, die geeignet ist, Zigarettenrauch-induziertes mildes Emphysem zu bewerten.
Einleitung
COPD ist eine der weltweit führenden Todesursachen1. Zigarettenrauch ist die wichtigste Ursache für COPD, aber die Mechanismen der Pathogenese bleiben unvollständig definiert. COPD zeigt zwei Hauptmerkmale, darunter eine fortschreitende Begrenzung des Luftstroms und eine abnormale Entzündungsreaktion der Lunge. Emphysematous Störung tritt häufig in der Lunge von COPD-Patienten2. Die pathologischen Befunde des Emphysems zeichnen sich durch alveolare Wandzerstörung3aus. Mehrere Tierarten wurden verwendet, um COPD-Modelle in vivo zu erzeugen (d.h. Hunde, Meerschweinchen, Affen und Nagetiere)4. Allerdings ist die Maus die am häufigsten verwendete bei der Konstruktion von COPD-Modellen geworden. Dies hat viele Vorteile, einschließlich seiner niedrigen Kosten, die Fähigkeit, genetisch verändert zu werden, umfangreiche genomische Informationsverfügbarkeit, Verfügbarkeit von Antikörpern und die Fähigkeit, eine Vielzahl von Mausstämmen zu verwenden5. Derzeit gibt es kein Mausmodell, das die vollen Funktionen der menschlichen COPD imitieren kann; Daher müssen die einzelnen Forscher wählen, welches Modell für die spezifische COPD-Forschung am besten geeignet ist6. Das emphysematous Mausmodell ist eines von vielen COPD-Mausmodellen, die derzeit verfügbar sind. Weitere Modelle sind das Exazerbationsmausmodell, das Modell der systemischen Komorbidität und das COPD-Anfälligkeitsmodell7.
Das emphysematous Mausmodell kann durch verschiedene Arten von exogenen Wirkstoffen erzeugt werden, einschließlich chemischer Mittel und Zigarettenrauchexposition4. Chemische Exposition (z.B. Gegen Elastase) erzeugt eine schwere Art von Emphysem, während Zigarettenrauch zu einem leichten Emphysem8,9führt. Zigarettenrauch wird angenommen, dass die Hauptursache für die Pathogenese von COPD sein; daher ist die Wahl des Zigarettenrauchs als Mittel zur Erstellung eines COPD-Mausmodells sinnvoll10. Viele Studien haben Zigarettenrauch verwendet, um Emphysem in der Maus zu schaffen. Zum Beispiel, Nikula et al. erfolgreich erstellt ein emphysematous Maus-Modell von B6C3F1 weibliche Mäuse durch die Exposition sie Zigarettenrauch für 7 oder 13 Monate11. Wir haben auch ein emphysematous Mausmodell über Seneszenzmarker Protein/SMP-30 KO Mäuse12etabliert. Es ist wichtig, eine Lungenfixierungsmethode durchzuführen, die dieses milde Emphysem-Modell durch Zigarettenrauchexposition richtig visualisieren kann.
Verschiedene Methoden zur Lungenfixierung wurden etabliert13. Es gibt jedoch keine Goldstandardmethode der Lungengewebefixierung zur Beurteilung des Emphysems14. Mehrere Studien aus diesem Labor haben gezeigt, dass das hier vorgestellte Fixierungssystem nützlich ist, indem es einen stabilen Zustand für die Bewertung von Emphysem12,15,16,17,18erstellt. Der Hauptvorteil des aktuellen Systems ist, dass es viele Lungen mit dem gleichen Zustand auf einmal ohne Lungenkollaps oder Deflation reparieren kann. Das aktuelle Lungenfixierungssystem verwendet spezielle Geräte, mit denen Lungenproben für einen bestimmten Zeitraum bei einem angemessenen konstanten Druck aufgeblasen werden können. Diese Spezialausrüstung besteht aus drei Teilen, darunter ein unterer Behälter, ein oberer Behälter und eine Pumpe. Lungenproben werden in den unteren Behälter gelegt, der mit Druckbefestigungsmitteln verbunden ist, was zu einem Druckunterschied von 25cmH2O im Füllstand zwischen den oberen und unteren Behältern19führt.
Protokoll
Die folgenden Methoden wurden von den Animal Care and Use Committees der Juntendo University School of Medicine genehmigt. Die Leitlinien für die ordnungsgemäße Durchführung von Tierversuchen, Science Council of Japan, 1. Juni 2006 wurden befolgt. Es gibt drei Hauptschritte bei dieser Methode: 1) Maussektion, 2) Lungenexsanguination und 3) Fixierung von Lungengewebe, unterstützt durch spezielle Geräte. Typischerweise werden Lungenproben nach 48 h Fixierung12,15,16,17,18zur Einbettung verarbeitet.
1. Maus-Sektion
- Messen Sie das Körpergewicht der Maus, und bestimmen Sie dann die Menge an Pentobarbital, die verabreicht werden soll.
- Injizieren Pentobarbital intraperitoneally in einer Dosierung von 70 mg/kg Körpergewicht und bestätigen Anästhesie durch das Fehlen einer Reaktion auf Zehenkneifung.
- Injizieren Sie die Nadel in einem 45°-Winkel, bis sie die Haut und den Muskel durchdringt. Zeichnen Sie den Kolben und bestätigen Sie ein Luftvakuum, dann injizieren Sie das Pentobarbital.
- Bestätigen Sie die Anästhesie durch das Fehlen von Reflexbewegung.
HINWEIS: Die Verwendung von anästhesierter Maus im Gegensatz zu einer eingeschläferten Maus wird für die vollständige Lungenexsanguination empfohlen. - Schneiden Sie die Maushaut und den Bauchmuskel an der medialen Linie, mit dem Ziel für den Cephalic Bereich.
- Schneiden Sie seitlich, um einen größeren Arbeitsbereich zu schaffen.
2. Lungenexsanguination
- Setzen Sie die Membranschicht aus und punktieren Sie sie mit Zangen.
- Öffnen Sie den Brustraum und schneiden Sie den Brustbereich, so dass Lunge und Herz deutlich zu sehen sind.
- Schneiden Sie das Herz in linken Vorhof und rechten Ventrikel.
- Setzen Sie eine Kanüle (24 G) in den rechten Ventrikelbereich ein und leiten Sie sie in den Cephala-Bereich, bis sie die Lungenarterie erreicht, wie in Abbildung 1dargestellt.
- Schalten Sie die Pumpe ein und lassen Sie die 1x phosphatgepufferte Saline (PBS) zirkulieren (ca. 200 ml/h), bis sich das gesamte Lungengewebe in eine weiße Farbe ändert.
3. Fixierung des Lungengewebes
- Entfernen Sie die Luftröhre, Lunge und Herz.
- Befreien Sie alle drei Organe, indem Sie die umgebenden Bindegewebe schneiden.
- Binden Sie den rechten Hauptbronchus mit einem Nahtfaden und schneiden Sie alle Lappen der rechten Lunge.
- (Optional): Die Lappen der rechten Lunge bestehen aus vier Teilen. Schneiden Sie diese Teile aus dem rechten Hauptbronchus und teilen Sie die Teile für die Verarbeitung als gefrorene Gewebeproben.
- Setzen Sie das Herz und die Lappen der linken Lunge in Fixiermittel ein, die sich in einer 10 ml Spritze befinden.
VORSICHT: Befestigungsmittel sind gefährlich. Tragen Sie die richtige Schutzausrüstung (z. B. lange Gummihandschuhe) und arbeiten Sie in einem gut belüfteten Raum. - Erstellen Sie einen Vakuumzustand mit einer 10 ml Spritze, um die Lunge aufzublasen, wie in Abbildung 2dargestellt.
- Legen Sie eine Kanüle (20 G) in die Luftröhre und binden Sie einen Knoten.
- Aufblasen Sie die Lunge mit Fixiermitteln, um mit einer 1 ml Spritze nach Leckagen zu suchen.
- Übertragung auf Lungenfixierungsdruckgeräte, wie in Abbildung 3dargestellt.
- Nach der Fixierung der Perioden entfernen Sie die Lungenprobe, die die Luftröhre mit einem Knoten bindet.
Ergebnisse
Wie bereits beschrieben, kann die Spezialausrüstung, die einen erweiterten konstanten Druck erzeugt, in drei Teile unterteilt werden (Abbildung 3A). Der untere Teil ist der Punkt, an dem die Lungenprobe eingesetzt werden soll (Abbildung 4A). Die Lunge wird über eine Kanüle (20 G) mit der Spitze des Formalinflusses über einen Drei-Wege-Stopphahn verbunden (Abbildung 4B). Der Druck wird aus den unterschiedlichen Oberflächenebenen der Fixiermittel zwischen dem unteren und dem oberen Behälter erzeugt (Abbildung 5). Der Druckunterschied beträgt 25 cmH2O; Mit dem Höhenverstellknopf kann der Druck jedoch im Bereich von 25–30 cmH2O eingestellt werden (Abbildung 5). Eine Pumpe verbindet die unteren und oberen Behälter über Rohre(Abbildung 3A),wobei ein Unterschied von 25 cm in der Oberflächenhöhe des Befestigungsmittels erhalten bleibt. Die Richtung des Agentenflusses ist in Abbildung 3Bbeschrieben.
Als nächstes wird ein repräsentatives Ergebnis histologischer Befunde in der Lunge nach 48 h Fixierung präsentiert. Sechs Monate alte männliche SMP30-KO-Mäuse waren 8 Wochen lang Zigarettenrauch oder frischer Luft (als Kontrolle) ausgesetzt. Beide Gewebeproben wurden mit Hämatoxylin und Eosin gefärbt. Abbildung 6 Eine zeigt histologische Befunde der luftexponierten Mäuse, die keine deutliche Luftraumvergrößerung aufweisen. Im Gegensatz dazu zeigt Abbildung 6B eine signifikante Luftraumvergrößerung und die Zerstörung von Alveolarwänden bei Mäusen, die chronischem Zigarettenrauch ausgesetzt waren.
Die mittleren linearen Abschnitte (MLI) wurden nach der von Thurlbeck et al. beschriebenen Methodebestimmt. 20, um auf die Luftraumgröße zuzugreifen. Der destruktive Index (DI) wurde bestimmt, um die Zerstörung der Alveolarwand nach der von Saetta et al. beschriebenen Methode zubewerten. 21. Diese morphometrischen Untersuchungen der Lungenprobe ergaben, dass DI und MLI bei den rauchexponierten SMP30-KO-Mäusen signifikant größer waren als bei den luftexponierten Mäusen(Abbildung 6C,D).
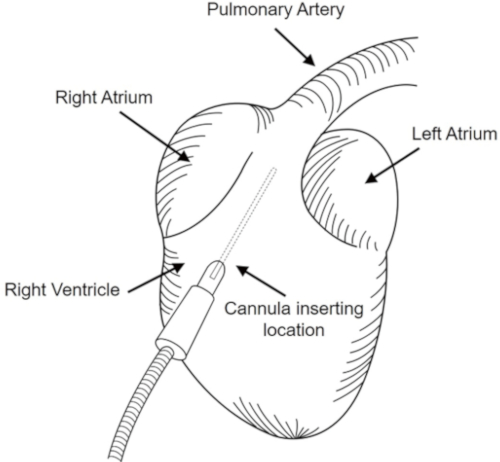
Abbildung 1: Lungenexsanguination. An der Stelle des rechten Ventrikels wurde eine Kanüle eingesetzt und zur Lungenarterie geleitet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
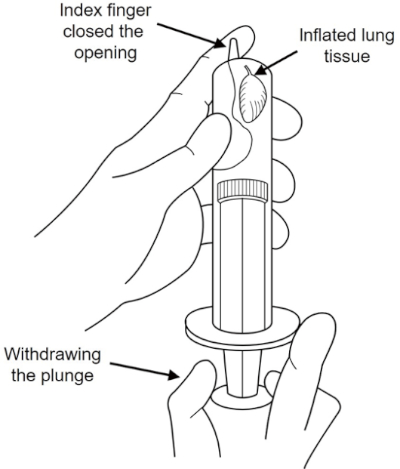
Abbildung 2: Vakuumspritze Lungeninflation. Vakuumzustand in der 10 ml Spritze mit Fixiermitteln zur Aufblasen der Lunge. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
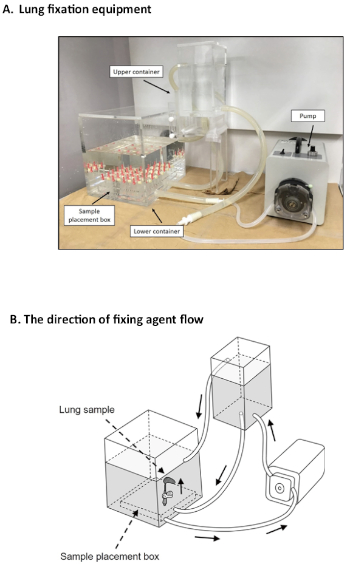
Abbildung 3: Lungenbefestigungsgerät. (A) Die Acrylausrüstung ermöglichte einen Druckunterschied von 25cmH2O, um die Lunge kontinuierlich für 48 h aufzublasen, wobei eine Pumpenmaschine verwendet wurde. (B) Die Richtung des Fixiermittelflusses wird durch Pfeile angezeigt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 4: Niedrigerer Behälter. (A) Die Maus-Lungenprobe wurde in Fixiermitteln im unteren Behälter positioniert. (B) Im unteren Behälter befindet sich ein Musterplatzierungskasten, an dessen Spitze Formalin durch einen Dreiwege-Hahn und die Kanüle fließt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.

Abbildung 5: Oberer Behälter- und Höhenverstellknopf. Der obere Behälter erzeugte einen Druck von 25 cmH2O. Es gibt zwei Paare von Höhenverstellknöpfen, die verwendet werden können, um die Höhe des oberen Behälters einzustellen; Dadurch kann der erzeugte Druck im Bereich von 25–30 cmH2O eingestellt werden. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
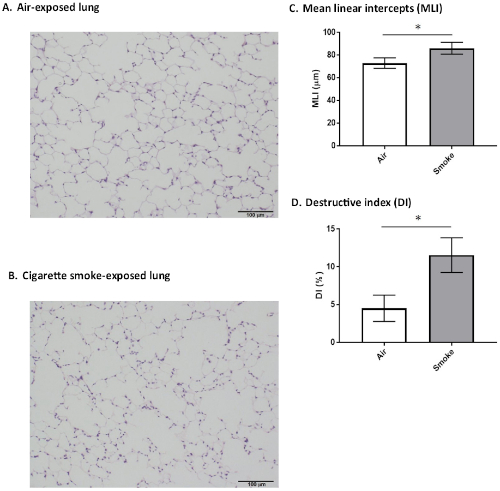
Abbildung 6: Mauslungen-Histologische und morphometrische Befunde. Repräsentative histologische Bilder von Lungenabschnitten von 8-wöchigen zigarettenrauchexponierten oder luftexponierten SMP30-KO-Mäusen (6 Monate alt, männlich), mit Hämatoxylin-Eosin gefärbt. Skalenbalken = 100 m. (A) Die luftexponierte Gruppe zeigte keine nennenswerte Erweiterung oder andere Befunde. (B) Die rauchexponierte Gruppe zeigte eine deutliche Luftraumvergrößerung und die Zerstörung von Alveolarwänden. (C) Die mittleren linearen Abschnitte (MLI). In der Lunge von zigarettenrauchexponierten Mäusen war MLI signifikant größer als luftexponierte Mäuse (*p < 0,001). (D) Der destruktive Index (DI). In der Lunge von zigarettenrauchexponierten Mäusen war DI im Vergleich zur Lunge von luftexponierten Mäusen signifikant erhöht (*p < 0,001). Die Werte werden als Mittelwert sD (n = 6 für jede Gruppe) dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Das hier vorgestellte Fixierungsverfahren für Nagetiere ist nicht neu; Dieses System hat jedoch mehrere Vorteile. Erstens kann es viele Lungen (maximal 20) mit dem gleichen Zustand gleichzeitig fixieren. Die Gesellschaft für Toxikologische Pathologie stellt fest, dass der Druck für die Schwerkraftinstillation von 22–25 cmH2O22variiert. Insbesondere haben mehrere Studien Lungenfixierung bei einem Druck von 25 cmH2O13,19,23,24,25,26,27 durchgeführt , die in unserem Labor mit dem aktuellen System angenommen wurde12,15,16,17,18.
Zweitens, Es kann Lungengewebe bei einem konstanten Druck für verschiedene Zeiträume zu beheben. In unserem Labor werden Lungenproben in der Regel für 48 h fixiert. Viele Ermittler nutzen einen relativ kurzen Zeitraum (z.B. 5–20 min)13,28,29,30,31,32, dann binden Sie die aufgeblasene Lunge und tauchen sie ein in formalin für längere Zeiträume wie gewünscht. Es liegen keine Daten oder Untersuchungen vor, die einen Goldstandard für die Dauer der Lungenfixierung angeben. Die Erklärung der American Thoracic Society (ATS)/European Respiratory Society (ERS) beschreibt jedoch den "Silberstandard", bei dem der Luftwegdruck für mindestens 24 h14aufrechterhalten werden muss. Die Japanische Gesellschaft für Pathologie empfahl auch Fixationszeiten von nicht mehr als 1 Woche, um konsistente immunhistochemische Dias zu produzieren; obwohl ihre Empfehlung auf einer Analyse mit menschlichen Proben33basiert. Relativ kurze Fixierungszeiträume sind für das derzeitige System möglicherweise nicht anwendbar, da jede Probe einzeln in den unteren Behälter gelegt werden soll. Dies ist eine Einschränkung des aktuellen Systems. Zusammenfassend lässt sich sagen, dass die richtige Dauer für die Lungenfixierung der Maus unbekannt bleibt.
Kritische Schritte bei dieser Methode beziehen sich auf das Risiko einer Lungenformalin-Leckage während des Formalin-Fixierungsprozesses. Lungenformalin Leckbildung kann Lungengröße Schrumpfung verursachen. Dieses Risiko kann in zwei Teile unterteilt werden. Der erste Teil erfolgt während des Opferschritts. Beim Öffnen des Brustkorbs ist es wichtig, keine Verletzungen der Lungenoberfläche zu verursachen. Der Schlüssel zur Prävention ist, dies aus dem Zwerchfell zu nähern und weiterhin den Brustrippenkäfig zu schneiden, nachdem die Lunge von der parietalen Pleura gelöst wurde. Diese Methode vermeidet Lungenverletzungen durch chirurgische Geräte. Ein weiterer wichtiger Schritt tritt beim Binden der rechten Hauptbronchus. Es ist wichtig zu identifizieren, welche die richtigen Lappen der Maus sind. Das Platzieren der Lunge in eine Position, in der sie von einer dorsalen Ansicht aus gesehen werden können, ermöglicht eine einfachere Identifizierung der Lage der Lunge.
Der zweite Teil erfolgt während des Lungenfixierungsprozesses mit speziellen Geräten. Ein kritischer Schritt tritt beim Einsetzen der Lungenprobe in den Formalinport des unteren Behälters auf. Es sollte bestätigt werden, dass die Einfügung fest gesichert ist, um eine Ablösung der Lungenproben vom Formalinport während des konstanten Druckprozesses zu verhindern. Ein weiterer Aspekt, der hervorgehoben werden soll, ist die Schlauchverbindung zwischen den drei Teilen der Spezialausrüstung (unterer Behälter, Oberbehälter und Pumpe). Alle Rohrverbindungen sollten eng verbunden sein. Tritt ein Leck ein, verringert sich das Formalinvolumen im oberen Behälter, wodurch der konstante Druck reduziert wird.
Nach den Empfehlungen der Gesellschaft für Toxikologische Pathologie hat die intratracheale Instillation von Formalin Vorteile für das Nagetier-Lungenmodell, das über seinen Nachteilen22vorherrscht. Sie haben die Verwendung einer intratrachealen formalin fixation Methode bei der Durchführung von quantitativen Studien der alveolar Lungenmorphometrie vorgeschlagen. Die intratracheale Lungeninstillation hat zwei Vorteile, darunter die Erhaltung der Atemwege und der Alveolarwand sowie die Visualisierung von Lungenparenchym22. Eine Studie von Braber et al. zeigte, dass die intratracheale formalinininstillation Methode in Bezug auf die Erhaltung der Lungenstruktur im Vergleich zur Vakuuminflation und Ganzkörperperfusionsmethoden13überlegen ist. Die aktuelle Methode nutzt die intratracheale Instillation in einem Mausmodell, um die Visualisierung des Alveolarbereichs zu optimieren.
Bei Fixiermitteln werden 10% Formalin, das Formaldehyd enthält, konventionell verwendet. Formaldehyd wird häufig als Fixiermittel für immunpathologische Untersuchungen eingesetzt, da es die Proteinimmunogenität nicht vollständig zerstört. Die ATS/ERS-Anweisung empfiehlt jedoch keine Formalfixierung, da sie die Gewebestruktur nicht ausreichend stabilisiert14. Glutaraldehyd wird stattdessen für die Instillation der Atemwege empfohlen; Es unterliegt jedoch der Zerstörung der Proteinimmunogenität, was zu einem ungeeigneten Fixiermittel für die Immunhistochemie führt. Mehrere Beweisstücke haben berichtet, dass die feste Lunge für die morphometrische Auswertung vorgesehen werden kann (z. B. mittlere lineare Abschnitte, innere Oberfläche und destruktiver Index) nach formalin Fixierung mit dem aktuellen Fixierungssystem12 , 15 , 16 , 17 , 18. Sicherlich kann Glutaraldehyd für das aktuelle System angenommen werden; So können Die Forscher beide Wirkstoffe im aktuellen System nach experimentellen Bedürfnissen auswählen.
Offenlegungen
Die Autoren haben keine konkurrierenden Interessen zu erklären.
Danksagungen
Diese Arbeit wurde teilweise von JSPS KAKENHI Grant Number 26461199 (T. Sato) und dem Institute for Environmental and Gender-Specific Medicine, Juntendo University Graduate School of Medicine, Grant Number E2920 (T. Sato) unterstützt. Der Geldgeber hatte keine Rolle bei der Gestaltung der aktuellen Methoden und beim Schreiben des Manuskripts.
Materialien
| Name | Company | Catalog Number | Comments |
| 10% formalin (formalin neutral buffer solution) | Wako | 060-01667 | |
| Bent forceps | Hammacher | HSC187-11 | |
| Cannula, size 20G | Terumo | SR-FS2032 | |
| Cannula, size 22G | Terumo | SR-OT2225C | Cannula to exsanguinate lung |
| Forceps | Hammacher | HSC184-10 | |
| Kimtowel | Nippon Paper Crecia (Kimberly Clark) | 61000 | |
| Kimwipe | Nippon Paper Crecia (Kimberly Clark) | 62011 | |
| Lower container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
| Roller pump | Nissin Scientific Corp | NRP-75 | Pump machine to exsanguinate lung |
| Roller pump RP-2000 | Eyela (Tokyo Rikakikai Co. Ltd) | 160200 | Pressure equipment pump |
| Silicone tube Ø 9 mm | Sansyo | 94-0479 | Pressure equipment component |
| Somnopentyl (64.8 mg/mL) | Kyoritsu Seiyaku | SOM02-YA1312 | Pentobarbital Sodium |
| Surgical scissor | Hammacher | HSB014-11 | |
| Suture thread, size 0 | Nescosuture | GA01SW | |
| Syringe, 1 mL | Terumo | SS-01T | |
| Syringe, 1 ml with needle | Terumo | SS-01T2613S | |
| Syringe, 10 mL | Terumo | SS-10ESZ | |
| Three-way stopcock | Terumo | TS-TR1K01 | |
| Upper container (acrylic glass material) | Tokyo Science | Custom-made | Pressure equipment component |
Referenzen
- Vogelmeier, C. F., et al. Global strategy for the diagnosis, management, and prevention of chronic obstructive lung disease 2017 report. GOLD Executive Summary. American Journal of Respiratory and Critical Care Medicine. 195 (5), 557-582 (2017).
- Pauwels, R. A., Rabe, K. F. Burden and clinical features of chronic obstructive pulmonary disease (COPD). Lancet. 364 (9434), 613-620 (2004).
- Spurzem, J. R., Rennard, S. I. Pathogenesis of COPD. Seminars in Respiratory and Critical Care Medicine. 26 (2), 142-153 (2005).
- Vlahos, R., Bozinovski, S., Gualano, R. C., Ernst, M., Anderson, G. P. Modelling COPD in mice. Pulmonary Pharmacology and Therapeutics. 19 (1), 12-17 (2006).
- Vlahos, R., Bozinovski, S. Recent advances in pre-clinical mouse models of COPD. Clinical Science (Lond). 126 (4), 253-265 (2014).
- Stevenson, C. S., Belvisi, M. G. Preclinical animal models of asthma and chronic obstructive pulmonary disease. Expert Review of Respiratory Medicine. 2 (5), 631-643 (2008).
- Stevenson, C. S., Birrell, M. A. Moving towards a new generation of animal models for asthma and COPD with improved clinical relevance. Pharmacology and Therapeutics. 130 (2), 93-105 (2011).
- Vandivier, R. W., Ghosh, M. Understanding the Relevance of the Mouse Cigarette Smoke Model of COPD: Peering through the Smoke. American Journal of Respiratory Cell and Molecular Biology. 57 (1), 3-4 (2017).
- Wright, J. L., Cosio, M., Churg, A. Animal models of chronic obstructive pulmonary disease. American Journal of Physiology Lung Cellular and Molecular Physiology. 295 (1), L1-L15 (2008).
- Rennard, S. I., Togo, S., Holz, O. Cigarette smoke inhibits alveolar repair: a mechanism for the development of emphysema. Proceedings of the American Thoracic Society. 3 (8), 703-708 (2006).
- Nikula, K. J., et al. A mouse model of cigarette smoke-induced emphysema. Chest. 117, 246S-247S (2000).
- Sato, T., et al. Senescence marker protein-30 protects mice lungs from oxidative stress, aging, and smoking. American Journal of Respiratory and Critical Care Medicine. 174 (5), 530-537 (2006).
- Braber, S., Verheijden, K. A., Henricks, P. A., Kraneveld, A. D., Folkerts, G. A comparison of fixation methods on lung morphology in a murine model of emphysema. American Journal of Physiology Lung Cellular and Molecular Physiology. 299 (6), L843-L851 (2010).
- Hsia, C. C., et al. An official research policy statement of the American Thoracic Society/European Respiratory Society: standards for quantitative assessment of lung structure. American Journal of Respiratory and Critical Care Medicine. 181 (4), 394-418 (2010).
- Kasagi, S., et al. Tomato juice prevents senescence-accelerated mouse P1 strain from developing emphysema induced by chronic exposure to tobacco smoke. American Journal of Physiology Lung Cellular and Molecular Physiology. 290 (2), L396-L404 (2006).
- Koike, K., et al. Complete lack of vitamin C intake generates pulmonary emphysema in senescence marker protein-30 knockout mice. American Journal of Physiology Lung Cellular and Molecular Physiology. 298 (6), L784-L792 (2010).
- Koike, K., et al. Vitamin C prevents cigarette smoke-induced pulmonary emphysema in mice and provides pulmonary restoration. American Journal of Respiratory Cell and Molecular Biology. 50 (2), 347-357 (2014).
- Suzuki, Y., et al. Hydrogen-rich pure water prevents cigarette smoke-induced pulmonary emphysema in SMP30 knockout mice. Biochemical and Biophysical Research Communications. 492 (1), 74-81 (2017).
- Saad, M., Ruwanpura, S. M. Tissue Processing for Stereological Analyses of Lung Structure in Chronic Obstructive Pulmonary Disease. Methods in Molecular Biology. 1725, 155-162 (2018).
- Thurlbeck, W. M. The internal surface area of nonemphysematous lungs. The American Review of Respiratory Disease. 95 (5), 765-773 (1967).
- Saetta, M., et al. Destructive index: a measurement of lung parenchymal destruction in smokers. The American Review of Respiratory Disease. 131 (5), 764-769 (1985).
- Renne, R., et al. Recommendation of optimal method for formalin fixation of rodent lungs in routine toxicology studies. Toxicologic Pathology. 29 (5), 587-589 (2001).
- Schneider, J. P., Ochs, M. Alterations of mouse lung tissue dimensions during processing for morphometry: a comparison of methods. American Journal of Physiology Lung Cellular and Molecular Physiology. 306 (4), L341-L350 (2014).
- Wright, J. L. Relationship of pulmonary arterial pressure and airflow obstruction to emphysema. Journal of Applied Physiology. 74 (3), 1320-1324 (1993).
- Wright, J. L., Churg, A. Cigarette smoke causes physiologic and morphologic changes of emphysema in the guinea pig. The American Review of Respiratory Disease. 142 (6 Pt 1), 1422-1428 (1990).
- Thurlbeck, W. M. Internal surface area and other measurements in emphysema. Thorax. 22 (6), 483-496 (1967).
- Wright, J. L., et al. Airway remodeling in the smoke exposed guinea pig model. Inhalation Toxicology. 19 (11), 915-923 (2007).
- Limjunyawong, N., Mock, J., Mitzner, W. Instillation and Fixation Methods Useful in Mouse Lung Cancer Research. Journal of Visualized Experiments. (102), e52964(2015).
- Roos, A. B., Berg, T., Ahlgren, K. M., Grunewald, J., Nord, M. A method for generating pulmonary neutrophilia using aerosolized lipopolysaccharide. Journal of Visualized Experiments. (94), (2014).
- Laucho-Contreras, M. E., Taylor, K. L., Mahadeva, R., Boukedes, S. S., Owen, C. A. Automated measurement of pulmonary emphysema and small airway remodeling in cigarette smoke-exposed mice. Journal of Visualized Experiments. (95), 52236(2015).
- Nakanishi, Y., et al. Clarithromycin prevents smoke-induced emphysema in mice. American Journal of Respiratory and Critical Care Medicine. 179 (4), 271-278 (2009).
- Maeno, T., et al. CD8+ T Cells are required for inflammation and destruction in cigarette smoke-induced emphysema in mice. Journal of Immunology. 178 (12), 8090-8096 (2007).
- Sato, M., et al. Optimal fixation for total preanalytic phase evaluation in pathology laboratories: a comprehensive study including immunohistochemistry, DNA, and mRNA assays. Pathology International. 64 (5), 209-216 (2014).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten